
METOTREXATO
METOTREXATO
Solución inyectable
Caja , 1 Frasco vial , Solución para inyección , 20 Mililitros
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Nombre químico: Ácido N-[4-[[(2,4-diamino-6-pteridinil)metil]metilamino]benzoil]-L-glutámico
Estructura:
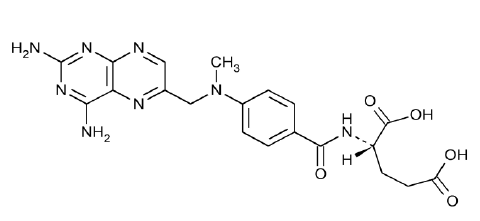
Fórmula molecular: C20H22N8O5
Peso molecular: 454.45
Metotrexato sódico es un polvo cristalino de color amarillo a naranja-marrón, que contiene no más de 12% de agua.
Prácticamente insoluble en agua, alcohol, cloroformo, y éter; se disuelve en soluciones diluidas de ácidos minerales y hidróxidos alcalinos y carbonatos.
Metotrexato se encuentra disponible como: Solución inyectable conteniendo 25 mg/mL de metotrexato sódico (500 mg).
INDICACIONES TERAPÉUTICAS: Coadyudante en el tratamiento de tumores de trofoblasto, tumores testiculares, coriocarcinoma y mola hiditadiforme y en el tratamiento de la leucemia linfocítica aguda, linfosarcoma y soriasis.
El metotrexato es un medicamento citotóxico usado para quimioterapia antineoplásica y en ciertas condiciones no malignas.
Indicaciones oncológicas: El metotrexato está indicado para el tratamiento de los siguientes tumores sólidos y procesos malignos hematológicos:
• Neoplasmas trofoblásticos gestacionales
• Corioadenoma destruens
• Mola hidatidiforme
• Leucemia linfocítica aguda
• Cáncer de seno
• Cáncer cervical
• Carcinoma ovárico
• Carcinoma testicular
• Cáncer de vejiga (localmente avanzado / metastásico)
• Cáncer epidermoide de cuello y cabeza (carcinoma de células escamosas)
• Micosis fungoide (Linfoma cutáneo de células T)
• Cáncer de pulmón
• Linfoma no Hodgkin
• Linfoma Meníngeo
• Linfoma histiocítico y linfatico, linfoma de Burkitt
• Osteosarcoma
Otras enfermedades:
• Psoriasis
• Artritis reumatoide incluyendo artritis reumatoide juvenil (JRA) de curso poliarticular.
FORMA FARMACÉUTICA: Solución inyectable.
PARTICULARIDADES FARMACÉUTICAS
Incompatibilidades: Se ha informado que el metotrexato es incompatible con fosfato sódico de prednisolona. Se ha cuestionado la incompatibilidad con fluorouracilo previamente reportada y estudios posteriores documentados en la literatura indican que el metotrexato y la citarabina son físicamente y químicamente estables en mezclas intravenosas sobre un rango de concentraciones en una variedad de vehículos comunes. Una mezcla de metotrexato sódico con citarabina y succinato sódico de hidrocortisona en diversos líquidos de infusión es visualmente compatible al menos durante 8 horas a 25 °C, aunque no ocurrió precipitación en el almacenamiento durante varios días. En general, la compatibilidad de cual medicamento mezclado con metotrexato debe asegurarse previo a la administración al paciente. Las interacciones medicamentosas son descritas en Interacción con otros medicamentos y otras formas de interacción.
Precauciones especiales de almacenamiento: Se ha reportado que las soluciones diluidas en cloruro de sodio al 0.9% para inyección contenidas en bolsas de cloruro de polivinilo exhiben una pequeña fotodegradación; el almacenamiento bajo condiciones de iluminación normal conduce a un pequeño cambio en la concentración del fármaco luego de 24 hrs, con un decrecimiento de hasta el 12% hacia las 48 horas. La pérdida será mayor en dispositivos de polibutadieno no protegidos, en donde se puede perder hasta el 80% de la droga en 48 horas.
Instrucciones para uso o manipulación: Las personas que tienen contacto con medicamentos contra el cáncer o que trabajan en áreas donde se utilizan estos medicamentos pueden quedar expuestas a estos agentes en el aire o a través del contacto directo con objetos contaminados.
Los efectos potenciales en la salud pueden reducirse a través del cumplimiento de los procedimientos institucionales, las pautas publicadas y las regulaciones locales sobre preparación, administración, transporte y desecho de medicamentos peligrosos. No hay un acuerdo general de que todos los procedimientos recomendados en las pautas sean necesarios o adecuados.
PROPIEDADES FARMACOLÓGICAS
Propiedades farmacodinámicas: El metotrexato (ácido 4-amino-10-metil fólico) es un antimetabolito y un análogo del ácido fólico. La droga penetra a las células vía un sistema de transporte activo de folatos reducidos y, debido a un ligamiento relativamente irreversible. El metotrexatoinhibe la dihidrofolato reductasa. Los dihidrofolatos se pueden reducir a tetrahidrofolatos por medio de esta enzima antes de que sean usados como portadores de un grupo carbono en la síntesis de nucleótidos de purina y timidilato. Por lo tanto el metotrexato interfiere con la síntesis del ADN, y la reparación y replicación celular. La afinidad de la dihidrofolato reductasa por el metotrexato es de lejos mayor a su afinidad por el ácido fólico o dihidrofólico y, por lo tanto, el mismo suministro simultáneo de muy grandes cantidades de ácido fólico no podrá reversar los efectos del metotrexato. El fármaco parece también causar un incremento en los niveles intracelulares del trifosfato de desoxiadenosina, del cual se cree que inhibe la reducción de ribonucleótidos y la polinucleótido ligasa, una enzima involucrada en la síntesis y reparación del ADN.
Tejidos con proliferación activa tales como las células malignas, médula ósea, células fetales, mucosa bucal e intestinal, espermatogonios y células de la vejiga urinaria son en general, más sensibles a este efecto del metotrexato. Cuando la proliferación celular en tejidos malignos es mayor, el metotrexato puede afectar el crecimiento maligno sin daño irreversible en los tejidos normales.
En la psoriasis, el índice de producción de células epiteliales en la piel aumenta considerablemente con respecto a la piel normal. Este diferencial en los índices de proliferación es la base del uso de metotrexato para controlar el proceso psoriásico.
El metotrexato en altas dosis, seguido de rescate con ácido folínico, se utiliza como parte del tratamiento de pacientes con osteosarcoma no metastásico. La justificación original para la terapia con altas dosis de metotrexato está basada en el concepto de rescate selectivo de tejidos normales con ácido folínico. Evidencia más reciente sugiere que las dosis altas de metotrexato también pueden vencer la resistencia al metotrexato causada por transporte activo deficiente, afinidad disminuida de la ácido dihidrofolico reductasa por el metotrexato, aumento en los niveles de la ácido dihidrofolico reductasa como resultado de la amplificación de los genes o disminución en la poliglutamación del metotrexato. El mecanismo de acción real es desconocido.
En el tratamiento de la artritis reumatoide, el mecanismo de acción preciso del metotrexato es desconocido. El metotrexato se utiliza como monoterapia, así como en combinación con otras intervenciones. El metotrexato está clasificado como medicamento antirreumático modificador de la enfermedad (DMARD) en el tratamiento de la artritis reumatoide.
PROPIEDADES FARMACOCINÉTICAS
Absorción: Luego de la administración intramuscular se logra una rápida y completa absorción y los niveles séricos pico se alcanzan dentro de las 0.5-2 hr siguientes. En adultos, la absorción oral parece ser dependiente de la dosis. Las concentraciones séricas máximas se alcanzan dentro de una a dos horas. En dosis de 30 mg/m2 o menos, en general el metotrexato se absorbe bien dentro de una biodisponibilidad media de alrededor del 60%. La absorción de dosis superiores a 80 mg/m2 es significativamente más baja, posiblemente debido a un efecto de saturación.
Sin embargo, se ha detectado una variabilidad en la absorción del metotrexato en sujetos que reciben tratamiento oral debido a una denudación epiteliar inducida por el fármaco, cambios en la motilidad y alteraciones en la flora intestinal. Los niveles séricos pico alcanzados después de la administración oral son ligeramente más bajos que aquellos detectados después de la administración intramuscular; estos valores pico se logran dentro de 1 a 4 horas después de la administración oral.
En pacientes pediátricos leucémicos, la absorción oral de metotrexato también parece ser dependiente de la dosis y se ha informado que varía ampliamente (23% a 95%). Se ha informado una diferencia de veinte veces entre las concentraciones máximas más altas y más bajas (Cmáx: 0,11 a 2,3 micromolares después de una dosis de 20 mg/m2). También se ha observado una variabilidad interindividual significativa en la concentración de tiempo hasta el pico (Tmáx: 0.67 a 4 horas después de una dosis de 15 mg/m2) y la fracción de dosis absorbida. Se ha informado que la absorción de dosis superiores a 40 mg/m2 es significativamente inferior a la de las dosis más bajas.
Al igual que en los pacientes pediátricos leucémicos, se ha informado una variabilidad interindividual amplia en las concentraciones plasmáticas de metotrexato en pacientes pediátricos con JRA. Después de la administración oral de metotrexato en dosis de 6,4 a 11,2 mg/m2/semana en pacientes pediátricos con JRA, las concentraciones séricas medias fueron de 0,59 micromolares (rango de 0,03 a 1,40) en 1 hora, 0,44 micromolares (rango de 0,01 a 1,00) en 2 horas y 0,29 micromolares (rango de 0,06 a 0,58) en 3 horas. En pacientes pediátricos que reciben metotrexato por leucemia linfocítica aguda (6,3 a 30 mg/m2) o por JRA (3,75 a 26,2 mg/m2), se ha informado que la media vida terminal varía entre 0,7 y 5,8 horas o 0,9 a 2,3 horas, respectivamente
Distribución: Después de la administración intravenosa, el volumen de distribución inicial es de aproximadamente 0,18 L/kg (18% del peso corporal) y el volumen de distribución en el estado estacionario es de aproximadamente 0,4 a 0,8 L/kg (40% a 80% del peso corporal). El metotrexato compite con folatos reducidos por el transporte activo a través de las membranas celulares por medio de un solo proceso de transporte activo mediado por transportadores.
A concentraciones séricas superiores a 100 micromolares, la difusión pasiva se convierte en una vía principal por medio de la cual se pueden lograr concentraciones intracelulares eficaces. El metotrexato en suero está unido a proteínas en aproximadamente un 50%.
El metotrexato no penetra la barrera de sangre-líquido cefalorraquídeo en cantidades terapéuticas cuando se administra por vía oral o parenteral. Pueden obtenerse altas concentraciones de LCF del medicamento por administración intratecal.
En perros, las concentraciones de líquido sinovial después de dosis orales fueron más altas en articulaciones inflamadas que no inflamadas. Aunque los salicilatos no interfirieron con esta penetración, el tratamiento previo con prednisona redujo la penetración en articulaciones inflamadas hasta el nivel de las articulaciones normales.
El metotrexato se distribuye ampliamente en los tejidos corporales en donde las concentraciones más altas se encuentran en los riñones, vesícula biliar, bazo, hígado y piel. El metotrexato en cantidades terapéuticas administradas oral o parenteralmente no penetra la barrera hematoencefálica. Pueden obtenerse altas concentraciones de CSF del fármaco luego de la administración intratecal.
En perros, las concentraciones de líquido sinovial después de dosis orales fueron más altas en articulaciones inflamadas que no inflamadas. Aunque los salicilatos no interfirieron con esta penetración, el tratamiento previo con prednisona redujo la penetración en articulaciones inflamadas hasta el nivel de las articulaciones normales.
Metabolismo: A dosis bajas, el metotrexato no parece sufrir un significativo metabolismo; luego de una terapia a dosis altas, el metotrexato sufre metabolismo hepático y metabolismo intracelular a formas poliglutamadas que pueden convertirse de nuevo a metotrexato mediante enzimas hidrolasas. Estos poliglutamatos funcionan como inhibidores de dihidrofolato reductasa y timidilato sintetasa. Pueden permanecer pequeñas cantidades de poliglutamatos de metotrexato en tejidos durante periodos prolongados. La retención y la acción prolongada del medicamento de estos metabolitos activos varían entre diferentes células, tejidos y tumores. Una pequeña cantidad del metabolismo a 7-hidroximetotrexato puede ocurrir a dosis comúnmente recetadas. La acumulación de este metabolito puede volverse significativa a las dosis altas utilizadas en sarcoma osteogénico. La solubilidad acuosa del 7-hidroximetotrexato es 3 a 5 veces más baja que el compuesto original. El metotrexato se metaboliza parcialmente a través de la flora intestinal después de la administración oral.
Vida media: La vida media terminal informada para el metotrexato es de aproximadamente tres a diez horas en pacientes que reciben tratamiento por psoriasis, artritis reumatoide o terapia antineoplásica de dosis baja (menos de 30 mg/m2). En pacientes que reciben altas dosis de metotrexato, la Vida media terminal es de 8 a 15 horas.
En pacientes pediátricos que reciben metotrexato por leucemia linfocítica aguda (6,3 a 30 mg/m2) o por JRA (3,75 a 26,2 mg/m2), se ha informado que la vida media terminal varía entre 0,7 y 5,8 horas o 0,9 a 2,3 horas, respectivamente.
Excreción: La excreción renal es la principal vía de eliminación y depende de la dosis y de la vía de administración. Con administración IV, entre el 80% y el 90% de la dosis administrada se excreta sin cambios en la orina dentro de las 24 horas seguido por 1-2-% de la retención de la dosis diaria. Hay excreción biliar limitada que representa el 10% o menos de la dosis administrada. Se ha propuesto recirculación enterohepática del metotrexato.
La excreción renal ocurre por filtración glomerular y secreción tubular activa. Se ha observado eliminación no lineal debido a la saturación de la reabsorción tubular renal en pacientes psoriásicos con dosis de entre 7,5 y 30 mg. El deterioro de la función renal, así como el uso simultáneo de medicamentos como ácidos orgánicos débiles que también ejercen secreción tubular, pueden aumentar marcadamente las concentraciones séricas de metotrexato. Se ha informado una excelente correlación entre el aclaramiento de metotrexato y el aclaramiento de creatinina endógena.
El aclaramiento total de metotrexato promedia en 12L/h, pero las tasas de aclaramiento pueden variar ampliamente y en general disminuyen en dosis más altas. Se ha identificado eliminación retardada del medicamento como uno de los principales factores responsables de toxicidad del metotrexato. Se ha postulado que la toxicidad del metotrexato en tejidos normales depende más de la duración de la exposición al medicamento que de la concentración máxima alcanzada. Cuando un paciente tiene eliminación retardada del medicamento debido a una función renal comprometida, un derramen en tercer espacio u otra causa, las concentraciones séricas de metotrexato pueden permanecer elevadas durante periodos prolongados.
El potencial de toxicidad de los regímenes de dosis altas o de excreción retardada se reduce con la administración de ácido folínico durante la fase final de la eliminación plasmática de metotrexato.
Efectos de los alimentos: La biodisponibilidad del metotrexato administrado por vía oral no se reduce por los alimentos y el metotrexato puede administrarse sin tener en cuenta las comidas.
CONTRAINDICACIONES: Hipersensibilidad conocida al metotrexato o a cualquiera de los excipientes de la formulación, embarazo, lactancia, daño hepático y/o renal severo, discrasias sanguíneas preexistentes.
Las formulaciones de metotrexato y diluentes que contienen preservantes no deben ser usados para terapia intratecal o terapia con dosis alta de metotrexato.
Solamente para pacientes con psoriasis o artritis reumatoide aplica:
• Alcoholismo, enfermedad hepática alcohólica u otras enfermedades crónicas del hígado.
• Evidencia manifiesta o de laboratorio de síndromes de inmunodeficiencia.
• Discrasias sanguíneas preexistentes, tales como hipoplasia de médula ósea, leucopenia, trombocitopenia, o anemia significativa.
• Embarazo.
FERTILIDAD, EMBARAZO Y LACTANCIA
Fertilidad: Se ha reportado que el metotrexato puede causar alteración de la fertilidad, oligospermia y disfunción menstrual en humanos, durante y por un corto periodo tiempo después de la suspensión de la terapia.
Embarazo: El metotrexato puede causar muerte fetal, embriotoxicidad, aborto o efectos teratógenicos cuando se administra a mujeres embarazadas. El metotrexato está contraindicado en pacientes embarazadas diagnosticadas con psoriasis o artritis reumatoide.
Las mujeres en edad fértil no deben recibir tratamiento con metotrexato hasta que se haya excluido la posibilidad de embarazo y deben recibir asesoramiento acerca de los riesgos graves para el feto en caso de que queden embarazadas mientras reciben tratamiento. El embarazo se debe evitar cuando uno de los miembros de la pareja está recibiendo metotrexato.
El intervalo de tiempo óptimo entre la suspensión del tratamiento con metotrexato y el embarazo todavía no se ha determinado con exactitud. En la bibliografía publicada, se recomiendan intervalos de tiempo de 3 meses a un año.
El riesgo de efectos sobre la reproducción se debe discutir con los pacientes, tanto hombres como mujeres que toman metotrexato.
Lactancia: El metotrexato se ha detectado en la leche de materna humana y está contraindicado durante la lactancia.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR VEHÍCULOS Y OPERAR MAQUINARIA: Algunos de los efectos mencionados en Efectos no deseados (p. ej.: mareos y fatiga), pueden afectar la capacidad para conducir u operar maquinaria.
EFECTOS INDESEABLES: En general, la incidencia y la gravedad de las reacciones adversas severas están relacionadas con la dosis y la frecuencia de administración. Se deben consultar otras secciones relevantes al buscar información acerca de las reacciones adversas con metotrexato.
Entre las reacciones adversas informadas con más frecuencia se incluyen estomatitis ulcerativa, leucopenia, náuseas y dolor abdominal. Otros efectos adversos informados con frecuencia son malestar, fatiga indebida, escalofríos y fiebre, mareos y disminución de la resistencia a la infección. Las ulceraciones de la mucosa oral usualmente son los signos más prematuros de toxicidad.
A continuación se incluyen otras reacciones adversas que se han informado con metotrexato por sistema orgánico. En el marco de la oncología, el tratamiento concomitante y la enfermedad subyacente hacen que una atribución específica a una reacción al metotrexato sea difícil. Ver Advertencias y Precauciones Especiales de Uso para referencia específica a eventos de largo plazo medicamente importantes, incluyendo aquellas de un tratamiento a largo plazo o dosis acumulativas altas (por ejemplo toxicidad hepática).
Las categorías de frecuencia se definen como: Muy comunes (= 1/10), Comunes (= 1/100 a <1/10), Poco frecuentes (>1/1,000 a <1/100), raras (>1/10, 000 a <1/1, 000), Muy raras (<1/10,000), Frecuencia Indeterminada (no puede estimarse a partir de los datos disponibles).
|
Tabla 4. |
|
|
Clasificación por órganos y sistemas |
Reacción Adversa |
|
Infecciones e infestaciones |
|
|
Raras |
Sepsis |
|
Frecuencia Indeterminada |
Infecciones (incluyendo sepsis fatal); neumonía; neumonía por Pneumocystis carinii; Nocardiosis; Histoplasmosis; Criptococcosis; Herpes zóster; Hepatitis por H. simplex; H. simplex diseminado; infección por Citomegalovirus (incluyendo neumonía citomegaloviral); reactivación de la infección por hepatitis B; empeoramiento de la infección de hepatitis C. |
|
Neoplasias benignas, malignas e inespecificas (incluyendo quistes y pólipos) |
|
|
Poco frecuentes |
Linfoma (incluyendo linfoma reversible) |
|
Muy raros |
Síndrome de lisis tumoral |
|
Trastornos del sistema sanguineo y linfático |
|
|
Poco frecuentes |
Anemia, hematopoyesis suprimida, trombocitopenia |
|
Muy raros |
Anemia aplásica |
|
Frecuencia Indeterminada |
Agranulocitosis; Pancitopenia; Leucopenia; Neutropenia; Linfadenopatía y trastornos linfoproliferativos (incluyendo reversibles); Eosinofilia; Anemia megaloblástica |
|
Trastornos del sistema inmunitario |
|
|
Poco frecuentes |
Reacciones anafilactoides |
|
Muy raros |
Hipogamaglobulinemia |
|
Trastornos del metabolismo y nutrición |
|
|
Raros |
Diabetes |
|
Trastornos psiquiátricos |
|
|
Raros |
Alteración del estado de ánimo, disfunción cognitiva transitoria |
|
Trastornos del sistema nervioso |
|
|
Comunes |
Parestesia |
|
Poco frecuentes |
Hemiparesis; Encefalopatía/Leucoencefalopatía*; Convulsiones;* Dolor de cabeza |
|
Raros |
Paresia; Disartria; Afasia; Somnolencia |
|
Muy raros |
Sensaciones craneanas inusuales |
|
Trastornos oculares |
|
|
Raros |
Visión borrosa; cambios visuales serios |
|
Muy raros |
Ceguera transitoria/pérdida de la visión; Conjuntivitis |
|
Trastornos cardiacos |
|
|
Raros |
Hipotensión |
|
Muy raros |
Efusión Pericárdica; Pericarditis |
|
Trastornos Vasculares |
|
|
Raros |
Eventos tromboembólicos (incluyendo thrombosis cerebral, thrombosis arterial, embolismo pulmonar, thrombosis venosa profunda, tromboflebitis, trombosis venosa retiniana) |
|
Muy raros |
Vasculitis |
|
Trastornos respiratorios, torácicos y del mediastino |
|
|
Poco frecuentes |
Neumonitis interstitial (incluyendo fallecimientos); derrame pleural |
|
Raros |
Fibrosis respiratoria; Faringitis |
|
Frecuencia Indeterminada |
Enfermedad pulmonary intersticial crónica; Alveolitis; Disnea; Dolor de cuello; Hipoxia; Tos |
|
Trastornos gastrointestinales |
|
|
Poco frecuentes |
Pancreatitis; Disminución del apetito; Vómito; Diarrea; Estomatitis |
|
Raros |
Ulceración y sangrado gastrointestinal; Melena; Enteritis; Gingivitis |
|
Muy raros |
Hematemesis |
|
Frecuencia Indeterminada |
Perforación intestinal; Peritonitis no infecciosa;Glositis; Náuseas; |
|
Trastornos hepatobiliares |
|
|
Poco frecuentes |
Elevación de enzimas hepáticas |
|
Raros |
Fibrosis crónica y cirrosis; Hepatitis aguda; Hepatotoxicidad |
|
Muy raros |
Disminución de la albúmina sérica |
|
Frecuencia Indeterminada |
Falla hepática |
|
Skin and Subcutaneous Tissue Disorders |
|
|
Poco frecuentes |
Necrolisis epidérmica tóxica (Síndrome de Lyell); syndrome de Stevens-Johnson; Alopecia. |
|
Raros |
Eritema multiforme; erupción eritematosa; Erosión eritematosa de placas psoriásicas; fotosensibilidad; Ulceración cutánea; Urticaria; Acné; Equimosis; trastornos en la pigmentación; Prurito |
|
Muy raros |
Forunculosis; Telangiectasia |
|
Frecuencia Indeterminada |
Reacción medicamentosa con eosinofilia y síntomas sistémicos.; Dermatitis; Petequias. |
|
Trastornos musculoesqueléticos, óseos y del tejido conectivo |
|
|
Raros |
Artralgia/mialgia; Osteoporosis; fracturas por estrés |
|
Frecuencia Indeterminada |
Osteonecrosis |
|
Trastornos renales y urinarios |
|
|
Poco frecuentes |
Insuficiencia renal; Nefropatía |
|
Raros |
Disuria |
|
Muy raros |
Hematuria; Azotemia; Cistitis |
|
Frecuencia Indeterminada |
Proteinuria215 |
|
Embarazo, puerperio y afecciones perinatales |
|
|
Poco frecuentes |
Defectos fetales |
|
Raros |
Aborto |
|
Frecuencia Indeterminada |
Muerte fetal |
|
Trastornos del sistema reproductive y de mamas |
|
|
Raros |
Disfunción menstrual |
|
Muy raros |
Ovogénesis/spermatogenesis defectuosa; Impotencia; Infertilidad; pérdida de libido; Oligospermia transitoria; Descarga vaginal |
|
Frecuencia Indeterminada |
Disfunción urogenital |
|
Trastornos generales y condiciones del sitio de administración |
|
|
Raros |
Nódulo |
|
Muy raros |
Muerte súbita |
|
Frecuencia Indeterminada |
Pirexia; Escalofríos; Malestar general; Fatiga |
|
*administración parenteral solamente |
|
Eventos adversos en estudios de JRA (artritis reumatoide juvenil): La incidencia aproximada de reacciones adversas informadas en pacientes pediátricos con JRA tratados con dosis orales semanales de metotrexato (5 a 20 mg/m2/semana o 0,1 a 1,1 mg/kg/semana), fue la siguiente (prácticamente todos los pacientes estaban recibiendo medicamentos antiinflamatorios no esteroides concomitantes y algunos también estaban recibiendo dosis bajas de corticosteroides): pruebas de la función hepática elevada, 14%; reacciones gastrointestinales (por ej., náuseas, vómitos, diarrea), 11%; estomatitis, 2%; leucopenia, 2%; dolor de cabeza, 1,2%; alopecia, 0,5%; mareos, 0,2%; y erupción, 0,2%. A pesar de que hay experiencia con dosis de hasta 30 mg/m2/semana en JRA, los datos publicados para dosis superiores a 20 mg/m2/semana son demasiado limitados, como para proporcionar estimaciones confiables de índices de reacciones adversas.
DATOS DE SEGURIDAD PRECLÍNICA: La DL50 intraperitoneal del metotrexato fue de 94 y 6-25 mg/kg en ratones y ratas, respectivamente. La DL50 oral del compuesto en ratas fue de 180 mg/kg. La tolerancia al metotrexato en ratones se incrementó con la edad. En perros, la dosis intravenosa de 50 mg/kg fue letal. Los principales blancos después de una dosis única fueron el sistema hemolinfopoyético y el tracto gastrointestinal.
Los efectos tóxicos observados después de la repetida administración de metotrexato fueron investigados en ratones y ratas. Los blancos principales del metotrexato en las especies animales antes nombradas fueron el sistema hemolinfopoyético, tracto G.I., pulmones, hígado, riñones, testículos, y piel. La tolerancia de los ratones a dosis crónicas de metotrexato se incrementó con la edad.
El metotrexato se ha evaluado en una cantidad de estudios en animales para investigar el potencial carcinogénico con resultados no concluyentes. A pesar de que hay evidencia de que el metotrexato causa daño cromosómico en células somáticas animales y en células de médula ósea humanas, la significancia clínica sigue siendo incierta.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE USO
General: Debido a la posibilidad de reacciones tóxicas graves (que pueden ser fatales), metotrexato solamente debe utilizarse en enfermedades neoplásicas (como se indica), o en pacientes con psoriasis severa, recalcitrante, incapacitante o artritis reumatoide que no es adecuadamente sensible a otras formas de la terapia. El paciente debe ser informado por el médico de los riesgos involucrados y debe estar bajo constante supervisión de un médico. Consulte Poblaciones Especiales, uso geriátrico y uso pediátrico para advertencias específicas.
Debe hacerse énfasis al paciente tratado para artritis reumatoide y psoriasis que la dosis recomendada debe ser tomada semanalmente, y que el uso errado de la dosis diaria recomendada ha dado lugar a toxicidad fatal (ver Posología y Método de Administración y Sobredosificación).
Se ha reportado que el metotrexato causa muerte fetal y/o anomalías congénitas. No se recomienda para el tratamiento de enfermedades neoplásicas en mujeres de potencial fértil.
Al igual que otros medicamentos citotóxicos, el metotrexato puede provocar el “síndrome de lisis tumoral” en pacientes con tumores de rápido crecimiento. Medidas de apoyo y farmacológicas apropiadas pueden prevenir o aliviar esta complicación.
Se han reportado reacciones graves de la piel, en ocasiones fatales, como el síndrome de Stevens -Johnson, necrólisis epidérmica tóxica (síndrome de Lyell), después de dosis únicas o múltiples de metotrexato.
El metotrexato provoca hepatotoxicidad, fibrosis hepática y cirrosis, pero por lo general sólo después de un uso prolongado. Con frecuencia, se observa un incremento agudo de las enzimas hepáticas. Por lo general, son transitorios y asintomáticos, y no indicarían una subsiguiente alteración hepática. La biopsia del hígado después de un uso sostenido revela alteraciones histológicas, y se han informado casos de fibrosis y cirrosis; estas últimas lesiones podrían no estar precedidas de síntomas ni resultados anormales en las pruebas de la función hepática en la población diagnosticada con psoriasis. Se recomiendan biopsias hepáticas a intervalos regulares en los pacientes diagnosticados con psoriasis que reciben un tratamiento a largo plazo. Es posible que ciertas anormalidades en las pruebas de la función hepática precedan la manifestación de fibrosis o cirrosis en la población diagnosticada con artritis reumatoide.
El metotrexato ha causado la reactivación de la infección con la hepatitis B o el agravamiento de infecciones con la hepatitis C y, en algunos casos, ha provocado la muerte. Se han informado casos de reactivación de la hepatitis B después de la interrupción del metotrexato. Se deben llevar a cabo evaluaciones clínicas y de laboratorio para analizar las afecciones hepáticas preexistentes en pacientes que manifestaron infecciones previas con el virus de la hepatitis B o C. Según estas evaluaciones, el tratamiento con metotrexato podría no ser apropiado en algunos pacientes.
Las afecciones pulmonares inducidas por el metotrexato, incluyendo neumonitis intersticial crónica o aguda y derrame pleural, pueden presentarse en cualquier momento durante la terapia, y se han informado durante el tratamiento con dosis bajas. No siempre estas afecciones se pueden revertir, y se han informado casos de muerte. Los pacientes con artritis reumatoide tienen alto riesgo de desarrollar enfermedad pulmonar reumatoide, la cual se está asociada frecuentemente a enfermedad pulmonar intersticial. El metotrexato puede exacerbar esta enfermedad pulmonar subyacente. Los síntomas pulmonares (especialmente la tos seca no productiva) podrían requerir la interrupción del tratamiento y una investigación exhaustiva.
La diarrea y la estomatitis ulcerativa requieren la interrupción del tratamiento, de lo contrario, puede presentarse enteritis hemorrágica y muerte debido a una perforación intestinal. El metotrexato se debe usar con mucho cuidado en presencia de enfermedad por úlcera péptica o colitis ulcerativa.
El metotrexato administrado simultáneamente con radioterapia puede aumentar el riesgo de necrosis de tejido blando y osteonecrosis.
El metotrexato se elimina lentamente de los compartimientos del tercer espacio (p. ej., derrames pleurales, ascitis). Esto genera una vida media terminal prolongada y toxicidad imprevista. En pacientes con acumulación apreciable en el tercer espacio, se recomienda drenar el líquido antes del tratamiento y supervisar las concentraciones plasmáticas del metotrexato.
El tratamiento con metotrexato en pacientes con insuficiencia renal se debe aplicar con mucho cuidado, y en dosis reducidas, debido a que la insuficiencia renal puede disminuir la eliminación de metotrexato.
Es necesario llevar a cabo un seguimiento estricto de los pacientes que reciben metotrexato. El metotrexato tiene el potencial de causar toxicidad grave. Los efectos tóxicos pueden relacionarse en frecuencia e intensidad con la dosis o con la frecuencia de administración, pero se han observado en todas las dosis y pueden manifestarse en cualquier momento durante el tratamiento. La mayoría de las reacciones adversas se pueden revertir si se las detecta oportunamente. Cuando se presenta este tipo de reacción, la dosis se debe reducir o interrumpir, y se deben implementar medidas correctivas apropiadas. Si se reanuda el tratamiento con metotrexato, este se debe implementar con cuidado, y se debe analizar la necesidad del medicamento, con mayor atención a una posible recurrencia de toxicidad.
Se debe informar a los pacientes acerca de los potenciales riesgos y beneficios del uso de metotrexato (incluyendo los síntomas e indicios tempranos de toxicidad), la necesidad de consultar oportunamente al médico en caso que ocurran y acerca de la necesidad de un seguimiento estricto, incluyendo análisis de laboratorio a intervalos regulares, a fin de supervisar la toxicidad.
El uso de regímenes de dosis elevadas (>500 mg/m2) recomedadas para osteosarcoma requiere cuidado meticuloso (ver Posología y Método de Administración para instrucciones de prehidratación y rescate con ácido folínico). Regimenes de dosis elevadas para otras enfermedades neoplásicas están en fase de investigación y todavía no se ha establecido una ventaja terapéutica.
Pueden presentarse linfomas malignos en pacientes que reciben dosis bajas de metotrexato. Estos linfomas pueden retroceder tras la suspensión de metotrexato sin requerir tratamiento.
Estados de deficiencia de folato podrían incrementar la toxicidad.
Toxicidad en sistema de órganos
Gastrointestinal: Si se presenta vómito, diarrea o estomatitis, con subsiguiente deshidratación, se debe considerar iniciar una terapia de apoyo e interrumpir la administración de metotrexato hasta la recuperación.
Hematológico: El metotrexato puede suprimir la hematopoyesis y causar anemia, anemia aplásica, pancitopenia, leucopenia, neutropenia y trombocitopenia. El metotrexato se debe usar con precaución en pacientes con insuficiencia hematopoyética previa.
El punto más bajo de leucocitos circulantes, neutrófilos y plaquetas ocurre generalmente entre 5 a 13 días después de una dosis de bolo IV (con la recuperación entre 14 a 28 días). Los leucocitos y neutrófilos pueden ocasionalmente mostrar dos depresiones, la primera ocurre en 4 a 7 días y un segundo punto más bajo después de 12 a 21 días, seguido de la recuperación. Se pueden esperar secuelas clínicas tales como fiebre, infecciones y hemorragia de varios sitios.
En el tratamiento de alteraciones neoplásicas, se debe interrumpir la administración de metotrexato solamente si el beneficio potencial supera los riesgos de mielosupresión grave. En psoriasis y artritis reumatoide, se debe interrumpir inmediatamente la administración de metotrexato si se detecta una reducción considerable en el recuento de eritrocitos.
Hepatotoxicidad: El metotrexato tiene el potencial de causar hepatitis aguda y hepatotoxicidad crónica (fibrosis y cirrosis). La toxicidad crónica es potencialmente mortal; generalmente se ha presentado después del uso prolongado (usualmente, dos años o más) y después de una dosis acumulativa total de al menos 1.5 gramos. En estudios de pacientes diagnosticados con psoriasis, la hepatotoxicidad sería una función de la dosis acumulativa total y sería agravada por el alcoholismo, la obesidad, la diabetes y la edad avanzada.
Con frecuencia, se observan resultados transitorios anormales de los parámetros hepáticos después de la administración de metotrexato y, en general, no justifican una modificación del tratamiento.
Las anormalidades hepáticas persistentes o la reducción de la albúmina sérica pueden sugerir, toxicidad hepática grave.
En pacientes diagnosticados con psoriasis, se deben llevar a cabo pruebas funcionales y del daño hepático incluyendo albúmina sérica y tiempo de protrombina varias veces antes de administrar el medicamento. Con frecuencia, las pruebas de la función hepática son normales en pacientes que desarrollan fibrosis o cirrosis. Estas lesiones solamente se pueden detectar mediante una biopsia. Se recomienda llevar a cabo una biopsia del hígado: 1) antes de iniciar el tratamiento o brevemente después de haberlo iniciado (2 a 4 meses); 2) después de alcanzar una dosis acumulativa total de 1.5 g; y 3) después de cada dosis acumulativa total y adicional de 1.0 a 1.5 g. En caso de fibrosis moderada o cirrosis de cualquier intensidad, se debe interrumpir el tratamiento con metotrexato; generalmente, los casos de fibrosis leve sugieren la necesidad de una nueva biopsia en 6 meses. Ciertas observaciones histológicas más leves, como la alteración grasa y una inflamación portal de grado leve, son relativamente frecuentes antes del inicio del tratamiento. Si bien estas alteraciones leves generalmente no justifican evitar o interrumpir el tratamiento con metotrexato, el medicamento se debe usar con precaución.
En pacientes con artritis reumatoide, en el momento de recibir la primera dosis de metotrexato la edad y la duración del tratamiento se informaron como factores de riesgo de hepatotoxicidad. Es posible que ciertas anormalidades en las pruebas de la función hepática precedan la manifestación de fibrosis o cirrosis en la población diagnosticada con artritis reumatoide. Las pruebas de la función hepática se deben llevar a cabo en el punto de partida (valor de referencia) y a intervalos de 4 a 8 semanas en pacientes diagnosticados con artritis reumatoide que reciben metotrexato. La biopsia del hígado antes del tratamiento se debe llevar a cabo en pacientes con antecedentes de consumo excesivo de alcohol, valores persistentemente anormales en las pruebas de la función hepática o infectados con el virus de la hepatitis B o C. Durante el tratamiento, se debe llevar a cabo una biopsia del hígado si se detectan valores persistentemente anormales en la prueba de la función hepática, o bien si se observa una reducción de la concentración de albúmina sérica por debajo del rango normal (en un entorno de artritis reumatoide bien controlada).
Si los resultados de la biopsia del hígado revelan alteraciones leves (grados Roenigk I, II y IIIa), se podría interrumpir la administración de metotrexato y el paciente se debe supervisar de conformidad con las recomendaciones anteriores.
La terapia con metotrexato se debe interrumpir en todo paciente que presente valores persistentemente anormales en la prueba de la función hepática y que se niegue a una biopsia del hígado, o bien en todo paciente cuyos resultados de la prueba de la función hepática revelen alteraciones moderadas o graves (grados Roenigk III b o IV).
Infecciones o estado inmunológico: El metotrexato se debe usar con mucho cuidado en presencia de una infección activa y, en general, está contraindicado en pacientes con pruebas evidentes o de laboratorio de síndromes de inmunodeficiencia.
Se pueden presentar infecciones oportunistas potencialmente mortales, como la neumonía por Pneumocystis carinii, durante la terapia con metotrexato. Cuando un paciente presenta síntomas pulmonares, se debe considerar la posibilidad de neumonía por Pneumocystis carinii.
Inmunización: Las vacunas pueden ser menos inmunogénicas cuando se administran durante la terapia con metotrexato. En general, no se recomienda la inmunización con vacunas de virus vivos.
Neurológico: Se han informado casos de leucoencefalopatías después de la administración de metotrexato por vía intravenosa a pacientes sometidos a irradiación craneoespinal. Para advertencias específicas referirse a Advertencias y Precauciones Especiales de Uso. Poblaciones especiales, uso pediátrico. Los pacientes sintomáticos fueron observados comúnmente para tener leucoencefalopatía y/o calcificaciones microangiopáticas en los estudios de imágenes diagnósticas.
También se ha reportado leucoencefalopatía crónica en pacientes que recibieron dosis repetidas de altas dosis de metotrexato con rescate de ácido folínico incluso sin irradiación cranial. También hay reportes de leucoencefalopatía en pacientes que recibieron metotrexato oral.
La interrupción del tratamiento con metotrexato no siempre genera una recuperación completa.
Se ha observado un síndrome neurológico agudo y transitorio en pacientes tratados con las dosis elevadas de metotrexato. Entre las manifestaciones de este síndrome neurológico, se incluyen anormalidades del comportamiento, signos sensitivomotores localizados, incluyendo ceguera transitoria y reflejos anormales. Se desconoce la causa específica.
Después de la administración de metotrexato por vía intratecal, se podría presentar toxicidad del sistema nervioso central, según se clasifica a continuación: aracnoiditis química aguda manifestada como, por ejemplo, dolor de cabeza, dolor de espalda, rigidez de la nuca y fiebre; mielopatía subaguda caracterizada, por ejemplo, por paraparesia/paraplejia asociada con la afectación de una o más raíces de los nervios raquídeos; leucoencefalopatía crónica manifestada, por ejemplo, por confusión, irritabilidad, somnolencia, ataxia, demencia, convulsiones y coma.
Este tipo de toxicidad del sistema nervioso central puede ser progresivo e incluso causar la muerte. Hay pruebas que indican que el uso combinado de radiación craneal y metotrexato por vía intratecal aumenta la incidencia de leucoencefalopatía. Los signos de neurotoxicidad (irradiación meníngea, paresia transitoria o permanente, encefalopatía) se deben supervisar después de la administración intratecal de metotrexato.
La administración de metotrexato por vía intratecal e intravenosa también puede causar encefalitis aguda y encefalopatía aguda con resultado de muerte.
Se han informado casos de pacientes con linfoma periventricular del sistema nervioso central que manifestaron hernia cerebral cuando se administró metotrexato por vía intratecal.
Se han informado casos de reacciones adversas neurológicas graves que variaron de dolor de cabeza a parálisis y episodios similares a accidentes cerebrovasculares, mayormente en niños y adolescentes que recibieron metotrexato de forma concomitante con citarabina.
Pulmonar: Los síntomas y signos pulmonares, como tos seca no productiva, fiebre, dolor de pecho, disnea, hipoxemia y un infiltrado en la radiografía de tórax, o una neumonitis inespecífica durante el tratamiento con metotrexato, pueden ser indicativos de una lesión potencialmente peligrosa y podrían requerir la interrupción del tratamiento y una investigación exhaustiva. Las lesiones pulmonares pueden manifestarse con todas las dosis. Se debe excluir la presencia de infecciones (incluyendo neumonía).
Renal: El metotrexato puede causar daño renal y una subsiguiente insuficiencia renal aguda. Se recomienda un control estricto de la función renal, incluyendo hidratación adecuada, alcalinización de la orina y medición del metotrexato sérico y de la función renal.
El uso concomitante de inhibidores de la bomba de protones (PPIs) y dosis altas de metotrexato se debe evitar si es posible y se debe tener precaución en pacientes con insuficiencia renal.
Cutáneo: Se han informado casos de reacciones dermatológicas graves, ocasionalmente fatales, incluyendo necrólisis epidérmica tóxica (síndrome de Lyell), síndrome de Stevens-Johnson y eritema multiforme, en un plazo de días de haberse administrado el metotrexato por vía oral, intramuscular, intravenosa o intratecal.
Las lesiones de la psoriasis podrían agravarse debido a la exposición concomitante a la radiación ultravioleta. Las quemaduras y la dermatitis por radiación podrían volver a manifestarse por el uso de metotrexato.
Control de laboratorio
General: Los pacientes sometidos a tratamiento con metotrexato deben ser estrictamente controlados para detectar oportunamente los efectos tóxicos.
En la evaluación del valor de referencia, se debe incluir un recuento de sangre completo con recuento diferencial y recuento de plaquetas; enzimas hepáticas, pruebas de detección del virus de la hepatitis B o C, pruebas de la función renal; y una radiografía de tórax.
Durante el tratamiento de artritis reumatoide y psoriasis, se recomienda la monitorización de los siguientes parámetros: hematología, al menos mensualmente, niveles de enzimas hepáticas y función renal cada 1 a 2 meses. Generalmente, durante la terapia antineoplásica está indicado un control más frecuente. Durante el inicio o ajuste en la dosificación, o durante periodos de mayor riesgo de incremento de las concentraciones sanguíneas de metotrexato (por ejemplo, deshidratación), también se indica un control más frecuente.
Pruebas de la función pulmonar: Las pruebas de la función pulmonar podrían ser de utilidad si se sospecha una enfermedad pulmonar, especialmente si se dispone de las mediciones del valor de referencia.
Concentración de metotrexato: El control de las concentraciones séricas de metotrexato puede reducir considerablemente la toxicidad y mortalidad permitiendo el ajuste de las dosis de metotrexato y la implementación de medidas de rescate apropiadas.
Los pacientes sometidos a las siguientes condiciones están predispuestos a desarrollar concentraciones elevadas o prolongadas de metotrexato y a beneficiarse de un control sistemático de la concentración del medicamento: p. ej., derrame pleural, ascitis, obstrucción del tubo digestivo, tratamiento previo con cisplatino, deshidratación, aciduria, insuficiencia renal.
Algunos pacientes pueden presentar eliminación retardada del metotrexato en ausencia de estas características. Es importante que los pacientes sean detectados en un plazo de 48 horas puesto que la toxicidad al metotrexato podría no revertirse si se demora el rescate con ácido folínico más de 42 a 48 horas.
El método de control de las concentraciones de metotrexato varía de institución a institución. Debería incluir la determinación de una concentración de metotrexato a las 24, 48 o 72 horas, y una evaluación del índice de reducción de las concentraciones de metotrexato (para determinar el periodo de rescate con ácido folínico).
Poblaciones especiales
Uso pediátrico: La seguridad y la eficacia en pacientes pediátricos se han determinado únicamente en la quimioterapia contra el cáncer y en la artritis reumatoide juvenil de curso poliarticular.
Los estudios clínicos publicados que analizaron el uso del metotrexato en niños y adolescentes (es decir, pacientes de 2 a 16 años) con artritis reumatoide juvenil revelaron una seguridad comparable a la observada en adultos diagnosticados con artritis reumatoide.
Se han informado casos de toxicidad mortal relacionada con un cálculo incorrecto de las dosis por vía intravenosa e intratecal. Se debe prestar especial atención al cálculo de las dosis (ver Posología y Método de Administración).
Se han informado casos de neurotoxicidad grave, frecuentemente caracterizada como convulsiones localizadas o generalizadas con un frecuencia mayor imprevista en pacientes pediátricos diagnosticados con leucemia linfoblástica aguda tratados con dosis intermedias de metotrexato por vía intravenosa (1 g/m2).
Uso geriátrico: Se han informado casos de toxicidad mortal relacionada con dosis diarias no recomendadas, en lugar de dosis semanales, especialmente en pacientes geriátricos. Se le debe enfatizar al paciente que la dosis recomendada se debe tomar una vez a la semana en casos de artritis reumatoide y psoriasis.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN
Agentes quimioterapéuticos: Se puede observar aumento de la nefrotoxicidad cuando se administran altas dosis de metotrexato en combinación con un agente quimioterapéutico potencialmente nefrotóxico (por ejemplo, cisplatino).
Citarabina: El metotrexato intratecal administrado simultáneamente con citarabina IV puede aumentar el riesgo de eventos adversos neurológicos severos, como dolor de cabeza, parálisis, coma y episodios cerebrovasculares.
L-asparaginasa: Se ha reportado que la administración de L-asparaginasa antagoniza el efecto de metotrexato.
Mercaptopurina: El metotrexato aumenta los niveles plasmáticos de mercaptopurina. Por lo tanto, la combinación de metotrexato y mercaptopurina puede requerir ajuste de dosis.
Medicamentos antirreumáticos modificadores de la enfermedad (DMARD) y Medicamentos antiinflamatorios no esteroidales (AINEs): Los AINEs no deben administrarse antes o simultáneamente con altas dosis de metotrexato, como las que se utilizan en el tratamiento de osteosarcoma. Se ha informado que la administración simultánea de AINEs con una terapia de metotrexato de dosis alta eleva y prolonga las concentraciones séricas de metotrexato, lo que da como resultado muertes por toxicidad hematológica grave (incluyendo supresión de la médula ósea y anemia aplásica) y gastrointestinal.
Se ha informado que los AINEs y los salicilatos reducen la secreción tubular de metotrexato en un modelo animal y pueden incrementar su toxicidad al aumentar las concentraciones de metotrexato. Por lo tanto, se debe tener precaución cuando se administran simultáneamente con dosis más bajas de metotrexato.
Al tratar la artritis reumatoide con metotrexato, puede continuarse el uso de aspirina, AINEs o esteroides de dosis baja.
La posibilidad de aumento de la toxicidad con el uso simultáneo de AINEs, incluidos los salicilatos, no se ha explorado completamente. Los esteroides pueden reducirse gradualmente en pacientes que responden al metotrexato. A pesar de las interacciones potenciales, los estudios de metotrexato en pacientes con artritis reumatoide en general han incluido el uso concomitante de regímenes de dosificación constantes de AINEs, sin dificultad. Sin embargo, las dosis de metotrexato utilizadas en artritis reumatoide (7,5 a 15 mg / semana) son algo inferiores a los utilizados en la psoriasis, y dosis mayores pueden causar toxicidad inesperada. El uso combinado de metotrexato con oro, penicilamina, hidroxicloroquina, sulfasalazina no se ha estudiado y puede aumentar la incidencia de efectos adversos.
Inhibidores de la bomba de protones: La administración concomitante de inhibidores de la bomba de protones (PPIs) con metotrexato puede disminuir el aclaramiento de metotrexato causando niveles plasmáticos elevados de metotrexato con signos clínicos y síntomas de toxicidad por metotrexato. Se debe evitar el uso concomitante de PPIs y altas dosis de metotrexato, si es posible, y se debe tener precaución en pacientes con insuficiencia renal.
Antibióticos
Ciprofloxacino: El transporte por los túbulos renales disminuye con ciprofloxacino; el uso de metotrexato con este medicamento debe controlarse cuidadosamente.
Penicilinas y sulfonamidas: Las penicilinas y las sulfonamidas pueden reducir el aclaramiento renal de metotrexato; se ha observado toxicidad hematológica y gastrointestinal en combinación con dosis altas y bajas de metotrexato.
Antibióticos orales: Antibióticos orales, como tetraciclina, cloranfenicol y antibióticos de amplio espectro no absorbibles, pueden reducir la absorción intestinal de metotrexato o interferir con la circulación enterohepática por la inhibición de la flora intestinal y la supresión del metabolismo de metotrexato por bacterias.
Se ha informado que la trimetoprima y el sulfametoxazol rara vez aumentan la supresión de la médula ósea en pacientes que reciben metotrexato, probablemente por la secreción tubular reducida o el efecto antifolato aditivo.
El uso simultáneo de la pirimetamina antiprotozoaria puede aumentar los efectos tóxicos del metotrexato debido a un efecto antifolato aditivo.
Agentes hepatotóxicos: No se ha evaluado el potencial de aumento de hepatotoxicidad cuando se administra metotrexato con otros agentes hepatótoxicos. Sin embargo, se ha informado hepatotoxicidad en esos casos. Por lo tanto, los pacientes que reciben terapia concomitante con metotrexato y otros agentes hepatotóxicos potenciales (por ejemplo, leflunomida, azatioprina, sulfasalazina, retinoides) deben controlarse cuidadosamente por posible aumento del riesgo de hepatotoxicidad.
Anestesia con óxido nitroso: El uso de anestesia con óxido nitroso potencia el efecto del metotrexato en el metabolismo del folato, produciendo mielosupresión impredecible y estomatitis graves. Este efecto se puede reducir mediante el uso de rescate con ácido folínico.
Probenecid: El transporte por los túbulos renales disminuye con probenecid; el uso de metotrexato con este medicamento debe controlarse cuidadosamente.
Vitaminas: Las preparaciones de vitamina que contienen ácido fólico o sus derivados pueden disminuir las respuestas al metotrexato administrado sistémicamente, sin embargo, estados de deficiencia de folato pueden aumentar la toxicidad del metotrexato.
Amiodarona: La administración de amiodarona en pacientes que reciben tratamiento con metotrexato para la psoriasis ha inducido lesiones cutáneas ulceradas.
Medicamentos altamente unidos a proteínas plasmáticas: El metotrexato está parcialmente unido a albúmina sérica, y la toxicidad puede aumentar debido al desplazamiento por otros medicamentos altamente afines, como sulfonilureas, ácido aminobenzoico, salicilatos, fenilbutazona, fenitoína, sulfonamidas, algunos antibióticos como penicilinas, tetraciclina, pristinamicina, probenecid y cloranfenicol.
Leflunomida: El metotrexato en combinación con leflunomida puede aumentar el riesgo de pancitopenia.
Concentrado de eritrocitos: Se debe tener cuidado cuando se administran al mismo tiempo concentrado de eritrocitos y metotrexato: los pacientes que recibieron 24 horas de infusión de metotrexato y transfusiones posteriores han mostrado un aumento de la toxicidad probablemente como resultado de concentraciones séricas elevadas de metotrexato prolongadas.
Terapia de psoraleno y luz ultravioleta (PUVA): Se ha reportado cáncer de piel en algunos pacientes con psoriasis o micosis fungoide (linfoma cutáneo de células T) que recibían un tratamiento concomitante con metotrexato más terapia PUVA (metoxaleno y luz ultravioleta).
Teofilina: El metotrexato puede disminuir la eliminación de teofilina; se debe controlar la concentración de teofilina cuando se utiliza simultáneamente con metotrexato.
Diuréticos: Se han descrito supresión de la médula ósea y disminución de los niveles de folato durante la administración concomitante de triamtereno y metotrexato.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN
|
Tabla 1. |
|||
|
Dosis (mg/m2) |
Vía de administración |
Frecuencia |
Rescate con ácido folínico |
|
Conventional Dose |
Orally, Intravenous as a bolus Intravenous as a bolus, Intramuscular |
Weekly Every 2 – 3 weeks |
- - |
|
Intermediate Dose |
Intravenous push Intravenous infusion Intravenous infusion (36 – 48 h) |
Every 2 – 3 weeks Every 4 – 7 days 2 – 3 weeks |
- + + |
|
High Dose 1 – 12 g/m2 |
Intravenous (1 – 24 h) |
Every 1 – 3 weeks |
+ |
|
Tabla 2. |
||||
|
Dosisi de metotrexate |
Nivel de metotrexate a 48 h (M) |
Tiempo (h) después de metotrexate |
Dosificación con ácido folínico |
|
|
mg/m2 cada 6 h |
Número de dosis |
|||
|
50 – 250 mg/kg cada 6 h |
< 5 x 10-7 |
48 |
15 |
7 |
|
= 5 x 10-7 |
48 |
15 |
8 |
|
|
= 1 x 10-6 |
48 |
100 |
8 |
|
|
= 2 x 10-6 |
48 |
200 |
8 |
|
|
= 5 x 10-6 |
96 |
Continuar con régimen previo hasta que el nivel es = 5 x 10-7 |
||
Incluye prehidratación por 12 horas para establecer una diuresis alcalina usando 1.5 L/m2 de fluido conteniendo 10 mEq de bicarbonato y 20 mEq KCl/L (orina debe ser > pH 7.0).
Administración intratecal: Dosis de 10 a 15 mg/m2 se administran intratecalmente a intervalos de 2 a 5 días hasta que el recuento de células de líquido cefalorraquídeo vuelva a la normalidad y luego son seguidos por una dosis adicional o dosis una vez por semana durante 2 semanas y un mes a partir de entonces. Alternativamente, un régimen para niños basado en la edad ha sido sugerido como sigue:
Menores de 1 año de edad: 6 mg.
1 año de edad: 8 mg.
2 años de edad: 10 mg.
3 años de edad o mayores: 12 mg.
El metotrexato libre de preservantes se diluye a una concentración de 1 mg/mL en un medio apropiado estéril libre de preservantes como cloruro de sodio para inyección 0.9%.
Ver Advertencias y Precauciones especiales de uso para advertencias en radioterapia CNS concomitante.
Micosis fungoides (Linfoma cutáneo de células T): La terapia con metotrexato como un agente único parece producir una respuesta clínica en hasta 50% de los pacientes tratados. La dosificación en las primeras etapas es generalmente de 5 a 50 mg una vez por semana. La reducción de la dosis o su interrupción se guía por la respuesta del paciente y el monitoreo hematológico. El metotrexato también ha sido administrado dos veces al a semana en dosis entre 15 y 37.5 mg en pacientes que han respondido mal a la terapia. Regímenes de quimioterapia combinados que incluyen metotrexato intravenoso administrado a dosis más altas con ácido folínico se han usado en etapas avanzadas de la enfermedad.
Psoriasis: Programa vía intramuscular o intravenosa única semanalmente: 10 a 25 mg por semana. Una dosis semanal total de 25 mg no debe normalmente ser excedido.
Una vez se ha alcanzado la respuesta clínica óptima, el programa de dosificación debe ser reducido a la cantidad más baja posible de fármaco y el intervalo de dosificación más largo posible.
Artritis reumatoide (AR): Dosis únicas por vía parenteral de 7,5 a 20 mg una vez semanalmente.
Una dosis semanal total de 20 mg no debe normalmente ser excedida. Una vez que se ha logrado una respuesta clínica óptima, la dosis debe ser reducida a la dosis efectiva más baja posible. La duración óptima del tratamiento no se conoce; los datos limitados de estudios a largo plazo indican que la mejoría clínica inicial se mantiene durante al menos 2 años con terapia continua.
Uso en ancianos: Debido a la disminución de las funciones hepática y renal así como la disminución de las reservas de folato en esta población, se deben considerar dosis relativamente bajas (especialmente en las indicaciones de psoriasis y AR) y estos pacientes deben ser monitoreados de cerca para signos tempranos de toxicidad (ver Advertencias y Precauciones especiales de uso). Ver tabla 3 abajo para dosis reducidas en pacientes oncológicos.
Artritis reumatoide juvenil de curso poliarticular (JRA): La dosis de inicio recomendada es 10 mg/m2 administrada una vez semanalmente.
Las dosis de metotrexato reportadas en estudios clínicos publicados en pacientes pediátricos con JRA han oscilado entre 4 a 17 mg/m2/semana o 0.1 a 1.1 mg/Kg/semana. La duración osciló desde 1 mes hasta 7.3 años. En la mayoría de estos estudios, el metotrexato fue administrado oralmente; sin embargo, en algunos casos, fue administrado intramuscularmente.
Uso en pacientes con insuficiencia renal-ajustes de dosis: El metotrexato se excreta en gran medida por los riñones, por lo que en pacientes con insuficiencia renal el médico puede requerir ajustar la dosis para evitar la acumulación del fármaco. La tabla a continuación, recomienda dosis iniciales en pacientes con insuficiencia renal; la dosificación puede necesitar un ajuste adicional debido a la amplia variabilidad interindividual del pK.
|
Tabla 3. |
|
|
Depuración de Creatinina (ml/min) |
% Dosis estándar para administrar |
|
>80 |
Dosis completa |
|
80 |
75 |
|
60 |
63 |
|
50 |
56 |
|
<50 |
Usar terapia alternativa |
Suplementación con folato: En pacientes con artritis reumatoide, incluyendo artritis reumatoide juvenil de curso poliarticular o psoriasis, el ácido fólico o ácido folínico puede reducir toxicidades de metotrexato como síntomas gastrointestinales, estomatitis, alopecia y enzimas hepáticas elevadas.
Antes de tomar un suplemento con folato, es recomendable revisar los niveles de B12, particularmente en adultos sobre los 50 años de edad, ya que la administración de folato puede enmascarar síntomas de deficiencia de vitamina B12.
SOBREDOSIFICACIÓN: En la experiencia posterior a la comercialización, la sobredosis con metotrexato generalmente ha ocurrido con administración oral e intratecal, aunque también se han informado sobredosis intravenosas e intramusculares.
Los informes de sobredosis indican administración diaria accidental en lugar de semanal (dosis únicas o divididas). Los síntomas comúnmente informados después de la sobredosis oral incluyen aquellos síntomas y signos informados en dosis farmacológicas, en particular reacciones hematológicas y gastrointestinales. Entre algunos ejemplos se incluyen leucopenia, trombocitopenia, anemia, pancitopenia, supresión de la médula ósea, mucositis, estomatitis, ulceración bucal, náuseas, vómitos, ulceración gastrointestinal y sangrado gastrointestinal. En algunos casos, no se informaron síntomas. Ha habido informes de fallecimiento después de la sobredosis. En estos casos, también se informaron eventos como sepsis o shock séptico, insuficiencia renal y anemia aplásica.
Los síntomas de sobredosis intratecal en general son síntomas del sistema nervioso central (SNC), que incluyen dolor de cabeza, náuseas y vómitos, ataque o convulsión y encefalopatía tóxica aguda. En algunos casos, no se informaron síntomas. Ha habido informes de fallecimiento después de la sobredosis intratecal. En estos casos, también se ha informado hernia cerebral asociada con aumento de la presión intracraneal y encefalopatía tóxica aguda.
Tratamiento recomendado: Se ha indicado que el ácido folínico disminuye la toxicidad y contrarresta el efecto de sobredosis de metotrexato administradas de manera inadvertida. La administración de ácido folínico debe comenzar tan pronto como sea posible. A medida que aumenta el intervalo entre la administración de metotrexato y el inicio con leucovorina, disminuye la efectividad del ácido folínico para contrarrestar la toxicidad. El control de la concentración sérica de metotrexato es fundamental para determinar la dosis óptima y la duración del tratamiento con ácido folínico.
En los casos de sobredosis masiva, pueden ser necesarias la hidratación y la alcalinización urinaria para prevenir la precipitación de metotrexato o sus metabolitos en los túbulos renales. No se ha demostrado que la hemodiálisis estándar ni la diálisis peritoneal mejoren la eliminación del metotrexato. Sin embargo, se ha informado aclaramiento de metotrexato eficaz con hemodiálisis intermitente aguda con dializador de alto flujo.
La sobredosis intratecal accidental puede requerir soporte sistémico intensivo, ácido folínico sistémico de alta dosis, diuresis alcalina y drenaje rápido del LCF y perfusión ventriculolumbar.
Hay informes de casos publicados de tratamiento con carboxipeptidasa G2 intratecal e intravenosa para promover el aclaramiento de metotrexato en casos de sobredosis.
PRESENTACIÓN: METOTREXATO 500 mg/20 ml (Reg. San. INVIMA 2006M-005795 R1).
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá, D.C., Colombia.
Titulo del documento de producto: Metotrexato
Fecha de CDS que reemplaza: Junio 1, 1997
Fecha efectiva: 29 de Octubre de 2013
Versión CDS: 1.0
LLD_Col_26Mar2014_CDSv8.0_24Abr2014_CDSv9.0_26Sep2014_CDSv10.0_v1
PFIZER S.A.S.