
INVEGA TRINZA
PALIPERIDONA
Suspensión inyectable
Caja, 1 Jeringa(s) precargada(s),
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
FORMAS FARMACÉUTICAS Y CONCENTRACIONES:
INVEGA TRINZA™ (175 mg de paliperidona en forma de 273 mg de palmitato de paliperidona) suspensión de liberación prolongada para inyección intramuscular.
INVEGA TRINZA™ (263 mg de paliperidona en forma de 410 mg de palmitato de paliperidona) suspensión de liberación prolongada para inyección intramuscular.
INVEGA TRINZA™ (350 mg de paliperidona en forma de 546 mg de palmitato de paliperidona) suspensión de liberación prolongada para inyección intramuscular.
INVEGA TRINZA™ (525 mg de paliperidona en forma de 819 mg de palmitato de paliperidona) suspensión de liberación prolongada para inyección intramuscular.
INVEGA TRINZA™ contiene 175, 263, 350 o 525 mg de paliperidona (en forma de 273, 410, 546 o 819 mg de palmitato de paliperidona, respectivamente).
El nombre químico es (±)-3-[2-[4-(6-fluoro-1,2-benzisoxazol-3-il)-1-piperidinil]etil]-6,7,8,9-tetrahidro-2-metil-4-oxo-4H-pirido[1,2-a]pirimidin-9-il hexadecanoato.
Consulte los excipientes en la “Lista de excipientes”.
Suspensión de liberación prolongada en jeringas precargadas. La suspensión es blanca o blanquecina.
INFORMACIÓN SOBRE LA ADMINISTRACIÓN: Los productos farmacéuticos parenterales deben inspeccionarse visualmente en busca de algún material extraño o coloración, antes de su administración. Dentro de los 5 minutos antes de la administración de INVEGA TRINZA™ es importante agitar vigorosamente la jeringa durante al menos 15 segundos para asegurar una suspensión homogénea (consulte la sección “Instrucciones de administración, manipulación y eliminación”).
INVEGA TRINZA™ es exclusivamente para uso intramuscular. No administre por vía intravascular ni subcutánea. Evite inyectar inadvertidamente en un vaso sanguíneo. Las inyecciones las debe administrar únicamente un profesional de la salud. Administre la dosis en una única inyección; no administre la dosis en inyecciones separadas. Inyecte lentamente y en profundidad en el músculo deltoides o en el músculo glúteo.
INVEGA TRINZA™ debe administrarse solo con las agujas de pared delgada que se proporcionan en el envase de INVEGA TRINZA™. No deben utilizarse las agujas del envase del producto inyectable de 1 mes de palmitato de paliperidona ni otras agujas disponibles en el mercado para administrar INVEGA TRINZA™.
El tamaño recomendado de la aguja para administrar INVEGA TRINZA™ en el músculo deltoides dependerá del peso del paciente. Para aquellos que pesen ≥ 90 kg (≥ 200 lbs), se recomienda utilizar la aguja de pared delgada calibre 22 de 1½ pulgadas. Para aquellos que pesen < 90 kg (< 200 lbs), se recomienda utilizar la aguja de pared delgada calibre 22 de 1 pulgada. Administre en el centro del músculo deltoides. Las inyecciones deben alternarse en ambos músculos deltoides.
El tamaño recomendado de la aguja para administrar INVEGA TRINZA™ en el músculo glúteo, independientemente del peso corporal, es la aguja de pared delgada calibre 22 de 1½ pulgadas. Administre en el cuadrante superior externo del músculo glúteo. Las inyecciones deben alternarse en ambos glúteos.
Como la paliperidona es el metabolito activo de la risperidona, se debe tener precaución cuando se administra INVEGA TRINZA™ de manera concomitante con risperidona o paliperidona oral durante períodos de tiempo prolongados. Los datos de seguridad que evalúan el uso concomitante de INVEGA TRINZA™ con otros antipsicóticos son limitados.
Administración incompleta: Para evitar una administración incompleta de INVEGA TRINZA™, asegúrese de agitar vigorosamente la jeringa precargada durante al menos 15 segundos, dentro de los 5 minutos antes de la administración, para asegurar una suspensión homogénea (consulte la sección “Instrucciones de administración, manipulación y eliminación”). Sin embargo, en caso de una administración incompleta de la dosis, no vuelva a inyectar la dosis que quedó en la jeringa ni tampoco administre otra dosis. Controle atentamente y trate al paciente de forma adecuada hasta la próxima inyección de 3 meses de INVEGA TRINZA™ programada.
Poblaciones especiales:
Pediátricos (menores de 18 años de edad): La seguridad y la eficacia de INVEGA TRINZA™ no se han estudiado en pacientes < 18 años de edad.
Ancianos (65 años de edad o más): En general, la dosis recomendada de INVEGA TRINZA™ para pacientes ancianos con una función renal normal es la misma que para los adultos más jóvenes con una función renal normal. Como los pacientes ancianos pueden tener una función renal reducida, consulte la sección “Insuficiencia renal” a continuación para obtener recomendaciones de dosificación en pacientes con insuficiencia renal.
Insuficiencia renal: INVEGA TRINZA™ no se ha estudiado sistemáticamente en pacientes con insuficiencia renal (consulte la sección “Propiedades farmacocinéticas”). Para pacientes con insuficiencia renal leve (aclaramiento de creatinina ≥ 50 a < 80 ml/min), el ajuste de la dosis se realiza al inicio del tratamiento con el producto inyectable de 1 mes de palmitato de paliperidona; no se requiere un ajuste de dosis de INVEGA TRINZA™. La transición a INVEGA TRINZA™ se realiza con una dosis en una relación de 3,5 a 1 con la dosis anteriormente estabilizada del producto inyectable de 1 mes de palmitato de paliperidona, como se describe anteriormente en la sección “Posología”. La dosis máxima recomendada de INVEGA TRINZA™ en pacientes con insuficiencia renal leve es de 350 mg.
No se recomienda administrar INVEGA TRINZA™ a pacientes con Insuficiencia renal moderada o grave (aclaramiento de creatinina < 50 ml/min).
Insuficiencia hepática: INVEGA TRINZA™ no se ha estudiado en pacientes con insuficiencia hepática. Según un estudio sobre la paliperidona oral, no se necesita ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. No se ha estudiado la paliperidona en pacientes con insuficiencia hepática grave (consulte la sección “Propiedades farmacocinéticas”).
Otras poblaciones: No se recomiendan ajustes en la dosis de INVEGA TRINZA™ según el sexo, la etnia o el consumo de tabaco. (Respecto a las pacientes embarazadas o en período de lactancia, consulte la sección “Embarazo y lactancia”)
Cambio de otros agentes antipsicóticos: INVEGA TRINZA™ debe utilizarse solo luego de que el paciente haya sido tratado adecuadamente con el producto inyectable de 1 mes de palmitato de paliperidona durante al menos 4 meses (consulte las secciones “Indicaciones”, “Posología” y “Administración”).
Si se suspende el tratamiento con INVEGA TRINZA™, se deben tener en cuenta sus características de liberación prolongada. Tal como se recomienda con otros medicamentos antipsicóticos, se debe reevaluar periódicamente la necesidad de continuar con la medicación para síntomas extrapiramidales (SEP) existentes.
Cambio de INVEGA TRINZA™ al producto inyectable de 1 mes de palmitato de paliperidona: Para cambiar de INVEGA TRINZA™ al producto inyectable de 1 mes de palmitato de paliperidona, este último debe administrarse en el momento en que debe administrarse la siguiente dosis de INVEGA TRINZA™ con una dosis 3,5 veces menor, como se muestra en la Tabla 3. Luego, las dosis del producto inyectable de 1 mes de palmitato de paliperidona deben continuar en intervalos mensuales.
|
Tabla 3. Conversión de la última dosis del producto inyectable de 3 meses de palmitato de paliperidona (INVEGA TRINZA™) a la dosis del producto inyectable de 1 mes de palmitato de paliperidona con 3,5 como factor de conversión |
|
|
Si la última dosis de INVEGA TRINZA™ es: |
Administre el producto de 1 mes de palmitato de paliperidona con la siguiente dosis: |
|
175 mg |
50 mg |
|
263 mg |
75 mg |
|
350 mg |
100 mg |
|
525 mg |
150 mg |
|
La dosis inicial, como se describe en la información del prospecto para el producto inyectable de 1 mes de palmitato de paliperidona no es necesaria. |
|
Cambio de INVEGA TRINZA™ a los comprimidos de paliperidona oral de liberación prolongada: Para cambiar de INVEGA TRINZA™ a los comprimidos de paliperidona oral de liberación prolongada, la dosis diaria de estos últimos debe iniciarse 3 meses después de la última dosis de INVEGA TRINZA™ y continuar durante los próximos meses luego de la última dosis de INVEGA TRINZA™, como se describe en la Tabla 4. La Tabla 4 proporciona los regímenes de conversión de dosis para permitir que los pacientes anteriormente estabilizados con dosis diferentes de INVEGA TRINZA™ logren una exposición similar a la paliperidona con un comprimido de liberación prolongada diario de paliperidona.
|
Tabla 4. Dosis de INVEGA TRINZA™ y regímenes de conversión de los comprimidos de liberación prolongada de paliperidona de una toma al día necesarios para lograr exposiciones similares a la paliperidona* |
|||
|
Semanas desde la última dosis de INVEGA TRINZA™ |
|||
|
≥ 3 meses a ≤ 18 semanas |
> 18 semanas a ≤ 24 semanas |
> 24 semanas |
|
|
Última dosis de INVEGA TRINZA™ |
Dosis diaria de los comprimidos de paliperidona oral de liberación prolongada |
||
|
175 mg |
3 mg |
3 mg |
3 mg |
|
263 mg |
3 mg |
3 mg |
6 mg |
|
350 mg |
3 mg |
6 mg |
9 mg |
|
525 mg |
6 mg |
9 mg |
12 mg |
|
* Las dosis de los comprimidos de paliperidona oral de liberación prolongada deben individualizarse teniendo en cuenta la razón del cambio, la respuesta al tratamiento anterior con paliperidona, la gravedad de los síntomas psicóticos o la tolerabilidad. |
|||
INDICACIONES: INVEGA TRINZA™, una inyección de 3 meses, está indicada para el tratamiento de la esquizofrenia en pacientes adultos que hayan sido tratados adecuadamente con el producto inyectable de 1 mes de palmitato de paliperidona durante al menos cuatro meses.
INFORMACIÓN FARMACÉUTICA:
Lista de excipientes: Los ingredientes inactivos de INVEGA TRINZA™ son ácido cítrico monohidrato, polietilenglicol 4.000, polisorbato 20, sodio dihidrógeno fosfato monohidrato, hidróxido sódico y agua para inyección.
Incompatibilidades: INVEGA TRINZA™ no se debe mezclar con ningún otro producto ni diluyente y se debe inyectar directamente por vía intramuscular con la jeringa en la que va envasado.
Periodo de validez: Consulte la fecha de vencimiento que se encuentra en el envase externo.
PROPIEDADES FARMACOCINÉTICAS:
Absorción y distribución: Debido a que su solubilidad en agua es extremadamente baja, la formulación de 3 meses de palmitato de paliperidona se disuelve lentamente tras la inyección intramuscular, antes de hidrolizarse a la paliperidona y ser absorbido en el sistema circulatorio. La liberación del fármaco comienza el Día 1 y dura hasta 18 meses.
Los datos presentados en este párrafo se basan en un análisis farmacocinético de la población. Después de la administración de una única dosis de INVEGA TRINZA™ por vía intramuscular, las concentraciones plasmáticas de paliperidona aumentaron gradualmente hasta alcanzar el máximo a un valor medio de tmáx de 30 a 33 días. Después de la inyección intramuscular de INVEGA TRINZA™ con dosis de 175 a 525 mg en el músculo deltoides, en promedio, se observó una Cmáx un 11 a 12% mayor que con la inyección en el músculo glúteo. El perfil de liberación y el régimen posológico de INVEGA TRINZA™ da lugar a concentraciones terapéuticas sostenidas. La exposición total de la paliperidona después de la administración de INVEGA TRINZA™ fue proporcional a la dosis en un rango de 175 a 525 mg, y aproximadamente proporcional a la dosis para la Cmáx. El pico medio del estado de equilibrio de la concentración mínima de una dosis de INVEGA TRINZA™ fue de 1,6 después de la administración en el glúteo y de 1,7 después de la administración en el deltoides. Después de la administración de INVEGA TRINZA™, el volumen aparente de distribución de la paliperidona es 1.960 l.
La unión a proteínas plasmáticas de la paliperidona racémica es de 74%.
Después de la administración de INVEGA TRINZA™, los enantiómeros (+) y (-) de la paliperidona se interconvierten hasta alcanzar un cociente de AUC (+) sobre AUC (-) de aproximadamente 1,7 a 1,8.
Metabolismo y excreción: En un estudio con 14C-paliperidona oral de liberación inmediata, una semana después de la administración de una dosis oral única de 1 mg de 14C-paliperidona de liberación inmediata, el 59% de la dosis se excretó inalterada en la orina, lo que indica que el metabolismo hepático de la paliperidona no es muy importante. Aproximadamente el 80% de la radiactividad administrada se recuperó en la orina y el 11% en las heces. Se han identificado cuatro vías metabólicas in vivo, ninguna de las cuales supuso más del 10% de la dosis: desalquilación, hidroxilación, deshidrogenación y escisión del benzisoxazol. A pesar de que los estudios in vitro indican que CYP2D6 y CYP3A4 podrían tener una implicación en el metabolismo de la paliperidona, no hay indicios in vivo de que estas isoenzimas desempeñen un papel significativo en el metabolismo de la paliperidona. Los análisis farmacocinéticos de la población no indicaron ninguna diferencia discernible en el aclaramiento aparente de paliperidona después de la administración de paliperidona oral entre grandes metabolizadores y bajos metabolizadores de sustratos de CYP2D6. En estudios in vitro realizados en microsomas hepáticos humanos se ha observado que la paliperidona no inhibe sustancialmente el metabolismo de los fármacos metabolizados por las isoenzimas del citocromo P450, incluidas CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5.
En los estudios in vitro se ha observado que la paliperidona es un sustrato de la glicoproteína P (P-gp) y un inhibidor débil de la P-gp en concentraciones elevadas. No existen datos in vivo y se desconoce la relevancia clínica.
En función del análisis farmacocinético de la población, la media de semivida aparente de la paliperidona, tras una administración de INVEGA TRINZA™ dentro del rango de dosis de 175 a 525 mg, varió de 84 a 95 días después de las inyecciones en el deltoides y de 118 a 139 días después de las inyecciones en el glúteo.
Inyección de 3 meses de palmitato de paliperidona de acción prolongada en comparación con otras formulaciones de paliperidona: INVEGA TRINZA™ está diseñado para liberar paliperidona en un periodo de 3 meses, mientras que la inyección de 1 mes de palmitato de paliperidona se administra todos los meses. INVEGA TRINZA™, cuando se administra en dosis 3,5 veces mayores que la dosis correspondiente de la inyección de 1 mes de palmitato de paliperidona, produce exposiciones a la paliperidona similares a las obtenidas con las dosis mensuales correspondientes de la inyección de 1 mes de palmitato de paliperidona y con las dosis diarias, de una vez al día, correspondientes de los comprimidos de paliperidona de liberación prolongada. El rango de exposición de INVEGA TRINZA™ está dentro del rango de exposición para las concentraciones aprobadas de las dosis de los comprimidos de paliperidona de liberación prolongada.
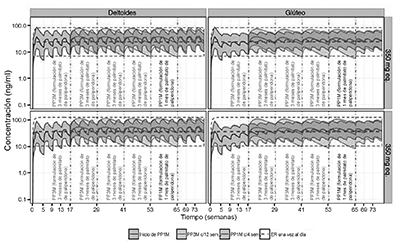
La Figura 3 presenta la media prevista de los perfiles farmacocinéticos de la población para la paliperidona después de la administración de INVEGA TRINZA™ con dosis de 350 mg y 525 mg en comparación con la administración de la inyección de 1 mes de palmitato de paliperidona con dosis de 100 mg y 150 mg y con la administración oral de comprimidos de liberación prolongada (con dosis de 8 mg o 12 mg). El tratamiento con la inyección de 1 mes de palmitato de paliperidona durante al menos 4 meses antes de iniciar el tratamiento con INVEGA TRINZA™ permitió que la exposición plasmática a la paliperidona se mantuviera en un estado de equilibrio.
Figura 3: Concentraciones plasmáticas previstas de paliperidona comparadas con el tiempo de INVEGA TRINZA™ (PP3M) en grupos con dosis de 350 mg y 525 mg en comparación con la dosis mensual de la inyección de 1 mes de palmitato de paliperidona (PP1M) con dosis de 100 mg 150 mg. Las líneas punteadas representan las concentraciones previstas de paliperidona después del tratamiento con comprimidos de 8 mg y 12 mg de paliperidona oral de liberación prolongada.
Poblaciones especiales:
Ancianos (65 años de edad o más): No se recomienda ajustar la dosis por edades. Sin embargo, puede ser necesario ajustar la dosis si hubiera una reducción del aclaramiento de creatinina relacionada con la edad (consulte la sección “Insuficiencia renal” que está a continuación y la sección “Posología y forma de administración”).
Insuficiencia renal: INVEGA TRINZA™ no se ha estudiado sistemáticamente en pacientes con insuficiencia renal. Se estudió la eliminación de una dosis oral única de un comprimido de 3 mg de paliperidona de liberación prolongada en sujetos con distintos grados de función renal. La eliminación de la paliperidona disminuyó con la reducción del aclaramiento estimado de creatinina. El aclaramiento total de la paliperidona se redujo en sujetos con alteraciones de la función renal, en un promedio de 32% en casos de insuficiencia renal leve (CrCl = 50 a < 80 ml/min), en un 64% en casos de insuficiencia renal moderada (CrCl = 30 a < 50 ml/min) y en un 71% en casos de insuficiencia renal grave (CrCl = 10 a < 30 ml/min), lo que correspondería a un aumento promedio de la exposición (AUCinf) de 1,5; 2,6 y 4,8 veces, respectivamente, en comparación con los valores en sujetos sanos. En función de una cantidad limitada de observaciones con INVEGA TRINZA™ en sujetos con insuficiencia renal leve y de simulaciones farmacocinéticas, debe reducirse la dosis inicial y de mantenimiento de la inyección de 1 mes de palmitato de paliperidone en pacientes con insuficiencia renal leve. Los sujetos pueden pasarse a INVEGA TRINZA™ con la dosis correspondiente de 3,5 veces más para sujetos con insuficiencia renal leve. No es necesaria ninguna dosis adicional al iniciar el tratamiento con INVEGA TRINZA™. (consulte la sección “Posología y forma de administración”)
Insuficiencia hepática: La paliperidona se metaboliza predominantemente en el hígado. A pesar de que no se estudió INVEGA TRINZA™ en pacientes con insuficiencia hepática, no se requiere un ajuste de la dosis en pacientes con insuficiencia hepática leve o moderada. En un estudio con paliperidona oral en sujetos con insuficiencia hepática moderada (clase B de Child-Pugh), las concentraciones plasmáticas de paliperidona libre fueron similares a las de los sujetos sanos. No se ha estudiado la paliperidona en pacientes con insuficiencia hepática grave
Raza: El análisis farmacocinético poblacional, según los datos de los estudios de paliperidona oral, no muestra diferencias étnicas en la farmacocinética de la paliperidona después de la administración de INVEGA TRINZA™.
Sexo: No se observaron diferencias clínicamente significativas entre hombres y mujeres.
Tabaquismo: Según estudios in vitro con enzimas hepáticas humanas, la paliperidona no es un sustrato de CYP1A2; por lo tanto, el consumo de tabaco no debería repercutir en la farmacocinética de la paliperidona. En consonancia con los resultados in vitro, el análisis farmacocinético poblacional, a partir de los datos de estudios con el producto inyectable de 1 mes de paliperidona, no muestra diferencias entre fumadores y no fumadores.
Índice de masa corporal (IMC)/Peso: No se requiere un ajuste de la dosis con base en el IMC. Se observó una Cmáx menor en sujetos con sobrepeso y obesidad. En un estado de equilibrio aparente con INVEGA TRINZA™, las concentraciones mínimas fueron similares entre sujetos con peso normal, con sobrepeso y con obesidad.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Otros antipsicóticos, código ATC: N05AX13.
Mecanismo de acción: El palmitato de paliperidona, el principio activo de INVEGA TRINZA™, es un agente psicotrópico que pertenece a la clase química de los derivados del benzisoxazol (antipsicótico neuroléptico atípico). INVEGA TRINZA™ contiene una mezcla racémica de paliperidona (+) y (-).
El palmitato de paliperidona se hidroliza a la paliperidona (consulte la sección “Datos no clínicos”). La paliperidona es un antagonista dopaminérgico D2 de acción central, con actividad principalmente antagonista serotoninérgica 5-HT2A. La paliperidona también actúa como antagonista sobre los receptores adrenérgicos a1 y a2 y sobre los receptores histaminérgicos H1. La paliperidona no manifiesta afinidad por los receptores muscarínicos colinérgicos ni por los receptores adrenérgicos ß1 y ß2. La actividad farmacológica de los enantiómeros de la paliperidona (+) y (-) es parecida cualitativa y cuantitativamente.
Se desconoce el mecanismo de acción de la paliperidona, al igual que ocurre con otros fármacos eficaces contra la esquizofrenia. Sin embargo, se ha propuesto que la actividad terapéutica de la paliperidona contra la esquizofrenia está mediada por una combinación de la acción antagónica sobre el receptor dopaminérgico tipo 2 (D2) y sobre el receptor serotoninérgico tipo 2 (5HT2A). El antagonismo sobre otros receptores distintos de D2 y 5HT2A podría explicar algunos de los otros efectos de la paliperidona.
Efecto en el intervalo QT/QTc y electrofisiología cardíaca: Los efectos de la paliperidona en el intervalo QT se evaluaron en un amplio estudio sobre el QT multicéntrico, de doble ciego, controlado con principio activo (400 mg de moxifloxacina en una única dosis), con paliperidona oral en adultos con esquizofrenia y trastorno esquizoafectivo, y en cuatro estudios de eficacia con una dosis fija y un estudio de mantenimiento del producto inyectable de 1 mes de palmitato de paliperidona.
En el amplio estudio sobre el QT (n = 141), la dosis de 8 mg de paliperidona oral de liberación inmediata (n = 50) indicó un aumento medio, sustraído el placebo, desde el inicio, del QTcLD (intervalo QT corregido para la frecuencia cardíaca con el método derivado y lineal específico para la población) de 12,3 ms (IC del 90%: 8,9; 15,6) en el Día 8, después de 1,5 horas de la administración de la dosis. El pico medio del estado de equilibrio de la concentración plasmática para esta dosis de 8 mg de paliperidona de liberación inmediata (Cmáx ss = 113 ng/ml) fue aproximadamente 2 veces mayor que la exposición con la dosis máxima recomendada de 525 mg de INVEGA TRINZA™ administrada en el músculo deltoides (media prevista de Cmáx ss = 56 ng/ml). En este mismo estudio, una dosis de 4 mg de la formulación de paliperidona oral de liberación inmediata, con una Cmáx ss = 35 ng/ml, indicó un aumento, sustraído el placebo, del QTcLD de 6,8 ms (IC del 90%: 3,6; 10,1) en el Día 2, después de 1,5 horas de la administración de la dosis.
En los cuatro estudios de eficacia con una dosis fija del producto inyectable de 1 mes de palmitato de paliperidona, ningún sujeto experimentó cambios en el valor de QTcLD de más de 60 ms y nadie alcanzó un valor de QTcLD > 500 ms en ningún momento. En el estudio de mantenimiento, ningún paciente experimentó cambios en el valor de QTcLD > 60 ms, y solo un paciente alcanzó un valor de QTcLD de 507 ms (valor del intervalo QT corregido de Bazett [QTcB] de 483 ms); este último sujeto también presentó una frecuencia cardíaca de 45 latidos por minuto.
En el ensayo de prevención de recidiva a largo plazo de INVEGA TRINZA™ en sujetos con esquizofrenia se observó que 1 sujeto (< 1%) presentó un aumento de QTcLD que superó los 60 ms durante la fase abierta, que ningún sujeto presentó un aumento de QTcLD superior a 60 ms después del tratamiento con INVEGA TRINZA™ durante la fase de doble ciego y que ningún sujeto presentó un valor de QTcLD > 480 ms en ningún momento durante el estudio.
Eficacia clínica: La eficacia de INVEGA TRINZA™ para el tratamiento de la esquizofrenia en sujetos que han recibido un tratamiento adecuado durante al menos 4 meses con el producto inyectable de 1 mes de palmitato de paliperidona se evaluó en un estudio de prevención de recidiva/estudio aleatorizado de abstinencia a largo plazo, de doble ciego, controlado con placebo y en un estudio de no inferioridad, a largo plazo, de doble ciego, controlado con principio activo.
Estudio de prevención de recidiva/estudio aleatorizado de abstinencia: Los sujetos adultos que cumplían con los criterios DSM-IV-TR para la esquizofrenia podían participar del estudio con síntomas agudos (si habían sido tratados con antipsicóticos orales anteriormente) o con un estado clínicamente estable (si habían sido tratados con antipsicóticos inyectables de acción prolongada [LAI]). A todos los sujetos que habían sido tratados anteriormente con antipsicóticos orales se les administró el régimen de iniciación de 1 mes de palmitato de paliperidona (inyecciones en el deltoides de 234 mg y 156 mg separadas por un periodo de una semana), mientras que a los sujetos que cambiaban del medicamento LAI se les administró el producto inyectable de 1 mes de palmitato de paliperidona en lugar de la siguiente inyección programada. Específicamente:
• Para los sujetos que ingresaban al estudio que ya recibían el tratamiento con el producto inyectable de 1 mes de palmitato de paliperidona, la dosis no se modificó. Los sujetos que ya recibían la dosis de 39 mg de 1 mes de palmitato de paliperidona no fueron elegibles para participar en el estudio.
• Los sujetos que ingresaban al estudio que recibían el tratamiento con dosis de 25 mg, 37,5 mg o 50 mg de RISPERDAL® CONSTA® (inyección de risperidona de acción prolongada) se cambiaron a dosis de 78 mg, 117 mg o 156 mg, respectivamente, del producto inyectable de 1 mes de palmitato de paliperidona administrado en el músculo deltoides.
• Los sujetos que ingresaban al estudio que recibían el tratamiento con cualquier otro producto LAI se cambiaron a dosis de 234 mg del producto inyectable de 1 mes de palmitato de paliperidona administrado en el músculo deltoides.
Este estudio incluyó los tres periodos de tratamiento que se describen a continuación:
• Un periodo abierto de 17 semanas con dosis flexibles del producto inyectable de 1 mes de palmitato de paliperidona (primera parte de la fase de estabilización abierta de 29 semanas). Un total de 506 sujetos ingresó en esta fase del estudio. La dosis del producto inyectable de 1 mes de palmitato de paliperidona se individualizó según la respuesta sintomática, la tolerabilidad y los antecedentes médicos. En especial, la dosis podía ajustarse en la inyección de la Semana 5 o 9, y el lugar de inyección podía ser el deltoides o el glúteo. La dosis de la Semana 13 debía ser igual a la de la Semana 9. Los sujetos debían estar clínicamente estables al final de este periodo antes de que se les administrara INVEGA TRINZA™ en la visita de la Semana 17. La estabilidad clínica se definió como una puntuación total de la PANSS < 70 en la Semana 17.
• Un periodo de tratamiento abierto de 12 semanas con INVEGA TRINZA™ (segunda parte de la fase de estabilización abierta de 29 semanas). A un total de 379 sujetos se les administró una dosis única de INVEGA TRINZA™ que era un múltiplo de 3,5 veces de la última dosis del producto inyectable de 1 mes de palmitato de paliperidona. Los sujetos debían permanecer clínicamente estables antes de ingresar al siguiente periodo (de doble ciego). La estabilidad clínica se definió como una puntuación total de la PANSS < 70 y una puntuación ≤ 4 para los puntos P1, P2, P3, P6, P7, G8 y G14 de la PANSS al final de este periodo de 12 semanas (Semana 29 del estudio).
• Un periodo de tratamiento de doble ciego de duración variable. En este periodo, se aleatorizaron 305 sujetos estabilizados en una proporción 1:1 para continuar con el tratamiento con INVEGA TRINZA™ o con placebo hasta la recidiva, la interrupción temprana del tratamiento o el final del estudio. Los sujetos se aleatorizaron para recibir la misma dosis de INVEGA TRINZA™ que se les administró durante la fase abierta (es decir, 273 mg, 410 mg, 546 mg u 819 mg) o para recibir placebo administrado cada 12 semanas. La cantidad (%) de sujetos que ingresó a la fase de doble ciego en cada nivel de dosis fue de 6 (4%) para 175 mg, 15 (9%) para 263 mg, 78 (49%) para 350 mg y 61 (38%) para 525 mg.
La variable de eficacia principal fue el tiempo hasta la primera recidiva. La recidiva se había definido previamente como el tiempo transcurrido hasta la primera presentación de alguno de los siguientes hechos: hospitalización psiquiátrica, ≥ 25% de aumento (si la puntuación inicial era > 40) o un aumento de 10 puntos (si la puntuación inicial era ≤ 40) de la puntuación total de la PANSS en dos evaluaciones consecutivas; autolesiones deliberadas; comportamiento violento; pensamientos suicidas/homicidas; o una puntuación ≥ 5 (si la puntuación inicial máxima era ≤ 3) o ≥ 6 (si la puntuación inicial máxima era de 4) en dos evaluaciones consecutivas de los puntos P1 (delirios), P2 (desorganización conceptual), P3 (alucinaciones), P6 (desconfianza/manía persecutoria), P7 (hostilidad) o G8 (no cooperación) de la PANSS.
En un análisis provisional planificado previamente se observó que el tiempo hasta la recidiva era significativa y estadísticamente mayor en sujetos tratados con INVEGA TRINZA™ en comparación con los del grupo con placebo. El estudio se interrumpió prematuramente porque se demostró que la eficacia se mantenía. La razón más frecuente de recidiva que se observó en ambos grupos de tratamiento fue el aumento en la puntuación total de la PANSS, seguida de la hospitalización psiquiátrica.
La duración media (DE) de la exposición durante la fase de doble ciego fue de 150 (79) días en el grupo con placebo y de 175 (90) días en el grupo con INVEGA TRINZA™. Un veintitrés por ciento (23%) de los sujetos en el grupo con placebo y un 7,4% de los sujetos en el grupo con INVEGA TRINZA™ experimentaron una recidiva. El cociente de riesgo de recidiva (placebo/INVEGA TRINZA™) fue de 3,45 (95% IC: 1,73, 6,88) lo que indica una disminución de 71% en el riesgo de recidiva con INVEGA TRINZA™. Hubo una diferencia significativa (valor de p < 0,001) entre los grupos de tratamiento en favor de INVEGA TRINZA™. El estimador de Kaplan-Meier del tiempo hasta la recidiva según el grupo de tratamiento se muestra en la Figura 1. El valor medio de tiempo hasta la recidiva (momento en el que la función de supervivencia acumulada es igual a 0,5, o 50%) para los sujetos del grupo con placebo (274 días) fue significativamente menor que el del grupo con INVEGA TRINZA™ (que no se pudo estimar ya que menos del 15% de los pacientes restantes experimentó una recidiva en cualquier momento durante el ensayo).
En una evaluación de los subgrupos de población no se observaron diferencias clínicamente significativas en la capacidad de respuesta por sexo, edad ni etnia.
Figura 1: Estimador de Kaplan-Meier del tiempo hasta la recidivaa: análisis provisional
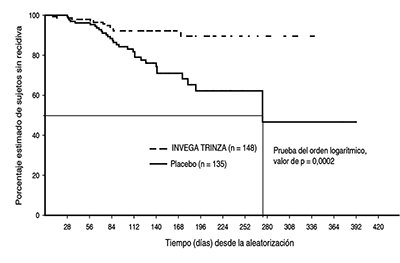
a También se muestra el valor medio del tiempo hasta la recidiva del grupo con placebo (274 días), que es un valor estimado del tiempo promedio que tardó el 50% de la población del ensayo en experimentar una recidiva después de que se interrumpiera el tratamiento con INVEGA TRINZA™.
Estudio de no inferioridad: En el estudio de no inferioridad, 1.429 sujetos gravemente enfermos (valor medio inicial de la puntuación total de la PANSS: 85,7) se inscribieron en la fase abierta y recibieron un tratamiento con el producto inyectable de 1 mes de palmitato de paliperidona durante 17 semanas. La dosis podía ajustarse (es decir, 50 mg, 75 mg, 100 mg o 150 mg) en las inyecciones de la Semana 5 o 9, y el lugar de inyección podía ser el deltoides o el glúteo. Para sujetos que cumplían con los criterios de aleatorización en las Semanas 14 y 17, se aleatorizaron 1016 sujetos en una proporción 1:1 para continuar con inyecciones mensuales del producto inyectable de 1 mes de palmitato de paliperidona o para cambiarse al grupo con INVEGA TRINZA™ con un múltiplo de 3,5 veces de la dosis del producto inyectable de 1 mes de palmitato de paliperidona de la Semana 9 y 13 durante 48 semanas. A los sujetos se les administró INVEGA TRINZA™ una vez cada 3 meses y medicamento inyectable de placebo el resto de los meses para mantener el ciego.
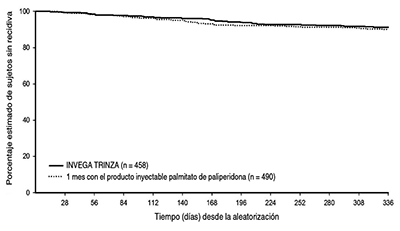
El criterio de valoración principal de la eficacia del estudio fue el porcentaje de sujetos que no experimentaron una recidiva al final de la fase de doble ciego de 48 semanas de duración, calculado con el estimador de Kaplan-Meier de 48 semanas (INVEGA TRINZA™: 91,2%, producto inyectable de 1 mes de palmitato de paliperidona: 90,0%). La duración media (DE) de la exposición durante la fase de doble ciego fue de 295 (88) días en el grupo con INVEGA TRINZA™ y de 287 (96) días en el grupo con el producto inyectable de 1 mes de palmitato de paliperidona. No se pudo estimar el valor medio del tiempo hasta la recidiva en ninguno de los grupos debido a que hubo un porcentaje muy bajo de sujetos con recidiva. La diferencia (95% IC) entre los grupos de tratamiento fue de 1,2% (-2,7%, 5,1%), lo que cumple con el criterio de no inferioridad previamente especificado con base en un margen de -15%. Por lo tanto, el grupo de tratamiento con INVEGA TRINZA™ no fue inferior al producto inyectable de 1 mes de palmitato de paliperidona. Las mejoras en el funcionamiento, medidas con la escala de comportamiento personal y social (PSP), que se observaron durante la fase de estabilización abierta se mantuvieron durante la fase de doble ciego en ambos grupos de tratamiento.
Figura 2: Estimador de Kaplan-Meier del tiempo hasta la recidiva que compara INVEGA TRINZA™ con el producto inyectable de 1 mes de palmitato de paliperidona.
Los resultados de eficacia fueron consistentes en todos los subgrupos de población (sexo, edad y etnia) en ambos estudios.
DATOS DE ENSAYOS CLÍNICOS:
Los datos descritos en esta sección incluyen datos de 3 ensayos clínicos. Uno fue un ensayo a largo plazo de prevención de recidiva/ensayo aleatorizado de abstinencia, en el que 506 sujetos con esquizofrenia recibieron el producto inyectable de 1 mes de palmitato de paliperidona durante la fase abierta, de los cuales 379 continuaron recibiendo una única inyección de INVEGA TRINZA™ durante la fase abierta, 160 se aleatorizaron posteriormente para recibir al menos una dosis de INVEGA TRINZA™ y 145 recibieron placebo durante la fase de doble ciego controlada con placebo. La duración media (desviación estándar [DE]) de la exposición durante la fase de doble ciego fue de 150 (79) días en el grupo de placebo y de 175 (90) días en el grupo de INVEGA TRINZA™.
El segundo ensayo fue un estudio de no inferioridad, de doble ciego, a largo plazo y con control activo, en el que 1.429 sujetos gravemente enfermos se inscribieron en la fase abierta y recibieron un tratamiento con el producto inyectable de 1 mes de palmitato de paliperidona. Los sujetos que cumplían con los criterios de aleatorización se aleatorizaron en una proporción 1:1 para continuar con inyecciones mensuales del producto inyectable de 1 mes de palmitato de paliperidona (n = 512) o para cambiarse al grupo de INVEGA TRINZA™ (n = 504) durante 48 semanas. La duración media (DE) de la exposición durante la fase de doble ciego fue de 295 (88) días en el grupo de INVEGA TRINZA™ y de 287 (96) días en el grupo del producto inyectable de 1 mes de palmitato de paliperidona.
El tercer ensayo fue un estudio de fase 1, en el que 308 sujetos con esquizofrenia o trastorno esquizoafectivo recibieron una única inyección de INVEGA TRINZA™ en forma concomitante con otros antipsicóticos orales.
La mayoría de las reacciones adversas fueron de intensidad leve a moderada.
Las reacciones adversas registradas en el ensayo a largo plazo de prevención de recidiva se muestran en la Tabla 5.
|
Tabla 5. Incidencia de reacciones adversas identificadas para INVEGA TRINZA™, resumidas por términos agrupados para las fase abierta y la fase de doble ciego de un ensayo a largo plazo de prevención de recidiva en sujetos con esquizofrenia |
|||
|
--- Fase abierta --- |
------- Fase de doble ciego ------ |
||
|
Palmitato de paliperidonaa |
Placebo |
INVEGA TRINZA™ |
|
|
Clasificación por órganos y sistemas |
(n = 506) |
(n = 145) |
(n = 160) |
|
Reacción adversab |
n (%)c |
n (%)c |
n (%)c |
|
Infecciones e infestaciones |
|||
|
Infección de las vías respiratorias superiores |
26 (5,1) |
6 (4,1) |
16 (10,0) |
|
Infección de las vías urinarias |
2 (0,4) |
2 (1,4) |
5 (3,1) |
|
Trastornos metabólicos y nutricionales |
|||
|
Hiperglucemia |
0 |
7 (4,8) |
3 (1,9) |
|
Hiperinsulinemia |
0 |
1 (0,7) |
1 (0,6) |
|
Aumento de peso |
52 (10,3) |
5 (3,4) |
14 (8,8) |
|
Trastornos psiquiátricos |
|||
|
Ansiedad |
44 (8,7) |
16 (11,0) |
13 (8,1) |
|
Trastornos del sistema nervioso |
|||
|
Acatisia |
23 (4,5) |
3 (2,1) |
8 (5,0) |
|
Discinesia |
1 (0,2) |
2 (1,4) |
1 (0,6) |
|
Distonía |
6 (1,2) |
0 |
1 (0,6) |
|
Dolor de cabeza |
33 (6,5) |
6 (4,1) |
14 (8,8) |
|
Parkinsonismo |
23 (4,5) |
0 |
7 (4,4) |
|
Somnolencia |
20 (4,0) |
0 |
1 (0,6) |
|
Trastornos cardíacos |
|||
|
Taquicardia |
8 (1,6) |
1 (0,7) |
1 (0,6) |
|
Trastornos vasculares |
|||
|
Hipotensión ortostática |
2 (0,4) |
0 |
0 |
|
Trastornos gastrointestinales |
|||
|
Náusea |
11 (2,2) |
0 |
2 (1,3) |
|
Vómitos |
9 (1,8) |
0 |
0 |
|
Trastornos del aparato reproductor y mamarios |
|||
|
Amenorrea |
6 (1,2) |
0 |
1 (0,6) |
|
Galactorrea |
4 (0,8) |
0 |
0 |
|
Reacción en el lugar de inyección |
62 (12,3) |
0 |
5 (3,1) |
|
a Durante la fase abierta, los sujetos recibieron varias dosis del producto inyectable de 1 mes de palmitato de paliperidona seguidas de una dosis única de INVEGA TRINZA™ antes de la aleatorización al grupo de placebo o de INVEGA TRINZA™ en la fase de doble ciego siguiente (consulte la sección “Propiedades farmacodinámicas: eficacia clínica”). b Se combinaron los siguientes términos: El término taquicardia incluye: taquicardia y taquicardia sinusal. El término reacción en el lugar de inyección incluye: reacción, eritema, extravasación, induración, inflamación, masas, nódulos, dolor e hinchazón en el lugar de inyección. El término aumento de peso incluye: aumento de peso y aumento de la circunferencia de la cintura. El término infección de las vías respiratorias superiores incluye: infección de las vías respiratorias superiores, nasofaringitis, faringitis y rinitis. El término somnolencia incluye: somnolencia y sedación. El término acatisia incluye: acatisia e inquietud. El término parkinsonismo incluye: parkinsonismo, rigidez de rueda dentada, babeo, trastorno extrapiramidal, hipoquinesia, rigidez muscular, contracción muscular, rigidez musculoesquelética e hipersecreción salival. El término distonía incluye: distonía y blefaroespasmo. c La incidencia se basa en la cantidad de sujetos que experimentan al menos un evento adverso, no en la cantidad de eventos. |
|||
Datos de otros estudios clínicos: El palmitato de paliperidona se hidroliza a paliperidona.
La paliperidona es el metabolito activo de la risperidona, por lo tanto, el perfil de reacciones adversas de cada uno de estos compuestos (tanto en formulaciones orales como inyectables) es relevante para el otro.
Esta subsección incluye reacciones adversas adicionales comunicadas con paliperidona o risperidona en ensayos clínicos.
Las reacciones adversas adicionales comunicadas en ensayos clínicos de INVEGA TRINZA™, que no se incluyen en la Tabla 5, se muestran en la Tabla 6a.
|
Tabla 6a. Reacciones adversas adicionales comunicadas en ensayos clínicos de INVEGA TRINZA™ |
|
Clasificación por órganos y sistemas |
|
Reacción adversa |
|
Infecciones e infestaciones |
|
Acarodermatitis, bronquitis, celulitis, cistitis, infección de oídos, infección ocular, gripe, onicomicosis, neumonía, infección de las vías respiratorias, sinusitis, absceso subcutáneo, amigdalitis. |
|
Trastornos de la sangre y del sistema linfático |
|
Anemia, neutropenia, recuento leucocitario reducido. |
|
Trastornos del sistema inmunitario |
|
Hipersensibilidad. |
|
Trastornos endocrinos |
|
Glucosuria, hiperprolactinemia. |
|
Trastornos del metabolismo y de la nutrición |
|
Hipercolesterolemia, hipertrigliceridemia, disminución del apetito, aumento del apetito, polidipsia, pérdida de pesoa. |
|
Trastornos psiquiátricos |
|
Agitación, anorgasmia, afecto aplanado, estado confusional, depresióna, insomnioa, disminución de la libido, nerviosismo, pesadillas, trastornos del sueño. |
|
Trastornos del sistema nervioso |
|
Isquemia cerebral, trastornos de la atención, mareos, mareo postural, disartria, hipoestesia, parestesia, hiperactividad psicomotora, síncope, discinesia tardía, temblores corporalesa. |
|
Trastornos oculares |
|
Conjuntivitis, ojos secos, glaucoma, aumento del lagrimeo, visión borrosa. |
|
Trastornos del oído y del laberinto |
|
Dolor de oídos, tinnitus, vértigo. |
|
Trastornos cardíacos |
|
Bloqueo aurioventricular, bradicardia, trastornos de la conducción, electrocardiograma anormal, QT prolongado del electrocardiograma, palpitaciones, síndrome de taquicardia postural ortostática. |
|
Trastornos vasculares |
|
Hipertensióna, hipotensión. |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
Tos, disnea, epistaxis, congestión nasal, dolor faringolaríngeo, congestión de las vías respiratorias. |
|
Trastornos gastrointestinales |
|
Malestar abdominal, dolor abdominal, queilitis, estreñimientoa, diarreaa, boca seca, dispepsia, disfagia, flatulencias, gastroenteritis, odontalgiaa. |
|
Trastornos hepatobiliares |
|
Aumento de la gamma-glutamil transferasa, aumento de las enzimas hepáticas, aumento de las transaminasas. |
|
Trastornos de la piel y del tejido subcutáneo |
|
Acné, erupción medicamentosa, piel seca, eccema, eritema, prurito, erupciones, urticaria. |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|
Artralgia, dolor de espaldaa, aumento de la creatina fosfoquinasa sanguínea, rigidez en las articulaciones, inflamación de las articulaciones, espasmos musculares, debilidad muscular, dolor musculoesqueléticoa, dolor de cuello. |
|
Trastornos renales y urinarios |
|
Disuria, incontinencia urinaria, polaquiuria. |
|
Trastornos del aparato reproductor y mamarios |
|
Malestar en la mama, aumento de tamaño de la mama, dolor de mamas, trastornos de la eyaculación, disfunción eréctil, ginecomastia, trastornos de la menstruaciónb, disfunción sexual. |
|
Trastornos generales y afecciones en el lugar de la administración |
|
Astenia, aumento de la temperatura corporal, malestar en el pecho, dolor de pecho, escalofríos, síndrome de abstinencia farmacológica, edema facial, fatigaa, marcha anormal, malestar, edemab, pirexia. |
|
Lesiones, intoxicaciones y complicaciones de los procedimientos. |
|
Caídas. |
|
a Notificados en ≥ 2% de los sujetos tratados con INVEGA TRINZA™ o el producto inyectable de 1 mes de palmitato de paliperidona. b El término edema incluye: edema generalizado, periférico y con fóvea. El término trastornos de la menstruación incluye: menstruación irregular y oligomenorrea. |
Reacciones adversas adicionales comunicadas en otros ensayos clínicos de paliperidona y risperidona se muestran en la Tabla 6b.
|
Tabla 6b. Reacciones adversas adicionales comunicadas en otros ensayos clínicos de paliperidona y risperidona. |
|
Clasificación por órganos y sistemas |
|
Reacción adversa |
|
Trastornos de la sangre y del sistema linfático |
|
Aumento en el recuento de eosinófilos. |
|
Trastornos del sistema inmunitario |
|
Reacción anafiláctica. |
|
Trastornos del metabolismo y de la nutrición |
|
Anorexia. |
|
Trastornos del sistema nervioso |
|
Trastornos en el equilibrio, convulsióna, coordinación anormal, nivel de conciencia deprimido, coma diabético, titubeo de cabeza, pérdida de conciencia, síndrome neuroléptico maligno, falta de respuesta a los estímulos. |
|
Trastornos oculares |
|
Trastorno de los movimientos oculares, ojos hacia atrás, hiperemia ocular, fotofobia. |
|
Trastornos cardíacos |
|
Arritmia sinusal. |
|
Trastornos vasculares |
|
Rubefacción, isquemia. |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
Disfonía, hiperventilación, neumonía por aspiración, congestión pulmonar, crepitantes, sibilancias. |
|
Trastornos gastrointestinales |
|
Incontinencia fecal, fecaloma, obstrucción intestinal, lengua hinchada. |
|
Trastornos de la piel y del tejido subcutáneo |
|
Caspa, hiperqueratosis, dermatitis seborreica, decoloración de la piel. |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|
Postura anómala, rabdomiólisis. |
|
Trastornos del aparato reproductor y mamarios |
|
Congestión mamaria, secreción vaginal. |
|
Trastornos generales y afecciones en el lugar de la administración |
|
Disminución de la temperatura corporal, induración, sed. |
|
a El término convulsión incluye: convulsiones tonicoclónicas generalizadas. |
Eventos de especial interés en relación con la clase:
Síntomas Extrapiramidales (SEP): Datos de la fase de doble ciego, controlada con placebo, del ensayo de prevención de recidiva a largo plazo (consulte la sección “Propiedades farmacodinámicas: eficacia clínica”) indicaron que la incidencia de eventos adversos relacionados con los SEP fue mayor en el grupo con INVEGA TRINZA™ (13 sujetos [8,1%]) que en el grupo con placebo (5 sujetos [3,4%]). La evaluación de los SEP incluyó un análisis conjunto de los siguientes grupos de SEP: discinesia, distonía, hipercinesia, parkinsonismo y temblores corporales.
Aumento de peso: En la fase de doble ciego, controlada con placebo, del ensayo de prevención de recidiva a largo plazo se observaron aumentos de peso anómalos de ≥ 7%, desde el inicio hasta el final de la fase de doble ciego, en 15 sujetos (10%) en el grupo con INVEGA TRINZA™ y en 1 sujeto (1%) en el grupo con placebo. Por el contrario, se observaron pérdidas de peso anómalas (≥ 7%), desde el inicio hasta el final de la fase de doble ciego, en 2 sujetos (1%) en el grupo con INVEGA TRINZA™ y en 12 sujetos (8%) en el grupo con placebo. Los cambios medios en el peso corporal, desde el inicio hasta el final de la fase de doble ciego, fueron +0,94 kg y -1,28 kg en los grupos con INVEGA TRINZA™ y placebo, respectivamente.
Pruebas de laboratorio:
Prolactina sérica: Durante la fase de doble ciego, controlada con placebo, del ensayo de prevención de recidiva a largo plazo, se observó un aumento de la prolactina por encima del rango de referencia (> 13,13 ng/ml en hombres y > 26,72 ng/ml en mujeres) en un porcentaje mayor de hombres y mujeres en el grupo con INVEGA TRINZA™ que en el grupo con placebo (9% vs. 3% y 5% vs. 3%, respectivamente). En el grupo con INVEGA TRINZA™, el cambio medio, desde el inicio hasta el final de la fase de doble ciego, fue de +2,90 ng/ml en hombres (vs. -10,26 ng/ml en el grupo con placebo) y de +7,48 ng/ml en mujeres (vs. -32,93 ng/ml en el grupo con placebo). En el grupo con INVEGA TRINZA™, una mujer (2,4%) tuvo una reacción adversa de amenorrea, mientras que, en el grupo con placebo, no se observaron posibles reacciones adversas relacionadas con la prolactina en mujeres. No se observaron reacciones adversas potencialmente relacionadas con la prolactina en hombres en ningún grupo.
CONTRAINDICACIONES: INVEGA TRINZA™ está contraindicado en pacientes con hipersensibilidad conocida a la paliperidona o a cualquier otro componente de la formulación. Dado que la paliperidona es un metabolito activo de la risperidona, INVEGA TRINZA™ está contraindicado en pacientes con hipersensibilidad conocida a la risperidona.
EMBARAZO Y LACTANCIA:
Embarazo: No se ha establecido la seguridad de la inyección intramuscular del palmitato de paliperidona o de la paliperidona oral durante el embarazo en seres humanos. No se han observado efectos teratogénicos en ninguno de los estudios realizados con animales. Se observó un ligero aumento de muertes fetales en animales de laboratorio tratados con una dosis alta de paliperidona oral. Los parámetros del embarazo no se vieron afectados en ratas a las que se les administró el producto inyectable de 1 mes de palmitato de paliperidona por vía intramuscular. Las dosis altas resultaron ser tóxicas para las madres. Las crías no se vieron afectadas con una exposición oral 20 a 22 veces mayor que la dosis máxima de paliperidona oral en seres humanos ni con exposiciones intramusculares 6 veces mayores que la dosis máxima del producto inyectable de 1 mes de palmitato de paliperidona en seres humanos.
Los neonatos expuestos a antipsicóticos (incluida la paliperidona) durante el tercer trimestre de embarazo, corren el riesgo de sufrir síntomas extrapiramidales o de abstinencia de gravedad variable después del parto. Estos síntomas en los neonatos pueden incluir agitación, hipertonía, hipotonía, temblores, somnolencia, dificultad respiratoria y trastornos alimentarios. Como la paliperidona se ha detectado en el plasma hasta 18 meses después de la admnistración de una única dosis de INVEGA TRINZA™, debe tenerse en cuenta la naturaleza de acción prolongada de INVEGA TRINZA™ ya que los neonatos pueden estar en riesgo por la administración de INVEGA TRINZA™ antes del embarazo o también durante el primer y el segundo trimestre.
INVEGA TRINZA™ solo se debe usar durante el embarazo si los beneficios superan a los riesgos. Se desconoce el efecto de INVEGA TRINZA™ en el trabajo de parto y el alumbramiento en el caso de los seres humanos.
Lactancia: En estudios de paliperidona realizados en animales y de risperidona realizados en humanos, se ha observado la excreción de paliperidona en la leche. Por tanto, las mujeres que reciben INVEGA TRINZA™ no deben amamantar a sus hijos. Como la paliperidona se ha detectado en el plasma hasta 18 meses después de la admnistración de una única dosis de INVEGA TRINZA™, debe tenerse en cuenta la naturaleza de acción prolongada de INVEGA TRINZA™ ya que los lactantes pueden estar en riesgo incluso por la administración de INVEGA TRINZA™ mucho antes de la lactancia.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR VEHÍCULOS Y MANEJAR MAQUINARIA: INVEGA TRINZA™ puede interferir con actividades que requieran concentración y puede tener efectos sobre la visión (consulte la sección “Reacciones adversas”). Por lo tanto, se debe aconsejar a los pacientes que no conduzcan ni utilicen maquinaria hasta que se conozca su sensibilidad individual.
REACCIONES ADVERSAS: En esta sección, se presentan las reacciones adversas. Las reacciones adversas son eventos adversos que se consideran razonablemente asociados con el consumo de palmitato de paliperidona, según la evaluación completa de la información disponible sobre eventos adversos. No se puede establecer fidedignamente una relación causal con el palmitato de paliperidona en casos individuales. Además, dado que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas de los ensayos clínicos de otro medicamento y es posible que no reflejen los índices observados en la práctica clínica.
DATOS POSTERIORES A LA COMERCIALIZACIÓN: Además de las reacciones adversas informadas durante los estudios clínicos y las indicadas anteriormente, se han informado las siguientes reacciones adversas durante la experiencia posterior a la comercialización de paliperidona y risperidona (Tablas 7 y 8).
En cada tabla, se detallan las frecuencias conforme a la siguiente convención:
Muy frecuentes ≥ 1/10
Frecuentes ≥ 1/100 y < 1/10
Poco frecuentes ≥ 1/1.000 y < 1/100
Raros ≥ 1/10.000 y < 1/1.000
Muy raros < 1/10.000, incluye informes aislados.
En la Tabla 7, las reacciones adversas se clasifican por categoría de frecuencia a partir de las tasas de comunicación espontánea, mientras que en la Tabla 8, las mismas reacciones adversas se clasifican por categoría de frecuencia a partir de la incidencia en los ensayos clínicos, cuando se conoce.
|
Tabla 7. Reacciones adversas identificadas durante la experiencia posterior a la comercialización de paliperidona y risperidona, clasificadas por categoría de frecuencia estimada a partir de las tasas de comunicación espontánea de paliperidona |
|
|
Trastornos de la sangre y del sistema linfático |
|
|
Muy raros |
Agranulocitosis, trombocitopenia |
|
Trastornos endocrinos |
|
|
No se conocen |
Secreción inadecuada de la hormona antidiurética |
|
Trastornos metabólicos y nutricionales |
|
|
Muy raros |
Diabetes mellitus, cetoacidosis diabética, hipoglucemia |
|
No se conocen |
Intoxicación con agua |
|
Trastornos psiquiátricos |
|
|
Muy raros |
Manía |
|
Trastornos del sistema nervioso |
|
|
Muy raros |
Disgeusia |
|
Trastornos oculares |
|
|
No se conocen |
Síndrome del iris flácido (intraoperatorio) |
|
Trastornos cardíacos |
|
|
Muy raros |
Fibrilación auricular |
|
Trastornos vasculares |
|
|
Muy raros |
Trombosis venosa, embolismo pulmonar |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Muy raros |
Síndrome de apnea del sueño |
|
Trastornos gastrointestinales |
|
|
Muy raros |
Pancreatitis |
|
Muy raros |
Íleo |
|
Trastornos hepatobiliares |
|
|
No se conocen |
Ictericia |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Raros |
Angioedema |
|
Muy raros |
Alopecia |
|
Trastornos renales y urinarios |
|
|
Muy raros |
Retención urinaria |
|
Embarazo, puerperio y enfermedades perinatales |
|
|
Muy raros |
Síndrome de abstinencia neonatal a fármacos |
|
Trastornos del aparato reproductor y mamarios |
|
|
Muy raros |
Priapismo |
|
Trastornos generales y afecciones en el lugar de la administración |
|
|
Muy raros |
Hipotermia, absceso en el lugar de inyección, celulitis en el lugar de inyección, hematoma en el lugar de inyección |
|
No se conocen |
Quiste en el lugar de la inyección, necrosis en el lugar de la inyección, úlcera en el lugar de la inyección |
|
Tabla 8. Reacciones adversas identificadas durante la experiencia posterior a la comercialización de paliperidona y risperidona, clasificadas por categoría de frecuencia estimada a partir de los ensayos clínicos con formulaciones inyectables de paliperidona |
|
|
Trastornos de la sangre y del sistema linfático |
|
|
Poco frecuentes |
Trombocitopenia |
|
No se conocen |
Agranulocitosis |
|
Trastornos endocrinos |
|
|
Raros |
Secreción inadecuada de la hormona antidiurética |
|
Trastornos metabólicos y nutricionales |
|
|
Poco frecuentes |
Diabetes mellitusa |
|
Raros |
Cetoacidosis diabética, hipoglucemia |
|
No se conocen |
Intoxicación con agua |
|
Trastornos psiquiátricos |
|
|
Raros |
Manía |
|
Trastornos del sistema nervioso |
|
|
Poco frecuentes |
Disgeusia |
|
Trastornos oculares |
|
|
No se conocen |
Síndrome del iris flácido (intraoperatorio) |
|
Trastornos cardíacos |
|
|
Raros |
Fibrilación auricular |
|
Trastornos vasculares |
|
|
Raros |
Trombosis venosa |
|
No se conocen |
Embolia pulmonar |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Raros |
Síndrome de apnea del sueño |
|
Trastornos gastrointestinales |
|
|
Raros |
Pancreatitis |
|
No se conocen |
Íleo |
|
Trastornos hepatobiliares |
|
|
No se conocen |
Ictericia |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Poco frecuentes |
Alopecia |
|
No se conocen |
Angioedema |
|
Trastornos renales y urinarios |
|
|
Raros |
Retención urinaria |
|
Embarazo, puerperio y enfermedades perinatales |
|
|
No se conocen |
Síndrome de abstinencia neonatal a fármacos |
|
Trastornos del aparato reproductor y mamarios |
|
|
No se conocen |
Priapismo |
|
Trastornos generales y afecciones en el lugar de la administración |
|
|
Raros |
Hipotermia, absceso en el lugar de inyección, celulitis en el lugar de inyección, quiste en el lugar de inyección, hematoma en el lugar de inyección |
|
No se conocen |
Necrosis en el lugar de inyección, úlcera en el lugar de inyección |
|
a En ensayos controlados con placebo del producto inyectable de 1 mes de palmitato de paliperidona, se observó diabetes mellitus en 0,32% de los sujetos tratados con la inyección de 1 mes, en comparación con una tasa de 0,39% en el grupo con placebo. Durante la fase de doble ciego, controlada con placebo, del ensayo de prevención de recidiva a largo plazo con INVEGA TRINZA™, se observó diabetes mellitus en 0,6% de los sujetos tratados con INVEGA TRINZA™, en comparación con un 0% en el grupo con placebo. La incidencia total de todos los ensayos clínicos fue de 0,63% en todos los sujetos tratados con formulaciones inyectables de paliperidona. |
|
En muy raras ocasiones, se han informado casos de reacción anafiláctica tras la administración del producto inyectable de 1 mes de palmitato de paliperidona durante el período posterior a la comercialización en pacientes que, con anterioridad, han manifestado tolerancia a la risperidona oral o la paliperidona oral.
INTERACCIONES: Se recomienda precaución al prescribir INVEGA TRINZA™ junto con fármacos que prolonguen el intervalo QT.
Como el palmitato de paliperidona se hidroliza a paliperidona (consulte la sección “Propiedades farmacocinéticas”), deben tenerse en cuenta los resultados de los estudios con paliperidona oral al momento de evaluar las interacciones medicamentosas posibles.
Capacidad de INVEGA TRINZA™ para afectar a otros fármacos: No se prevé que la paliperidona cause interacciones farmacocinéticas de relevancia clínica con fármacos que se metabolicen mediante isoenzimas del citocromo P-450. En estudios in vitro realizados en microsomas hepáticos humanos se ha observado que la paliperidona no inhibe sustancialmente el metabolismo de los fármacos metabolizados por las isoenzimas del citocromo P450, incluidas CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5. Por tanto, no se espera que la paliperidona inhiba el aclaramiento de fármacos metabolizados por estas vías metabólicas de forma clínicamente relevante. Tampoco se espera que la paliperidona tenga propiedades de inducción enzimática.
La paliperidona es un inhibidor débil de la glicoproteína P (P-gp) en concentraciones elevadas. No existen datos in vivo y se desconoce la relevancia clínica.
Dado que los principales efectos de la paliperidona se producen en el SNC (consulte la sección “Reacciones adversas”), INVEGA TRINZA™ se debe utilizar con precaución si se combina con otros fármacos que actúen sobre el SNC o con alcohol. La paliperidona puede antagonizar el efecto de la levodopa y de otros agonistas dopaminérgicos.
Dada su capacidad para inducir la hipotensión ortostática (consulte la sección “Advertencias y precauciones: hipotensión ortostática”), se puede observar un efecto aditivo al administrar INVEGA TRINZA™ con otros agentes terapéuticos que tengan la misma capacidad.
La administración concomitante de comprimidos orales de paliperidona de liberación prolongada en estado estacionario (12 mg una vez al día) con comprimidos de divalproex sódico de liberación prolongada (500 a 2.000 mg una vez al día) no afecta a la farmacocinética del valproato en estado estacionario.
Es poco probable que haya una interacción farmacocinética entre INVEGA TRINZA™ y el litio.
Capacidad de otros fármacos para afectar a INVEGA TRINZA™: La paliperidona no es un sustrato de CYP1A2, CYP2A6, CYP2C9, CYP2C19 ni CYP3A5. Esto sugiere que es poco probable que haya una interacción con inhibidores o inductores de estas isoenzimas. Mientras que los estudios in vitro indican que CYP2D6 y CYP3A4 podrían tener una participación mínima en el metabolismo de la paliperidona, no hay indicios, in vitro o in vivo, de que estas isoenzimas desempeñen un papel importante en el metabolismo de la paliperidona. En los estudios in vitro se ha observado que la paliperidona es un sustrato de la P-gp.
La CYP2D6 metaboliza a la paliperidona de forma limitada (consulte la sección “Propiedades farmacocinéticas: Metabolismo y excreción”). En un estudio sobre las interacciones en sujetos sanos, en el que se administró paliperidona oral conjuntamente con paroxetina, un potente inhibidor de la CYP2D6, no se observaron efectos clínicamente relevantes sobre la farmacocinética de la paliperidona.
La administración concomitante de paliperidona oral de liberación prolongada una vez al día con 200 mg de carbamazepina dos veces al día produjo una reducción de aproximadamente un 37% en el estado de equilibrio medio de la Cmáx. y del AUC de la paliperidona. Esta reducción se debe, en gran parte, a un aumento del 35% en el aclaramiento renal de la paliperidona, probablemente como resultado de la inducción de la P-gp renal por parte de la carbamazepina. Una reducción insignificante en la cantidad de fármaco excretado inalterado en orina sugiere que el efecto sobre el metabolismo de CYP o la biodisponibilidad de la paliperidona durante la administración concomitante con carbamazepina es poco relevante. Al iniciar el tratamiento con carbamazepina, se debe reevaluar la dosis de INVEGA TRINZA™ y aumentarla si fuera necesario. Por el contrario, al interrumpir el tratamiento con carbamazepina, se debe reevaluar la dosis de INVEGA TRINZA™ y disminuirla si fuera necesario. Debe tenerse en cuenta la naturaleza de acción prolongada de INVEGA TRINZA™.
La paliperidona, un catión a pH fisiológico, se excreta principalmente inalterada por los riñones, aproximadamente la mitad por filtración y la otra mitad por secreción activa. La administración concomitante de trimetoprima, un conocido inhibidor del transporte activo renal de fármacos catiónicos, no influye en la farmacocinética de la paliperidona.
La administración concomitante de una única dosis de un comprimido de 12 mg de paliperidona oral de liberación prolongada con comprimidos de divalproex sódico de liberación prolongada (dos comprimidos de 500 mg una vez al día) resultó en un incremento de aproximadamente un 50% en la Cmáx. y el AUC de la paliperidona, probablemente como resutlado de un aumento de la absorción oral. Dado que no se observan efectos significativos sobre el aclaramiento sistémico, no se espera una interacción clínicamente significativa entre los comprimidos de divalproex sódico de liberación prolongada y la inyección intramuscular de INVEGA TRINZA™. Esta interacción con INVEGA TRINZA™ no se ha estudiado.
La interacción farmacocinética entre INVEGA TRINZA™ y el litio es poco probable.
Uso concomitante de INVEGA TRINZA™ con risperidona o con paliperidona oral: Como la paliperidona es el metabolito activo de la risperidona, se debe tener precaución cuando se administra INVEGA TRINZA™ de manera concomitante con risperidona o paliperidona oral durante períodos de tiempo prolongados. Los datos de seguridad que evalúan el uso concomitante de INVEGA TRINZA™ con otros antipsicóticos son limitados.
ADVERTENCIAS Y PRECAUCIONES:
Síndrome neuroléptico maligno: Se ha comunicado la aparición de Síndrome Neuroléptico Maligno (SNM), caracterizado por hipertermia, rigidez muscular, inestabilidad autónoma, alteración de la conciencia y aumento de los niveles séricos de creatina fosfoquinasa, con la administración de fármacos antipsicóticos, incluida la paliperidona. Otros posibles signos clínicos incluyen la mioglobinuria (rabdomiólisis) y la insuficiencia renal aguda. Si el paciente desarrolla signos o síntomas que sugieran SMN, se deberán suspender todos los antipsicóticos, incluido INVEGA TRINZA™. Debe tenerse en cuenta la naturaleza de acción prolongada de INVEGA TRINZA™.
Discinesia tardía: Los fármacos con propiedades antagonistas de los receptores dopaminérgicos han sido relacionados con la inducción de discinesia tardía, caracterizada por movimientos rítmicos involuntarios, sobre todo de la lengua y/o la cara. Si aparecen signos y síntomas de discinesia tardía, debe considerarse la posibilidad de suspender todos los antipsicóticos, incluido INVEGA TRINZA™. Debe tenerse en cuenta la naturaleza de acción prolongada de INVEGA TRINZA™.
Intervalo QT: Al igual que con otros antipsicóticos, se debe actuar con precaución al prescribir INVEGA TRINZA™ a pacientes con antecedentes de arritmias cardíacas, con síndrome de QT largo congénito y al utilizar fármacos que prolongan el intervalo QT de forma concomitante (consulte la sección “Propiedades farmacodinámicas”: efecto en el intervalo QT/QTc y electrofisiología cardíaca).
Reacciones de hipersensibilidad: En raras ocasiones, se han informado casos de reacciones anafilácticas en pacientes que con anterioridad han manifestado tolerancia a la risperidona o a la paliperidona oral durante la experiencia posterior a la comercialización con el producto inyectable de 1 mes de palmitato de paliperidona (consulte las secciones “Posología y forma de administración” y “Reacciones adversas”).
Si ocurre una reacción de hipersensibilidad, suspenda el uso de INVEGA TRINZA™, inicie medidas de apoyo generales, como sea clínicamente adecuado, y controle al paciente hasta que los signos y síntomas se resuelvan. (Consulte las secciones “Contraindicaciones” y “Reacciones adversas”)
Hiperglucemia y diabetes mellitus: Se han informado casos de hiperglucemia, de diabetes mellitus y de empeoramiento de una diabetes preexistente durante el tratamiento con antipsicóticos. Evaluar la relación entre el uso de antipsicóticos atípicos y las anomalías en la glucosa es complicado, debido a la posibilidad de que los pacientes con esquizofrenia tengan un mayor riesgo intrínseco de sufrir diabetes mellitus y a la creciente incidencia de la diabetes mellitus en la población general. Dados estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia aún no se comprende totalmente. Se debe controlar a todo paciente tratado con antipsicóticos atípicos, incluido INVEGA TRINZA™, en busca de síntomas de hiperglucemia y diabetes mellitus. (Consulte también la sección “Reacciones adversas”).
Aumento de peso: Se ha observado aumento de peso con el uso de fármacos antipsicóticos. Se recomienda el control clínico del peso corporal.
Hipotensión ortostática: La paliperidona puede inducir una hipotensión ortostática en algunos pacientes por su efecto bloqueante alfa-adrenérgico. INVEGA TRINZA™ debe utilizarse con precaución en pacientes con enfermedades cardiovasculares conocidas (por ejemplo, insuficiencia cardíaca, infarto de miocardio o isquemia y anomalías de la conducción), enfermedad cerebrovascular o afecciones que predisponen al paciente a la hipotensión (por ejemplo, deshidratación, hipovolemia y tratamiento con antihipertensivos).
Convulsiones: Al igual que con otros antipsicóticos, INVEGA TRINZA™ debe administrase con precaución en pacientes con antecedentes de convulsiones u otras afecciones que puedan disminuir potencialmente el umbral convulsivo.
Pacientes ancianos con demencia: INVEGA TRINZA™ no se ha estudiado en pacientes ancianos con demencia.
Mortalidad global: En un meta-análisis de 17 ensayos clínicos controlados, la incidencia de mortalidad aumentó en pacientes ancianos con demencia tratados con otros atipsicóticos atípicos, incluida la risperidona, la aripiprazola, la olanzapina y la quetiapina, en comparación con el placebo. Entre los pacientes tratados con risperidona la mortalidad fue de 4% en comparación con un 3,1% en pacientes con placebo.
Eventos adversos cerebrovasculares: En ensayos controlados con placebo, en pacientes ancianos con demencia tratados con antipsicóticos atípicos, como la risperidona, el aripiprazol y la olanzapina, se registró una incidencia mayor de eventos adversos cerebrovasculares (accidentes cerebrovasculares y accidentes isquémicos transitorios), incluida la muerte, que en el grupo tratado con placebo.
Leucopenia, neutropenia y agranulocitosis: Se han registrado episodios de leucopenia, neutropenia y agranulocitosis con agentes antipsicóticos, incluida la paliperidona. Los casos de agranulocitosis se han comunicado muy raramente (< 1/10.000 pacientes) durante la vigilancia posterior a la comercialización.
Se debe controlar a los pacientes con antecedentes de recuento leucocitario significativamente bajo, o de leucopenia/neutropenia inducida por fármacos, durante los primeros meses del tratamiento, y considerar la interrupción de INVEGA TRINZA™ ante el primer signo de una reducción clínicamente significativa en el recuento leucocitario, en ausencia de otros factores causantes.
En pacientes con neutropenia clínicamente significativa se deben controlar cuidadosamente la fiebre y otros síntomas de infección, y tratarlos con prontitud, si se presentaran. Se debe suspender el uso de INVEGA TRINZA™ en pacientes con neutropenia grave (recuento absoluto de neutrófilos < 1 x 109/l) y controlar el recuento leucocitario hasta la recuperación.
Debe tenerse en cuenta la naturaleza de acción prolongada de INVEGA TRINZA™.
Tromboembolismo venoso: Se han comunicado casos de Tromboembolismo Venoso (TEV) con el uso de fármacos antipsicóticos. Dado que los pacientes tratados con antipsicóticos a menudo presentan factores de riesgo de TEV adquiridos, se deben identificar todos los posibles factores de riesgo de TEV, antes y durante el tratamiento con INVEGA TRINZA™, así como tomar medidas preventivas.
Enfermedad de Parkinson y demencia con cuerpos de Lewy: El médico deberá sopesar los riesgos y los beneficios de prescribir antipsicóticos, incluido INVEGA TRINZA™, a pacientes con enfermedad de Parkinson o demencia con cuerpos de Lewy (DCL), ya que ambos grupos presentan mayor riesgo de padecer síndrome neuroléptico maligno y mayor sensibilidad a los antipsicóticos. Las manifestaciones de esta mayor sensibilidad incluyen desorientación, obnubilación e inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
Priapismo: Se ha comunicado que los fármacos con efecto bloqueante alfa-adrenérgico inducen el priapismo. Se han notificado casos de priapismo con paliperidona durante la vigilancia posterior a la comercialización (consulte la sección “Reacciones adversas”).
Regulación de la temperatura corporal: La interrupción de la capacidad corporal para reducir la temperatura central se ha atribuido a los agentes antipsicóticos. Se deben tomar las precauciones adecuadas cuando se prescriba INVEGA TRINZA™ a pacientes que vayan a estar sometidos a condiciones que puedan contribuir a una elevación de la temperatura corporal central, como ejercicio extenuante, exposición a calor extremo y toma de medicación concomitante con acción anticolinérgica, o que estén sujetos a deshidratación.
Efecto antiemético: Se ha observado un efecto antiemético en los estudios preclínicos con paliperidona. Este efecto, si se produce en seres humanos, puede enmascarar los signos y síntomas de sobredosis de algunos fármacos o de condiciones tales como la obstrucción intestinal, el síndrome de Reye y los tumores cerebrales.
ADMINISTRACIÓN: Se debe evitar inyectar inadvertidamente INVEGA TRINZA™ en un vaso sanguíneo.
Síndrome del iris flácido intraoperatorio: El síndrome del Iris Flácido Intraoperatorio (IFIS) se ha observado durante la cirugía de cataratas en pacientes tratados con medicamentos de efecto antagonista sobre los adrenérgicos-alfa 1a, como INVEGA TRINZA™ (consulte la sección “Reacciones adversas”).
El IFIS puede incrementar el riesgo de complicaciones oculares quirúrgicas y posquirúrgicas. Debe advertirse al cirujano oftalmólogo del consumo actual o pasado de medicamentos con efecto antagonista sobre los adrenérgicos-alfa 1a antes de la cirugía. No se ha establecido el beneficio potencial derivado de interrumpir la terapia de bloqueadores de alfa 1a y deberá compararse con el riesgo que implica la interrupción de la terapia antipsicótica.
INSTRUCCIONES DE USO, MANIPULACIÓN Y ELIMINACIÓN: INVEGA TRINZA™ palmitato de paliperidona de liberación prolongada suspensión inyectable.
|
|
Administrar una vez cada 3 meses. |
|
|
Agite vigorosamente la jeringa durante al menos 15 segundos. |
Solo para inyección intramuscular.
No administre por ninguna otra vía.
IMPORTANTE: El profesional de la salud debe administrar INVEGA TRINZA™ en una única inyección. No divida la dosis en varias inyecciones. INVEGA TRINZA™ es exclusivamente para uso intramuscular. Inyecte lentamente y en profundidad en el músculo, con cuidado de no inyectar en un vaso sanguíneo.
Lea las instrucciones completas antes de utilizar.
POSOLOGÍA: Este medicamento debe administrarse una vez cada 3 meses.
Preparación: Despegue la etiqueta de la jeringa y colóquela en la historia clínica del paciente. INVEGA TRINZA™ requiere una agitación más vigorosa y prolongada que el producto inyectable de 1 mes de palmitato de paliperidona. Agite la jeringa vigorosamente, con la punta de la jeringa hacia arriba, durante al menos 15 segundos dentro de los 5 minutos antes de la administración (consulte el Paso 2).
Selección de agujas de seguridad de pared delgada: Las agujas de seguridad de pared delgada están diseñadas para utilizarse con INVEGA TRINZA™. Por lo tanto, es importante que solo utilice las agujas proporcionadas en el envase de INVEGA TRINZA™.
Contenidos del envase de dosis:
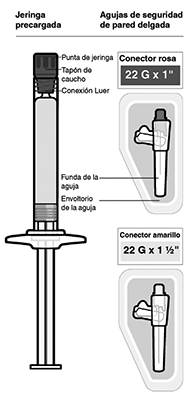
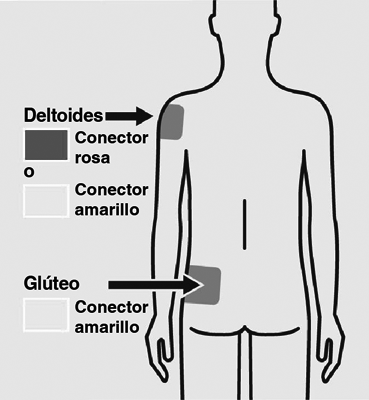
1 Seleccione la aguja: La selección de la aguja se determina por el área de inyección y el peso del paciente.
Si administra una inyección en el deltoides:
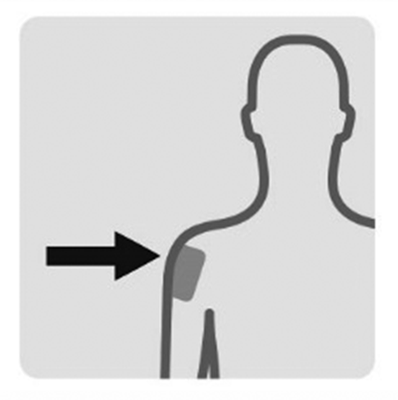
Si el paciente pesa: Menos de 90 kg, conector rosa 22G × 1” - 90 kg.
Si administra una inyección en el glúteo:
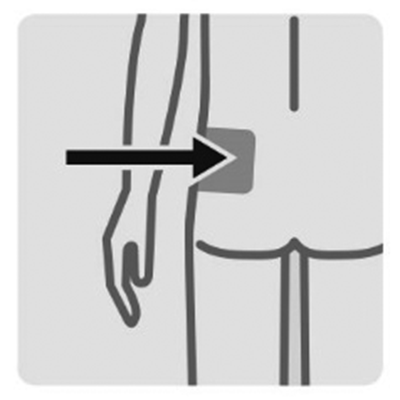
Independientemente del peso del paciente: Conector amarillo 22G × 1½”.
ADVERTENCIA: Deseche inmediatamente la aguja sin utilizar en un recipiente adecuado para objetos punzantes. No guarde para usos futuros.
2 Prepárese para la inyección:
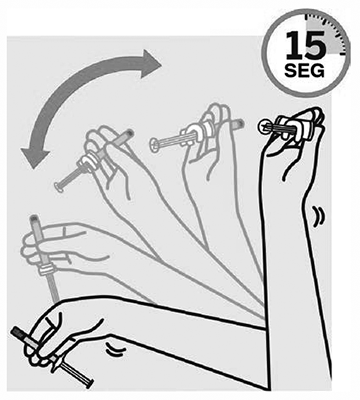
AGITE VIGOROSAMENTE durante al menos 15 segundos.
Con la punta de la jeringa hacia arriba, AGITE VIGOROSAMENTE con la muñeca floja durante al menos 15 segundos para asegurar una suspensión homogénea.
NOTA: Este medicamento requiere una agitación más vigorosa y prolongada que el producto inyectable de 1 mes de palmitato de paliperidona.
IMPORTANTE: Proceda al paso siguiente inmediatamente después de agitar. Si pasan más de 5 minutos antes de la inyección, agite vigorosamente, con la punta de la jeringa hacia arriba, nuevamente durante al menos 15 segundos para volver a suspender el medicamento.
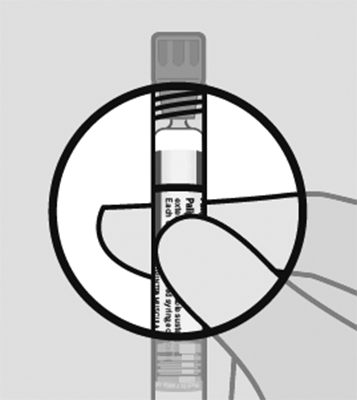
Controle la suspensión: Después de agitar la jeringa durante 15 segundos, controle el líquido en la ventana de visualización. La suspensión debe verse uniforme y de un color blanco lechoso.
También es normal ver pequeñas burbujas de aire.
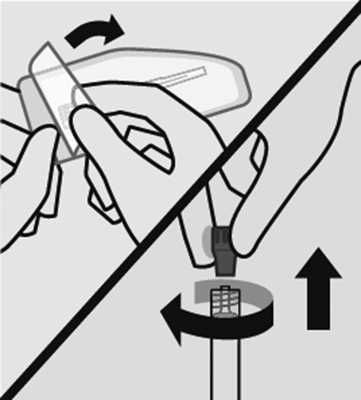
Abra el envoltorio de la aguja y quite el tapón: Primero, abra el envoltorio de la aguja al despegar la parte trasera de la cobertura hasta la mitad. Colóquela sobre una superficie limpia.
Luego, mientras sujeta la jeringa en posición vertical, gire y tire del tapón de goma para quitarlo.
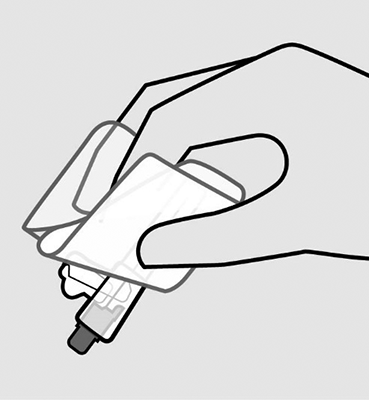
Sujete el envoltorio de la aguja: Doble la cobertura de la aguja y la lámina plástica. Luego, sujete firmemente la funda de la aguja a través del envoltorio, como se muestra en la imagen.
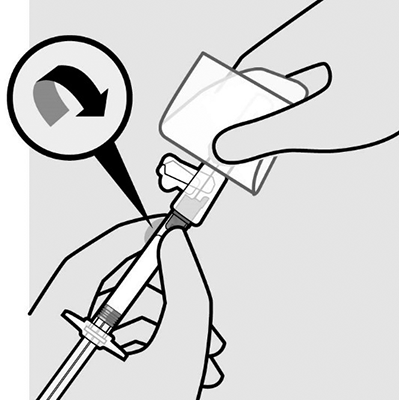
Acople la aguja: Con la otra mano, sostenga la jeringa por la conexión Luer y acóplela a la aguja de seguridad girándola suavemente en el sentido de las agujas del reloj.
No quite el envoltorio hasta que la jeringa y la aguja estén bien acopladas.
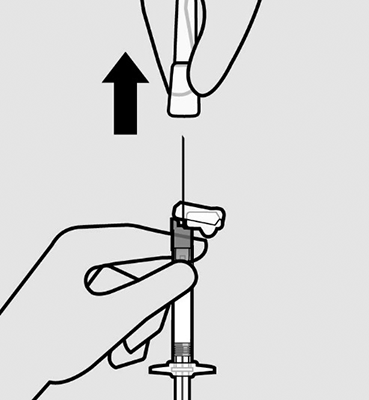
Quite la funda de la aguja: Quite la funda de la aguja con un movimiento recto.
No gire la funda, ya que esto puede aflojar la aguja de la jeringa.
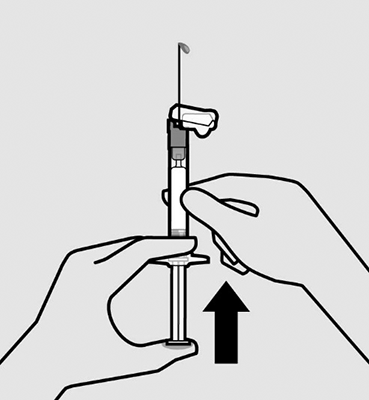
Elimine las burbujas de aire: Sostenga la jeringa en posición vertical y golpéela suavemente para que las burbujas de aire se desplacen hacia la parte superior.
Para quitar el aire, presione el émbolo hacia arriba con cuidado hasta que una gota de líquido salga de la punta de la aguja.
3 Inyecte:
Inyecte la dosis: Inyecte lentamente y en profundidad el contenido completo de la jeringa por vía intramuscular en el músculo deltoides o glúteo.
No administre por ninguna otra vía.
4 Después de la inyección:
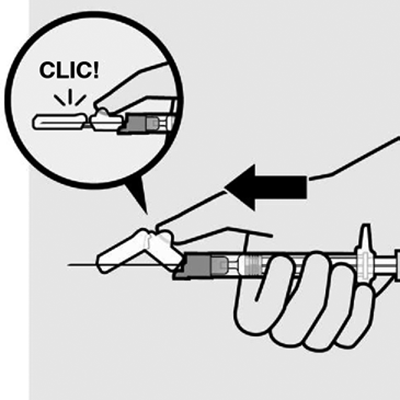
Asegure la aguja: Después de completar la inyección, use su pulgar o una superficie plana para asegurar la aguja en el dispositivo de seguridad.
La aguja estará segura cuando escuche un “clic”.

Deseche en forma adecuada: Deseche la jeringa y la aguja sin utilizar en un recipiente adecuado para objetos punzantes.
ADVERTENCIA: Las agujas de seguridad de pared delgada están específicamente diseñadas para utilizarse con INVEGA TRINZA™. La aguja sin utilizar debe desecharse y no guardarse para usos futuros.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN: INVEGA TRINZA™ debe utilizarse solo luego de que se haya establecido el producto inyectable de 1 mes de palmitato de paliperidona como un tratamiento adecuado durante al menos cuatro meses. Para establecer una dosis de mantenimiento consistente, se recomienda que las últimas dos dosis de la inyección de 1 mes tengan la misma concentración antes de iniciar la administración de INVEGA TRINZA™.
Posología: Iniciar la administración de INVEGA TRINZA™ en el momento en que se debe programar la siguiente dosis de 1 mes de palmitato de paliperidona con una dosis de INVEGA TRINZA™ basada en la dosis anterior de la inyección de 1 mes como se muestra en la Tabla 1. INVEGA TRINZA™ puede administrarse hasta 7 días antes o después del plazo mensual de la siguiente dosis programada de 1 mes de palmitato de paliperidona.
|
Tabla 1. Conversión de la última dosis del producto inyectable de 1 mes de palmitato de paliperidona a la dosis del producto inyectable de 3 meses de palmitato de paliperidona (INVEGA TRINZA™) con 3,5 como multiplicador |
|
|
Si la última dosis de la inyección de 1 mes de palmitato de paliperidona es: |
Iniciar la administración de INVEGA TRINZA™ en la siguiente dosis: |
|
50 mg |
175 mg |
|
75 mg |
263 mg |
|
100 mg |
350 mg |
|
150 mg |
525 mg |
|
La conversión del producto inyectable de 1 mes de palmitato de paliperidona con dosis de 25 mg no se estudió. |
|
Luego de la dosis inicial de INVEGA TRINZA™, INVEGA TRINZA™ debe administrarse cada 3 meses. De ser necesario, se puede ajustar la dosis cada 3 meses en incrementos dentro del rango de 175 mg a 525 mg según la eficacia y la tolerabilidad individual de los pacientes. Debido a la naturaleza de acción prolongada de INVEGA TRINZA™, la respuesta de los pacientes a una dosis ajustada puede no ser evidente durante varios meses (consulte la sección “Propiedades farmacocinéticas”).
Dosis omitida(s):
Ventana de dosificación: Debe evitarse omitir dosis de INVEGA TRINZA™. Sin embargo, en casos excepcionales, se puede administrar la inyección hasta 2 semanas antes o después del plazo de 3 meses.
Dosis omitida > 3½ meses hasta 4 meses: Si han transcurrido más de 3½ meses (hasta 4 meses) desde la última inyección de INVEGA TRINZA™, se deberá administrar la dosis anterior de INVEGA TRINZA™ lo antes posible y continuar con las inyecciones de 3 meses después de esta dosis.
Dosis omitida > 4 meses hasta 9 meses: Si han transcurrido más de 4 meses (hasta 9 meses) desde la última inyección de INVEGA TRINZA™, NO se deberá administrar la siguiente dosis de INVEGA TRINZA™. Por el contrario, utilice el régimen para reiniciar el tratamiento que se muestra en la Tabla 2.
|
Tabla 2. Régimen para reiniciar el tratamiento después de omitir dosis de INVEGA TRINZA™ durante > 4 meses hasta 9 meses |
|||
|
Última dosis del producto inyectable de 3 meses de INVEGA TRINZA™ |
Administre el producto inyectable de 1 mes de palmitato de paliperidona, dos dosis con una semana entre ellas (en el músculo deltoides) |
Luego administre una dosis del producto inyectable de 3 eses de INVEGA TRINZA™ (en el músculo deltoidesa o en el músculo glúteo) |
|
|
Día 1 |
Día 8 |
1 mes después del Día 8 |
|
|
175 mg |
50 mg |
50 mg |
175 mg |
|
263 mg |
75 mg |
75 mg |
263 mg |
|
350 mg |
100 mg |
100 mg |
350 mg |
|
525 mg |
100 mg |
100 mg |
525 mg |
|
a Consulte las Instrucciones de administración para seleccionar agujas para la inyección en el deltoides según el peso corporal. |
|||
Dosis omitida > 9 meses: Si han transcurrido más de 9 meses desde la última inyección de INVEGA TRINZA™, reinicie el tratamiento con el producto inyectable de 1 mes de palmitato de paliperidona como se describe en la información del prospecto de ese producto. Puede reanudarse el tratamiento con INVEGA TRINZA™ luego de que el paciente haya sido tratado adecuadamente con el producto inyectable de 1 mes de palmitato de paliperidona durante al menos 4 meses.
SOBREDOSIS: Dado que INVEGA TRINZA™ debe administrarse por profesionales de la salud, el riesgo de sobredosis es bajo.
Síntomas y signos: En general, los signos y síntomas esperados son los debidos a una exageración de los efectos farmacológicos conocidos de la paliperidona, es decir, somnolencia y sedación, taquicardia e hipotensión, prolongación del QT y síntomas extrapiramidales. Se ha comunicado la ocurrencia de Torsade de pointes y fibrilación ventricular en relación con la sobredosis de paliperidona oral. En caso de sobredosis aguda, se contemplará la posibilidad de que el paciente haya tomado varios fármacos.
Tratamiento: Se debe tener en cuenta la liberación prolongada de INVEGA TRINZA™ y la larga semivida aparente de la paliperidona al evaluar las necesidades de tratamiento y la recuperación.
No existe ningún antídoto específico contra la paliperidona. Se deberán adoptar medidas de apoyo generales. Establecer y mantener una vía respiratoria despejada y asegurar una adecuada oxigenación y ventilación. Se establecerá de inmediato una monitorización cardiovascular con registro electrocardiográfico continuo, para detectar posibles arritmias. La hipotensión y el colapso circulatorio se tratarán con las medidas adecuadas, tales como la administración intravenosa de líquidos y/o agentes simpaticomiméticos. Si aparecen síntomas extrapiramidales graves, se administrarán agentes anticolinérgicos. Se controlará y vigilará estrechamente al paciente hasta que se recupere.
DATOS NO CLÍNICOS:
Toxicología: Al igual que ocurre con otros fármacos antagonistas de los receptores dopaminérgicos D2, el palmitato de paliperidona inyectado por vía intramuscular y la paliperidona oral aumentaron los niveles de prolactina sérica en estudios de toxicidad con dosis repetidas.
En un estudio de toxicidad juvenil de 7 semanas de duración, realizado en ratas, con dosis orales de paliperidona de 0,16, 0,63 y 2,5 mg/kg/día, que corresponden a 0,12, 0,5 y 1,8 veces la dosis oral máxima recomendada en humanos de 12 mg/día para adolescentes, calculadas según los mg/m2, no se observaron efectos sobre el crecimiento, la madurez sexual y la función reproductiva. Dosis orales de hasta 2,5 mg/kg/día no afectaron al desarrollo neuroconductual en machos y hembras, salvo por un efecto sobre el aprendizaje y la memoria en las ratas hembra tratadas con 2,5 mg/kg/día. Este efecto no se observó tras suspender el tratamiento.
En un estudio de 40 semanas, realizado con perros jóvenes, tratados con risperidona oral (que se convierte en su mayor parte en paliperidona) a dosis de 0,31, 1,25 y 5 mg/kg/día, no se observaron efectos adversos sobre la madurez sexual con las dosis de 0,31 y 1,25 mg/kg/día. El crecimiento de los huesos largos no se vio afectado con la dosis de 0,31 mg/kg/día; sí se observaron efectos con las dosis de 1,25 y 5 mg/kg/día.
Carcinogenicidad: Se evaluó el potencial carcinogénico del palmitato de paliperidona inyectado por vía intramuscular en ratas. Se observó un aumento estadísticamente significativo de adenocarcinomas de la glándula mamaria en ratas hembra con dosis de 10, 30 y 60 mg/kg/mes, que equivale a 0,2, 0,6 y 1,1 veces la dosis máxima recomendada en humanos de 525 mg de INVEGA TRINZA™ con base en mg/m2 de superficie corporal En ratas macho se observó un aumento estadísticamente significativo de adenomas y carcinomas de la glándula mamaria con 30 y 60 mg/kg/mes, que equivale a 1,3 y 2,5 veces la dosis máxima recomendada en humanos de 525 mg de INVEGA TRINZA™ con base en mg/m2.
El potencial carcinogénico de la paliperidona oral, que es un metabolito activo de la risperidona, se evaluó sobre la base de estudios realizados en ratones y ratas con risperidona. Se administró risperidona en dosis de hasta 10 mg/kg/día, durante 18 meses a los ratones y durante 25 meses a las ratas. Se observaron aumentos estadísticamente significativos de adenomas de la glándula pituitaria, adenomas endocrinos del páncreas y adenocarcinomas de la glándula mamaria. Se han observado aumentos de los tumores mamarios, pituitarios y endocrinos del páncreas en roedores tras la administración crónica de otros antipsicóticos, y se considera que se deben al antagonismo dopaminérgico D2 prolongado. Se desconoce la relevancia de estos datos tumorales en roedores, en cuanto al riesgo para los humanos.
Mutagenicidad: No se han detectado indicios de capacidad mutagénica de la paliperidona en la prueba Ames de mutación inversa, en el ensayo de linfomas en ratones, ni en la prueba de micronúcleos en ratas. No se ha observado capacidad genotóxica con el palmitato de paliperidona en la prueba de mutación inversa Ames ni en el ensayo sobre linfomas en ratones.
Fertilidad: A pesar de que el tratamiento con paliperidona oral provocó efectos mediados por la prolactina y el SNC, la fertilidad de las ratas macho y hembra no se vio afectada. Con una dosis tóxica para la madre, las ratas hembra tuvieron un número ligeramente inferior de embriones vivos.
CONDICIONES DE ALMACENAMIENTO: Consulte las condiciones de almacenamiento que se encuentran en el envase externo.
Mantenga fuera del alcance y la vista de los niños.
NATURALEZA Y CONTENIDO DEL ENVASE: El envase contiene una jeringa (copolímero de olefina cíclica) precargada con una suspensión de 175 mg (0,875 ml), 263 mg (1,315 ml), 350 mg (1,75 ml) o 525 mg (2,625 ml) de paliperidona (en forma de 273 mg, 410 mg, 546 mg o 819 mg de palmitato de paliperidona), con un retén para el émbolo y un tapón para la punta de la aguja (goma bromobutílica), un tope trasero y 2 tipos de agujas disponibles comercialmente: una aguja de seguridad de pared delgada calibre 22 de 1½ pulgadas y una aguja de seguridad de pared delgada calibre 22 de 1 pulgada. (Reg. San. INVIMA 2018M-0018005).
JANSSEN-CILAG, S. A.
Av. Calle 26 No. 69-76 - Edificio Elemento
Torre 2, Piso 11 - PBX: +57 1 927 1200 - Bogotá, D. C.