
INSPRA
EPLERENONA
Tabletas con película de recubrimiento
Caja , 30 Tabletas con película de recubrimiento , 25 Miligramos
Caja , 30 Tabletas con película de recubrimiento , 50 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Ingrediente activo: Eplerenona.
TABLETAS para administración oral que contienen 25 mg o 50 mg de eplerenona.
INDICACIONES TERAPÉUTICAS
Hipertensión: La eplerenona está indicada para el tratamiento de la hipertensión. En estos pacientes, la eplerenona se puede usar sola o en combinación con otros agentes antihipertensivos.
Insuficiencia cardiaca- Post MI: La eplerenona está indicada, además de la terapia estándar, para reducir el riesgo de mortalidad y morbilidad cardiovascular en pacientes estables con disfunción ventricular izquierda (LVEF =40%) y evidencia clínica de insuficiencia cardiaca después de un infarto al miocardio reciente.
Insuficiencia cardiaca NYHA Clase II (crónica): La eplerenona está indicada, además de la terapia óptima estándar, para reducir el riesgo de mortalidad y morbilidad cardiovascular en pacientes adultos con insuficiencia cardiaca NYHA Clase II (crónica) y disfunción sistólica ventricular izquierda (LVEF =35%). (Ver la sección Propiedades farmacodinámicas).
PROPIEDADES FARMACOCINÉTICAS
Absorción y distribución: La biodisponibilidad absoluta de eplerenona es del 69% después de la administración de una tableta de 100 mg por vía oral. Las concentraciones plasmáticas máximas se alcanzan después de aproximadamente 2 horas. Los niveles plasmáticos máximos (Cmáx) y el área bajo la curva (AUC) son proporcionales a la dosis para dosis de 10 a 100 mg y menos proporcional para dosis superiores a 100 mg. El estado estable se alcanza en 2 días. La absorción no se ve afectada por los alimentos.
La unión de la eplerenona a proteínas plasmáticas es de aproximadamente el 50% y se une principalmente a alfa-1-ácido glicoproteínas. El volumen aparente de distribución en estado estable se estima en 50 (± 7) L. La eplerenona no se une preferencialmente a los glóbulos rojos.
Metabolismo y excreción: Metabolismo de eplerenona está mediado principalmente a través del CYP3A4. No se han identificado metabolitos activos de la eplerenona en el plasma humano.
Menos del 5% de una dosis de eplerenona se recupera como fármaco sin alteraciones en la orina y en las heces. Después de una dosis oral única radiomarcada del fármaco, aproximadamente el 32% de la dosis se excreta en las heces y aproximadamente el 67% se excreta en la orina. La vida media de eliminación de la eplerenona es de aproximadamente 3 a 5 horas. La depuración plasmática aparente es de aproximadamente 10 L/hr.
Poblaciones especiales
Edad, sexo y raza: Se ha investigado la farmacocinética de la eplerenona a una dosis de 100 mg una vez al día en sujetos de edad avanzada (= 65 años), en hombres y mujeres, y en sujetos de raza negra. La farmacocinética de la eplerenona no fue significativamente diferente entre hombres y mujeres. En el estado estable, los sujetos de edad avanzada tuvieron incrementos en el Cmáx (22%) y en el AUC (45%) en comparación con sujetos más jóvenes (18 a 45 años). En el estado estable, el Cmáx fue 19% menor y el AUC fue 26% menor en sujetos de raza negra. (Vea la sección Posología y método de administración).
Insuficiencia renal: La farmacocinética de eplerenona se evaluó en pacientes con distintos grados de insuficiencia renal y en pacientes sometidos a hemodiálisis. En comparación con los sujetos control, el estado estable del AUC y del Cmáx aumentó en un 38% y 24%, respectivamente, en los pacientes con insuficiencia renal grave, y se redujeron en un 26% y 3%, respectivamente, en los pacientes sometidos a hemodiálisis. No se observó correlación entre la depuración plasmática de la eplerenona y la depuración de creatinina. La eplerenona no se elimina por hemodiálisis (ver sección Sobredosis).
Insuficiencia hepática: La farmacocinética de la eplerenona de 400 mg se ha investigado en pacientes con insuficiencia hepática moderada (Child-Pugh clase B) y se ha comparado con sujetos normales. El estado estable del Cmáx y del AUC de la eplerenona aumentó en un 3,6% y 42%, respectivamente (ver sección Posología y método de administración). Dado que el uso de eplerenona no ha sido estudiado en pacientes con insuficiencia hepática grave, la eplerenona está contraindicada en este grupo de pacientes (ver sección Contraindicaciones).
Insuficiencia cardiaca: Se evaluó la farmacocinética de la eplerenona de 50 mg en pacientes con insuficiencia cardiaca (NYHA clasificación II-IV). En comparación con los sujetos sanos igualados por edad, peso y sexo, el estado estable del AUC y del Cmáx en pacientes con insuficiencia cardiaca fue del 38% y 30% superior, respectivamente. De acuerdo con estos resultados, un análisis farmacocinético de población de la eplerenona basado en un subconjunto de pacientes de EPHESUS indica que la depuración aparente de la eplerenona en pacientes con insuficiencia cardiaca fue similar a la de los sujetos ancianos sanos.
Población pediátrica: Un modelo farmacocinético poblacional de las concentraciones de eplerenona de dos estudios en 51 pacientes pediátricos hipertensos con edades de 4-17 años identificó que el peso corporal del paciente tenía un efecto estadísticamente significativo en el volumen de distribución de eplerenona, pero no en su depuración. Se puede predecir que el volumen de distribución y la exposición máxima de la eplerenona en un paciente pediátrico con mayor peso serán similares a los de un adulto de peso corporal similar; en un paciente con menor peso, 45 kg, el volumen de distribución es aproximadamente 40% menor y se puede predecir que la exposición máxima será más alta que en adultos típicos. El tratamiento con eplerenona se inició con 25 mg una vez al día en pacientes pediátricos y se aumentó a 25 mg dos veces al día después de 2 semanas y, eventualmente, a 50 mg dos veces al día, cuando está clínicamente indicado; a estas dosis, las concentraciones más altas observadas de eplerenona en pacientes pediátricos no fueron sustancialmente mayores que en los adultos que iniciaron con 50 mg una vez al día.
PROPIEDADES FARMACODINÁMICAS:
La eplerenona se describe químicamente como ácido pregn-4-eno-7,21-dicarboxílico, 9,11-epoxi-17-hidroxi-3-oxo-, ?-lactona, éster metílico, (7a, 11a, 17a)-. Su fórmula empírica es C24H30O6 y que tiene un peso molecular de 414,50. La fórmula estructural de la eplerenona se representa a continuación:
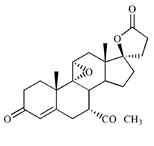
Eplerenona
Mecanismo de la eplerenona: La eplerenona tiene selectividad relativa en la unión a receptores mineralocorticoides humanos recombinantes en comparación con su unión a receptores glucocorticoides humanos recombinantes, de la progesterona y de los andrógenos. La eplerenona impide la unión de la aldosterona, una hormona clave en el sistema renina-angiotensina-aldosterona (RAAS), que está involucrado en la regulación de la presión arterial y en la fisiopatología de la enfermedad cardiovascular.
Se ha demostrado que la eplerenona produce un aumento sostenido de la renina en plasma y de la aldosterona sérica, consistentes con la inhibición de la retroalimentación reguladora negativa de la aldosterona sobre la secreción de renina. El aumento resultante de la actividad de la renina en plasma y niveles circulantes de aldosterona no se sobreponen a los efectos de la eplerenona.
Hipertensión: La eplerenona se estudió en 3091 pacientes hipertensos, que comprendieron un 46% de mujeres, un 14% de raza negra y un 22% de ³65 años de edad. Se excluyó a los pacientes con valor inicial elevado de potasio sérico (>5,0 mmol/L) o creatinina (>133 mmol/L en hombres y >115 mmol/L en mujeres). Dos estudios de monoterapia, controlados con dosis fija de placebo durante 8 a 12 semanas en pacientes hipertensos con 611 pacientes escogidos al azar para eplerenona (dosis de 25 mg a 400 mg al día en una sola dosis al día o dos dosis diarias) y 140 para placebo. Los pacientes tratados con 50 mg a 200 mg al día experimentaron una disminución significativa en la presión arterial sentados a concentración mínima con diferencias con respecto al placebo de 6-13 mg Hg (sistólica) y 3-7 mm de Hg (diastólica), los efectos se confirmaron con mediciones ambulatorias durante 24 horas.
La disminución de la presión arterial fue ostensible a las 2 semanas y el efecto máximo a las 4 semanas de tratamiento. En 6 estudios, después de 8 a 24 semanas de tratamiento, la suspensión de la eplerenona, del placebo o del control activo dio como resultado tasas similares de eventos adversos en la semana siguiente a la suspensión. En los pacientes tratados con eplerenona la presión arterial se elevó en pacientes que no tomaban otros antihipertensivos, lo que sugiere que el efecto de la eplerenona se mantuvo a 8 a 24 semanas. En general, los efectos de eplerenona no se ven afectados por la edad, el sexo o la raza con excepción de los pacientes con hipertensión de renina baja en donde un único estudio mostró pequeñas reducciones de la presión arterial con eplerenona en pacientes de raza negra con respecto a los de raza blanca durante el periodo de ajuste inicial.
La eplerenona se ha estudiado de forma concomitante con el tratamiento con inhibidores de la ACE, con antagonistas de la angiotensina II, con bloqueadores del canal de calcio, con betabloqueantes y con hidroclorotiazida. Cuando se administra eplerenona concomitantemente con uno de estos fármacos generalmente se producen sus efectos antihipertensivos esperados.
Población pediátrica: En un estudio de 10 semanas con pacientes pediátricos con hipertensión (rango de edad de 4 a 17 años, n = 304), la eplerenona, a dosis (de 25 mg hasta 100 mg por día) que producía una exposición similar a la de los adultos, no redujo eficazmente la presión arterial. En este estudio y en un estudio de seguridad pediátrica a un año en 149 pacientes, el perfil de seguridad fue similar al de los adultos. La eplerenona no se ha estudiado en pacientes hipertensos de menos de 4 años de edad debido a que el estudio en pacientes pediátricos mayores no demostró eficacia. (Vea la sección Posología y método de administración).
Insuficiencia cardiaca posterior al infarto al miocardio: En estudios de rango de dosis en insuficiencia cardiaca crónica (NYHA clasificación II-IV), la adición de eplerenona a la terapia estándar dio como resultado el aumento esperado de aldosterona dependiente de la dosis.
La eplerenona se estudió en EPHESUS (Estudio sobre la eficacia y supervivencia con eplerenona en pacientes con insuficiencia cardiaca post infarto agudo de miocardio), un estudio doble ciego, controlado con placebo en 6632 pacientes con infarto agudo de miocardio (MI), disfunción ventricular izquierda (según la medición de la fracción de eyección del ventrículo izquierdo [LVEF] £40%), y signos clínicos de insuficiencia cardiaca. En un lapso de 3-14 días (mediana 7 días) después de un infarto de miocardio agudo, los pacientes recibieron eplerenona o placebo además de las terapias estándar con una dosis inicial de 25 mg una vez al día, ajustándola a la dosis objetivo de 50 mg una vez al día después de 4 semanas si el potasio sérico fue <5,0 mmol/L. Durante el estudio los pacientes recibieron la atención estándar, incluyendo ácido acetilsalicílico (92%), inhibidores de la ACE (90%), betabloqueadores (83%), nitratos (72%), diuréticos de asa (66%), o inhibidores de la HMG CoA reductasa (60% ).
En EPHESUS, los criterios primarios de valoración fueron la mortalidad por toda causa y el criterio combinado de muerte por causas CV u hospitalización por causas CV; 14,4% de los pacientes asignados a eplerenona y 16,7% de los pacientes asignados a placebo murieron (por toda causa), mientras que el 26,7% de los pacientes asignados a eplerenona y el 30,0% asignado a placebo cumplieron el criterio de valoración combinado de muerte por causas CV u hospitalización. Así, en EPHESUS, eplerenona redujo el riesgo de muerte por toda causa en un 15% (RR 0,85; CI 95%, 0,75-0,96, p=0,008) en comparación con placebo, principalmente por la reducción de la mortalidad por causas cardiovasculares (CV). El riesgo combinado de muerte por CV u hospitalización por CV se redujo en un 13% con eplerenona (RR 0,87, CI 95%, 0,79-0,95, p=0,002). Las reducciones del riesgo absoluto para los criterios de mortalidad por toda causa y de mortalidad por causas combinadas de CV/hospitalización fueron de 2,3 y 3,3%, respectivamente. La eficacia clínica se demostró principalmente cuando se inició la terapia con eplerenona en pacientes <75 años de edad. Los beneficios de la terapia en pacientes mayores de 75 no son claros. La clasificación funcional de la NYHA mejoró o se mantuvo estable en una proporción significativamente mayor estadísticamente en pacientes tratados con eplerenona en comparación con placebo. La incidencia de hipercalemia fue de 3,4% en el grupo de eplerenona vs. 2,0% en el grupo de placebo (p <0,001). La incidencia de hipocalemia fue de 0,5 % en el grupo de eplerenona vs. 1,5 % en el grupo de placebo (p <0,001).
Insuficiencia cardiaca NYHA Clase II (crónica): En el estudio clínico EMPHASIS-HF (Uso de Eplerenona para evaluar hospitalizaciones y supervivencia de pacientes con síntomas leves de insuficiencia cardiaca) se evaluó el efecto de eplerenona al añadirse a la terapia estándar en los resultados clínicos en pacientes con insuficiencia cardiaca sistólica y síntomas leves (Clase funcional NYHA II).
Los pacientes fueron incluidos si tenían al menos 55 años de edad, tenían una fracción de eyección del ventrículo izquierdo (LVEF) del £30% o LVEF =35% además de una duración del QRS >130 ms, y que fueron hospitalizados, por causas cardiovasculares (CV) 6 meses antes de la inclusión o porque tenían un nivel en plasma del péptido natriurético tipo B (BNP) de al menos 250 pg/mL o un nivel en plasma N-terminal pro-BNP de al menos 500 pg/mL en hombres (750 pg/mL en mujeres). La eplerenona se inició a una dosis de 25 mg una vez al día y se incrementó después de 4 semanas a 50 mg una vez al día cuando el nivel de potasio sérico fue <5,0 mmol/L. Alternativamente, si la GFR estimada fue de 30-49 mL/min/1,73 m2, la eplerenona se inició con 25 mg día de por medio, y se aumentó a 25 mg una vez al día.
En total, 2737 pacientes fueron escogidos al azar (doble ciego) para el tratamiento con eplerenona o con placebo incluyendo una terapia inicial con diuréticos (85%), con inhibidores de la ACE (78%), con bloqueadores de los receptores de la angiotensina II (19%), betabloqueadores (87%), fármacos anti trombóticos (88%), agentes reductores de lípidos (63%) y glucósidos digitálicos (27%). La FEVI media fue de ~26% y la duración media del QRS fue de ~122 milisegundos. La mayoría de los pacientes (83,4%) fueron hospitalizados previamente por causas CV dentro de los 6 meses de la aleatorización, con aproximadamente un 50% de ellos debido a insuficiencia cardiaca. Alrededor del 20% de los pacientes tenían desfibriladores implantables o terapia de resincronización cardiaca.
El criterio primario, muerte por causa cardiovascular u hospitalización por insuficiencia cardiaca ocurrió en 249 pacientes (18,3%) en el grupo de eplerenona y 356 pacientes (25,9%) en el grupo de placebo (RR 0,63, CI 95%, 0,54-0,74, p<0,001). El efecto de la eplerenona en el criterio primario fue consistente en todos los subgrupos pre-especificados.
El criterio secundario de muerte por toda causa ocurrió en 171 pacientes (12,5%) en el grupo de eplerenona y en 213 pacientes (15,5%) en el grupo de placebo (RR 0,76, CI 95%, 0,62-0,93, p = 0,008). Se reportó la muerte por causas CV en 147 pacientes (10,8%) en el grupo de eplerenona y en 185 pacientes (13,5%) en el grupo de placebo (RR 0,76, CI 95%, 0,61-0,94, p = 0,01).
Durante el estudio, la hipercalemia (nivel de potasio sérico >5,5 mmol/L) fue reportada en 158 pacientes (11,8%) en el grupo de eplerenona y en 96 pacientes (7,2%) en el grupo de placebo (p<0,001). La hipocalemia, definida como niveles de potasio sérico <4,0 mmol/L, fue estadísticamente menor con eplerenona en comparación con placebo (38,9% para eplerenona en comparación con 48,4% para placebo, p<0,0001.
Electrocardiografía: No se observaron efectos consistentes de eplerenona sobre la frecuencia cardiaca; la duración del intervalo QRS, o PR o QT se observó en 147 sujetos normales evaluados para observar cambios electrocardiográficos durante los estudios farmacocinéticos.
CONTRAINDICACIONES
La eplerenona está contraindicada en TODOS los pacientes con
• Hipersensibilidad a la eplerenona o a cualquier componente de este medicamento.
• Pacientes con hipercalemia significativa clínicamente o con condiciones asociadas con la hipercalemia.
• Nivel de potasio sérico >5,0 mmol/L (mEq/L) antes de iniciar la terapia.
• Deterioro renal moderado a severo (depuración de creatinina <50 mL/min) en insuficiencia cardiaca post MI y depuración de creatinina <30 ml/min en pacientes con insuficiencia cardiaca NYHA Clase II (crónica).
• Deterioro hepático severo (Child-Pugh Clase C).
• Uso concomitante con diuréticos reductores de potasio, suplementos de potasio o con inhibidores potentes del CYP450 3A4 como ketoconazol, itraconazol y ritonavir (ver sección Interacción con otros medicamentos y otras formas de interacción).
La eplerenona también está contraindicada en pacientes con HIPERTENSIÓN y lo siguiente
• Diabetes tipo 2 con microalbuminuria.
• Creatinina sérica >2,0 mg/dL (ó >177 µmol/L) en hombres ó >1,8 mg/dL (ó >159 µmol/L) en mujeres.
FERTILIDAD, EMBARAZO Y LACTANCIA
Fertilidad/embarazo: La eplerenona no ha sido estudiada en mujeres embarazadas. Los estudios en animales no indican efectos adversos directos o indirectos sobre el embarazo, el desarrollo embriofetal, el parto y el desarrollo postnatal (ver sección Datos preclínicos de seguridad). Se debe tener precaución al recetar eplerenona a las mujeres embarazadas.
Lactancia: Se desconoce si la eplerenona se excreta en la leche materna después de la administración oral. Sin embargo, los datos preclínicos muestran que la eplerenona y/o los metabolitos están presentes en la leche materna de rata y que los cachorros de rata expuestos por esta vía se desarrollaron normalmente. Debido a que muchos medicamentos se excretan en la leche humana y debido al potencial desconocido de efectos adversos en el lactante, se debe tomar una decisión en relación con descontinuar la lactancia o descontinuar el medicamento teniendo en cuenta la importancia del medicamento para la madre.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MAQUINARIA: Se ha informado la ocurrencia de mareos y síncope en algunos pacientes. Se recomienda precaución al conducir o utilizar maquinaria hasta que la respuesta al tratamiento inicial haya sido determinada.
EFECTOS NO DESEADOS
Hipertensión: Los siguientes eventos adversos son aquellos en los que se sospecha tienen relación con el tratamiento y son las ramas de la monoterapia de cuatro estudios clínicos controlados por placebo en pacientes con hipertensión que fueron tratados con 25 a 400 mg de eplerenona. A continuación se proporcionan los eventos con incidencia mayor al 1% y mayores que el placebo.
Nota: No se incluyen los eventos adversos que son demasiado generales para ser informativos o que son muy comunes en la población tratada.
|
Sistema de clasificación de órganos |
Común =1/100 a <1/10 |
|
Infecciones e infestaciones |
Enfermedad tipo influenza |
|
Trastornos del metabolismo y de la nutrición |
Hipercolesterolemia, hipertrigliceridemia, hipercalemia |
|
Trastornos del sistema nervioso |
Mareo |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
|
Trastornos gastrointestinales |
Dolor abdominal, diarrea |
|
Trastornos hepatobiliares |
Gamma glutamil transferasa aumentada, alanina aminotransferasa aumentada |
|
Trastornos renales y urinarios |
Albuminuria |
|
Trastornos generales y condiciones del sitio de administración |
Fatiga |
Insuficiencia cardiaca post infarto de miocardio e insuficiencia cardiaca NYHA Clase II (crónica): En dos estudios (Estudio sobre la eficacia y supervivencia con eplerenona en pacientes con insuficiencia cardiaca post infarto agudo de miocardio [EPHESUS] y Eplerenona en el estudio de hospitalizaciones y supervivencia de pacientes leves con insuficiencia cardiaca [EMPHASIS-HF]), la incidencia global de eventos adversos y la tasa de interrupción debido a eventos adversos reportados con eplerenona fue similar a la del placebo.
El efecto adverso más frecuente reportado en los estudios EPHESUS y EMPHASIS-HF fue la hipercalemia con una tasa de incidencia del 3,4% y del 8,7% para eplerenona, respectivamente.
Los eventos adversos reportados a continuación son los que tienen relación sospechosa con el tratamiento. Los efectos adversos se listan por sistema corporal y frecuencia absoluta.
|
Tabla de eventos adversos |
|||
|
Sistema de clasificación de órganos |
Común = 1/100 a < 1/10 |
Poco común = 1/1000 a < 1/100 |
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles) |
|
Infecciones e infestaciones |
infección |
faringitis |
|
|
Trastornos sanguíneos y del sistema linfático |
eosinofilia |
||
|
Trastornos endocrinos |
hipotoroidismo |
||
|
Trastornos del metabolismo y de la nutrición |
hipercalemia, deshidratación |
hipercolesterolemia, hipertrigliceridemia, hiponatremia |
|
|
Trastornos psiquiátricos |
insomnio |
||
|
Trastornos del sistema nervioso |
mareos y síncope |
dolor de cabeza, hipoestesia |
|
|
Trastornos cardiacos |
infarto al miocardio |
fibrilación auricular, insuficiencia ventricular izquierda |
|
|
Trastornos vasculares |
hipotensión |
hipotensión ortostática |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
tos |
||
|
Trastornos gastrointestinales |
diarrea, náuseas, estreñimiento |
flatulencia, vómitos |
|
|
Trastornos hepatobiliares |
colecistitis |
||
|
Trastornos de la piel y del tejido subcutáneo |
prurito |
hiperhidrosis |
angioedema*, erupción cutánea* |
|
Trastornos musculoesqueléticos, del tejido conjuntivo y óseos |
espasmos musculares, dolor musculoesquelético |
dolor de espalda |
|
|
Trastornos renales y urinarios |
insuficiencia renal |
||
|
Trastornos generales y condiciones del sitio de administración |
astenia, malestar |
||
|
Investigaciones |
aumento de urea en sangre |
creatinina elevada en sangre, receptor del factor de crecimiento epidérmico disminuido, glucosa en sangre aumentada |
|
|
*ADR identificada en forma posterior a la comercialización |
|||
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN
Diuréticos reductores de potasio: La eplerenona no debe ser administrada a pacientes que estén tomando otros diuréticos reductores de potasio (ver secciones Contraindicaciones y Advertencias especiales y precauciones de uso - Hipercalemia).
Inhibidores de la ACE, bloqueadores del receptor de angiotensina (ARB): El riesgo de hipercalemia puede aumentar cuando la eplerenona se administra en combinación con un inhibidor de la enzima convertidora de angiotensina (ACE) y/o un bloqueador del receptor de angiotensina (ARB). Se recomienda un control estricto del potasio sérico y de la función renal, especialmente en pacientes con riesgo de insuficiencia renal, por ejemplo, personas de edad avanzada.
Digoxina: No se han encontrado interacciones farmacocinéticas clínicamente significativas entre fármacos con la digoxina. Aunque se observó un aumento estadísticamente significativo del 16% en el AUC0-24 con digoxina 200 mcg y con 100 mg de eplerenona una vez al día en un estudio farmacocinético en voluntarios sanos, este aumento no fue acompañado por evidencia clínica de toxicidad por la digoxina.
Warfarina: No se han encontrado interacciones farmacocinéticas clínicamente significativas entre fármacos con la warfarina.
Fármacos anti-inflamatorios no esteroideos (AINEs): Los estudios de interacciones medicamentosas de la eplerenona no han sido realizados con AINEs. Los AINEs administrados con antihipertensivos reductores de potasio han demostrado causar hipercalemia en pacientes con función renal deteriorada.
Litio: No se han llevado a cabo estudios de interacción medicamentosa de eplerenona con litio. Se ha reportado toxicidad del litio en pacientes tratados con litio concomitantemente con diuréticos e inhibidores de la ACE.
Los estudios in vitro indican que la eplerenona no es un inhibidor de las isoenzimas CYP1A2, CYP2C19, CYP2C9 o CYP2D6. La eplerenona no es un sustrato o un inhibidor de la P-glicoproteína.
Sustratos de CYP3A4: Los resultados de los estudios farmacocinéticos con sustratos de sondeo CYP3A4, como el midazolam y la cisaprida, no mostraron interacciones farmacocinéticas significativas cuando estos medicamentos se administraron conjuntamente con eplerenona.
Inhibidores de CYP3A4
Inhibidores potentes de CYP3A4: Pueden ocurrir interacciones farmacocinéticas significativas cuando la eplerenona se co-administra con fármacos que inhiben la enzima CYP3A4. Un potente inhibidor de CYP3A4 (el ketoconazol de 200 mg dos veces al día) provocó un aumento del 441% en el AUC de la eplerenona (ver las sección Contraindicaciones). El uso concomitante de eplerenona con inhibidores potentes del CYP3A4 como ketoconazol, itraconazol y ritonavir está contraindicado (ver sección Contraindicaciones).
Inhibidores del CYP3A4 leves a moderados: La administración conjunta con eritromicina, saquinavir, verapamilo y fluconazol ha dado lugar a interacciones farmacocinéticas significativas con aumentos en el AUC que van desde el 98% al 187%. La dosificación de eplerenona no debe por lo tanto exceder de 25 mg cuando se administran inhibidores de CYP3A4 leves a moderados conjuntamente con eplerenona (ver sección Posología y método de administración).
Inductores del CYP3A4: La administración conjunta de la hierba de San Juan (un potente inductor del CYP3A4) con eplerenona causó una disminución del 30% en el AUC de la eplerenona. Un descenso más pronunciado en el AUC de la eplerenona puede ocurrir con inductores del CYP3A4 más potentes y no se recomienda el uso concomitante de inductores potentes de CYP3A4 con eplerenona (ver sección Advertencias especiales y precauciones de uso).
DATOS PRECLÍNICOS DE SEGURIDAD
Carcinogénesis, mutagénesis, problemas de fertilidad: Los estudios preclínicos sobre seguridad farmacológica, genotoxicidad, potencial carcinogénico y toxicidad para la reproducción no revelaron ningún riesgo especial para los humanos.
En estudios de toxicidad con dosis repetida, se observó atrofia de la próstata en ratas y en perros con niveles de exposición varias veces por encima de los niveles clínicos de exposición. Los cambios prostáticos no se asociaron con consecuencias funcionales adversas. No se conoce la relevancia clínica de estos hallazgos.
Los estudios en ratas y en conejos no mostraron efectos teratogénicos, aunque se observó una disminución del peso corporal en conejas gestantes y un aumento de las resorciones fetales en conejos y se observaron pérdidas posteriores a la implantación con la dosis más alta administrada.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES DE USO
Hipercalemia: La eplerenona está asociada con un mayor riesgo de hipercalemia. Este riesgo se puede minimizar mediante la selección de pacientes, evitando ciertos tratamientos concomitantes, y mediante el control. Por lo general, la eplerenona no debe ser administrada a pacientes que estén recibiendo suplementos de potasio (ver también la sección Contraindicaciones). Los niveles de potasio deben ser monitoreados regularmente en pacientes con insuficiencia renal, incluyendo la microalbuminuria diabética (ver más adelante). La reducción de la dosis de eplerenona ha demostrado que disminuye los niveles de potasio sérico. (Ver también la sección Posología y método de administración).
El riesgo de hipercalemia puede aumentar cuando la eplerenona se administra en combinación con un inhibidor de la enzima convertidora de angiotensina (ACE) y/o un bloqueador del receptor de angiotensina (ARB).
Funcionamiento hepático deteriorado: Los niveles de electrolitos deben ser monitoreados en pacientes con insuficiencia hepática leve a moderada. El uso de eplerenona en pacientes con insuficiencia hepática grave (Child-Pugh clase C) no ha sido evaluada y está contraindicado (ver también las secciones Posología y método de administración y Contraindicaciones).
Insuficiencia renal: Ver Hipercalemia, citada más arriba, y también la sección Contraindicaciones.
Personas de edad avanzada: Debido a la disminución de la función renal relacionada con la edad, el riesgo de hipercalemia aumenta en pacientes de edad avanzada. Se recomienda el control periódico del potasio sérico.
Inductores del CYP 3A4: No se recomienda la administración conjunta de eplerenona con inductores potentes del CYP 3A4 (ver sección Interacción con otros medicamentos y otras formas de interacción).
Información para los pacientes: A los pacientes tratados con eplerenona se les debe informar que no deben usar suplementos de potasio, sustitutos de la sal que contengan potasio, ni medicamentos contraindicados sin consultar con el médico tratante.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN: Para el ajuste individual de la dosis, están disponibles las concentraciones de 25 mg y 50 mg. El régimen de dosis máxima es de 50 mg al día para insuficiencia cardiaca y 100 mg al día para hipertensión.
Hipertensión: La eplerenona se puede tomar sola o en combinación con otros agentes antihipertensivos. La dosis inicial recomendada de eplerenona es de 50 mg administrados una vez al día. Si la presión arterial no se controla adecuadamente, la dosis de eplerenona se puede incrementar a 100 mg al día.
Insuficiencia cardiaca - Post MI: La dosis de mantenimiento recomendada de eplerenona es de 50 mg una vez al día. El tratamiento se debe iniciar con 25 mg una vez al día y ajustarse en un paso a la dosis objetivo de 50 mg una vez al día, preferiblemente en un lapso de 4 semanas, teniendo en cuenta el nivel de potasio sérico (véase la Tabla 1). Después de empezar, se debe ajustar la dosis en base al nivel de potasio sérico como se muestra en la Tabla 1.
Insuficiencia cardiaca NYHA Clase II (crónica): Para pacientes con insuficiencia cardiaca crónica NYHA Clase II, el tratamiento debe iniciarse con una dosis de 25 mg una vez al día y ajustarse para la dosis objetivo de 50 mg una vez al día, preferiblemente en un lapso de 4 semanas; teniendo en cuenta el nivel de potasio sérico (véase la Tabla 1 y la sección Advertencias especiales y precauciones de uso).
|
Tabla 1. Tabla de ajuste de dosis en insuficiencia cardiaca - Post MI |
||
|
Potasio sérico (mmol/L o mEq/L) |
Acción |
Ajuste de la dosis |
|
< 5,0 |
Aumentar |
25 mg EOD a 25 mg OD 25 mg OD a 50 mg OD |
|
5,0 – 5,4 |
Mantener |
Ningún ajuste de dosis |
|
5,5 – 5,9 |
Disminuir |
50 mg OD a 25 mg OD 25 mg OD a 25 mg EOD 25 mg EOD a suspensión |
|
³ 6,0 |
Suspender |
N/D |
|
EOD (Cada dia de por medio, OD (Una vez al día) |
||
Después de la suspensión de eplerenona debido a los niveles de potasio sérico de ³6,0 mmol/L (o >6,0 mEq/L), se puede volver a administrar eplerenona a una dosis de 25 mg cada dos días cuando los niveles de potasio hayan caído por debajo de 5,0 mmol/L (o 5,0 mEq/L).
Consideraciones generales
Potasio: El potasio sérico debe ser medido antes de iniciarse la terapia con eplerenona, dentro de la primera semana y al mes del inicio del tratamiento o del ajuste de la dosis. Después de eso se debe evaluar el potasio sérico periódicamente.
Alimentos: La eplerenona se puede administrar con o sin alimentos.
Administración concomitante con medicamentos inhibidores de CYP3A4: Los pacientes que reciben inhibidores débiles del CYP3A4, como eritromicina, saquinavir, verapamilo y fluconazol deben recibir una dosis inicial de 25 mg una vez al día. (Ver también la sección Interacción con otros medicamentos y otras formas de interacción).
• Poblaciones especiales y consideraciones especiales para la dosificación
— Uso en deterioro hepático
Deterioro hepático leve a moderado: No es necesario ajustar la dosis inicial. (Ver también las secciones Contraindicaciones y Advertencias especiales y precauciones de uso).
— Uso en deterioro renal
No es necesario ajustar la dosis inicial en pacientes con deterioro renal leve. Las tasas de hipercalemia aumentan con el deterioro de la función renal. Se recomienda el control periódico del potasio sérico (ver sección Advertencias especiales y precauciones de uso) y el ajuste de las dosis de acuerdo con la Tabla 1.
Los pacientes con insuficiencia cardiaca NYHA Clase II (crónica) y con insuficiencia renal moderada (CrCl 30-60 mL/min) deben comenzar con una dosis de 25 mg cada dia de por medio, y se debe ajustar la dosis de acuerdo con el nivel de potasio (ver Tabla 1). Se recomienda el control periódico del potasio sérico (ver sección Advertencias especiales y precauciones de uso).
En pacientes con insuficiencia cardiaca post-MI, no hay experiencia con CrCl <50 mL/min. El uso de eplerenona en estos pacientes debe hacerse con precaución.
Las dosis superiores a 25 mg diarios no han sido estudiadas en pacientes con CrCl <50 mL/min.
En los pacientes con insuficiencia renal grave (CrCl <30 mL/min) está contraindicada (ver sección Contraindicaciones). La eplerenona no es dializable.
En pacientes hipertensos con insuficiencia renal moderada a grave o con diabetes tipo 2 con microalbuminuria: (Ver las secciones Contraindicaciones y Advertencias especiales y precauciones de uso).
Uso en personas de edad avanzada: No se requiere ajuste inicial de la dosis en pacientes de edad avanzada. (Ver también la sección Advertencias especiales y precauciones de uso).
Uso en niños: La eplerenona no se ha estudiado en pacientes hipertensos de menos de 4 años de edad debido a que el estudio en pacientes pediátricos mayores no demostró eficacia. Los datos actualmente disponibles se describen en las secciones Propiedades farmacodinámicas y Propiedades farmacocinéticas.
La seguridad y eficacia de la eplerenona no se ha estudiado en pacientes pediátricos con insuficiencia cardiaca.
SOBREDOSIS: No se han reportado casos de eventos adversos asociados con la sobredosis de eplerenona en seres humanos. La manifestación más probable de sobredosis en humanos sería la hipotensión y/o la hipercalemia, por consiguiente los pacientes deben recibir tratamiento sintomático y medidas de apoyo, según se requiera. La eplerenona no se elimina por hemodiálisis. La eplerenona se ha demostrado que se une ampliamente al carbón.
PRESENTACIÓN: INSPRA® 25 mg (Reg. San. INVIMA 2012M-0013745).
INSPRA® 50 mg (Reg. San. INVIMA 2012M-0013733).
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá – Colombia.
Título del Documento del Producto: Eplerenona
Fecha de CDS que Reemplaza: 13 de Agosto de 2012
Fecha Efectiva: 12 de diciembre de 2012
Versión CDS: 7.0
LLD_Col_CDSv7.0_12Dec2012_V1.0_Aprobado por Resol.2014028443/2014027854_12Sep2014
PFIZER S.A.S.