
INLYTA
AXITINIB
Tabletas recubiertas
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada TABLETA Recubierta contiene 1 mg o 5 mg de axitinib.
INDICACIONES TERAPÉUTICAS: Axitinib está indicado para el tratamiento de pacientes con carcinoma de células renales (CCR) avanzado después del fracaso de un tratamiento sistémico previo. (Ver también sección Propiedades farmacodinámicas).
PROPIEDADES FARMACOCINÉTICAS: Después de la administración oral de las tabletas de axitinib, la biodisponibilidad absoluta media es 58% comparada con la administración intravenosa. La vida media plasmática de axitinib varía entre 2,5 a 6,1 horas. La administración de axitinib a 5 mg dos veces al día produjo una acumulación dos veces menor comparada con la administración de una única dosis. Con base en la vida media corta de axitinib, se espera que el estado estable se encuentre dentro de 2 a 3 días de la administración de la dosis inicial.
Absorción y distribución: Las concentraciones plasmáticas pico de axitinib se alcanzan generalmente dentro de las 4 horas después de la administración oral de axitinib con el Tmáx medio variando entre 2,5-4,1 horas. La administración de axitinib con una comida con contenido moderado de grasa produjo un 10% menos de exposición en comparación con la administración en ayunas. Una comida con alto contenido de grasa y calorías produjo 19% más de exposición en comparación con la administración en ayunas. Axitinib se puede administrar con o sin alimentos.
La Cmáx y el ABC promedios aumentaron proporcionalmente durante un intervalo de administración de dosis de axitinib de 5 a 10 mg. La unión in vitro de axitinib a las proteínas plasmáticas humanas es >99% con unión preferencial a la albúmina y unión moderada a a1-ácido glicoproteína. A la dosis de 5 mg dos veces al día en una condición de alimentación, la concentración plasmática pico media geométrica y el ABC a las 24 horas fueron 27,8 ng/mL y 265 ng.h/mL, respectivamente en pacientes con CCR avanzado. La depuración oral media geométrica y el volumen aparente de distribución fueron 38 L/h y 160 L, respectivamente.
Metabolismo y eliminación: Axitinib se metaboliza principalmente en el hígado por CYP3A4/5 y a un menor grado por CYP1A2, CYP2C19 y UGT1A1. Después de la administración oral de una dosis radioactiva de 5 mg de axitinib, 30-60% de la radioactividad fue recuperada en las heces y 23% de la radioactividad fue recuperada en la orina. El axitinib sin cambio, que equivalió a un 12% de la dosis, fue el componente principal identificado en las heces. El medicamento madre no se detectó en la orina; el ácido carboxílico y los metabolitos sulfóxido equivalieron a la mayoría de la radioactividad en la orina. En plasma, el N-glucurónido representó el componente radioactivo predominante (50% de radioactividad circulante) y el axitinib sin cambio y el metabolito sulfóxido cada uno equivalió a aproximadamente el 20% de la radioactividad circulante.
Los metabolitos sulfóxido y N-glucurónido mostraron aproximadamente 400 veces y 800 veces menos potencia in vitro, respectivamente, contra VEGFR-2 comparados con axitinib.
• Poblaciones especiales
Género, raza y edad: Los análisis farmacocinéticos poblacionales de pacientes con cáncer avanzado (incluido CCR avanzados) y voluntarios sanos indicaron que no existe ningún efecto clínicamente relevante de la edad, el sexo, el peso corporal, la raza, la función renal, el genotipo UGT1A1 o el genotipo de CYP2C19.
Población pediátrica: Axitinib no se ha estudiado en pacientes < 18 años de edad.
Insuficiencia hepática: Los datos in vitro e in vivo indican que axitinib se metaboliza principalmente por el hígado. Comparada con personas con función hepática normal, la exposición sistémica después de una única dosis de axitinib fue similar en pacientes con insuficiencia hepática leve (Child-Pugh Clase A) y mayor (aproximadamente el doble) en pacientes con insuficiencia hepática moderada (Child-Pugh Clase B). Axitinib no se ha estudiado en pacientes con insuficiencia hepática severa. (Child-Pugh clase C).
Insuficiencia renal: El medicamento madre axitinib no se detectó en la orina.
Axitinib no se ha estudiado en pacientes con insuficiencia renal. En los estudios clínicos con axitinib para el tratamiento de pacientes con CCR, los pacientes con creatinina sérica >1,5 veces el LSN o depuración de creatinina calculada <60 mL/min fueron excluidos. Los análisis farmacocinéticos poblacionales han demostrado que la depuración de axitinib no se alteró en pacientes con insuficiencia renal y no se requiere ningún ajuste de la dosis de axitinib.
PROPIEDADES FARMACODINÁMICAS
Mecanismos de acción: Axitinib es un inhibidor potente y selectivo de la tirosina cinasa del receptor del factor de crecimiento endontelial vascular (VEGFR)-1, VEGFR-2 y VEGFR-3. Estos receptores están implicados en la angiogénesis patológica, crecimiento de tumores y progresión metastásica del cáncer. Axitinib ha demostrado inhibir potentemente la proliferación y supervivencia de células endoteliales mediadas por VEGF. Axitinib inhibió la fosforilación de VEGFR-2 en la vasculatura de tumores de xenoinjertos que expresaban el objetivo in vivo y produjo retraso, regresión del crecimiento del tumor, e inhibió la metástasis en muchos modelos experimentales de cáncer.
Efectos farmacodinámicos: En un estudio aleatorizado, cruzado de dos vías, 35 personas sanas recibieron una única dosis oral de axitinib (5 mg) en ausencia y presencia de 400 mg de ketoconazol durante 7 días. Los resultados de este estudio indicaron que las exposiciones plasmáticas a axitinib de hasta dos veces mayores a los niveles terapéuticos esperados después de una dosis de 5 mg no produjeron prolongación clínicamente significativa del intervalo QT.
Eficacia clínica: La seguridad y eficacia de axitinib se evaluaron en un estudio de Fase 3 aleatorizado, abierto, multicéntrico. Los pacientes (N=723) con CCR avanzado cuya enfermedad había empeorado durante o después del tratamiento con una terapia sistémica previa, incluidos tratamientos que contenían sunitinib, bevacizumab, temsirolimus o citocinas fueron asignados aleatoriamente (1:1) para recibir axitinib (n=361) o sorafenib (n=362). El criterio de valoración principal, la supervivencia libre de progresión (PFS), se evaluó utilizando una revisión central independiente enmascarada. Los criterios de valoración secundarios incluyeron la tasa de respuesta objetiva (ORR) y la supervivencia global (OS).
De los pacientes incluidos en este estudio, 389 (54%) habían recibido una terapia previa a base de sunitinib, 251 pacientes (35%) habían recibido una terapia previa a base de citocinas (interleucina-2 o interferí-alfa), 59 pacientes (8%) habían recibido una terapia a base de bevacizumab previa y 24 pacientes (3%) había recibido una terapia a base de tensirolimus previa. Las características iniciales demográficas y de la enfermedad fueron similares entre los grupos de axitinib y sorafenib con relación a la edad, el sexo, la raza, el estado de desempeño según el Grupo Cooperativo de Oncología del Este (ECOG), región geográfica y tratamiento previo.
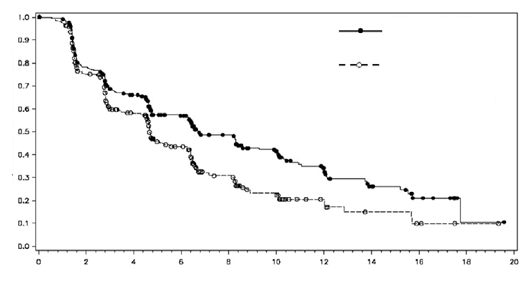
Axitinib tuvo una ventaja estadísticamente significativa sobre sorafenib en el criterio de valoración principal de PFS (ver Tabla 2 y Figura 1). No hubo diferencia de importancia estadística entre los grupos en OS.
|
Tabla 2. Resultados para eficacia por evaluación independiente |
||||
|
Criterio de valoración/población del estudio |
Axitinib |
Sorafenib |
HR (IC 95%) |
Valor P |
|
PFSa,b |
||||
|
ITT general |
N= 361 |
N= 362 |
||
|
Mediana, meses (IC 95%) |
6,7 (6,3, 8,6) |
4,7 (4,6, 5,6) |
0,665 (0,544, 0,812) |
<0,0001c |
|
Subgrupo resistente al tratamiento con sunitinib |
N=194 (54%) |
N=195 (54%) |
||
|
Mediana, meses (IC 95%) |
4,8 (4,5, 6,4) |
3,4 (2,8, 4,7) |
0,741 (0,573, 0,958) |
0,0107c |
|
Subgrupo resistente al tratamiento con citocinas |
N=126 (35%) |
N=125 (35%) |
||
|
Mediana, meses (IC 95%) |
12,1 (10,1, 13,9) |
6,5 (6,3, 8,3) |
0,464 (0,318. 0,676) |
<0,0001c |
|
OS Mediana, meses (IC 95%) |
20,1 (16,7, 23,4) |
19,2 (17,5, 22,3) |
0,97 (0,80, 1,17) |
0,374 |
|
Tasas de respuesta objetiva |
N= 361 |
N= 362 |
||
|
% |
19,4 |
9,4 |
2,056d |
0,0001e |
|
(IC 95%) |
(15,4, 23,9) |
(6,6, 12,9) |
(1,408, 3,003) |
|
|
IC: intervalo de confianza; HR: razón de riesgos instantáneos (axitinib/sorafenib); ITT: intención de tratar; OS: sobrevida general; PFS: supervivencia sin progresión. aTiempo desde la asignación aleatoria hasta la progresión o muerte debido a cualquier causa, lo que ocurra primero. bEvaluado mediante revisión radiológica independiente de acuerdo con criterios RECIST cValor p unilateral obtenido de una prueba de rango logarítmico de tratamiento estratificada por estado de desempeño ECOG y terapia previa (la comparación se considera estadísticamente significativa si el valor p unilateral es <0,023) dLa razón de riesgos se utiliza para ORR. Una razón de riesgos >1 indica una probabilidad mayor de respuesta en el grupo de axitinib; una razón de riesgos <1 indica una probabilidad mayor de responder en el grupo de sorafenib eValor p unilateral obtenido a partir de la prueba log-rank de tratamiento estratificado mediante estado de desempeño ECOG y terapia previa. f Se utiliza el índice de proporción para ORR. Un índice de proporción >1 indicó una mayor probabilidad de respuesta en el grupo de axitinib: un índice de proporción <1 indicó una mayor probabilidad de respuesta en el grupo de sorafenib. g Valor p unilateral obtenido a partir de la prueba de Cochran-Mantel-Haenzel de tratamiento estratificado mediante estado rendimiento ECOG y terapia previa. |
||||
Figura 1. Curva de Kaplan-Meier para supervivencia libre de progresión mediante evaluación independiente para la población general.
CONTRAINDICACIONES: En pacientes con hipersensibilidad al axitinib o a algún otro constituyente del INLYTA® Tabletas recubiertas. Hipertensión arterial no controlada. El producto solo debe ser administrado bajo estricta vigilancia médica. Este producto no debe ser administrado durante el embarazo o cuando se sospeche su existencia, ni durante el periodo de lactancia, a menos que a criterio médico el balance riesgo beneficio sea favorable. No exceder la dosis prescrita.
FERTILIDAD, EMBARAZO Y LACTANCIA
Fertilidad: Con base en los resultados no clínicos, axitinib tiene el potencial de afectar la función reproductora y la fertilidad en los humanos. (Ver sección Datos preclínicos de seguridad).
Mujeres en edad de procrear: Debe advertirse a las mujeres en edad de procrear que eviten quedar embarazadas mientras estén recibiendo axitinib.
Embarazo: Axitinib puede producir lesión fetal cuando se administra a una mujer embarazada. Los estudios en ratones hembra embarazados han demostrado que axitinib produce efectos tóxicos al feto. (Ver sección Datos preclínicos de seguridad).
No existen estudios adecuados y bien controlados en mujeres embarazadas utilizando axitinib. Debe advertirse a las mujeres en edad de procrear que eviten quedar embarazadas mientras estén recibiendo axitinib. Si este medicamento se utiliza durante el embarazo o si una paciente queda embarazada mientras está recibiendo este medicamento, la paciente deberá ser advertida del posible peligro para el feto.
Lactancia: No se ha realizado ningún estudio en humanos para evaluar el efecto de axitinib sobre la producción de leche, su presencia en la leche materna o su efecto sobre el lactante. Se desconoce si el medicamento se elimina en la leche materna.
Debido a que muchos medicamentos son comúnmente distribuidos en la leche materna y al potencial de reacciones adversas serias en lactantes por la exposición a axitinib, debe tomarse la decisión si interrumpir la lactancia o interrumpir axitinib, teniendo en cuenta la importancia del medicamento para la madre.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y OPERAR MÁQUINAS: No se ha realizado ningún estudio sobre el efecto de axitinib sobre la capacidad para conducir y operar máquinas. Debe advertirse a los pacientes que podrían experimentar efectos como mareos o fatiga durante el tratamiento con axitinib.
EFECTOS ADVERSOS: La seguridad de axitinib se ha evaluado en 699 pacientes en estudios de monoterapia, que incluyeron 537 pacientes con CCR avanzado. Los datos descritos a continuación reflejan la exposición a axitinib a 359 pacientes con CCR avanzado que participaron en el estudio clínico aleatorizado.
La duración media del tratamiento fue 6,4 meses (intervalo 0,03 a 22,0) para pacientes que recibieron axitinib. Las modificaciones de la dosis o el retraso temporal del tratamiento debido a un evento adverso ocurrió en 199/359 pacientes (55%) que estaban recibiendo axitinib. La interrupción permanente ocurrió debido a un evento adverso en 33/359 pacientes (9%) que estaban recibiendo axitinib.
Las reacciones adversas más frecuentes (=20%) observadas después del tratamiento con axitinib fueron: diarrea, hipertensión, fatiga, disminución del apetito, náuseas, disfonía, síndrome de eritrodisestesia palmo-plantar (mano-pies), pérdida de peso, vómitos, abstemia y estreñimiento.
Los siguientes riesgos, incluida la acción apropiada a realizar, se discuten con mayor detalle en la sección Advertencias especiales y precauciones especiales de utilización: Eventos de insuficiencia cardiaca, hipertensión, disfunción tiroidea, eventos tromboembólicos arteriales, eventos tromboembólicos venosos, elevación de la hemoglobina o hematocrito, hemorragia, perforación gastrointestinal y formación de fístulas, complicaciones de cicatrización de heridas, síndrome de leucoencefalopatía posterior reversible, proteinuria y elevación de las enzimas hepáticas.
La Tabla 1 presenta las reacciones adveras reportadas en pacientes que recibieron axitinib.
Las reacciones adversas se listan por clase de sistema de órganos, categoría de frecuencia y grado de severidad. Las categorías de frecuencia se definen como: muy frecuentes (=1/10), frecuentes (=1/100 a <1/10), poco frecuentes (=1/1.000 a <1/100), raras (=1/10.000 a <1/1000), muy raras (<1/10.000) frecuencia desconocida (no se puede estimar a partir de los datos disponibles).
|
Tabla 1. Reacciones adversas informadas en el estudio de CCR en pacientes que recibieron axitinib |
||||
|
Clase de Sistema de Órganos |
Categoría de Frecuencia |
Reacción adversaa |
Axitinib (n=359) |
|
|
Todos los Gradosb |
Grado =3 |
|||
|
% |
% |
|||
|
Trastornos del sistema sanguíneo y linfático |
Frecuentes |
Anemia |
3,6 |
0,6 |
|
Poco frecuentes |
Policitemia |
0,8 |
0,3 |
|
|
Trastornos cardiacos |
Frecuentes |
Eventos de insuficiencia cardiaca |
1,8 |
1,3 |
|
Trastornos endocrinos |
Muy frecuentes |
Hipotiroidismo |
19,2 |
0,3 |
|
Frecuentes |
Hipertiroidismo |
1,1 |
0 |
|
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Disminución del apetito |
34,0 |
5,0 |
|
Frecuentes |
Deshidratación |
6,4 |
3,6 |
|
|
Hipercalemia |
3,1 |
1,4 |
||
|
Hipercalcemia |
2,8 |
0,3 |
||
|
Trastornos del sistema nervioso |
Muy frecuentes |
Disgeusia |
10,6 |
0 |
|
Cefalea |
13,6 |
0,6 |
||
|
Frecuentes |
Mareo |
9,2 |
0,6 |
|
|
Poco frecuentes |
Ataque isquémico transitorio |
0,8 |
0,8 |
|
|
Síndrome de leucoencefalopatía posterior reversible |
0,3 |
0,3 |
||
|
Trastornos del oído y el laberinto |
Frecuentes |
Tinitus |
3,1 |
0 |
|
Trastornos vasculares |
Muy frecuentes |
Hipertensión |
40,4 |
15,6 |
|
Hemorragia |
16,2 |
1,7 |
||
|
Frecuentes |
Eventos trombóticos y embólicos venosos |
3,1 |
2,8 |
|
|
Eventos trombóticos y embólicos arteriales |
1,4 |
1,4 |
||
|
Poco frecuentes |
Crisis hipertensiva |
0,6 |
0,6 |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Muy frecuentes |
Disfonía |
30,9 |
0 |
|
Tos |
15,3 |
0,8 |
||
|
Disnea |
14,8 |
2,5 |
||
|
Trastornos gastrointestinales |
Muy frecuentes |
Diarrea |
54,9 |
10,6 |
|
Náuseas |
32,3 |
2,5 |
||
|
Vómito |
23,7 |
3,3 |
||
|
Estreñimiento |
20,3 |
1,1 |
||
|
Estomatitis |
15,0 |
1,4 |
||
|
Dolor abdominal |
14,2 |
2,2 |
||
|
Dispepsia |
10,0 |
0 |
||
|
Frecuentes |
Dolor abdominal superior |
8,1 |
0,8 |
|
|
Hemorroides |
4,2 |
0 |
||
|
Poco frecuentes |
Perforación gastrointestinal y fístulasf |
0,8 |
0 |
|
|
Trastornos hepatobiliares |
Poco frecuentes |
Hiperbilirrubinemia |
0,8 |
0,3 |
|
Trastornos cutáneos y del tejido subcutáneo |
Muy frecuentes |
Eritrodisestesia palmo-plantar (Síndrome mano-pie) |
27,3 |
5,0 |
|
Exantema |
12,5 |
0,3 |
||
|
Piel seca |
10,0 |
0 |
||
|
Frecuentes |
Prurito |
6,7 |
0 |
|
|
Alopecia |
3,9 |
0 |
||
|
Eritema |
2,2 |
0 |
||
|
Trastornos musculoesqueléticos y del tejido conectivo |
Muy frecuentes |
Artralgia |
15,0 |
1,9 |
|
Dolor en las extremidades |
12,5 |
0,6 |
||
|
Frecuentes |
Mialgia |
7,0 |
0,8 |
|
|
Trastornos renales y urinarios |
Muy frecuentes |
Proteinuria |
10,9 |
3,1 |
|
Trastornos generales y condiciones en el sitio de administración |
Muy frecuentes |
Fatiga |
39,0 |
11,4 |
|
Astenia |
20,6 |
5,3 |
||
|
Inflamación de las mucosas |
15,3 |
1,4 |
||
|
Investigaciones |
Muy frecuentes |
Pérdida de peso |
24,8 |
2,2 |
|
Frecuentes |
Aumento de la creatinina |
2,8 |
0,3 |
|
|
Aumento de la lipasa |
2,5 |
0,6 |
||
|
Aumento de la alanina aminotransferasa |
2,2 |
0,3 |
||
|
Aumento de la fosfatasa alcalina |
1,9 |
0,3 |
||
|
Aumento de la amilasa |
1,7 |
0 |
||
|
Aumento de espartato aminotransferasa |
1,1 |
0,3 |
||
|
a Se listan las reacciones adversas según la frecuencia, surgida del tratamiento y por cualquier causa. b Criterios de terminología común para eventos adversos del Instituto Nacional de Cáncer, Versión 3.0 c Los eventos de insuficiencia cardiaca incluyen los siguientes términos preferidos (todos los grados de frecuencia): insuficiencia cardiaca (0,7%), insuficiencia cardiaca congestiva (0,3%), insuficiencia cardiopulmonar (0,3%), disfunción del ventrículo izquierdo (0,3%), disminución de la fracción de eyección (0,1%) e insuficiencia ventricular derecha (0,1%). Las frecuencias se basaron en estudios sobre el tratamiento de pacientes con CCR avanzado (n=672). d La hemorragia incluye los siguientes términos preferidos (por frecuencia de todos los grados): epistaxis (6,1%), hematuria (3,3%), hemoptisis (2,2%), hemorragia rectal (2,2%), hemorragia cerebral (0,3%), hemorragia gástrica (0,3%) y hemorragia gastrointestinal inferior (0,3%). e Los eventos trombóticos y embólicos venosos incluyen los siguientes términos preferidos (por frecuencia de todos los grados): embolia pulmonar (1,9%), oclusión/trombosis de las venas retinianas (0,6%) y trombosis de vena profunda (0,6%). f Los eventos trombóticos y embólicos arteriales incluyen los siguientes términos preferidos (por frecuencia de todos los grados): ataque isquémico transitorio (0,8%) y accidente cerebrovascular (0,3%). En estudios de monoterapia con axitinib también se informó infarto del miocardio (0,1%). g La perforación gastrointestinal y las fístulas incluyen los siguientes términos preferidos (por frecuencia de todos los grados): fístulas (0,3%), fístulas anales (0,3%) y perforación gastrointestinal (0,3%). |
||||
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN
Los datos in vitro indican que axitinib se metaboliza principalmente por CYP3A4/5 y, en un menor grado, por CYP1A2, CYP2C19 y por uridina difosfato-glucuronosiltransferasa (UGT) 1A1.
Inhibidores de CYP3A4/5: El ketoconazol, un inhibidor fuerte de CYP3A4/5, administrado a una dosis de 400 mg una vez al día durante 7 días, aumentó al doble el área bajo la curva (ABC) media y a 1,5 veces la Cmáx de una única dosis oral de 5 mg de axitinib en voluntarios sanos. La coadministración de axitinib con inhibidores fuertes de CYP3A4/5 (por ejemplo ketoconazol, itraconazol, claritromicina, atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, y telitromicina) puede aumentar las concentraciones plasmáticas de axitinib. La toronja puede también aumentar las concentraciones plasmáticas de axitinib. Se recomienda la selección de medicamentos concomitantes con ningún potencial o un potencial mínimo de inhibición de CYP3A4/5. Si un inhibidor fuerte de CYP3A4/5 debe coadministrarse, deberá considerarse el ajuste de la dosis de axitinib. (Ver sección Posología y método de administración).
Inductores de CYP3A4/5: La rifampicina, un inhibidor fuerte de CYP3A4/5, administrado a una dosis de 600 mg una vez al día durante 9 días, redujo el ABC media en un 79% y la Cmáx en un 71% de una única dosis de 5 mg de axitinib en voluntarios sanos. La coadministración de axitinib con inductores fuertes de CYP3A4/5, (por ejemplo rifampicina, dexametasona, fenitoína, carbamazepina, rifabutina, rifapentina, fenobarbital e Hypericum perforatum también conocido como [La Hierba de San Juan]) puede disminuir las concentraciones plasmáticas de axitinib8 Se recomienda la selección de medicamentos concomitantes sin ningún potencial o un potencial mínimo de inducción de CYP3A4/5. Si un inductor fuerte de CYP3A4/5 debe coadministrarse, deberá considerarse el ajuste de la dosis de axitinib. (Ver sección Posología y método de administración).
Estudios in vitro de inhibición e inducción de CYP y UGT: Los estudios in vitro indican que axitinib no inhibe CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5, o UGT1A1 a concentraciones plasmáticas terapéuticas.
Los estudios in vitro indicaron que axitinib tiene potencial para inhibir CYP1A2. Por lo tanto, la coadministración de axitinib con sustratos de CYP1A2 puede aumentar las concentraciones plasmáticas de sustratos de CYP1A2 (por ejemplo teofilina).
Los estudios in vitro indicaron también que axitinib tiene el potencial de inhibir CYP2C8. Sin embargo, la coadministración de axitinib con paclitaxel, un sustrato conocido de CYP2C8, no produjo un aumento de las concentraciones plasmáticas de paclitaxel en pacientes con cáncer avanzado, lo que indica ausencia de inhibición clínica de CYP2C8.
Los estudios in vitro en hepatocitos humanos también indicaron que axitinib no induce CYP1A1, CYP1A2, o CYP3A4/5. Por lo tanto no se espera que la coadministración de axitinib reduzca la concentración plasmática de sustratos CYP1A1, CYP1A2, o CYP3A4/5 coadministrados in vivo.
Estudios in vitro con la glicoproteína P: Los estudios in vitro indican que axitinib inhibe la glicoproteína P. Sin embargo, no se espera que axitinib inhiba la glicoproteína P a concentraciones plasmáticas terapéuticas. Por lo tanto, no se espera que la coadministración de axitinib aumente la concentración plasmática de digoxina u otros sustratos de la glicoproteína P in vivo.
DATOS PRECLÍNICOS DE SEGURIDAD
Carcinogenicidad: No se han realizado estudios de carcinogenicidad con axitinib.
Genotoxicidad: Axitinib fue sometido a prueba utilizando una serie de ensayos toxicológicos genéticos que se componían de ensayos de mutación bacteriana inversa in vitro (Ames), aberración cromosómica de linfocitos humanos y ensayos de micronúcleos de médula ósea de ratón in vivo. Axitinib no fue mutagénico o clastogénico en estos ensayos.
Deterioro de la fertilidad: Axitinib tiene el potencial para deteriorar la función reproductora y la fertilidad en los humanos. Se observaron hallazgos en las vías reproductoras masculinas en los testículos/epidídimos (disminución del peso del órgano, atrofia o degeneración, disminución de células germinales, hipospermia o formas anormales de esperma) a =100 mg/kg/día en ratones (aproximadamente 306 veces el ABC a la dosis inicial recomendada para humanos) y =3 mg/kg/día en perros (aproximadamente 0,5 veces el ABC a la dosis inicial recomendada para los humanos) Los resultados para las vías reproductoras femeninas en los ratones y los perros incluyeron signos de retraso de la madurez sexual, reducción o ausencia de cuerpos lúteos, disminución de los pesos uterinos y atrofia uterina a =10 mg/kg/día (aproximadamente equivalente al ABC a la dosis inicial recomendada para los humanos).
Axitinib no afectó el apareamiento o la fertilidad en ratones machos a ninguna dosis probada de hasta 100 mg/kg/día. Sin embargo, la reducción de los pesos testiculares, la densidad del esperma y el recuento fueron observados a 30 mg/kg/día (aproximadamente 72 veces el ABC a la dosis inicial recomendada para los humanos) después de al menos 70 días de tratamiento con axitinib. Ningún efecto reproductor adverso masculino en los ratones fue observado a 10 mg/kg/día (aproximadamente 21 veces el ABC a la dosis inicial recomendada para los humanos). En los ratones hembra, se observó reducción de la fertilidad y la viabilidad embriónica a todas las dosis probadas. (=30 mg/kg/día) después de al menos 15 días de tratamiento con axitinib (aproximadamente 64 veces el ABC a la dosis inicial recomendada para los humanos).
Toxicidad para el desarrollo: Los ratones embarazados expuestos a axitinib a una dosis oral de 3 mg/kg/día (aproximadamente 3 veces el ABC a la dosis inicial recomendada para los humanos), mostraron aumento en la ocurrencia de paladar hendido y variaciones frecuentes en la osificación esquelética. Ninguna alteración fetal fue observada en ratones a la dosis de 1 mg/kg/día (aproximadamente equivalente al ABC a la dosis inicial recomendada para los humanos).
Estudios de toxicidad en animales jóvenes: Se observó displasia fisaria en ratones y perros inmaduros que recibieron axitinib a dosis de =30 mg/kg/día durante al menos 1 mes (aproximadamente 37 veces el ABC a la dosis inicial recomendada para los humanos); la incidencia y severidad estuvo relacionada con la dosis y los efectos fueron reversibles cuando se interrumpía el tratamiento. Se observaron caries dentales en ratones tratados durante al menos 1 mes a dosis de axitinib de >10 mg/kg/día (aproximadamente 9 veces el ABC a la dosis inicial recomendada para los humanos); los hallazgos residuales, indicadores de reversibilidad parcial, fueron observados cuando se interrumpía el tratamiento. Para displasia fisaria, no se observó ningún efecto a concentraciones de 10 mg/kg/día en ratones (aproximadamente 8 veces el ABC a la dosis inicial recomendada para los humanos) y a 10 mg/kg/día en perros (aproximadamente equivalente al ABC a la dosis inicial recomendada para los humanos) en animales que recibieron axitinib durante un mes. No se definió ningún nivel de efecto para caries de los incisivos en ratones. Otras toxicidades de posible preocupación para pacientes pediátricos no se han evaluado en animales jóvenes.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá – Colombia.
INLYTA® 1 mg Tabletas Recubiertas (Reg. San. INVIMA 2013M-0014412).
INLYTA® 5 mg Tabletas Recubiertas (Reg. San. INVIMA 2013M-0014373).
Título del Documento de Producto: Axitinib
Fecha de CDS reemplazado: 13 de Septiembre de 2013
Fecha efectiva: 10 de Enero de 2014
CDS versión: 6.0
LLD_Axit_Col_10Ene2014_CDSv6.0_Cambio 1_Auto No. 2014006462, 2014006556
PFIZER S.A.S.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES ESPECIALES PARA LA UTILIZACIÓN
Eventos de insuficiencia cardiaca: En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, se informaron eventos de insuficiencia cardiaca (insuficiencia cardiaca, insuficiencia cardiopulmonar, disfunción del ventrículo izquierdo e insuficiencia del ventrículo derecho, incluidos) en 6/359 pacientes (1,7%) a los que se les administró axitinib. Se observaron eventos de insuficiencia cardiaca de Grado 3/4 en 2/359 pacientes (0,6%) a los que se les administró axitinib. Se informó insuficiencia cardiaca mortal en 2/359 pacientes a los que se les administró axitinib.
En los estudios clínicos con axitinib para el tratamiento de pacientes con CCR, se informaron eventos de insuficiencia cardiaca (insuficiencia cardiaca, insuficiencia cardiaca congestiva, insuficiencia cardiopulmonar, disfunción del ventrículo izquierdo, disminución de la fracción de eyección e insuficiencia del ventrículo derecho, incluidos) en 12/672 pacientes (1,8%) a los que se les administró axitinib. Se informaron eventos de insuficiencia cardiaca de Grado 3/4 en 7/672 pacientes (1,0%) y eventos de insuficiencia cardiaca mortal en 2/672 pacientes (0,3%) a los que se les administró axitinib.
Monitorizar en busca de signos de síntomas de insuficiencia cardiaca periódicamente durante el tratamiento con axitinib. El tratamiento de eventos de insuficiencia cardiaca puede requerir la interrupción temporal o permanente o la reducción de la dosis de tratamiento de axitinib.
Hipertensión: En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, se reportó hipertensión en 145/359 pacientes (40%) que estaban recibiendo axitinib. Se observó hipertensión Grado 3 en 55/359 pacientes (15%) que estaban recibiendo axitinib e hipertensión Grado 4 en 1/359 pacientes (<1%) que estaban recibiendo axitinib. Se reportó crisis de hipertensión en 2/359 pacientes (<1%) que estaban recibiendo axitinib. El tiempo medio de inicio para hipertensión (tensión arterial sistólica >150 mmHg o tensión arterial diastólica >100 mmHg) estuvo dentro del primer mes del inicio del tratamiento con axitinib y se han observado aumentos en la presión sanguínea ya a los 4 días después de haber comenzado con axitinib. La hipertensión se trató con terapia antihipertensiva estándar. La interrupción del tratamiento con axitinib debido a hipertensión ocurrió en 1/359 pacientes (<1%) que estaban recibiendo axitinib.
La tensión arterial debe estar bien controlada antes de iniciar el tratamiento con axitinib. Los pacientes deben controlarse con relación a la hipertensión y someterse a tratamiento según sea necesario con el tratamiento antihipertensivo estándar. En el caso de hipertensión persistente a pesar de la utilización de medicamentos antihipertensivos, la dosis de axitinib deberá reducirse. Para pacientes que desarrollan hipertensión severa, el tratamiento con axitinib deberá interrumpirse temporalmente y reiniciarlo a una dosis más baja una vez el paciente sea normotenso. (Ver sección Posología y método de administración). Si axitinib se interrumpe, los pacientes que están recibiendo medicamentos antihipertensivos deberán controlarse con relación al desarrollo de hipotensión.
Disfunción tiroidea: En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, el hipotiroidismo se reportó en 69/359 pacientes (19%) que estaban recibiendo axitinib. Se informó hipotiroidismo en 4/359 pacientes (1%) que estaban recibiendo tratamiento con axitinib. En pacientes que tenían la tirotropina (TSH) <5 µU/mL antes del tratamiento, las elevaciones de TSH a = 10 µU/mL ocurrieron en 79/245 pacientes (32%) que estaban recibiendo tratamiento con axitinib.
Antes del inicio del tratamiento con axitinib deberá controlarse la función tiroidea y periódicamente durante el tratamiento. El hipotiroidismo y el hipertiroidismo deben tratarse de acuerdo con la práctica médica estándar para mantener el estado eutiroideo.
Eventos tromboembólicos arteriales: En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, se informaron eventos tromboembólicos arteriales Grado 3/4 en 4/359 pacientes (1%) bajo tratamiento con axitinib.
El evento tromboembólico arterial más frecuente fue el ataque isquémico transitorio (1%). Se informó un accidente cerebrovascular mortal en 1/359 pacientes (<1%) que recibían axitinib.
En estudios de monoterapia con axitinib, los eventos tromboembólicos arteriales (incluido el ataque isquémico transitorio, accidente cerebrovascular, el infarto del miocardio y oclusión de la arteria retiniana) fueron reportados en 16/699 pacientes (2%) que estaban recibiendo axitinib.
Axitinib debe utilizarse con precaución en pacientes que están en riesgo de estos eventos o que presentan antecedentes de estos eventos. Axitinib no se ha estudiado en pacientes que tienen eventos tromboembólicos arteriales dentro de los 12 meses previos.
Eventos tromboembólicos venosos: En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, se informaron eventos tromboembólicos venosos en 11/359 pacientes (3%) que estaban recibiendo tratamiento con axitinib. Se informaron eventos tromboembólicos venosos Grado 3/4 en 9/359 pacientes (3%) que estaban recibiendo tratamiento con axitinib (incluida embolia pulmonar, trombosis de vena profunda y oclusión/trombosis de vena retiniana). Se informó embolia pulmonar fatal en 1/359 pacientes (<1%) que estaban recibiendo axitinib.
Axitinib se debe utilizar con precaución en pacientes que están en riesgo de estos eventos o que tienen antecedentes de estos eventos. Axitinib no se ha estudiado en pacientes que habían presentado eventos tromboembólicos venosos dentro de los 6 meses previos.
Elevación de la hemoglobina o el hematocrito: Los aumentos en la hemoglobina o hematocrito, como reflejo de aumentos en la masa de los glóbulos rojos, puede presentarse durante el tratamiento con axitinib. Un aumento en la masa de los glóbulos rojos puede aumentar el riesgo de eventos tromboembólicos.
El aumento de la hemoglobina por encima del límite superior de normalidad se observó en 31/320 pacientes (10%) que estaban recibiendo axitinib. Antes de iniciar el tratamiento con axitinib, deberá controlarse la hemoglobina y hematocrito y periódicamente durante el tratamiento. Si la hemoglobina o el hematocrito aumentan por encima del nivel normal, los pacientes deberán tratarse de acuerdo con la práctica médica estándar para disminuir la hemoglobina o hematocrito a un nivel aceptable.
Hemorragia: En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, en el que los pacientes con metástasis cerebral no tratada fueron excluidos, los eventos hemorrágicos fueron reportados en 58/359 pacientes (16%) que estaban recibiendo tratamiento con axitinib. Los eventos hemorrágicos más frecuentes en los pacientes tratados con axitinib fueron epistaxis (6%), hematuria (3%), hemoptisis (2%) y hemorragia rectal (2%). Los eventos hemorrágicos Grado 3/4 fueron reportados en 5/359 de los pacientes (1%) que estaban recibiendo tratamiento con axitinib (incluidos hemorragia cerebral, hematuria, hemoptisis, hemorragia gastrointestinal inferior y melena). La hemorragia fatal fue informada en 1/359 pacientes (<1%) que estaban recibiendo tratamiento con axitinib (hemorragia gástrica).
Axitinib no se ha estudiado en pacientes que presentan evidencia de metástasis cerebral no tratada o hemorragia gastrointestinal activa reciente y no se debe utilizar en estos pacientes. Si alguna hemorragia que requiere intervención médica se presenta, deberá interrumpirse temporalmente la dosis de axitinib.
Perforación gastrointestinal y formación de fístulas: En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, la perforación gastrointestinal fue informada en 1/359 pacientes (<1%) que estaban recibiendo tratamiento con axitinib. Además de casos de perforación gastrointestinal, se informaron fístulas en 2/359 pacientes (1%) que recibían axitinib como tratamiento. En los estudios con monoterapia con axitinib (N=699), se informó perforación gastrointestinal fatal en 1/699 pacientes (<1%).
Los pacientes deberán controlarse con relación a síntomas de perforación gastrointestinal durante el tratamiento con axitinib.
Complicaciones de la cicatrización de heridas: No se ha realizado ningún estudio formal del efecto de axitinib sobre la cicatrización de heridas.
El tratamiento con axitinib se deberá interrumpir al menos 24 horas antes de una cirugía programada. La decisión de reasumir el tratamiento con axitinib después de la cirugía deberá basarse en el criterio clínico de cicatrización adecuada de la herida.
Síndrome de leucoencefalopatía posterior reversible: En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, el síndrome de leucoencefalopatía posterior reversible (SLPR) se informó en 1/359 pacientes (<1%) que estaban recibiendo axitinib. El SLPR es un trastorno neurológico que puede presentarse con cefalea, convulsiones, letargia, confusión, ceguera y otras alteraciones visuales y neurológicas. La hipertensión leve a severa puede estar presente. Las imágenes de resonancia magnética son necesarias para confirmar el diagnóstico del SLPR. En pacientes con signos/síntomas de SLPR, deberá interrumpirse temporal o permanentemente el tratamiento con axitinib. La seguridad de reiniciar el tratamiento con axitinib en pacientes que experimentaron previamente SLPR se desconoce.
Proteinuria: En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, la proteinuria se informó en 39/359 pacientes (11%) que estaban recibiendo axitinib. La proteinuria Grado 3 fue informada en 11/359 pacientes (3%) que estaban recibiendo axitinib.
Se recomienda el monitoreo para proteinuria antes de iniciar el tratamiento con axitinib y periódicamente durante el tratamiento. Para los pacientes que desarrollan proteinuria moderada a severa, deberá reducirse la dosis o interrumpirse temporalmente el tratamiento con axitinib.
Elevación de las enzimas hepáticas: En un estudio clínico de determinación de la dosis, las elevaciones concurrentes de alanino aminotransferasa ALT (12 veces el límite superior de normalidad [LSN]) y de bilirrubina (2,3 veces el LSN), consideradas hepatoxicidades relacionadas con el medicamento, se observaron en 1 paciente que recibió axitinib a una dosis inicial de 20 mg dos veces al día (4 veces la dosis de inicio recomedada). En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, no se observaron elevaciones concurrentes de la alanino aminotransferasa (ALT) (>3 veces el límite superior de normalidad [LSN]) y de bilirrubina (>2 veces el LSN) para axitinib (N=359).
Se deberán controlar las pruebas de función hepática antes de iniciar el tratamiento con axitinib y periódicamente durante el tratamiento.
Insuficiencia hepática: En los estudios clínicos con axitinib, la exposición sistémica al axitinib fue aproximadamente dos veces mayor en pacientes con insuficiencia hepática moderada (Child-Pugh Clase B) comparada con los pacientes con función hepática normal.
La dosis de axitinib se debe disminuir si se utiliza en pacientes con insuficiencia hepática moderada (Child-Pugh Clase B). Axitinib no se ha estudiado en pacientes con insuficiencia hepática severa (Child-Pugh Clase C).
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN
Posología: La dosis oral inicial recomendada de axitinib es 5 mg dos veces al día. Axitinib se puede tomar con o sin alimento.
Si el paciente vomita u olvida tomar una dosis, no deberá tomarse una dosis adicional. La siguiente dosis prescrita deberá tomarse a la hora usual.
Ajustes de la dosis: El aumento o la reducción de la dosis se recomiendan con base en la seguridad y tolerabilidad individual.
Los pacientes que toleran la dosis inicial de 5 mg dos veces al día de axitinib sin presentar reacciones adversas mayores a Grado 2 según los Criterios de Eventos Adversos de Toxicidad Común (CTCAE) durante un periodo consecutivo de 2 semanas, son normotensos y no están recibiendo medicamentos antihipertensivos, pueden tener aumentos de la dosis a 7 mg dos veces al día. Posteriormente, utilizando los mismos criterios, los pacientes que toleran la dosis de axitinib de 7 mg dos veces al día, pueden someterse a un aumento de la dosis hasta máximo 10 mg dos veces al día.
El manejo de algunas reacciones adversas medicamentosas puede requerir la interrupción temporal o permanente y/o la reducción de la dosis del tratamiento con axitinib. Cuando es necesaria la reducción de la dosis, puede reducirse a 3 mg dos veces al día e incluso 2 mg dos veces al día.
No se requiere ajuste de la dosis con base en la edad, raza, sexo o peso corporal de paciente.
Administración concomitante con inhibidores fuertes de CYP3A4/5: La coadministración de axitinib con inhibidores fuertes de CYP3A4/5 (por ejemplo ketoconazol, itraconazol, claritromicina, atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, y telitromicina) puede aumentar las concentraciones plasmáticas de axitinib. La toronja puede también aumentar las concentraciones plasmáticas de axitinib. Se recomienda seleccionar un medicamento concomitante alterno sin ningún potencial o un potencial mínimo de inhibición de CYP3A4/5. Aunque el ajuste de la dosis de axitinib no se ha estudiado en pacientes que están recibiendo inhibidores fuertes de CYP3A4/5, si un inhibidor fuerte de CYP3A4/5 se debe coadministrar, deberá considerarse disminuir la dosis de axitinib a aproximadamente la mitad de la dosis (por ejemplo reducir la dosis inicial de 5 mg dos veces al día a 2 mg dos veces al día). Si se interrumpe la coadministración del inhibidor fuerte, deberá considerarse volver a la dosis de axitinib utilizada antes de iniciar el inhibidor fuerte de CYP3A4/5.
Administración Concomitante de Inductores Fuertes de CYP3A4/5: La coadministración de axitinib con inductores fuertes de CYP3A4/5 (por ejemplo rifampicina, dexametasona, fenitoína, carbamazepina, rifabutina, rifapentina, fenobarbital y Hypericum perforatum [conocido también como la Hierba de San Juan]) puede disminuir las concentraciones plasmáticas de axitinib. Se recomienda seleccionar un medicamento concomitante alterno que no posea potencial o que tenga un potencial mínimo de inducción de CYP3A4/5. Aunque no se ha estudiado ningún ajuste de la dosis de axitinib en pacientes que están recibiendo inductores fuertes de CYP3A4/5, si un inductor fuerte de CYP3A4/5 debe coadministrarse, deberá considerarse un aumento gradual de la dosis de axitinib. Si la dosis de axitinib se aumenta, se deberá controlar cuidadosamente al paciente con relación a posibles toxicidades. Si se interrumpe la coadministración del inductor fuerte, deberá retornarse inmediatamente a la dosis de axitinib utilizada antes del inicio del inductor fuerte de CYP3A4/5.
Uso pediátrico: No se ha establecido la seguridad y eficacia de axitinib en niños (<18 años). No se encuentran datos disponibles.
Utilización en ancianos: No se requiere ningún ajuste de la dosis (ver sección Propiedades farmacocinéticas).
Uso en insuficiencia hepática: No se requiere ningún ajuste de la dosis cuando se administra axitinib a pacientes con insuficiencia hepática leve (Child-Pugh clase A). Se recomienda una dosis inicial de 2 mg dos veces al día cuando se administra axitinib a pacientes con insuficiencia hepática moderada (Child-Pugh clase B) [ej: la dosis inicial deberá ser reducida de 5 mg 2 veces al día a 2 mg dos veces al día]. Axitinib no se ha estudiado en pacientes con insuficiencia hepática severa (Child-Pugh clase C).
Uso en insuficiencia renal: No se requiere ningún ajuste de la dosis (ver sección Propiedades farmacocinéticas).
SOBREDOSIS: No existe tratamiento específico para sobredosis para axitinib.
En un estudio clínico controlado con axitinib para el tratamiento de pacientes con CCR, un paciente recibió inadvertidamente una dosis de 20 mg dos veces al día durante 4 días y experimentó mareo (Grado 1).
En un estudio clínico de determinación de la dosis con axitinib, los pacientes que recibieron dosis iniciales de 10 mg dos veces al día o 20 mg dos veces al día experimentaron reacciones adversas que incluyeron hipertensión, crisis epilépticas asociadas con hipertensión y hemoptisis fatal.
En los casos de sospecha de sobredosis, axitinib debe suspenderse y deberá proporcionarse tratamiento de soporte.