
INCRUSE ELLIPTA
UMECLIDINIO
Inhalador
Caja, 1 Inhalador, 30 Dosis,
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
INCRUSE ELLIPTA 62.5 microgramos: Cada dosis administrada (la dosis que sale por la boquilla del inhalador) contiene 55 microgramos de umeclidinio (equivalentes a 65 microgramos de bromuro de umeclidinio). Esto corresponde a una dosis predispensada de 62.5 microgramos de umeclidinio (equivalentes a 74.2 microgramos de bromuro de umeclidinio).
INDICACIONES: INCRUSE ELLIPTA está indicado en el tratamiento broncodilatador de mantenimiento para aliviar síntomas asociados con Enfermedad Pulmonar Obstructiva Crónica (EPOC).
INCRUSE ELLIPTA en combinación con corticoesteroides inhalados/agonistas de los receptores beta2-adrenérgicos de acción prolongada (ICS/LABAs por sus siglas en inglés), está indicado para el mantenimiento del tratamiento broncodilatador de la Enfermedad Pulmonar Obstructiva Crónica (COPD por sus siglas en inglés, o EPOC en español).
DATOS FARMACÉUTICOS:
Lista de excipientes: Lactosa monohidratada (la cual contiene proteína de leche (12.5 miligramos de lactosa monohidratada por dosis).
Estearato de magnesio.
Incompatibilidades: No se han identificado incompatibilidades.
Vida útil: La fecha de caducidad se indica en el envase.
Vida útil durante su uso: Después de retirarse de la bandeja blíster, el producto puede almacenarse durante un período máximo de 6 semanas.
Anote en el espacio proveído en la etiqueta la fecha en que debe desechar el inhalador. La fecha se debe agregar tan pronto como el inhalador se ha extraído de la bandeja.
FARMACOCINÉTICA:
Absorción: Tras la administración por inhalación de umeclidinio en voluntarios sanos, la Cmáx ocurrió a los 5 a 15 minutos. La biodisponibilidad absoluta de umeclidinio inhalado fue, en promedio, 13% de la dosis, con una contribución insignificante de la absorciónoral. Después de la administración repetida de umeclidinio inhalado, se alcanzó el estado estable en los siguientes 7 a 10 días, con una acumulación de 1.5 a 2 veces mayor. La exposición sistémica a umeclidinio tras su administración inhalada fue proporcional a la dosis.
Distribución: Después de la administración intravenosa a sujetos sanos, el volumen medio de distribución era de 86 litros. La unión a proteínas plasmáticas in vitro en plasma humano fue, en promedio, de 89%.
Metabolismo: Estudios in vitro demostraron que umeclidinio experimenta un metabolismo mediado principalmente por la isoenzima CYP2D6 del citocromo P450, y es un substrato para el transportador de glicoproteína P(Pgp). Las principales vías metabólicas para umeclidinio son oxidativas (hidroxilación, O-desalquilación), seguidas de una conjugación (glucoronidación, etc.), dando como resultado una variedad de metabolitos, ya sea con una actividad farmacológica disminuida, o para los que aún no se ha establecido la actividad farmacológica. La exposición sistémica a los metabolitos es baja.
Interacciones farmacológicas: Umeclidinio es un sustrato del transportador de glicoproteína P(Pgp) y CYP2D6. Se evaluó el efecto que ejerce el inhibidor del transportador de P-gp, verapamilo (240 miligramos una vez al día), en la farmacocinética en estado establede umeclidinio en voluntarios sanos. No se observó que verapamilo ejerciera algún efecto en la Cmáx de umeclidinio. Se observó un aumento de aproximadamente 1.4 veces en el AUC de umeclidinio . Se evaluó el efecto que produce la falta del genotipo metabolizador lento de CYP2D6 en el perfil farmacocinético en estado estable de umeclidinio en voluntarios sanos (metabolizadores normales de CYP2D6 y metabolizadores lentos de CYP2D6). No se observaron diferencias clínicamente significativas en la exposición sistémica a umeclidinio (500 microgramos), después de la administración por inhalación de dosis diarias repetidas a sujetos normales y metabolizadores lentos de CYP2D6.
Eliminación: Después de la administración intravenosa, la depuración plasmática fue de 151 litros/hora. Tras la administración intravenosa, aproximadamente 58% de la dosis radiomarcada administrada (o 73% de la radioactividad recuperada) se excretó en las heces a las 192 horas después de la dosis. La eliminación urinaria representó 22% de la dosis radiomarcada administrada a las 168 horas (27% de la radiactividad recuperada). Después de la administración intravenosa, la excreción de material relacionado con el fármaco en heces indicó la existencia de secreción con la bilis. Tras la administración oral a sujetos sanos de sexo masculino, la radiactividad total se excretó principalmente en heces (92% de la dosis radiomarcada administrada o 99% de la radiactividad recuperada) a las 168 horas después de la dosis. Menos de 1% de la dosis administrada por vía oral (1% de la radiactividad recuperada) se excretó en orina, lo cual sugiere la existencia de una absorción insignificante después de la administración oral. La vida media de eliminación plasmática de umeclidinio tras su administración por inhalación durante 10 días fue, en promedio, de 19 horas, con una excreción de 3% a 4% del fármaco en forma inalterada en la orina en estado estable.
Poblaciones especiales depacientes:
Personas de edad avanzada: Un análisis farmacocinético poblacional demostró que el perfil farmacocinético de umeclidinio es similar entre pacientes con EPOC de 65 años de edad y mayores, y aquel los menores de 65 años de edad.
Insuficiencia renal: Los sujetos con insuficiencia renal grave (depuración de creatinina <30 mililitros/min) no mostraron indicios de un aumento en la exposición sistémica a umeclidinio (Cmáx y AUC), y no hubo indicios de una alteración en la unión a proteínas plasmáticas entre sujetos con insuficiencia renal grave y voluntarios sanos.
Insuficiencia hepática: Los sujetos con insuficiencia hepática moderada (Clase B de Child-Pugh) no mostraron evidencia de aumento en la exposición sistémica a umeclidinio (Cmáx y AUC), y no hubo indicios de una alteración en la unión a proteínas plasmáticas entre sujetos con insuficiencia hepática moderada y voluntarios sanos. Umeclidiniono ha sido evaluado en sujetos con insuficiencia hepática grave.
Otras características de pacientes:- Un análisis farmacocinético poblacional demostró que no se requiere ajustar la dosis de umeclidinio, con base en el efecto de la edad, raza, género, uso de corticosteroides inhalados o peso. Un estudio realizado en metabolizadores lentos de CYP2D6 no mostró indicios de un efecto clínicamente significativo de polimorfismo genético de CYP2D6 en la exposición sistémica a umeclidinio.
Estudios clínicos: Se evaluó la eficacia de INCRUSE ELLIPTA administrado una vez al día en dos estudios clínicos controlados con placebo, en pacientes adultos con un diagnóstico clínico de EPOC; un estudio de 12 semanas de duración (AC4115408) y un estudio de 24 semanas de duración (DB2113373).
Estudios controlados con placebo: En el estudio de 12 semanas de duración, INCRUSE ELLIPTA demostró mejorías estadísticamente significativas y clínicamente importantes en las medidas de la función pulmonar (tal como se definen por el cambio respecto al VEF1 basal en la Semana 12, que fue el criterio primario de valoración de eficacia, en comparación con placebo (véase la Tabla 1). Los efectos broncodilatadores observados con INCRUSE ELLIPTA, en comparación con el placebo, fueron evidentes después del primer día de tratamiento, y se mantuvieron durante el período de tratamiento de 12 semanas.
|
Tabla1. Criterio primario de valoración de eficacia en la Semana 12 (Estudio AC4115408) |
|||
|
VEF1 (L) |
|||
|
Diferencia con placebo |
|||
|
Basal (SD) |
Cambio desde la basal (SE) |
Diferencia en el tratamiento (CI95%) Valor p |
|
|
Estudio AC4115408 |
|||
|
INCRUSE ELLIPTA 62.5 mcg OD (n= 69) |
1.26 (0.57) |
0.12 (0.03) |
0.13 (0.05,0.20) <0.001 |
|
Placebo (n= 68) |
1.21 (0.43) |
-0.01 (0.03) |
- |
|
Abreviaturas: CI= intervalo de confianza; VEF1= volumen espiratorio forzado en 1 segundo; L= litros; mcg= microgramos; n= número aleatorizado al tratamiento; OD= una vez al día; SD= desviación estándar; SE= error estándar. |
|||
INCRUSE ELLIPTA demostró una mejoría estadísticamente significativa respecto al valor basal en la media ponderada del VEF1 durante 0-6 horas después de la administración en la Semana 12, en comparación con el placebo (0.17 litros (p<0.001)).
El porcentaje de pacientes que recibieron INCRUSE ELLIPTA, y que respondieron con una diferencia mínima clínicamente importante (MCID) de ≥1 unidad en el puntaje focal del Índice de Disnea Transicional (TDI) en la Semana 12, fue de 38% (24/64), en comparación con 15% (8/53) para el placebo. Las probabilidades de ser un respondedor vs. un no respondedor, de acuerdo con el TDI, fueron mayores de manera estadísticamente significativa para INCRUSE ELLIPTA, en comparación con placebo, en la Semana 12 (cociente de probabilidades de 3.4 (CI de 95% de 1.3, 8.4), p=0.009).
INCRUSE ELLIPTA demostró mejorías estadísticamente significativas, en comparación con el placebo, en el cambio respecto al valor basal en el puntaje total en la Semana 12 para el Cuestionario Respiratorio de St. George (SGRQ), una herramienta de medición específica del estado de salud (-7.90 unidades) (p<0.001). El porcentaje de pacientes que recibieron INCRUSE ELLIPTA, y que respondieron con una reducción de ≥4 unidades (MCID) en el puntaje total del SGRQ en la Semana 12, fue de 44% (28/63), en comparación con 26% (14/54) para el placebo. Las probabilidades de ser un respondedor vs. un no respondedor, de acuerdo con el SGRQ, fueron mayores de manera estadísticamente significativa para INCRUSE ELLIPTA, en comparación con placebo, en la Semana 12 (cociente de probabilidades de 2.44 (CI de 95% de 1.08, 5.50), p=0.032).
Además, un número significativamente menor de pacientes tratados con INCRUSE ELLIPTA requirieron salbutamol de rescate durante el período de tratamiento de 12 semanas, en comparación con los tratados con placebo (reducción media de 0.7 atomizaciones por día, y la diferencia del placebo fue estadísticamente significativa (p=0.025)).
En el estudio de 24 semanas de duración, INCRUSE ELLIPTA demostró mejorías estadísticamente significativas en la función pulmonar (tal como se definen por el cambio respecto al VEF1 basal en la Semana 24, que fue el criterio primario de valoración de eficacia, en comparación con placebo (véase la Tabla 2). Los efectos broncodilatadores observados con INCRUSE ELLIPTA, en comparación con el placebo, fueron evidentes después del primer día de tratamiento, y se mantuvieron durante el período de tratamiento de 24 semanas.
|
Tabla 2. Criterio primario de valoración de eficacia en la Semana 24 (Estudio DB2113373) |
|||
|
VEF1(L) |
|||
|
Diferencia con placebo |
|||
|
Basal (SD) |
Cambio desde el valor basal (SE) |
Diferencia en el tratamiento (CI95%) Valor p |
|
|
Estudio DB2113373 |
|||
|
INCRUSE ELLIPTA 62.5 mcg OD (n= 418) |
1.20 (0.49) |
0.12 (0.01) |
0.12 (0.08,0.16) <0.001 |
|
Placebo (n= 280) |
1.20 (0.47) |
0.00 (0.02) |
- |
|
Abreviaturas: CI= intervalo de confianza; VEF1= volumen espiratorio forzado en 1 segundo; L= litros; mcg= microgramos; n= número aleatorizado al tratamiento; OD= una vez al día; SD= desviación estándar; SE= error estándar. |
|||
INCRUSE ELLIPTA demostró una mejoría estadísticamente significativa respecto al valor basal en la media ponderada del VEF1 durante 0-6 horas después de la dosis en la Semana 24, en comparación con el placebo (0.15 litros; (p<0.001)).
Se demostraron mejorías estadísticamente significativas respecto al placebo en el puntaje focal de TDI en la Semana 24 para INCRUSE ELLIPTA (1.0 unidades) (p<0.001). El porcentaje de pacientes que recibieron INCRUSE ELLIPTA, y que respondieron con una diferencia mínima clínicamente importante (MCID) de ≥1 unidad en el puntaje focal de TDI en la Semana 24, fue de 53% (207/394), en comparación con 41% (106/260) para placebo. Las probabilidades de ser un respondedor vs. un no respondedor, de acuerdo con el TDI, fueron mayores de manera estadísticamente significativa para INCRUSE ELLIPTA, en comparación con placebo, en la Semana 24 (cociente de probabilidades de 1.6 (CI de
95% de 1.2, 2.3), p=0.002).
Para INCRUSE ELLIPTA también se demostraron mejorías estadísticamente significativas, en comparación con el placebo, en el cambio respecto a la línea basal en el puntaje total en la Semana 24 para el Cuestionario Respiratorio de St. George (SGRQ), una herramienta de medición específica del estado de salud (-4.69 unidades) (p≤0.001). El porcentaje de pacientes que recibieron INCRUSE ELLIPTA, y que respondieron con una reducción de ≥4 unidades (MCID) en el puntaje total del SGRQ en la Semana 24, fue de 44% (172/388), en comparación con 34% (86/254) para el placebo. Las probabilidades de ser un respondedor vs. un no respondedor, de acuerdo con el SGRQ, fueron mayores de manera estadísticamente significativa para INCRUSE ELLIPTA, en comparación con placebo, en la Semana 24 (cociente de probabilidades de 1.6 (CI de 95% de 1.2, 2.3), p=0.003).
El tratamiento con INCRUSE ELLIPTA disminuyó el riesgo de exacerbación de la EPOC, en comparación con el placebo (análisis del tiempo hasta la primera exacerbación; cociente de riesgo 0.6, CI 95%=0.4 a 1.0, reducción de riesgo de 40%).
Estudios adicionales de eficacia conducidos con INCRUSE ELLIPTA en combinación con RELVAR (furoato de fluticasona/vilanterol) 100/25 microgramos o ADVAIR (propionato de fluticasona/salmeterol) 250/50 microgramos en pacientes adultos con diagnóstico clínico de EPOC: En dos estudios de 12 semanas, controlados con placebo (200109 y 200110), la adición de INCRUSE ELLIPTA a RELVAR (100/25 microgramos) una vez al día, resultaron en mejoría estadísticamente significativa, e importante mejoría clínica en el objetivo primario VEF1 valle al Día 85 comparado con placebo mas RELVAR (124 mL (95% IC 93, 154, p<0.001) y 122 mL (95% IC 91, 152, p<0.001)).
En dos estudios de 12 semanas, controlados con placebo (AC4116135 y AC4116136), la adición de INCRUSE ELLIPTA a ADVAIR (250/50 microgramos) dos veces al día, resultaron en mejoría estadísticamente significativa, e importante mejoría clínica en el objetivo primario VEF1 valle al Día 85 comparado con placebo mas ADVAIR (147 mL (95% IC 107, 187, p<0.001) y 127 mL (95%IC 89, 164, p<0.001)).
En estos estudios no se identificaron nuevas reacciones adversas debidas al medicamento con la adición de INCRUSE ELLIPTA a RELVAR o ADVAIR.
Datos de seguridad preclínica: En estudios no clínicos con umeclidinio, los hallazgos fueron aquellos típicamente relacionados con la farmacología primaria de antagonistas de receptores muscarínicos y/o irritación local.
FARMACODINAMIA:
Mecanismo de acción: Umeclidinio es un antagonista de los receptores muscarínicos de acción prolongada (también de nominado anticolinérgico). Es un derivado de quinuclidina, un antagonista de los receptores muscarínicos con actividad en múltiples subtipos de receptores colinérgicos muscarínicos. Umeclidinio ejerce su actividad broncodilatadora mediante la inhibición competitiva de la unión de acetil colina con receptores colinérgicos muscarínicos en el músculo liso de las vías respiratorias. Presenta una baja reversibilidad in vitro en el subtipo M3 de receptores muscarínicos humanos, y acción de larga duración in vivo cuando se administra directamente en los pulmones en modelos preclínicos.
Efectos farmacodinámicos: En un estudio de eficacia clínica controlado con placebo, de 24 semanas de duración, INCRUSE ELLIPTA aumentó el volumen espiratorio forzado en un segundo (VEF1) después de la administración de la primera dosis en Día1, con una mejoría de 0.07 litros a los 15 minutos, en comparación con el placebo (p<0.001). El aumento desde el valor basal hasta el VEF1 máximo, durante las primeras 6 horas posterior es a la administración en el Día1, fue de 0.23 litros con INCRUSE ELLIPTA, en comparación con 0.11 litros para placebo. El aumento desde el valor basal hasta el VEF1 máximo, durante las primeras 6 horas posteriores a la administración en la Semana 24, fue de 0.23 litros con INCRUSE ELLIPTA, en comparacióncon 0.10 litros para placebo.
Efectos cardiovasculares: En un estudio del QT, controlado con placebo y moxifloxacino, y realizado en 103 voluntarios sanos, se evaluó el efecto que ejerce umeclidinio 500 microgramos en el intervalo QT. Tras la administración de dosis repetidas de umeclidinio 500 microgramos una vez al día durante 10 días, no se observaron efectos clínicamente relevantes en la prolongación del intervalo QT (corregido utilizando el método de Fridericia).
CONTRAINDICACIONES: Hipersensibilidad al Umeclidinio o a cualquier otro componente del producto.
INCRUSE ELLIPTA está contraindicado en pacientes con alergia grave a la proteína de la leche.
EMBARAZO Y LACTANCIA:
Fertilidad: No hay datos sobre los efectos de INCRUSE ELLIPTA en la fertilidad humana. Los estudios realizados en animales indican que INCRUSE ELLIPTA no ejerce efectos en la fertilidad (véase Información no clínica).
Embarazo: Existe una cantidad limitada de datos sobre el uso de INCRUSE ELLIPTA en mujeres embarazadas. Los estudios realizados en animales no indican la existencia de efectos perjudiciales, ya sea directos o indirectos, con respecto a una toxicidad en la reproducción (véase Información no clínica).
INCRUSE ELLIPTA sólo debe utilizarse durante el embarazo si el beneficio esperado para la madre justifica el posible riesgo para el feto.
Lactancia: Se desconoce si umeclidinio se excreta en la leche materna. No esposible excluir un riesgo para neonatos/lactantes amamantados.
Se debe tomar una decisión acerca de suspender la lactancia o suspender la terapia con INCRUSE ELLIPTA, tomando en consideración el beneficio de la lactancia para el niño y el de la terapia para la madre.
EFECTOS EN LA CAPACIDAD DE CONDUCIR Y OPERAR MAQUINARIA: No se han realizado estudios para investigar el efecto que ejerce INCRUSE ELLIPTA en el desempeño automovilístico o la capacidad de operar maquinaria. No se han observado efectos adversos asociados con INCRUSE ELLIPTA que pudieran afectar la capacidad de desempeñar tareas que requieran discernimiento, o habilidades motrices o cognitivas.
REACCIONES ADVERSAS:
Datos de estudios clínicos: Se evaluó el perfil de seguridad de umeclidinio apartir de aproximadamente 1700 pacientes con EPOC que recibieron dosis de 62.5 microgramos o mayores hasta por un año. Esto incluye a aproximadamente 600 pacientes que recibieron la dosis recomendada de 62.5 microgramos una vez al día.
En la siguiente tabla se presentan las reacciones adversas que se identificaron apartir de los cuatro estudios de eficacia y el estudio de seguridad a largo plazo (los cuales implicaron a aproximadamente 1400 pacientes que recibieron umeclidinio).
A continuación se presentan las Reacciones Adversas al Medicamento (RAM) por clase de sistema orgánico del MedDRA y por frecuencia. Se ha utilizado la siguiente convención para la clasificación de las reacciones adversas:
Muy comunes ≥1/10
Comunes ≥1/100 y <1/10
Poco comunes ≥1/1,000 y <1/100
Raras ≥1/10,000 y <1/1,000
Muy raras <1/10,000
|
MedDRA Clase de sistemas y órganos |
Reacción(es) adversa(s) |
Frecuencia |
|
Infecciones einfestaciones |
Infección de las vías urinarias Sinusitis Nasofaringitis Infección de las vías respiratorias superiores |
Común Común Común Comunes |
|
Trastornos cardiacos |
Fibrilación auricular Taquicardia supraventricular Taquicardia |
Poco comunes Poco comunes Común |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
Común |
|
Trastornos Gastrointestinales |
Estreñimiento Bocaseca |
Poco comunes Poco comunes |
Datos posteriores a la comercialización:
|
MedDRA Clase de sistemas y órganos |
Reacción(es) adversa(s) |
Frecuencia |
|
Trastornos sistema inmune |
Reacciones de hipersensibilidad incluyendo: Exantema, urticaria y prurito |
No común |
|
Anafilaxia, angioedema |
Raro |
|
|
Trastornos oculares |
Visión borrosa |
Raro |
|
Dolor de ojo |
Raro |
|
|
Glaucoma |
Raro |
|
|
Trastornos sistema nervioso |
Disgeusia |
Común |
|
Trastornos renales y urinarios |
Retenciónurinaria |
Raro |
|
Disuria |
Raro |
INTERACCIONES: Los datos clínicos disponibles no han revelado la existencia de interacciones farmacológicas clínicamente pertinentes (véase Farmacologíaclínica).
ADVERTENCIAS Y PRECAUCIONES: INCRUSE ELLIPTA está indicado en el tratamiento de mantenimiento de la EPOC. No debe utilizarse para el aliviode síntomas agudos, es decir, como terapia de rescate para el tratamiento de episodios agudos de bronco espasmo. Los síntomas agudos deben ser tratados con un broncodilatador de acción corta inhalado. El uso cada vez más frecuente de broncodilatadores de acción corta para aliviar síntomas indica un deterioro en el control, por lo cual los pacientes deben ser examinados por un médico.
Al igual que con otras terapias inhaladas, la administración de INCRUSE ELLIPTA puede producir broncoespasmo paradójico que podría poner en peligro la vida. En caso de ocurrir broncoespasmo paradójico, se debe suspender el tratamiento con INCRUSE ELLIPTA y, de ser necesario, instituir una terapia alternativa.
Es posible que se observen efectos cardiovasculares tales como arritmias, p.ej., fibrilación auricular y taquicardia, después de la administración de antagonistas de receptores muscarínicos, incluyendo INCRUSE ELLIPTA. Por lo tanto, INCRUSE ELLIPTA debe utilizar se con precaución en pacientes con trastornos cardiovasculares graves, en especial con arritmias cardiacas.
Consistentemente con su actividad antimuscarínica, INCRUSE ELLIPTA debe utilizarse con precaución en pacientes con glaucoma de ángulo cerrado o retención urinaria.
DOSIS Y ADMINISTRACIÓN:
INCRUSE ELLIPTA es para inhalación oral únicamente.
INCRUSE ELLIPTA debe administrarse una vez al día, a la misma hora del día cada día.
Adultos: La dosis recomendada consiste en una inhalación de INCRUSE ELLIPTA una vez al día.
Niños: Debido a la indicación de este producto, no es relevante en pacientes menores de 18 años de edad.
Personas de edad avanzada: No se requiere ajustar la dosis en pacientes mayores de 65 años de edad (véase Farmacocinética – Poblaciones especiales de pacientes).
Insuficiencia renal: No se requiere ajustar la dosis en pacientes con insuficiencia renal (véase Farmacocinética – Poblaciones especiales de pacientes).
Insuficiencia hepática: No se requiere ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. INCRUSE ELLIPTA no ha sido estudiado en pacientes con insuficiencia hepática grave (véase Farmacocinética – Poblaciones especiales de pacientes).
INSTRUCCIONES DE USO/MANEJO: Cuando utilice por primera vez el inhalador Ellipta, no necesita revisar que se encuentre funcionando adecuadamente y no necesita prepararlo para su uso de manera especial. Simplemente siga las instrucciones que se presentan a continuación.
Su empaque de cartón del inhalador Ellipta contiene:
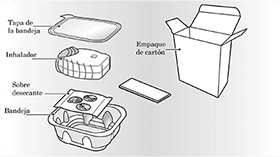
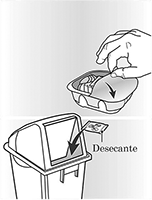
El inhalador se encuentra empacado en una bandeja blíster. No abra la bandeja hasta que esté listo para inhalar una dosis de su medicina. Cuando este listo para usar su inhalador, despegue la tapa para abrir la bandeja. La bandeja contiene un sobre desecante para disminuir la humedad. Tire a la basura este sobre desecante – no lo abra, ingiera o inhale.
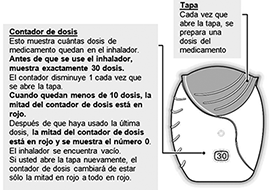
Al sacar el inhalador de la bandeja blíster, éste se encontrará en posición ‘cerrada’. No abra el inhalador hasta que esté listo para inhalar una dosis del medicamento. Anote “Desechar” y la fecha en el espacio proveido en la etiqueta. La fecha para “Desechar” es 6 semanas a partir de la fecha en que abrió la bandeja. Después de esta fecha, no debe usar mas el inhalador.
Las instrucciones paso a paso que se muestran a continuación para el inhalador Ellipta de 30 dosis (suministro para 30 días) también aplican para el inhalador Ellipta de 7 dosis (suministro para 7 días).
a) Lea esto antes de iniciar:
Si usted abre y cierra la tapa sin inhalar el medicamento, perderá la dosis.
La dosis perdida se mantendrá de forma segura dentro del inhalador, pero ya no estará disponible.
No es posible tomar medicamento extra o duplicar la dosis en una inhalación accidentalmente.
b) Prepare una dosis:
Espere a abrir la tapa hasta que esté listo para inhalar su dosis. No agite el inhalador.
• Deslice la tapa completamente hasta escuchar un “clic”.
Su medicamento está listo para ser inhalado.
El contador de dosis disminuye en 1 para confirmar.
• Si el contador de dosis no disminuye conforme escucha el “clic”, el inhalador no administrará el medicamento. Llévelo a su farmacéutico para recibir orientación.
• No agite el inhalador en ningún momento.
c) Inhale su medicamento:
• Manteniendo el inhalador lejos de su boca, exhale la mayor cantidad de aire que pueda, mientras se sienta cómodo.
No exhale dentro del inhalador.
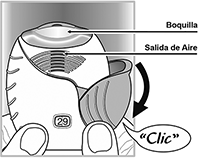
• Coloque la boquilla entre sus labios y cierre los labios firmemente alrededor de la misma.
No bloquee la salida de aire con sus dedos.
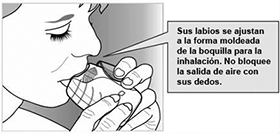
• Tome una inhalación profunda, larga y constante. Mantenga el aire lo más que pueda (por lo menos 3 a 4 segundos).
• Retire el inhalador de su boca.
• Respire lenta y suavemente.
Es posible que usted no sienta el medicamento o perciba su sabor, aun cuando esté utilizando el inhalador de forma correcta.
Si desea limpiar la boquilla, utilice un pañuelo desechable seco antes de cerrar la tapa.
d) Cierre el inhalador:
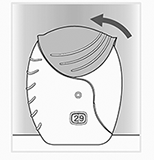
• Para cubrir la boquilla, deslice la tapa hacia arriba hasta donde llegue.
SOBREDOSIS: No se dispone de datos obtenidos de estudios clínicos en relación con la sobredosis de INCRUSE ELLIPTA.
Síntomas y signos: Una sobredosis de INCRUSE ELLIPTA probablemente producirá signos y síntomas acordes a los efectos adversos conocidos de los antagonistas muscarínicos inhalados (p.ej., xerostomía, alteraciones en la acomodación visual y taquicardia).
Tratamiento: En caso de sobredosis, el paciente debe recibir tratamiento complementario con monitoreo adecuado, según sea necesario.
El manejo adicional deberá llevarse acabo según lo indicado clínicamente, o deacuerdo con lo recomendado por el centro nacional de toxicología, donde esté disponible.
CARCINOGÉNESIS/MUTAGÉNESIS: Umeclidinio no fue genotóxico en un conjunto estándar de estudios, ni fue carcinogénico en estudios de inhalación de por vida en ratones o ratas a exposiciones ≥26 o ≥22 veces mayores a la exposición clínica en seres humanos a umeclidinio, con base en el AUC, respectivamente.
Toxicología en la reproducción: Umeclidinio no tuvo efectos adversos en la fertilidad masculina o femenina en ratas. Umeclidinio no fue teratogénico en ratas o conejos. En un estudio prenatal y postnatal, la administración subcutánea de umeclidinio a ratas dio lugar a menores aumentos de peso corporal materno y consumo de alimentos, y disminuyó ligeramente los pesos corporales de las crías previos al destete en hembras tratadas con una dosis de 180 microgramos/kg/día (aproximadamente 80 veces la exposición clínica en seres humanos a umeclidinio, basado en el AUC).
PRESENTACIÓN FARMACÉUTICA: Polvo para inhalación, predispensado.
Un inhalador de plástico Ellipta consiste en un cuerpo de color gris,una cubierta de color verde claro para la boquilla y un contador de dosis, empacados en una bandeja blíster laminada con un sobre de desecante. La bandeja blíster está sellada con una hoja de aluminio desprendible.
PRESENTACIONES COMERCIALES: Caja por 1 inhalador con 30 dosis.
Muestra médica: Caja por 1 inhalador con 30 dosis.
Información exclusiva para Colombia: INCRUSE ELLIPTA 62.5 mcg Polvo para inhalación. (Reg. San. No: INVIMA 2016M-0017469).
No todas las presentaciones se encuentran disponibles en todos los países.
Número de versión: GDS09/IPI010
Fecha de emisión: 07/02/2017
INCRUSE y ELLIPTA son marcas registradas del grupo de compañías GSK.
GLAXOSMITHKLINE COLOMBIA S.A.
PRECAUCIONES ESPECIALES DE ALMACENAMIENTO: No almacenar a temperaturas superiores a 30 °C. Si se almacena en un refrigerador, permita que el inhalador vuelva a la temperatura ambiente durante cuando menos una hora antes de su uso.
Naturaleza y contenido del envase: El inhalador de plástico Ellipta consiste en un cuerpo de color gris, una cubierta de color verde claro para la boquilla y un contador de dosis, empacados en una bandeja blíster laminada con un sobre desecante. La bandeja blíster está sellada con una hoja de aluminio desprendible.
El inhalador contiene una tira de 7 o 30 blísteres distribuidos en forma regular, cada uno de los cuales contiene un polvo blanco.