
IMIGRAN FDT
SUMATRIPTÁN
Tabletas
Caja , Blíster , 2 Tabletas , 50 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Tabletas con 50 ó 100 mg de sumatriptán base, como sal succinato.
INDICACIONES: IMIGRAN FDT se indican para el alivio agudo de los ataques de migraña, con o sin aura, incluyendo el tratamiento agudo de ataques de migraña asociados con el período menstrual en las mujeres.
CARACTERÍSTICAS FARMACÉUTICAS:
Lista de Excipientes:
• Fosfato hidrogenado de calcio.
• Celulosa microcristalina.
• Carbonato hidrogenado de sodio.
• Croscarmelosa sódica.
• Estearato de magnesio.
• Agua purificada.
• Hipromelosa.
• Dióxido de titanio.
• Triacetina.
• Óxido de hierro rojo.
Incompatibilidades: Ninguna comunicada.
Vida de Anaquel: La fecha de caducidad se indica en el empaque.
FARMACOCINÉTICA: La farmacocinética del sumatriptán no parece verse afectada en forma significativa por los ataques de migraña.
Absorción: Después de una dosis de 100 mg, el promedio de concentración plasmática máxima es de 54 nanogramos/mL. El promedio de biodisponibilidad oral absoluta es de 14%, lo cual por una parte se debe al metabolismo presistémico y, por otra, a una absorción incompleta.
La Cmáx de sumatriptán aumenta un 15% después de la administración oral de la tableta de rápida desintegración acompañada por una comida rica en grasas.
Distribución: La fijación a proteínas plasmáticas es baja (14 a 21%); el promedio del volumen total de distribución es de 170 litros.
Metabolismo: El metabolito principal ácido indol acético, el cual es análogo del sumatriptán, se excreta principalmente en la orina, donde se encuentra presente como ácido libre y como conjugado glucurónido. Carece de actividad 5-HT1 ó 5-HT2 conocida. No se han identificado metabolitos secundarios.
Eliminación: La vida media de eliminación es de aproximadamente dos horas. El promedio de depuración plasmática total es de aproximadamente 1,160 mL/min; asimismo, el promedio de depuración plasmática renal es de aproximadamente 260 mL/min.
La depuración que no se lleva a cabo por la vía renal representa aproximadamente el 80% de la depuración total. El sumatriptán se elimina principalmente a través del metabolismo oxidativo mediado por la monoaminooxidasa A.
Poblaciones de pacientes especiales:
Insuficiencia hepática: Después de su administración oral, se presenta una reducción de la depuración presistémica en aquellos pacientes que padecen insuficiencia hepática, lo cual da lugar a un aumento en los niveles plasmáticos de sumatriptán. (Véase Advertencias y Precauciones).
FARMACODINAMIA:
Código ATC: N02CC01.
Mecanismo de acción:
Grupo farmacoterapéutico: Agonistas selectivos del receptor 5-HT1.
Se ha demostrado que el sumatriptán es un agonista selectivo del receptor vascular 5- hidroxitriptamina-1-(5-HT1D), el cual carece de efectos sobre otros subtipos de receptores 5-HT (5-HT2–7). El receptor vascular 5-HT1D se encuentra predominantemente en los vasos sanguíneos craneales y, además, es un mediador de la vasoconstricción.
En los animales, el sumatriptán constriñe selectivamente la circulación arterial carotídea, pero no altera el flujo sanguíneo cerebral. La circulación de la arteria carótida abastece de sangre a los tejidos extracraneales e intracraneales, como las meninges; se cree que la formación de edemas o la dilatación, o ambas cosas, es el mecanismo subyacente de la migraña en el ser humano. Además, los indicios experimentales sugieren que el sumatriptán inhibe la actividad del nervio trigémino. Es posible que estas dos acciones contribuyan a la acción antimigrañosa del sumatriptán en los seres humanos.
Efectos farmacodinámicos: La respuesta clínica se inicia de 10 a 15 minutos después de administrar una inyección subcutánea de 6 mg, 15 minutos después de administrar una dosis de 20 mg vía intranasal y alrededor de 30 minutos después de administrar una dosis oral de 100 mg en tableta convencional o una dosis rectal de 25 mg.
Después de administrar una (FDT) de 50 mg y 100 mg, comenzó a producirse un alivio del dolor en un lapso de 30 minutos y 20 minutos, respectivamente, en una pequeña proporción de sujetos. El porcentaje de respondedores siguió aumentando hasta que el 67% y 72% de los sujetos alcanzaron un alivio del dolor a lo largo de 2 horas, en comparación con un 42% de los sujetos tratados con placebo. El inicio de la supresión del dolor tuvo lugar a los 33 minutos y 26 minutos, respectivamente, en una pequeña proporción de sujetos; el porcentaje de respondedores siguió aumentado hasta que el 40% y 47% de los sujetos alcanzaron una respuesta consistente en supresión del dolor a lo largo de 2 horas, en comparación con un 15% de los sujetos tratados con placebo. (Véase Estudios Clínicos).
Aunque la dosis recomendada de sumatriptán oral consiste en 50 mg, la severidad de los ataques de migraña varía de acuerdo con cada paciente. En las pruebas clínicas, se ha demostrado que las dosis de 25 a 100 mg poseen una mayor eficacia que la del placebo, pero las de 25 mg son estadística y significativamente menos eficaces que las de 50 y 100 mg.
El sumatriptán es eficaz en el tratamiento agudo de la migraña, con inclusión de migraña asociada con la menstruación.
DATOS DE PRUEBAS CLÍNICAS:
Trastornos del sistema nervioso:
Comunes: Mareos, somnolencia, trastornos sensoriales, incluyendo parestesia e hipoestesia.
Trastornos vasculares:
Comunes: Aumentos transitorios en la tensión arterial que surgen poco después del tratamiento. Rubefacción.
Trastornos respiratorios, torácicos y mediastínicos:
Común: Disnea.
Trastornos gastrointestinales:
Comunes: Náuseas y vómito que se presentaron en algunos pacientes, pero no es clara su relación con sumatriptán.
Trastornos musculoesqueléticos y del tejido conjuntivo: El siguiente síntoma suele ser transitorio y posiblemente intenso, además, puede afectar cualquier parte del cuerpo, incluyendo el tórax y la garganta:
Comunes: Sensaciones de pesantez.
Trastornos generales y en el sitio de administración: Los siguientes síntomas suelen ser transitorios y posiblemente intensos, además, pueden afectar cualquier parte del cuerpo, incluyendo el tórax y la garganta:
Comunes: Dolor, sensaciones de calor o frío, tensión o tirantez.
Los siguientes síntomas son, en su mayor parte, transitorios y de intensidad leve a moderada:
Comunes: Sensaciones de debilidad, fatiga.
Investigaciones:
Muy raros: Ocasionalmente se han observado perturbaciones de menor orden en las pruebas de función hepática.
Datos posteriores a la comercialización:
Trastornos del sistema inmunitario:
Muy raros: Reacciones de hipersensibilidad variables, desde hipersensibilidad cutánea hasta anafilaxia.
Trastornos del sistema nervioso:
Muy raros: Accesos convulsivos, aunque algunos han tenido lugar en pacientes con antecedentes de convulsiones o con trastornos concurrentes que predisponen a éstas, también existen comunicaciones en pacientes que no muestran tales factores predisponentes.
Temblores, distonía, nistagmo, escotoma.
Trastornos oculares:
Muy raros: Parpadeo, diplopía, visión reducida. Pérdida de la vista (usualmente transitoria). Sin embargo, los trastornos visuales también pueden presentarse durante el mismo ataque de migraña.
Trastornos cardiacos:
Muy raros: Bradicardia, taquicardia, palpitaciones, arritmias cardiacas, cambios isquémicos transitorios en ECG, vasoespasmo de la arteria coronaria, angina de pecho, infarto de miocardio (véanse Contraindicaciones, Advertencias y Precauciones).
Trastornos vasculares:
Muy raros: Hipotensión, fenómeno de Raynaud.
Trastornos gastrointestinales:
Muy raro: Colitis isquémica.
CONTRAINDICACIONES:
• Hipersensibilidad a cualquiera de los componentes de la preparación.
• IMIGRAN no debe administrarse a pacientes que hayan padecido un infarto de miocardio o presenten alguna cardiopatía isquémica (CI), angina de Prinzmetal/ vasoespasmo coronario, vasculopatía periférica, ni a pacientes que presenten signos o síntomas indicativos de CI.
• IMIGRAN no debe administrarse a pacientes con antecedentes de accidentes cerebrovasculares (ACV) o ataques isquémicos transitorios (AIT) previos.
• Se contraindica el uso de IMIGRAN en aquellos pacientes con hipertensión no controlada.
• IMIGRAN no debe administrarse a pacientes con insuficiencia hepática severa.
• Se contraindica el uso concomitante de ergotamina, o derivados de ergotamina (incluyendo la metisergida) (véase Interacciones).
• Se contraindica la administración concurrente de inhibidores de la monoaminooxidasa (IMAOs) y IMIGRAN. El IMIGRAN no debe emplearse dentro de las dos semanas posteriores a la suspensión de la terapia con IMAOs.
EMBARAZO Y LACTANCIA:
Embarazo: Se debe tener precaución al ponderar los beneficios esperados para la madre contra el posible riesgo para el feto.
Los datos posteriores a la comercialización obtenidos de múltiples registros prospectivos de embarazo, han documentado los resultados de la gravidez en más de 1,000 mujeres expuestas a sumatriptán. Aunque la información disponible resulta insuficiente para llegar a conclusiones definitivas, los hallazgos no han detectado algún aumento en la frecuencia de defectos de nacimiento, ni un patrón estable de estos defectos entre las mujeres expuestas a sumatriptán, en comparación con la población general.
Lactancia: Se ha demostrado que, después de su administración subcutánea, el sumatriptán se excreta en la leche materna. La exposición del lactante puede minimizarse evitando el amamantamiento durante las 12 horas posteriores al tratamiento.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y OPERAR MAQUINARIA: Se puede producir somnolencia como resultado de la migraña o tratamiento con IMIGRAN.
Se recomienda extremar precauciones a aquellos pacientes que realizan tareas que requieren destreza, p. ej., conducir u operar maquinaria.
EFECTOS ADVERSOS: Los efectos adversos se listan a continuación por clase de sistema de órganos y frecuencia de ocurrencia. La frecuencia de ocurrencia se define como: muy común ( (≥1/10), común ((≥1/100, to <1/10), no común ((≥1/1000, to <1/100), raro ((≥1/10,000, to <1/1000) y muy raro ((≥1/10,000), con inclusión de comunicaciones aisladas. Los datos obtenidos a partir de pruebas clínicas son estimadores. Cabe mencionar que no se tomó en cuenta la tasa de antecedentes en los grupos de comparación. Los datos posteriores a la comercialización se refieren a la tasa de comunicaciones más que a una frecuencia verdadera.
INTERACCIONES: No existen indicios de interacciones con propranolol, flunarizina, pizotifeno o alcohol.
Se han comunicado reacciones vasoespásticas prolongadas con ergotamina. Como estos efectos pueden ser aditivos, debe transcurrir un período de 24 horas antes de que se pueda tomar sumatriptán después de cualquier preparado que contenga ergotamina. A la inversa, no deben tomarse preparaciones que contengan ergotamina hasta que hayan transcurrido seis horas después de la administración de IMIGRAN.
Puede producirse una interacción entre el IMIGRAN y los IMAOs, por lo que se contraindica la administración concomitante (véase Contraindicaciones).
En raras ocasiones han surgido comunicaciones posteriores a la comercialización que describen casos de pacientes con síndrome serotoninérgico (incluyendo estado mental alterado, inestabilidad autonómica y anormalidades neuromusculares), después de utilizar concomitantemente ISRSs y sumatriptán. También han surgido comunicaciones de síndrome serotoninérgico después de administrar un tratamiento concomitante con triptanos e IRNSs (véase Advertencias y Precauciones).
ESTUDIOS CLÍNICOS: En dos estudios aleatorizados, doblemente ciegos, controlados con placebo y que fueron idénticos en cuanto a diseño, se demostró en adultos el tiempo necesario para el inicio de la eficacia de las FDT de 50 mg y 100 mg de sumatriptán. Se combinaron los datos obtenidos de estos estudios para obtener resultados únicos en cada criterio de valoración. En general, 2696 sujetos que experimentaron jaquecas de grado moderado a severo comunicaron un tiempo necesario para alcanzar el alivio del dolor y un tiempo necesario para alcanzar la supresión del mismo en los grupos tratados con placebo y con 50 mg y 100 mg de sumatriptán. Para el sumatriptán y el placebo, se generaron curvas de tiempo necesario para alcanzar el alivio del dolor (definido como una reducción en la severidad del dolor, de dolor moderado o severo a dolor leve o nulo) en un periodo de dos horas, a partir de la administración del tratamiento. El tiempo necesario para el inicio del alivio del dolor se definió como el primer punto de tiempo en que se logró por primera vez un significado estadístico, en comparación con el placebo, que se mantuviera en todos los puntos ulteriores de tiempo en la curva trazada de 0 a 2 horas. La supresión del dolor (definida como una reducción en la severidad del dolor, de dolor severo o moderado a dolor nulo) se evaluó empleando métodos similares. (Véase Efectos Farmacodinámicos).
El porcentaje de sujetos que alcanzaron el alivio del dolor (Figura 1) o la supresión del mismo (Figura 2), dentro de las dos horas posteriores al tratamiento, fue significativamente mayor en los sujetos que recibieron sumatriptán (FDT de 50 mg ó 100 mg) que en los que recibieron placebo (p<0.001).
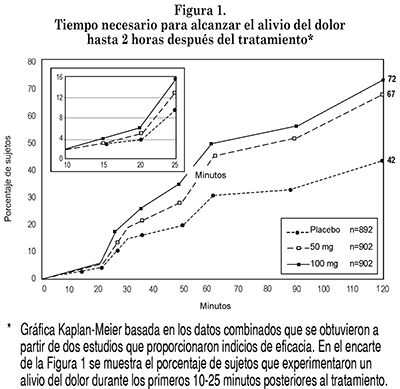
Para las FDT de 50 mg y 100 mg de sumatriptán, el tiempo necesario para el inicio del alivio del dolor fue de 30 minutos y 20 minutos, respectivamente, con base en los datos combinados. A partir de este momento en adelante, el porcentaje de respondedores siguió aumentando hasta que el 67% y 72% de los sujetos alcanzaron un alivio del dolor dos horas después del tratamiento con 50 mg y 100 mg, respectivamente, en comparación con un 42% de los sujetos incluidos en el grupo tratado con placebo (Figura 1).
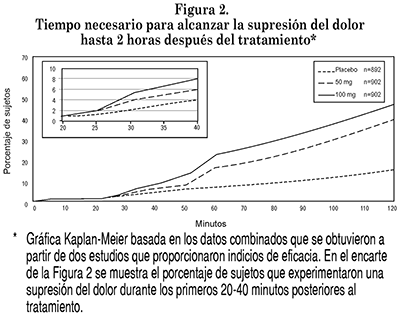
Para las FDT de 50 mg y 100 mg de sumatriptán, el tiempo necesario para el inicio de la respuesta consistente en supresión del dolor fue de 33 minutos y 26 minutos, respectivamente, con base en los datos combinados. A partir de este momento en adelante, el porcentaje de respondedores siguió aumentando hasta que el 40% y 47% de los sujetos alcanzaron la supresión del dolor dos horas después del tratamiento con 50 mg y 100 mg, respectivamente, en comparación con un 15% de los sujetos incluidos en el grupo tratado con placebo (Figura 2).
Aún no se realizan estudios con tabletas FDT de IMIGRAN en adolescentes. Sin embargo, en diversos estudios clínicos controlados con placebo, se evaluaron los perfiles de seguridad y eficacia de las tabletas orales estándar de sumatriptán, en más de 650 niños y adolescentes migrañosos que se encontraban en el intervalo de edad de 10 a 17 años. En estos estudios, no se pudo demostrar la existencia de alguna diferencia estadísticamente significativa en el alivio de la cefalea a las 2 horas, entre la administración de placebo y cualquier dosis de sumatriptán. En niños y adolescentes de 10 a 17 años de edad, el perfil de efectos adversos del sumatriptán oral fue similar al comunicado a partir de estudios realizados en la población adulta.
DATOS PRECLÍNICOS DE SEGURIDAD:
Carcinogenicidad, mutagenicidad: El sumatriptán no mostró actividad genotóxica ni carcinogénica alguna en sistemas in- vitro ni en estudios realizados en animales.
Embarazo y lactancia: No se han observado efectos teratogénicos en ratas o conejos, por lo que el sumatriptán no tuvo efecto alguno sobre el desarrollo postnatal de las ratas.
Cuando se administra a conejas preñadas durante el período de organogénesis, el sumatriptán ha producido ocasionalmente mortalidad embrionaria, a dosis suficientemente altas para producir toxicidad materna.
ADVERTENCIAS Y PRECAUCIONES: IMIGRAN sólo debe usarse cuando exista un diagnóstico preciso de migraña.
El uso de IMIGRAN no se indica en el tratamiento de la migraña hemipléjica, basilar u oftalmopléjica.
Antes de tratar los casos de cefalea en pacientes no diagnosticados previamente como migrañosos, así como en migrañosos que se presentan con síntomas atípicos, debe tenerse cuidado al excluir otros trastornos neurológicos potencialmente graves (por ej. ACV, AIT) si el paciente presenta síntomas atípicos o si no han recibido un diagnóstico apropiado para el uso de IMIGRAN.
Es posible que, después de su administración, el IMIGRAN se asocie con síntomas transitorios, incluyendo dolor y rigidez torácicos, los cuales pueden ser intensos e incluir la garganta (véase Efectos Adversos). Cuando se considere que estos síntomas pueden indicar IHD, debe realizarse una evaluación adecuada.
IMIGRAN no debe administrarse a pacientes con probabilidad de presentar alguna cardiopatía desconocida, sin necesidad de realizar previamente una evaluación de la enfermedad cardiovascular subyacente. Estos pacientes incluyen mujeres postmenopáusicas, varones mayores de 40 años de edad y pacientes con factores de riesgo de arteriopatías coronarias. Sin embargo, es posible que estas evaluaciones no identifiquen a todos los pacientes que padecen alguna cardiopatía y, en casos muy raros, se han producido eventos cardiacos graves en pacientes que no padecen enfermedades cardiovasculares subyacentes.
IMIGRAN debe administrarse cautelosamente a los pacientes con hipertensión controlada, ya que se han observado aumentos transitorios en la tensión arterial y resistencia vascular periférica, en una porción reducida de pacientes.
En raras ocasiones han surgido comunicaciones posteriores a la comercialización que describen casos de pacientes con síndrome serotoninérgico (incluyendo estado mental alterado, inestabilidad autonómica y anormalidades neuromusculares), después de utilizar concomitantemente algún inhibidor selectivo de la recaptación de serotonina (ISRS) y sumatriptán. Han surgido comunicaciones de síndrome serotoninérgico después de administrar un tratamiento concomitante con triptanos e inhibidores de la recaptación de noradrenalina y serotonina (IRNS).
Cuando el tratamiento concomitante con IMIGRAN y algún ISRS/IRNS se encuentre clínicamente justificado, se aconseja realizar una adecuada observación del paciente (véase Interacciones).
No se recomienda la administración concomitante de algún triptano/agonista de los receptores 5-HT1 con IMIGRAN.
IMIGRAN debe administrarse con precaución a los pacientes con trastornos que puedan afectar significativamente la absorción, metabolismo o excreción del fármaco, p. ej., insuficiencia hepática o renal.
IMIGRAN debe administrarse con cautela a los pacientes con antecedentes de accesos convulsivos u otros factores de riesgo que disminuyan el umbral de las convulsiones.
Es posible que los pacientes con hipersensiblidad conocida a las sulfonamidas presenten una reacción alérgica después de la administración de IMIGRAN. Las reacciones pueden variar, desde hipersensibilidad cutánea hasta anafilaxia. Existen pocos indicios de sensibilidad cruzada; sin embargo, debe tenerse precaución antes de emplear IMIGRAN en estos pacientes.
No se debe exceder la dosis recomendada de IMIGRAN.
El uso excesivo de tratamientos agudos contra la cefalea ha sido asociado con la exacerbación de la cefalea (cefalea por uso excesivo de medicamentos, CEM) en pacientes sensibles. Es posible que se requiera retirar el tratamiento.
DOSIS Y ADMINISTRACIÓN: IMIGRAN no debe emplearse de manera profiláctica. No debe excederse la dosis recomendada de IMIGRAN.
Es aconsejable que el IMIGRAN se administre tan pronto como sea posible después del inicio de la migraña. Es igualmente eficaz en cualquier etapa del ataque en que se administre.
Poblaciones:
Adultos: La dosis oral recomendada de IMIGRAN FDT consiste en una sola tableta de 50 mg. Algunos pacientes pueden requerir 100 mg.
Si algún paciente no responde a la primera dosis de IMIGRAN, no se debe administrar una segunda dosis para el mismo ataque. IMIGRAN FDT puede tomarse para tratar ataques subsiguientes.
Si el paciente ha respondido a la primera dosis, pero hay recurrencia de los síntomas, puede administrarse una segunda dosis durante existe un intervalo mínimo de dos horas entre dosis y, siempre y cuando no se hayan tomado más de 300 mg en cualquier período de 24 horas.
Las tabletas deben deglutirse enteras, con ayuda de agua. Aquellos pacientes que presentan dificultades para deglutir pueden elegir la dispersión de una tableta en una pequeña cantidad de agua antes de su administración. IMIGRAN FDT que se dispersan en agua presentan un sabor amargo.
Niños y Adolescentes (menores de 18 años de edad): En adolescentes o niños, aún no se realizan estudios IMIGRAN FDT (véase Estudios Clínicos).
Personas de edad avanzada (mayores de 65 años de edad): La experiencia que se tiene en cuanto al uso de tabletas estándar de sumatriptán en pacientes mayores de 65 años de edad es limitada. La farmacocinética no difiere significativamente de la población más joven, pero hasta que se disponga de datos clínicos adicionales, no se recomienda el uso de IMIGRAN FDT en aquellos pacientes mayores de 65 años de edad.
INSTRUCCIONES PARA SU USO/MANEJO:
Deben deglutirse enteras, con ayuda de agua. Aquellos pacientes que presentan dificultades para deglutir pueden elegir la dispersión de una tableta en una pequeña cantidad de agua antes de su administración. IMIGRAN FDT que se dispersan en agua presentan un sabor amargo.
Versión número: GDS 23 / IPI 07.
Fecha de emisión: 18 de Enero 2014.
IMIGRANes una marca registrada del grupo de compañías GlaxoSmithKline.
SOBREDOSIS:
Síntomas y signos: Las dosis de hasta 100 mg orales no se asociaron con otros efectos secundarios aparte de los mencionados.
Tratamiento: Si se produce una sobredosificación, debe vigilarse al paciente durante cuando menos 10 horas, aplicando un tratamiento estándar de soporte, según se requiera.
Se desconoce el tipo de efecto que puede tener la hemodiálisis, o la diálisis peritoneal, sobre las concentraciones plasmáticas de sumatriptán.
PRESENTACIÓN: (Reg. San. INVIMA 2015M-0003999-R1).
GLAXOSMITHKLINE COLOMBIA S.A.
PRESENTACIÓN FARMACÉUTICA: Las tabletas de rápida desintegración tienen forma triangular.
IMIGRAN FDT de 50 mg son de color rosa, recubiertas y grabadas con la clave ‘GS 1YM’ en una de las caras y ‘50’ en la otra.
IMIGRAN FDT de 100 mg son de color blanco, recubiertas y grabadas con la clave ‘GS YE7’ en una de las caras y ‘100’ en la otra.
NATURALEZA Y CONTENIDO DEL EMPAQUE:
El empaque blíster formado en frío/con cubierta resistente a prueba de niños comprende una lámina de poliamida/aluminio/polivinilcloruro en forma de bolsas, sellado con una cubierta de aluminio a presión con papel en la parte posterior recubierto con laca termosellante en la superficie interna.
PRECAUCIONES ESPECIALES DE ALMACENAMIENTO: Las tabletas de IMIGRAN deben almacenarse a temperaturas inferiores a 30 °C.