
GARDASIL
PAPILOMA HUMANO, VIRUS DEL, PROTEÍNA L1 VPH
Suspensión inyectable
, Vial,0.5 ml
Caja , 1 Jeringa(s) prellenada(s) , Suspensión , 0,5 Mililitros
Caja , 10 Jeringa(s) prellenada(s) , Suspensión , 0.5 Mililitros
Caja , 10 Vial(es) , Suspensión , 0.5 Mililitros
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN:
Ingredientes activos:
GARDASIL® es una preparación estéril de administración intramuscular. Cada dosis de 0.5 mL contiene aproximadamente:
Proteína L1 VPH Tipo 6 20 mcg
Proteína L1 VPH Tipo 11 40 mcg
Proteína L1 VPH Tipo 16 40 mcg
Proteína L1 VPH Tipo 18 20 mcg
INGREDIENTES INACTIVOS:
Cada dosis de 0.5 mL contiene aproximadamente:
Aluminio (en forma de adyuvante sulfato
hidroxifosfato de aluminio amorfo) 225 mcg
Cloruro de sodio 9.56 mg
L-histidina 0.78 mg
Polisorbato 80 50 mcg
Borato de sodio 35 mcg
Agua para inyección c.s.
El producto no contiene preservante ni antibiótico.
INDICACIONES: GARDASIL® es una vacuna indicada en niñas y mujeres de 9 a 45 años para la prevención de cáncer cervical, vulvar, vaginal y anal, lesiones precancerosas o displásicas, verrugas genitales, e infección causada por los tipos de Virus de Papiloma Humano (VPH) que son el objetivo de la vacuna.
GARDASIL® está indicada para prevenir las siguientes enfermedades:
• Cáncer de cuello uterino, vulvar, vaginal y anal causado por VPH tipos 16 y 18.
• Verrugas genitales (condiloma acuminado) causadas por VPH tipos 6 y 11.
Además de prevenir las siguientes lesiones precancerosas o displásicas causadas por VPH tipos 6, 11, 16 y 18:
• Neoplasia intraepitelial Cervical (NIC) grado 2/3 y Adenocarcinoma cervical in situ (AIS).
• Neoplasia Intraepitelial Cervical (NIC) grado 1.
• Neoplasia Intraepitelial Vulvar (NIV) grado 2 y grado 3.
• Neoplasia Intraepitelial Vaginal (NIVa) grado 2 y grado 3.
• NIV grado 1 y NIVa grado 1.
• Neoplasia intraepitelial anal (NIA) grados 1, 2 y 3.
GARDASIL® está indicada en niños y hombres de 9 a 26 años para la prevención de lesiones genitales externas e infecciones y las siguientes enfermedades causadas por los tipos de Virus de Papiloma Humano (VPH) incluidos en la vacuna:
• Cáncer anal causado por VPH tipo 16 y 18.
• Verrugas genitales (Condyloma acuminata) causados por VPH de los tipos 6 y 11.
Y las siguientes lesiones precancerosas o displásicas causadas por el VPH de los tipos 6, 11, 16 y 18:
• Neoplasia intraepitelial anal (NIA) Grados 1, 2 y 3.
CLASE TERAPÉUTICA: GARDASIL® es una Vacuna Recombinante, Tetravalente que protege contra el Virus de Papiloma Humano (VPH).
USO PEDIÁTRICO: La seguridad y eficacia de GARDASIL® no se ha evaluado en niños menores de 9 años.
CONTRAINDICACIONES: Hipersensibilidad a las sustancias activas o a cualquiera de los excipientes de la vacuna.
Los individuos que desarrollen síntomas indicativos de hipersensibilidad después de recibir una dosis de GARDASIL® no deben recibir más dosis de GARDASIL®.
USO EN PACIENTES DE EDAD AVANZADA: La seguridad y eficacia de GARDASIL® no se ha evaluado en adultos mayores de 45 años.
USO EN OTRAS POBLACIONES ESPECIALES: La seguridad, inmunogenicidad y eficacia de GARDASIL® no se ha evaluado por completo en individuos infectados por VIH.
EMBARAZO:
Estudios en ratas hembras: Estudios en animales no indican efectos dañinos directos o indirectos con respecto al embarazo, desarrollo embrionario/fetal, parto o desarrollo postnatal. GARDASIL® indujo una respuesta de anticuerpos específica contra los tipos 6, 11, 16, y 18 de VPH en ratas embarazadas después de una o múltiples inyecciones intramusculares. Los anticuerpos contra los 4 tipos de VPH se transfirieron a la descendencia durante la gestación y posiblemente durante la lactancia.
Estudios clínicos en humanos: Sin embargo, no existen estudios adecuados y bien controlados en mujeres embarazadas. Debido a que los estudios de reproducción en animales no siempre son indicativos de la respuesta humana, se debe evitar el embarazo durante el régimen de vacunación para GARDASIL®.
En estudios clínicos, las mujeres se sometieron a la prueba de embarazo en orina antes de la administración de cada dosis de GARDASIL®. Las mujeres que estaban embarazadas antes de terminar el régimen de 3 dosis de GARDASIL® recibieron instrucciones de postergar la culminación de sus regímenes de vacunación hasta el término del embarazo. Dichos regímenes no estándares produjeron respuestas anti-VPH 6, anti-VPH 11, anti-VPH 16, y anti-VPH 18 después de la dosis 3 que fueron comparables con aquellas observadas en mujeres que recibieron un régimen de vacunación estándar de 0, 2, y 6 meses (ver Dosis y via de administración).
Durante las pruebas clínicas, 3819 mujeres (vacuna N= 1894 vs. placebo N= 1925) presentaron al menos un embarazo. En general, las proporciones de embarazos con un resultado adverso, definidas como el número combinado de abortos espontáneos, muerte fetal tardía y casos de anormalidades congénitas del número total de embarazos con resultados conocidos (y excluyendo terminaciones electivas), fueron 22.6% (446/1973) en individuos que recibieron GARDASIL® y 23.1% (460/1994) en individuos que recibieron placebo.
Se realizaron sub-análisis adicionales para evaluar los embarazos con inicio estimado dentro de los 30 días o más de 30 días de la administración de una dosis de GARDASIL® o placebo. Para los embarazos con inicio estimado dentro de los 30 días de la vacunación, se observaron 5 casos de anomalía congénita en el grupo que recibió GARDASIL® comparado con 1 caso de anomalía congénita en el grupo que recibió placebo. Por el contrario, en embarazos con inicio más de 30 días después de la vacunación, se observaron 40 casos de anomalía congénita en el grupo que recibió GARDASIL® comparado con 33 casos de anomalía congénita en el grupo que recibió placebo. Los tipos de anomalías observados fueron consistentes (independientemente de cuando ocurrió el embarazo en relación con la vacunación) con aquellos generalmente observados en embarazos de mujeres en edades entre 16 a 45 años.
De este modo, no hay evidencia para sugerir que la administración de GARDASIL® afecte de manera adversa la fertilidad, el embarazo, o los resultados en los niños.
LACTANCIA: No se sabe si los antígenos o anticuerpos de la vacuna inducidos por la vacuna son excretados en la leche materna.
GARDASIL® se puede administrar a mujeres que amamantan.
GARDASIL® o placebo fueron dados a un total de 1133 madres que amamantan durante la relevante Fase III de los estudios clínicos. En estos estudios, los índices de eventos adversos en la madre y el lactante fueron comparables entre los grupos de vacunación. Asimismo, la inmunogenicidad de la vacuna fue comparable entre las madres que amamantan y las mujeres que no amamantan durante la administración de la vacuna.
REACCIONES ADVERSAS:
Estudios clínicos: En 7 estudios clínicos (6 controlados con placebo), los individuos recibieron GARDASIL® o placebo el día del enrolamiento y aproximadamente 2 y 6 meses después. GARDASIL® demostró un perfil de seguridad favorable cuando se comparó con placebo (que contiene aluminio o no). Algunos individuos (0.2%) descontinuaron debido a eventos adversos. En todos los estudios clínicos excepto uno, la seguridad se evaluó usando vigilancia asistida por la cartilla de vacunación (VRC, por sus siglas en inglés) durante 14 días después de cada inyección de GARDASIL® o placebo. Los individuos que fueron monitoreados usando vigilancia asistida por VRC incluyeron 10088 individuos (6996 niñas y mujeres entre 9 y 45 años y 3092 niños y hombres entre 9 y 26 años en el enrolamiento) que recibieron GARDASIL® y 7995 individuos que recibieron placebo.
Se observaron los siguientes eventos adversos relacionados con la vacuna entre los receptores de GARDASIL® a una frecuencia de al menos 1.0% y también a una frecuencia mayor a aquella observada entre los receptores de placebo, se listan de acuerdo a la frecuencia y el sistema de clasificación de órganos.
La clasificación por frecuencia es como sigue: Muy común: (?1/10); Común: (?1/100, <1/10); Poco común: (?1/1.000, <1/100); Raro: (?1/10.000, <1/1.000); Muy Raro: (<1/10.000).
Experiencias adversas clínicas relacionadas en niñas y mujeres de 9 - 45 años:
• Desórdenes del sistema nervioso:
— Muy común: Dolor de cabeza.
— Común: Mareos.
• Desórdenes gastrointestinales:
— Común: Nausea.
• Desórdenes músculo esqueléticos y del tejido conectivo:
— Común: Dolor en extremidad.
• Trastornos generales y condiciones del lugar de administración:
— Muy común: Pirexia.
Las siguientes reacciones en el lugar de la inyección ocurrieron con una mayor incidencia en el grupo que recibió GARDASIL® comparado con el grupo de placebo que contiene adyuvante aluminio amorfo de sulfato hidroxifosfato o el grupo de placebo de solución salina.
— Muy común: Eritema, dolor, e hinchazón.
— Comunes: Prurito y hematoma.
La mayoría de reacciones en el lugar de la inyección fueron leves a moderadas.
Así mismo, el broncoespasmo fue muy raramente reportado como un evento adverso serio.
Eventos adversos relacionados con la Vacuna en niños y hombres de 9 - 26 años:
• Trastornos del sistema nervioso:
— Comunes: Cefalea.
• Trastornos generales y del sitio de administración:
— Comunes: Pirexia.
Las siguientes reacciones en el sitio de inyección ocurrieron con mayor incidencia en el grupo que recibió GARDASIL® comparados con los grupos administrados con coadyuvante con aluminio amorfo de sulfato hidroxifosfato o el grupo placebo con solución salina.
— Muy comunes: Eritema, dolor e Hinchazón.
Las siguientes reacciones en el sitio de inyección ocurrieron con mayor incidencia en el grupo que recibió GARDASIL® comparados con el grupo administrado con coadyuvante aluminio amorfo de sulfato hidroxifosfato.
— Comunes: Hematoma.
La mayoría de las reacciones en el sitio de inyección fueron de leves a moderadas. Administración concomitante con otras vacunas.
La seguridad de GARDASIL® cuando se administró concomitantemente con otras vacunas fue evaluada en estudios clínicos.
La frecuencia de experiencias adversas observadas con la administración concomitante con la vacuna de hepatitis B (recombinante) fue similar a la frecuencia cuando GARDASIL® fue administrada sola.
Hubo un incremento en dolor de cabeza e inflamación en el sitio de inyección cuando GARDASIL® fue administrado concomitantemente con la vacuna difteria, tetanos, pertussis (componente acelular) y vacuna inactivada de Poliomielitis (contenido reducido de antígeno adsorbido).
Hubo un incremento en la inflamación en el sitio de inyección cuando GARDASIL® fue administrada concomitantemente con Meningococo (Grupo A, C, Y, y W-135), vacuna conjugada de difteria Toxoide Polisacárida y Toxoide Tetánico, Toxoide Difteria reducido y Vacuna Adsorbida de Pertussis Acelular (Tdap).
La mayoría de estas experiencias adversas luego de la administración concomitante con otras vacunas fueron reportadas como de intensidad leve a moderada.
• Reportes de post-comercialización:
Las siguientes experiencias adversas han sido reportadas espontáneamente durante el uso post-aprobación de GARDASIL® debido a que estas experiencias adversas fueron reportadas voluntariamente de una población de tamaño incierto, no es posible estimar realmente su frecuencia o establecer la relación causal de exposición a la vacuna.
Infecciones e infestaciones: Celulitis.
Desórdenes en el sistema circulatorio y linfático: Trombocitopenia púrpura idiopática, linfoadenopatía.
Desórdenes del sistema nervioso: Encefalomielitis diseminada aguda, mareo, síndrome de Guillain-Barré, dolor de cabeza, síncope algunas veces acompañado de movimientos tónico- clónicos.
Desórdenes gastrointestinales: Náusea, vómito.
Desórdenes Músculo esqueléticos y del tejido conectivo: Artralgia, mialgia.
Desórdenes generales y del sitio de administración: Astenia, fatiga, debilidad, escalofríos.
Desórdenes del sistema inmune: Hipersensibilidad incluyendo reacciones anafilácticas/anafilactoides, broncoespasmo y urticaria.
INTERACCIONES FARMACOLÓGICAS:
Uso con otras vacunas: Los resultados de los estudios clínicos indican que GARDASIL® se puede administrar de manera concomitante (en un lugar diferente de aplicación de la inyección) con HBVAX II (vacuna de Hepatitis B recombinante), Menactra [Vacuna conjugada Meningococo (Grupos A, C, Y y W-135) y Toxoide de Difteria], Adacel [Vacuna adsorbida de Toxoide de Tétanos, Toxoide reducido de Difteria y Pertussis acelular], Repevax (Difteria, Tetanos, Pertussis (componente acelular)) y vacuna de Poliomielitis inactivada (Vacuna que contiene antígenos inactivados reducidos adsorbidos).
Uso con medicamentos comunes: En estudios clínicos para niñas y mujeres (de 16 a 26 años), 11.9%, 9.5%, 6.9%, y 4.3% de los individuos usaron analgésicos, antinflamatorios, antibióticos, y preparaciones de vitaminas, respectivamente. En un estudio clínico en mujeres (de 24 a 45 años) 30.6%, 20.2%, 11.6%, y 7.5% de los individuos usaron analgésicos, antinflamatorios, antibióticos, y preparaciones de vitaminas, respectivamente. Al contrario en un estudio clínico en niños y hombres (con edades
entre 16 y 26 años), 10.3%, 7.8%, 6.8%, 3.4% y 2.6% de los individuos usaron analgésicos, antiinflamatorios, antibióticos, antihistamínicos, y preparaciones de vitaminas, respectivamente. La eficacia, inmunogenicidad y seguridad de la vacuna no sufrieron impacto por el uso de estos medicamentos.
Uso con anticonceptivos hormonales: En estudios clínicos, 50.2% de mujeres (de 16 a 45 años) que recibieron GARDASIL® usaron anticonceptivos hormonales. El uso de anticonceptivos hormonales al parecer no afectó las respuestas inmunitarias a GARDASIL®.
Uso con esteroides: En estudios clínicos de niñas y mujeres (de 16 a 26 años), 1.7% (n = 158), 0.6% (n = 56), y 1.0% (n = 89) de los individuos usaron inmunosupresores inhalados, tópicos y parenterales, respectivamente. En un estudio clínico en mujeres (de 24 a 45 años), 1.4% (n = 27) usaron corticosteroides para uso sistémico. En un estudio clínico en niños y hombres (con edades entre 16 y 26 años), 1.0% (n=21) utilizaron corticosteroides de uso sistémico. Los corticosteroides fueron administrados cerca del tiempo de la administración de una dosis de GARDASIL®. Estos medicamentos al parecer no afectaron las respuestas inmunitarias a GARDASIL®. Muy pocos individuos en los estudios clínicos estaban tomando esteroides, y se presume que la cantidad de inmunosupresión fue baja.
Uso con medicamentos inmunosupresores sistémicos: No existe información sobre el uso concomitante de inmunosupresores potentes con GARDASIL®. Los individuos que reciben terapia con agentes inmunosupresores (dosis sistémicas de corticosteroides, antimetabolitos, agentes alquilantes, agentes citotóxicos) pueden no responder de manera óptima a la inmunización activa (ver Precauciones, General).
FARMACOLOGÍA CLÍNICA:
Carga de la enfermedad: En todo el mundo, cada año se diagnostican más de 490,000 casos de cáncer de cuello uterino. La prevención del cáncer de cuello uterino se centra en el tamizaje repetido (a saber, frotis de Papanicolaou, pruebas de virus del papiloma humano o ambas) y la intervención temprana. Tal estrategia ha reducido las tasas de cáncer aproximadamente 75% en el mundo desarrollado, pero ha desviado la carga, pasando del manejo del cáncer de cuello uterino a la detección y el tratamiento de un gran número de lesiones premalignas.
El cáncer de cuello uterino es causado por una infección por el virus del papiloma humano (VPH). Es necesaria la infección por VPH para que aparezcan el cáncer de cuello uterino de células escamosas (y su lesión precursora, la neoplasia intraepitelial cervical o NIC de grados 1 y 2/3) y el adenocarcinoma de cuello uterino (y su lesión precursora, el adenocarcinoma in situ [AIS]). El VPH también causa un subgrupo de cánceres vulvares y vaginales, así como sus lesiones precursoras, la neoplasia intraepitelial vulvar (NIV) y la neoplasia intraepitelial vaginal (NIVa).
La infección por el VPH es muy común. La mayoría de infecciones resuelven sin secuelas pero algunas progresan a cáncer de cuello uterino y/u otras enfermedades relacionadas con VPH. A falta de vacunación, más de 50% de los adultos sexualmente activos se infectarán con el VPH a lo largo de la vida. Los hombres juegan un papel muy importante en la transmisión del virus VPH a sus parejas sexuales. Muchos estudios prospectivos han mostrado un alto nivel de concordancia entre la presencia de VPH en parejas que se han infectado recientemente, indicando transmisión del VPH entre las parejas (Hombre a mujer y mujer a hombre). Estos datos soportan la naturaleza de transmisión natural sexualmente del virus y el rol de los hombres en la infección de mujeres quienes pueden desarrollar subsecuentemente cánceres ano-genitales y verrugas genitales relacionadas con VPH. Basados en varias líneas de evidencia se espera la disminución del riesgo de infección en hombres a través de la vacunación que debe disminuir a su vez la infección en sus parejas sexuales, por lo tanto provee un beneficio adicional en la salud pública.
La infección por el VPH de los tipos 6, 11, 16 y 18 puede ocasionar resultados anormales en la citología de Papanicolaou y lesiones displásicas de bajo grado (NIC 1, NIV 1 y NIVa 1). Las lesiones por el VPH de los tipos 6 y 11 tienen pocas probabilidades de progresar hasta el cáncer, pero son clínicamente indistinguibles de las lesiones premalignas causadas por el VPH de los tipos 16 y 18.
La infección por el VPH de los tipos 6 y 11 también causa verrugas genitales (condilomas acuminados), excrecencias que aparecen en la mucosa de cuello uterino, vulvar y perianal y en los genitales externos, que rara vez progresan hasta el cáncer. Se ha calculado que el riesgo de por vida de contraer verrugas genitales es superior al 10%. La incidencia de estas lesiones por lo general es comparable entre hombres y mujeres.
El VPH de los tipos 6 y 11 también causa la papilomatosis respiratoria recurrente (PRR), una enfermedad de los lactantes y los adultos. La papilomatosis respiratoria recurrente se caracteriza por la aparición repetida de verrugas en las vías respiratorias. En Estados Unidos, cada año se diagnostican 5,900 casos. El tratamiento requiere intervenciones quirúrgicas repetidas.
La infección por VPH está fuertemente ligada al cáncer anal. La gran mayoría de cánceres anales son carcinomas de las células escamosas (SCC). Los SCC del canal anal son positivos a VPH en
80 al 90% de los casos en hombres y mujeres. VPH 16 (73%) y VPH 18 (5%) son los tipos más comunes asociados a la patología. Aproximadamente 100.000 nuevos casos de cáncer anal se estima que ocurren anualmente a nivel mundial y la cifra va en aumento. No existe actualmente un test de tamizaje de rutina de evaluación para este cáncer en personas saludables.
El VPH se acepta como causa del cáncer de cabeza y cuello y datos emergentes muestran un incremento desde las últimas décadas en la proporción de este cáncer causado por VPH. La mayoría de los cánceres de cabeza y cuello relacionados con el VPH ocurren en la orofaringe, específicamente en el área tonsilar del anillo de Waldever. De los cánceres oro faríngeos 60 - 70% son causados por VPH, y de estos, aproximadamente el 90% se asocian al tipo 16. En general, aproximadamente 2/3 de los casos ocurren en hombres. La infección oral con VPH y seropositiva por VPH del tipo 16 se ha asociado con un riesgo significativamenteelevado de desarrollar cáncer de cabeza y cuello.
GARDASIL® es una vacuna recombinante con proteínas L1 semejantes a los tipos de VPH 6, 11, 16 y 18. Los tipos 16 y 18 causan aproximadamente:
• 70% de los casos de cáncer de cuello uterino, adenocarcinoma in situ, y NIC 3;
• 50% de casos NIC 2
• 70% de los casos de cáncer vulvar y vaginal relacionados con el VPH, casos de NIV 2/3, y NIVa;
• 90% de cánceres anales relacionados con VPH
• 70% de cánceres AIN 2/3 relacionados con VPH y;
• 60% de los casos de cáncer de pene relacionados con VPH.
Los tipos de VPH 6, 11, 16 y 18 causan aproximadamente:
• 35 a 50% de todos los casos de NIC 1, NIV 1 y NIVa.
Los tipos de VPH 6 y 11 causan aproximadamente:
• 90% de los casos de verrugas genitales y PRR; y
• 9 a 12% de los casos de NIC 1
Los tipos de VPH 16 causan aproximadamente:
• 90% de los casos de carcinoma de células escamosas orofaríngeo.
Los efectos de GARDASIL® también han sido estudiados en el VPH tipos 31, 33, 52, 56, 58 y 59.
Estos tipos causan aproximadamente:
• 11.6% de los casos de cáncer de cuello uterino;
• 32.2% de los casos de NIC 1
• 39.3% de los casos de NIC 2; y
• 24.3% de los casos de NIC y AIS.
Mecanismo de acción: GARDASIL® contiene partículas parecidas a virus (PPV) de L1, las cuales son proteínas que semejan los viriones naturales. Dado que las partículas parecidas a virus no contienen ADN, no pueden infectar a las células ni reproducirse.
En los estudios preclínicos, la inducción de anticuerpos contra el papilomavirus con las vacunas de PPV de L1 confirió protección contra la infección. La administración del suero de los animales vacunados a animales no vacunados logró transferir la protección contra el VPH a los segundos. Estos datos sugieren que la eficacia de las vacunas de PPV de L1 está mediada por la aparición de una respuesta inmune humoral.
Estudios clínicos: En mujeres, la neoplasia intraepitelial cervical grados 2/3 y el adenocarcinoma in situ son los precursores inmediatos del carcinoma de células escamosas invasivo y del adenocarcinoma de cuello uterino invasivo, respectivamente. Se ha demostrado que su detección y extirpación previene el cáncer invasivo (prevención secundaria); así pues, su prevención primaria mediante la vacunación también prevendrá el cáncer invasivo.
No puede emplearse el cáncer de cuello uterino invasivo como un desenlace en los estudios de eficacia de las vacunas contra el VPH, debido a la importancia de emplear medidas de prevención secundaria. Así pues, los precursores inmediatos, tales como la NIC 2 (displasia de cuello uterino de grado moderado), la NIC 3 (displasia de cuello uterino de grado alto, que incluye el carcinoma in situ), y el adenocarcinoma in situ son los desenlaces más apropiados para demostrar la prevención del cáncer de cuello uterino mediante las vacunas contra el VPH.
La neoplasia intraepitelial cervical 3 y el adenocarcinoma in situ se clasifican como cánceres de cuello uterino de grado 0, según la FIGO (Federación Internacional de Ginecología y Obstetricia). La neoplasia intraepitelial vulvar y la neoplasia intraepitelial vaginal de grados 2 y 3 son, respectivamente, las precursoras de los cánceres vulvares y vaginales relacionados con el VPH.
En hombres hasta el 84% de las neoplasias intraepiteliales de pene, perineal y perianal (NIP) 1 (Bajo grado) y por encima del 90% de NIP 3 (Alto grado) se han asociado al VPH. El tipo 16 es el más comúnmente detectado. La eritoplasia de Queyrat (EQ), enfermedad de Bowen (BD) y papulosis bowenoide (BP) son presentaciones clínicas de alto grado de NIP. Una proporción tan alta como el 33% de BD y EQ se ha asociado con cáncer invasivo. La BP raramente progresa en enfermedad maligna.
La eficacia de GARDASIL® se evaluó en 6 estudios clínicos de Fase II y III, doble ciego, aleatorizados, controlados con placebo. El primer estudio de Fase II evaluó el componente de VPH 16 de GARDASIL® (Protocolo 005, N = 2,391 niñas y mujeres), y el segundo evaluó todos los componentes de GARDASIL® (Protocolo 007, N = 551 niñas y mujeres). Los estudios de Fase III, denominados FUTURE (siglas en inglés de Mujeres Unidas para Reducir Unilateralmente las Enfermedades Ecto- y Endocervicales), evaluaron GARDASIL® en 5,442 (FUTURE I), 12,157 (FUTURE II), y 3,817 (FUTURE III) niñas y mujeres participantes. Un cuarto estudio en faseIII, protocolo 020, evaluó GARDASIL® en 4055 niños y hombres incluyendo un subgrupo de 598 (GARDASIL®=299 y placebo=299) hombres que se identificaron como población MSM, hombres que mantienen sexo con hombres. En conjunto, dichos estudios evaluaron a 24,358 mujeres que tenían entre 16 a 45 años y 4055 hombres entre 16 y 26 al ingreso. La mediana de duración del seguimiento fue de 4.0, 3.0, 3.0, 3.0, 4.0, y 2.9 años para el Protocolo 005, el Protocolo 007, FUTURE I, FUTURE II, y FUTURE III y los estudios base del protocolo 020, respectivamente. Los participantes recibieron la vacuna o placebo el día de su ingreso y 2 y 6 meses después. Se analizó la eficacia por separado en cada estudio y en todos los estudios combinados realizados en niñas y mujeres.
Los estudios no tuvieron una fase de detección. Así pues, en los estudios se incluyó a personas que habían estado expuestas a alguno de los tipos del VPH de la vacuna antes del ingreso. En términos generales, 73% de las participantes de 16 a 26 años de edad y 67% de las participantes de 24 a 45 años de edad nunca habían estado expuestas (eran inmunológicamente “vírgenes”) a ninguno de los 4 tipos de VPH presentes en la vacuna al momento del ingreso. Del total de individuos, el 83% de los niños y hombres entre 16 y 26 años nunca habían estado expuestos (eran inmunológicamente “vírgenes”) a ninguno de los 4 tipos de VPH presentes en la vacuna al momento del ingreso. Las participantes que nunca habían estado expuestas continuaron en riesgo de contraer infecciones y enfermedades causadas por los cuatro tipos de VPH presentes en la vacuna. De las mujeres participantes de 24 a 45 años de edad, sólo el 0.4% estuvieron expuestas a los 4 tipos de VPH presentes en la vacuna. De los hombres participantes de 16 a 26 años de edad, sólo el 0.2% estuvieron expuestas a los 4 tipos de VPH presentes en la vacuna.
— Eficacia Profiláctica - VPH tipos 6, 11, 16 y 18 en niñas y Mujeres de 16 a 26 Años de Edad:
GARDASIL® fue altamente eficaz para reducir la incidencia de cánceres de cuello uterino, vulvar y vaginal; neoplasia intraepitelial cervical (de cualquier grado); de adenocarcinoma in situ; de cáncer de cuello uterino no invasivo (NIC 3 y adenocarcinoma in situ); y de lesiones genitales externas, incluidos los condilomas acuminados y las neoplasias intraepiteliales vulvares y vaginales (de cualquier grado) causadas por el VPH tipos 6, 11, 16 y 18. Con base en un análisis pre especificado de las lesiones evidentes a partir de 30 días después de la primera dosis, se demostró que la vacuna ya era eficaz durante el curso del esquema de vacunación de tres dosis.
Los análisis primarios de eficacia, con relación al VPH tipos 6, 11, 16 y 18, se realizaron en la población de eficacia con adherencia al protocolo (PPE por su siglas en ), conformada por participantes que recibieron las 3 dosis de vacuna en el curso de 1 año después del ingreso, no presentaron desviaciones importantes con respecto al protocolo del estudio y no habían estado expuestas (eran inmunológicamente “vírgenes”) al tipo o tipos relevantes de VPH antes de la primera dosis y hasta un mes después de la tercera dosis (mes 7). La eficacia se midió a partir de la consulta del 7° mes.
La eficacia de GARDASIL® en contra de la NIC 2/3 o AIS relacionadas con el VPH 16 ó 18 fue de 98.2% (IC de 95%: 93.5%, 99.8%) en los protocolos combinados. Los análisis de cada uno de los protocolos demostraron los siguientes resultados: 100% (IC de 95%: 65.1%, 100.0%) en el Protocolo 005, 100% (IC de 95%: <0.0%, 100.0%) en el Protocolo 007, 100% (IC de 95%: 89.2%, 100.0%) en el FUTURE I y 96.9% (IC de 95%: 88.2%, 99.6%) en el FUTURE II. Se presentaron dos casos de NIC 3 que ocurrieron en el grupo que recibió GARDASIL®. En el primer caso se detectaron el VPH 16 y el VPH 52. Este individuo fue infectado de manera crónica con el VPH 52 (infección en el día 1, y meses 32.5 y 33.6) en 8 de 11 especímenes, incluyendo tejido que fue extirpado durante un procedimiento de escisión electroquirúrgica con asa (LEEP por sus siglas en inglés). Se encontró VPH 16 en 1 de 11 especímenes en el Mes 32.5. El VPH 16 no fue detectado en el tejido que fue extirpado durante la LEEP. En el segundo caso, se detectaron VPH 16, VPH 51, y VPH 56. Este individuo fue infectado con VPH 51 (infección detectada por PCR en el día 1) en 2 de 9 especímenes. VPH 56 fue detectado (en tejido extirpado durante una LEEP) en 3 de 9 especímenes en el Mes 52. VPH fue detectado en 1 de 9 especímenes por biopsia en el mes 51. Dado que estos casos ocurrieron en el contexto de una infección mixta, con el tipo dominante no presente en la vacuna de VPH, parece ser que el tipo de VPH relacionado con la vacuna no fue el tipo de VPH causal. Con base a esta evaluación, puede deducirse que la eficacia de la vacuna contra la NIC 2/3 o AIS relacionada con el VPH 16/18 fue de 100%.
La eficacia de GARDASIL® contra NIC 2/3 o AIS relacionada con el VPH 16 fue de 97.9% (IC de 95%: 92.3%, 99.8%) en los protocolos combinados. La eficacia de GARDASIL® contra NIC 2/3 o AIS relacionada con el VPH 18 fue de 100% (IC de 95%: 86.6%, 100%) en los protocolos combinados.
La eficacia de GARDASIL® contra la NIV 2/3 relacionada con el VPH 16 ó 18 fue de 100% (IC de 95%: 55.5%, 100.0%) en los protocolos combinados. El análisis de cada uno de los protocolos demostró los siguientes resultados: 100% (IC de 95%:14.4%, 100.0%) en el FUTURE I y 100% (IC de 95%: <0.0%, 100.0%) en el FUTURE II.
La eficacia de GARDASIL® contra la NIVa 2/3 relacionada con el VPH 16 ó 18 fue de 100% (IC de 95%: 49.5%, 100.0%) en los protocolos combinados. El análisis de cada uno de los protocolos demostró los siguientes resultados: 100% (IC de 95%:<0.0%, 100.0%) en el FUTURE I y 100% (IC de 95%: <0.0%, 100.0%) en el FUTURE II.
La eficacia de GARDASIL® contra la NIC (NIC 1, NIC 2/3) o AIS relacionados con el VPH 6, 11, 16 o 18 fue de 96.0% (IC de 95%: 92.3%, 98.2%) al en los protocolos combinados. El análisis de cada uno de los protocolos demostró los siguientes resultados: 100% (IC de 95%:<0.0%, 100.0%) en el Protocolo 007, 100% (IC de 95%: 95.1%, 100.0%) en el FUTURE I y 93.8% (IC de 95%: 88.0%, 97.2%) en el FUTURE II.
La eficacia de GARDASIL® contra las lesiones genitales (verrugas genitales, NIV, NIVa, cáncer vulvar y cáncer vaginal) relacionadas con el VPH 6, 11, 16 ó 18 fue de 99.1% (IC de 95%: 96.8%, 99.9%) al en los protocolos combinados.
El análisis de cada uno de los protocolos demostró los siguientes resultados: 100% (IC de 95%:<0.0%, 100.0%) en el Protocolo 007, 100% (IC de 95%: 94.9%, 100.0%) en el FUTURE I y 98.7% (IC de 95%: 95.2%, 99.8%) en el FUTURE II.
La eficacia de GARDASIL® contra las verrugas genitales relacionadas con el VPH 6 y 11 fue de 99.0% (IC de 95%: 96.2%, 99.9%) en los protocolos combinados.
En el estudio de extensión a largo plazo FUTURE II, para mujeres entre 16 a 26 años de edad en la población PPE vacunada con GARDASIL® en el estudio de base y seguidas en un periodo de extensión, no hay casos de enfermedades causadas por el VPH tipos 6/11/16/18 relacionadas con NIC de cualquier grado observadas durante un máximo de aproximadamente 8 años. En este estudio, la protección duradera estadísticamente demostrada fue aproximadamente 6 años. En este estudio de extensión, las mujeres serán objeto de seguimiento hasta por 14 años.
— Análisis complementario de eficacia para los desenlaces del Cáncer en Mujeres de 16 a 26 años de edad:
En un análisis complementario, la eficacia de GARDASIL® fue evaluada contra el cáncer de cuello uterino (NIC 2/3 y AIS) Etapa 0 de acuerdo con la FIGO relacionado con el VPH 16/18 y para los precursores inmediatos del cáncer vulvar y vaginal (NIV 2/3 o NIVa 2/3 en la población PPE y en la población modificada por intención de tratar-2 (PMIT-2). La PMIT-2 consistió en individuos que no habían sido expuestos (eran inmunológicamente “vírgenes”) al tipo o tipos relevantes de VPH (tipos 6, 11, 16 y 18) antes de la dosis 1, que recibieron por lo menos una dosis de la vacuna o placebo, y que tuvieron por lo menos una visita de seguimiento después del Día 30. La población PMIT-2 fue diferente a la PPE en que la primera incluye individuos con violaciones importantes al protocolo y que se infectaron con un tipo incluido en la vacuna durante el periodo de vacunación. La eficacia se midió comenzando 30 días Postdosis 1 para la población PMIT-2.
La eficacia de GARDASIL® contra enfermedad relacionada con el VPH 16/18 fue de 96.9% (IC de 95%: 88.4%, 99.6%), 100% (IC de 95%: 30.6%, 100.0%), y 100% (IC de 95%: 78.6%, 100.0%) para NIC 3, AIS, y NIV 2/3 o NIVa 2/3, respectivamente, en la población PPE. La eficacia de GARDASIL® en contra de enfermedad relacionada con el VPH 16/18 fue de 96.7% (IC de 95%: 90.2%, 99.3%), 100% (IC de 95%: 60.0%, 100.0%), y 97.0% (IC de 95%: 82.4%, 99.9%) para NIC 3, AIS, y NIV 2/3 o NIVa 2/3, respectivamente, en la población PMIT-2.
La eficacia profiláctica en contra de la infección persistente o enfermedad en una fase de extensión del Protocolo 007, que incluyó datos desde el Mes 60, fue 95.8% (IC de 95%: 83.8%, 99.5%). En el grupo que recibió GARDASIL®, no se observaron casos a pesar de la inmunidad decreciente.
GARDASIL® fue igualmente eficaz contra las enfermedades por el VPH causadas por los tipos de VPH 6, 11, 16 y 18.
— Eficacia en Mujeres de 16 a 26 años de edad con Infección Actual o Previa con el VPH Tipos 6,11, 16 y 18:
Los individuos que ya estaban infectados con uno o más tipos de VPH relacionados con la vacuna antes de la vacunación fueron protegidos de la enfermedad clínica causada por los tipos de VPH remanentes.
Los individuos con evidencia de una infección previa que decidieron vacunarse al comienzo de la enfermedad fueron protegidos de una readquisición o recurrencia de la infección que los llevara a enfermedad clínica.
Los individuos que recibieron GARDASIL®, pero que tenían infección en curso por el VPH al momento de la vacunación, tuvieron un 21.6% (IC de 95%: <0.0%, 42.1%) menos incidencia de NIC (NIC 1 o NIC 2/3) o AIS como resultado de esta infección al compararse con placebo. La infección en curso se definió como una infección de un tipo de VPH contenido en la vacuna al momento de la inclusión, pero sin evidencia de respuesta inmune a la misma.
— Eficacia Profiláctica en una Población Generalmente No expuesta (eran inmunológicamente “vírgenes”) al VPH y la Población General del Estudio - VPH tipos 31, 33, 45, 52, 56, 58 y 59 en Mujeres de 16 a 26 Años de Edad:
La eficacia en protección cruzada de GARDASIL® fue evaluada en las bases de datos combinadas de los estudios FUTURE I y FUTURE II (N=17,599). El punto final primario de este análisis fue la incidencia combinada de NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 31 y 45. El punto final secundario de este análisis fue la incidencia combinada de NIC (grados 1, 2, 3) y AIS relacionadas con el VPH 31, 33, 45, 52 y 58. Los análisis también se realizaron para evaluar la eficacia con relación a la NIC (grados 1, 2, 3) o AIS causados por tipos de VPH de manera individual no incluidos en la vacuna. En sujetos que nunca habían sido expuestos (eran inmunológicamente “vírgenes”) a los tipos de VPH relevantes de la vacuna en el Día 1 (PMIT-2, n=16,895 para el punto final compuesto de 31/45 y n = 16,969 para el punto final compuesto de 31/33/45/52/58, se observó una tendencia hacia la reducción de la incidencia de NIC grados 1, 2, 3) o AIS relacionada con VPH 31-, y 45- y VPH 31-,33-, 45-, 52-, y 58-. La administración de GARDASIL® redujo la incidencia de NIC (grados 1, 2, 3) o AIS en 37.3% (IC de 95%: 17.0%, 52.8%), comparado con placebo. La administración de GARDASIL® redujo la incidencia de la NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 31, 33, 45, 52 y 58 en 26.4% (IC de 95%: 12.9%, 37.8%), comparado con placebo. La eficacia está dadapor reducciones en los desenlaces relacionados con el VPH 31, 33, 52 y 58. No hubo una evidencia clara de eficacia para el VPH 45. En un análisis post hoc, la administración profiláctica de GARDASIL® también redujo la incidencia de NIC (grados 1, 2, 3) o AIS relacionados con el VPH 56 y 59, comparado con placebo en esta población.
Análisis post hoc posteriores consideraron la eficacia en 2 poblaciones clínicamente relevantes: (1) una población nunca antes expuesta(eran inmunológicamente “vírgenes”) al VPH (con resultado negativo a 14 tipos comunes de VPH y que tuvo una prueba de Papanicolaou con resultado negativo para LICE [lesiones intraepiteliales de células escamosas] en el Día 1), la cual asemejaba una población de adolescentes y mujeres jóvenes adultas sin experiencia sexual previa más mujeres jóvenes adultas poco después de su debut sexual; y (2) la población general del estudio de mujeres jóvenes adultas sin importar su estado de VPH inicial, algunas de ellas con enfermedad relacionada con el VPH al comienzo de la vacunación. La administración de GARDASIL® a individuos sin exposición previa al VPH, redujo las incidencias de NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 31, 33, 52 y 58, de NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 56 y de NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 59. Las reducciones en las tasas de estas enfermedades también fue observada en la población general del estudio (la cual incluyó mujeres sin exposición previa al VPH y mujeres infectadas con el VPH).
En la población sin exposición previa al VPH (n=9,296), GARDASIL® redujo la incidencia de NIC (cualquier grado) o AIS en 43.6% (IC de 95%: 12.9%, 64.1%) para el VPH tipos 31/45; 29.2% (IC de 95%: 8.3%, 45.5%) para el VPH tipos 31/33/45/52/58; 33.8% (IC de 95%: 13.4%, 49.6%) para el VPH tipos 31/33/52/58; 27.6% (IC de 95%: <0.0%, 49.3%) para el VPH tipo 56; y 22.3% (IC de
95%:<0.0%, 58.9%) para el VPH tipo 59.
En la población general del estudio (n = 17,151), GARDASIL® redujo la incidencia de NIC (cualquier grado) o AIS en 23.2% (IC de 95%: 5.6%, 37.7%) para el VPH tipos 31/45; 19.6% (IC de 95%: 8.2%, 29.6%) para el VPH tipos 31/33/45/52/58; 21.2% (IC de 95%: 9.6%, 31.3%) para el VPH tipos 31/33/52/58; 16.8% (IC de 95%: <0.0%, 32.8%) para el VPH tipo 56; y 39.2% (IC de
95%: 8.1%, 60.3%) para el VPH tipo 59.
Los análisis de eficacia cruzada demostraron que la administración profiláctica de GARDASIL® a adolescentes y mujeres jóvenes adultas reduce el riesgo de que adquieran NIC 1, NIC 2/3 y AIS causadas por los tipos de VPH 31, 33, 52, 56, 58 y 59.
— Protección contra la carga general de Enfermedad por VPH Cervical, Vulvar y Vaginal en Mujeres de 16 a 26 años de edad:
El impacto de GARDASIL® en contra del riesgo general de enfermedad cervical, vulvar y vaginal causado por el VPH (p. ej., enfermedad causada por cualquier tipo de VPH) fue evaluado en un análisis pre especificado en 17,599 sujetos incluidos en el FUTURE I y FUTURE II. Entre estos sujetos que no tuvieron exposición previa por lo menos a uno de los 14 tipos comunes de VPH y/o tuvieron una prueba de Papanicolaou negativa para LICE [lesión intraepitelial de células escamosas] en el Día 1 (población PMIT-2), la administración de GARDASIL® redujo la incidencia de NIC 2/3 o AIS causados por tipos de VPH contenidos o no en la vacuna en 33.8% (IC de 95%: 20.7%, 44.8%).
Se realizaron análisis posteriores de eficacia en 2 poblaciones clínicas relevantes: (1) una población nunca antes expuesta (eran inmunológicamente “vírgenes”) al VPH (con resultado negativo a 14 tipos comunes de VPH y que tuvo una prueba de Papanicolaou con resultado negativo para LICE [lesiones intraepiteliales de células escamosas] en el Día 1), la cual asemejaba una población de adolescentes y mujeres jóvenes adultas sin experiencia sexual previa más mujeres jóvenes adultas poco después de su debut sexual; y (2) la población general del estudio de mujeres jóvenes adultas sin importar su estado de VPH inicial, algunas de ellas con enfermedad relacionada con el VPH al comienzo de la vacunación.
Entre las mujeres sin exposición previa al VPH y entre la población general del estudio (incluyendo mujeres con infección por VPH al comienzo de la vacunación), GARDASIL® redujo la incidencia general de NIC 2/3 o AIS; de NIV 2/3 o NIVa 2/3; o NIC (de cualquier grado) o AIS; y de verrugas genitales. Estas reducciones se debieron principalmente a reducciones en las lesiones causadas por el VPH tipos 6, 11, 16 y 18. Entre los individuos sin exposición previa y la población general del estudio, el beneficio de la vacuna con respecto a la incidencia general de NIC 2/3 o AIS (causados por cualquier tipo de VPH) fue más evidente con el transcurso del tiempo. Lo anterior debido a que GARDASIL® no tiene un impacto sobre la evolución de las infecciones que estén presentes al comienzo de la vacunación. Dichas mujeres infectadas pueden tener NIC 2/3 o AIS al comienzo de la vacunación y algunas desarrollarán NIC 2/3 o AIS durante el seguimiento. GARDASIL® reduce la incidencia de NIC 2/3 o AIS causadas por infecciones por el VPH tipos 6, 11, 16, 18, 31, 33, 52, 56, 58 y 59 que ocurran después del comienzo de la vacunación.
GARDASIL® no ha demostrado proteger contra enfermedades causadas por cada tipo de VPH, y no tratará la enfermedad preexistente. La eficacia general de GARDASIL® variará con la prevalencia inicial de la infección y enfermedad por VPH, la incidencia de la infección en contra de las cuales GARDASIL® ha demostrado protección, y en aquellas infecciones en contra de las cuales GARDASIL® no ha demostrado proteger.
— Impacto en las Tasas de Anormalidades de la Prueba de Papanicolaou y en Procedimientos Cervicales, Vulvares y Vaginales en Mujeres de 16 a 26 años de edad:
El impacto de GARDASIL® en las tasas de pruebas de Papanicolaou y procedimientos cervicales (biopsia colposcópica, terapia definitiva) independientemente de los tipos de VPH causales fue evaluada en 18,150 sujetos incluidos en el Protocolo 007, el FUTURE I y FUTURE II. El impacto de GARDASIL® en las tasas de procedimientos de escisión para tratar las lesiones causadas por cualquier tipo de VPH fue evaluado en 5,455 sujetos incluidos en el FUTURE I. Se consideraron dos poblaciones: (1) una población sin exposición previa al VPH (con resultado negativo a 14 tipos comunes de VPH y que tuvieron una prueba de Papanicolaou que fue negativa a LICE [lesión intraepitelial de células escamosas] en el Día 1), la cual asemejaba una población de adolescentes y mujeres jóvenes adultas sin experiencia sexual previa más mujeres jóvenes adultas poco después de su debut sexual; y (2) la población general del estudio de mujeres jóvenes adultas sin importar su estado de VPH inicial, algunas de ellas con enfermedad relacionada con el VPH al comienzo de la vacunación.
En ambas poblaciones, GARDASIL® redujo las proporciones de mujeres que experimentaron una anormalidad en la prueba de Papanicolaou sugerente de NIC, una biopsia colposcópica, un procedimiento de tratamiento de cuello uterino definitivo (escisión electro quirúrgica con asa o conización por criocirugía), una biopsia vulvar o vaginal, o un procedimiento de escisión definitivo en la vagina o vulva.
Adicionalmente, la administración de GARDASIL® a la población general de mujeres de 16 a 26 años de edad no expuesta (eran inmunológicamente “vírgenes”) a VPH redujo la incidencia de anormalidades en la prueba de papanicolaou (ASCUS positivas para VPH de alto riesgo, LICE de bajo grado, o peores) relacionadas con el VPH 16 y 18 en 92.4% (IC de 95%: 83.7%, 97.0%) y
96.9% (IC de 95%: 81.6%, 99.9%) en el estudio FUTURE I.
— Eficacia Profiláctica - VPH tipos 6, 11, 16 y 18 - en Mujeres de 24 a 45 Años de Edad:
No ha sido definido un nivel mínimo de anticuerpos antiVPH que proporcione protección contra infección y enfermedad por VPH. Asimismo, las respuestas inmunes a las vacunas en personas mayores son comúnmente más bajas comparadas con las de los jóvenes. Por lo tanto, para confirmar la utilidad de GARDASIL® para prevenir cánceres cervical, vulvar, y vaginal y enfermedades relacionadas causadas por los tipos objetivo de la vacuna en mujeres de hasta 45 años de edad, se realizó un estudio de eficacia (FUTURE III).
GARDASIL® fue altamente eficaz en reducir la incidencia de infección persistente; NIC (cualquier grado); lesiones genitales externas (LGE) causadas por los tipos de VPH 6, 11, 16, y 18. GARDASIL® fue también altamente eficaz en reducir la incidencia de VPH 16/18 relacionada con el diagnóstico por prueba de Papanicolaou de ASCUS (células escamosas atípicas de significado indeterminado) positivas para alto riesgo de VPH. Los análisis primarios de eficacia, con respecto a los tipos de VPH 6, 11, 16, y 18, fueron conducidos en una población PPE. La eficacia fue medida después de la visita 7 del Mes.
La eficacia de GARDASIL® contra VPH 6-, 11-, 16- o 18- relacionados con infección persistente, NIC (cualquier grado) o LGE fue de 88.7% (IC de 95%: 78.1%, 94.8%).
La eficacia de GARDASIL® contra VPH 16- ó 18- relacionados con infección persistente, NIC (cualquier grado), o LGE fue de 84.7% (IC de 95%: 67.5%, 93.7%).
Hubo 1 caso de NIC 2 (VPH 16 y VPH 51 identificados) en el grupo de PPE. El caso NIC 2 fue positivo para VPH tipos 16 y 51 mediante biopsia en el Mes 18. Los 9 casos remanentes en el grupo PPE fueron de infección persistente.
La eficacia de GARDASIL® contra infección persistente relacionada con VPH 6-, u 11-, NIC (cualquier grado) o LGE fue de 94.8% (IC de 95%: 79.9%, 99.4%).
La eficacia de GARDASIL® contra el diagnóstico de ASCUS positivas para VPH de alto riesgo por Papanicolaou, relacionadas con VPH 16/18 fue de 96.3% (IC de 95%: 77.7%, 99.9%).
Con base en estos hallazgos de eficacia, puede deducirse la eficacia de GARDASIL® con respecto a la prevención de cáncer cervical, vulvar, y vaginal y enfermedades relacionadas en mujeres de hasta 45 años de edad.
En la extensión a largo plazo del estudio FUTURE III, para las mujeres de 24 a 45 años de edad, en la población PPE vacunadas con GARDASIL® en el estudio de base y seguidas en la extensión, no hay casos de enfermedades de VPH, (NIC de cualquier grado y verrugas genitales relacionadas con VPH de los tipos 6 / 11 / 16 /18 ) en seguimiento hasta aproximadamente 6 años. En esta extensión del estudio, las mujeres serán objeto de seguimiento hasta 10 años.
— Eficacia profiláctica VPH tipos 6, 11, 16 y 18 en adolescentes y hombres entre los 16 y los 26 años:
En estudios clínicos realizados en niños y hombres, la eficacia fue evaluada empleando los siguientes desenlaces: verrugas genitales externas; neoplasias intraepiteliales de pene, perianales y perineales (NIP) grados 1, 2, y 3 o cáncer de pene, perianales y perineales e infecciones persistentes. El NIPs de alto grado está asociado con ciertos tipos de cáncer de pene, perianales y perineales. Las infecciones persistentes son predictores de enfermedad clínica.
Los análisis primarios de la eficacia fueron conducidos por población PPE. Esta población consistió en individuos que recibieron las 3 dosis dentro del primer año de entrada al estudio, no se presentaron mayores desviaciones del protocolo y no tenían contacto (PCR negativo y seronegativo) con los tipos relevantes de VPH (6, 11, 16, 18) previos a la primera dosis y hasta un mes después de la tercera dosis. La eficacia fue medida después de la visita del séptimo mes.
GARDASIL® fue eficaz reduciendo la incidencia de lesiones genitales externas (Condilomas y NIP grados 1, 2 y 3) e infecciones persistentes relacionados con VPH tipos 6, 11, 16 y 18 en aquellos que tenian PCR negativa y eran seronegativos.
La eficacia de GARDASIL® contra Lesiones genitales externas relacionadas con VPH del tipo 6, 11, 16 o 18 (Condiloma y NIP grados 1, 2 y 3) fue de 90.6% (IC de 95%: 70.1%, 98.2%). El análisis de los componentes individuales del desenlace demostró los siguientes resultados: 89.3% (IC de 95%: 65.3%, 97.9%) para condiloma y 100 % (IC de 95%: <0.0%, 100.0%) para NIP grados 1, 2 y 3.
La eficacia de GARDASIL® contra infecciones persistentes relacionadas con VPH del tipo 6, 11, 16 o 18 fue de 85.5% (IC de 95%: 77.0%, 91.3%). El análisis de serotipos de VPH relacionados con la infección persistente demostraron los siguientes resultados: 90.1% (IC de 95%: 75.3%, 96.9%), 94.4% (IC de 95%: 64.7%, 99.9%), 79.3% (IC de 95%: 61.9%, 89.6%), y 93.9% (IC de 95%: 76.3%, 99.3%), para infecciones persistentes relacionadas con VPH tipo 6-, 11-, 16- y 18, respectivamente.
— Eficacia profiláctica - enfermedad anal causada por VPH de los tipos 6, 11 ,16 y 18 en adolescentes y hombres entre los 16 y los 26 años dentro del sub-estudio MSM (hombres que mantienen sexo con hombres):
Un subestudio del protocolo 020 evaluó la eficacia de GARDASIL® contra la enfermedad anal (neoplasia intraepitelial anal y cáncer anal) en una población de 598 MSM. En este sub-estudio, los casos de neoplasia Intraepitelial anal (NIA) grado 2 y 3 fueron los desenlaces de eficacia usados para evaluar la prevención del cáncer anal relacionado con el VPH. Los análisis primarios de la eficacia se realizaron en la población PPE en el protocolo de eficacia 020.
GARDASIL® fue eficaz en la reducción de la incidencia de NIA grados 1 (condiloma acuminado y no acuminado), 2 y 3 relacionados con VPH tipos 6, 11, 16 y 18 en aquellos adolescentes y hombres quienes presentaron PCR negativa y eran seronegativos en la línea base.
La eficacia de GARDASIL® contra NIA 1, 2 y 3 relacionada con VPH tipos 6, 11, 16 y 18 fue del 77.5% (IC de 95%: 39.6%, 93.3%). Análisis de los componentes individuales de los desenlaces demostraron los siguientes resultados: 74.9% (IC de 95%: 8.8%, 95.4%) para NIA grados 2/3 y 73.0% (IC de 95%: 16.3%, 93.4%) para NIA grado 1 (condiloma acuminado y no acuminado).
La duración de la protección contra el cáncer anal es actualmente desconocida. En el estudio de extensión a largo plazo del Protocolo 020 para hombres entre 16 y 26 años de edad, en la población PPE de los hombres vacunados con GARDASIL® en el estudio de base y seguidos en la extensión, no hay casos de enfermedades de VPH (verrugas genitales relacionadas con VPH 06 y 11, lesiones genitales externas y cualquier grado de AIN relacionados con VPH 6/11/16/18 en MSM) hasta aproximadamente 6 años después. En este estudio de extensión, los hombres serán seguidos hasta 10 años.
• Inmunogenicidad:
— Análisis Para Medir la Respuesta Inmune:
Análisis de tipo con estándares de tipo específico fueron utilizados para evaluar la inmunogenicidad contra cada tipo de VPH de la vacuna. Estos inmunoensayos Luminex multiplexedcompetitivos midieron anticuerpos contra epítopes neutralizantes para cada tipo de VPH, en lugar de los anticuerpos totales dirigidos contra las partículas parecidas al virus de la vacuna. Las escalas para los análisis son únicas para cada tipo de VPH; por lo tanto, las comparaciones entre tipos y con otros análisis carecen de significado. Se demostró que los análisis empleados para medir la respuesta inmune a GARDASIL® se correlacionaron con la capacidad para neutralizar los viriones vivos de VPH.
Debido a la gran eficacia de GARDASIL® en los estudios clínicos, no ha sido posible establecer los niveles mínimos de anticuerpos anti-VPH 6, anti- VPH 11, anti-VPH 16 y anti-VPH 18 que protegen contra la enfermedad manifiesta por VPH.
La inmunogenicidad de GARDASIL® se evaluó en 23,951 mujeres y niñas de 9 a 45 años de edad (GARDASIL®, N = 12,634; placebo, N = 11,317) y en 5,417 niños y hombres (GARDASIL®, N = 3,109; placebo, N = 2,308) y adolescentes de 9 a 26 años de edad.
Los análisis primarios de inmunogenicidad se llevaron a cabo en una población de inmunogenicidad con apego al protocolo (IAP). Esta población consistió en individuos que eran seronegativos y tenían una reacción en cadena de la polimerasa (PCR) negativa para el tipo o tipos relevantes de VPH a su ingreso, que mantuvieron una PCR negativa para el tipo o tipos relevantes de VPH hasta un mes después de la tercera dosis (Mes 7), que recibieron las tres dosis de vacuna y que no se desviaron del protocolo del estudio de alguna manera que pudiera interferir con los efectos de la vacuna.
La inmunogenicidad fue medida por (1) el porcentaje de individuos que fueron seropositivos para anticuerpos contra los tipos relevantes de la vacuna de VPH, y (2) los Títulos Geométricos Promedio (TGP).
— La Respuesta Inmune a GARDASIL® en el Mes 7 en niñas de 9 a mujeres de 45 años (Punto en el Tiempo Aproximado al Pico Máximo de Inmunogenicidad):
En la población IAP en mujeres de 9 a 45 años de edad, la seropositividad en el Mes 7 fluctuó de 96.4% a 99% para los 4 tipos de la vacuna y a través de las poblaciones definidas por rango de edad. Los TGPs antiVPH para todos los tipos disminuyeron con la edad. Este hallazgo era de esperarse, ya que las respuestas inmunes a las vacunas generalmente disminuyen con la edad de la vacunación. La eficacia de GARDASIL® permaneció alta a pesar de la disminución observada en los TGPs antiVPH relacionados con la edad.
— Respuesta inmune de GARDASIL® en el mes 7 en niños y hombres entre los 9 y los 26 años (punto en el tiempo aproximado de mayor inmunogenicidad):
En la población IAP entre 9 y 26 años, el rango de seropositivos en el mes 7 fue de 97.4% al 99.9% para la vacuna contra los 4 tipos y para el rango de población definido. Los TGPs anti VPH para todos los tipos de virus disminuyeron con la edad. Este hallazgo se esperaba, puesto que la respuesta inmune a la vacunación disminuye con la edad de vacunación. La eficacia de GARDASIL® permaneció alta a pesar de la disminución de TPGs anti-VPH relacionados con la edad.
— Comparación de la eficacia de GARDASIL® en los adultos jóvenes y en los adolescentes:
Un estudio clínico comparó las respuestas contra el VPH-6, el VPH-11, el VPH-16 y el VPH-18 en mujeres de 10 a 15 años de edad con las respuestas en mujeres de 16 a 23 años de edad. Entre los individuos que recibieron GARDASIL®, 99.1% a 100% se volvieron seropositivos contra el VPH-6, el VPH-11, el VPH-16 y el VPH-18, respectivamente, al término de un mes después de la tercera dosis. Las respuestas anti-VPH, en niñas y adolescentes de 10 a 15 años de edad, fueron significativamente superiores a las observadas en las mujeres de 16 a 23 años de edad.
Se observaron resultados similares en una comparación de las respuestas anti-VPH un mes después de la tercera dosis en niñas de 9 a 15 años de edad con las respuestas anti-VPH en mujeres de 16 a 23 años de edad, en la base de datos combinada de los estudios de inmunogenicidad de GARDASIL®.
Las respuestas anti-VPH 6, 11, 16 y 18 (TGPs) fueron comparadas entre hombres adolescentes de 9 a 15 años y hombres adultos de 16 a 26 años. De los individuos que recibieron GARDASIL®
97.4% al 99.9% se volvieron seropositivos Contra-VPH 6, 11, 16 y 18, para el primer mes después de la tercera dosis. La respuesta anti-VPH en el grupo de hombres adolescentes entre 9 y 15 años fue significativamente superior a la observada en el grupo de los niños y hombres entre 16 y 26 años de edad.
Con base en la comparación de la inmunogenicidad, la eficacia de GARDASIL® en niñas de 9-15 años es comparable a la eficacia de GARDASIL® observada en mujeres entre los 16 y los 26 años. Adicionalmente, la eficacia de GARDASIL® en niños de 9 a 15 años es comparable a la eficacia de GARDASIL® observada en estudios en hombres de 16 a 26 años.
En el estudio de extensión a largo plazo del Protocolo 018, para niñas y niños entre 9 y 15 años vacunados con Gardasil en el estudio de base y seguidos en la extensión, no hay casos de enfermedades relacionadas con VPH (NIC de cualquier grado relacionado con tipos de VPH 6/11/16/18 y / o verrugas genitales) observados después de una mediana de seguimiento de aproximadamente 6,9 y 6,5 años, respectivamente. En este estudio de extensión, las niñas y los niños serán objeto de seguimiento por 10 años.
— Persistencia de la Respuesta Inmune a GARDASIL®:
La duración de la inmunidad después de un programa completo de inmunización con GARDASIL® no ha sido establecida.
En el Protocolo 007, se observaron picos anti-VPH 6, anti-VPH 11, anti-VPH 16 y anti-VPH 18 TGP al mes 7. Los TGP se redujeron hacia el mes 24 y luego por lo general se estabilizaron al menos por 60 meses (ver Figura 1).
Un subconjunto de las personas inscritas en los estudios de fase III fue seguido por un período de largo plazo para evaluar la seguridad, inmunogenicidad y eficacia. Se utilizó IgG total con Inmunoensayo Luminex (IgG IEL) para evaluar la persistencia de la respuesta inmune, además de IEQL (inmunoensayo químico lumínico).
En todas las poblaciones (mujeres 9 - 45 años, hombres 9 - 26 años), se observaron picos anti- VPH 6, anti-VPH 11, anti-VPH 16 y anti-VPH 18 TGPs por IEQL en el Mes 7. Posteriormente, los TGP disminuyeron hacia el Mes 24-48 y luego generalmente se estabilizaron. Actualmente se está estudiando la duración exacta de la inmunidad después de una serie de 3 dosis.
Las niñas y niños de entre 9-15 años de edad vacunados con GARDASIL® en el estudio de base Protocolo 018 se seguirán para evaluar la persistencia de la inmunidad hasta 10 años en un estudio de extensión. Dependiendo del tipo de VPH, 64-97% y 89 - 100% de los sujetos fueron seropositivos por IEQL e IgG IEL respectivamente 8 años después de la vacunación.
Figura 1
Persistencia de las Respuestas Anti-VPH Después de Aplicar un Esquema de 3-dosis de GARDASIL®
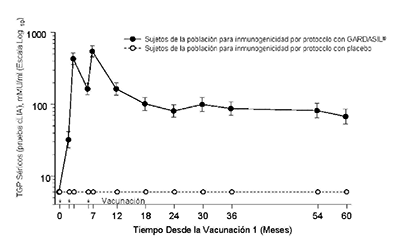
Persistencia de las Respuestas AntiVPH 6
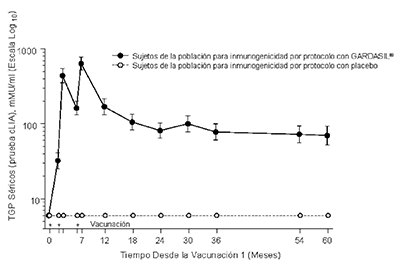
Persistencia de las Respuestas AntiVPH 11
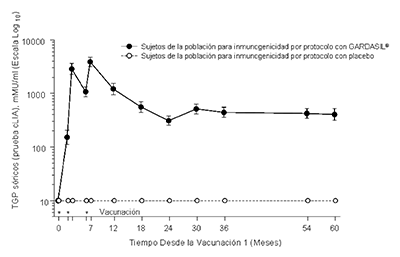
Persistencia de las Respuestas AntiVPH 16
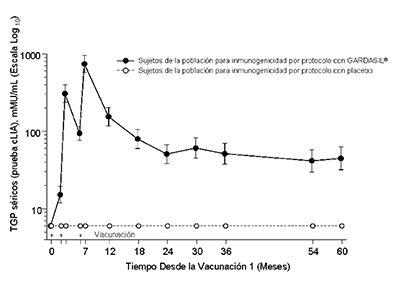
Persistencia de las Respuestas AntiVPH 18
Las mujeres entre 16 - 23 años de edad vacunadas con GARDASIL® en el estudio de base FUTURE II serán objeto de seguimiento a los 14 años en un estudio de extensión. Nueve años después de la vacunación, 94%, 96%, 99% y 60% eran anti-VPH 6, anti-VPH 11, anti-VPH 16 y anti-VPH 18 seropositivos en las cLIA, respectivamente, y 98%, 96%, 100% y 91% eran anti- VPH 6, anti- VPH 11, VPH 16 anti-y anti- VPH 18 seropositivos en el IEL IgG, respectivamente.
Las mujeres entre 24 - 45 años de edad vacunadas con GARDASIL® en el estudio de base FUTURE III serán seguidos hasta 10 años en un estudio de extensión. Seis años después de la vacunación, el 89%, 92%, 97% y 45% eran anti-VPH 6, anti-VPH 11, anti-VPH 16 y anti-VPH 18 seropositivos en los IEQL, respectivamente, y el 88%, 84%, 100% y 82% eran anti- VPH 6, anti- VPH 11, VPH 16 anti-y anti- VPH 18 seropositivos en el IEL IgG, respectivamente.
Los hombres entre 16-26 años de edad vacunados con GARDASIL® en el estudio de base Protocolo 020 se seguirán hasta 10 años en un estudio de extensión. Seis años después de la vacunación, el 84%, 87%, 97% y 48% eran anti-VPH 6, anti-VPH 11, anti-VPH 16 y anti-VPH 18 seropositivos en los IEQL, respectivamente, y el 89%, 86%, 100% y 82% eran anti- VPH 6, anti- VPH 11, VPH 16 anti-y anti- VPH 18 seropositivos en el IEL IgG, respectivamente.
En estos estudios de más largo plazo de seguimiento en mujeres de 16 a 45 años y hombres de 16 a 26 años, los individuos que eran seronegativos para anti-VPH 6, anti-VPH 11, anti-VPH 16 y anti-VPH 18 en el IEQL , al final del estudio, seguían siendo protegidos contra la enfermedad clínica después de un seguimiento de 9 años para las mujeres 16 - 23 años de edad, 6 años para las mujeres 24 - 45 años de edad, y 6 años en hombres de 16 a 26 años de edad.
— Evidencia de Memoria Inmune:
Se observó la evidencia de una respuesta de memoria inmunológica en individuos vacunados que eran seropositivos al tipo de VPH relevante(s) antes de la vacunación.
En un estudio para evaluar la capacidad de inducir memoria inmunológica, los individuos que recibieron una serie de 3 dosis de la vacuna recibieron una dosis de desafío de GARDASIL® 5 años después del inicio de la vacunación. Estos individuos mostraron una respuesta de memoria inmunológica rápida y fuerte que superó el Título médio geométrico (TMG) anti-VPH observadas 1 mes después de la dosis 3 (Mes 7). Los TMGs una semana después de la dosis fueron 0.9-, 2.2-, 1.2-, y 1,4 veces mayor que los TMG de la dosis 3 para los tipos 6, 11, 16 y 18, respectivamente. Los TMGs con la dosis después de la exposición 1 mes fueron 1.3-, 4.2-, 1.5-, y 1,7 veces mayor que los de la dosis 3 para los tipos 6, 11, 16 y 18, respectivamente. Una semana después de la primera dosis, 87,2%, 94,9%, 86,4% y 95,2% de los individuos tenían TGMs anti-VPH 6, anti-VPH 11, anti-VPH 16 y anti-VPH 18 superiores a las detectadas en el mes 60.
Además, un subgrupo de individuos que recibieron una serie primaria de 3 dosis de la vacuna se convirtió nominalmente anti-VPH 18 seronegativos en el mes 60. Aunque estos individuos eran nominalmente anti-VPH 18 seronegativos, no se detectaron casos de enfermedades relacionadas con el VPH 18 entre estos individuos. También mostraron memoria inmune: Cuando estos individuos recibieron una dosis de desafío de GARDASIL® (en el mes 60), 93% y 97% se convirtieron en anti- VPH 18 seropositivos por 1 semana y 1 mes después de la estimulación, respectivamente; 73% tenían 18 niveles en 1 mes después de la estimulación que fueron superiores a los anti-VPH nivel 18 dell mes 7 (1 mes después de la dosis 3).
— Flexibilidad del esquema:
Todos los individuos evaluados en las poblaciones PPE de los estudios de Fase II y III recibieron el esquema de tres dosis de GARDASIL® en el transcurso de un año, independientemente del intervalo entre las dosis. Un análisis de los datos sobre la respuesta inmune sugiere que la flexibilidad de ±1 mes para la segunda dosis (es decir, del mes 1 al mes 3 en el esquema de vacunación) y la flexibilidad de ±2 meses para la tercera dosis (es decir, del mes 4 al mes 8 en el esquema de vacunación) no influye sustancialmente en las respuestas inmunes a GARDASIL® (véase Dosis y administración).
— Respuestas inmunes a GARDASIL® con un esquema de 2 dosis:
Un ensayo clínico mostró que, en el mes 7, la respuesta inmunitaria en niñas de 9 a 13 años (n = 259) que recibieron 2 dosis de GARDASIL® (a los 0, 6 meses) no fue inferior a la respuesta inmune en mujeres mayores de 16 años - 26 años (n = 310) que recibieron 3 dosis de GARDASIL® (a los 0, 2, 6 meses). No se ha establecido la duración de la protección de un esquema de 2 dosis de GARDASIL®.
— Estudios con otras vacunas:
H-B-VAX II [Vacuna hepatitis B (recombinante)]: La seguridad e inmunogenicidad de la co-administración de GARDASIL® con H-B-VAX II [vacuna hepatitis B (recombinante)] (en la misma visita, sitios separados de inyección) fueron evaluadas en un estudio aleatorizado de 1,871 mujeres entre 16 y 24 años de edad en el momento del enrolamiento. La respuesta inmune y el perfil de seguridad para ambas vacunas H-B-VAX II y GARDASIL® fueron similares incluso al ser administradas en la misma visita o en diferentes visitas.
Repevax (Difteria, Tetanos, Pertussis (componente acelular)) y Poliomielitis (Vacuna que contiene antígenos inactivados reducidos adsorbidos): La seguridad e inmunogenicidad de la co-administración de GARDASIL® con Repevax y vacuna de Polio (en la misma visita, sitios separados de inyección) fueron evaluadas en un estudio aleatorizado de 843 niños y niñas de 11 a 17 años de edad al momento del enrolamiento. La administración concomitante de GARDASIL® con Repevax y vacuna de Polio no interfiere con la respuesta de los anticuerpos a alguno de los componentes de la vacuna. Adicionalmente, el perfil de seguridad fue generalmente similar (ver Reacciones adversas, Administración concomitante con otras vacunas).
Menactra [Vacuna conjugada Meningococo (Grupos A, C, Y y W-135) y Toxoide de Difteria] y Adacel [Vacuna adsorbida de Toxoide de Tétanos, Toxoide reducido de Difteria y Pertussis acelular]: La seguridad e inmunogenicidad de la coadministración de GARDASIL® con Menactra y Adacel (la misma visita, sitios separados de inyección) fueron evaluadas en un estudio randomizado de 1040 niños y niñas de 11 a 17 años de edad en el momento del enrolamiento. La administración concomitante de GARDASIL® con Menactra y Adacel no interfiere con la respuesta de los anticuerpos a alguno de los componentes de estas vacunas. Adicionalmente el perfil de seguridad fue generalmente similar (ver Reacciones adversas, Administración concomitante con otras vacunas).
ADVERTENCIAS Y PRECAUCIONES:
General: Como es el caso de cualquier vacuna, la vacunación con GARDASIL® puede no producir protección en todos los receptores de la vacuna.
Esta vacuna no está destinada para ser usada para el tratamiento de lesiones genitales externas activas, cáncer de cuello uterino, vulvar, vaginal, o anal; NIC, NIV, NIVa o NIA.
Esta vacuna no protegerá contra enfermedades que no son causadas por VPH.
Como sucede con todas las vacunas inyectables, siempre deberá estar fácilmente disponible un tratamiento médico apropiado en caso de reacciones anafilácticas raras después de la administración de la vacuna.
Después de cualquier vacunación, o incluso antes, se puede producir, especialmente en adolescentes, síncope (desmayos), algunas veces asociado a caídas. Durante la recuperación éste puede ir acompañado de varios signos neurológicos tales como deterioro visual transitorio, parestesia y movimientos involuntarios en extremidades. Por lo tanto, debe observarse cuidadosamente a los vacunados durante aproximadamente 15 minutos después de la administración de la vacuna. (Ver Efectos colaterales, Reportes Post-comercialización).
La decisión para administrar o retrasar la vacunación debido a una enfermedad febril actual o reciente depende en gran medida de la gravedad de los síntomas y su etiología. La fiebre baja y la infección leve de las vías respiratorias superiores generalmente no son contraindicaciones para la vacunación.
Los individuos con respuesta inmunitaria deficiente, ya sea por el uso de terapia inmunosupresora, un defecto genético, infección por el Virus de Inmunodeficiencia Humana (VIH), u otras causas, podrían tener reducida la respuesta de los anticuerpos a la inmunización activa (ver Interacciones con otros medicamentos o alimentos).
Esta vacuna deberá administrarse con precaución a los individuos con trombocitopenia o algún trastorno de coagulación debido a que puede ocurrir hemorragia después de la administración intramuscular en estos individuos.
DOSIS Y ADMINISTRACIÓN:
• Dosificación:
GARDASIL® se debe administrar intramuscularmente como 3 dosis separadas de 0.5 - mL de acuerdo con el siguiente programa:
— Primera dosis: En la fecha elegida.
— Segunda dosis: 2 meses después de la primera dosis.
— Tercera dosis: 6 meses después de la primera dosis.
Se anima a que los individuos cumplan un programa de vacunación de 0, 2, y 6 meses. Sin embargo, en estudios clínicos, se ha demostrado la eficacia en individuos que recibieron las 3 dosis en un periodo de 1 año. La segunda dosis se deberá administrar al menos 1 mes después de la primera dosis, y la tercera dosis se deberá administrar al menos 3 meses después de la segunda dosis. Las tres dosis deben ser administradas dentro de un período de 1 año.
Alternativamente, en individuos de 9 hasta 13 años de edad, GARDASIL® puede ser administrado de acuerdo a un esquema de 2 dosis (0, 6 meses o 0, 12 meses).
El uso de GARDASIL® debe estar de acuerdo con las recomendaciones oficiales.
Se recomienda que los individuos que reciben una primera dosis de GARDASIL® completen el curso de la vacunación con GARDASIL®.
La necesidad de una dosis de refuerzo no ha sido establecida.
• Método de administración:
GARDASIL® se deberá administrar intramuscularmente en la región deltoide del brazo o en el área anterolateral superior del muslo.
GARDASIL® no se debe inyectar intravascularmente. Tampoco han sido objeto de estudio la administración subcutánea ni intradérmica. Estos métodos de administración no son recomendados.
La jeringa prellenada es sólo para un único uso y no se deberá usar para más de un individuo. Para viales de uso único se debe usar una jeringa y aguja estéril individual para cada individuo.
La vacuna se deberá usar tal cual se suministra; no es necesario dilución ni reconstitución. Se deberá usar la dosis completa recomendada de la vacuna.
Agitar bien antes de usar. Es necesario agitar bien inmediatamente antes de la administración para mantener la suspensión de la vacuna.
Después de agitar bien, GARDASIL® es un líquido blanco, turbio. Los productos parenterales del fármaco deberán ser inspeccionados visualmente antes de su administración, con respecto a materia particulada y decoloración. Desechar el producto si existen materias particuladas o si existe decoloración.
Uso de vial de dosis única: Retirar la dosis de la vacuna de 0.5 mL del vial de dosis única usando una aguja y jeringa estéril libre de preservantes, antisépticos, y detergentes. Una vez que el vial de dosis única ha sido penetrado, la vacuna extraída se deberá usar inmediatamente, y el vial se deberá desechar.
Uso de jeringa prellenada: Inyectar todo el contenido de la jeringa.
SOBREDOSIS: Han habido informes de administración de dosis de GARDASIL® superiores a las recomendadas. En general, el perfil de eventos adversos reportados con sobredosis fue comparable a las dosis únicas recomendadas de GARDASIL®.
ALMACENAMIENTO: Consérvese en refrigeración entre 2 °C y 8 °C. No congelar. Protéjase de la luz.
GARDASIL® se debe administrar lo más pronto posible después de sacarlo del refrigerador. GARDASIL® puede estar fuera de refrigeración (a una temperatura de 25 °C/77 °F o menor) durante un tiempo total de no más de 72 horas.
Este documento fue actualizado por última vez en Febrero de 2015.
WPC-V501-I-022015
MERCK SHARP & DOHME
Bogotá, D.C. - Colombia
DISPONIBILIDAD: GARDASIL® [Vacuna Recombinante Tetravalente contra el Virus de Papiloma Humano (Tipos 6, 11, 16, 18)]. (Reg. San. No. INVIMA 2006M-0006714).
GARDASIL® se encuentra disponible en jeringa prellenada y vial.
Presentaciones disponibles:
— Caja con 1 jeringa prellenada conteniendo una dosis de 0.5 mL.
— Caja con 10 jeringas prellenadas conteniendo una dosis de 0.5 mL.