
EZETROL
EZETIMIBA
Tabletas
, Caja,10-20 Tabletas,
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
INDICACIONES:
Hipercolesterolemia primaria: EZETROL® administrado con un inhibidor de la HMG-CoA reductasa (estatina) o solo, está indicado como tratamiento coadyuvante a la dieta para disminuir las concentraciones elevadas de colesterol total (C-Total), colesterol de las lipoproteínas de baja densidad (C-LDL), apolipoproteína B (Apo B) y triglicéridos (TG) y para aumentar el colesterol de las lipoproteínas de alta densidad (C-HDL) en pacientes adultos y adolescentes (10 a 17 años de edad) con hipercolesterolemia primaria (heterocigótica familiar y no familiar).
EZETROL®, administrado en combinación con fenofibrato, está indicado como terapia adyuvante a la dieta para la reducción de los niveles elevados del C-total, el C-LDL, la Apo B y del no-C-HDL en pacientes adultos con hiperlipidemia mixta.
Hipercolesterolemia familiar homocigótica (HFHo): Administrado con una Estatina, EZETROL® (ezetimiba) está indicado para disminuir las concentraciones elevadas de colesterol total y de C-LDL en pacientes adultos y adolescentes (10 a 17 años de edad) con hipercolesterolemia familiar homocigótica, quienes pueden recibir también tratamientos coadyuvantes (p. ej, aféresis de LDL).
Sitosterolemia homocigótica (fitosterolemia): EZETROL® (Ezetimiba) está indicado para disminuir las concentraciones elevadas de sitosterol y de campesterol en pacientes con sitosterolemia familiar homocigótica.
CLASE TERAPÉUTICA: EZETROL® (ezetimiba) pertenece a una nueva clase de compuestos reductores de los lípidos que inhiben selectivamente la absorción intestinal de colesterol y de esteroles vegetales relacionados.
USO PEDIATRICO: La seguridad y efectividad de EZETROL® coadministrado con simvastatina en pacientes de 10 a 17 años de edad con hipercolesterolemia familiar heterocigótica han sido evaluadas en estudios controlados en niños y niñas que tuvieran por lo menos un año de post menarquia. Los pacientes adolescentes tratados con EZETROL® y hasta 40 mg diarios de simvastatina tuvieron un perfil de eventos adversos similar al de los adultos tratados con EZETROL® y simvastatina. En este estudio controlado, no se detectaron efectos sobre el crecimiento o maduración sexual en los niños y niñas adolescentes, así como tampoco se detectaron efectos en la duración del ciclo menstrual en las niñas. EZETROL® no ha sido estudiado en pacientes menores de 10 años de edad, o en niñas pre menárquicas.
CONTRAINDICACIONES: Hipersensibilidad a cualquiera de los componentes de este producto. Cuando se administre EZETROL® con una estatina o con fenofibrato, por favor remítase también a la información de prescripción de ese medicamento en particular.
EMBARAZO: No hay datos clínicos sobre la administración de Ezetimiba a mujeres en embarazo. Los estudios en animales sobre la administración de ezetimiba solo, no indican efectos perjudiciales directos ni indirectos sobre el embarazo, el desarrollo embrionario y fetal, el parto ni el desarrollo postnatal. Sin embargo, se debe tener precaución cuando se prescribe Ezetimiba a mujeres en embarazo.
Cuando se administró ezetimiba con lovastatina, simvastatina, pravastatina o atorvastatina, no se observaron efectos teratogénicos en los estudios de desarrollo embrio-fetal en ratas embarazadas. En conejas embarazadas se observó una incidencia baja de malformaciones esqueléticas.
Al administrar ezetimiba con una estatina, por favor consultar la información para prescribir de la estatina.
MADRES LACTANTES: En estudios en ratas se ha demostrado que ezetimiba se excreta por la leche materna. No se sabe si también es excretado por la leche materna humana, por lo que no se debe administrar EZETROL® (ezetimiba) a mujeres en período de lactancia, a menos que el beneficio potencial justifique el posible riesgo para el lactante.
EFECTOS COLATERALES: Los estudios clínicos de hasta 112 semanas de duración en los que se administraron 10 mg diarios de EZETROL® solos (n=2396), con una estatina (n=11308) o con Fenofibrato (n=185), los pacientes demostraron que EZETROL® fue generalmente bien tolerado; las reacciones adversas fueron usualmente leves y pasajeras, y los efectos colaterales reportados y el abandono del tratamiento por reacciones adversas tuvieron una incidencia similar a los reportados con el placebo.
Las siguientes experiencias adversas comunes (≥1/100,<1/10) o no comunes (≥1/1000,<1/100) relacionadas con el uso del medicamento fueron reportadas en pacientes tomando EZETROL® solo (n=2396) con una mayor incidencia que el placebo (n=1159), o en pacientes tomando EZETROL® co-administrado con una estatina (n=11308) y con mayor incidencia que la estatina administrada sola (n=9361).
EZETROL® administrado solo:
Investigaciones:
• No comunes: Incremento de ALT y/o AST; Incremento de la creatina fosfoquinasa (CPK) sanguíneo, incremento de la gamma-glutamiltransferasa, test anormal de la función hepática.
Trastornos respiratorios, del tórax y del mediastino:
• No comunes: Tos.
Trastornos gastrointestinales:
• Comunes: Dolor abdominal, diarrea, flatulencias.
• No comunes: Dispepsia, reflujo gastroesofágico, náuseas.
Trastornos músculo-esqueléticos y de tejidos conectivos:
• No comunes: Artralgia, espasmos musculares, dolor en el cuello.
Trastornos del metabolismo y nutrición:
• No comunes: Disminución del apetito.
Trastornos vasculares:
• No comunes: Sofocos, hipertensión.
Trastornos generales y del lugar de administración:
• Comunes: Fatiga
• No comunes: Dolor en el pecho, dolor.
EZETROL® co-administrado con estatinas:
Investigaciones:
• Comunes: Incremento de ALT y/o AST.
Trastornos del sistema nervioso:
• Comunes: Dolor de cabeza.
• No comunes: Parestesia.
Trastornos gastrointestinales:
• No comunes: Sequedad bucal, gastritis.
Trastornos de piel y tejidos subcutáneos:
No comunes: Prurito, rash, urticaria.
Trastornos músculo-esqueléticos y de tejidos conectivos:
• Comunes: Mialgia.
• No comunes: Dolor de espalda, debilidad muscular, dolor en extremidades.
Trastornos generales y del lugar de administración:
• No comunes: Astenia, edema periférico.
EZETROL® co-administrado con fenofibrato:
Trastornos gastrointestinales:
• Comunes: Dolor abdominal.
En un estudio clínico multicéntrico, doble ciego, controlado con placebo, en pacientes con hiperlipidemia mixta, se trató a 625 pacientes hasta por 12 semanas y a 576 hasta por un año. Este estudio no se diseñó para comparar eventos no frecuentes entre los grupos de tratamiento. Las tasas de incidencia (IC 95%) para elevaciones clínicamente importantes (>3 x ULN, consecutivas) en las transaminasas séricas fueron de 4,5% (1,9; 8,8) y 2,7% (1,2; 5,4) para la monoterapia con fenobritato y EZETROL® (ezetimiba) administrado con fenofibrato respectivamente, ajustadas para exposición al tratamiento. Las tasas de incidencia correspondientes para colecistectomia fueron 0,6% (0,0; 3,1) y 1,7% (0,6; 4,0) para la monoterapia con fenofibrato y la coadministración de EZETROL® (ezetimiba) con fenofibrato respectivamente (ver Precauciones). No se presentaron elevaciones en la creatina fosfoquinasa (CPK) >10 x ULN en ninguno de los tratamientos de este estudio.
Pacientes con enfermedad renal crónica: En el estudio del corazón y protección renal (SHARP), de 9000 pacientes tratados con EZETROL® 10 mg y simvastatina 20 mg diarios (n=4650), o placebo (n=4620), los perfiles de seguridad fueron comparables durante un seguimiento promedio de 4.9 años. En este estudio, fueron tenidos en cuenta solo eventos adversos serios y descontinuación del tratamiento debido a algún evento adverso. Las tazas de deserción del tratamiento debido a eventos adversos fueron comparables (10.4% en pacientes tratados con EZETROL® en combinación con simvastatina, 9.8% en pacientes tratados con placebo). La incidencia de miopatía/rabdomiólisis fue 0.2% en pacientes tratados con EZETROL® combinado con simvastatina y 0.1% en pacientes tratados con placebo. La elevación sucesiva de transaminasas (Mayor o igual a tres veces el límite superior normal) ocurrió en 0.7% pacientes tratados con EZETROL® combinado con simvastatina, comparado con 0.6% de pacientes tratados con placebo. En este estudio no hubo incremento estadístico significativo en la incidencia de eventos adversos predeterminados, incluyendo cáncer (9.4% para EZETROL® combinado con simvastatina, 9.5% para placebo), hepatitis, colecistectomía o complicaciones de cálculos biliares o pancreatitis.
En un estudio realizado con pacientes adolescentes (10 a 17 años) con hipercolesterolemia heterocigótica familiar, (n=248), el perfil de tolerabilidad y seguridad del grupo tratado con EZETROL® y simvastatina fue similar al realizado en pacientes adultos con EZETROL® y simvastatina. (Ver Uso pediatrico).
Valores de laboratorio: En los ensayos clínicos controlados con ezetimiba sola, la incidencia de aumentos clínicamente importantes de las transaminasas séricas (ALT y/o AST ≥ 3 veces del límite superior de los valores normales) fue similar con EZETROL® (0,5%) que con placebo (0,3%). En los ensayos en los que se coadministraron EZETROL® (ezetimiba) y una estatina, la incidencia fue de 1,3% con la coadministración y de 0,4% con la estatina sola. Generalmente esos aumentos de las transaminasas fueron asintomáticos, no se asociaron con colestasis, y volvieron a los valores normales al suspender o al continuar el tratamiento (ver Precauciones).
Elevaciones clínicamente importantes de la creatina fosfoquinasa (CPK) (≥ 10 veces el límite superior normal) en pacientes tratados con EZETROL® administrado sólo o con una estatina fueron similares a las elevaciones observadas con placebo o estatina administrada sola, respectivamente.
Experiencia post-mercadeo:
Los siguientes eventos adversos han sido reportados después de la comercialización de EZETROL® (ezetimiba) sin contemplar evaluación de causalidad:
— Trastornos de la sangre y del sistema linfático: Trombocitopenia.
— Trastorno del sistema nervioso: Mareos, parestesia.
— Trastornos gastrointestinales: Constipación, pancreatitis.
— Trastornos de la piel y tejidos subcutáneos: Eritema multiforme.
— Trastornos músculo-esqueléticos y del tejido conectivo: Mialgia, miopatía/rabdomiólisis (ver Precauciones).
— Trastornos generales y condiciones del sitio de administración: Astenia.
— Trastornos del sistema inmune: Reacciones de hipersensibilidad, incluyendo anafilaxis, angioedema, rash y urticaria.
— Trastornos hepato-biliares: Colelitiasis, colecistitis, hepatitis.
— Trastornos psiquiátricos: Depresión.
INTERACCIONES CON OTROS MEDICAMENTOS: Los estudios preclínicos han mostrado que ezetimiba no induce las enzimas citocromo P450, metabolizadoras de medicamentos. No se ha observado ninguna interacción farmacocinética de importancia clínica entre ezetimiba y medicamentos que son metabolizados por los citocromos P450 1A2, 2D6, 2C8, 2C9 y 3A4 o por la N- acetiltransferasa.
La coadministración de ezetimiba no tuvo ningún efecto sobre la farmacocinética de la dapsona, el dextrometorfano, la digoxina, los anticonceptivos orales (etinilestradiol y levonorgestrel), la glipicida, la tolbutamida, o el midazolam. La coadministración de cimetidina no tiene ningún efecto sobre la biodisponibilidad del ezetimiba.
Antiácidos: La administración concomitante de antiácidos disminuye la tasa de absorción del ezetimiba, pero no modifica su biodisponibilidad. Esa disminución de la tasa de absorción del ezetimiba no se considera de importancia clínica.
Colestiramina: La administración concomitante de colestiramina disminuyó aproximadamente un 55% el promedio del área bajo la curva de concentración de ezetimiba total (ezetimiba + glucurónido de ezetimiba). Esa interacción puede hacer que sea menor la disminución adicional del C-LDL debida a la coadministración de ezetimiba y colestiramina.
Ciclosporina: En un estudio de ocho pacientes con trasplante renal con depuración de creatinina mayor de 50 mL/min bajo una dosificación estable de ciclosporina, una única dosis de 10 mg de ezetimiba aumentó 3,4 veces (rango, 2,3 a 7,9 veces) el AUC promedio de ezetimiba total en comparación con una población control sana de otro estudio (n=17). En otro estudio, un paciente con trasplante renal e insuficiencia renal severa (depuración de creatinina de 13,2 mL/min/1,73 m2) que estaba recibiendo múltiples medicamentos, incluyendo ciclosporina, demostró una exposición a ezetimiba total 12 veces mayor que los controles. En un estudio alternado de dos períodos en doce sujetos sanos, la administración diaria de 20 mg de ezetimiba por 8 días con una dosis única de 100 mg de ciclosporina en el día 7 resulto en un aumento promedio de 15% en el AUC de la ciclosporina (un rango de 10% de disminución a 51% de aumento) comparado con una dosis única de 100 mg de ciclosporina sola (ver Precauciones).
Fibratos: La seguridad y la eficacia de ezetimiba co-administrada con fenofibrato ha sido evaluada en un estudio clínico (ver Efectos colaterales); la co-administración de ezetimiba con otros fenofibratos no ha sido estudiada. Los fibratos pueden aumentar la excreción de colesterol con la bilis y producir así colelitiasis. En un estudio preclínico en perros, ezetimiba aumentó el contenido de colesterol de la bilis de la vesícula biliar. Aunque se desconoce la importancia de ese resultado preclínico en los seres humanos, no se recomienda la coadministración de EZETROL® (ezetimiba) y fibratos hasta que su uso en pacientes sea estudiado.
Fenofibrato: En un estudio de farmacocinética, la administración concomitante de ezetimiba con fenofibrato aumentó las concentraciones de ezetimiba aproximadamente 1,5 veces. Este aumento no se considera clínicamente significativo.
Gemfibrozilo: En un estudio farmacocinético, la administración concomitante con gemfibrozilo aumentó las concentraciones totales de ezetimiba 1,7 veces. Este aumento no es considerado clínicamente significativo. No hay datos clínicos disponibles.
Estatinas: No se observó ninguna interacción farmacocinética de importancia clínica cuando se coadministró ezetimiba con atorvastatina, simvastatina, pravastatina, lovastatina, fluvastatina o rosuvastatina.
Anticoagulantes: La administración concomitante de ezetimiba (10 mg una vez al día) no tuvo efecto significativo sobre la biodisponibilidad de warfarina y el tiempo de protrombina en un estudio de 12 adultos masculinos sanos. Ha habido reportes posteriores a la comercialización de aumento en el índice internacional normalizado en pacientes quienes tomaron EZETROL® sumado a warfarina o fluindiiona. La mayoría de estos pacientes estaban tomando también otros medicamentos (ver Precauciones).
ESTUDIOS CLÍNICOS:
Prevención de Eventos Cardiovasculares Mayores en Enfermedad Renal Crónica (CKD): El estudio del Corazón y Protección Renal (SHARP) fue un estudio multinacional, aleatorizado, controlado con placebo, doble ciego llevado a cabo en 9438 pacientes con enfermedad renal crónica, un tercio de los cuales estaban en diálisis al inicio del estudio. Por el primer año, los pacientes fueron aleatorizados en un radio de 4:4:1, respectivamente a EZETROL® 10mg con simvastatina 20mg, placebo, o simvastatina 20 mg al día. El brazo del primer año de simvastatina fue incluido para hacer posible la comparación de EZETROL® con simvastatina sola con respecto a la seguridad y lípidos. En 1 año el brazo de simvastatina sólo fue re aleatorizado 1:1 para EZETROL® 10 mg combinado con simvastatina 20 mg o placebo. Un total de 4650 pacientes fueron asignados a EZETROL® 10 mg en combinación con simvastatina 20 mg y 4620 a placebo y seguidos durante una media de 4,9 años. Los pacientes tenían una edad media de 62 años, y el 63% eran hombres, el 72% caucásicos, 23% diabéticos y para los que no están en diálisis, la tasa media estimada de filtración glomerular (TFG) fue de 26,5 ml/min/1.73 m2. No hubo criterios de entrada de lípidos. La media de C-LDL al inicio del estudio fue de 108 mg/dL. A partir de la medición de 1 año, el C-LDL se redujo en 26% en relación a placebo por la simvastatina 20 mg solo y 38% para EZETROL® 10 mg en combinación con simvastatina 20 mg. En el punto medio del estudio (2,5 años) la reducción media de C-LDL en relación con el placebo EZETROL® fue de 32%. Todas las mediciones de lípidos incluyeron pacientes que ya no toman la medicación del estudio.
La comparación primaria del protocolo especificado por SHARP fue un análisis de la intención de tratar los “eventos vasculares mayores” (MVE, definida como IM no fatal o muerte cardíaca, accidente cerebrovascular, o cualquier procedimiento de revascularización) en sólo aquellos pacientes inicialmente asignados al azar a EZETROL® (n = 4193) o los grupos placebo (n = 4191). Los análisis secundarios incluyeron el mismo compuesto analizado para la cohorte completa aleatorizada (al inicio del estudio o en el año 1) a EZETROL® en combinación con simvastatina (n = 4650) o placebo (n = 4620), así como los componentes de este compuesto.
El análisis del punto final principal mostró que EZETROL® en combinación con simvastatina redujo significativamente el riesgo de eventos vasculares mayores (749 pacientes con eventos en el grupo placebo frente a 639 en el grupo de EZETROL® en combinación con simvastatina) con una reducción del riesgo relativo del 16% (p = 0,001) (ver Figura 1)
La reducción del riesgo para el material compuesto MVE fue consistente direccionalmente (es decir, EZETROL® en combinación con simvastatina superior numéricamente al placebo) con la de toda la cohorte de pacientes para los siguientes subgrupos clave predefinidos de referencia: la edad, el género, la diálisis frente a no- diálisis, eGFR, diabetes, enfermedad aterosclerótica pre-existente, la presión arterial, o terciles de C-LDL de línea base.
Figura 1. Efecto de la combinación EZETROL® con simvastatina en el punto final primario del riesgo de eventos vasculares mayores.
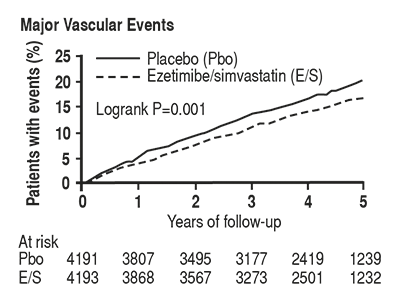
Los componentes individuales de MVE en todos los pacientes aleatorizados se presentan en la Tabla 1. EZETROL® en combinación con simvastatina redujo significativamente el riesgo de accidente cerebrovascular y cualquier revascularización con diferencias numéricas no significativas que favorecen EZETROL® en combinación con simvastatina para IM no fatal y muerte cardíaca.
|
Tabla 1. Eventos vasculares mayores por grupo de tratamiento en todos los pacientes aleatorizados en SHARPa |
||||
|
Resultado |
EZETROL® 10 mg en combinación con simvastatina 20 mg (N=4650) |
Placebo (N=4620) |
Radio de riesgo (95% CI) |
Valor-P |
|
Eventos vasculares mayores |
701 (15.1%) |
814 (17.6%) |
0.85 (0.77-0.94) |
0.001 |
|
IM No fatal |
134 (2.9%) |
159 (3.4%) |
0.84 (0.66-1.05) |
0.12 |
|
Muerte cardiaca |
253 (5.4%) |
272 (5.9%) |
0.93 (0.78-1.10) |
0.38 |
|
Cualquier accidente cerebrovascular |
171 (3.7%) |
210 (4.5%) |
0.81 (0.66-0.99) |
0.038 |
|
Accidente cerebrovascular no hemorrágico |
131 (2.8%) |
174 (3.8%) |
0.75 (0.60-0.94) |
0.011 |
|
Accidente cerebrovascular hemorrágico |
45 (1.0%) |
37 (0.8%) |
1.21 (0.78-1.86) |
0.40 |
|
Cualquier revascularización |
284 (6.1%) |
352 (7.6%) |
0.79 (0.68-0.93) |
0.004 |
|
Eventos ateroscleróticos mayores (MAE)b |
526 (11.3%) |
619 (13.4%) |
0.83 (0.74-0.94) |
0.002 |
|
a Análisis de Intención de Tratar en todos los pacientes aleatorizados en SHARP para EZETROL® en combinación con simvastatina o placebo ya sea al inicio del studio o al 1er año. b MAE; Definido como el compuesto de infarto al miocardio no fatal, muerte coronaria, accidente cerebrovascular no hemorrágico, o cualquier revascularización. |
||||
PRECAUCIONES: Cuando se administre EZETROL® con una estatina o con fenofibrato, por favor referirse a la información para prescripción para cada medicamento particular.
Enzimas hepáticas: En ensayos controlados en pacientes a los que se les coadministraron EZETROL® y una estatina se han observado aumentos de las transaminasas (≥ 3 veces el límite superior de los valores normales). Cuando se coadministre EZETROL® (ezetimiba) con una estatina, se deben hacer pruebas de función hepática al iniciar el tratamiento y de acuerdo con las recomendaciones sobre el empleo de la estatina (ver Eventos adversos).
En un estudio clínico controlado de 9000 pacientes con enfermedad renal crónica, fueron elegidos al azar, para la administración de EZETROL® 10 mg combinados con simvastatina 20 mg diarios (n=4650) o placebo (n=4620) (seguimiento promedio de 4.9 años), la incidencia de aumentos sucesivos de transaminasas (mayor o igual a tres veces el límite superior normal) fue de 0.7% para EZETROL® combinado con simvastatina y del 0.6% para el placebo. (Ver Efectos colaterales).
Músculo esquelético: En estudios clínicos, no hubo un incremento en la frecuencia de miopatía o rabdomiólisis asociados con EZETROL® comparado con el grupo control relevante (placebo o estatina sola). Sin embargo, la miopatía y la rabdomiólisis son reacciones adversas conocidas de las Estatinas y de los agentes reductores de los lípidos. En estudios clínicos, la incidencia de la creatina fosfoquinasa (CPK) >10 x ULN fue de 0,2% para EZETROL® comparado con 0,1% para placebo, y 0,1% para EZETROL® coadministrado con estatina comparado con 0,4% para la estatina sola.
En la experiencia posterior a la comercialización con EZETROL®, se han reportado casos de miopatía y rabdomiólisis sin considerar la causalidad. La mayoría de los pacientes quienes desarrollaron rabdomiólisis estaban tomando una estatina antes de iniciar el tratamiento con EZETROL®, sin embargo, se ha reportado rabdomiólisis muy rara vez con monoterapia de EZETROL®, y muy rara vez con la adición de EZETROL®, a agentes que se sabe que están asociados con un mayor riesgo de rabdomiólisis. Todos los pacientes que comienzan la terapia con EZETROL®, deben ser advertidos del riesgo de miopatía y se les debe informar que reporten rápidamente cualquier dolor, sensibilidad o debilidad muscular inexplicados. EZETROL® y cualquier estatina que el paciente este tomando concomitantemente debe ser suspendido inmediatamente si se diagnostica o sospecha miopatía. La presencia de estos síntomas y niveles elevados de creatina fosfoquinasa (CPK) > 10 veces al límite superior normal (ULN) indican miopatía.
En un estudio clínico de 9000 pacientes con enfermedad renal crónica, fueron elegidos al azar, para la administración de EZETROL® 10 mg combinados con simvastatina 20 mg diarios (n=4650) o placebo (n=4620) (seguimiento promedio de 4.9 años), la incidencia de miopatía/rabdomiólisis fue de 0.2% para EZETROL® combinado con simvastatina y del 0.1% para el placebo. (Ver Efectos colaterales).
Insuficiencia hepática: Debido a que se desconocen los efectos de la exposición elevada de ezetimiba en pacientes con insuficiencia hepática moderada o severa, EZETROL® no se recomienda en estos pacientes.
Fibratos: No se ha estudiado la ezetimiba coadministrada con fibratos distintos a fenofibrato, por lo que no se recomienda la coadministración de EZETROL® y fibratos (distintos a fenofibrato) (ver Interacciones con otros medicamentos).
Fenofibrato: Si se sospecha colelitiasis en los pacientes que estén recibiendo EZETROL® y fenofibrato, se indican estudios de la vesícula biliar y se debe considerar una terapia alternativa para disminuir los lípidos (ver Efectos colaterales y la información para prescripción de fenofibrato).
Ciclosporina: Se debe tener precaución al iniciar ezetimiba conjunto con ciclosporina. Se deben monitorizar las concentraciones de ciclosporina en pacientes que estén recibiendo EZETROL® y ciclosporina (ver Interacciones con otros medicamentos).
Anticoagulantes: Si se adiciona EZETROL® a la terapia con warfarina u otro anticoagulante cumarínico, o fluindiona se debe monitorizar apropiadamente el Índice Internacional Normalizado (INR) (ver Interacciones con otros medicamentos).
DOSIFICACIÓN Y ADMINISTRACIÓN: El paciente debe estar bajo una dieta reductora de los lípidos apropiada y debe continuarla durante el tratamiento con EZETROL® (ezetimiba).
La dosis recomendada de EZETROL® (ezetimiba) es de 10 mg, una vez al día, solo, con una estatina o con fenofibrato. EZETROL® puede administrarse a cualquier hora del día, con o sin alimentos.
Pacientes con falla renal/enfermedad renal crónica:
• Monoterapia: En pacientes con insuficiencia renal no es necesario realizar ajuste de dosis al usar EZETROL®.
• Terapia combinada con simvastatina: En pacientes con insuficiencia renal media (GFR estimada ≥60 ml/min/1.73m2), no es necesario hacer ajuste de dosis de EZETROL® o simvastatina. En pacientes con enfermedad renal crónica y una taza de Filtración Glomerular (GFR) < 60 ml/min/1.73m2. La dosis de EZETROL® es 10 mg y la dosis de simvastatina 20 mg una vez al día, en la tarde. En dichos pacientes el uso de dosis más altas de simvastatina, debe ser monitoreado de cerca. (Ver Precauciones).
Uso en pacientes de edad avanzada: No se requiere ajuste de dosis en los pacientes de edad avanzada.
Uso en pacientes pediátricos:
• Niños y adolescentes ≥ 10 años: No se requiere hacer ningún ajuste de la dosificación.
• Niños menores de 10 años: El tratamiento con EZETROL® (ezetimiba) no se recomienda en este grupo de edad.
Uso en pacientes con insuficiencia hepática: No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve (puntuación de Child-Pugh de 5 a 6). No se recomienda el tratamiento con ezetimiba en pacientes con insuficiencia hepática moderada (puntuación de Child-Pugh de 7 a 9) o severa (puntuación de Child-Pugh > 9) (Ver Precauciones).
Coadministración con secuestradores de ácidos biliares: Se debe administrar EZETROL® dos a cuatro horas antes o después de administrar un secuestrador de ácidos biliares.
SOBREDOSIFICACIÓN: En estudios clínicos, la administración de 50 mg diarios de ezetimiba a 15 personas sanas hasta por 14 días o de 40 mg diarios a 18 pacientes con hipercolesterolemia primaria durante hasta 56 días, y 40 mg diarios a 27 pacientes con sitosterolemia homocigotica por 26 semanas, fue generalmente bien tolerada.
Se han reportado pocos casos de sobredosis con EZETROL®; la mayoría de los cuales no se han asociado con eventos adversos. Los eventos adversos reportados no fueron serios. En caso de una sobredosis, se deben aplicar medidas sintomáticas y de soporte.
PRESENTACIÓN: EZETROL® 10 mg, caja con 10 o 20 tabletas. Reg. San.: INVIMA 2014M-0002491-R1.
Este documento fue revisado por última vez en noviembre de 2011.
PC-MK0653-T-112011
MERCK SHARP & DOHME
Bogotá, D.C. - Colombia
CONSERVACIÓN: Conserve a no más de 30 °C, con las variaciones climáticas usuales. Manténgase el envase bien cerrado.