
ELOVENT® TWISTHALER
MOMETASONA
Inhalador de polvo
Inhalador de polvo , 200 y 400 mcg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Furoato de mometasona 200 y 400 microgramos inhalador de polvo seco: Inhalador de polvo seco de múltiples dosis. Cada dosis administrada contiene 200 o 400 microgramos de furoato de mometasona. Un contador en el dispositivo indica el número de dosis restantes.
El inhalador de polvo de 200 microgramos es de color blanco con una base rosada. El inhalador de polvo de 400 microgramos es de color blanco con una base de color granate (rojo). Cada inhalador de polvo es un dispositivo de múltiples componentes compuesto de caucho de copolímero de polipropileno, tereftalato de polibutileno, poliéster, acrilonitrilo-butadien-estireno, bromo-butilo y acero inoxidable. Contiene un cartucho desecante de gel de sílice en la tapa de polipropileno blanca.
NOMBRE DEL MEDICAMENTO Y FORMA FARMACÉUTICA: ELOVENT® TWISTHALER® es un inhalador de polvo seco (DPI por sus siglas en inglés) que contiene furoato de mometasona anhidro, un corticosteroide 17-heterocíclico sintético con actividad antiinflamatoria, el cual se está utilizando terapéuticamente en la actualidad en el tratamiento del asma y EPOC.
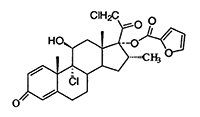
El furoato de mometasona (ver la Figura a continuación), 9,21-dicloro-11ß,17- dihidroxi-16·-metilpregna-1,4-dien-3,20-diona 17-(2)-furoato, es un corticosteroide sintético cuyo núcleo esteroide es el análogo 16·-metil de la beclometasona, pero con un grupo 21-cloro y una novedosa función (2)-furoato 17-éster. La fórmula empírica es C27H30CI2O6 y el peso molecular (MW) es 521,44.
Estructura química del furoato de mometasona anhidro
PROPIEDADES FARMACOCINÉTICAS:
Absorción y biodisponibilidad: La biodisponibilidad sistémica del furoato de mometasona después de la inhalación oral es baja, en parte, debido a la pobre absorción y extenso metabolismo presistémico del medicamento ingerido. Con la utilización de la exposición en estado estable al furoato de mometasona cuando es administrado por inhalación y después de una dosis IV única de los diferentes estudios, los cálculos de la biodisponibilidad absoluta fueron de 16% en sujetos sanos y aproximadamente el 10% en sujetos con asma.
Distribución: Después de la administración en bolo intravenoso, la media del volumen de distribución en estado estable (Vd) es de 152 L. La unión a proteínas in vitro para el furoato de mometasona es alto, 98% a 99% en el rango de concentración de 5 a 500 ng/mI.
Metabolismo: El furoato de mometasona se metaboliza extensamente en todas las especies investigadas. No se han identificado metabolitos mayores. La porción de una dosis de furoato de mometasona que se ingiere y absorbe del tracto gastrointestinal sufre un extenso metabolismo a múltiples metabolitos. En los microsomas hepáticos humanos, el furoato de mometasona se metaboliza en muchos metabolitos, incluyendo el 6-beta hidroxifuroato de mometasona, el cual se forma por el citocromo P-450 3A4.
Eliminación: Una dosis inhalada oralmente, radiomarcada se excreta principalmente en la materia fecal (74%) y en menor grado en la orina (8%).
CARACTERÍSTICAS CLÍNICAS:
Indicaciones terapéuticas:
Adultos y adolescentes de 12 años de edad y mayores:
• Tratamiento regular para controlar el asma persistente.
• El furoato de mometasona DPI está indicado como terapia profiláctica en el manejo de pacientes asmáticos de todas las severidades, incluyendo a aquellos que han sido dependientes de corticosteroides inhalados o administrados sistémicamente, y pacientes no dependientes de corticosteroides controlados inadecuadamente con otros regímenes farmacológicos.
• Tratamiento sintomático de EPOC (Enfermedad Obstructiva Crónica) moderado a severo.
CARACTERÍSTICAS FARMACÉUTICAS:
Lista de excipientes de interés especial: Lactosa anhidra (la cual contiene cantidades trazas de proteínas lácteas).
PROPIEDADES FARMACOLÓGICAS:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: El furoato de mometasona es un glucocorticosteroide tópico con propiedades antiinflamatorias locales.
Mecanismo de acción: Los glucocorticoides, como el furoato de mometasona, ejercen sus efectos antiinflamatorios a través de los receptores glucocorticoide (GRs). Al unirse al glucocorticoide, se disocia el heterocomplejo GR, y el ligando GR activado se transloca del citoplasma al núcleo. El GR activado puede en ese momento aumentar la regulación de los genes antiinflamatorios al unirse a secuencias de ADN específicas denominadas elementos de respuesta del glucocorticoide. Sin embargo, es más probable que sea la capacidad de los glucocorticoides de suprimir la transcripción de genes su actividad primaria para suprimir la inflamación. En este caso, el GR activado interactúa con los factores de transcripción apolipoproteína 1 (AP 1) o el factor nuclear kappa B (NF-kB) para disminuir la expresión del gen. Además, se ha demostrado que los glucocorticoides aumentan la expresión de un inhibidor del NF-kB.
Efectos farmacodinámicos: La afinidad de unión del GR corresponde a la actividad funcional. El furoato de mometasona se une con una afinidad muy alta al GR humano y esto conlleva a su potente efecto inhibitorio en las células para reducir la síntesis y liberación de los mediadores proinflamatorios y citoquinas.
El furoato de mometasona inhibe significativamente la liberación de leucotrienos de leucocitos en pacientes alérgicos. En cultivo celular, el furoato de mometasona demostró una potencia alta en la inhibición de la síntesis y liberación del IL-1, IL-5, IL-6, y TNFa también es un inhibidor potente de la producción de las citoquinas TH2, IL-4 e IL-5, de las células T CD4+ humanas. En leucocitos mixtos de pacientes atópicos, el furoato de mometasona fue un inhibidor más potente de la producción de leucotrienos que el BDP.
En modelos preclínicos, se ha demostrado que el furoato de mometasona reduce la acumulación de las células inflamatorias, incluyendo eosinófilos, que se infiltran en las vías aéreas superior e inferior después de la provocación del alérgeno. Adicionalmente, el furoato de mometasona redujo el número de linfocitos y los niveles del ARN mensajero para las citoquinas proalérgicas IL-4 e IL-5.
Los estudios doble ciego, controlados con placebo de 12 semanas de duración han demostrado que el tratamiento con furoato de mometasona DPI en dosis administradas dentro del rango de 100-800 microgramos por día resultaron en una mejoría de la función pulmonar según la medición del FEV (Volumen de expiración forzado) y flujo espiratorio máximo, mejora en el control de los síntomas del asma, y disminución en la necesidad de un agonista beta-2 inhalado. La mejoría en la función pulmonar se observó dentro de las 24 horas del inicio del tratamiento en algunos pacientes, aunque el beneficio máximo no se alcanzó antes de 1 a 2 semanas o más. La mejoría en la función pulmonar se mantuvo durante la duración del tratamiento.
CONTRAINDICACIONES: Pacientes con hipersensibilidad conocida al furoato de mometasona o a las proteínas lácteas, que están contenidas en el excipiente lactosa.
EMBARAZO Y LACTANCIA: No existen estudios adecuados en mujeres embarazadas. Los estudios en animales con furoato de mometasona, al igual que otros glucocorticoides, han demostrado la toxicidad reproductiva; sin embargo, se desconoce el riesgo potencial para humanos.
Al igual que con otras preparaciones de corticosteroides inhaladas, el furoato de mometasona no se debe utilizar durante el embarazo a menos que el beneficio potencial para la madre justifique el riesgo potencial a la madre, feto o infante. Los infantes nacidos de madres que recibieron corticosteroides durante el embarazo se deben observar cuidadosamente para hipoadrenalismo.
Se desconoce si el furoato de mometasona se excreta en leche materna. Debido a que otros corticosteroides se excretan en leche materna, se debe tener precaución cuando el furoato de mometasona se administra a mujeres durante la lactancia.
EFECTOS INDESEABLES:
Experiencia de estudios clínicos:
Adultos: Los efectos indeseables más comunes reportados en estudios clínicos controlados con placebo fueron candidiasis oral, faringitis, y dolor de cabeza. La candidiasis oral ocurrió en el 6% de los pacientes tratados con furoato de mometasona DPI 200 microgramos dos veces al día, y el 2% y 4 % de los pacientes tratados con 200 microgramos y 400 microgramos una vez al día, respectivamente. La incidencia en pacientes tratados con placebo fue del 1%.
En comparación, entre los pacientes con asma severa tratados con corticosteroides orales que recibieron furoato de mometasona DPI 400 microgramos dos veces al día durante 12 semanas, la candidiasis oral se reportó por el 20% de los pacientes (vs. 9% con placebo), y disfonía por el 7% de los pacientes (vs. 0% con placebo). Estos efectos se consideraron como relacionados con el tratamiento.
La faringitis relacionada con el tratamiento se reportó por el 4% de los pacientes tratados con furoato de mometasona DPI 200 microgramos dos veces al día. En pacientes tratados una vez al día, la incidencia fue del 3% al 7% en la dosis de 200 microgramos y 3% en la dosis de 400 microgramos, vs. 4% en pacientes tratados con placebo.
El dolor de cabeza relacionado se reportó por el 3% al 7% de los pacientes en los grupos de tratamiento activo y en el 5% de los pacientes tratados con placebo.
Se han reportado casos raros de glaucoma, aumento de la presión intraocular y cataratas.
No existe sugerencia de un riesgo aumentado para los efectos indeseables en adolescentes o pacientes de 65 años de edad o mayores.
Pueden ocurrir efectos sistémicos de los corticosteroides inhalados, particularmente cuando son prescritos en dosis altas durante periodos prolongados.
Experiencia poscomercialización: Se han presentado reportes de reacciones de hipersensibilidad incluyendo erupción cutánea, prurito, angioedema y reacción anafiláctica. Se ha reportado el empeoramiento del asma, el cual puede incluir tos, disnea, sibilancia y broncoespasmo.
Interferencia con pruebas de laboratorio: Ninguna identificada.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: La coadministración de furoato de mometasona inhalado con ketoconazol, un inhibidor potente de la enzima CYP3A4, causa un aumento en la concentración plasmática del furoato de mometasona.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES ESPECIALES DE USO: Durante los estudios clínicos, la candidiasis oral, la cual está asociada con el uso de esta clase de medicamentos, ocurre en algunos pacientes. Esta infección puede requerir tratamiento con terapia antifúngica apropiada y en algunos pacientes puede ser necesaria la descontinuación de ELOVENT® TWISTHALER®.
Pueden ocurrir efectos sistémicos de los corticosteroides inhalados, particularmente en dosis altas prescritas durante periodos prolongados. Estos efectos tienen menos probabilidad de ocurrir que con los corticosteroides orales. Los posibles efectos sistémicos incluyen la supresión adrenal, retardo en el crecimiento de niños y adolescentes, disminución de la densidad mineral ósea, cataratas y glaucoma. Por lo tanto, es importante que la dosis del corticosteroide inhalado sea titulada a la dosis más baja en la cual se mantiene un control efectivo del asma.
Se requiere cuidado particular en pacientes que son transferidos de corticosteroides sistémicos a furoato de mometasona inhalado, debido a que han ocurrido muertes causadas por insuficiencia adrenal en pacientes asmáticos durante y después del cambio de corticosteroides sistémicos a corticosteroides inhalados con menos disponibilidad sistémica. Después del retiro de los corticosteroides sistémicos, se requiere que transcurran unos meses para la recuperación de la función del eje hipotalámico-pituitario-adrenal (HPA).
Durante periodos de estrés, incluyendo trauma, cirugía, o infección, o un ataque de asma severo, los pacientes transferidos de corticosteroides sistémicos requerirán tratamiento suplementario con un ciclo corto de corticosteroides sistémicos, el cual se reducirá gradualmente a medida que disminuyan los síntomas. Se recomienda que dichos pacientes porten un suministro de corticosteroides orales y una tarjeta de advertencia que indique su necesidad y dosis recomendada de corticosteroides sistémicos durante periodos de mucho estrés. Se recomiendan pruebas periódicas de la función adrenocortical, particularmente la medición de los niveles plasmáticos de cortisol a primera hora del día.
La transferencia de pacientes de la terapia corticosteroide sistémica al furoato de mometasona DPI puede desenmascarar condiciones alérgicas preexistentes suprimidas anteriormente por la terapia corticosteroide sistémica. Si esto ocurre, se recomienda tratamiento sintomático.
El furoato de mometasona DPI no se debe considerar como un broncodilatador y no está indicado para el rápido alivio del broncoespasmo.
Instruir a los pacientes para que se pongan en contacto con su médico de inmediato cuando los episodios asmáticos no responden a los broncodilatadores o si desciende el flujo máximo. Esto puede indicar el empeoramiento del asma. Durante esos episodios, los pacientes pueden requerir terapia corticosteroide sistémica. En estos pacientes, se puede considerar la titulación de la dosis a la dosis de mantenimiento máxima recomendada del furoato de mometasona inhalado.
El furoato de mometasona DPI permitirá usualmente el control de los síntomas del asma con menos supresión de la función del eje HPA que las dosis orales terapéuticamente equivalentes de prednisona. Aunque el furoato de mometasona ha demostrado una biodisponibilidad sistémica baja en la dosis recomendada, se absorbe en la circulación y puede ser sistémicamente activo en dosis más altas. Por ende, para mantener su perfil de potencial limitado de supresión del eje HPA, no se deben exceder las dosis recomendadas del furoato de mometasona DPI, y se debe titular a la dosis efectiva más baja para cada paciente individual.
Ninguna evidencia soporta que la administración del furoato de mometasona DPI en cantidades mayores a las dosis recomendadas aumente la eficacia.
Utilizar el furoato de mometasona DPI con precaución, y de acuerdo a criterio médico, en pacientes con tuberculosis activa o quiescente, infecciones del tracto respiratorio, o en infecciones fúngicas, bacterianas, o virales sistémicas no tratadas o herpes simple ocular.
Informar a los pacientes que reciben corticosteroides y otros medicamentos inmunosupresores del riesgo de exposición a ciertas infecciones (por ejemplo, varicela, sarampión) y la importancia de recibir asesoría médica si ocurre dicha exposición. Esto es de particular importancia en niños.
Cuando se utilizan corticosteroides inhalados, existe la posibilidad que pueda ocurrir una supresión adrenal clínicamente significativa, especialmente después del tratamiento con dosis más altas a las recomendadas. Esto se debe considerar durante periodos de estrés o una cirugía electiva, cuando se pueden necesitar corticosteroides sistémicos adicionales. Sin embargo, durante los estudios clínicos no se observó evidencia de la supresión del eje HPA después del tratamiento prolongado con furoato de mometasona DPI en dosis ?800 microgramos por día (ver Embarazo y lactancia).
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN
General: Para uso en pacientes de 12 años de edad y mayores.
Dosis:
Adultos y adolescentes de 12 años de edad y mayores (incluyendo pacientes geriátricos): Las recomendaciones de dosificación se basan en la severidad del asma (ver los criterios a continuación).
Pacientes con asma persistente leve a moderada: La dosis de inicio recomendada para la mayoría de estos pacientes es de 400 microgramos una vez al día. Los datos sugieren que un mejor control del asma se logra si una dosis una vez al día se administra en la noche. Algunos pacientes se pueden controlar de forma más adecuada con 400 microgramos diarios, administrados en dos dosis divididas (200 microgramos dos veces al día).
La dosis de ELOVENT® TWISTHALER® se debe individualizar y titular a la dosis más baja en la cual se mantiene un control efectivo del asma. La reducción de la dosis a 200 microgramos una vez al día administrada en la noche puede ser una dosis de mantenimiento efectiva para algunos pacientes.
Pacientes con asma severa: La dosis de inicio recomendada es de 400 microgramos dos veces al día, la cual es la dosis máxima recomendada. Cuando se controlan los síntomas, titular ELOVENT® TWISTHALER® a la dosis efectiva más baja.
Pacientes con EPOC moderado a severo: La dosis recomendada es de 400 mcg dos veces al día.
Método de administración: Este producto es para uso por inhalación oral únicamente.
OTRA INFORMACIÓN DE SEGURIDAD RELEVANTE:
Efectos en la capacidad de conducir y utilizar maquinaria: El furoato de mometasona inhalado no tiene influencia en la capacidad de conducir o utilizar maquinaria.
SOBREDOSIS: Debido a la baja biodisponibilidad sistémica de este producto, es poco probable que la sobredosis requiera alguna terapia diferente a la observación, seguido por la iniciación de la dosis adecuada prescrita. La inhalación o administración oral de dosis excesivas de corticosteroides puede conllevar a la supresión de la función del eje HPA.
El manejo de la inhalación del furoato de mometasona en dosis excesivas a los regímenes de dosis recomendados debe incluir el monitoreo de la función adrenal. Se puede continuar la terapia de furoato de mometasona en una dosis conveniente para controlar el asma.
TOXICOLOGÍA NO CLÍNICA: No se demostraron efectos toxicológicos únicos a la exposición del furoato de mometasona durante el curso de las pruebas preclínicas. Todos los efectos observados son típicos de esta clase de compuestos y se relacionan con los efectos farmacológicos exagerados de los glucocorticoides.
Carcinogénesis, mutagénesis y deterioro de la fertilidad: En un estudio de carcinogenicidad de 2 años en ratas Sprague Dawley, el furoato de mometasona no demostró un aumento estadísticamente significativo en la incidencia de tumores en dosis de inhalación hasta de 67 mcg/kg (aproximadamente 8 veces la dosis de inhalación diaria máxima recomendada en adultos en una base de ABC y 2 veces la dosis de inhalación diaria máxima recomendada en pacientes pediátricos en una base de mcg/m2). En un estudio de carcinogenicidad de 19 meses en ratones Suizos CD-1, el furoato de mometasona no demostró un aumento estadísticamente significativo en la incidencia de tumores en dosis de inhalación hasta de 160 mcg/kg (aproximadamente 10 veces la dosis de inhalación diaria máxima recomendada en adultos en una base de ABC y 2 veces la dosis de inhalación diaria máxima recomendada en pacientes pediátricos en una base de mcg/m2). El furoato de mometasona no fue mutagénico en el ensayo de linfoma de ratón y bioensayo de mutagenicidad de Salmonella/E. coli/microsoma mamífero. En dosis citotóxicas solamente, el furoato de mometasona produjo un aumento en las aberraciones del cromosoma in vitro en cultivos de células de ovario de hámster (CHO) chino en la fase de no activación, pero no en la presencia de la fracción S9 hepática de rata. Sin embargo, el furoato de mometasona no indujo las aberraciones cromosomales in vitro en un ensayo de aberraciones cromosomales de célula de pulmón de hámster (CHO) chino, o in vivo en el ensayo de micronúcleo de eritrocito de médula ósea de ratón, en el ensayo de clastogenicidad de médula ósea de rata, y el ensayo de clastogenicidad en célula germinal masculina de ratón. El furoato de mometasona tampoco indujo la síntesis de ADN no programado in vivo en hepatocitos de ratas. El hallazgo de aberraciones cromosomales simples en la fase de no activación del ensayo CHO se considera relacionado con la citotoxicidad y no se considera que sea de significancia en la evaluación de riesgo del furoato de mometasona debido a los resultados negativos en la fase S9 de este ensayo, los resultados negativos en un segundo ensayo de aberraciones cromosomales in vitro (ensayo CHL), y los resultados negativos en los tres ensayos de aberraciones cromosomales in vivo.
En estudios de la función reproductiva, el furoato de mometasona subcutáneo fue bien tolerado en dosis hasta de 7,5 ?g/kg. En 15 ?g/kg, el furoato de mometasona produjo gestación prolongada y parto prolongado y difícil con una reducción en la supervivencia de la cría y peso corporal o aumento en el peso corporal. No se
observó efecto en la fertilidad.
Teratogenicidad: Al igual que otros glucocorticoides, el furoato de mometasona es un teratógeno en roedores y conejos. Estudios de teratología se realizaron en ratas, ratones y conejos por las vías oral, tópica y/o subcutánea. Los efectos observados fueron hernia umbilical en ratas, paladar hendido en ratones, y agenesia de la vesícula biliar, hernia umbilical, y patas delanteras flexionadas en conejos. También se observaron reducciones en el aumento de peso corporal materno, efectos en el crecimiento fetal (peso corporal fetal más bajo y/o retardo en la osificación) en ratas, conejos y ratones, y reducción en la supervivencia de crías en ratones.
En un estudio de teratología en conejos, a 700 ?g/kg, se observó un aumento en las incidencias de reabsorción y malformaciones, incluyendo paladar hendido y/o malformación de cabeza (hidrocefalia o cabeza abovedada). Se observó pérdida del embarazo en la mayoría de los conejos en 2800 ?g/kg.
Otros efectos: Estudios preclínicos demuestran que el furoato de mometasona está desprovisto de actividad androgénica, anti-androgénica, estrogénica o anti-estrogénica pero, al igual que otros glucocorticoides, exhibe alguna actividad antiuterotrófica y retarda la apertura vaginal en los modelos animales en dosis orales altas de 56 mg/kg/día y 280 mg/kg/día.
PRESENTACIÓN: ELOVENT® TWISTHALER® Inhalador de polvo seco 200 mcg (Reg. San. INVIMA 2015M-0015797).
ELOVENT® TWISTHALER® Inhalador de polvo seco 400 mcg (Reg. San. INVIMA 2015M-0015798).
Este documento fue revisado por última vez en Diciembre de 2012.
CCDS-MK0887-Versión 12-2012
MERCK SHARP & DOHME
Bogotá, D.C. - Colombia