
EFEXOR XR
VENLAFAXINA
Cápsulas de liberación prolongada
Cápsulas, 37,5 mg
Cápsulas, 75 mg
Cápsulas, 150 mg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada CÁPSULA contiene 37,5 mg, 75 mg ó 150 mg de venlafaxina (como clorhidrato).
Nombre Químico: (R/S)-1-[2-dimetilamino)–1-(4-metoxifenil)etil] ciclohexanol Clorhidrato de (±)–1-[a-[dimetilamino) metil]-p-metoxibencil] ciclohexanol
Estructura
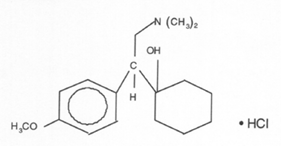
Fórmula molecular: C17H27NO2HCl
Peso molecular: 313,87
Características físicas: El clorhidrato de venlafaxina es un sólido cristalino de color blanco a blanquecino.
Solubilidad en agua: 572 mg/mL (ajustado a una concentración iónica de 0.2 M con cloruro de sodio).
Solubilidad en octanol: agua: (cloruro de sodio 0,2M), coeficiente de partición = 0,43
Clase farmacológica y terapéutica: Inhibidor de la recaptación de serotonina y norepinefrina (IRSN). Antidepresivo. Ansiolítico. Código ATC: NO6A X16
INDICACIONES TERAPÉUTICAS
Tratamiento de depresión, incluyendo depresión asociada con ansiedad.
Para la prevención de la recaída y de la recurrencia de la depresión
Tratamiento de la ansiedad y del trastorno de ansiedad generalizada, incluyendo el tratamiento a largo plazo.
Tratamiento del trastorno de ansiedad social, incluyendo el tratamiento a largo plazo.
Tratamiento del trastorno de pánico, incluyendo el tratamiento a largo plazo.
PARTICULARIDADES FARMACÉUTICAS
Incompatibilidades: No aplica.
Precauciones especiales de eliminación del medicamento o de los residuos derivados de dicho producto medicinal y manipulación del producto: Las cápsulas de liberación prolongada de venlafaxina contienen esferoides, los cuales liberan el fármaco lentamente en el tracto digestivo. La porción insoluble de estos esferoides es eliminada y puede ser vista en la materia fecal.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá – Colombia.
EFEXOR XR 37,5 mg cápsulas (Reg. San. INVIMA 2013M-0001926-R1).
EFEXOR XR 75 mg cápsulas (Reg. San. INVIMA 2008 M-012991R-1).
EFEXOR XR 150 mg cápsulas (Reg. San. INVIMA 2008 M-011741R-1).
Título del Documento: Venlafaxina
Última fecha de Revisión: Agosto 4 de 2012
Fecha efectiva: Marzo 15 de 2013
Versión CDS: 29.0
PFIZER S.A.S.
PROPIEDADES FARMACODINÁMICAS: La venlafaxina y su metabolito activo, la O-desmetilvenlafaxina, son potentes inhibidores de la recaptación de la serotonina y la norepinefrina y también inhibidores débiles de la recaptación de dopamina.
La actividad antidepresiva de la venlafaxina parece estar asociada con la potenciación de la actividad neurotransmisora en el sistema nervioso central (SNC). La venlafaxina y la O-desmetilvenlafaxina no tienen afinidad significativa para los receptores muscarínicos, histaminérgicos o a1-adrenérgicos in vitro.
La actividad de estos receptores está potencialmente asociada con varios efectos anticolinérgicos, sedativos y cardiovasculares vistos con otras drogas psicotrópicas. En los modelos preclínicos de roedores, la venlafaxina demostró una actividad predictiva de las acciones antidepresivas y ansiolíticas y propiedades para aumentar el proceso cognoscitivo.
Depresión: La eficacia de las cápsulas de venlafaxina de liberación prolongada como tratamiento para la depresión, incluyendo depresión con ansiedad asociada, se estableció en dos estudios a corto plazo controlados con placebo. Las poblaciones de ambos estudios eran pacientes ambulatorios que reunieron los criterios DSM III-R ó DSM-IV para depresión mayor.
El primer estudio, con duración de 12 semanas, comparó la venlafaxina de liberación prolongada de 75 a 150 mg/día, la venlafaxina de liberación inmediata de 75 a 150 mg/día y placebo. La venlafaxina de liberación prolongada mostró una ventaja significativa sobre placebo, comenzando desde la segunda semana de tratamiento sobre el puntaje de la Escala Hamilton para Depresión total (HAM-D) y para la categoría sobre Ánimo Deprimido de la escala HAM-D, a la tercera semana sobre el total del puntaje de la Escala de Depresión Montgomery-Asberg (MADRS), y a la cuarta semana sobre la escala de enfermedad que mide las Impresiones Clínicas Globales sobre la severidad.189 Todas las ventajas se mantuvieron hasta el final del tratamiento. La venlafaxina de liberación prolongada también mostró una ventaja significativa sobre la venlafaxina de liberación inmediata a las semanas 8 y 12 sobre el total de la escala HAM-D y la Escala CGI Severidad de la Enfermedad, y a la semana 12 para todas las variables de eficacia.
El segundo estudio comparó el tratamiento de venlafaxina de liberación prolongada con dosis de 75 a 225 mg/día y placebo durante 8 semanas. La estadística sobre mejoría sostenida y placebo se notó a la segunda semana para la escala CGI, Severidad de la Enfermedad; al empezar la cuarta semana para la escala HAM-D total y la escala MADRS total, y comenzando con la tercera semana para la categoría de Ánimo Deprimido de la escala HAM-D.
Trastorno de Ansiedad Generalizada: La eficacia de las cápsulas de venlafaxina de liberación prolongada en el tratamiento para Trastorno de Ansiedad Generalizada (TAG) se estableció en dos estudios a corto plazo (8 semanas), controlados con placebo, estudios de dosis fijas; un estudio a largo plazo (6 meses de duración), controlado con placebo, dosis fija, y un estudio largo plazo (seis meses), placebo controlado, dosis flexible en pacientes ambulatorios que reunieron los criterios DSM-IV para TAG.
Un estudio a corto plazo que evaluaba las dosis de venlafaxina de liberación prolongada de 75, 150, y 225 mg/día y de placebo, mostró que la dosis de 225 mg/día fue más efectiva que el placebo sobre el puntaje total de la Escala Hamilton para ansiedad (HAM-A), tensión y la escala CGI. También hubo evidencia de superioridad sobre el placebo para las dosis de 75 y 50 mg/día pero estas dosis no fueron tan consistentemente efectivas como la dosis más alta.
Un segundo estudio a corto plazo, que evaluaba las dosis de venlafaxina de liberación prolongada de 75 y 150 mg/día y de placebo, mostró que ambas dosis fueron más efectivas que el placebo sobre varios de estos mismos resultados; sin embargo, la dosis de 75 mg/día fue consistentemente más efectiva que la dosis de 150 mg/día. Dos estudios a largo plazo (duración de 6 meses), uno con dosis de venlafaxina de liberación prolongada de 37,5, 75 y 150 mg/día y el otro evaluando dosis de 75 a 225 mg/día, mostró que las dosis de 75 mg o mayores eran más efectivas que el placebo sobre el HAM-A total, sobre ambos ítems del HAM-A, para ansiedad y tensión y la escala CGI después de tratamientos a corto plazo (8 semanas) y a largo plazo (mes 6).
PROPIEDADES FARMACODINÁMICAS
Absorción: Al menos el 92% de la venlafaxina se absorbe después de una dosis oral de venlafaxina de liberación inmediata. La biodisponibilidad absoluta es del 40% al 45% debido al metabolismo presistémico. En estudios de dosis única de 25 a 150 mg de venlafaxina de liberación inmediata, el promedio de las concentraciones plasmáticas máximas (Cmax), oscilo entre 37 a 163 ng / mL respectivamente y se alcanzó a las 2,1 a 2,4 horas (tmax). Después de la administración de cápsulas de venlafaxina de liberación prolongada, se observan concentraciones plasmáticas pico de venlafaxina y ODV en el curso de 5,5 y 9 horas, respectivamente. Después de la administración de venlafaxina de liberación inmediata, las concentraciones plasmáticas máximas de venlafaxina y O-desmetilvenlafaxina se producen en 2 y 3 horas, respectivamente.
El periodo de absorción de las cápsulas de venlafaxina de liberación prolongada y las tabletas de liberación inmediata, es similar.
Distribución: Las concentraciones estables de venlafaxina y de ODV en plasma se obtienen dentro de los 3 días siguientes del tratamiento con dosis múltiples orales de venlafaxina de liberación inmediata. Sobre el rango de dosis entre 75 a 450 mg diarios; venlafaxina y ODV exhiben una farmacocinética lineal cuando se administran cada 8 horas. La fijación de venlafaxina y la ODV a las proteínas plasmáticas humanas fluctúa entre 27% y 30%, respectivamente. Puesto que esta fijación es independiente de las concentraciones respectivas de la droga hasta 2,215 y 500 ng/mL, tanto venlafaxina como ODV tienen un potencial bajo para una interacción significativa con otras drogas y que comprometan el desplazamiento de la droga de las proteínas séricas. El volumen de distribución para la venlafaxina en el estado estable, seguido de una administración intravenosa es de 4,4 + 1,.9 l/kg.
Metabolismo: La venlafaxina se metaboliza extensamente en el hígado. Los estudios in vitro e in vivo indican que la venlafaxina es biotransformada a su principal metabolito ODV por la isoenzima CYP2D6 del citocromo P450. Estudios in vitro e in vivo indican que la venlafaxina es metabolizada por el CYP3A4 a un metabolito secundario menos activo, N-desmetilvenlafaxina. A pesar de que la poca actividad de CYP2D6 puede diferir entre los pacientes, no se requiere modificaciones relacionadas con el régimen de la dosis de venlafaxina. La exposición a la droga (AUC) y la fluctuación en los niveles plasmáticos tanto de venlafaxina como de ODV fueron comparables, seguida de una administración de dosis iguales de venlafaxina en regímenes de dos veces al día (b.i.d.) o tres veces al día (t.i.d.) de la venlafaxina de liberación inmediata.
Eliminación: La venlafaxina y sus metabolitos son excretados primordialmente a través de los riñones. Aproximadamente un 87% de la dosis de venlafaxina es recuperada en la orina dentro de las primeras 48 horas después de su administración e igualmente se recupera como 5% de la venlafaxina sin cambios, ODV no conjugada (29%), ODV conjugada (26%) u otros metabolitos menores (27%).
Efecto de los alimentos: La comida no ejerce efectos sobre la absorción de la venlafaxina ni sobre la ulterior formación de ODV.
Enfermedad hepática: En algunos pacientes con cirrosis hepática compensada (deterioro hepático moderado), la disposición farmacocinética de venlafaxina u ODV estuvo significativamente alterada después de la administración de una dosis única oral de venlafaxina. En los pacientes con deterioro hepático, la depuración plasmática promedio de la venlafaxina y ODV está reducida aproximadamente 30 a 33% y las vidas medias promedio de eliminación están prolongadas dos veces o más si se compara con sujetos normales.
En un segundo estudio, venlafaxina fue administrada oral e intravenosamente en sujetos normales (n=21), en sujetos Child-Pugh A (n=8) y sujetos Child-Pugh B (n=11) (deterioro hepático leve y moderado respectivamente). En comparación de los sujetos normales, la biodisponibilidad oral en pacientes con deterioro hepático fue aproximadamente el doble. En pacientes con deterioro hepático, la vida media de eliminación de venlafaxina oral fue aproximadamente dos veces y la depuración oral fue reducida a más de la mitad en comparación con los sujetos normales. En sujetos con deterioro hepático, la vida media de eliminación de ODV oral fue prolongada en aproximadamente un 40%, mientras que la depuración oral de ODV fue similar a la de sujetos normales. Se notó un gran grado de variabilidad intersujeto.
Pacientes con disfunción renal: Las vidas medias de eliminación de venlafaxina y ODV aumentan con el grado de deterioro en la función renal. La vida media de eliminación aumenta aproximadamente 1,5 veces en pacientes con falla renal moderada y entre 2,5 y 3 veces en pacientes con enfermedad renal terminal.
Edad y estudios de género: Un análisis farmacocinético de la población de 404 pacientes tratados con venlafaxina de liberación inmediata en dos estudios que incluyeron los regímenes de dosis de 2 y 3 veces al día mostraron que los niveles plasmáticos normalizados ya fuera de venlafaxina y/o ODV no fueron alterados por diferencias en la edad y el género.
CONTRAINDICACIONES: Hipersensibilidad al medicamento, embarazo, lactancia y menores de 18 años. Tratamiento concomitante con inhibidores de la MAO. Hipertensión persistente o no controlada. Debe administrarse con precaución en pacientes con insuficiencia renal y/o hepática, los cuales requieren ajustes en la dosificación. Después de administrar el medicamento durante varios días, su supresión requiere un descenso gradual de la medicación. No administrar antes de 14 días después de haber suspendido los inhibidores de la MAO, ni administrar inhibidores MAO antes de 7 días de haber suspendido la Venlafaxina. Debe establecerse un monitoreo periódico de la presión arterial.
FERTILIDAD, EMBARAZO Y LACTANCIA: La seguridad de la venlafaxina en el embarazo en humanos no se ha establecido. La venlafaxina debe administrarse únicamente a mujeres embarazadas si los beneficios esperados sobrepasan los riesgos posibles. Si se utiliza la venlafaxina hasta o un poco antes del nacimiento, los efectos de descontinuación de la venlafaxina en el recién nacido debe ser considerados. algunos neonatos expuestos a venlafaxina, al final del tercer trimestre han desarrollado complicaciones que requieren alimentación por tubo, soporte respiratorio u hospitalización prolongada. tales complicaciones pueden surgir inmediatamente después del parto.
Cuando la venlafaxina fue administrada oralmente a ratas embarazadas durante la gestación y la lactancia, hubo una disminución de peso en las crías, un incremento en las crías nacidas muertas durante los 5 primeros días de lactancia, cuando las dosis comienzan durante el embarazo y continúa hasta el destete. La causa de estas muertes es desconocida. Estos efectos ocurren a 10 veces (sobre una base de mg/kg) o 2,5 veces (sobre una base de mg/m2) de la dosis diaria humana de 375 mg de venlafaxina. La dosis sin efectos en la mortalidad de las crías fue 1,4 veces la dosis humana sobre una base de mg/Kg o 0,25 veces la dosis humana en mg/m2.
La venlafaxina y la o-desmetilvenlafaxina se excretan en la leche humana; de tal forma que se debe tomar la decisión de no lactar o de descontinuar la venlafaxina.
EFECTOS INDESEABLES
Las reacciones adversas están enumeradas en la Tabla de acuerdo con las categorías de frecuencia del CIOMS
Común: >1%
Poco común: >0,1% y < 1%
Raro: >0,01% y < 0.1%
Muy raro: < 0,01%
Frecuencia desconocida: No se puede estimar a partir de los datos disponibles.
|
Sistema Orgánico |
Reacciones Adversas |
|
Sistémico |
|
|
Común: |
Astenia/fatiga, resfriados* |
|
Poco común: |
Angioedema*, Reacción de fotosensibilidad |
|
Muy Raro: |
Anafilaxia* |
|
Sistema Cardiovascular |
|
|
Común: |
Hipertensión, vasodilatación (la mayoría de oleadas de calor/rubor), palpitaciones*. |
|
Poco común: |
Hipotensión postural*, síncope, hipotensión, taquicardia |
|
Muy raro: |
Prolongación del segmento QT, * fibrilación ventricular,* taquicardia ventricular (incluyendo torsión de puntas)*. |
|
Sistema digestivo |
|
|
Común: |
Disminución del apetito, estreñimiento, náusea y vómito |
|
Poco común: |
Bruxismo,* diarrea. |
|
Muy raro: |
Pancreatitis |
|
Sistema linfático y hematológico |
|
|
Poco común: |
Equimosis, sangrado en membranas mucosas, hemorragia gastrointestinal* |
|
Raro: |
Prolongación del tiempo de sangrado, *trombocitopenia* |
|
Muy raro: |
Discrasias sanguíneas,* (incluyendo agranulocitosis,*, anemia aplásica,* neutropenia,* y pancitopenia*) |
|
Desordenes del sistema inmune |
|
|
Metabólico y nutricional |
|
|
Común: |
Incremento del colesterol sérico (particularmente con la administración prolongada o dosis muy altas), pérdida de peso |
|
Poco común: |
Pruebas de función hepática anormales, *hiponatremia e *incremento de peso |
|
Raro: |
Hepatitis*, síndrome de secreción inapropiada de hormona antidiurética (SSIHA)*. |
|
Muy raro: |
Incremento de la prolactina sérica* |
|
Músculo-esquelético |
|
|
Muy raro: |
Rabdomiolisis* |
|
Sistema nervioso |
|
|
Muy Común: |
Cefalea* |
|
Común: |
Sueños anormales, disminución de la libido, vértigo, xerostomía, incremento del tono muscular, insomnio, nerviosismo, parestesia, sedación, temblor, confusión,* despersonalización*. |
|
Poco común: |
Apatía, alucinaciones, mioclonus, agitación*, afectación de la coordinación y el equilibrio*. |
|
Raro: |
Acatisia/agitación psicomotora*, convulsiones, reacciones maníacas, síndrome neuroléptico maligno (SNM) y *síndrome serotoninérgico* |
|
Muy raro: |
Delirio*, reacciones extrapiramidales (incluyendo distonía, discinesia)*, discinesia tardía*. |
|
Sistema respiratorio |
|
|
Común: |
Bostezos |
|
Poco común: |
Disnea* |
|
Muy raro: |
Eosinofilia pulmonar* |
|
Piel |
|
|
Común: |
Sudoración (incluyendo sudoración nocturna)* |
|
Poco común: |
Exantema, alopecia* |
|
Muy raro: |
Eritema multiforme,* síndrome de Stevens Johnson,* prurito, *, Urticaria* |
|
Frecuencia Desconocida: |
Necrosis epidérmica tóxica*. |
|
Órganos de los sentidos |
|
|
Común: |
Anormalidades de la acomodación, midriasis, trastorno visual |
|
Poco común: |
Sensaciones alteradas en el sentido del gusto, tinitus* |
|
Muy raro: |
Glaucoma de ángulo estrecho* |
|
Sistema Genitourinario |
|
|
Común: |
Eyaculación/orgasmo anormales (en hombres), anorgasmia, disfunción eréctil y micción trastornada (comúnmente demora involuntaria o incapacidad para comenzar a orinar), trastornos menstruales asociados con aumento de hemorragia o aumento irregular de hemorragia* (por ejemplo: menorragia, metrorragia*), aumento en la frecuencia urinaria*. |
|
Poco común: |
Orgasmos anormales (mujeres), retención urinaria |
|
Raro: |
Incontinencia urinaria*. |
|
Lesión, envenenamiento y complicaciones del procedimiento |
|
|
Desconocida: |
Fractura ósea (no se puede estimar a partir de los datos Disponibles) |
|
*Reacciones adversas identificadas durante la postcomercialización |
|
Los siguientes síntomas se han reportado en asociación con una descontinuación abrupta, con una reducción de dosis, o con una disminución gradual del tratamiento, hipomanía, ansiedad, agitación, nerviosismo, confusión, insomnio u otros trastornos del sueño, fatiga, somnolencia, parestesia, mareo, convulsión, vértigo, cefalea, síntomas seudogripales, tinitus, deterioro de la coordinación y el equilibrio, tremorsudoración, sequedad bucal, anorexia, diarrea, náusea y vómito. En estudios precomercialización la mayoría de las reacciones de descontinuación fueron leves y se resolvieron sin tratamiento.
Pacientes pediátricos: En general el perfil de reacciones adversas de venlafaxina (en estudios controlados con placebo), en niños y adolescentes (edades de 6 a 17 años), fue similar al observado en los adultos. Como con los adultos se observó disminución en el apetito, pérdida de peso, incremento en la presión sanguínea e incremento del colesterol sérico (ver secciones Advertencias especiales y Efectos indeseables).
En estudios clínicos con pacientes pediátricos se ha observado como reacción adversa la ideación suicida. También se ha observado aumento de reportes de hostilidad especialmente lesiones autoinflingidas en el trastorno depresivo mayor.
Particularmente, fueron observadas las siguientes reacciones adversas: Dolor abdominal, agitación, dispepsia, equimosis epistaxis y mialgia.
EFECTOS SOBRE LAS ACTIVIDADES QUE REQUIEREN CONCENTRACIÓN Y DESEMPEÑO: La venlafaxina no afectó el comportamiento psicomotor, cognitivo o el desempeño complejo del comportamiento en voluntarios sanos. Sin embargo, cualquier fármaco psicoactivo puede deteriorar el juicio, el pensamiento y las habilidades motoras. Por lo tanto, se debe precaver a los pacientes acerca de sus habilidades para conducir u para operar maquinaria de alto riesgo.
INTERACCIONES CON OTROS PRODUCTOS MEDICINALES Y OTRAS FORMAS DE INTERACCIÓN
Inhibidores de la Monoaminoxidasa (IMAO): Varias reacciones adversas severas han sido reportadas en pacientes que recientemente han descontinuado un IMAO y han comenzado con venlafaxina, o que han descontinuado recientemente la terapia con venlafaxina antes de la iniciación de un IMAO. (Ver sección Contraindicaciones). Estas reacciones incluyen: temblor, mioclonus, diaforesis, náuseas, vómito, enrojecimiento de la piel, mareo e hipertermia con manifestaciones semejantes a un síndrome neuroléptico maligno, convulsiones y muerte.
Medicamentos activos en el SNC: El riesgo de usar venlafaxina en combinación con otros medicamentos activos sobre el SNC no ha sido evaluado sistemáticamente. Por consiguiente, se debe tener precaución cuando la venlafaxina sea administrada en combinación con otros medicamentos de actividad sobre el SNC.
Síndrome de la Serotonina: Como sucede con otros agentes serotoninérgicos se puede presentar con el tratamiento de venlafaxina el síndrome de serotonina una condición potencial de amenaza contra la vida, particularmente con el uso concomitante de otros agentes que puedan afectar el sistema neurotransmisor serotoninérgico. (Incluye triptanos, IRSS, otros IRNS, litio, sibutramina, fentanil y sus análogos, tramadol, dextrometorfano, tapentadol, meperidina, metadona, pentazocina o la hierba de San Juan [Hypericum perforatum]), con medicamentos que afectan el metabolismo de la serotonina, (como p. ej., los IMAO; incluyendo linezolide, [antibiótico el cual es un IMAO reversible no-selectivo]) y azul de metileno o con precursores de serotonina (tales como suplementos del triptófano) (ver secciones Contraindicaciones y Advertencias especiales ).
Si el tratamiento concomitante con venlafaxina y un IRSS, un IRNS o un agonista del receptor 5-hidroxitriptamina (triptano) se justifica clínicamente, se aconseja la observación cuidadosa del paciente, particularmente durante la iniciación del tratamiento y el incremento de la dosis. El uso concomitante de venlafaxina con precursores de serotonina (tales como suplementos de triptófano) no es recomendado (ver sección Advertencias especiales).
Medicamentos que prolongan el intervalo QT: El riesgo de la prolongación QTc y/o arritmias ventriculares (p. ej., TdP) aumenta con el uso concomitante de otros medicamentos que prolongan el intervalo QTc (p. ej., algunos antisicóticos y antibióticos) (ver sección Advertencias especiales).
Indinavir: Un estudio farmacocinético con Indinavir mostró una disminución del 28% del área bajo la curva (AUC) y un 36% de disminución en Cmax para Indinavir. El indinavir no afectó la farmacocinética de la venlafaxina y o-desmetilvenlafaxina. Se desconoce el significado clínico de esta interacción.
Etanol: No se ha demostrado que la venlafaxina aumente el deterioro mental y la habilidad motora causada por el etanol. Sin embargo, cómo con todas las drogas activas del sistema nervioso central (SNC), los pacientes deben ser aconsejados para evitar el consumo de alcohol mientras estén tomando venlafaxina.
Haloperidol: Un estudio farmacocinético con haloperidol ha mostrado para el caso de haloperidol: una disminución del 42% en la depuración total oral, un incremento del 70% en el AUC (área bajo la curva), un 88% de incremento en la Cmax, sin ningún cambio en la vida media. Esto debe tenerse en cuenta en pacientes tratados concomitantemente con haloperidol y venlafaxina.
Cimetidina: En el estado estable se ha demostrado que la cimetidina inhibe el metabolismo de primer paso de la venlafaxina; sin embargo, la cimetidina no tiene efectos sobre la farmacocinética de ODV. La actividad farmacológica total de la venlafaxina más ODV se espera que aumente ligeramente en la mayoría de los pacientes. En pacientes ancianos con disfunción hepática esta interacción puede ser más pronunciada.
Imipramina: La venlafaxina no afecta la farmacocinética de imipramina y la 2-OH- imipramina. Sin embargo, el AUC de la desipramina, la Cmax, y la Cmin se incrementó en un 35% en presencia de venlafaxina. Hubo un aumento de 2,5 a 4,5 veces del AUC de 2-OH-Desipramina. La imipramina no afectó la farmacocinética de venlafaxina y ODV. Esto debe tenerse en cuenta en pacientes tratados con imipramina y venlafaxina concomitantemente.
Ketoconazol: Un estudio farmacocinético con ketoconazol en metabolizadores extensivos (ME) y pobres (MP) de CYP2D6 demostró en la mayoría de los sujetos un aumento en las concentraciones plasmáticas de venlafaxina y de ODV luego de la administración de ketoconazol. El Cmax de venlafaxina se incrementó en un 26% en sujetos ME y en un 48% en sujetos MP. El valor de Cmax para ODV se incrementó en un 14% y en un 29% en sujetos ME y MP, respectivamente. El AUC de venlafaxina se incrementó en un 21% en sujetos ME y en un 70% en sujetos MP. El valor de AUC para ODV se incrementó en un 23% y en un 33% en sujetos ME y MP, respectivamente (ver sección Interacciones con otros productos medicinales y otras formas de interacción - Potencial de otros medicamentos para afectar a la venlafaxina).
Metoprolol: En un estudio de interacción farmacocinética, la administración concomitante de venlafaxina (50 mg cada 8 horas por 5 días) y metoprolol (100 mg cada 24 horas por 5 días) a voluntarios sanos, mostró un incremento de las concentraciones plasmáticas de metoprolol en aproximadamente 30 - 40% sin alteración de las concentraciones plasmáticas de su metabolito activo, a-hidroximetoprolol. La venlafaxina parece que redujo el efecto del metoprolol de bajar la tensión arterial en este estudio de voluntarios sanos. La relevancia clínica de este hallazgo en pacientes hipertensos es desconocida. Metoprolol no alteró el perfil farmacocinético de venlafaxina o de su metabolito activo, O-desmetilvenlafaxina. Se debe tener precaución con la coadministración de venlafaxina y metoprolol.
Risperidona: La venlafaxina aumentó el AUC de risperidona en un 32% pero no alteró significativamente el perfil farmacocinético de la porción activa total (risperidona más 9-hidroxirisperidona). El significado clínico de está interacción es desconocido.
Diazepam: El diazepam no parece afectar la farmacocinética de la venlafaxina o de ODV. La administración de venlafaxina no tiene efectos sobre la farmacocinética y farmacodinamia de diazepam y de su metabolito activo, desmetildiazepam.
Litio: La farmacocinética en el estado estable de la venlafaxina y la ODV no son afectadas cuando se administra concomitantemente litio. La venlafaxina no afectó el perfil farmacocinético del litio. (Ver también Medicamentos Activos en el SNC).
Fármacos altamente unidos a las proteínas plasmáticas: La venlafaxina no se une fuertemente a las proteínas plasmáticas (27% de unión); por lo tanto, la administración de venlafaxina a pacientes tomando otros medicamentos que se unan fuertemente a las proteínas no se espera que cause aumento en las concentraciones libres de los otros fármacos.
Fármacos Metabolizados por las Isoenzimas del Citocromo P450: Estudios indican que la venlafaxina es un inhibidor relativamente débil de la CYP2D6. La venlafaxina in vitro no inhibe CYP3A4, CYP1A2, CYP2C9. Estos hallazgos han sido confirmados en estudios in vivo con los siguientes fármacos: alprazolam (CYP3A4), cafeína (CYP1A2), carbamazepina (CYP3A4), diazepam (CYP3A4 y CYP2C19) y tolbutamida (CYP2C9).
Potencial de otros Medicamentos para Afectar la venlafaxina: La ruta de metabolismo de venlafaxina incluye CYP2D6 y CYP3A4. venlafaxina es metabolizado primero a su metabolito activo ODV, por el citocromo P450 enzima CYP2D6. La enzima CYP3A4 comparado con la CYP2D6 no es la principal ruta en el metabolismo de la venlafaxina.
Inhibidores de CYP2D6: El uso concomitante de Inhibidores de CYP2D6 y venlafaxina puede reducir el metabolismo de venlafaxina a OVD, resultando en un incremento en la concentración en plasma de venlafaxina y disminución de OVD. Como venlafaxina y OVD son farmacológicamente activos, el ajuste de dosis no es requerido cuando la venlafaxina es coadministrada con inhibidores CYP2D6.
Inhibidores de CYP3A4: El uso concomitante de inhibidores del CYP3A4 y venlafaxina puede incrementar los niveles de venlafaxina y ODV (ver sección Interacciones con otros productos medicinales y otras formas de interacción , Ketoconazol). Por lo tanto, se aconseja tener precaución cuando un paciente utilice concomitantemente en su terapia un inhibidor del CYP3A4 y venlafaxina (ver Farmacocinética, Metabolismo).
Inhibidores de CYP2D6 y 3A4: El uso concomitante de venlafaxina con medicamentos que potencialmente inhiben CYP2D6 y CYP3A4, enzimas del metabolismo primario de venlafaxina, no ha sido estudiado. Sin embargo, de este uso concomitante se esperaría un incremento de las concentraciones en plasma de venlafaxina. Por lo tanto, la advertencia es avisar cuando la venlafaxina es combinada con cualquier agente que produzca inhibición simultánea de estos dos sistemas de enzimas.
Terapia Electroconvulsiva: No hay datos clínicos que establezcan el beneficio de la terapia electroconvulsiva combinada con el tratamiento con venlafaxina.
Interacciones con Pruebas de Laboratorio de Detección de Fármacos: Se han reportado falsos positivos en pruebas de detección de fármacos mediante inmunoanálisis en orina para fenciclidina (PCP) y anfetaminas en pacientes que estaban tomando venlafaxina. Esto se debe a la falta de especificidad de las pruebas de detección. Los resultados falso positivos de las pruebas pueden esperarse durante varios días después de la interrupción del tratamiento con venlafaxina. Las pruebas confirmatorias, como por ejemplo cromatografía de gases/espectometría de masas, distinguirán la venlafaxina de la PCP y las anfetaminas.
INFORMACIÓN DE SEGURIDAD PRECLÍNICA
Carcinogenicidad: La venlafaxina fue administrada en forma de cebos orales a ratones y ratas por 18 meses en dosis hasta de 120 mg/kg/día (1,7 veces la dosis máxima recomendada para los humanos en mg/m2). También se administró venlafaxina por medio de un cebo oral a ratones y ratas por 24 meses en dosis hasta de 120 mg/kg/día (1,7 la dosis máxima recomendada para los humanos). La concentración plasmática en necropsia de venlafaxina en las ratas que recibieron la dosis de 120 mg/kg fue 1 vez (ratas macho) y 6 veces (ratas hembra) las concentraciones plasmáticas de pacientes que estaban recibiendo el máximo de la dosis recomendada en humanos. Los niveles plasmáticos de la ODV fueron más bajos en ratas que en pacientes que recibieron la dosis máxima recomendada. Los tumores no aumentaron por el tratamiento de venlafaxina en ratones o ratas.
Mutagenicidad: La venlafaxina y ODV no fueron mutagénicos en el ensayo de mutación reversa de Ames en la bacteria Salmonella y en el ovario de hámster chino (CHO)/análisis de mutación el gene de la célula de mamíferos HGPRT. La venlafaxina tampoco fue mutagénica o clastogénica en el ensayo de mutación in vitro en células de ratones BALB7c-3T3; ni en otros realizados en las células ováricas de hámster chino, o en el ensayo in vivo de aberraciones cromosómicas en la médula ósea de ratas. La ODV tampoco fue clastogénica en el ensayo in vivo de aberraciones cromosómicas en la médula ósea de ratones chinos, pero produjo una respuesta clastogénica en el ensayo in vivo de aberraciones cromosómicas en la médula ósea en ratas.
Deterioro de la fertilidad: Los estudios sobre reproducción y fertilidad en ratas no mostraron efectos en la fertilidad y reproducción en machos o hembras, con dosis orales de hasta ocho veces la dosis máxima diaria recomendada en humanos en mg/kg, o dos veces la máxima recomendada en humanos en mg/m2.
Fue observada una reducción en la fertilidad en un estudio en el cual ratas macho y hembra fueron expuestas al metabolito principal de la venlafaxina (ODV). Esta exposición de ODV fue aproximadamente 2 a 3 veces la de la dosis humana de venlafaxina de 225 mg/día La relevancia de este hallazgo en humanos es desconocida.
Teratogenicidad: Venlafaxina no causa malformaciones en la descendencia de ratas o conejos a dosis administradas de 11 veces (ratas) o 12 veces (conejos) de la dosis humana de 375 mg/día de venlafaxina (sobre una base de mg/Kg), o 2,5 veces (ratas) y 4 veces (conejos) de la dosis de 375 mg/día de venlafaxina (en mg/m2).
ADVERTENCIAS ESPECIALES
Suicidio / pensamientos suicidas o empeoramiento clínico: Todos los pacientes tratados con venlafaxina deben ser monitoreados apropiadamente y observados estrechamente por un empeoramiento o suicidalidad. A los pacientes, familiares y sus cuidadores, se les debe advertir acerca de una emergencia de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía, manía, otros cambios inusuales en el comportamiento, empeoramiento de la depresión y generación de ideas suicidas, especialmente al inicio de la terapia o durante cualquier cambio de la dosis o del régimen de dosificación. Se debe considerar el riesgo de intento de suicidio especialmente en pacientes deprimidos y se debe proporcionar la menor cantidad de medicamento, que sea consistente con el buen manejo del paciente, para reducir el riesgo de sobredosis (ver secciones Advertencias especiales y Efectos indeseables).
El suicidio es un riesgo conocido de la depresión y de ciertos otros trastornos psiquiátricos, y estos trastornos, por si mismos, son fuertes predictores de suicidio. Análisis conjuntos de ensayos de corto plazo controlados con placebo, de medicamentos antidepresivos (IRSS y otros) mostraron que estos medicamentos incrementaban el riesgo de suicidio en niños, adolescentes y adultos jóvenes (entre 18 – 24 años) con depresión mayor y otros trastornos psiquiátricos. Estudios de corto plazo no mostraron un incremento en el riesgo de suicidio con antidepresivos comparados con placebo en adultos de 24 años. Hubo una reducción in el riesgo de suicidalidad con antidepresivos comparado con el placebo en adultos de 65 años o más.
Fracturas Óseas: Los estudios epidemiológicos muestran aumento en el riesgo de fracturas óseas en pacientes que están recibiendo inhibidores de la recaptación de serotonina (IRS) incluida venlafaxina. Aún no se comprende completamente el mecanismo que conlleva a ese riesgo.
Uso en niños y adolescentes: La eficacia en pacientes menores de 18 años aún no se ha establecido.
Es recomendado realizar mediciones regulares del peso y de la tensión arterial en niños y adolescentes en tratamiento con venlafaxina. En niños y adolescentes que presenten elevación sostenida de la tensión arterial debe considerarse la descontinuación del tratamiento con venlafaxina. La medición de los niveles séricos de colesterol debe ser considerada en el tratamiento prolongado de niños y adolescentes (ver secciones Dosis y método de administración y Efectos indeseables). La seguridad en niños menores de 6 años no ha sido evaluada.
Síndrome neuroléptico maligno (SNM): Como con otros agentes serotoninérgicos, se puede presentar con el tratamiento de venlafaxina el desarrollo de síndrome de serotonina o reacciones similares al Síndrome Neuroléptico Maligno (SNM), que potencialmente amenazan la vida, particularmente con el uso concomitante de otros medicamentos serotoninérgicos (incluidos IRSS, IRNS, triptanos, fentanil, dextrometorfano, tramadol, tapentadol, meperidina, metadona y pentazocina), con medicamentos que deterioran el metabolismo de la serotonina (incluidos los IMAO, por ejemplo azul de metileno), o con antipsicóticos u otros antagonistas de la dopamina. Los síntomas del síndrome de serotonina pueden incluir cambios en el estado mental (p. ej., agitación, alucinaciones y coma), inestabilidad autonómica (p. ej., taquicardia, tensión arterial inestable e hipertermia), afecciones neuromusculares (p. ej., hiperreflexia, falta de coordinación), y/o síntomas gastrointestinales (p. ej., náuseas, vómito y diarrea). El síndrome de serotonina, en su forma más grave, puede asemejarse al SNM, que incluye hipertermia, rigidez muscular, inestabilidad autonómica con posible fluctuación rápida de los signos vitales y cambios en el estado mental. (Ver sección Interacciones con otros productos medicinales y otras formas de interacción).
Si el tratamiento concomitante con venlafaxina y otros medicamentos que pueden afectar el sistema neurotransmisor serotoninérgico y/o dopaminérgico se justifica clínicamente, se aconseja observación cuidadosa del paciente, específicamente durante el inicio del tratamiento y cuando se incrementa la dosis.
No se recomienda la utilización concomitante de venlafaxina con precursores de la serotonina (p. ej., suplementos de triptófano).
Midriasis: Puede ocurrir midriasis asociada al uso de venlafaxina. Se recomienda que los pacientes que presenten presión intraocular elevada o pacientes en riesgo de un glaucoma agudo de ángulo estrecho (glaucoma de ángulo cerrado) sean vigilados muy de cerca.
Sistema cardiovascular: La venlafaxina no ha sido evaluada en pacientes con una historia reciente de infarto de miocardio o con enfermedad cardiaca inestable. Por lo tanto, debe usarse con precaución en estos pacientes.
Se han reportado aumentos en la tensión arterial relacionados con la dosis en algunos pacientes tratados con venlafaxina. En la experiencia postcomercialización se han reportado casos de tensión arterial elevada que requirieron tratamiento inmediato. Se recomienda monitorear la tensión arterial para pacientes que reciben venlafaxina. La hipertensión pre-existente debe ser controlada antes de iniciar el tratamiento con venlafaxina. Se debe tener precaución con los pacientes cuyas otras condiciones de base pueden verse comprometidas con un incremento en la presión sanguínea.
Se pueden presentar aumentos en la frecuencia cardiaca, particularmente con dosis elevadas. Debe ejercerse precaución en pacientes cuyas condiciones subyacentes puedan comprometerse con aumentos en la frecuencia cardiaca.
Se han informado casos de prolongación de la QTc, Torsade de Pointes (TdP), taquicardia ventricular y muerte súbita durante el uso posterior a la comercialización de venlafaxina. La mayoría de los informes ocurrió en asociación con sobredosis o en pacientes con otros factores de riesgo para prolongación de la QTc/TdP. Por lo tanto, la venlafaxina debe emplearse con precaución en pacientes con factores de riesgo para prolongación de la QTc.
Convulsiones: Las convulsiones pueden ocurrir con la terapia de venlafaxina. Como con todos los antidepresivos, la venlafaxina debe ser iniciada con precaución en pacientes con antecedentes de convulsiones.
Manía/Hipomanía: Puede ocurrir manía/hipomanía en una pequeña proporción de pacientes con trastornos del humor y que hayan recibido antidepresivos, incluyendo la venlafaxina. Como con otros antidepresivos, la venlafaxina debe usarse con precaución en pacientes con historia o con antecedentes familiares de trastorno bipolar.
Agresión: Pueden ocurrir casos de agresión en una pequeña proporción de pacientes que reciban antidepresivos, incluyendo terapia con venlafaxina, reducción o descontinuación de la dosis. Como con otros antidepresivos, la venlafaxina debería ser usada cautelosamente en pacientes con antecedentes de agresión.
Hiponatremia: Pueden ocurrir casos de hiponatremia y/o el síndrome de secreción inapropiada de hormona antidiurética (SIADH) con venlafaxina, usualmente en pacientes con un volumen disminuido o pacientes deshidratados. Pacientes ancianos, pacientes que toman diuréticos y pacientes quienes están de una u otra manera con un volumen disminuido, pueden tener un mayor riesgo en este evento.
Hemorragia: Los inhibidores de la recaptación de serotonina pueden producir anormalidades en la agregación plaquetaria. Se han reportado anomalías de sangrado con la venlafaxina, desde sangrado a nivel de la piel, las membranas mucosas, que incluye la hemorragia gastrointestinal, hasta hemorragia potencialmente mortal. De igual forma que se hace con otros inhibidores de la recaptación de serotonina, se debe utilizar la venlafaxina con precaución en pacientes con predisposición a hemorragias que incluyen a los pacientes bajo tratamiento con anticoagulantes e inhibidores plaquetarios.
Pérdida de peso: La seguridad y eficacia de la terapia con venlafaxina en combinación con los agentes para perder peso, incluyendo la fentermina, no han sido establecidas. La administración de venlafaxina clorhidrato concomitantemente con agentes para perder peso no está recomendada. La venlafaxina clorhidrato no está indicada para la pérdida de peso por sí sola o en combinación con otros productos.
Colesterol sérico: En estudios controlados con placebo de al menos 3 meses de duración, se han registrado incrementos del colesterol sérico clínicamente relevantes en 5,3% de los pacientes tratados con venlafaxina y en 0,0% de los pacientes tratados con placebo. Deben considerarse las mediciones del colesterol sérico en pacientes con tratamientos prolongados.
Descontinuación: Los efectos de la descontinuación de agentes antidepresivos son bien conocidos, y por lo tanto se recomienda que la dosis de cualquiera de las formulaciones de venlafaxina sea disminuida gradualmente y los pacientes sean monitorizados (ver secciones Dosis y método de administración y Efectos indeseables).
Abuso y dependencia: Los estudios clínicos no mostraron evidencia de búsqueda compulsiva de la droga, desarrollo de tolerancia o aumento escalado de dosis en el tiempo.
Los estudios in vitro revelaron que la venlafaxina virtualmente no tiene ninguna afinidad con los receptores opiáceos, de benzodiacepinas, de fenciclidina (PCP), o sobre los receptores del ácido N-metil-D-aspártico (NMDA). Tampoco se encontró que la venlafaxina tenga una actividad estimulante significativa sobre el SNC de roedores. En estudios de discriminación de la droga realizados en primates, la venlafaxina no mostró efectos estimulantes o depresivos significativos por riesgo de abuso. En un estudio de auto-administración en monos rhesus se ha observado la auto-administración de venlafaxina intravenosamente.
DOSIS Y MÉTODO DE ADMINISTRACIÓN: Se recomienda que las cápsulas de liberación prolongada sean tomadas con la comida y aproximadamente a la misma hora cada día. Las cápsulas deben ser tragadas enteras con líquido y no deben ser partidas, trituradas, masticadas o disueltas, o también puede ser administrado abriendo cuidadosamente la cápsula y colocando el contenido completo en una cucharada de compota de manzana. Esta mezcla debe ser ingerida inmediatamente, sin masticar, y seguida de un vaso de agua que asegure la ingestión completa de los microgránulos.
Con la excepción de los pacientes con TAS (ver abajo), los pacientes que no responden a la dosis de 75 mg/día, pueden beneficiarse de un incremento en la dosis desde 75 mg/día hasta un máximo de 225 mg/día. Los incrementos de la dosis de venlafaxina de liberación prolongada pueden hacerse a intervalos de aproximadamente 2 semanas o más, pero no menores a 4 días.
Pacientes tratados con tabletas de liberación inmediata de venlafaxina pueden ser cambiados a las cápsulas de liberación prolongada de venlafaxina a una dosis equivalente cercana a la dosis diaria. Por ejemplo, la tabletas de liberación inmediata de venlafaxina de 37,5 mg administradas dos veces al día pueden ser cambiadas por cápsulas de liberación prolongada de venlafaxina 75 mg cada día. Ajustes individuales en la dosis pueden ser necesarios.
Trastorno depresivo mayor: La dosis de inicio recomendada para cápsulas de venlafaxina de liberación prolongada es de 75 mg administrada una vez al día. Los pacientes que no responden a la dosis inicial de 75 mg/día pueden beneficiarse de un aumento en la dosis hasta un máximo de 225 mg/día.4
Mientras que para pacientes moderadamente deprimidos, la dosis recomendada es hasta 225 mg/día para la venlafaxina de liberación inmediata, en un estudio los pacientes más severamente deprimidos respondieron a la dosis media de 350 mg/día (rango de 150 a 375 mg/día).
Trastorno de Ansiedad Generalizada (TAG): La dosis de inicio recomendada para cápsulas de venlafaxina de liberación prolongada es de 75 mg administrada una vez al día. Los pacientes que no responden a la dosis de inicio de 75 mg/día, se les puede beneficiar con un incremento en la dosis a un máximo de 225 mg/día.
Trastorno de Ansiedad Social (TAS): La dosis de inicio recomendada para cápsulas de venlafaxina de liberación prolongada es de 75 mg administrada una vez al día. No hay evidencia de que a dosis mayores se conceda algún beneficio adicional.
Trastorno de Pánico: La dosis recomendada para EFEXOR XR® es de 37,5 mg administrada una vez al día durante 7 días. La dosis luego debe ser incrementada a 75 mg/día. Los pacientes que no responden a la dosis de 75 mg/día pueden beneficiarse con un incremento en la dosis a un máximo de 225 mg/día.
Descontinuación de venlafaxina: Se recomienda la disminución escalonada de la dosis, de ser posible, cuando se descontinúa la terapia con venlafaxina (ver secciones Advertencias especiales y Efectos indeseables). En los estudios clínicos con las cápsulas de venlafaxina de liberación prolongada, la disminución gradual se pudo lograr al reducir la dosis diariamente en 75 mg/día, con intervalos de una semana. El periodo requerido para la disminución escalonada depende de la dosis, de la duración de la terapia y del paciente en forma individual.
Uso en pacientes con deterioro renal: La dosis diaria total de venlafaxina debería reducirse entre un 25% a un 50% para pacientes con deterioro renal con una tasa de filtración glomerular (TFG) de 10 a 70 mL/min.
La dosis diaria total de venlafaxina debería reducirse en un 50% en pacientes que se encuentran en hemodiálisis.
Debido a la variabilidad individual en la depuración, es deseable la individualización de dosis en estos pacientes.
Uso en pacientes con deterioro hepático: El total de la dosis de venlafaxina debería reducirse en un 50% en pacientes con deterioro hepático leve a moderado. Puede ser apropiado para algunos pacientes una reducción de más del 50%.
Debido a la variabilidad individual en la depuración, es deseable la individualización de dosis en estos pacientes.
Uso en Niños y Adolescentes: No hay suficiente experiencia del uso de venlafaxina con pacientes menores de 18 años (ver secciones Advertencias especiales y Efectos indeseables).
Uso en pacientes ancianos: No son necesarios los ajustes específicos de las dosis de venlafaxina basados en la edad del paciente.
SOBREDOSIS: En la experiencia postcomercialización, se ha informado que la sobredosis con venlafaxina se ha presentado predominantemente en combinación con alcohol y/u otras drogas. Los eventos más comúnmente reportados de sobredosis incluyen taquicardia, cambios en los niveles de conciencia (que van entre la somnolencia y el coma), midriasis, convulsiones y vómito. Otros eventos reportados incluyen cambios electrocardiográficos (p. ej.: Prolongación del intervalo QT, bloqueo de rama, prolongación del QRS), taquicardia ventricular, bradicardia, hipotensión, vértigo y muerte.
Estudios retrospectivos publicados reportan que la sobredosis de venlafaxina puede ser asociada con un incremento en el riesgo de un resultado fatal comparado al que se observa con los productos antidepresivos IRSS, pero es menor en comparación con los antidepresivos tricíclicos. Estudios epidemiológicos han mostrado que los pacientes tratados con venlafaxina tienen una más alta carga de factores de riesgo de suicidio que los pacientes tratados con IRSS. El alcance del hallazgo que el incremento en el riesgo de resultados fatales puede ser atribuido a la toxicidad de la venlafaxina en sobredosis opuesto a algunas características de los pacientes tratados con venlafaxina, no es claro. Las prescripciones de venlafaxina deben ser dadas para la cantidad más pequeña del medicamento, consistente con el buen manejo del paciente, para reducir el riesgo de sobredosis.
Tratamiento recomendado: Generalmente se recomiendan medidas de soporte generales y sintomáticas: El ritmo cardiaco y los signos vitales deben ser monitorizados.
Cuando haya un riesgo de broncoaspiración, la inducción de emesis no es recomendada.
El lavado gástrico puede estar indicado si es realizado inmediatamente después de la ingestión o en pacientes sintomáticos.
La administración de carbón activado puede también limitar la absorción de la droga.
La diuresis forzada, la diálisis, la hemoperfusión y la transfusión por intercambio es poco probable que sean de beneficio.
No se conocen antídotos específicos para la venlafaxina.