
DECAPEPTYL 3.75 MG, 11,25 MG , 22,5 MG
TRIPTORELINA
Polvo para suspensión inyectable
1 Ampolla, 3.75 mg
1 Ampolla, 11.25 mg
1 Ampolla, 22.5 mg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN:
Principio activo: Triptorelina Pamoato.
Concentración: 3.75 mg, 11.25 mg y 22.5 mg.
Forma farmacéutica: Polvo Liofilizado para reconstituir a suspensión inyectable.
Presentación comercial: Kit empaque(Caja 1 frasco ampolla)+jeringa+agua.
Categoría terapéutica: Agente antineoplasico.
INDICACIONES:
DECAPEPTYL® 3,75 mg: Tratamiento de cáncer de próstata en cualquier estadio de evolución, con o sin metástasis. Endometriosis y miomas uterinos, pubertad precoz.
DECAPEPTYL® 11,25 mg: Tratamiento de cáncer de próstata en cualquier estadio de evolución, con o sin metástasis.
DECAPEPTYL® 22,5 mg: Tratamiento de cáncer de próstata en cualquier estadio de evolución, con o sin metástasis, tratamiento de la pubertad precoz de origen central.
MECANISMO DE ACCIÓN: La triptorelina, un agonista de LH-RH, actúa como un potente inhibidor de la secreción de gonadotrofina cuando se la administra continuamente o en dosis terapéuticas. Los estudios de animales machos y de humanos de sexo masculino muestran que luego de la administración de la triptorelina existe un incremento inicial y temporal de la hormona luteinizante (LH), de la hormona folículo-estimulante (FSH), y la testosterona. Sin embargo, la administración crónica y continua de la triptorelina provoca una disminución de la secreción de LH y de FSH y la supresión de la generación de esteroides en los testículos y ovarios. En los hombres, se produce una reducción de los niveles de testosterona dentro del rango normal que generalmente ocurre luego de la castración quirúrgica, aproximadamente entre 2 y 4 semanas luego de la iniciación de la terapia. Esto causa atrofia accesoria de los órganos sexuales. Estos efectos son generalmente reversibles al discontinuar el producto medicinal. En los animales, la administración de la triptorelina ayudó a la inhibición del crecimiento de algunos tumores prostáticos sensibles a las hormonas en modelos experimentales.
CONTRAINDICACIONES Y ADVERTENCIAS: Está contraindicado en personas con hipersensibilidad a Triptorelina o algún otro componente del producto, obstrucción uretral y metástasis espinal. Embarazo y lactancia. El tratamiento con DECAPEPTYL® trimestral no está indicado en mujeres.
Triptorelina no se debe utilizar durante el embarazo ya que el uso concurrente de agonistas de la GnRH se asocia con un riesgo teórico de aborto o anomalías fetales. Antes del tratamiento, se debe examinar a las mujeres potencialmente fértiles para excluir un embarazo. Durante la terapia deben emplearse métodos anticonceptivos no hormonales hasta que se reanude la menstruación.
PRINCIPALES REACCIONES ADVERSAS: Dolor en el lugar de la inyección, reacción e inflamación en el lugar de la inyección; sofocación, dolor de espalda, dolor de piernas, fatiga, dolor de pecho, astenia, edema periférico, edema en las pierna, malestar, alergia sincope, dolor perineal; hipertensión, edema dependiente, isquemia del miocardio; reducción del tamaño de los genitales, dolor del pecho masculino, ginecomastia, mastitis masculinas; constipación, náuseas, diarrea, dolor abdominal, dispepsia, vómitos, retención urinaria, reflujo gastroesófagico ; distorsión de los sabores; función hepática anormal, hepatitis colestática; anemia, linfoadenopatia; embolia pulmonar; tromboflebitis aguda; incremento de la fosfatasa alcalina, gota; hiperglucemia, incremento del urea en sangre, diabetes melitus, incremento del nitrógeno noproteico, aumento de peso¸ dolores óseos, artralgia, mialgia, artrosis, debilidad muscular, fractura patológica, hipoestesia, compresión de la medula espinal; exacerbación tumoral; dolor de cabeza, mareos, calambres, parestesia, somnolencia, episodios epilépticos; insomnio, impotencia, anorexia, disminución de la libido, depresión, nerviosismo, amnesia, euforia; desórdenes prostáticos y testiculares; tos, disnea, faringitis, rinitis; picazón, alopecia, desórdenes cutáneos, eczema, prurito, erupción en forma de ampollas, incrementos del sudor, urticaria, reacciones de fotosensibilidad; dolor en los ojos, conjuntivitis, visión anormal, papiledema, defectos en el campo de la visión; zumbido; cistitis, retención urinaria, desórdenes en la uretra, incontinencia urinaria, micciones frecuentes, hematuria, infección en el tracto urinario, disfunción renal, dolor renal, micciones nocturnas frecuentes; dolor post-operatorio.
Tolerancia general en hombres: Dado que los pacientes que padecen cáncer de próstata hormono-dependiente, localmente avanzado o metastásico generalmente son hombres de edad avanzada y presentan otras enfermedades que con frecuencia están presentes en la población de esta edad, más del 90% de los pacientes incluidos en los ensayos clínicos notificaron reacciones adversas, y a menudo la causalidad es difícil de evaluar. Tal y como se observa con otras terapias con agonistas de la GnRH o después de la castración quirúrgica, las reacciones adversas relacionadas con el tratamiento con triptorelina observadas con mayor frecuencia eran consecuencia de los efectos farmacológicos esperados. Estos efectos incluían sofocos y disminución de la libido.
Con la excepción de las reacciones inmuno-alérgicas (raras) y las reacciones en el lugar de la inyección (<5%), todas las reacciones adversas se sabe que están relacionadas con los cambios en los niveles de testosterona.
Se comunicaron las siguientes reacciones adversas, consideradas al menos posiblemente relacionadas con el tratamiento con triptorelina. La mayoría de ellas estaban relacionadas con la castración bioquímica o quirúrgica.
La frecuencia de las reacciones adversas se clasifica de la siguiente forma: Muy frecuentes (≥1/10); frecuentes (≥1/100, <1/10); poco frecuentes (≥1/1000, <1/100); raras (≥1/10000, <1/1000).
|
Clasificación por sistema de órganos |
RAs Muy frecuentes |
RAs Frecuentes |
RAs Poco frecuentes |
RAs Raras |
RAs post- comercialización adicionales Frecuencia no conocida |
|
≥1/10 |
≥1/100 <1/10 |
≥1/1000 - <1/100 |
≥1/10.000 <1/1000 |
||
|
Trastornos de la sangre y del sistema linfático |
Trombositosis |
||||
|
Trastornos cardiacos |
Palpitaciones |
Prolongación del QT* |
|||
|
Trastornos del oído y del laberinto |
Tinnitus Vértigo |
||||
|
Trastornos oculares |
Alteración visual |
Sensación anormal en el ojo Trastorno visual |
|||
|
Trastornos gastrointestinales |
Sequedad de boca Náuseas |
Dolor abdominal Estreñimiento Diarrea Vómitos |
Distensión abdominal Disgeusia Flatulencia |
||
|
Trastornos generales y alteraciones en el lugar de la administración |
Astenia |
Reacciones en el lugar de la inyección (incluyendo eritema, inflamación y dolor). Edema |
Letargia Edema periferico Dolor Escalofrios Somnolencia |
Dolor en el tórax Distasia Enfermedad tipo gripe Pirexia |
Malestar |
|
Trastornos del sistema inmune |
Hipersensibilidad |
Reacción anafiláctica |
Shock anafilactico |
||
|
Infecciones e infestaciones |
Nasofaringitis |
||||
|
Exploraciones complementarias |
Aumento de peso |
Incremento de la alanino-aminotransferasa Incremento de la aspartato amino-transferasa Incremento de creatinina en sangre Aumento de la presión arterial Incremento de urea en sangre Incremento de la gamma-glutamil transferasa Disminución de peso |
Incremento de la fosfatasa alcalina sanguínea |
||
|
Trastornos del metabolismo y de la nutrición |
Anorexia diabetes mellitus Gota Hiperlipidemia Aumento del apetito |
||||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor de espalda |
Dolor musculoesquelético Dolor en las extremidades |
Artralgia Dolor óseo Calambres musculares Debilidad muscular Mialgia |
Rigidez de articulaciones Inflamación de articulaciones Rigidez musculoesquelética Osteoartritis |
|
|
Trastornos del sistema nervioso |
Parestesia en los miembros inferiores |
Mareos Cefalea |
Parestesia |
Alteración de la memoria |
|
|
Trastornos psiquiátricos |
Descenso de la libido |
Pérdida de libido Depresión* Cambios de humor* |
Insomnio Irritabilidad |
Confusión Descenso de la actividad Comportamiento eufórico |
Ansiedad |
|
Trastornos renales y urinarios |
Nocturia Retención urinaria |
Incontinencia urinaria |
|||
|
Trastornos del aparato reproductor y de la mama |
Disfunción eréctil (incluyendo fallo en la eyaculación, trastorno de eyaculación). |
Dolor pélvico |
Ginecomastia Dolor en el pecho Atrofia testicular Dolor testicular |
||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea Epistaxis |
Ortopnea |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Hiperhidrosis |
Acné Alopecia Eritema Prurito Erupción Urticaria |
Ampollas Púrpura |
Edema angioneurótico |
|
|
Trastornos vasculares |
Sofoco |
Hipertensión |
Hipotensión |
||
|
* Esta frecuencia se basa en las frecuencias del efecto de clase, común para todos los agonistas de la GnRH. |
|||||
INTERACCIONES: Cuando se administra un agonista de la GnRH en concomitancia con medicamentos que afectan la secreción de gonadotrofinas por la glándula pituitaria se debe precaución y se recomienda la supervisión del estado hormonal del paciente.
Existe un riesgo potencial de hematomas en el lugar donde se coloca la inyección en aquellos pacientes que se encuentren siendo tratados con anticoagulantes.
Incompatibilidad: En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
PRECAUCIONES: Inicialmente la triptorelina provoca un incremento temporal en los niveles de testosterona. Como consecuencia, pueden desarrollarse casos aislados de empeoramiento temporal o signos y síntomas de cáncer de próstata.
Un número reducido de pacientes pueden experimentar un incremento temporal de dolor óseo, lo cual puede manejarse en forma sintomática. Se han observados casos aislados de compresión de medula espinal u obstrucción de la uretra. Si se desarrollara una compresión en medula espinal o mal funcionamiento renal, se debe administrar el tratamiento estándar para estos casos, y en casos extremos se debe consideran una inmediata orquidectomía. Se aconseja un cuidadosos monitoreo durante las primeras semana de tratamiento, particularmente en pacientes que sufren de metástasis vertebral y/o de obstrucción de tracto urinario. Durante la fase inicial de tratamiento, se debe considerar la administración adicional de un antiandrógeno adecuado para contrarrestar los niveles de testosterona y el empeoramiento de los síntomas clínicos.
La efectividad del tratamiento puede monitorearse midiendo los niveles de testosterona y los antígenos específicos de la próstata.
Luego de la castración quirúrgica, la triptorelina no induce ninguna reducción mayor en los niveles de testosterona, es por eso que DECAPEPTYL® no debe utilizarse luego de la orquidectomía.
Se recomienda precaución en los pacientes tratados con anticoagulantes, debido al riesgo potencial de hematomas en la zona donde se coloca la inyección. Ha habido reportes de casos de depresión en pacientes tratados con DECAPEPTYL® que pueden ser severos. Los pacientes deben ser informados al respecto y tratados según corresponda si aparecen los síntomas correspondientes. Los pacientes con antecedentes de depresión deben ser monitoreados de cerca durante el tratamiento.
La administración de triptorelina en dosis terapéuticas provoca la supresión del sistema gonadal pituitario. Su función generalmente se normaliza luego de que el tratamiento es discontinuado. Los ensayos diagnósticos de la función gonadal pituitaria conducidos durante el tratamiento y luego de la descontinuación de la terapia con un agonista LH-RH, pueden llegar a desorientar en cuanto a los resultados.
Raramente, el tratamiento con agonistas de la GnRH puede revelar la presencia de un adenoma hipofisario de células gonadotrofas previamente desconocido. Estos pacientes pueden presentar una apoplejía hipofisaria caracterizada por cefalea repentina, vómitos, alteración visual y oftalmoplejía.
Adicionalmente, de los datos epidemiológicos, se ha observado que los pacientes pueden experimentar cambios metabólicos (p. ej., intolerancia a la glucosa), o un incremento del riesgo de padecer enfermedad cardiovascular durante la terapia de deprivación androgénica.
El uso de agonistas GnRH puede causar reducción de la densidad mineral ósea. Datos preliminares en hombres sugieren que el uso de bifosfonatos en combinación en combinación con agonistas de la Gnrh puede reducir la perdida mineral ósea. Se debe tener particular precaución en pacientes con factores de riesgo adicionales para osteoporosis (p. ej., Abuso crónico de alcohol, fumadores, tratamiento prolongado con medicación que reduce la densidad mineral, p. ej,: Anticonvulsivantes o corticoides, historia familiar de osteoporosis, desnutrición).
Hiperglucemia y diabetes: Se ha informado hiperglucemia y un mayor riesgo de manifestar diabetes e hombres que reciben agonistas de la GnRH. La hiperglucemia puede representar desarrollo de diabetes mellitus o empeoramiento del control glucémico en pacientes de diabetes. Controlar la glucosa y/o hemoglobina glicosilada (HbA1c) en sangre de forma periódica en pacientes que reciben un agonista de la GnRH y manejar con la práctica actual para el tratamiento de la hiperglucemia o la diabetes.
Enfermedades cardiovasculares: Se ha informado un mayor riesgo de desarrollar infarto de miocardio, muerte cardiaca súbita y ACV en relación con el uso de agonista de la GnRH en los hombres.
El riesgo parece bajo e base a porcentajes de incidencia informados, y debe evaluarse cuidadosamente junto con factores de riesgo cardiovascular al determinar un tratamiento para pacientes con cáncer de próstata. Los pacientes que reciben un agonista de la GnRH deben ser monitoreados para detectar la presencia de síntomas y signos que indiquen desarrollo de enfermedad cardiovascular y deben ser manejados según la práctica actual.
Existe un mayor riesgo de depresión (que puede ser grave) en pacientes sometidos a tratamiento con agonistas de la hormona liberadora de gonadotropinas (GnRH), como triptorelina. Los pacientes deben ser informados y recibir tratamiento si se presentan síntomas de depresión.
Pubertad precoz: El tratamiento de niños con tumores cerebrales progresivos debe ir precedido de una meticulosa valoración individual de los riesgos y beneficios. Se debe excluir la pubertad pseudo-precoz (tumor o hiperplasia gonadal o adrenal) y la pubertad precoz independiente de gonadotropinas (toxicosis testicular, hiperplasia de células de Leydig familiar).
En niñas, la estimulación ovárica inicial al comienzo del tratamiento, seguido de la retirada de estrógenos inducida por el tratamiento, puede provocar sangrado vaginal de intensidad leve o moderada, durante el primer mes. La terapia es un tratamiento a largo plazo, que se ajusta individualmente. DECAPEPTYL® trimestral se debe administrar de forma tan precisa como sea posible en periodos regulares de 3 meses.
Tras la interrupción del tratamiento se producirá el desarrollo característico de la pubertad. La densidad mineral ósea (DMO) puede disminuir durante la terapia con GnRH para la pubertad precoz central debido a los efectos esperados de la supresión estrogénica. No obstante, tras la interrupción de la terapia se mantiene una posterior acumulación de masa ósea, y el pico de masa ósea en la adolescencia tardía no parece estar afectado por el tratamiento.
Tras la retirada del tratamiento con GnRH puede observarse deslizamiento de la epífisis femoral capital. La teoría sugerida es que las bajas concentraciones de estrógenos durante el tratamiento con agonistas de la GnRH debilitan la placa epifisaria. El incremento en la velocidad de crecimiento tras la interrupción del tratamiento, posteriormente provoca una reducción de la fuerza de deslizamiento necesaria para el desplazamiento de la epífisis.
DOSIS:
DECAPEPTYL® 3,5 mg y 11,25 mg: En cáncer de próstata la posología habitual es una inyección intramuscular única de DECAPEPTYL® 3.75 mg 1 vez cada 4 semanas y de 11,25 mg una vez cada 12 semanas.
Los preparados DECAPEPTYL® 3.75 mg y 11,25 mg sólo deben ser utilizados por médicos o personal médico.
El sitio de inyección debe modificarse periódicamente.
En la endometriosis, la duración habitual del tratamiento es de 4-6 meses, es decir, 4-6 inyecciones de DECAPEPTYL® 3,75 mg.
Pubertad precoz: Por lo general, una inyección intramuscular profunda de DECAPEPTYL® 3.75 cada 4 semanas. A los pacientes de peso corporal inferior a los 20 kg se puede administrar la mitad de la dosis.
Modo de preparación:
a) De la ampolla que contiene agua estéril, aspirar 2 ml.
b) Mediante la jeringa y aguja (1) transferir al frasco que contiene el polvo liofilizado de DECAPEPTYL®.
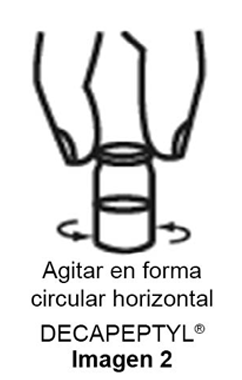
c) Agitar suavemente en forma circular-horizontal, evitando la formación de espuma para dispersar los microgránulos y formar una suspensión lechosa y homogénea.
d) Extraer la totalidad de la mezcla del frasco.
e) Desechar la aguja (1) y proceder a la inyección intramuscular inmediata utilizando la aguja (2).
f) Inyectar lentamente.
Estabilidad: La suspensión de triptorelina debe ser descartada si no es utilizada inmediatamente después de la preparación. El lugar donde se coloca la inyección debe variar periódicamente, ya que DECAPEPTYL® es una suspensión de microgránulos. Debe evitarse estrictamente una inyección intravascular accidental.
DECAPEPTYL® 22,5 mg:
Cáncer de próstata avanzado:
Dosis habitual para adultos: 22,5 mg, inyección intramuscular, cada 24 semanas.
Dosis geriátrica habitual: Ver dosis habitual para adultos.
Preparación y Forma de Aplicación de DECAPEPTYL® 22,5 mg:
Disponga del siguiente material para una correcta aplicación del DECAPEPTYL® intramuscular.
a) Frasco ampolla de DECAPEPTYL® 22,5 mg.
b) 1 jeringa estéril desechable de 5 ml con aguja 21 G (1).
e) 1 aguja estéril desechable 20 G (2).
d) 1 ampolla de agua estéril para inyección 2 ml.
Modo de preparación:
a) De la ampolla que contiene agua estéril, aspirar 2 ml con la jeringa estéril desechable de 5 ml con aguja 21 G (1).
b) Retirar la tapa del frasco ampolla que contiene el polvo liofilizado de DECAPEPTYL® y adicionar el agua estéril para inyección sobre las paredes internas del vidrio como se muestra en la imagen 1, a fin de evitar la formación de espuma.
c) Agitar suavemente en forma circular horizontal como se muestra en la imagen 2, hasta obtener una suspensión homogénea lechosa.
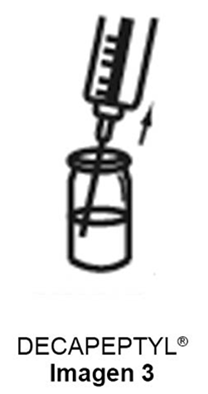
d) Extraer la totalidad de la suspensión obtenida sin invertir el frasco ampolla como se muestra en la imagen 3.
e) Desechar la aguja ( 1) y acoplar la aguja 20 G (2) para proceder a la administración del medicamento al paciente.

VÍA DE ADMINISTRACIÓN: Intramuscular.
SOBREDOSIS: Las propiedades farmacéuticas de DECAPEPTYL® trimestral y su modo de administración hacen improbable la sobredosis accidental o intencionada. No hay experiencia con sobredosis en seres humanos. El estudio en animales indica que con dosis superiores de DECAPEPTYL® semestral no hay otros efectos evidentes, aparte de los efectos terapéuticos previstos en la concentración de hormonas sexuales y en el aparato reproductor. Si se produce sobredosis, está indicado el tratamiento sintomático.
PRESENTACIÓN:
DECAPEPTYL® 3,75 mg: 1 frasco ampolla con microgránulos liofilizados inyectable IM de 3,75 mg de triptorelina de liberación controlada, 1 ampolla de solvente, 1 jeringa estéril vacía de 5 ml, 1 aguja estéril 21G y 1 aguja estéril 20G. (Reg. San. INVIMA 2016M-003326-R2).
DECAPEPTYL® 11,25 mg: 1 frasco ampolla con microgránulos liofilizados inyectable IM de 11,25 mg de triptorelina de liberación controlada, 1 ampolla de solvente, 1 jeringa estéril vacía de 5 ml, 1 aguja estéril 21G y 1 aguja estéril 20G. (Reg. San. INVIMA 2015 M-0004541-R1).
DECAPEPTYL® 22,5 mg: 1 frasco ampolla con microgránulos de liberación controlada para reconstituir a suspensión inyectable IM de 22,5 mg, 1 jeringa estéril desechable de 5 ml con aguja 21G, 1 aguja estéril desechable 20G, 1 ampolla con agua estéril para inyección 2 ml. (Reg. San. INVIMA 2014M-0014927).
MANTENER FUERA DEL ALCANCE DE LOS NIÑOS.
Elaborado por: DEBIOPHARM RESEARCH & MANUFACTURING S.A. Rue Du Levant 146, CH-1920 Martigny, Suiza.
Acondicionado por: ADIUM PHARMA S.A. Ruta 8, Km 1500 Zonamerica, Montevideo, Uruguay.
Distribuido por:
ADIUM S.A.S
Para mayor información por favor comunicarse a
Carrera 16 No. 85 -96 - Bogotá, D.C. - Teléfono: PBX 601-6460505
página web: www.adium.com.co
CONSERVACIÓN Y ALMACENAMIENTO:
Estabilidad: El medicamento no debe usarse después de la fecha de vencimiento que se indica en el envase.
Suspensión tras la reconstitución: Por motivos microbiológicos, la suspensión debe inyectarse inmediatamente tras su reconstitución.
Manipulación: La preparación de la suspensión inyectable debe realizarse inmediatamente antes de la inyección.
Conservación: Almacenar a temperatura menor a 30 °C en su envase y empaque original. Después de reconstituido, administrarse inmediatamente.