
DARZALEX™
DARATUMUMAB
Vial
Vial(es), Solución para infusión, 5, 20 Mililitros
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
INSTRUCCIONES DE USO Y MANIPULACIÓN Y ELIMINACIÓN: Preparar la solución para la infusión usando técnica aséptica como la que se explica a continuación:
• Calcular la dosis (mg), el volumen total (mL) de la solución de DARZALEX™ requerida y el número de viales de DARZALEX™ necesarios basado en el peso del paciente.
• Verificar que la solución de DARZALEX™ sea de incolora a amarilla. No usar si están presentes partículas opacas, decoloración u otras partículas extrañas.
• Usando una técnica aséptica, retirar un volumen de cloruro de sodio al 0.9% de la bolsa/envase de infusión que sea igual al volumen requerido de la solución de DARZALEX™.
• Extraer la cantidad necesaria de la solución de DARZALEX™ y diluir hasta el volumen apropiado añadiéndola a una bolsa/envase de infusión que contenga cloruro de sodio al 0.9% (ver sección Dosificación y administración). Las bolsas/envases de la infusión deben estar hechos de polivinilcloruro (PVC), polipropileno (PP), polietileno (PE) o una mezcla de poliolefina (PP+PE). Diluir bajo las condiciones asépticas apropiadas. Desechar cualquier porción no usada que quede en el vial.
• Invertir cuidadosamente la bolsa/envase para mezclar la solución. No agitar ni congelar.
• Los medicamentos parenterales deben ser visualmente inspeccionados por partículas extrañas y decoloración antes de la administración, siempre que la solución y el envase lo permitan. La solución diluida puede desarrollar partículas proteináceas muy pequeñas, de translúcidas a blancas, debido a que daratumumab es una proteína. No usar si se observan visualmente partículas opacas, decoloración o partículas extrañas.
• Debido a que DARZALEX™ no contienen un preservante, las soluciones diluidas deben ser administradas dentro de 15 horas (incluyendo el tiempo de infusión) a temperatura ambiente 15 °C-25 °C (59 °F-77 °F) y con luz ambiente.
• Si no se usa inmediatamente, la solución diluida puede ser almacenada antes de la administración hasta por 24 horas en condiciones de refrigeración a 2 °C – 8 °C (36 °F-46 °F) y protegido de la luz. No congelar.
• Administrar la solución diluida mediante infusión intravenosa usando un equipo de infusión equipado con un regulador de flujo y con un filtro equipado, estéril, apirógeno de poliétersulfona (PES) de baja unión a proteínas (tamaño de poro 0.22 o 0.2 micrómetro). Deben usarse equipos de administración de poliuretano (PU), polibutadieno (PBD), PVC, PP o PE.
• No infundir DARZALEX™ concomitantemente en la misma línea intravenosa con otros agentes.
• No guarde ninguna porción sin usar de la solución de la infusión para su reutilización. Cualquier producto sin usar o material de desecho debe ser desechado de acuerdo con los requerimientos locales.
INDICACIONES: DARZALEX™ está indicado: En monoterapia para el tratamiento de pacientes adultos con mieloma múltiple en recaída y refractario al tratamiento, que hayan recibido previamente un inhibidor del proteasoma y un agente inmunomodulador y que hayan presentado progresión de la enfermedad en el último tratamiento.
En combinación con lenalidomida y dexametasona, o bortezomib y dexametasona, para el tratamiento de pacientes adultos con mieloma múltiple que han recibido al menos un tratamiento previo.”
PROPIEDADES FARMACOCINÉTICAS: La farmacocinética (PK) de daratumumab después de la administración intravenosa de DARZALEX™ en monoterapia fue evaluada en los pacientes con mieloma múltiple recidivante y refractario en niveles de dosis de 0.1 mg/kg a 24 mg/kg. Se desarrolló un modelo PK poblacional de daratumumab para describir las características PK de daratumumab y para evaluar la influencia de las covariables en la disposición de daratumumab en pacientes con mieloma múltiple. El análisis PK poblacional incluyó a 223 pacientes que recibieron DARZALEX™ en monoterapia en dos estudios clínicos (150 sujetos recibieron 16 mg/kg).
En las cohortes de 1 a 24 mg/kg, las concentraciones séricas máximas (Cmáx) después de la primera dosis se incrementaron en una proporción aproximada a la dosis y el volumen de distribución fue consistente con la distribución inicial en el compartimiento plasmático. Los incrementos en el AUC fueron más que proporcionales a la dosis y el aclaramiento (CL) disminuyó con el incremento de la dosis. Estas observaciones sugieren que CD38 puede saturarse a dosis más altas, después de lo cual el impacto del aclaramiento de la unión a la diana es minimizado y el aclaramiento de daratumumab se aproxima al aclaramiento lineal de la IgG1 endógena. El aclaramiento también disminuyó con múltiples dosis, lo cual puede estar relacionado con las disminuciones de la carga tumoral.
La vida media terminal se incrementa con el incremento de la dosis y con la dosificación repetida. La vida media terminal estimada promedio (desviación estándar [DE]) de daratumumab después de la primera dosis de 16 mg/kg fue 9 (4.3) días. Basado en el análisis PK poblacional, la vida media (DE) promedio asociada con la eliminación lineal no específica fue de aproximadamente 18 (9) días; esta es la vida media terminal que puede esperarse con la saturación completa del aclaramiento mediado por la diana y la dosificación repetida de daratumumab.
Al final de la dosificación semanal para el esquema de monoterapia recomendada y la dosis de 16 mg/kg, el valor sérico promedio (DE) de la Cmáx fue 915 (410.3) microgramos/mL, aproximadamente 2.9 veces mayor que después de la primera infusión. La concentración sérica promedio (DE) previa a la dosis (mínima) al final de la dosificación semanal fue 573 (331.5) microgramos/mL.
Basado en el análisis PK poblacional de DARZALEX™ en monoterapia, el estado estacionario de daratumumab se alcanza aproximadamente a los 5 meses del periodo de dosificación de cada 4 semanas (para la 21ª infusión), y la proporción media (DE) de Cmáx en el estado estacionario a Cmáx después de la primera dosis fue 1.6 (0.5). El volumen central promedio (DE) de distribución es 56.98 (18.07) mL/kg.
Se realizó un análisis adicional de la PK poblacional en pacientes con mieloma múltiple que recibieron daratumumab en diferentes terapias en combinación a partir de cuatro estudios clínicos (694 pacientes, de los cuales 684 recibieron daratumumab a 16 mg/kg). Los perfiles de concentración de daratumumab vs tiempo fueron similares después de la monoterapia y las terapias de combinación. La vida media terminal estimada promedio (DE) asociada con el aclaramiento lineal en terapia de combinación fue aproximadamente 23 (12) días.
Basado en el análisis PK poblacional se identificó el peso corporal como una covariable estadísticamente significativa para el aclaramiento de daratumumab. Por lo tanto, la dosificación basada en el peso corporal es una estrategia apropiada de dosificación para los pacientes con mieloma múltiple.
PROPIEDADES FARMACODINÁMICAS: Grupo farmacoterapéutico: Agentes antineoplásicos, anticuerpos monoclonales, código ATC: L01XC24.
Mecanismo de acción: Daratumumab es un anticuerpo monoclonal humano de la IgG1κ (mAb) que se une a la proteína CD38 expresada en un alto nivel en la superficie de las células en una variedad de neoplasias malignas hematológicas, incluyendo células tumorales de mieloma múltiple, así como otros tipos de células y tejidos en varios niveles. La proteína CD38 tiene múltiples funciones tales como adhesión mediada por el receptor, señalización y actividad enzimática.
Se ha demostrado que daratumumab inhibe potentemente el crecimiento in vivo de las células tumorales que expresan CD38. Basado en los estudios in vitro, daratumumab puede utilizar múltiples funciones efectoras, produciendo la muerte de las células tumorales mediada inmunológicamente. Estos estudios sugieren que daratumumab puede inducir la lisis de las células tumorales a través de la citotoxicidad dependiente del complemento (CDC), la citotoxicidad mediada por las células dependientes de los anticuerpos (ADCC) y la fagocitosis celular dependiente del anticuerpo (ADCP) en neoplasias malignas que expresan a CD38. Un subgrupo de células supresoras derivadas de mieloide (CD38+MDSCs), células T reguladoras (CD38+Tregs) y células B reguladoras (CD38+Bregs) son disminuidas por daratumumab. También se conoce que las células T (CD3+, CD4+ y CD8+) expresan la CD38 dependiendo de la fase de desarrollo y el nivel de activación. Se han observado incrementos significativos en el recuento absoluto de las células CD4+ y CD8+ y en los porcentajes de los linfocitos con el tratamiento con DARZALEX™ en sangre entera periférica y médula ósea. Se verificó por secuenciación de ADN de los receptores de células T que la clonalidad de las células T se incrementaron con el tratamiento con DARZALEX™, indicando efectos modulatorios inmunológicos que pueden contribuir a la respuesta clínica.
Daratumumab indujo apoptosis in vitro después del entrecruzamiento mediada por Fc. Además, daratumumab moduló la actividad de la enzima del CD38, inhibiendo la actividad de la enzima ciclasa y estimulando la actividad de la hidrolasa. La significación de estos efectos in vitro en un ambiente clínico, y las implicaciones en el crecimiento tumoral, no son comprendidas adecuadamente.
INFORMACIÓN FARMACÉUTICA:
Lista de Excipientes:
• Ácido acético glacial.
• Manitol.
• Polisorbato 20.
• Acetato de sodio trihidratado.
• Cloruro de sodio.
• Agua para inyección.
CONTRAINDICACIONES: Hipersensibilidad al principio activo o a alguno de los excipientes.
EMBARAZO, LACTANCIA Y FERTILIDAD:
Embarazo: No existen datos en humanos o animales para evaluar el riesgo del uso de DARZALEX™ durante el embarazo. Los anticuerpos monoclonales de la IgG1 son conocidos por cruzar la placenta después del primer trimestre del embarazo. Por lo tanto, no debe usarse DARZALEX™ durante el embarazo a menos que se considere que el beneficio del tratamiento para la mujer sopese los riesgos potenciales para el feto. Si la paciente queda embarazada mientras está tomando este fármaco, se debe informar a la paciente del riesgo potencial para el feto.
Para evitar la exposición al feto, las mujeres con potencial reproductivo deben usar anticonceptivos efectivos durante y por 3 meses después de la culminación del tratamiento con DARZALEX™.
Lactancia: Se desconoce si daratumumab es excretado en la leche humana o animal o si afecta la producción de la leche. No existen estudios para evaluar el efecto de daratumumab en el infante lactante.
El IgG materno es excretado en la leche humana, pero no ingresa a las circulaciones neonatales y de los infantes en cantidades sustanciales ya que estos son degradados en el tracto gastrointestinal y no son absorbidos. Debido a que los riesgos de DARZALEX™ para el infante a partir de la ingestión oral son desconocidos, se debe tomar una decisión de discontinuar la lactancia, o discontinuar la terapia con DARZALEX™, tomando en cuenta el beneficio de la lactancia para el niño y el beneficio de la terapia para la mujer.
Fertilidad: No existen datos disponibles para determinar los efectos potenciales de daratumumab en la fertilidad masculina o femenina.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y USAR MÁQUINAS: DARZALEX™ tiene influencia nula o insignificante sobre la capacidad para conducir y usar máquinas. Sin embargo, se ha reportado fatiga en pacientes que toman daratumumab y esto se debe considerar al conducir o utilizar máquinas.
EFECTOS FARMACODINÁMICOS: Recuento de células asesinas naturales (NK) y de células T: Las células NK son conocidas por expresar altos niveles de CD38 y son susceptibles a la lisis celular mediada por daratumumab. Se observaron disminuciones en el recuento absoluto y los porcentajes de las células NK totales (CD16+CD56+) y células NK activadas (CD16+CD56dim) en la sangre total periférica y la médula ósea con el tratamiento con DARZALEX™. Sin embargo, los niveles basales de las células NK no mostraron una asociación con la respuesta clínica.
Inmunogenicidad: Se evaluaron en pacientes tratados con daratumumab en monoterapia (n=199) y en terapia en combinación (n=299) las respuestas de los anticuerpos antiterapéuticos (ATA) a daratumumab en múltiples puntos temporales durante el tratamiento y hasta 8 semanas después del final del tratamiento. Después del inicio del tratamiento con DARZALEX™, ninguno de los pacientes con monoterapia y 2 (0.7%) de los pacientes con terapia en combinación dieron resultado positivo para los anticuerpos anti-daratumumab; 1 de los pacientes con terapia en combinación desarrolló anticuerpos neutralizantes contra daratumumab.
Los datos de inmunogenicidad dependen en gran medida de la sensibilidad y la especificidad de los métodos de pruebas usados. Adicionalmente, la incidencia observada de un resultado positivo en un método de prueba puede estar influenciada por varios factores, incluyendo el manejo de la muestra, el tiempo de recolección de la muestra, la interferencia del fármaco, los medicamentos concomitantes y la enfermedad subyacente. Por lo tanto, la comparación de la incidencia de los anticuerpos a daratumumab con la incidencia de los anticuerpos a otros productos puede ser confusa.
REACCIONES ADVERSAS: A lo largo de esta sección, se presentan las reacciones adversas. Las reacciones adversas son eventos adversos que fueron considerados estar asociados razonablemente con el uso de daratumumab basado en la evaluación integral de la información disponible del evento adverso. Una relación causal con daratumumab no puede ser establecida de manera confiable en casos individuales. Además, debido a que los estudios clínicos son conducidos bajo condiciones ampliamente variables, las tasas de la reacción adversa observadas en los estudios clínicos de un fármaco no pueden ser comparadas directamente con las tasas en los estudios clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Los datos de seguridad descritos a continuación reflejan la exposición a DARZALEX™ (16 mg/kg) en 820 pacientes con mieloma múltiple, incluyendo 526 pacientes de dos estudios de Fase 3 controlados con activo que recibieron DARZALEX™ en combinación con lenalidomida (DRd, n=283; Estudio MMY3003) o bortezomib (DVd, n=243; Estudio MMY3004) y cinco estudios clínicos abiertos en los que los pacientes recibieron DARZALEX™ en combinación con pomalidomida (DPd, n=103; Estudio MMY1001) en combinación con lenalidomida (n=35), o como monoterapia (n=156).
Tratamiento combinado con lenalidomida: Las reacciones adversas descritas en la Tabla 4 reflejan la exposición a DARZALEX™ (grupo DRd) para una mediana de la duración del tratamiento de 13.1 meses (intervalo: 0 a 20.7 meses) y una mediana de la duración del tratamiento de 12.3 meses (intervalo: 0.2 a 20.1 meses) para el grupo de lenalidomida (Rd) en el Estudio 3. Las reacciones adversas más frecuentes fueron reacciones a la infusión, diarrea, náusea, fatiga, pirexia, infección de las vías respiratorias superiores, espasmos musculares, tos y disnea. Las reacciones adversas graves fueron neumonía, infección de las vías respiratorias superiores, influenza y pirexia. Las reacciones adversas produjeron la discontinuación del 7% (n=19) de los pacientes en el grupo DRd frente al 8% (n=22) en el grupo Rd.
|
Tabla 3. Reacciones adversas reportadas en el estudio MMY3003 |
||||||
|
Clase de órgano/Sistema Reacción adversa |
DRd (N=283) |
Rd (N=281) |
||||
|
Cualquier Grado (%) |
Grado 3 (%) |
Grado 4 (%) |
Cualquier Grado (%) |
Grado 3 (%) |
Grado 4 (%) |
|
|
Reacciones a la infusióna |
48 |
5 |
0 |
0 |
0 |
0 |
|
Trastornos gastrointestinales |
||||||
|
Diarrea |
43 |
5 |
0 |
25 |
3 |
0 |
|
Náusea |
24 |
1 |
0 |
14 |
0 |
0 |
|
Vómito |
17 |
1 |
0 |
5 |
1 |
0 |
|
Trastornos generales y condiciones en el sitio de la administración |
||||||
|
Fatiga |
35 |
6 |
< 1 |
28 |
2 |
0 |
|
Pirexia |
20 |
2 |
0 |
11 |
1 |
0 |
|
Infecciones e infestaciones |
||||||
|
Influenza |
7 |
3 |
0 |
5 |
1 |
0 |
|
Neumoníab |
19 |
10 |
2 |
15 |
7 |
2 |
|
Infección de las vías respiratorias superioresb |
65 |
6 |
< 1 |
51 |
4 |
0 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
||||||
|
Espasmos musculares |
26 |
1 |
0 |
19 |
2 |
0 |
|
Trastornos del sistema nervioso |
||||||
|
Dolor de cabeza |
13 |
0 |
0 |
7 |
0 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos |
||||||
|
Tosb |
30 |
0 |
0 |
15 |
0 |
0 |
|
Disnea |
21 |
3 |
< 1 |
12 |
1 |
0 |
|
Clave: D=daratumumab, Rd=lenalidomida-dexametasona. a La reacción a la infusión incluye términos determinados por los investigadores para relacionarse con la infusión, ver la descripción de las Reacciones a la Infusión a continuación. b Indica el agrupamiento de los términos preferidos. Nota: Se describen las reacciones adversas que ocurrieron en ≥ 10% de los pacientes y por lo menos con una frecuencia mayor al 5% en el grupo DRd. Adicionalmente, se describen los eventos adversos graves si se presentaron por lo menos con una incidencia mayor al 2% en el grupo DRd en comparación con el grupo Rd. Las toxicidades relacionadas con análisis de laboratorio hematológico fueron excluidas y se reportaron por separado en la Tabla 5. Las anormalidades de los análisis de laboratorio que empeoraron durante el tratamiento a partir de la línea de base se describen en la Tabla 5. |
||||||
|
Tabla 4. Anormalidades en los análisis de laboratorio hematológicos emergentes por el tratamiento |
||||||
|
Estudio MMY3003 |
||||||
|
DRd (N=283) % |
Rd (N=281) % |
|||||
|
Cualquier Grado |
Grado 3 |
Grado 4 |
Cualquier Grado |
Grado 3 |
Grado 4 |
|
|
Anemia |
52 |
13 |
0 |
57 |
19 |
0 |
|
Trombocitopenia |
73 |
7 |
6 |
67 |
10 |
5 |
|
Neutropenia |
92 |
36 |
17 |
87 |
32 |
8 |
|
Linfopenia |
95 |
42 |
10 |
87 |
32 |
6 |
|
Clave: D=Daratumumab, Rd=lenalidomida-dexametasona. |
||||||
Tratamiento en combinación con bortezomib: Las reacciones adversas descritas en la Tabla 6 reflejan la exposición de DARZALEX™ (grupo DVd) para una mediana de la duración del tratamiento de 6.5 meses (intervalo: 0 a 14.8 meses) y una mediana de duración del tratamiento de 5.2 meses (intervalo: 0.2 a 8.0 meses) para el grupo de bortezomib (Vd) en el Estudio MMY3004. Las reacciones adversas más frecuentes (>20%) fueron reacciones a la infusión, diarrea, edema periférico, infección de las vías respiratorias superiores, neuropatía sensorial periférica, tos y disnea. Las reacciones adversas graves incluyeron diarrea, infección de las vías respiratorias superiores y fibrilación atrial. Las reacciones adversas produjeron la discontinuación del 7% (n=18) de los pacientes en el grupo DVd frente al 9% (n=22) en el grupo Vd.
|
Tabla 5. Reacciones adversas reportadas en el Estudio MMY3004 |
||||||
|
Clase de Órgano/Sistema Reacción adversa |
DVd (N=243) |
Vd (N=237) |
||||
|
Cualquier Grado (%) |
Grado 3 (%) |
Grado 4 (%) |
Cualquier Grado (%) |
Grado 3 (%) |
Grado 4 (%) |
|
|
Reacciones a la infusióna |
45 |
9 |
0 |
0 |
0 |
0 |
|
Trastornos cardiacos |
||||||
|
Fibrilación atrial |
5 |
1 |
1 |
2 |
1 |
0 |
|
Trastornos gastrointestinales |
||||||
|
Diarrea |
32 |
3 |
< 1 |
22 |
1 |
0 |
|
Vómito |
11 |
0 |
0 |
4 |
0 |
0 |
|
Trastornos generales y condiciones en el sitio de la administración |
||||||
|
Edema periféricob |
22 |
1 |
0 |
13 |
0 |
0 |
|
Pirexia |
16 |
1 |
0 |
11 |
1 |
0 |
|
Infecciones e infestaciones |
||||||
|
Infección de vías respiratorias superioresb |
44 |
6 |
0 |
30 |
3 |
< 1 |
|
Trastornos del sistema nervioso |
||||||
|
Neuropatía sensorial periférica |
47 |
5 |
0 |
38 |
6 |
< 1 |
|
Trastornos respiratorios, torácicos y mediastínicos |
||||||
|
Tosb |
27 |
0 |
0 |
14 |
0 |
0 |
|
Disneab |
21 |
4 |
0 |
11 |
1 |
0 |
|
Clave: D=daratumumab, Vd=bortezomib-dexametasona. a La reacción a la infusión incluye términos determinados por los investigadores relacionados con la infusión; ver la descripción de las reacciones a la infusión a continuación. b Indica el agrupamiento de términos preferidos. Nota: Se describen las reacciones adversas que ocurrieron en ≥ 10% de los pacientes y por lo menos con una frecuencia mayor al 5% en el grupo DVd. Adicionalmente, se describen los eventos adversos graves si se presentaron por lo menos con una incidencia mayor al 2% en el grupo DVd en comparación con el grupo Rd. Las toxicidades relacionadas con análisis de laboratorio hematológico fueron excluidas y se reportaron por separado en la Tabla 7. |
||||||
Las anormalidades de los análisis de laboratorio que empeoraron durante el tratamiento se describen en la Tabla 7.
|
Tabla 7. Anormalidades en los análisis de laboratorio hematológicos emergentes por el tratamiento |
||||||
|
Estudio MMY3004 |
||||||
|
DVd (N=243) % |
Vd (N=237) % |
|||||
|
Cualquier Grado |
Grado 3 |
Grado 4 |
Cualquier Grado |
Grado 3 |
Grado 4 |
|
|
Anemia |
48 |
13 |
0 |
56 |
14 |
0 |
|
Trombocitopenia |
90 |
28 |
19 |
85 |
22 |
13 |
|
Neutropenia |
58 |
12 |
3 |
40 |
5 |
<1 |
|
Linfopenia |
89 |
41 |
7 |
81 |
24 |
3 |
|
Clave: D=Daratumumab, Vd=bortezomib-dexametasona. |
||||||
Tratamiento combinado con pomalidomida: Las reacciones adversas descritas en la Tabla 8 reflejan la exposición a DARZALEX™ y pomalidomida (DPd) para una mediana de duración del tratamiento de 6 meses (intervalo: 0.03 a 16.9 meses) en el Estudio MMY1001. Las reacciones adversas produjeron la discontinuación del 13% de los pacientes.
|
Tabla 6. Reacciones adversas reportadas en el Estudio MMY1001 |
|||
|
Clase de Órgano/Sistema Reacción Adversa |
Estudio MMY1001 |
||
|
DPd (N=103) |
|||
|
Cualquier Grado (%) |
Grado 3 (%) |
Grado 4 (%) |
|
|
Reacciones a la infusióna |
50 |
4 |
0 |
|
Trastornos cardiacos |
|||
|
Fibrilación atrial |
7 |
1 |
0 |
|
Trastornos gastrointestinales |
|||
|
Diarrea |
38 |
3 |
0 |
|
Náusea |
30 |
0 |
0 |
|
Vómito |
21 |
2 |
0 |
|
Trastornos generales y condiciones en el sitio de la administración |
|||
|
Fatiga |
50 |
10 |
0 |
|
Edema periféricob |
17 |
4 |
0 |
|
Pirexia |
25 |
1 |
0 |
|
Infecciones e infestaciones |
|||
|
Influenza |
5 |
3 |
0 |
|
Neumoníab |
15 |
8 |
2 |
|
Infección de las vías respiratorias superioresb |
50 |
4 |
1 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|||
|
Espasmos musculares |
26 |
1 |
0 |
|
Trastornos del sistema nervioso |
|||
|
Dolor de cabeza |
17 |
0 |
0 |
|
Neuropatía sensorial periférica |
8 |
2 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos |
|||
|
Tosb |
43 |
1 |
0 |
|
Disneab |
33 |
6 |
1 |
|
Clave: D=Daratumumab, Pd=pomalidomida-dexametasona a Las reacciones a la infusión incluyen términos determinados por los investigadores relacionados con la infusión; ver la descripción de las Reacciones a la Infusión a continuación. b Indica un agrupamiento de los términos preferidos. Las toxicidades relacionadas con análisis de laboratorio hematológico fueron excluidas y se reportaron por separado en la Tabla 9. |
|||
Las anormalidades de los análisis de laboratorio que empeoraron durante el tratamiento se describen en la Tabla 9.
|
Tabla 9. Anormalidades en los análisis de laboratorio hematológicos emergentes por el tratamiento (Estudio MMY1001) |
|||
|
DPd (N=103) |
|||
|
Cualquier Grado (%) |
Grado 3 (%) |
Grado 4 (%) |
|
|
Anemia |
57 |
30 |
0 |
|
Trombocitopenia |
75 |
10 |
10 |
|
Neutropenia |
95 |
36 |
46 |
|
Linfopenia |
94 |
45 |
26 |
|
Clave: D=Daratumumab, Pd=pomalidomida-dexametasona. |
|||
Monoterapia: Los datos descritos a continuación reflejan la exposición a DARZALEX™ en tres estudios clínicos abiertos agrupados que incluyeron 156 pacientes con mieloma múltiple recidivante y refractario tratados con DARZALEX™ a 16 mg/kg. La mediana de la duración del tratamiento con DARZALEX™ fue de 3.3 meses, siendo la duración máxima del tratamiento de 14.2 meses
Las reacciones adversas que ocurrieron a una tasa de ≥ 10% se presentan en la Tabla 10. Las reacciones adversas reportadas con mayor frecuencia (≥ 20%) fueron RRIs, fatiga, náusea, dolor de espalda, anemia, neutropenia y trombocitopenia. Cuatro por ciento de los pacientes discontinuó el tratamiento con DARZALEX™ debido a las reacciones adversas, ninguna de las cuales fue considerado relacionada con el fármaco.
Las frecuencias son definidas como muy común (≥ 1/10), común (≥ 1/100 a < 1/10), poco común (≥ 1/1000 a < 1/100), rara (≥ 1/10000 a < 1/1000) y muy rara (< 1/10000).
|
Tabla 10. Reacciones adversas en pacientes con mieloma múltiple tratados con 16 mg/kg de DARZALEX™ |
||||
|
Clase de Órgano/Sistema |
Reacción Adversa |
Frecuencia (todos los Grados) |
Incidencia (%) |
|
|
Todos los Grados |
Grado 3-4 |
|||
|
Infecciones e infestaciones |
Infección de las vías respiratorias superiores |
Muy Común |
17 |
1* |
|
Nasofaringitis |
12 |
0 |
||
|
Neumonía ** |
10 |
6* |
||
|
Trastornos de la sangre y del sistema linfático |
Anemia |
Muy Común |
25 |
17* |
|
Neutropenia |
22 |
12 |
||
|
Trombocitopenia |
20 |
14 |
||
|
Trastornos metabólicos y de la nutrición |
Disminución del apetito |
Muy Común |
15 |
1* |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
Muy Común |
14 |
0 |
|
Trastornos gastrointestinales |
Náuseas |
Muy Común |
21 |
0 |
|
Diarrea |
15 |
0 |
||
|
Estreñimiento |
14 |
0 |
||
|
Trastornos musculo- esqueléticos y del tejido conectivo |
Dolor de espalda |
Muy Común |
20 |
2* |
|
Artralgia |
16 |
0 |
||
|
Dolor en la extremidad |
15 |
1* |
||
|
Dolor de pecho musculo- esquelético |
10 |
1* |
||
|
Trastornos generales y condiciones en el sitio de la administración |
Fatiga |
Muy Común |
37 |
2* |
|
Pirexia |
17 |
1* |
||
|
Lesión, intoxicación y complicaciones del procedimiento |
Reacción relacionada con la infusión *** |
Muy Común |
51 |
4* |
|
* Sin Grado 4. ** Neumonía también incluye los términos neumonía estreptocócica y neumonía lobar. *** Las reacciones relacionadas con la infusión incluyen, pero no están limitadas a los siguientes términos de reacciones adversas múltiples: congestión nasal, tos, escalofríos, rinitis alérgica, irritación de garganta, disnea, náusea (todas ≥ 5%), broncoespasmo (2.6%), hipertensión (1.9%) e hipoxia (1.3%). |
||||
Reacciones relacionadas con la infusión: En estudios clínicos (monoterapia y tratamientos combinados; N=820) la incidencia de las reacciones relacionadas con la infusión de cualquier grado fue de 46% con la primera infusión de DARZALEX™, de 2% con la segunda infusión y de 3% con las infusiones subsecuentes. Menos de 1% de los pacientes presentaron una reacción a la infusión grado 3 con la segunda o con infusiones subsecuentes.
La mediana del tiempo para el comienzo de una reacción fue 1.4 horas (rango: 0.02 a 72.8 horas). La incidencia de interrupciones de la infusión debidas a reacciones fue de 42%. La mediana de la duración de la infusión para la 1ra, 2da e infusiones subsecuentes fue 7, 4.3 y 3.5 horas respectivamente.
Las reacciones graves relacionadas a la infusión (grado 3) incluyeron broncoespasmo, disnea, edema laríngeo, edema pulmonar, hipoxia e hipertensión. Otras reacciones adversas relacionadas con la infusión (cualquier grado, ≥5%) incluyeron congestión nasal, tos, escalofrío, irritación en garganta, vómito y náusea.
Infecciones: Si los pacientes en terapia combinada con DARZALEX™, se reportaron infecciones grado 3 o 4 con combinaciones con DARZALEX™ y terapias base (DVd: 21%, Vd: 19%, DRd: 27%, Rd: 23%, DPd: 28%). La neumonía fue la infección grave (grado 3 o 4) más comúnmente reportada de los estudios. Se reportó la descontinuación del tratamiento en 2% a 5% de los pacientes. Se reportaron infecciones fatales en 0.8% a 2% de los pacientes en los estudios principalmente debido a neumonía y sepsis.
INCOMPATIBILIDADES: Este medicamento no debe mezclarse con otros medicamentos, excepto aquellos mencionados en la sección Instrucciones de uso y manipulación y eliminación.
INTERACCIONES: No se han realizado estudios de interacción fármaco-fármaco.
Evaluaciones de farmacocinética clínica de pomalidomida, talidomida y bortezomib no indicaron interacción fármaco-fármaco clínicamente relevantes entre DARZALEX™ y estas terapias de combinación.
Efectos de DARZALEX™ sobre las pruebas de laboratorio:
Interferencia con la prueba de antiglobulinas indirecta (Prueba de Coombs indirecta): Daratumumab se une a CD38 en los glóbulos rojos e interfiere con las pruebas de compatibilidad, incluyendo el cribado de anticuerpos y la prueba cruzada. Los métodos que mitigan la interferencia de daratumumab incluyen el tratamiento de los glóbulos rojos reactivos con ditiotreitol (DTT) para interrumpir la unión o el genotipo de daratumumab. Dado que el sistema de grupo sanguíneo Kell también es sensible al tratamiento con DTT, se deben suministrar unidades Kell-negativas después de descartar o identificar a los anticuerpos utilizando glóbulos rojos tratados con DTT.
ESTUDIOS CLÍNICOS: Tratamiento en combinación con lenalidomida: El Estudio MMY3003, un estudio de Fase 3, abierto, aleatorizado, controlado con activo, comparó el tratamiento de DARZALEX™ 16 mg/kg en combinación con lenalidomida y dosis bajas de dexametasona (DRd) con el tratamiento de lenalidomida y dosis bajas de dexametasona (Rd) en pacientes con mieloma múltiple que han recibido por lo menos una terapia previa. Se administró lenalidomida (25 mg una vez al día por vía oral en los Días 1-21 de ciclos repetidos de 28 días [4 semanas]) con dosis baja oral o intravenosa de dexametasona 40 mg/semana (o una dosis reducida de 20 mg/semana para pacientes > 75 años o con un índice de masa corporal [IMC] <18.5). En los días de la infusión de DARZALEX™, se administró 20 mg de la dosis de dexametasona como medicamento previo a la infusión y el resto se administró el día después de la infusión. En pacientes con una dosis reducida de dexametasona, se administró toda la dosis de 20 mg como un medicamento previo a la infusión de DARZALEX™. Se aplicaron ajustes de la dosis para lenalidomida y dexametasona de acuerdo a la información de prescripción del fabricante. Se continuó el tratamiento en ambos grupos hasta la progresión de la enfermedad o una toxicidad inaceptable.
Un total de 569 pacientes fueron aleatorizados; 286 al grupo DRd y 283 al grupo Rd. Las características iniciales demográficas y de la enfermedad fueron similares entre los grupos de DARZALEX™ y de control. La mediana de la edad del paciente fue 65 años (intervalo, 34 a 89 años), 11% fueron ≥ 75 años, 59% fueron varones; 69% caucásicos, 18% asiáticos y 3% afroamericanos. Los pacientes habían recibido una mediana de 1 línea de tratamiento previo. El 63% de los pacientes habían recibido previamente trasplante autólogo de progenitores hematopoyéticos (TAPH). La mayoría de los pacientes (86%) recibieron previamente un inhibidor del proteasoma (IP), el 55% de los pacientes habían recibido previamente un agente inmunomodular (IMiD), incluyendo el 18% de los pacientes que habían recibido previamente lenalidomida, y el 44% de los pacientes habían recibido previamente un IP y IMiD. Al inicio, el 27% de los pacientes fueron refractarios a la última línea de tratamiento. El 18% de los pacientes fueron refractarios solamente a un IP, y el 21% fueron refractarios a bortezomib. La eficacia se evaluó mediante la supervivencia libre de progresión (SLP) basado en el criterio del Grupo de Trabajo Internacional para Mieloma (IMWG).
El Estudio MMY3003 demostró una mejoría en la SLP en el grupo DRd en comparación con el grupo Rd; la mediana de la SLP no se había alcanzado en el grupo DRd y fue de 18.4 meses en el grupo Rd (cociente de riesgo [HR]=0.37; IC del 95%: 0.27, 0.52; p<0.0001) representando una reducción del 63% en el riesgo de la progresión de la enfermedad o muerte en los pacientes tratados con DRd.
Figura 1: Curva de Kaplan-Meier de la SLP en el Estudio MMY3003
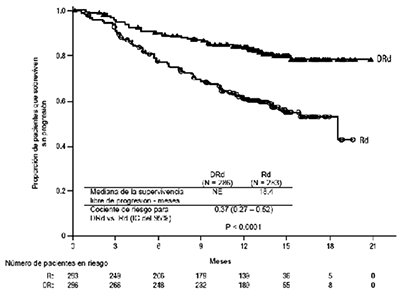
La Tabla 12 a continuación presenta resultados de eficacia adicionales del Estudio MMY3003.
|
Tabla 7. Resultados adicionales de la eficacia del Estudio MMY3003 |
||
|
Número de pacientes con respuesta evaluable |
DRd (n=281) |
Rd (n=276) |
|
Respuesta general (RCe+RC+ MBRP+RP) n(%) |
261 (92.9) |
211 (76.4) |
|
Valor de pa |
<0.0001 |
|
|
Respuesta completa estricta (RCe) |
51 (18.1) |
20 (7.2) |
|
Respuesta completa (RC) |
70 (24.9) |
33 (12.0) |
|
Muy buena respuesta parcial (MBRP) |
92 (32.7) |
69 (25.0) |
|
Respuesta parcial (RP) |
48 (17.1) |
89 (32.2) |
|
Mediana del tiempo hasta la respuesta [meses (IC del 95%)] |
1.0 (1.0, 1.1) |
1.3 (1.1, 1.9) |
|
Mediana de la duración hasta la respuesta [meses (IC del 95%)] |
NE (NE, NE) |
17.4 (17.4, NE) |
|
Tasa EMR negativa (IC del 95%) b (%) |
29.0 (23.8, 34.7) |
7.8 (4.9, 11.5) |
|
Cociente de momios con IC del 95%c |
4.85 (2.93, 8.03) |
|
|
Valor de pd |
<0.000001 |
|
|
DRd = daratumumab-lenalidomida-dexametasona; Rd = lenalidomida-dexametasona; EMR= enfermedad mínima residual; IC = intervalo de confianza; NE =no estimable. a Valor de p de la prueba de Chi Cuadrado de Cochran Mantel-Haenszel. b Basada en la población de intención de tratar y un umbral de 10-4 c Se utiliza una estimación común de Chi Cuadrado del cociente de momios. Un cociente de momios > 1 indica una ventaja para DRd. d El valor de p se obtiene de una prueba de Chi Cuadrado con cocientes de probabilidad. |
||
Con una mediana general de seguimiento de 13.5 meses, el cociente de riesgo para SG fue 0.64 (IC del 95%: 0.40, 1.01; p=0.0534). La tasa de SG a los 18 meses fue 86% (IC del 95%: 79.9, 90.5) para pacientes en el grupo DRd frente al 76% (IC del 95%: 79.9, 90.5) en el grupo Rd.
Tratamiento de combinación con bortezomib: El estudio MMY3004, un estudio de Fase 3, abierto, aleatorizado, controlado con activo, comparó el tratamiento con DARZALEX™ 16 mg/kg en combinación con bortezomib y dexametasona (DVd), frente al tratamiento con bortezomib y dexametasona (Vd). Bortezomib se administró por inyección SC o infusión IV a dosis de 1.3 mg/m2 área de superficie corporal dos veces a la semana durante dos semanas (Días 1, 4, 8, y 11) de ciclos de tratamiento repetidos de 21 días (3 semanas), por un total de 8 ciclos. La dexametasona se administró por vía oral a una dosis de 20 mg los Días 1, 2, 4, 5, 8, 9, 11, y 12 de los 8 ciclos de bortezomib (80 mg/semana por dos de las tres semanas de cada uno de los ciclos de bortezomib) o a una dosis reducida de 20 mg/semana para pacientes > 75 años, IMC < 18.5, diabetes mellitus deficientemente controlada o intolerancia previa a tratamiento con esteroides. En los días de la infusión con DARZALEX™, se administraron 20 mg de la dosis de dexametasona como medicamento previo a la infusión. Para pacientes con una dosis reducida de dexametasona, se administró la dosis completa de 20 mg como un medicamento previo a la infusión de DARZALEX™. El bortezomib y la dexametasona fueron administrados por 8 ciclos de tres semanas en ambos grupos de tratamiento, mientras que DARZALEX™ se administró hasta la progresión del tratamiento. Sin embargo, se continuó la administración de dexametasona 20 mg como medicamento previo a la infusión de DARZALEX™ en el grupo DVd. Se aplicaron ajustes de la dosis para bortezomib y dexametasona de acuerdo con la información de prescripción del fabricante.
Se aleatorizaron un total de 498 pacientes; 251 al grupo DVd y 247 al grupo Vd. Las características iniciales demográficas y de la enfermedad fueron similares entre DARZALEX™ y el grupo de control. La mediana de la edad del paciente fue 64 años (intervalo, 30 a 88 años); el 12% fueron ≥ 75 años, el 57% fueron varones; el 87% caucásicos, el 5% asiáticos y el 4% afroamericanos. Los pacientes habían recibido una mediana de 2 líneas de tratamiento previo y el 61% de los pacientes habían recibido previamente trasplante autólogo de progenitores hematopoyéticos (TAPH). El 69% de los pacientes habían recibido previamente un IP (66% recibieron bortezomib) y el 76% de los pacientes recibieron un IMiD (42% recibieron lenalidomida). Al inicio, el 32% de los pacientes fueron refractarios a la última línea de tratamiento y la proporción de pacientes refractarios a cualquier tratamiento específico previo estuvieron bien equilibrados entre los grupos de tratamiento. El 33% de los pacientes fueron refractarios solamente a un IMiD, y el 28% fueron refractarios a la lenalidomida. La eficacia se evaluó mediante la supervivencia libre de progresión (SLP) basado en el criterio el Grupo de Trabajo Internacional para Mieloma (IMWG).
El Estudio MMY3004 demostró una mejoría en la SLP en el grupo DVd en comparación con el grupo Vd; la mediana de la SLP no se había alcanzado en el grupo DVd y fue de 7.2 meses en el grupo Vd (HR [IC del 95%]: 0.39 [0.28, 0.53]; valor de p < 0.0001), representando una reducción del 61% en el riesgo de progresión de la enfermedad o muerte para pacientes tratados con DVd frente a Vd.
Figura 2: Curva de Kaplan-Meier de la SLP en el Estudio MMY3004.
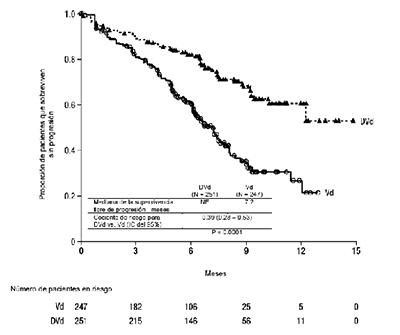
En la Tabla 13 a continuación se presentan los resultados adicionales de la eficacia del Estudio MMY3004.
|
Tabla 8. Resultados adicionales de la eficacia del Estudio MMY3004 |
||
|
Número de pacientes con respuesta evaluable |
DVd (n=240) |
Vd (n=234) |
|
Respuesta general (RCe+RC+MBRP+RP) n (%) |
199 (82.9) |
148 (63.2) |
|
Valor de pa |
<0.0001 |
|
|
Respuesta completa estricta (RCe) |
11 (4.6) |
5 (2.1) |
|
Respuesta completa (RC) |
35 (14.6) |
16 (6.8) |
|
Muy buena respuesta parcial (MBRP) |
96 (40.0) |
47 (20.1) |
|
Respuesta parcial (RP) |
57 (23.8) |
80 (34.2) |
|
Mediana del tiempo hasta la respuesta [meses (intervalo)] |
0.9 (0.8, 1.4) |
1.6 (1.5, 2.1) |
|
Mediana de la duración de la respuesta [meses (IC del 95%)] |
NE (11.5, NE) |
7.9 (6.7, 11.3) |
|
Tasa EMR negativa (IC del 95%)b (%) |
13.5 (9.6, 18.4) |
2.8 (1.1, 5.8) |
|
Cociente de momios con IC del 95%c |
5.37 (2.33, 12.37) |
|
|
Valor de pd |
0.000006 |
|
|
DVd = daratumumab- bortezomib-dexametasona; Vd = bortezomib-dexametasona; EMR= enfermedad mínima residual; IC = intervalo de confianza; NE =no estimable a valor de p de la prueba de Chi Cuadrado de Cochran Mantel-Haenszel. b Basado en la población de intención para tratar y un umbral de 10-4 c Se utiliza una estimación común de Chi Cuadrado del cociente de momios. Un cociente de momios > 1 indica una ventaja para DVd. d El valor de p se obtiene de la prueba de Chi Cuadrado con cociente de probabilidad. |
||
No se alcanzó la mediana de SG para ninguno de los grupos de tratamiento. Con una mediana general del seguimiento de 7.4 meses (IC del 95%: 0.0, 14.9), el cociente de riesgo para SG fue 0.77 (IC del 95%: 0.47, 1.26; p=0.2975).
Tratamiento en combinación con pomalidomida: El estudio MMY1001 fue un estudio abierto en el que 103 pacientes con mieloma múltiple que habían recibido previamente IP y IMiD, recibieron DARZALEX™ 16 mg/kg en combinación con pomalidomina y dosis baja de dexametasona hasta la progresión de la enfermedad. Se administró pomalidomida (4 mg una vez al día por vía oral los Días 1-21 de ciclos repetidos de 28 días [4 semanas]) con dosis baja oral o intravenosa de 40 mg/semana de dexametasona (dosis reducida de 20 mg/semana para pacientes >75 años o con un índice de masa corporal [IMC] <18.5). En los días de la infusión de DARZALEX™, se administraron 20 mg de dexametasona como un medicamento previo a la infusión y el resto se administró el día después de la infusión. Para pacientes con una dosis reducida de dexametasona, se administró la dosis total de 20 mg como un medicamento previo a la infusión de DARZALEX™.
La mediana de la edad del paciente fue 64 años (intervalo: 35 a 86 años) con el 8% de los pacientes ≥75 años de edad. Los pacientes en el estudio habían recibido una mediana de 4 líneas de tratamiento previo. El 74% de los pacientes habían recibido previamente TAPH. El 98% de los pacientes recibieron tratamiento previo con bortezomib, y el 33% de los pacientes recibieron previamente carfilzomib. Todos los pacientes recibieron previamente tratamiento con lenalidomida, con el 98% de los pacientes tratados previamente con la combinación de bortezomib y lenalidomida. El 89% de los pacientes fueron refractarios a la lenalidomida y el 71% fueron refractarios a bortezomib; el 64% de los pacientes fueron refractarios a bortezomib y lenalidomida.
La tasa de respuesta general fue 59% (IC del 95%: 49.1%, 68.8%); se alcanzó MBRP o mejor en el 42% de los pacientes, se alcanzó RC o mejor en el 14% de los pacientes y se alcanzó RC estricta en el 8% de los pacientes. La tasa de beneficio clínico (TRG+ RM [Respuesta mínima]) fue 62% (IC del 95%: 52.0, 71.5). La mediana del tiempo hasta la respuesta fue 1 mes (intervalo: 0.9 a 2.8 meses). La mediana de la duración de la respuesta fue 13.6 meses (IC del 95%: 10.0, no estimable). Después de una mediana de duración del seguimiento de 9.8 meses, no se alcanzó la mediana de SG. La tasa de supervivencia a los 12 meses fue del 72%.
Monoterapia: La eficacia y la seguridad clínica de DARZALEX™ en monoterapia para el tratamiento de pacientes con mieloma múltiple recidivante y refractario cuyo tratamiento previo incluyó un inhibidor del proteasoma y un agente inmunomodulador fueron demostradas en dos estudios abiertos.
En el estudio MMY2002, 106 pacientes con mieloma múltiple recidivante y refractario recibieron 16 mg/kg de DARZALEX™ hasta la progresión de la enfermedad. La mediana de la edad de los pacientes fue 63.5 años (intervalo, 31 a 84 años), el 49% fueron varones y el 79% fueron Caucásicos. Los pacientes habían recibido una mediana de 5 líneas de terapia previa. 80% de los pacientes habían recibido previamente trasplante autólogo de progenitores hematopoyéticos (TAPH). Las terapias previas incluyeron bortezomib (99%), lenalidomida (99%), pomalidomida (63%) y carfilzomib (50%). Al inicio, 97% de los pacientes fueron refractarios a la última línea de tratamiento, el 95% fueron refractarios a ambas, y el 77% fueron refractarios a agentes alquilantes, el 63% fueron refractarios a pomalidomida y el 48% de los pacientes fueron refractarios a carfilzomib.
Los resultados de la eficacia basados en la evaluación del Comité de Revisión Independiente (CRI) se presentan en la Tabla 14 a continuación.
|
Tabla 14. Resultados de la eficacia evaluados por el CRI para el Estudio MMY2002 |
|
|
Criterio de valoración de la eficacia |
DARZALEX™ 16 mg/kg N=106 |
|
Tasa de respuesta general1 (TRG: RCe+RC+MBRP+RP) [n (%)] |
31 (29.2) |
|
IC del 95% (%) |
(20.8, 38.9) |
|
Respuesta completa estricta (RCe) [n (%)] |
3 (2.8) |
|
Respuesta completa (RC) [n] |
0 |
|
Muy buena respuesta parcial (MBRP) [n (%)] |
10 (9.4) |
|
Respuesta parcial (RP) [n (%)] |
18 (17.0) |
|
Tasa de Beneficios Clínicos (TRG+RM) [n (%)] |
36 (34.0) |
|
Mediana de la duración de respuesta [meses (IC del 95%)] |
7.4 (5.5, NE) |
|
Mediana de tiempo hasta la respuesta [meses (intervalo)] |
1 (0.9; 5.6) |
|
1 Criterio principal de valoración de la eficacia (criterio del Grupo de Trabajo Internacional para mieloma). IC = intervalo de confianza; NE = no estimable; RM = respuesta mínima |
|
La tasa de respuesta general (TRG) en MMY2002 fue similar independientemente del tipo de terapia anti-mieloma previa. Con una mediana de duración de seguimiento de 9 meses, no se alcanzó la mediana de Supervivencia Global (SG). La tasa de SG de 12 meses fue 65% (IC del 95%: 51.2, 75.5).
En el Estudio GEN501, 42 pacientes mieloma múltiple recidivante y refractario recibieron 16 mg/kg de DARZALEX™ hasta la progresión de la enfermedad. La mediana de la edad de los pacientes fue 64 años (intervalo, de 44 a 76 años), el 64% fueron varones y 76% fueron Caucásicos. Los pacientes en el estudio habían recibido una mediana de 4 líneas de terapia previa. 74% de los pacientes habían recibido previamente TAPH. Las terapias previas incluyeron bortezomib (100%), lenalidomida (95%), pomalidomida (36%) y carfilzomib (19%). Al inicio, el 76% de los pacientes fueron refractarios a la última línea de tratamiento, el 64% fueron refractarios a un IP y un IMiD, el 60% fueron refractarios a agentes alquilantes, el 36% fueron resistentes a pomalidomida y el 17% fueron refractarios a carfilzomib.
El tratamiento con 16 mg/kg de daratumumab condujo a una TGR del 36% con RC del 5% y MBRP del 5%. La mediana del tiempo hasta la respuesta fue 1 (intervalo: 0.5 a 3.2) mes. La mediana de la duración de la respuesta no fue alcanzada (IC del 95%: 5.6 meses, no estimable). Con una mediana de la duración del seguimiento de 10 meses, no se alcanzó la mediana de SG. La tasa de SG a 12 meses fue 77% (IC del 95%: 58.0, 88.2).
INFORMACIÓN NO CLÍNICA: Se han derivado datos toxicológicos a partir de estudios con daratumumab en chimpancés y con un anticuerpo anti-CD38 sustituto en monos cynomolgus. Las toxicidades primarias identificadas en los chimpancés fueron RRIs durante la primera infusión, pero no durante las infusiones subsecuentes, con daratumumab, y trombocitopenia. Se observó anemia en los monos cynomolgus. La afinidad de unión de daratumumab a las plaquetas humanas es al menos 15 veces menor a la de las plaquetas de los chimpancés. De manera similar, la CD38 anti-cynomolgus se une fuertemente a los glóbulos rojos de los monos cynomolgus, mientras que daratumumab solamente muestra un bajo nivel de unión a los glóbulos rojos de humanos. Esto sugiere que la trombocitopenia y la anemia pueden ser de relevancia limitada para los humanos. El efecto en las plaquetas y en los glóbulos rojos fue reversible. No se ha realizado una prueba de toxicidad crónica.
Carcinogenicidad y mutagenicidad: No se han realizado estudios en animales para establecer el potencial carcinogénico de daratumumab. Los estudios de rutina de genotoxicidad y carcinogenicidad generalmente no aplican a los farmacéuticos biológicos debido a que las proteínas grandes no pueden difundirse en las células y no pueden interactuar con el ADN o el material cromosómico.
Toxicología reproductiva: No se han realizado estudios en animales para evaluar los efectos potenciales de daratumumab en la reproducción o el desarrollo.
Fertilidad: No se han realizado estudios en animales para determinar los efectos potenciales en la fertilidad machos o hembras.
ADVERTENCIAS Y PRECAUCIONES:
Reacciones relacionadas con la infusión: Se reportaron reacciones relacionadas con la infusión en aproximadamente la mitad de todos los pacientes tratados con DARZALEX™. Monitorear a dichos pacientes durante toda la infusión y el periodo posterior a la infusión.
La mayoría de las RRIs ocurrieron en la primera infusión. Cuatro por ciento de los pacientes tuvo una RRI en más de una infusión. Se han presentado reacciones severas, incluyendo broncoespasmo, hipoxia, disnea e hipertensión, edema laríngeo y edema pulmonar. Los signos y síntomas pueden incluir síntomas respiratorios, tales como congestión nasal, tos, irritación de garganta, así como escalofríos, vómito y náusea. Los síntomas menos comunes fueron sibilancia, rinitis alérgica, pirexia, malestar en el pecho, prurito e hipotensión (ver sección Reacciones adversas).
Medicar previamente a los pacientes con antihistamínicos, antipiréticos y corticosteroides para reducir el riesgo de RRIs antes del tratamiento con DARZALEX™. Interrumpir la infusión de DARZALEX™ por las RRIs de cualquier severidad. Instituir manejo médico/tratamiento de soporte para las RRIs según sea necesario. Reducir la velocidad de la infusión al reiniciar la infusión (ver sección Dosificación y administración).
Para reducir el riesgo de las RRIs retrasadas, administrar corticosteroides orales a todos los pacientes en cada uno de los dos días después de todas las infusiones de DARZALEX™ (comenzando el día después de la infusión). Adicionalmente, considerar el uso de medicamentos posteriores a la infusión (por ejemplo, corticosteroides inhalados broncodilatadores de acción corta y prolongada) para los pacientes con un antecedente de enfermedad pulmonar obstructiva crónica para manejar las complicaciones respiratorias si éstas ocurren (ver sección Dosificación y administración).
Discontinuar de manera permanentemente la terapia con DARZALEX™ en el caso de RRIs potencialmente fatales.
Neutropenia/Trombocitopenia: DARZALEX™ puede incrementar la neutropenia y la trombocitopenia inducidas por la terapia base (ver sección Reacciones adversas).
Monitorear el recuento de células sanguíneas completos periódicamente durante el tratamiento de acuerdo con la información de prescripción del fabricante para las terapias base. Monitorear a los pacientes con neutropenia por signos de infección. Puede ser necesario retrasar la dosis de DARZALEX™ para permitir la recuperación del recuento de células sanguíneas. No se recomienda reducir la dosis de DARZALEX™. Considerar cuidados de soporte con transfusiones y factores de crecimiento.
Interferencia con la prueba de antiglobulina indirecta (Prueba de Coombs Indirecta): Daratumumab se une a CD38 encontrada en niveles bajos en los glóbulos rojos y puede dar un resultado positivo en la prueba de Coombs indirecta. La prueba de Coombs indirecta positiva mediada por daratumumab puede persistir hasta por 6 meses después de la última infusión de daratumumab. Debe reconocerse que daratumumab unido a los glóbulos rojos puede enmascarar la detección de anticuerpos a antígenos menores en el suero del paciente. La determinación de ABO y el tipo de Rh sanguíneo de un paciente no está impactada.
Antes de iniciar el tratamiento con DARZALEX™ se debe tipificar y cribar a los pacientes.
En el caso de una transfusión planificada, notificar a los centros de transfusiones sanguíneas de esta interferencia con la prueba de antiglobulina indirecta (ver sección Interacciones). Si se requiere una transfusión de emergencia, se pueden administrar glóbulos rojos compatibles ABO/RhD sin pruebas cruzadas, de acuerdo a las prácticas locales del banco de sangre.
ADMINISTRACIÓN: DARZALEX™ es administrado como una infusión intravenosa después de la dilución con cloruro de sodio al 0.9%. Para las instrucciones sobre la dilución del medicamento antes de la administración, ver sección Instrucciones de uso y manipulación y eliminación.
Después de la dilución, la infusión de DARZALEX™ se debe administrar por vía intravenosa a una velocidad de infusión inicial apropiada, descrita en la Tabla 3 a continuación. El incremento escalonado de la velocidad de la infusión se debe considerar solamente en ausencia de las reacciones a la infusión.
|
Tabla 3. Velocidad de infusión para la administración de DARZALEX™ |
||||
|
Volumen de dilución |
Velocidad inicial de infusión (primera hora) |
Incrementos de la velocidad de infusióna |
Velocidad máxima de infusión |
|
|
Primera infusión |
1000 mL |
50 mL/hora |
50 mL/hora cada hora |
200 mL/hora |
|
Segunda infusiónb |
500 mL |
50 mL/hora |
50 mL/hora cada hora |
200 mL/hora |
|
Infusiones subsecuentesc |
500 mL |
100 mL/hora |
50 mL/hora cada hora |
200 mL/hora |
|
a Considerar incrementos escalonados de la velocidad de infusión solamente en la ausencia de reacciones a la infusión. b Un volumen de dilución de 500 mL solamente se debe usar si no se presentaron reacciones a la infusión de Grado 1 (leve) o mayores durante las primeras 3 horas de la primera infusión. De lo contrario, continuar usando un volumen de dilución de 1000 mL y las instrucciones para la primera infusión. c Usar una velocidad inicial modificada para las infusiones subsiguientes (es decir, a partir de la tercera infusión en adelante) solamente si no se presentaron reacciones a la infusión de Grado 1 (leve) o mayores durante una velocidad de infusión final de ≥ 100 mL/h en las primeras dos infusiones. De lo contrario, continuar con las instrucciones de uso para la segunda infusión. |
||||
MANEJO DE LAS REACCIONES RELACIONADAS CON LA INFUSIÓN: Administrar los medicamentos previos a la infusión para reducir el riesgo de RRIs antes del tratamiento con DARZALEX™.
Para las RRIs de cualquier grado/severidad, interrumpir inmediatamente la infusión de DARZALEX™ y manejar los síntomas.
El manejo de las RRIs puede requerir además la reducción de la velocidad de infusión, o la discontinuación del tratamiento de DARZALEX™ como se describe a continuación (ver también sección Advertencias y precauciones).
Grado 1-2 (leve a moderado): Una vez resueltos los síntomas de la reacción, reanudar la infusión a no más de la mitad de la velocidad a la cual ocurrió la RRI. Si el paciente no experimenta ningún síntoma adicional de RRI, el escalamiento de la velocidad de infusión puede reanudarse en incrementos e intervalos según sea clínicamente apropiado hasta una velocidad máxima de 200 mL/hora (Tabla 3).
Grado 3 (severo): Una vez resueltos los síntomas de la reacción, considerar reiniciar la infusión a no más de la mitad de la velocidad a la cual ocurrió la reacción. Si el paciente no experimenta síntomas adicionales, reanudar el escalamiento de la velocidad de infusión en incrementos e intervalos según sea apropiado (Tabla 3). Repetir el procedimiento anterior en el caso de recurrencia de síntomas de Grado 3. Discontinuar DARZALEX™ de manera permanente cuando se presente por tercera vez una reacción a la infusión de Grado 3 o mayor.
Grado 4 (potencialmente fatal): Descontinúe de manera permanente el tratamiento con DARZALEX™.
DOSIFICACIÓN Y ADMINISTRACIÓN:
Vía intravenosa: DARZALEX™ debe ser administrado por un profesional de salud, con el soporte médico apropiado para manejar reacciones relacionadas con la infusión (RRIs) si estas ocurren.
Se deben administrar medicamentos previos y posteriores a la infusión (ver sección Medicamentos concomitantes recomendados a continuación).
Dosificación – Adultos (≥18 años):
Dosis recomendada:
Monoterapia y terapia de combinación con regímenes cíclicos de 4 semanas: La dosis recomendada es de 16 mg/kg de peso corporal de DARZALEX™ administrada como una infusión intravenosa de acuerdo con el siguiente esquema de dosificación en la tabla 1:
|
Tabla 1. Régimen de dosificación para la monoterapia con DARZALEX™ y en combinación con regímenes de dosificación de ciclos de 4 semanas |
|
|
Semanas |
Régimen |
|
Semanas 1 a 8 |
Semanalmente (8 dosis en total) |
|
Semanas 9 a 24a |
Cada dos semanas (8 dosis en total) |
|
Semana 25 en adelante hasta progresión de la enfermedadb |
Cada cuatro semanas |
|
a La primera dosis del régimen de dosis cada 2 semanas se administra en la semana 9. |
|
Para las instrucciones de dosificación para los medicamentos administrados con DARZALEX™, ver la sección Estudios clínicos y la información de prescripción del fabricante.
Terapia de combinación con regímenes cíclicos de 3 semanas: La dosis recomendada es DARZALEX™ 16 mg/kg de peso corporal administrada como una infusión intravenosa de acuerdo con el siguiente esquema de dosificación en la Tabla 2:
|
Tabla 2. Régimen de dosificación para DARZALEX™ con regímenes de dosificación cíclicos de 3 semanas |
|
|
Semanas |
Regimen |
|
Semanas 1 a 9 |
Semanalmente (9 dosis en total) |
|
Semanas 10 a 24a |
Cada tres semanas (5 dosis en total) |
|
Semana 25 en adelante hasta progresión de la enfermedadb |
Cada cuatro semanas |
|
a La primera dosis del régimen de dosificación cada 3 semanas se administra en la semana 10 b La primera dosis del régimen de dosificación cada 4 semanas se administra en la semana 25 |
|
Para las instrucciones de dosificación para los medicamentos administrados con DARZALEX™, ver la sección Estudios clínicos y la información de prescripción del fabricante.
Dosis faltante(s): Si se omite una dosis planificada de DARZALEX™, administrar la dosis tan pronto como sea posible y ajustar el esquema de dosificación consecuentemente, manteniendo el intervalo del tratamiento.
Modificaciones de la dosis: No se recomienda reducir la dosis de DARZALEX™. Puede ser necesario retrasar la dosis para permitir la recuperación del recuento de células sanguíneas en el caso de toxicidad hematológica (ver sección Advertencias y precauciones). Para información relativa a los medicamentos que se administran en combinación con DARZALEX™, consultar la información para prescribir del fabricante.
Medicamentos concomitantes recomendados:
Medicamentos previos a la infusión: Administrar los siguientes medicamentos previos a la infusión para reducir el riesgo de RRIs a todos los pacientes 1-3 horas antes de cada infusión de DARZALEX™:
• Corticosteroide (de acción prolongada o acción intermedia):
— Monoterapia: Metilprednisolona 100 mg, o equivalente, administrada por vía intravenosa. Después de la segunda infusión, puede reducirse la dosis del corticosteroide (metilprednisolona 60 mg oral o intravenosa).
— Terapia de combinación: Administrar 20 mg de dexametasona antes de cada infusión de DARZALEX™ (ver sección Estudios clínicos).
La dexametasona se administra por vía intravenosa antes de la primera infusión de DARZALEX™ y puede considerarse la administración oral antes de las infusiones subsecuentes.
• Antipiréticos (650 a 1000 mg de paracetamol/acetaminofén oral).
• Antihistamínico (25 a 50 mg de difenhidramina oral o intravenosa o equivalente).
Medicamentos posteriores a la infusión: Administrar el medicamento después de la infusión para reducir el riesgo de reacciones retardadas relacionadas con la infusión, de la siguiente manera:
Monoterapia: Administrar el corticosteroide oral (20 mg de metilprednisolona o dosis equivalente de un corticosteroide de acción intermedia o acción prolongada de acuerdo con los estándares locales) en cada uno de los 2 días después de todas las infusiones de DARZALEX™ (comenzando el día después de la infusión).
Terapia de combinación: Considerar la administración de metilprednisolona oral a dosis baja (≤ 20 mg) o equivalente el día después de la infusión de DARZALEX™.
Sin embargo, si se administra un corticosteroide específico del régimen base (por ejemplo, dexametasona) el día después de la infusión de DARZALEX™, puede no ser necesario medicamentos adicionales después de la infusión (ver sección Estudios clínicos).
Adicionalmente, para los pacientes con un antecedente de enfermedad pulmonar obstructiva crónica, considerar el uso de medicamentos posteriores a la infusión incluyendo broncodilatadores de acción corta y prolongada, y corticosteroides inhalados. Después de las primeras cuatro infusiones, si el paciente no experimenta RRIs importantes, estos medicamentos inhalados posteriores a la infusión pueden ser discontinuados a discreción del médico.
Profilaxis para la reactivación del virus herpes zóster: Se debe considerar profilaxis antiviral para la prevención de la reactivación del virus herpes zóster.
POBLACIONES ESPECIALES:
Población pediátrica (de 17 años de edad y menores): La seguridad y la eficacia de DARZALEX™ no han sido establecidas en los pacientes pediátricos.
Ancianos (de 65 años de edad y mayores): No se observaron diferencias generales en la seguridad o en la efectividad entre los pacientes ancianos y los más jóvenes.
No se consideran necesarios ajustes en las dosis (ver sección Propiedades farmacocinéticas).
Insuficiencia renal: No se han realizado estudios formales de daratumumab en pacientes con insuficiencia renal. Basado en los análisis farmacocinéticos (PK) poblacionales, no es necesario ajustar la dosificación para los pacientes con insuficiencia renal (ver sección Propiedades farmacocinéticas).
Insuficiencia hepática: No se han realizado estudios formales de daratumumab en pacientes con insuficiencia hepática. Es improbable que los cambios en la función hepática tengan algún efecto en la eliminación de daratumumab ya que las moléculas de la IgG1 tales como daratumumab no son metabolizadas a través de las vías hepáticas. Basado en los análisis PK de la población, no es necesario ajustar la dosificación para los pacientes con insuficiencia hepática (ver sección Propiedades farmacocinéticas).
POBLACIONES ESPECIALES: Edad y sexo: Basado en el análisis PK poblacional en pacientes que recibieron monoterapia, la edad (intervalo: 31-84 años) no tuvo un efecto clínicamente importante en la PK de daratumumab, y la exposición de daratumumab fue similar entre pacientes jóvenes (< 65 años de edad, n=127) y mayores (≥ 65 años de edad, n=96). Similar a la monoterapia, no se observó influencia clínicamente importante de la edad en la exposición a daratumumab en el análisis PK poblacional en pacientes que recibieron terapias de combinación. La diferencia en exposición estuvo dentro del 6% entre sujetos jóvenes (< 65 años de edad, n=352; o < 75 años de edad, n=630) y sujetos mayores (≥ 65 años de edad, n=342; o ≥75 años de edad, n=64).
El sexo no afectó la exposición de daratumumab en un grado clínicamente relevante en ambos análisis de poblaciones PK.
Insuficiencia renal: No se han realizado estudios formales de DARZALEX™ en pacientes con insuficiencia renal. Se realizó un análisis PK poblacional basado en datos preexistentes de la función renal en pacientes que recibieron daratumumab en monoterapia, incluyendo 71 con función renal normal (aclaramiento de creatinina [CRCL] ≥ 90 mL/min), 78 con insuficiencia renal leve (CRCL <90 y ≥60 mL/min), 68 con insuficiencia renal moderada (CRCL <60 y ≥30 mL/min), y 6 con insuficiencia renal severa o enfermedad renal en etapa terminal (CRCL <30 mL/min). No se observaron diferencias clínicamente importantes en la exposición a daratumumab entre los pacientes con insuficiencia renal y aquellos con una función renal normal. Los análisis adicionales de la PK poblacional en pacientes que recibieron tratamientos en combinación también demostraron la ausencia de diferencias clínicamente importantes en la exposición a daratumumab en pacientes con insuficiencia renal (leve, n=264; moderado, n=166; severo, n=12) ni en aquellos con función renal normal (n=251).
Insuficiencia hepática: No se han realizado estudios formales de DARZALEX™ en pacientes con insuficiencia hepática.
El análisis de la PK población de pacientes tratados con daratumumab en monoterapia incluyó 189 pacientes con función hepática normal (bilirrubina total [BT] y aspartato aminotransferasa [AST] ≤ límite superior del intervalo de la normalidad [LSN]) y 34 pacientes con insuficiencia hepática leve (BT 1.0 x a 1.5 x LSN o AST>LSN). No se observaron diferencias clínicamente importantes en la exposición a daratumumab entre pacientes con insuficiencia hepática leve y aquellos con función hepática normal. Un análisis adicional de la PK poblacional de pacientes con mieloma múltiple que recibieron daratumumab en diferentes tratamientos en combinación incluyeron 598 pacientes con función hepática normal, 83 pacientes con insuficiencia hepática leve y 5 pacientes con insuficiencia hepática moderada (BT >1.5 x a 3.0 x LSN), o severa (BT >3.0 x LSN). No se observaron diferencias clínicamente importantes en la exposición a daratumumab entre pacientes con insuficiencia hepática y aquellos con función hepática normal.
Raza: Basado en el análisis PK poblacional de daratumumab en monoterapia, la exposición a daratumumab fue similar entre sujetos de raza blanca (n=197) y no blanca (n=26). En un análisis adicional de la PK poblacional en pacientes con mieloma múltiple que recibieron daratumumab con diferentes terapias en combinación, la exposición a daratumumab también fue similar entre sujetos de raza blanca (n=558) y no blanca (n=136).
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES: Daratumumab es un anticuerpo monoclonal humano de la inmunoglobulina G1 kappa (IgG1κ) contra el antígeno CD38, producido en una línea celular mamífera (Ovario de Hámster Chino [OHC]) usando tecnología de ADN recombinante.
DARZALEX™ está disponible como un concentrado líquido incoloro a amarillo libre de preservantes para infusión intravenosa después de la dilución. Cada mL contiene 20 mg de daratumumab.
Vial de 5 mL: Cada VIAL de un solo uso contiene 100 mg de daratumumab.
Vial de 20 mL: Cada VIAL de un solo uso contiene 400 mg de daratumumab.
Para los excipientes, ver la Lista de Excipientes.
SOBREDOSIS: Síntomas y signos: No ha habido experiencia de sobredosificación en los estudios clínicos. Se han administrado dosis de hasta 24 mg/kg por vía intravenosa en un estudio clínico sin alcanzar la dosis máxima tolerada.
Tratamiento: No existe un antídoto específico conocido para la sobredosis por DARZALEX™. En el caso de una sobredosis, el paciente debe ser monitoreado por cualquier signo o síntoma de efectos adversos y se debe instituir inmediatamente tratamiento sintomático apropiado.
PRESENTACIÓN: Vial de 5 ml (100 mg/5 ml) y vial de 20 mL (400 mg/20 ml) (Reg. San. INVIMA 2017M-0017749).
JANSSEN-CILAG, S. A.
Av. Calle 26 No. 69-76 - Edificio Elemento
Torre 2, Piso 11 - PBX: +57 1 927 1200 - Bogotá, D. C.
NATURALEZA Y CONTENIDOS DEL ENVASE: Caja por 1 vial de 5 ml o 20 ml (Reg. San. INVIMA 2017M-0017749). Venta con fórmula facultativa.
CONDICIONES DE ALMACENAMIENTO: Manténgase fuera de la vista y el alcance de los niños.
Para las condiciones de almacenamiento del medicamento diluido, ver sección Vida útil.
VIDA ÚTIL:
Viales sin abrir: Ver la fecha de expiración en el empaque exterior.
Después de la dilución: Debido a que las soluciones de daratumumab no contienen un preservante, a menos que el método de apertura/dilución excluya el riesgo de contaminación microbiana, el producto debe ser usado de inmediato. Si no se usa de inmediato, la solución puede ser almacenada en un refrigerador protegido de la luz a 2 ºC–8 ºC (36 ºF–46 ºF) hasta por 24 horas antes de su uso, seguido de 15 horas (incluyendo el tiempo de infusión) a temperatura ambiente 15 °C-25 °C (59 °F-77 °F) y con luz ambiente.