
CRESTOR® 5 MG, 10 MG, 20 MG, 40 MG
ROSUVASTATINA
Tabletas recubiertas
1 Caja,28 Tabletas recubiertas,5 mg
1 Caja,7, 14 y 28 Tabletas recubiertas,10 mg
1 Caja,7, 14 y 28 Tabletas recubiertas,20 mg
1 Caja,7, 14 y 28 Tabletas recubiertas,40 mg
Caja , 10, 20 y 3 Tabletas recubiertas , 5 Miligramos
Caja , 10, 20 y 3 Tabletas recubiertas , 10 Miligramos
Caja , 10, 20 y 3 Tabletas recubiertas , 20 Miligramos
1 Caja,7, 14 y 28 Tabletas recubiertas,10 mg
Caja , 10, 20 y 3 Tabletas recubiertas , 10 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada TABLETA contiene 5 mg, 10 mg, 20 mg o 40 mg de rosuvastatina como rosuvastatina cálcica.
INDICACIONES
En pacientes adultos con hipercolesterolemia:
• Hipercolesterolemia primaria (tipo IIa, incluyendo la hipercolesterolemia familiar heterocigota) o dislipidemia mixta (tipo IIb) como coadyuvante de una dieta, cuando resulta insuficiente la respuesta a la dieta y a otros tratamientos no farmacológicos.
• Hipercolesterolemia familiar homocigota, como coadyuvante de una dieta y de otros tratamientos hipolipemiantes (por ejemplo, aféresis de LDL), o si tales tratamientos son inadecuados.
• Prevención de eventos cardiovasculares: En pacientes adultos con un riesgo incrementado de enfermedad cardiovascular aterosclerótica basado en la presencia de marcadores de riesgo de enfermedad cardiovascular, tales como nivel elevado de PCR de alta sensibilidad (PCR-hs), edad, hipertensión, HDL-C bajo, consumo de tabaco o una historia familiar de enfermedad cardiaca prematura, CRESTOR® está indicado para reducir la mortalidad y el riesgo de eventos cardiovasculares mayores (muerte cardiovascular, ataque cerebrovascular, IM, angina inestable, o revascularización arterial).
En niños y adolescentes de 6 a 17 años de edad: CRESTOR® está indicado para reducir el colesterol total, c-LDL y la Apo B en pacientes con hipercolesterolemia familiar heterozigota (HeFH)”.
MECANISMO DE ACCIÓN: La rosuvastatina es un inhibidor selectivo, potente y competitivo de la HMG-CoA reductasa, la enzima que convierte la 3-hidroxi-3-metilglutaril coenzima A en mevalonato, un precursor del colesterol, y que limita la síntesis del mismo. El sitio de acción principal de la rosuvastatina es el hígado, el órgano blanco de la reducción del colesterol.
Los triglicéridos (TG) y el colesterol en el hígado son incorporados, con la apolipoproteína B (ApoB), dentro de la lipoproteína de muy baja densidad (VLDL) y liberados dentro del plasma para ser transportados a los tejidos periféricos. Las partículas de VLDL son ricas en TG. La lipoproteína de baja densidad (LDL) rica en colesterol se forma a partir de VLDL y es eliminada principalmente a través del receptor LDL de alta afinidad en el hígado.
La rosuvastatina produce sus propios efectos modificadores de lípidos de dos maneras; aumenta el número de receptores hepáticos de LDL en la superficie celular, mejorando la captación y el catabolismo de las LDL e inhibiendo la síntesis hepática de las VLDL, con lo que reduce el número total de partículas de VLDL y LDL.
La lipoproteína de alta densidad (HDL), que contiene ApoA-I, está involucrada, entre otras cosas, en el transporte de colesterol desde los tejidos de regreso hacia el hígado (transporte reverso de colesterol).
La intervención del LDL-C en la aterogénesis ha sido bien documentada. Estudios epidemiológicos han establecido que el LDL-C alto, TG elevados, HDL-C bajo y ApoA-I se han asociado con un riesgo más alto de enfermedad cardiovascular. Estudios de intervención han mostrado los beneficios de la reducción del LDL-C y TG o elevación del HDL-C sobre la mortalidad e índices de eventos CV. Datos más recientes han relacionado los efectos beneficiosos de los inhibidores de HMG-CoA reductasa para reducir el colesterol no HDL (es decir, todo el colesterol no HDL circulante) y la ApoB, o reducir el índice ApoB/ApoA-I.
FORMA FARMACÉUTICA
5 mg: Tableta recubierta redonda, biconvexa, 7 mm, color amarillo.
10 mg: Tableta recubierta redonda, biconvexa, 7 mm, color rosado.
20 mg: Tableta recubierta redonda, biconvexa, 9 mm, color rosado.
40 mg: Tableta recubierta ovalada, biconvexa, 11.4 x 6.9 mm, color rosado.
Las tabletas son impresas con “ZD4522” y la concentración de la tableta.
PROPIEDADES FARMACOLÓGICAS
Grupo farmacoterapéutico
Código ATC: C10A A07.
PROPIEDADES FARMACOCINÉTICAS: CRESTOR® se administra vía oral en la forma activa, ocurriendo niveles plasmáticos máximos 5 horas después de la dosificación. La exposición aumenta linealmente a través del rango de dosis. La vida media es de 19 horas y no aumenta al incrementarse la dosis.
La biodisponibilidad absoluta es de 20%. Se produce acumulación mínima al repetir la dosificación una vez al día.
La rosuvastatina sufre extracción de primer paso en el hígado, que es el sitio primario de síntesis de colesterol y eliminación de LDL-C.
La rosuvastatina se une aproximadamente un 90% a las proteínas plasmáticas, en su mayoría albúmina. El compuesto original es responsable de más del 90% de la actividad del inhibidor de HMG CoA reductasa activa circulante.
La rosuvastatina sufre metabolismo limitado (aproximadamente 10%), principalmente a la forma N-desmetil, y el 90% es eliminada como fármaco no modificado en las heces y el resto es excretado en la orina.
Poblaciones especiales
Edad y sexo: La edad o el sexo no tienen un efecto clínico significativo en la farmacocinética de la rosuvastatina en adultos. La exposición en niños y adolescentes con hipercolesterolemia familiar heterocigótica parece ser similar o inferior que en pacientes adultos con dislipidemia.
Raza: Estudios farmacocinéticos muestran una elevación aproximada del doble en el AUC promedio en sujetos asiáticos comparados con caucásicos. Un análisis farmacocinético poblacional reveló que no existen diferencias clínicamente relevantes en la farmacocinética entre los grupos caucásicos, hispanos y negros o afrocaribeños.
Insuficiencia renal: En un estudio realizado en sujetos con grados variados de daño renal, la enfermedad renal leve a moderada tuvo poca influencia sobre las concentraciones plasmáticas de rosuvastatina. Sin embargo, los sujetos con daño severo (CrCl <30 ml/min) tuvieron un incremento de 3 veces en la concentración plasmática comparados con voluntarios sanos.
Insuficiencia hepática: En un estudio realizado en sujetos con grados variados de daño hepático, no hubo otra evidencia de exposición aumentada a rosuvastatina diferente a la encontrada en los 2 sujetos con la enfermedad hepática más severa (puntajes de Child-Pugh de 8 y 9). En estos sujetos, la exposición sistémica se incrementó por lo menos 2 veces comparados con quienes tuvieron puntajes de Child-Pugh más bajos.
Polimorfismos genéticos: La configuración de los inhibidores de HMG-CoA reductasa, incluyendo rosuvastatina, incluye proteínas transportadoras OATP1B1 y BCRP. En pacientes con polimorfismos genéticos SLCO1B1 (OATP1B1) y/o ABCG2 (BCRP) existe un riesgo de exposición incrementada a rosuvastatina. Los polimorfismos individuales de SLCO1B1 c.521CC y ABCG2 c.421AA están asociados con una exposición aproximadamente 1.6 veces más alta a rosuvastatina (ABC) o una exposición 2.4 veces más alta, respectivamente, comparados con los genotipos SLCO1B1 c.521TT o ABCG2 c.421CC.
CONTRAINDICACIONES: Hipersensibilidad a cualquiera de los componentes. En pacientes con enfermedad hepática activa, lo cual incluye elevaciones persistentes e inexplicables de las concentraciones séricas de transaminasas, así como un aumento de dichas concentraciones a más de tres veces el límite superior normal. En pacientes con insuficiencia renal grave. La dosis de 40 mg está contraindicada en los pacientes con insuficiencia renal moderada (depuración de creatinina <60 mL/min). En pacientes con miopatía. Pacientes que reciben un tratamiento concomitante con ciclosporina. Durante el embarazo y la lactancia y en las mujeres en edad fértil que no utilicen un método anticonceptivo apropiado.
EMBARAZO Y LACTANCIA: No se ha establecido la seguridad de CRESTOR® durante el embarazo y la lactancia. Las mujeres en edad fértil deben usar medidas anticonceptivas apropiadas (véase sección Contraindicaciones).
EFECTOS EN LA CAPACIDAD PARA CONDUCIR O UTILIZAR MÁQUINAS: La prueba farmacológica no reveló evidencia de un efecto sedativo de CRESTOR®. A partir del perfil de seguridad, no es de esperar que CRESTOR® afecte en forma adversa la habilidad para conducir o manejar maquinaria.
EFECTOS INDESEABLES: CRESTOR® es generalmente bien tolerado. Las reacciones adversas observadas con CRESTOR® son generalmente leves y transitorias. En los estudios clínicos controlados, menos del 4% de los pacientes tratados con CRESTOR® tuvieron que retirarse de los estudios debido a reacciones adversas. Este índice de retiro fue comparable al reportado en pacientes que estaban recibiendo placebo.
|
Frecuentes (=1/100, <1/10) |
Cefalea, mialgia, astenia, estreñimiento, mareos, náuseas, dolor abdominal, diabetes mellitus*. |
|
Poco frecuentes (=1/1000, <1/100) |
Prurito, exantema y urticaria. |
|
Raros (=1/10000, <1/1000) |
Miopatía (incluyendo miositis), reacciones de hipersensibilidad (incluyendo angioedema), rabdomiólisis, pancreatitis. |
|
*Observado en el estudio JUPITER (frecuencia global reportada 2.8% con rosuvastatina y 2.3% con placebo) principalmente en pacientes que ya están en riesgo alto de desarrollar diabetes (ver secciones Advertencias y precauciones y Propiedades farmacodinámicas). |
|
Como sucede con otros inhibidores de la HMG-CoA reductasa, la incidencia de reacciones adversas tiende a aumentar con el incremento de la dosis.
Efectos sobre el músculo esquelético: Con rosuvastatina y otras estatinas comercializadas se han reportado casos raros de rabdomiólisis, que ocasionalmente se asociaron con deterioro de la función renal.
Efectos sobre las pruebas de laboratorio: Al igual que con otros inhibidores de HMG-CoA reductasa, se ha observado un incremento dosis-relacionado en las transaminasas y CK en un número reducido de pacientes que estaban tomando rosuvastatina. También se han observado aumentos en la HbA1c en pacientes tratados con rosuvastatina (ver secciones Advertencias y precauciones y Propiedades farmacodinámicas). Se han visto anomalías en la prueba de uroanálisis (proteinuria positiva en la prueba de tira reactiva) en un pequeño número de pacientes que estaban tomando CRESTOR® y otros inhibidores de HMG-CoA reductasa. La proteína detectada fue en su mayoría de origen tubular. En la mayor parte de los casos, la proteinuria disminuye o desaparece espontáneamente al continuar el tratamiento y no es predictiva de enfermedad renal aguda o progresiva.
Otros efectos: En un estudio clínico controlado, a largo plazo, se demostró que CRESTOR® no tiene efectos nocivos sobre el lente ocular.
En pacientes tratados con CRESTOR®, no se produjo alteración de la función adrenocortical.
Efectos renales: Se ha observado proteinuria (principalmente de origen tubular y detectada con tiras reactivas) en pacientes tratados con CRESTOR®. Las variaciones de la proteinuria, desde inexistente o mínima hasta ++ o más en algún momento del tratamiento, mostraron una frecuencia <1% con 10 y 20 mg y de aproximadamente 3% con 40 mg. Con la dosis de 20 mg fue menor la variación: Desde inexistente o mínima hasta +. En la mayoría de los casos, la proteinuria disminuye o desaparece espontáneamente al continuar el tratamiento.
Se ha observado hematuria en pacientes tratados con CRESTOR®, y los datos clínicos muestran que la ocurrencia es baja.
Farmacovigilancia: Además de los efectos anteriores, se han observado las siguientes reacciones adversas durante la farmacovigilancia de CRESTOR®:
Trastornos hematológicos: Frecuencia desconocida: Trombocitopenia.
Trastornos hepatobiliares: Muy raros: Ictericia, hepatitis; Raros: Elevación de las transaminasas hepáticas.
Trastornos musculoesqueléticos: Frecuencia desconocida: Miopatía necrotizante mediada por el sistema inmune. Muy raros: Artralgia.
Tal como sucede con otros inhibidores de HMG-CoA reductasa, el índice de reporte de rabdomiólisis en el uso post-mercadeo es más alto a la dosis más alta comercializada.
Trastornos del sistema nervioso: Muy raros: Pérdida de memoria; Frecuencia desconocida: Neuropatía periférica.
Trastornos psiquiátricos: Frecuencia desconocida: Depresión, trastornos del sueño (incluyendo insomnio y pesadillas).
Trastornos renales: Muy raros: Hematuria.
Sistema reproductivo y trastornos mamarios: Frecuencia desconocida: Ginecomastia.
Niños y adolescentes de 6 a 17 años de edad: El perfil de seguridad de CRESTOR® es similar en niños o adolescentes y pacientes adultos aunque se observaron elevaciones de la CK >10xULN y síntomas musculares después de realizar ejercicio o incrementar la actividad física, los cuales se resolvieron con tratamiento continuado, con mayor frecuencia en estudios clínicos con niños y adolescentes. Sin embargo, las mismas advertencias y precauciones especiales para el uso en adultos también aplican a los niños y adolescentes (ver sección Advertencias y precauciones).
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN
Efecto sobre rosuvastatina de productos medicinales coadministrados: Datos in vitro e in vivo indican que rosuvastatina no tiene interacciones clínicamente significativas con el citocromo P450 (como un sustrato, inhibidor o inductor). Rosuvastatina es un sustrato para ciertas proteínas transportadoras, incluyendo el transportador de captación hepática OATP1B1 y transportador de eflujo BCRP. La administración concomitante de CRESTOR® con productos medicinales que sean inhibidores de estas proteínas transportadoras puede producir aumento en las concentraciones plasmáticas de rosuvastatina y riesgo incrementado de miopatía (véanse Tabla 1, y secciones Dosis y vía de administración y Advertencias y precauciones).
|
Tabla 1. Efecto de productos medicinales coadministrados sobre la exposición a rosuvastatina (ABC; en orden de magnitud decreciente) tomado de estudios clínicos publicados |
||
|
Régimen de dosificación del fármaco interactuante |
Régimen de dosificación de rosuvastatina |
Cambio en el ABC de rosuvastatina |
|
Ciclosporina 75 mg BID a 200 mg BID, 6 meses |
10 mg OD, 10 días |
7.1 veces ? |
|
Atazanavir 300 mg/ritonavir 100 mg OD, 8 días |
10 mg, dosis única |
3.1 veces ? |
|
Simeprevir 150 mg OD, 7 días |
10 mg, dosis única |
2.8-fold ? |
|
Lopinavir 400 mg/ritonavir 100 mg BID, 17 días |
20 mg OD, 7 días |
2.1 veces ? |
|
Dosis de carga de clopidogrel 300 mg, seguida por 75 mg a las 24 horas |
20 mg, dosis única |
2 veces ? |
|
Gemfibrozil 600 mg BID, 7 días |
80 mg, dosis única |
1.9 veces ? |
|
Eltrombopag 75 mg OD, 5 días |
10 mg, dosis única |
1.6 veces ? |
|
Darunavir 600 mg/ritonavir 100 mg BID, 7 días |
10 mg OD, 7 días |
1.5 veces ? |
|
Tipranavir 500 mg/ritonavir 200 mg BID, 11 días |
10 mg, dosis única |
1.4 veces ? |
|
Dronedarona 400 mg BID |
No disponible |
1.4 veces ? |
|
Itraconazol 200 mg OD, 5 días |
10 mg or 80 mg, dosis única |
1.4 veces ? |
|
Ezetimibe 10 mg OD, 14 días |
10 mg, OD, 14 días |
1.2 veces ? |
|
Fosamprenavir 700 mg/ritonavir 100 mg BID, 8 días |
10 mg, dosis única |
? |
|
Aleglitazar 0.3 mg, 7 días |
40 mg, 7 días |
? |
|
Silymarin 140 mg TID, 5 días |
10 mg, dosis única |
? |
|
Fenofibrato 67 mg TID, 7 días |
10 mg, 7 días |
? |
|
Rifampicina 450 mg OD, 7 días |
20 mg, dosis única |
? |
|
Ketoconazol 200 mg BID, 7 días |
80 mg, dosis única |
? |
|
Fluconazol 200 mg OD, 11 días |
80 mg, dosis única |
? |
|
Eritromicina 500 mg QID, 7 días |
80 mg, dosis única |
20% ? |
|
Baicalin 50 mg TID, 14 días |
20 mg, dosis única |
47% ? |
Interacciones que requieren ajustes de la dosis de rosuvastatina (véase también Tabla 1): Cuando sea necesario coadministrar CRESTOR® con otros productos medicinales conocidos por incrementar la exposición a rosuvastatina, se deben ajustar las dosis de CRESTOR®. Se recomienda a los médicos que lo prescriben, consultar la información relevante del producto cuando consideren la posibilidad de administrar dichos fármacos simultáneamente con CRESTOR®. Iniciar con una dosis de 5 mg de CRESTOR® una vez al día si el incremento esperado en la exposición (ABC) es aproximadamente 2 veces o más. La dosis máxima diaria de CRESTOR® se debe ajustar de tal modo que la exposición esperada a rosuvastatina no tenga probabilidad de exceder la de una dosis de 40 mg diarios de CRESTOR® tomada sin productos medicinales interactuantes, por ejemplo, una dosis de 5 mg de CRESTOR® con ciclosporina (incremento de 7.1 veces en la exposición), una dosis de 10 mg de CRESTOR® con la combinación ritonavir/atazanavir (incremento de 3.1 veces) y una dosis de 20 mg de CRESTOR® con gemfibrozil (incremento de 1.9 veces).
Otros productos medicinales interactuantes
Antiácidos: La dosificación simultánea de CRESTOR® con una suspensión de antiácido que contenga hidróxido de aluminio y magnesio dio como resultado una reducción en la concentración plasmática de rosuvastatina de aproximadamente 50%. Este efecto fue atenuado cuando el antiácido se dosificó 2 horas después de CRESTOR®. No se ha estudiado la relevancia clínica de esta interacción.
Ácido fusídico: No se han llevado a cabo estudios de interacción con rosuvastatina y ácido fusídico. Al igual que con otras estatinas, se han reportado eventos relacionados con los músculos, incluyendo rabdomiolisis, en la experiencia post-comercialización con rosuvastatina y ácido fusídico administrados simultáneamente. Los pacientes se deben monitorear de cerca y puede ser apropiada la suspensión temporal del tratamiento con rosuvastatina.
Efecto de rosuvastatina sobre productos medicinales coadministrados
Warfarina: La farmacocinética de la warfarina no se afecta significativamente después de coadministración con CRESTOR®. Sin embargo, de igual forma que con otros inhibidores de HMG-CoA reductasa, la coadministración de CRESTOR® y warfarina puede producir una elevación en el INR comparada con warfarina sola. En pacientes que estén tomando antagonistas de vitamina K, se recomienda monitorear el INR, tanto al iniciar como al suspender el tratamiento con CRESTOR® o luego de ajustar la dosis.
Derivados de fenofibratos/ácido fíbrico: Aunque no se observó interacción farmacocinética entre rosuvastatina y fenofibrato, puede ocurrir una interacción farmacodinámica. Gemfibrozil, fenofibrato y otros ácidos fíbricos, incluyendo el ácido nicotínico, pueden incrementar el riesgo de miopatía cuando se administran concomitantemente con inhibidores de HMG-CoA reductasa (véase sección Advertencias y precauciones).
Ciclosporina: La coadministración de CRESTOR® con Ciclosporina no dio como resultado cambios significativos en la concentración plasmática de Ciclosporina.
Otros medicamentos: No hubo interacciones clínicamente significativas con un anticonceptivo oral, digoxina, ezetimibe o fenofibrato.
En estudios clínicos, CRESTOR® fue coadministrado con agentes antihipertensivos, antidiabéticos y terapia de reemplazo hormonal. Estos estudios no produjeron ninguna evidencia de interacciones adversas clínicamente significativas.
DATOS PRECLÍNICOS SOBRE SEGURIDAD: Los datos preclínicos no revelan ningún peligro particular para el ser humano; esto se desprende de estudios convencionales de seguridad, farmacología, toxicidad de dosis repetidas, genotoxicidad, potencial carcinógenico y toxicidad reproductiva.
CARACTERÍSTICAS FARMACÉUTICAS
Lista de excipientes
Excipientes:
Núcleo de la tableta: Crospovidona, lactosa monohidratada, celulosa microcristalina, fosfato de calcio, estearato de magnesio.
Recubrimiento de la tableta: Dióxido de titanio (E171), óxido férrico rojo (E172), óxido férrico amarillo (E172), triacetato de glicerol, Lactosa monohidratada, hipromelosa.
Incompatibilidades: No procede.
Almacenamiento: Almacenar a menos de 30 °C.
Instrucciones de uso y manipulación: Ninguna instrucción particular.
EFICACIA CLÍNICA: CRESTOR® reduce los niveles elevados de colesterol de LDL, colesterol total y triglicéridos y aumenta los niveles de colesterol de HDL. También disminuye los niveles de ApoB, C-no HDL, C-VLDL, TG-VLDL y eleva los de ApoA-I (ver Tabla 2). CRESTOR® también disminuye las proporciones C-LDL/C-HDL, C total/C-HDL, C-no HDL/C-HDL y ApoB/ApoA-I.
El efecto terapéutico de CRESTOR® se obtiene a la semana de haber empezado el tratamiento y el 90% de la respuesta máxima se alcanza en 2 semanas. La respuesta máxima generalmente se observa a las 4 semanas, manteniéndose posteriormente.
|
Tabla 2. Relación entre la dosis y la respuesta en pacientes con hipercolesterolemia primaria (Tipos IIa y IIb) (cambio porcentual promedio ajustado con respecto al valor inicial) |
||||||||
|
Dosis |
N |
C-LDL |
C total |
C-HDL |
TG |
C-no HDL |
ApoB |
ApoA-I |
|
Placebo |
13 |
-7 |
-5 |
3 |
-3 |
-7 |
-3 |
0 |
|
5 |
17 |
-45 |
-33 |
13 |
-35 |
-44 |
-38 |
4 |
|
10 |
17 |
-52 |
-36 |
14 |
-10 |
-48 |
-42 |
4 |
|
20 |
17 |
-55 |
-40 |
8 |
-23 |
-51 |
-46 |
5 |
|
40 |
18 |
-63 |
-46 |
10 |
-28 |
-60 |
-54 |
0 |
Los datos en la Tabla 2 son confirmados por el programa clínico más amplio de más de 5.300 pacientes que han recibido CRESTOR®.
En un estudio en pacientes con hipercolesterolemia familiar heterocigota, 435 pacientes recibieron dosis de CRESTOR® de 20 mg a 80 mg siguiendo un diseño con ajuste forzado de la dosis. Todas las dosis de CRESTOR® ejercieron un efecto benéfico en los parámetros lipídicos y alcanzaron los objetivos terapéuticos. Después de ajustar la dosis a 40 mg (12 semanas de tratamiento), el C-LDL disminuyó en un 53%.
Un estudio con un diseño abierto y ajuste forzado de la dosis evaluó la respuesta de 42 pacientes con hipercolesterolemia familiar homocigota en un intervalo de 6 semanas a dosis de CRESTOR® de 20 a 40 mg.
En la población general, la reducción media del LDL-C fue de 22%. En los 27 pacientes con una reducción mínima de 15% hacia la semana 12 (considerada como la población respondedora), la reducción media del LDL-C fue de 26% a la dosis de 20 mg y 30% a la dosis de 40 mg. De los 13 pacientes con un LDL-C inferior a 15%, 3 no tuvieron respuesta o presentaron un incremento en el LDL-C.
CRESTOR® puede retardar o reducir la progresión de la aterosclerosis: El estudio METEOR evaluó el efecto de la administración de 40 mg de rosuvastatina sobre la progresión de la aterosclerosis mediante una ecografía modo B de las arterias carótidas. En este estudio multicéntrico con un diseño doble ciego y controlado con un placebo, 984 sujetos con un bajo riesgo de cardiopatía coronaria (definido como un riesgo de Framingham <10% en diez años) y una media de C-LDL de 154.5 mg/dL, pero con aterosclerosis subclínica confirmada por la determinación de la media del espesor de las túnicas íntima y media de la arteria carótida (ETIMAC), se distribuyeron al azar en una proporción de 5:2 entre el tratamiento con 40 mg de rosuvastatina o un placebo durante 2 años. La rosuvastatina retrasó significativamente la progresión de la aterosclerosis de la carótida en comparación con el placebo. La diferencia en el índice de variación del ETIMAC máximo de los 12 sitios de las arterias carótidas entre los pacientes tratados con la rosuvastatina y aquellos tratados con un placebo fue de -0.0145 mm/año (IC del 95% = -0.0196, -0.0093; p<0.0001). La variación con respecto al valor inicial en el grupo de la rosuvastatina fue de -0.0014 mm/año (IC del 95% = -0.0041, 0.0014), pero no fue significativamente diferente de cero (p=0.3224). Los efectos benéficos de la rosuvastatina fueron consistentes a través de todos los 4 desenlaces secundarios del ETIMAC. Se observó una progresión significativa en el grupo con placebo (+0.0131 mm/año; IC del 95%=0.0087, 0.0174; p<0.0001). En el grupo con Rosuvastatina, 52.1% de los pacientes mostraron ausencia de la progresión de la enfermedad (p. ej., hubo regresión) comparado con un 37.7% de pacientes en el grupo con placebo (p=0.0002). La rosuvastatina 40 mg fue bien tolerada y los datos fueron consistentes con el perfil de seguridad establecido.
El Estudio Multinacional Controlado de Rosuvastatina en Falla Cardíaca (CORONA, sigla en inglés para ‘Controlled Rosuvastatin Multinational Study in Heart Failure’) fue un estudio aleatorio, doble-ciego, placebo controlado, en 5.011 sujetos con falla cardiaca sistólica crónica sintomática tratados con rosuvastatina 10 mg (n=2514) o placebo (n=2497) durante un tiempo promedio de tratamiento de 2.5 años. Cuando se adicionó rosuvastatina 10 mg a terapia farmacológica extensa de base en estos sujetos, se observó una reducción no significativa de 8% versus placebo en el punto final primario de muerte cardiovascular, IM no fatal o accidente cerebrovascular no fatal (HR 0.92, IC 95% 0.83 a 1.02; p=0.12).
El perfil de seguridad de los sujetos que estaban tomando rosuvastatina 10 mg fue comparable al de quienes estaban recibiendo placebo. A partir del estudio, el 1.8% de los sujetos tratados con rosuvastatina versus 1.7% de los tratados con placebo descontinuaron debido a reacciones adversas. Las reacciones adversas más comunes que condujeron a descontinuación del tratamiento fueron: Mialgia, prurito, erupción cutánea, y mareo. En la Tabla 3 se pueden encontrar las reacciones adversas reportadas en =2% de los pacientes y en una proporción mayor o igual a la observada con placebo.
|
Tabla 3 |
||
|
Reacciones adversas |
Rosuvastatina 10 mg |
Placebo |
|
Mareo |
7.8 |
7.6 |
|
Mialgia |
5.4 |
5.2 |
|
Dolor de cabeza |
3.5 |
2.5 |
|
Náuseas |
3.5 |
3.2 |
|
Artralgia |
2.8 |
2.7 |
|
Fatiga |
2.8 |
2.1 |
CRESTOR® es efectivo en una amplia variedad de poblaciones de pacientes con hipercolesterolemia, con y sin hipertrigliceridemia, independientemente de la raza, sexo o edad en poblaciones especiales como diabéticos o pacientes con hipercolesterolemia familiar.
En otro estudio controlado llamado ASTEROID (A Study To Evaluate the Effect of Rosuvastatin On Intravascular ultrasound-Derived coronary atheroma burden (Un estudio para evaluar el efecto de la rosuvastatina sobre la carga de ateroma coronario, obtenido por ultrasonido intravascular ), diseñado para evaluar el efecto de la rosuvastatina sobre la placa de ateroma, se produjo una reducción significativa de la aterosclerosis en los pacientes tratados con rosuvastatina 40 mg, demostrada a través de IVUS (ultrasonido intravascular). En el estudio ASTEROID, los pacientes que recibieron rosuvastatina alcanzaron una reducción más amplia del LDL-C (-53%), como también un incremento sustancial en el HDL-C(+15%), no observado previamente en un estudio con estatinas sobre el progreso de la aterosclerosis. En este estudio de 2 años, se demostró que la rosuvastatina es bien tolerada.
En el estudio de Justificación para el Uso de Estatinas en Prevención primaria: Un Estudio Intervencional Evaluando la Rosuvastatina (Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin [JUPITER]), se evaluó el efecto de CRESTOR® (rosuvastatina cálcica) sobre la ocurrencia de eventos mayores de enfermedad cardiovascular aterosclerótica (CV) en 17.802 hombres (=50 años) y mujeres (=60 años) quienes no tenían enfermedad cardiovascular establecida, niveles de LDL-C <130 mg/dL (3.3 mmol/l) y niveles de PCR-hs =2 mg/L. La población del estudio tenía un riesgo basal de enfermedad coronaria estimado de 11.3% durante 10 años, basado en los criterios de riesgo de Framingham, e incluyó un alto porcentaje de pacientes con factores de riesgo adicionales, tales como hipertensión (58%), niveles bajos de HDL-C (23%), consumo de cigarrillo (16%) o una historia familiar de enfermedad coronaria prematura (EC) (12%). Los participantes en el estudio fueron asignados aleatoriamente a recibir placebo (n=8901) o rosuvastatina 20 mg una vez al día (n=8901) y fueron seguidos durante un tiempo promedio de 2 años.
El punto final primario fue un punto final compuesto consistente del tiempo hasta la primera ocurrencia de alguno de los siguientes eventos CV: Muerte CV, infarto del miocardio no fatal, ataque cerebrovascular no fatal, angina inestable o procedimiento de revascularización arterial.
La rosuvastatina redujo significativamente el riesgo de eventos CV (252 eventos en el grupo placebo vs. 142 eventos en el grupo rosuvastatina), con una reducción estadísticamente significativa(p<0.001) del riesgo relativo de 44% (véase Figura 1). El beneficio fue aparente dentro de los primeros 6 meses de tratamiento. La reducción del riesgo fue coherente a través de múltiples subgrupos de población predefinidos, con base en evaluaciones de la edad, sexo, raza, estatus de tabaquismo, historia familiar de EC prematura, índice de masa corporal, niveles de LDL-C, HDL-C o PCR-hs en el momento del ingreso al estudio. Se produjo una reducción estadísticamente significativa de 48% en el punto final combinado de muerte CV, ataque cerebrovascular e infarto del miocardio (HR: 0.52, CI 95%: 0.40-0.68, p<0.001), una reducción de 54% en el infarto del miocardio fatal o no fatal (HR: 0.46, CI 95%: 0.30-0.70) y una disminución de 48% en el ataque cerebrovascular fatal o no fatal. La mortalidad total se redujo un 20% en el grupo rosuvastatina (HR: 0.80, CI 95%: 0.67- 0.97, p=0.02).
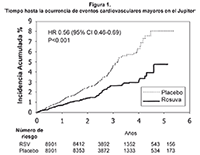
El perfil de seguridad para los individuos que estaban tomando rosuvastatina 20 mg fue generalmente similar al de aquellos que estaban recibiendo placebo. El 1.6% de participantes tratados con rosuvastatina y 1.8% de quienes estaban recibiendo placebo se retiraron del estudio debido a un evento adverso, independientemente de causalidad del tratamiento. Las reacciones adversas más comunes que condujeron a descontinuación del tratamiento fueron: Mialgia (0.3% rosuvastatina, 0.2% placebo), dolor abdominal (0.03% rosuvastatina, 0.02% placebo) y erupción cutánea (rash) (0.03% rosuvastatina, 0.03% placebo). Las reacciones adversas reportadas en =2% de los pacientes y a un índice mayor o igual al observado con placebo fueron mialgia (7.6% rosuvastatina, 6.6% placebo), constipación (3.3% rosuvastatina, 3.0% placebo) y náuseas (2.4% rosuvastatina, placebo, 2.3%).
En el JUPITER, se produjo un incremento estadísticamente significativo en la frecuencia de diabetes mellitus reportada por los investigadores; 2.8% de los pacientes en el grupo rosuvastatina y 2.3% de lo s pacientes en el grupo placebo (HR: 1.27, CI 95%: 1.05-1.53, p=0.015). La diferencia entre los grupos de tratamiento (rosuvastatina versus placebo) en el cambio promedio en la HbA1c desde el nivel inicial fue de aproximadamente 0.1%. Un análisis post hoc de este estudio sugiere que el riesgo de desarrollar diabetes mientras se recibe tratamiento con rosuvastatina se limita a los pacientes que ya están en riesgo elevado de desarrollar diabetes. Los beneficios cardiovasculares y sobre la mortalidad, provistos por el tratamiento con rosuvastatina, superaron el riesgo de diabetes en la población del estudio como un todo, asi como también en los participantes en riesgo incrementado de desarrollar diabetes (véanse secciones Advertencias y precauciones y Efectos indeseables).
Niños y adolescentes con hipercolesterolemia: En un estudio doble-ciego, aleatorizado, multicéntrico, placebo-controlado, de 12 semanas (n=176, 97 hombres y 79 mujeres), con un seguimiento de 40 semanas (n=173, 96 hombres y 77 mujeres), abierto, de fase de titulación de la dosis de rosuvastatina, pacientes de 10-17 años de edad (Estadio Tanner II-V, mujeres por lo menos con 1 año de post-menarquia) con hipercolesterolemia familiar heterocigótica, recibieron rosuvastatina 5, 10 o 20 mg, o placebo diariamente, por 12 semanas y luego, todos recibieron rosuvastatina diariamente, por 40 semanas. Al ingresar al estudio, aproximadamente el 30% de los pacientes tenía 10-13 años y alrededor del 17%, 18%, 40%, y 25% estaban en estadio Tanner II, III, IV, y V respectivamente.
La rosuvastatina redujo los niveles de LDL-C (punto final primario), colesterol total y ApoB. En la Tabla 4 se muestran los resultados.
|
Tabla 4. Efectos de la rosuvastatina sobre la modificación de los lípidos, en niños y adolescentes con hipercolesterolemia familiar heterocigótica (cambio porcentual promedio de mínimos cuadrados a partir del nivel basal hasta la semana 12) |
||||||||
|
Dosis (mg) |
N |
LDL-C |
HDL-C |
C-total |
TG |
No-HDL-C |
ApoB |
ApoA-1 |
|
Placebo |
46 |
-0.7 |
6.9 |
-0.0 |
5.1 |
-0.9 |
-1.7 |
2.8 |
|
5 |
42 |
-38.3 |
4.2 |
-29.9 |
0.3 |
-36.1 |
-31.7 |
1.8 |
|
10 |
44 |
-44.6 |
11.2 |
-34.2 |
-13.6 |
-43.0 |
-38.1 |
5.4 |
|
20 |
44 |
-50.0 |
8.9 |
-38.7 |
-8.1 |
-47.5 |
-40.7 |
4.0 |
Al final del periodo de 40 semanas, abierto, con titulación hasta obtener la meta, y dosificación hasta un máximo de 20 mg una vez al día, 70 de 173 pacientes (40.5%) habían logrado la meta del LDL-C de menos de 110 mg/dL (2.8 mmol/L).
Después de 52 semanas del tratamiento en estudio, no se detectó ningún efecto sobre el crecimiento ni sobre la maduración sexual (ver sección Advertencias y precauciones).
La rosuvastatina también se analizó en un estudio abierto de 2 años, de titulación hasta la meta, en 198 niños con hipercolesterolemia familiar heterocigota, con edad de 6 a 17 años (88 varones y 110 mujeres, estadio Tanner <II-V). La dosis inicial para todos los pacientes fue 5 mg de rosuvastatina una vez al día. Los pacientes de 6 a 9 años de edad (n=64) podían titular la dosis hasta un máximo de 10 mg una vez al día, y los pacientes de 10 a 17 años (n=134) hasta una dosis máxima de 20 mg una vez al día.
Después del tratamiento, 74 de 197 pacientes (37.6%) de este estudio alcanzaron la meta para el LDL-C de menos de 110 mg/dL (2.8 mmol/L). Todos los grupos de edad mostraron reducciones significativas en el LDL-C desde los valores iniciales.
Rosuvastatina 5 mg, 10 mg, y 20 mg también lograron cambios promedio estadísticamente significativos desde el valor inicial para las siguientes variables secundarias de lípidos y lipoproteíneas: HDL-C, colesterol total (TC), colesterol no HDL (non-HDL C), LDL-C/HDL-C, TC/HDL-C, triglicéridos (TG)/HDL-C, non-HDL C/HDL-C, ApoB, ApoB/ApoA-1.
Todos estos cambios fueron en dirección al mejoramiento de las respuestas lipídicas, y se mantuvieron durante 2 años.
No se detectó ningún efecto sobre el crecimiento o la maduración sexual después de 24 meses de tratamiento.
ADVERTENCIAS Y PRECAUCIONES
Efectos renales: Se ha observado proteinuria (principalmente de origen tubular y detectada con tiras reactivas) en pacientes tratados con dosis altas de CRESTOR®, en particular con 40 mg; este efecto es transitorio o intermitente en la mayoría de los casos. Se ha demostrado que la proteinuria no implica una patología renal aguda o progresiva (ver sección Efectos indeseables). Durante el uso post mercadeo se ha encontrado que la tasa de reportes de eventos renales serios es más alta en la dosis de 40 mg La observación periódica de los pacientes tratados con la dosis de 40 mg debe incluir pruebas de la función renal (ver sección Contraindicaciones).
Musculoesquelético: Al igual que con otros inhibidores de la HMG-CoA reductasa, se han reportado efectos en el músculo esquelético, por ejemplo, mialgia, miopatía y, raramente, rabdomiólisis en pacientes tratados con rosuvastatina. Al igual que con otros inhibidores de la HMG-CoA reductasa, durante el uso post mercadeo se ha encontrado que la tasa de reportes de rabdomiólisis asociada con CRESTOR® es mayor que con la dosis más alta comercializada.
A los pacientes que desarrollen cualquier signo o síntoma sugestivo de miopatía se les deben medir los niveles de CK. El tratamiento con CRESTOR® debe ser descontinuado si los niveles de CK están marcadamente elevados (>10xULN) o si se diagnostica o se sospecha miopatía. Se han producido reportes muy raros de miopatía necrotizante mediada por el sistema inmune, clínicamente caracterizada por debilidad muscular proximal persistente y creatinina sérica elevada durante el tratamiento o después de descontinuar las estatinas, incluyendo rosuvastatina. Es posible que se requieran pruebas neuromusculares y serológicas adicionales. Puede ser necesario el tratamiento con agentes inmunosupresores.
En los estudios de CRESTOR®, no hubo evidencia de efectos musculoesqueléticos aumentados cuando se dosificó CRESTOR® con cualquier otro tratamiento concomitante. Sin embargo, se ha observado un aumento en la incidencia de miositis y miopatía en pacientes que están recibiendo otros inhibidores de HMG-CoA reductasa junto con ciclosporina, derivados de ácido fíbrico (incluyendo gemfibrozil), ácido nicotínico, antimicóticos azólicos y antibióticos macrólidos.
CRESTOR® se debe prescribir con precaución en pacientes con factores predisponentes a miopatía, tales como daño renal, edad avanzada e hipotiroidismo, o situaciones en las cuales pueda ocurrir aumento en los niveles plasmáticos (ver secciones Interacciones con otros medicamentos y otras formas de interacción y Propiedades farmacocinéticas).
CRESTOR® se debe retirar temporalmente en cualquier paciente con una condición aguda seria sugestiva de miopatía o que predisponga al desarrollo de falla renal secundaria a rabdomiólisis (por ej., sepsis, hipotensión, cirugía mayor, trauma, trastornos metabólicos, endocrinos y electrolíticos severos; o convulsiones no controladas).
Diabetes mellitus: De igual manera que con otros inhibidores de HMG-CoA reductasa, se han observado incrementos en la HbA1c y en los niveles séricos de glucosa en pacientes tratados con rosuvastatina, y en algunos casos, estos incrementos pueden superar el umbral para el diagnóstico de diabetes mellitus, principalmente en pacientes que ya están en riesgo elevado de desarrollar diabetes (ver secciones Efectos indeseables y Propiedades farmacodinámicas).
Efectos hepáticos: Como otros inhibidores de la HMG-CoA reductasa, CRESTOR® debe utilizarse con precaución en los pacientes alcohólicos y/o que tienen antecedentes de hepatopatía. Se recomienda efectuar pruebas de la función hepática antes de empezar el tratamiento con CRESTOR®, así como 3 meses después. Si las concentraciones séricas de transaminasas aumentan a más de 3 veces el límite superior normal, debe suspenderse el tratamiento con CRESTOR® o reducirse la dosis del mismo. Durante el uso post mercadeo se ha encontrado que la tasa de reportes de eventos hepáticos serios (consistentes principalmente en un incremento de las transaminasas hepáticas), es más alta en la dosis de 40 mg.
En los pacientes con hipercolesterolemia secundaria provocada por hipotiroidismo o síndrome nefrótico, debe tratarse la enfermedad subyacente antes de empezar el tratamiento con CRESTOR®.
Raza: Estudios farmacocinéticos han demostrado un aumento de la exposición en sujetos asiáticos con respecto a sujetos de raza blanca (ver sección Dosis y vía de administración y Propiedades farmacocinéticas).
Niños y adolescentes de 6 a 17 años de edad: La evaluación del crecimiento lineal (talla), peso, IMC (índice de masa corporal), y características secundarias de maduración sexual por medio del estadiaje de Tanner en pacientes pediátricos que estén tomando rosuvastatina está limitada a un periodo de dos años (ver sección Propiedades farmacocinéticas).
DOSIS Y VIA DE ADMINISTRACIÓN: El rango de dosis usual es de 10-40 mg por vía oral una vez al día.
La dosis de CRESTOR® debe individualizarse en función del objetivo terapéutico y de la respuesta del paciente. La mayoría de pacientes son controlados con la dosis inicial. Sin embargo, si es necesario, se pueden hacer ajustes de la dosis en intervalos de 2 a 4 semanas (ver sección Propiedades farmacodinámicas).
CRESTOR® puede administrarse a cualquier hora del día, con o sin alimentos.
Adultos
Hipercolesterolemia primaria (incluyendo hipercolesterolemia familiar heterocigota), dislipidemia mixta, y prevención de eventos cardiovasculares: La dosis inicial recomendada es de 10 mg por vía oral una vez al día. Una dosis inicial de 5 mg está disponible para las poblaciones especiales de pacientes.
Para pacientes con hipercolesterolemia severa (incluyendo hipercolesterolemia familiar heterocigótica) o aquellos con metas agresivas para los lípidos, se puede considerar la posibilidad de una dosis inicial de 20 mg.
Hipercolesterolemia familiar homocigota: Para pacientes con hipercolesterolemia familiar homocigota se recomienda una dosis inicial de 20 mg al día.
Niños y adolescentes de 6 a 17 años de edad
• En niños de 6 a 9 años de edad con hipercolesterolemia familiar heterocigota, el rango de dosificación usual es de 5-10 mg vía oral, una vez al día. En esta población no se ha estudiado la seguridad y eficacia de dosis mayores a 10 mg.
• En niños de 10 a 17 años de edad con hipercolesterolemia familiar heterocigota, el rango de dosificación usual es de 5-20 mg vía oral, una vez al día. En esta población no se ha estudiado la seguridad y eficacia de dosis mayores a 20 mg.
La dosis se debe ajustar de manera apropiada para alcanzar la meta del tratamiento.
La experiencia pediátrica se limita a un reducido número de niños (mayores de 8 años) con hipercolesterolemia familiar homocigota.
Poblaciones especiales:
Pacientes de edad avanzada: Se recomienda una dosis inicial de 5 mg en pacientes de más de 70 años (ver sección Advertencias y precauciones). No es necesario ningún otro ajuste de la dosis en función de la edad.
Insuficiencia renal: No es necesario ajustar la dosis en los pacientes con insuficiencia renal leve a moderada. Se recomienda una dosis inicial de 5 mg en los pacientes con insuficiencia renal moderada (depuración de creatinina <60 mL/min). La dosis de 40 mg está contraindicada en los pacientes con insuficiencia renal moderada. Todas las dosis de CRESTOR® están contraindicadas en los pacientes con insuficiencia renal grave (ver sección Contraindicaciones y sección Propiedades farmacocinéticas).
Insuficiencia hepática: Mientras que la exposición sistémica a la rosuvastatina no aumentó en sujetos con índices de Child-Pugh de 7 o menos, se ha observado un aumento en sujetos con índices de Child-Pugh de 8 y 9 (ver sección Propiedades farmacocinéticas). En estos pacientes debe considerarse una evaluación de la función renal (ver sección Advertencias y precauciones). Se carece de experiencia en sujetos con índices de Child-Pugh superiores a 9. CRESTOR® está contraindicado en pacientes con enfermedad hepática activa (ver sección Contraindicaciones).
Raza: Se recomienda una dosis inicial de 5 mg en pacientes de ascendencia asiática. Se ha observado una mayor exposición sistémica en sujetos asiáticos (ver sección Advertencias y precauciones y sección Propiedades farmacocinéticas). Se debe tener en cuenta la exposición sistémica aumentada al tratar pacientes asiáticos cuya hipercolesterolemia no esté adecuadamente controlada a dosis hasta de 20 mg/diarios.
Polimorfismos genéticos: Se ha demostrado que los genotipos de SLCO1B1 (OATP1B1) c.521CC y ABCG2 (BCRP) c.421AA están asociados con un incremento en la exposición a rosuvastatina (ABC) comparados con SLCO1B1 c.521TT y ABCG2 c.421CC. Para los pacientes de quienes se sabe que tienen el genotipo c.521CC o c.421AA, se recomienda una dosis máxima de 20 mg de CRESTOR® una vez al día (véanse secciones Advertencias y precauciones, Interacción con otros medicamentos y otras formas de interacción y Propiedades farmacocinéticas).
Terapia concomitante: Rosuvastatina es un sustrato de varias proteínas transportadoras (por ej., OATP1B1 y BCRP). El riesgo de miopatía (incluyendo rabdomiólisis) está aumentado cuando se administra CRESTOR® concomitantemente con ciertos productos medicinales que pueden incrementar la concentración plasmática de rosuvastatina debido a interacciones con estas proteínas transportadoras (por ej., ciclosporina y ciertos inhibidores de proteasa, incluyendo combinaciones de ritonavir con atazanavir, lopinavir, y/o tipranavir; véanse secciones Advertencias y precauciones y Interacción con otros medicamentos y otras formas de interacción). Se recomienda a los médicos que lo prescriben, consultar la información relevante del producto cuando consideren la posibilidad de administrar dichos fármacos simultáneamente con CRESTOR®. En cuanto sea posible, se deben considerar medicaciones alternativas, y si fuera necesario, considerar la posibilidad de descontinuar temporalmente el tratamiento con CRESTOR®. En situaciones en las cuales la coadministración de estos productos medicinales con CRESTOR® es inevitable, se debe considerar cuidadosamente el beneficio y riesgo del tratamiento concurrente y la posibilidad de ajustar la dosis de CRESTOR® (véase sección Interacción con otros medicamentos y otras formas de interacción).
SOBREDOSIS: No existe un tratamiento específico en caso de sobredosis. En caso de sobredosis, el paciente debe recibir un tratamiento sintomático y las medidas de apoyo que convengan. La hemodiálisis no aportará probablemente ningún beneficio.
PRESENTACIÓN: CRESTOR® 5 mg: Caja por 10, 20, 28 y 30 tabletas recubiertas. (Reg. San. INVIMA 2007M-0007101).
CRESTOR® 10 mg: Caja por 7, 10, 14, 20, 28 y 30 tabletas recubiertas. (Reg. San. INVIMA 2014M-0003229-R1).
CRESTOR® 20 mg: Caja por 7, 10, 14, 20, 28 y 30 tabletas recubiertas. (Reg. San. INVIMA 2014M-0003173-R1).
CRESTOR® 40 mg: Caja por 7, 14 y 28 tabletas recubiertas. (Reg. San. INVIMA 2008M-0007976).
Venta con fórmula médica. Mantener fuera del alcance de los niños.
CRESTOR® es una marca registrada del Grupo AstraZeneca.
©AstraZeneca 2003-2015.
Fecha de revisión del texto: 23 de Julio de 2015.
Fecha de preparación de la versión: Enero de 2016.
Clave 1-2016.
Fuente: Doc ID-001393228 Versión 9.0
Traducción de: Doc ID-001394556 Versión 12.0
Mayor información Departamento Médico de
AstraZeneca Colombia S.A.S.
Bogotá, D. C., Colombia