
CAVERJECT
ALPROSTADIL
Inyectable
Inyectable, 10 y 20 mcg
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Ingredientes Activos:
Nombre establecido: Alprostadil, Prostaglandina E1, PGE1
Nombre internacional (INN): Alprostadil (Alprostadilum = forma latinizada)
Nombre EEUU (USAN): Alprostadil
No, de registro CAS: 745-65-3
Nombre Codificado: PNU-10136 (reemplaza a U-10136)
QUÍMICA: El Alprostadil es un polvo cristalino de blanco a blancuzco con un punto de fusión entre 115 °C-116 °C. Su solubilidad a 35 °C es de 8000 microgramos por 100 mililitros de agua bidestilada. La constante de disociación del ácido (Ka) es aproximadamente 1.1 X 10-5. Su nombre químico es ácido (11a,13E,15S)-11,15-dihidroxi-9-oxoprost-13-en-1-oico. Peso molecular: 354.49. La fórmula estructural del alprostadil es:
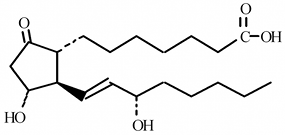
Carbonos asimétricos: 4 Carbonos quirales
Rotación óptica: -66° a 25 °C (10 mg del lote 570AU por ml de etanol al 95%)
Isomerismo Cis-trans: 13, 14 trans
CAVERJECT Polvo Estéril se encuentra disponible en las siguientes potencias |
|
Potencia (mcg) |
Concentración de alprostadil luego de la reconstitución de la manera indicada (mcg/ml) |
Contenido total de alprostadil / vial (mcg) |
|
5 |
5 |
6.15 |
|
10 |
10 |
11.9 |
|
20 |
20 |
23.2 |
|
40 |
40 |
46.4 |
|
*símbolo apropiado de marca comercial |
||
FARMACOLOGÍA / TOXICOLOGÍA: Se realizó en monos Cynomolgus un estudio de irritancia de un año de duración los cuales recibieron inyecciones intracavernosas dos veces a la semana con ya sea vehículo o 3 u 8.25 microgramos de alprostadil por inyección. Se inyectaron cierto número de monos adicionales en la forma descrita previamente con la salvedad de que en este último caso los monos recibieron múltiples dosis durante las semanas 44, 48, y 52. Los monos de los dos grupos se retuvieron para un periodo de recuperación de 4 semanas. No se observaron evidencias de irritancia peniana o lesiones en tejidos no penianos asociados con el uso de la droga, o que pudieran estar directamente relacionados con el alprostadil. La irritancia, la cual se observó tanto en el grupo de control como en los monos tratados, se consideró como el resultado del procedimiento de inyección en sí, y todas las lesiones detectadas demostraron ser reversibles. Al final del periodo de recuperación de 4 semanas, ya se habían revertido los cambios histológicos en el pene.
INDICACIONES TERAPÉUTICAS: CAVERJECT está indicado para el tratamiento de la disfunción eréctil de etiología neurogénica, vasculogénica, psicogénica, o combinada.
CAVERJECT puede constituir un complemento útil de otras pruebas diagnósticas en el diagnóstico de la disfunción eréctil.
CAVERJECT no está indicado para el uso pediátrico (ver Advertencias Especiales y Precauciones para Su Uso, alcohol bencílico).
MECANISMO DE ACCIÓN: El alprostadil es la forma en que la prostaglandina E1 (PGE1) se encuentra normalmente en la naturaleza. El alprostadil posee una amplia variedad de acciones farmacológicas, entre las cuales, la vasodilatación y la inhibición de la agregación plaquetaria se encuentran entre las más notables. En la mayoría de las especies animales sometidas a prueba, el alprostadil relajó el retractor penis y el corpus cavernosum uretrae in vitro. El alprostadil también relajó preparaciones aisladas del cuerpo cavernoso y esponjoso humanos, así como también segmentos arteriales cavernosos contraídos in vitro ya sea con noradrenalina o con PGF2a. En macacos (Macaca nemestrina), el alprostadil incrementó in vivo el flujo sanguíneo arterial cavernoso. El grado y duración de la relajación del músculo liso cavernoso en este modelo animal fue dosis dependiente.
El alprostadil induce la erección por relajación de la musculatura lisa trabecular y por dilatación de las arterias cavernosas. Esto conduce a la expansión de los espacios lacunares y al atrapamiento de la sangre por compresión de las vénulas contra la túnica albugínea, un proceso conocido como mecanismo veno-oclusivo corporal.
PROPIEDADES FARMACOCINÉTICAS
ADME
Absorción: Para el tratamiento de la disfunción eréctil, el alprostadil se administra a través de inyección en el cuerpo cavernoso. No se ha determinado aún la biodisponibilidad absoluta del alprostadil.
Distribución: Luego de la inyección intracavernosa de 20 microgramos de alprostadil, las concentraciones plasmáticas periféricas promedio del alprostadil 30 y 60 minutos después de la inyección (89 y 102 picogramos/mililitros, respectivamente) no fueron significativamente mayores a los niveles iniciales de referencia del alprostadil endógeno (96 picogramos/mililitros). El alprostadil se liga en el plasma fundamentalmente a la albúmina (81% de ligamiento) y en un menor grado a la fracción IV-4 de a-globulinas (55% de ligamiento). No se observó un ligamiento significativo a los eritrocitos ni a los leucocitos.
Metabolismo: El alprostadil es rápidamente transformado a compuestos que luego son adicionalmente metabolizados antes de la excreción. Después de la administración intravenosa, aproximadamente el 80% del alprostadil circulante sufre metabolismo de un solo paso en los pulmones, fundamentalmente mediante las oxidaciones beta y omega. En consecuencia, toda cantidad de alprostadil que entre a la circulación sistémica luego de la inyección intracavernosa será muy rápidamente metabolizada. Los metabolitos primarios del alprostadil son la 15-ceto-PGE1, 15-ceto-13,14-dihidro-PGE1, y la 13,14-dihidro-PGE1. En contraste con lo ocurre con los metabolitos 15-ceto-PGE1 y 15-ceto-13,14-dihidro-PGE1, los cuales carecen casi por completo de actividad biológica, se ha demostrado que el metabolito 13,14-dihidro-PGE1 reduce la presión sanguínea e inhibe la agregación plaquetaria. Una vez realizada la administración intravenosa o intraarterial del alprostadil, los niveles de este último metabolito estuvieron en el mismo orden de magnitud que el de la PGE1, mientras que los niveles del metabolito 15-ceto-13,14-dihidro-PGE1, el metabolito circulante mayoritario, fueron superiores en más de 10 veces. Los niveles plasmáticos del metabolito 15-ceto-PGE1 permanecieron indetectables durante todo el periodo de observación. Luego de la inyección intracavernosa de 20 microgramos de alprostadil, los niveles periféricos del metabolito circulante principal, la 13,14-dihidro-15-oxo-PGE1, se incrementaron hasta llegar a su máximo 30 minutos después de la inyección y regresaron a los niveles predosificación hacia los 60 minutos después de la inyección mientras que los niveles periféricos de alprostadil no fueron significativamente superiores a los niveles iniciales. No se determinaron las concentraciones plasmáticas del metabolito 13,14-dihidro-PGE1.
Eliminación: Los metabolitos del alprostadil se excretan fundamentalmente en el riñón, en donde casi el 90% de una dosis intravenosa administrada se excreta en la orina dentro de las 24 horas siguientes a su dosificación. La porción restante de la dosis se excreta en las heces. No existe evidencia de retención del alprostadil o sus metabolitos en los tejidos luego de la administración intravenosa. En hombres sanos, el 70% - 90% del alprostadil es ampliamente eliminado y metabolizado en un solo paso a través de los pulmones, dando lugar a una vida media metabólica inferior a un minuto.
PROPIEDADES FARMACODINÁMICAS
Clase terapéutica
Clasificación AHFS: 24:12, Agente vasodilatador
Clasificación ATC: (Pendiente)
USAN: Vasodilatador
FARMACOCINÉTICA DE SUBPOBLACIONES
Efectos de la edad o raza: No se ha evaluado el efecto potencial de la edad o la raza sobre la farmacocinética del alprostadil luego de su uso intracavernoso.
Efecto del deterioro renal o hepático: El metabolismo pulmonar de primer paso es el factor primordial que influencia la depuración sistémica del alprostadil. Aunque la farmacocinética del alprostadil no se ha estudiado formalmente en pacientes con insuficiencia renal o hepática, no se espera que las alteraciones en la función renal o hepática tengan algún efecto importante en la farmacocinética del alprostadil.
FORMA FARMACÉUTICA: Polvo estéril para inyección de uso intracavernoso
PARTICULARIDADES FARMACÉUTICAS: Incompatibilidades: Para reconstituir el polvo estéril de CAVERJECT, deberá usarse únicamente el diluente incluido con el producto o, agua para inyección bacteriostática junto con alcohol bencílico.
CONTRAINDICACIONES
CAVERJECT está contraindicado en los siguientes pacientes:
• Pacientes con hipersensibilidad conocida al medicamento
• Pacientes que presenten condiciones que puedan predisponerlos al priapismo, tales como anemia de células falciformes o recesivas, múltiple mieloma, o leucemia
• Pacientes con deformación anatómica del pene, tales como angulación, fibrosis cavernosa, o enfermedad de Peyronie
• Pacientes con implantes penianos
• Pacientes para quienes la actividad sexual no resulta aconsejable o está contraindicada
USO DURANTE EL EMBARAZO Y LA LACTANCIA: No aplicable.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR VEHÍCULOS Y MANEJAR MAQUINARIA: Ninguna conocida.
EFECTOS INDESEABLES: La reacción adversa que se presenta con mayor frecuencia luego de la inyección intracavernosa de CAVERJECT es el dolor peniano de leve a moderado, reportado en aproximadamente el 11% de las auto-inyecciones efectuadas por hombres que participaron en estudios clínicos. Dicho dolor fue reportado por lo menos una sola vez por aprox. un tercio de todos los pacientes, aunque únicamente el 3% de éstos suspendió el uso por tal razón. La fibrosis peniana, incluyendo la angulación, nódulos fibróticos, y la enfermedad de Peyronie, fue reportada en el 3% del total de pacientes del estudio clínico, sin embargo, en un estudio de auto-inyección en el que la duración de uso fue de hasta 18 meses, la incidencia de fibrosis peniana fue de aproximadamente 8% (véase Advertencias y precauciones especiales para su uso).
En estudios clínicos, se presentaron hematomas y equimosis en el sitio de inyección en el 3% y 2% de los pacientes, respectivamente; eventos adversos los cuales estuvieron relacionados con la técnica de inyección más no con los efectos propios del CAVERJECT. Erecciones prolongadas (definidas como aquellas erecciones de cuatro a seis horas de duración) después de la administración intracavernosa de CAVERJECT, fueron reportadas en el 4% de los pacientes. La frecuencia del priapismo (definido como una erección con una duración de 6 horas o más) fue del 0.4% (véase Advertencias y precauciones especiales para su uso). En la mayoría de los casos, el priapismo se resolvió con detumescencia espontánea.
Las siguientes reacciones adversas locales fueron reportadas por menos del 1% de los pacientes en estudios clínicos después de la inyección intracavernosa de CAVERJECT: balanitis, hemorragia en el sitio de inyección, inflamación en el sitio de inyección, ardor en el sitio de inyección, hinchazón en el sitio de inyección, edema en el sitio de inyección, sangrado uretral, acaloramiento peniano, entumecimiento, infección por levaduras, irritación, sensibilidad, fimosis, prurito, eritema, fuga venosa, erección dolorosa, y eyaculación anormal.
Los siguientes eventos sistémicos, juzgados por el investigador como posiblemente relacionados con el uso de CAVERJECT, fueron reportados por menos del 1% de los pacientes en estudios clínicos: dolor testicular, trastorno escrotal (enrojecimiento, dolor, espermatocele), edema escrotal, hematuria, trastorno testicular (acaloramiento, hinchazón, formación de masas, engrosamiento) micción alterada, micción frecuente, urgencia urinaria, dolor pélvico, hipotensión, vasodilatación, trastorno vascular periférico, extrasístole supraventricular, reacciones vasovagales, hipoestesia, debilidad no generalizada, diaforesis, elevaciones cutáneas, prurito en sitios diferentes al de aplicación, náuseas, resequedad en la boca, elevación de la creatinina sérica, calambres en las piernas, y midriasis.
Se observaron durante estudios clínicos cambios hemodinámicos, manifestados en la forma de disminuciones en la presión sanguínea, cuando se emplearon dosis superiores a 20 microgramos, como también incrementos en la frecuencia cardiaca con el uso de dosis mayores a 30 microgramos, cambios los cuales fueron al parecer dosis dependientes. Sin embargo, tales cambios no fueron, en términos generales, clínicamente importantes, y apenas tres pacientes suspendieron el tratamiento debido a hipotensión sintomática.
CAVERJECT no produce ningún efecto clínicamente importante sobre las pruebas de laboratorio que se realicen en suero u orina.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: No se ha estudiado formalmente el potencial de desarrollo de interacciones medicamentosas de orden farmacocinético entre CAVERJECT y otros agentes. En estudios clínicos, el uso concomitante de agentes tales como drogas antihipertensoras, diuréticos, agentes antidiabéticos (incluyendo insulina), o agentes antiinflamatorios no esteroidales, no tiene efecto alguno sobre la seguridad y eficacia de CAVERJECT. Tampoco se ha estudiado de manera sistemática la seguridad y eficacia de combinaciones de CAVERJECT con otros agentes vasoactivos.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES PARA SU USO
Advertencias y precauciones generales
Antes de iniciar la terapia con CAVERJECT, deberán diagnosticarse las causas médicas subyacentes de la disfunción eréctil que sean susceptibles de tratamiento.
Puede ocurrir priapismo (erección prolongada por más de seis horas) luego de la administración intracavernosa de CAVERJECT. A fin de minimizar los riesgos, el médico deberá seleccionar la dosis efectiva más baja y suministrar instrucciones a los pacientes para que de manera inmediata consulten a sus médicos y busquen asistencia médica en caso de presentarse cualquier erección prolongada que dure más de 4 horas. El tratamiento del priapismo deberá implementarse con base en la práctica médica establecida.
Puede desarrollarse fibrosis peniana, incluyendo angulación, nódulos fibróticos, y enfermedad de Peyronie, luego de la administración intracavernosa de CAVERJECT. La ocurrencia de fibrosis, puede incrementarse con el uso prolongado de CAVERJECT. Se encuentra altamente recomendado efectuar un seguimiento programado basado en exámenes físicos del pene, a fin de detectar signos de fibrosis peniana o de la enfermedad de Peyronie. El tratamiento con CAVERJECT deberá discontinuarse en pacientes que desarrollen angulación peniana, fibrosis cavernosa, o enfermedad de Peyronie.
Debido a que puede ocurrir un pequeño sangrado en el sitio de inyección, los pacientes deberán recibir asesoría acerca de las medidas de protección necesarias para contrarrestar la propagación de enfermedades de transmisión sexual, incluyendo VIH, y enfermedades de contagio sanguíneo. Los pacientes bajo terapia con anticoagulantes, tales como warfarina o heparina, pueden exhibir una incrementada propensión a sangrar luego de la aplicación de la inyección intracavernosa.
El preservante alcohol bencílico se ha relacionado con eventos adversos graves, incluido el “síndrome del jadeo” y la muerte en pacientes pediátricos. Se desconoce la cantidad mínima de alcohol bencílico que puede generar toxicidad. El riesgo de la toxicidad del alcohol bencílico depende de la cantidad administrada y de la capacidad hepática para detoxificar el químico. Los bebés prematuros y de bajo peso pueden ser más propensos a desarrollar toxicidad.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN
Información general: CAVERJECT se administra mediante inyección intracavernosa directa. Se recomienda el uso de una aguja de ½ pulgada con un calibre de 27 a 30. La dosis de CAVERJECT deberá individualizarse mediante la cuidadosa titulación de la dosis bajo estricta supervisión médica.
Las primeras inyecciones de CAVERJECT deberán efectuarse en el consultorio del médico por parte de profesionales de la salud debidamente entrenados. La terapia de inyección aplicada por el paciente podrá comenzar únicamente después de que el paciente haya sido adecuadamente instruido y bien entrenado en la técnica de inyección. El médico deberá hacer una cuidadosa valoración de las destrezas y competencia del paciente para efectuar dicho procedimiento. La inyección intracavernosa deberá hacerse bajo condiciones estériles. El sitio de inyección se encuentra usualmente a lo largo de cualquier área dorso-lateral del tercio proximal del pene. Deben evitarse las venas visibles. El usuario debe alternar el lado del pene a cada nueva inyección y variar el sitio de inyección.
Las soluciones reconstituidas de CAVERJECT están diseñadas para un único uso. Deseche después de su uso. El médico deberá instruir al usuario en cuanto a la correcta disposición (desechado) de la jeringa, aguja, y vial o ampolleta.
Titulación inicial de la dosis en el consultorio del médico: Durante la titulación de la dosis, el paciente debe permanecer en el consultorio del médico hasta que ocurra la completa detumescencia. Si no hay respuesta, la siguiente dosis más alta puede suministrarse una hora después. Si se observa una respuesta, deje por lo menos un intervalo de un día antes de administrar la siguiente dosis de prueba.
Disfunción eréctil de etiología vasculogénica, psicogénica, o combinada: La titulación de la dosificación deberá iniciarse al nivel de 2.5 microgramos de alprostadil. Si se observa una respuesta parcial, la dosis puede incrementarse en 2.5 microgramos a una dosis de 5 microgramos y luego en incrementos de 5 - 10 microgramos, dependiendo de la respuesta eréctil, hasta que se logre la dosis que produzca una erección apropiada para la relación sexual, y que no exceda de una hora de duración. Si no existe respuesta a la dosis inicial de 2.5 microgramos, la segunda dosis podrá incrementarse a 7.5 microgramos, seguida por incrementos de 5 a 10 microgramos.
Disfunción eréctil de etiología neurogénica pura (lesión de médula espinal): La titulación de la dosificación deberá iniciarse al nivel de 1.25 microgramos de alprostadil. La dosis puede incrementarse en 1.25 microgramos a una dosis de 2.5 microgramos, seguida por un incremento de 2.5 microgramos a una dosis de 5 microgramos, y luego en incrementos de 5 microgramos hasta que la dosis sea la adecuada para obtener una erección apropiada para la relación sexual y dicha erección no exceda una duración de una hora.
Terapia de Mantenimiento: Auto-inyección: La dosis de CAVERJECT que sea seleccionada para el tratamiento de auto-inyección deberá proporcionar al paciente una erección satisfactoria para la relación sexual y mantenida por no más de una hora. Si la duración de la erección supera la hora, deberá reducirse la dosis de CAVERJECT. La terapia de auto-inyección de uso en casa deberá iniciarse a la dosis que se determinó en el consultorio del médico; sin embargo, si se necesita ajustar la dosis, tal ajuste deberá únicamente realizarse después de una consulta con el médico. La dosis deberá ajustarse en concordancia con las pautas para su titulación antes descritas. La dosis efectiva más baja será la dosis que deba emplearse. La frecuencia recomendada para la inyección no debe ser mayor a tres veces por semana con por lo menos un intervalo de 24 horas entre cada dosis. El paciente puede esperar el desarrollo de una erección dentro de los 5 - 20 minutos siguientes a la aplicación de la inyección.
En un estudio de auto-inyección, no controlado, se documentó la eficacia de CAVERJECT por periodos de tiempo prolongados de hasta seis meses. La dosis promedio de alprostadil al final de los seis meses fue de 20.7 microgramos. En la mayoría de los pacientes, la dosis de mantenimiento se ubica entre 5 y 20 microgramos. No se recomienda el uso de dosis de mantenimiento superiores a 60 microgramos.
Uso de CAVERJECT como complemento en el diagnóstico de la disfunción eréctil: En las pruebas diagnósticas más sencillas de la disfunción eréctil (pruebas farmacológicas), los pacientes son objeto de un monitoreo en cuanto a la ocurrencia de una erección después de una inyección intracavernosa de CAVERJECT. Las extensiones de estas pruebas incluyen el uso de CAVERJECT a manera de complemento de las investigaciones de laboratorio, tales como el procesamiento de imágenes duplex o Doppler, las pruebas de lavado con 133Xenon, el penograma con radioisotopos, y la arteriografía peniana, las cuales permiten visualizar y valorar la vasculatura peneana. En algunas de estas pruebas, deberá usarse una sola dosis de CAVERJECT que induzca una erección de suficiente firmeza.
Recomendaciones para supervisar el tratamiento: Se recomienda hacer un seguimiento regular mientras el paciente se encuentre en el programa de auto-inyección. Esto es especialmente válido para las auto-inyecciones iniciales en la medida en que pueden necesitarse ajustes en la dosis de CAVERJECT.
SOBREDOSIFICACIÓN: No se han observado casos de sobredosificación en los estudios clínicos con CAVERJECT. En caso de que ocurra sobredosificación intracavernosa de CAVERJECT, el paciente deberá ponerse bajo supervisión médica hasta que cualquiera de los efectos sistémicos se hayan resuelto y/o hasta que ocurra la detumescencia peniana. El tratamiento sintomático de cualquiera de los síntomas sistémicos observados podría ser lo apropiado.
DETERIORO DE LA FERTILIDAD / EFECTOS SOBRE LA REPRODUCCIÓN: Los estudios de reproducción realizados en ratas indican que el alprostadil a dosis de hasta 2.0 mg/kg/día (s.c.), no afecta adversamente ni altera la espermatogénesis en ratas.
CARCINOGENICIDAD / MUTAGENICIDAD: No se han llevado a cabo estudios de carcinogenicidad de largo plazo. La siguiente batería de ensayos de mutagenicidad revelaron ausencia de potencial respecto del desarrollo de mutagénesis: mutación bacteriana (Ames), elución alcalina, micronúcleos en ratas, intercambio de cromátidas hermanas, mutación génica de avance de células CHO/HGPRT de mamíferos, y síntesis de ADN no programada (UDS).
PRESENTACIÓN
CAVERJECT 10 mcg (Reg. San. No. INVIMA 2005 M-003700-R1)
CAVERJECT 20 mcg (Reg. San. No. INVIMA 2005M-0004900)
Fecha de la ficha técnica sustituida: 02 de junio de 1997
Fecha de vigencia: 19 de diciembre de 2013
Versión de la ficha técnica: ND
PFIZER S.A.S.
PRECAUCIONES ESPECIALES PARA SU ALMACENAMIENTO
CAVERJECT Polvo Estéril
Para garantizar los límites de potencia del alprostadil (mínimo 90% de la cantidad etiquetada) y la cantidad de PGA1 (máx. 10% de la cantidad etiquetada de alprostadil), deberán proveerse las siguientes condiciones de distribución a cargo del distribuidor y de almacenamiento a cargo del paciente, así como también seguir las instrucciones de reconstitución para los viales de 5, 10, 20 y 40 microgramos. No congelar la solución reconstituida.
|
Tabla 1. Condiciones para garantizar una potencia mínima del alprostadil equivalente al 90% de la cantidad etiquetada y un límite superior de degradación a PGA1 equivalente al 10% de la cantidad etiquetada de alprostadil |
|||
|
Potencia, mcg |
Temperatura de Almacenamiento (a cargo del distribuidor) |
Temperatura Almacenamiento (a cargo del Paciente) |
Período de uso de la solución reconstituida |
|
5, 10, 20 |
25 °C, o una inferior |
25 °C, o una inferior |
Conserve hasta por 24 horas a 25 °C o una inferior |
|
40 |
Refrigere a 2 °C-8 °C |
Almacenar a 25 °C, o menos hasta por 3 meses |
Conserve hasta por 24 horas a 25 °C o una inferior |
Naturaleza y contenido de los recipientes
Polvo Estéril: CAVERJECT en su presentación de polvo estéril, se suministra en viales de vidrio de 5 mililitros y se expende con o sin jeringas de diluyente.
Instrucciones para su uso y manipulación
Los medicamentos de uso parenteral deberán inspeccionarse visualmente para descartar la presencia de partículas y decoloración antes de su administración en los casos en que la solución y el recipiente lo permitan.
CAVERJECT Polvo Estéril: Debe usarse Agua Bacteriostática para inyección o agua estéril, en ambos casos preservadas con alcohol bencílico al 0.945% p/v, como diluente para la reconstitución de CAVERJECT polvo estéril. Después de la reconstitución con 1 mililitro de diluente, el volumen de la solución resultante es de 1.13 mililitros. Un mililitro de esta solución contendrá ya sea 5.4, 10.5, o 20.5 microgramos de alprostadil, dependiendo de la potencia del vial. La cantidad administrable de alprostadil es de 5, 10, o 20 microgramos por mililitro, dado que aproximadamente 0.4 microgramos - en el caso de la potencia de 5 microgramos, y 0.5 microgramos - en el caso de las potencias de 10 y 20 microgramos, se pierden debido a la adsorción al vial y a la jeringa.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá - Colombia.