
BERODUAL
FENOTEROL, IPRATROPIO
Solución para inhalación
Tubo , Aerosol , 10 Mililitros
Tubo , Aerosol , 10 Mililitros
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN: BERODUAL® SOLUCIÓN Nebulizable1 ml (=20 gotas) de solución nebulizable contiene:
(8r) -3a-hidroxi-8-isopropil-1aH, 5aH-bromuro de tropano (a)- tropato monohidrato (= bromuro de ipratropio) correspondiente a 250 mcg de bromuro de ipratropio anhidro 261 mcg
1-(3,5-dihidroxi-fenil) -2-[[1-(4-hidroxi-bencil)-etil]-amino]-etanol bromhidrato (= bromhidrato de fenoterol) 500 mcg
Excipientes**: cloruro de benzalconio, edetato disódico, cloruro de sodio, ácido clorhídrico, agua purificada.
BERODUAL® solución inhalable presurizada
1 dosis medida (pulsación) contiene:
(8r)-3a-hidroxi-8-isopropil-1aH, 5aH-bromuro de tropano (±)- tropato monohidrato (= bromuro de ipratropio) correspondiente a 20 mcg de bromuro de ipratropio anhidro 21 mcg
1-(3,5-dihidroxi-fenil)-2-[[1-(4-hidroxi-bencil)-etil]-amino]-etanol bromhidrato (= fenoterol bromhidrato) 50mcg
Excipientes**:
Propelente: 1,1,1,2-Tetrafluoroetano (HFA 134a)
Otros excipientes**: ácido cítrico anhidro, agua purificada, etanol absoluto, nitrógeno (gas inerte)
INDICACIONES: BERODUAL® es un broncodilatador para la prevención y el tratamiento de los síntomas de las enfermedades obstructivas crónicas de las vías respiratorias con limitación reversible del flujo aéreo como el asma y especialmente la bronquitis crónica, con o sin enfisema. Debe considerarse el tratamiento antiinflamatorio concomitante para los pacientes con asma bronquial y enfermedades pulmonares obstructivas crónicas (EPOC) que responden a los esteroides.
PROPIEDADES FARMACOLÓGICAS: Grupo farmacoterapéutico: Adrenérgicos en combinación con anticolinérgicos para las enfermedades obstructivas de las vías aéreas.
Código ATC: R03AL01.
BERODUAL® contiene dos principios activos broncodilatadores: bromuro de ipratropio, con efecto anticolinérgico y bromhidrato de fenoterol, un beta-adrenérgico.
El bromuro de ipratropio es un compuesto de amonio cuaternario con propiedades anticolinérgicas (parasimpaticolíticas). En estudios preclínicos, inhibe los reflejos vagales porque antagoniza la acción de la acetilcolina, el neurotransmisor liberado por el nervio vago. Los anticolinérgicos impiden el aumento de la concentración intracelular de Ca++ provocado por la interacción de la acetilcolina con los receptores muscarínicos del músculo liso bronquial. La liberación de Ca ++ es mediada por el sistema de segundo mensajero que consiste en IP3 (inositol trifosfato) y DAG (diacilglicerol).
La broncodilatación que sigue a la inhalación del bromuro de ipratropio es principalmente un efecto local, específico de sitio, y no un efecto sistémico.
Las evidencias no preclínicas y clínicas no dejan entrever efectos perjudiciales del bromuro de ipratropio sobre la secreción mucosa de las vías respiratorias, la depuración mucociliar ni el intercambio gaseoso.
El bromhidrato de fenoterol es un simpaticomimético de acción directa, que estimula en forma selectiva los receptores beta2-adrenérgicos, dentro del rango de dosis terapéuticas. La estimulación de los receptores beta1 se produce dentro de un rango de dosis más elevadas La ocupación de los receptores beta2 activa la adenilciclasa a través de una proteína Gs estimulante.
El aumento del AMP cíclico activa la proteincinasa A, que luego fosforila las proteínas-blanco en las células musculares lisas. Esto a su vez conduce a la fosforilación de la miosina cinasa de cadena ligera, a la inhibición de la hidrólisis del fosfoinositol y a la apertura de los canales de potasio activados por calcio de gran conductancia.
El bromhidrato de fenoterol relaja el músculo liso bronquial y vascular, y protege contra los estímulos broncoconstrictores como la histamina, la metacolina, aire fresco y los alergenos (respuesta temprana). Después de la administración aguda se inhibe la liberación de mediadores broncoconstrictores y proinflamatorios de los mastocitos. Además, se ha demostrado un aumento de la depuración mucociliar después de la administración de dosis de fenoterol (0,6 mg).
Las concentraciones plasmáticas más elevadas, que se alcanzan con mayor frecuencia tras la administración oral, o más aún, tras la administración intravenosa, inhiben la motilidad uterina. También con las dosis más altas, se observan efectos metabólicos: Lipólisis, glucogenólisis, hiperglucemia e hipopotasemia, esta última causada por el incremento de la captación de K+, sobre todo por el músculo esquelético.
Los efectos beta-adrenérgicos sobre el corazón como el aumento de la frecuencia y la contractilidad cardíacas son provocados por los efectos vasculares del fenoterol, la estimulación de los receptores beta2 cardíacos y con dosis superiores a las terapéuticas, por estimulación de los receptores beta1. Como sucede con otros beta-adrenérgicos, se reportaron prolongaciones de QTc. Con las soluciones inhalables presurizadas con fenoterol estos efectos fueron discretos y se observaron con la administración de dosis más altas que las recomendadas. Sin embargo, la exposición sistémica tras la administración con nebulizadores (solución nebulizable, solución nebulizable en viales monodosis podría ser mayor que con las dosis recomendadas de la solución inhalable presurizada. La significación clínica de estos hallazgos aún no ha sido establecida. El temblor es un efecto observado con más frecuencia con los beta-agonistas. A diferencia de los efectos sobre el músculo liso bronquial, los efectos sistémicos de los beta-agonistas sobre la musculatura esquelética están sujetos al desarrollo de tolerancia.
El uso concurrente de estos dos principios activos dilata los bronquios porque actúan sobre distintos sitios de acción farmacológica. Los dos principios activos se complementan mutuamente respecto de la acción espasmolítica sobre el músculo liso bronquial y permiten un amplio uso terapéutico en el campo de los trastornos broncopulmonares asociados con la constricción del tracto respiratorio. La acción complementaria es tal que se requiere sólo una proporción muy baja del componente beta-adrenérgico para obtener el efecto deseado, lo que facilita la dosificación individual adecuada a cada paciente, con un mínimo de reacciones adversas.
Eficacia y seguridad clínicas: En pacientes con asma y EPOC, demostró eficacia superior comparado con los componentes individuales, ipratropio o fenoterol. Dos estudios (uno en pacientes con asma, otro en pacientes con EPOC) han demostrado que BERODUAL® es tan eficaz como una dosis doble de fenoterol administrado sin ipratropio, pero fue mejor tolerado en los estudios de acumulación de dosis.
En la broncoconstricción aguda BERODUAL® es eficaz inmediatamente después de la administración y, por lo tanto, también es adecuado para tratar los episodios de broncoespasmo agudos.
Farmacocinética: El efecto terapéutico de la combinación de bromuro de ipratropio y bromhidrato de fenoterol se produce por su acción local en las vías aéreas. La farmacodinámica de la broncodilatación, por tanto, no se relaciona con la farmacocinética de los componentes activos de la preparación.
En general, tras la inhalación, del 10 al 39% de la dosis se deposita en los pulmones, lo cual depende de la formulación, la técnica y el dispositivo de inhalación, mientras que el resto de la dosis administrada se deposita en la boquilla y en la parte superior del tracto respiratorio (orofaringe). Una cantidad similar de la dosis se deposita en el tracto respiratorio tras la inhalación mediante un aerosol dosificador, con HFA 134a. En particular tras la inhalación de la solución acuosa a través del inhalador RESPIMAT®, se observó experimentalmente que la deposición pulmonar aumenta más de 2 veces, en comparación con el aerosol dosificador. La deposición orofaríngea disminuyó en forma correspondiente y es significativamente menor con el inhalador RESPIMAT ® en comparación con el inhalador de aerosol dosificador. La porción de la dosis depositada en los pulmones alcanza la circulación rápidamente (en minutos). La cantidad de principio activo depositada en la orofaringe es deglutida lentamente y pasa al tubo digestivo. Por consiguiente, la exposición sistémica está en función de la biodisponibilidad tanto oral como pulmonar.
No hay pruebas de que la farmacocinética de ambos principios activos de la combinación difiera de la de cada uno de sus componentes por separado.
Bromhidrato de fenoterol: La porción deglutida se metaboliza principalmente a conjugados con sulfato. La biodisponibilidad absoluta tras la administración oral es baja (aproximadamente 1,5%).
Tras la administración intravenosa, el fenoterol libre y el conjugado representan aproximadamente el 15% y el 27% de la dosis administrada en la orina de 24 horas. Tras la inhalación a través del inhalador BERODUAL® alrededor del 1% de la dosis inhalada se excreta como fenoterol libre en la orina de 24 horas. Sobre la base de estos datos, se estima que la biodisponibilidad sistémica total de las dosis inhaladas de bromhidrato de fenoterol es del 7%.
Se calcularon los parámetros cinéticos que describen la disposición del fenoterol a partir de las concentraciones plasmáticas tras la administración intravenosa. Tras la administración intravenosa, las curvas de concentración plasmática-tiempo se pueden describir como un modelo de 3 compartimientos, donde la semivida terminal es de alrededor de 3 horas. En este modelo de 3 compartimientos el volumen de distribución aparente del fenoterol en estado de equilibrio (Vdss) es de aproximadamente 189 L (≈ 2,7 L/kg).
Alrededor del 40 % del fármaco se une a las proteínas plasmáticas.
Estudios preclínicos en ratas mostraron que fenoterol y sus metabolitos no atraviesan la barrera hematoencefálica. El fenoterol tiene una depuración total de 1,8 L/min y una depuración renal de 0,27 L/min.
En un estudio de balance de excreción, la excreción renal acumulativa (2 días) de la radioactividad relacionada con el fármaco (como compuesto de origen y todos los metabolitos) representó el 65% tras la administración intravenosa; la radioactividad total excretada por las heces fue del 14,8% de la dosis. Tras la administración oral, la radioactividad total excretada en la orina fue aprox. del 39% de la dosis y la radioactividad total excretada en las heces fue del 40,2% de la dosis en 48 horas.
Bromuro de ipratropio: La excreción renal acumulativa (0-24 h) de ipratropio (compuesto de origen) se aproxima al 46% tras la administración de una dosis intravenosa, es inferior al 1% tras la administración oral y es aproximadamente del 3 al 13% de una dosis inhalada mediante el aerosol dosificador BERODUAL®. Sobre la base de estos datos, la biodisponibilidad sistémica total de las dosis orales e inhaladas de bromuro de ipratropio se estima del 2% y del 7% al 28%, respectivamente. Teniendo esto en cuenta, las porciones ingeridas de la dosis de bromuro de ipratropio no contribuyen de manera relevante a la exposición sistémica.
Se calcularon los parámetros cinéticos que describen la disposición de ipratropio a partir de las concentraciones plasmáticas tras la administración intravenosa. Se observa una rápida declinación bifásica de las concentraciones plasmáticas. El volumen de distribución aparente en estado de equilibrio (Vdss) es aproximadamente de 176 litros (≈ 2,4 l/kg). La unión del fármaco con las proteínas plasmáticas es mínima (menos de 20%). Estudios preclínicos en ratas y perros mostraron que ipratropio, una amina cuaternaria, no atraviesa la barrera hematoencefálica.
La semivida de la fase de eliminación terminal es de alrededor de 1,6 horas. El bromuro de ipratropio presenta una depuración total de 2,3 L/min y una depuración renal de 0,9 L/min. Tras la administración intravenosa alrededor del 60% de la dosis es metabolizada, probablemente en su mayor parte en el hígado, por oxidación.
En un estudio de balance de excreción, la excreción renal acumulativa (6 días) de la radioactividad relacionada con el fármaco (como compuesto de origen y todos los metabolitos) representó el 72,1% tras la administración intravenosa, 9,3% tras la administración oral y 3,2% tras la inhalación. La radioactividad total excretada por las heces fue del 6,3% tras la aplicación intravenosa, del 88,5% luego de la administración oral y del 69,4% después de la inhalación. Con respecto a la excreción de la radioactividad relacionada con el fármaco tras la administración intravenosa, la principal vía de excreción fue la renal. La semivida de eliminación de la radioactividad relacionada con el fármaco (compuesto de origen y metabolitos) es de 3,6 horas. La unión de los principales metabolitos urinarios con los receptores muscarínicos es insignificante, por lo que los metabolitos se consideran inactivos.
Toxicología: Los estudios de toxicidad con dosis únicas con la combinación de bromuro de ipratropio y bromhidrato de fenoterol en proporción 1/2,5 (bromuro de ipratropio/bromhidrato de fenoterol) en ratones y ratas tras la administración oral, intravenosa e inhalatoria, mostraron niveles bajos de toxicidad aguda. Comparados con los componentes individuales, los valores de la LD50 de la combinación fueron determinados principalmente por el componente bromuro de ipratropio que por el bromhidrato de fenoterol sin indicios de potenciación.
Se realizaron estudios de toxicidad con dosis repetidas con la combinación de bromuro de ipratropio y bromhidrato de fenoterol en ratas (vía oral e inhalatoria) y perros (vía intravenosa e inhalatoria) durante períodos hasta de 13 semanas. Solo se observaron efectos tóxicos menores con concentraciones hasta varios cientos de veces superiores a las recomendadas en el hombre. Se observaron cicatrices en el miocardio ventricular izquierdo en sólo uno de los animales del grupo que recibió la dosis más elevada (84 μ/kg/día) en el estudio de 4 semanas de administración intravenosa en perros. En el estudio de 13 semanas por vía oral en ratas y en el estudio de 13 semanas por vía inhalatoria en perros no se observaron cambios toxicológicos más allá de lo proporcional a los componentes individuales.
No hubo indicación de potenciación con la combinación, comparada con los componentes individuales. Todos los efectos adversos observados son bien conocidos para el bromhidrato de fenoterol y el bromuro de ipratropio.
Tras la administración por vía inhalatoria de la combinación de bromuro de ipratropio y bromhidrato de fenoterol a ratas y conejos, no se produjeron efectos teratógenos. Tampoco se observaron efectos teratógenos después de administrar bromuro de ipratropio, ni tras la inhalación de bromhidrato de fenoterol. Tras la administración oral de dosis >25 mg/kg/día (conejo) y >38,5 mg/kg/día (ratón) el bromhidrato de fenoterol indujo un aumento de la tasa de malformaciones.
Las malformaciones observadas se consideran un efecto de clase de los fármacos beta-agonistas. No hubo alteración de la fertilidad en la rata con dosis orales hasta de 90 mg/kg/día de bromuro de ipratropio y hasta de 40 mg/kg/día de bromhidrato de fenoterol.
No se realizaron estudios de genotoxicidad con la combinación. Los estudios in vitro e in vivo mostraron que ni el bromhidrato de fenoterol ni el bromuro de ipratropio tienen potencial mutágeno.
No se realizaron estudios sobre carcinogenia con la combinación. No se demostraron efectos oncógenos ni carcinógenos en estudios a largo plazo realizados en ratones y ratas con bromuro de ipratropio. Se realizaron estudios sobre carcinogenia con bromhidrato de fenoterol tras la administración oral (ratón, 18 meses; rata, 24 meses) y tras la administración inhalatoria (rata, 24 meses). Con dosis orales de 25 mg/kg/día se observó aumento de la incidencia de leiomiomas uterinos con actividad mitótica variable en ratones y de leiomiomas mesováricos en ratas. Estos hallazgos son efectos reconocidos causados por la acción local de los fármacos beta-adrenérgicos sobre las células musculares lisas uterinas de ratones y ratas. Tomando en cuenta el nivel actual de la investigación, estos resultados no son aplicables al ser humano. Todas las otras neoplasias halladas se consideraron comunes, del tipo que se encuentra espontáneamente en las cepas usadas, y no mostraron un aumento biológicamente importante de la incidencia como resultado del tratamiento con bromhidrato de fenoterol.
CONTRAINDICACIONES: BERODUAL® está contraindicado en pacientes con hipersensibilidad conocida al bromhidrato de fenoterol, a las sustancias semejantes a la atropina o a cualquiera de los excipientes del producto. BERODUAL® también está contraindicado en pacientes con miocardiopatía hipertrófica obstructiva y taquiarritmia.
FERTILIDAD, EMBARAZO Y LACTANCIA: Embarazo: Los datos preclínicos, combinados con la experiencia disponible en humanos no han mostrado evidencia de efectos adversos de fenoterol o ipratropio para el embarazo. Con todo, deben tomarse las precauciones habituales con respecto al uso de fármacos durante el embarazo, especialmente durante el primer trimestre.
Debe tomarse en cuenta el efecto inhibitorio de fenoterol sobre las contracciones uterinas.
Lactancia: Los estudios no clínicos han mostrado que el bromhidrato de fenoterol se excreta en la leche materna. Se desconoce si el ipratropio se excreta en la leche materna. Pero resulta improbable que lleguen al lactante cantidades importantes de ipratropio, especialmente cuando se administra por vía inhalatoria. No obstante, se recomienda precaución cuando se administra BERODUAL ® a una mujer que amamanta.
Fertilidad: No se dispone de datos clínicos sobre fertilidad con la combinación de bromuro de ipratropio y bromhidrato de fenoterol ni sobre cada uno de los dos componentes de la combinación. Los estudios no clínicos realizados con los componentes individuales bromuro de ipratropio y bromhidrato de fenoterol no mostraron efectos adversos sobre la fertilidad (véase la sección “Toxicología”).
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR VEHÍCULOS U OPERAR MAQUINARIAS: No se han estudiado los efectos sobre la capacidad de conducir vehículos u operar maquinarias.
Sin embargo, se debe informar a los pacientes que pueden experimentar efectos adversos como mareos, temblor, alteraciones de la acomodación, midriasis y visión borrosa durante el tratamiento con BERODUAL®. Por lo tanto, se debe recomendar precaución al conducir vehículos u operar maquinarias. Si los pacientes experimentan los efectos adversos antes mencionados, deben evitar la realización de tareas potencialmente riesgosas como conducir vehículos u operar maquinarias.
EFECTOS SECUNDARIOS: Muchos de los efectos adversos listados se pueden asignar a las propiedades anticolinérgicas y beta-adrenérgicas de BERODUAL®. Como sucede con todos los tratamientos inhalatorios, BERODUAL® puede producir síntomas de irritación local. Las reacciones adversas se identificaron a partir de datos obtenidos en ensayos clínicos y de farmacovigilancia durante el período posterior a la aprobación de la droga.
Los efectos secundarios observados con mayor frecuencia en los ensayos clínicos fueron tos, sequedad bucal, dolor de cabeza, temblor, faringitis, náuseas, mareos, disfonía, taquicardia, palpitaciones, vómitos, aumento de la presión arterial sistólica y nerviosismo.
Trastornos del sistema inmune
— reacción anafiláctica
— hipersensibilidad
Trastornos del metabolismo y de la nutrición
— hipopotasemia
Trastornos psiquiátricos
— nerviosismo
— agitación
— trastorno mental
Trastornos del sistema nervioso
— dolor de cabeza
— temblor
— mareos
Trastornos oculares
— glaucoma
— aumento de la presión intraocular
— trastornos de la acomodación
— midriasis
— visión borrosa
— dolor ocular
— edema corneal
— hiperemia conjuntival
— visión de halos
Trastornos cardíacos
— taquicardia, aumento de la frecuencia cardíaca
— palpitaciones
— arritmia
— fibrilación auricular
— taquicardia supraventricular
— isquemia miocárdica
Trastornos respiratorios, torácicos y mediastínicos
— tos
— faringitis
— disfonía
— broncoespasmo
— irritación de la garganta
— edema faríngeo
— laringoespasmo
— broncoespasmo paradójico
— sequedad de garganta
Trastornos digestivos
— vómitos
— náuseas
— sequedad bucal
— estomatitis
— glositis
— trastornos de la motilidad gastrointestinal
— diarrea
— constipación
— edema bucal
Trastornos de la piel y del tejido subcutáneo
— urticaria
— erupción
— prurito
— angioedema
— hiperhidrosis
Trastornos musculoesqueléticos y del tejido conjuntivo
— debilidad muscular
— espasmos musculares
— mialgia
Trastornos renales y urinarios
— retención urinaria
Exploraciones complementarias
— aumento de la presión arterial sistólica
— disminución de la presión arterial diastólica
INTERACCIONES: La coadministración crónica de BERODUAL® con otros fármacos anticolinérgicos no ha sido estudiada. Por lo tanto, no se recomienda la coadministración crónica de BERODUAL® con otros anticolinérgicos.
Otros fármacos beta-adrenérgicos y anticolinérgicos y los derivados de las xantinas (como la teofilina) pueden aumentar el efecto broncodilatador. La administración concurrente de otros beta-miméticos, de anticolinérgicos disponibles por vía sistémica y de derivados de las xantinas (por ejemplo, teofilina) puede aumentar las reacciones adversas.
La administración concurrente de betabloqueadores puede producir una reducción potencialmente seria de la broncodilatación.
La hipopotasemia inducida por los agonistas beta2 puede aumentar por el tratamiento concomitante con derivados de las xantinas, corticosteroides y diuréticos. Esto debe ser tenido en cuenta particularmente en pacientes con obstrucción grave de las vías aéreas.
La hipopotasemia puede dar lugar a un aumento de la sensibilidad a las arritmias en pacientes tratados con digoxina. Además, la hipoxia puede agravar los efectos de la hipopotasemia sobre el ritmo cardíaco. En tales situaciones, se recomienda vigilar los niveles séricos de potasio.
Las especialidades farmacéuticas que contienen agonistas beta2-adrenérgicos deben ser administradas con precaución en pacientes tratados con inhibidores de la monoaminoxidasa o con antidepresivos tricíclicos, dado que pueden aumentar la acción de los agonistas beta-adrenérgicos.
La inhalación de hidrocarburos halogenados anestésicos como halotano, tricloroetileno y enflurano, puede aumentar la sensibilidad a los efectos cardiovasculares de los agonistas beta-adrenérgicos.
ADVERTENCIA: La boquilla de plástico ha sido diseñada especialmente para ser usada con BERODUAL® solución inhalable presurizada para garantizar que usted siempre reciba la cantidad correcta del medicamento. La boquilla nunca se debe usar con otra solución inhalable presurizada y tampoco debe usarse BERODUAL® solución inhalable presurizada con cualquier otra boquilla que no sea la que se entrega con el producto.
El aerosol se encuentra presurizado y bajo ningún concepto debe ser abierto por la fuerza ni expuesto a temperaturas superiores a 50° C.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES: Hipersensibilidad: Pueden producirse reacciones de hipersensibilidad inmediatas tras la administración de BERODUAL®, según lo demostrado por casos raros de urticaria, angioedema, erupción cutánea, broncoespasmo, edema orofaríngeo y anafilaxia.
Broncoespasmo paradojal: Al igual que con otros medicamentos inhalables, existe la posibilidad de que BERODUAL® provoque un broncoespasmo paradojal, cuadro potencialmente fatal. En el caso de producirse un broncoespasmo paradojal, debe suspenderse de inmediato el uso de BERODUAL® y debe utilizarse otra terapia en su reemplazo.
Complicaciones oculares: BERODUAL® debe usarse con precaución en los pacientes con predisposición a glaucoma de ángulo estrecho.
Se han informado casos aislados de complicaciones oculares (es decir, midriasis, aumento de la presión intraocular, glaucoma de ángulo estrecho, dolor ocular) cuando el bromuro de ipratropio aerosolizado, ya sea solo o en combinación con un agonista de los receptores beta adrenérgicos, ha entrado en contacto con los ojos.
La presencia de dolor o molestia ocular, visión borrosa, halos visuales o imágenes coloreadas en asociación con enrojecimiento ocular por congestión de la conjuntiva y edema de córnea pueden ser signos de glaucoma de ángulo estrecho agudo. En el caso de presentarse cualquier combinación de estos síntomas, debe iniciarse el tratamiento con gotas mióticas y realizar de inmediato una consulta con un especialista.
Por ende, se deberá indicar a los pacientes la forma correcta de administrar BERODUAL®.
Debe tenerse la precaución de evitar que el producto entre en contacto con los ojos.
En el caso de BERODUAL® solución nebulizable, se recomienda que la solución nebulizada se administre a través de una máscara bucal. En el caso de que no hubiera disponible una máscara bucal y se utilice una máscara para nebulización, debe asegurarse un correcto calce de la misma. Los pacientes que puedan tener predisposición al glaucoma deben ser advertidos específicamente de la necesidad de proteger sus ojos.
Efectos sistémicos: En las afecciones que se citan a continuación, BERODUAL® puede ser utilizado únicamente tras una cuidadosa evaluación de la relación riesgo-beneficio, en especial cuando se usan dosis más altas que las recomendadas:
Diabetes mellitus insuficientemente controlada, infarto de miocardio reciente, trastornos orgánicos cardíacos o vasculares severos, hipertiroidismo, feocromocitoma, o bien obstrucción preexistente de las vías urinarias (p. ej., hiperplasia prostática u obstrucción del cuello de la vejiga).
Efectos cardiovasculares: Existe la posibilidad de que se produzcan efectos cardiovasculares con los simpaticométicos, entre los cuales figura BERODUAL®. Existe cierta evidencia, obtenida a partir de datos de postcomercialización y bibliografía publicada, de casos infrecuentes (raros) de isquemia de miocardio asociada con beta-agonistas. Debe advertirse a los pacientes con una cardiopatía severa subyacente (p. ej., cardiopatía isquémica, arritmia o insuficiencia cardíaca severa) que estén recibiendo BERODUAL® que deben consultar a un profesional médico ante la aparición de dolor torácico u otros síntomas de empeoramiento de su cardiopatía. Debe prestarse atención a la evaluación de síntomas tales como disnea y dolor torácico, ya que su origen puede ser cardíaco o respiratorio.
Hipopotasemia: Pueden producirse cuadros de hipopotasemia potencialmente seria como consecuencia del tratamiento con agonistas beta2 (ver también la sección Sobredosis).
Alteraciones de la motilidad gastrointestinal: Los pacientes con fibrosis quística pueden tener una mayor propensión a padecer alteraciones de la motilidad gastrointestinal.
Disnea: Debe indicarse a los pacientes que, en caso de disnea aguda que empeora rápidamente deben consultar a un médico en forma inmediata.
Uso prolongado:
• En pacientes con asma bronquial, BERODUAL® se debe usar solo según necesidad. En pacientes con EPOC leve puede ser preferible el tratamiento a demanda (orientado a los síntomas) que al tratamiento regular.
• Se deberá pensar en agregar o aumentar la dosis de tratamiento antiinflamatorio para controlar la inflamación de las vías respiratorias y prevenir el deterioro del control de la enfermedad en los pacientes con asma bronquial y con EPOC que responde a los esteroides.
El uso regular de cantidades crecientes de productos que contienen agonistas beta2 como BERODUAL® para controlar los síntomas de la obstrucción bronquial puede hacer pensar en una declinación del control de la enfermedad. Si la obstrucción bronquial aumenta, resulta inconveniente y posiblemente riesgoso el simple aumento de los agonistas beta2 como BERODUAL® más allá de la dosis recomendada durante períodos prolongados. En esta situación, conviene revisar el plan terapéutico de los pacientes, en particular la adecuación del tratamiento antiinflamatorio con corticosteroides inhalados, para evitar el deterioro potencialmente mortal del control de la enfermedad.
El uso de otros broncodilatadores simpatomiméticos con BERODUAL® solo debe realizarse bajo supervisión médica (ver sección “Interacciones”).
Advertencia respecto del dopaje: El uso de BERODUAL® puede dar lugar a resultados positivos debidos al fenoterol en las pruebas para detectar abuso de sustancias de uso no clínico, es decir, en el contexto de la mejora del rendimiento deportivo (dopaje).
Excipientes: BERODUAL® solución nebulizable
Este producto contiene el conservante cloruro de benzalconio y el estabilizador edetato disódico dihidratado. Cuando se inhalan estos componentes pueden causar broncoespasmo en pacientes sensibles con vías respiratorias hiperreactivas.
DOSIS Y ADMINISTRACIÓN: La dosificación se debe adaptar a las necesidades individuales. Se recomiendan las siguientes dosis en adultos y niños > 6 años:
Crisis asmáticas: 2 pulsaciones son suficientes para el alivio rápido de los síntomas, en muchos casos. En casos más graves, si la respiración no ha mejorado notablemente después de 5 minutos, se pueden realizar otras dos pulsaciones.
Si no se consigue aliviar la crisis con 4 pulsaciones, es posible que se requieran pulsaciones adicionales.
En estos casos, debe indicarse a los pacientes que deben consultar al médico o concurrir al hospital más cercano, inmediatamente.
Tratamiento intermitente y a largo plazo (en el asma, BERODUAL® solución inhalable presurizada se debe usar solo según necesidad)
1 a 2 pulsaciones en cada administración, hasta un máximo de 8 pulsaciones por día (promedio: 1 a 2 pulsaciones, 3 veces por día).
En los niños, BERODUAL® solución inhalable presurizada solo se debe usar por indicación médica y bajo la supervisión de un adulto.
Los pacientes deben ser instruidos sobre la correcta administración de la solución inhalable presurizada para asegurar el éxito del tratamiento (véase Modo de empleo).
MODO DE EMPLEO: Antes del primer uso de la solución inhalable presurizada, tenga en cuenta lo siguiente: Quite la tapa protectora y presione la válvula dos veces.
Cada vez que use la solución inhalable presurizada, tenga en cuenta lo siguiente:
1. Retire la tapa protectora.
(Si no ha usado el inhalador durante más de tres días, debe accionar la válvula una vez)
2. Exhale (saque el aire de sus pulmones) profundamente.
3. Sostenga el inhalador como se muestra en la fig. 1, y ajuste los labios alrededor de la boquilla.
La flecha y la base del envase deben apuntar hacia arriba.
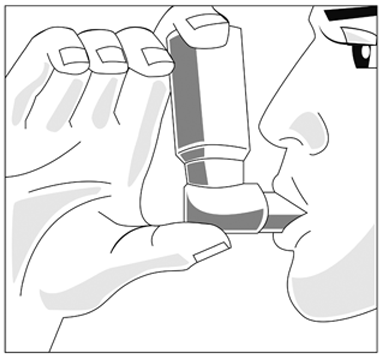
(Fig. 1)
4. Inspire (introduzca aire en sus pulmones) lo más profundamente posible, y al mismo tiempo presione la base del aerosol, para que libere una dosis inhalable presurizada. Contenga la respiración durante unos pocos segundos, luego retire la boquilla de la boca y exhale.
Repita los mismos pasos para realizar una segunda inhalación.
5. Vuelva a colocar la tapa protectora después del uso.
El recipiente no es trasparente. Por consiguiente no es posible ver cuándo está vacío. El inhalador contiene 200 dosis o, en caso de estar disponible, 300* dosis. Cuando ya se han usado todas las dosis, puede parecer que el recipiente aún contiene una pequeña cantidad de líquido. No obstante, el inhalador debe ser sustituido porque de lo contrario, es posible que no se obtenga la cantidad correcta de medicamento.
La cantidad aproximada de medicamento que queda en el inhalador se puede comprobar de la siguiente manera:
— Sacudir el aerosol permitirá saber si queda algo de líquido.
— Otra alternativa es separar el aerosol de la boquilla de plástico y ponerlo dentro de un recipiente con agua. El contenido del aerosol se puede estimar observando su posición en el agua.
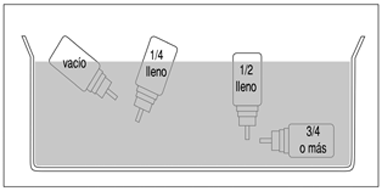
(fig.2)
— Limpie su inhalador por lo menos una vez por semana.
— Es importante mantener la boquilla del inhalador limpia para garantizar que el medicamento no se acumule y obstruya el vaporizador.
— Para limpiarlo, primero hay que retirar la tapa y luego quitar el aerosol del inhalador. Enjuague haciendo pasar agua tibia a través de la boquilla del inhalador hasta que no quede medicación ni suciedad visible.
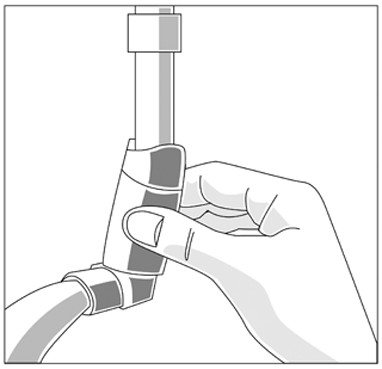
(fig.3)
— Después de la limpieza sacuda el inhalador y déjelo secar al aire sin usar ningún sistema de secado por calor. Una vez que la boquilla esté seca, vuelva a colocar el aerosol y la tapa de protección.
(fig.4)
* A ser especificado por cada Unidad Operativa según el dispositivo real comercializado.
DOSIS Y ADMINISTRACIÓN Y MODO DE EMPLEO: BERODUAL® solución nebulizable (1 ml contiene 261 mcg de bromuro de ipratropio + 500 mcg de bromhidrato de fenoterol)
(20 gotas = 1 ml)
Dosis y administración: El tratamiento debe iniciarse y administrarse bajo supervisión médica, p. ej., en el ámbito hospitalario. Puede recomendarse la modalidad de tratamiento en el hogar en aquellos casos en que una dosis baja de un broncodilatador beta agonista de acción rápida como Berodual solución inhalable presurizada no haya sido suficiente para brindar alivio, tras la consulta con un médico con experiencia en el tema. Esta modalidad también puede recomendarse en aquellos pacientes que necesitan un tratamiento de nebulización por otras razones, p. ej., para el manejo de dificultades relacionadas con la solución inhalable presurizada o bien en los casos de pacientes con experiencia que requieren dosis más altas.
El tratamiento con la solución nebulizable siempre debe iniciarse con la dosis recomendada más baja. La posología debe adaptarse a los requerimientos individuales de cada paciente, y ajustarse en función de la severidad del episodio agudo. Debe suspenderse la administración una vez logrado un alivio suficiente de los síntomas. Se recomiendan las siguientes dosis:
Adultos (incluye pacientes de edad avanzada) y adolescentes ≥ de 12 años:
Episodios agudos de broncoespasmo: Dependiendo de la severidad del episodio agudo, se pueden usar dosis que vayan desde 261 mcg bromuro de ipratropio/500 mcg hidrobromuro de fenoterol (es decir, 1 ml = 20 gotas) y 652,5 mcg bromuro de ipratropio/1250 mcg hidrobromuro de fenoterol (es decir, 2,5 ml = 50 gotas). En casos severos excepcionales, se puede usar dosis de hasta 1044 mcg bromuro de ipratropio/2000 mcg hidrobromuro de fenoterol (es decir, 4 ml = 80 gotas).
Niños de 6 a 12 años: Crisis asmáticas: Dependiendo de la severidad del episodio agudo y rangos de dosis por edad entre 130.5 mcg bromuro de ipratropio/250 mcg hidrobromuro de fenoterol (es decir, 0,5 ml = 10 gotas) y 522 mcg bromuro de ipratropio/1000 mcg hidrobromuro de fenoterol (es decir, 2 ml = 40 gotas) pueden ser utilizados.
Niños < 6 años (menos de 22 kg de peso corporal): Dado que existe información insuficiente en este grupo etario, se recomienda la siguiente dosis, solo bajo supervisión médica:
Alrededor de 26,1 mcg de bromuro de ipratropio /50 mcg de bromhidrato de fenoterol (es decir, 0,1 ml = 2 gotas) por kilogramo de peso corporal hasta un máximo de 0,5 ml (= 10 gotas)
Modo de empleo: La solución nebulizable está destinada solo a la inhalación con nebulizadores adecuados y no debe ser administrada por vía oral.
La dosis recomendada debe diluirse en solución fisiológica hasta un volumen final de 3 a 4 ml para luego nebulizar e inhalar hasta que se logre un grado suficiente de alivio de los síntomas.
BERODUAL® solución nebulizable, sin embargo, puede no diluirse con agua destilada.
La solución debe ser diluida en el momento antes de usarla; toda solución residual diluida debe ser desechada.
La solución diluida se debe inhalar en seguida después de prepararla.
La duración de la inhalación puede controlarse mediante el volumen de dilución.
BERODUAL® solución nebulizable se puede administrar utilizando varios nebulizadores disponibles comercialmente. Las exposiciones pulmonar y sistémica al fármaco dependen del nebulizador utilizado y pueden ser más altas que las administradas con BERODUAL® solución inhalable presurizada, lo cual depende de la eficiencia del dispositivo.
Cuando se dispone de una toma de oxígeno en la pared, se debe administrar la solución con un flujo de 6 a 8 litros por minuto.
Deben seguirse las instrucciones proporcionadas por el fabricante del nebulizador para el correcto cuidado, mantenimiento y limpieza del equipo.
BERODUAL® solución inhalable presurizada, dependiendo de la eficiencia del dispositivo.
Cuando se dispone de una toma de oxígeno en la pared, se debe administrar la solución con un flujo de 6 a 8 litros por minuto.
Deben seguirse las instrucciones proporcionadas por el fabricante del nebulizador para el correcto cuidado, mantenimiento y limpieza del equipo.
BERODUAL® solución inhalable presurizada
SOBREDOSIS: Síntomas: Se supone que los efectos de la sobredosis estarán relacionados sobre todo con el fenoterol.
Los síntomas de sobredosis que pueden anticiparse son los de la estimulación beta-adrenérgica excesiva, entre los cuales los más prominentes son taquicardia, palpitaciones, temblor, hipertensión, hipotensión, aumento de la amplitud del pulso, dolor anginoso, arritmias y sofocos. También se ha observado acidosis metabólica e hipopotasemia con fenoterol, cuando se administra en dosis mayores que las recomendadas para las indicaciones aprobadas de BERODUAL®.
Los síntomas previsibles de la sobredosis con bromuro de ipratropio (como sequedad bucal, trastornos de la acomodación visual) son leves porque la disponibilidad sistémica del ipratropio inhalado es muy baja.
Tratamiento: Debe interrumpirse el tratamiento con Berodual. Debe considerarse la posibilidad de efectuar un monitoreo de los valores de electrolitos y del equilibrio ácido-base.
Administración de sedantes, tranquilizantes, en casos graves bajo tratamiento de cuidados intensivos.
Los bloqueadores de los beta-receptores, de preferencia los selectivos para los receptores beta1 son adecuados como antídotos específicos; sin embargo, se debe tomar en cuenta el posible aumento de la obstrucción bronquial y deberá ajustarse la dosis con cuidado en los pacientes con asma bronquial o EPOC debido al riesgo de precipitar un broncoespasmo grave, que puede ser mortal.
PRESENTACIÓN: BERODUAL® HFA, caja con tubo en acero inoxidable por 10 mL con válvula dosificadora y boquilla (Reg. San. No. INVIMA 2017M-0002085-R2).
BERODUAL® Solución, caja con frasco de vidrio ámbar tipo III, tapón de Polietileno y tapa en Polipropileno por 20 mL (Reg. San. No. INVIMA 2020M-003240-R3)
“¡Almacenar en un lugar seguro; fuera del alcance de los niños!
La información de seguridad del producto puede cambiar, consulte la información vigente en la Dirección Médica.
Teléfono: (601) 319 91 00, e-mail: medfora.co@boehringer-ingelheim.com
Carrera 11 No. 84A-09 Piso 5, Bogotá D.C. Colombia.
BOEHRINGER INGELHEIM S.A.
Versión - 03 del 05 de mayo de 2014