
BENEFIX
NONACOG ALFA (FACTOR IX RECOMBINANT)
Polvo liofilizado para reconstituir
Caja , Vial(es) , Polvo para reconstituir , 250, 500 y Unidades Internacionales
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN Y CARACTERÍSTICAS FARMACÉUTICAS: Cada VIAL UNIDOSIS contiene nominalmente 250, 500, 1000, 2000 y 3000 Unidades Internacionales (UI).
Forma Farmacéutica y Vía de Administración: Polvo para reconstitución e inyección intravenosa.
Principio Activo: Nonacog Alfa (Denominación Común Internacional) (Factor IX recombinante de coagulación)
Características Físicas: BENEFIX® es un polvo liofilizado estéril y apirógeno para la preparación. Después de su reconstitución se convierte en una solución transparente e incolora.
Clase Farmacológica y Terapéutica: Factor IX de coagulación sanguínea, antihemorrágico.
ATC Code: B02BD091
Naturaleza y Contenido del envase: Viales en VIDRIO TIPO I.
INDICACIONES: BENEFIX® está indicado para la prevención y control de los episodios hemorrágicos y para la profilaxis de rutina o quirúrgica en pacientes con hemofilia B (Deficiencia congénita del factor IX o la enfermedad de Christmas), incluyendo el control y la prevención de la hemorragia en ambientes quirúrgicos.
MODO DE ACCIÓN: BENEFIX® contiene factor IX de coagulación recombinante (nonacog alfa). El factor IX de coagulación recombinante es una cadena simple de glicoproteínas, con una masa molecular aproximadamente de 55,000 Daltons, la cual es un miembro de la familia de proteasas de la serina de los factores de coagulación dependientes de la vitamina K. El factor IX de coagulación recombinante es una proteína terapéutica basada en el ADN recombinante, que tiene una estructura y unas características funcionales comparables al factor IX endógeno. El factor IX es activado por el complejo factor VII/factor tisular de la vía extrínseca, así como por el factor XIa de la vía intrínseca de coagulación. El factor IX activado, en combinación con el factor VIII activado, activa el factor X. Esto ocasiona como resultado final la conversión de protrombina a trombina. La trombina entonces convierte el fibrinógeno en fibrina y de esta manera se puede formar el coágulo. En los pacientes con hemofilia B, la actividad del factor IX está ausente o muy reducida y se necesita de una terapia de sustitución.
La hemofilia B es un trastorno hereditario de la coagulación sanguínea ligado al sexo, ocasionado por la disminución de los niveles de factor IX y que da como resultado una hemorragia profusa en las articulaciones, músculos y órganos internos, ya sea espontáneamente o como resultado de un trauma accidental o quirúrgico. Con la terapia de reemplazo, los niveles plasmáticos de factor IX se aumentan, lo que permite una corrección temporal de la deficiencia del factor y de la tendencia al sangrado.
USO GERIÁTRICO: Los estudios clínicos de BENEFIX® no incluyeron un número suficiente de pacientes de 65 años o mayores, que permitan determinar si existe una respuesta diferente a la de los sujetos más jóvenes. Así como con cualquier paciente bajo tratamiento con BENEFIX® , la selección de la dosis para un paciente anciano debe ser individualizada.
USO PEDIÁTRICO: La seguridad y eficacia han sido demostradas en pacientes pediátricos previamente tratados y no tratados. 29,30,31,32,33.
Para la información de dosificación con relación al uso en niños (Ver también Dosis y administración).
COMPATIBILIDADES O INCOMPATIBILIDADES: En ausencia de estudios de incompatibilidad, la solución reconstituida de BENEFIX® no debe ser administrada en el mismo catéter o bolsa con otros medicamentos. Solamente se debe emplear el equipo de infusión suministrado. Puede ocurrir falla terapéutica debido a la adsorción del factor IX de coagulación humana por las superficies internas de alguna parte del set de infusión.
Manipulación: Reconstituya el polvo liofilizado para inyección BENEFIX® con el diluyente suministrado (solución de cloruro de sodio al 0,234%) en la jeringa prellenada.56 Una vez el diluyente se ha inyectado dentro del vial, rote suavemente el vial hasta que se disuelva todo el polvo. Después de reconstituida, la solución se extrae nuevamente dentro de la jeringa y se realiza la infusión.
La solución debe ser transparente e incolora. Se debe desechar la solución si se observa material particulado o decoloración. El producto no contiene preservantes y la solución reconstituida se debe utilizar dentro de las 3 horas después de reconstituida. 57,58
FARMACOCINÉTICA: Una única infusión de BENEFIX® en 56 pacientes previamente tratados (PTP) (datos al inicio del estudio) con hemofilia B demostró que una Unidad Internacional de BENEFIX® por kilogramo de peso corporal produce un aumento medio en la actividad de 0,75 UI/dL (rango 0,3 a 1,4 UI/dL) de aumento en el nivel de factor IX circulante.47 La vida media biológica se encuentra en el rango de 11 a 36 horas (media 19,3 ± 5,0 horas).48
Para un subconjunto de los 56 pacientes, se tienen disponibles datos desde el inicio del estudio hasta los 24 meses. Los datos farmacocinéticos de estos pacientes para varios puntos del tiempo se presentan en la siguiente tabla.
|
Tabla 1. Resumen de los parámetros farmacocinéticos del Factor IX Recombinante para los datos de actividad por mes en los pacientes previamente tratados 49 |
|||||||
|
Parámetro |
Mes |
n |
Media |
Mediana |
DE |
Rango |
IC 95% |
|
Recuperación (%) |
0 6 12 18 24 |
56 53 50 47 47 |
33,7 31,8 31,3 30,7 31,0 |
31,5 31,0 30,5 28,9 30,6 |
10,31 9,04 8,75 9,24 8,80 |
15,3-62,2 15,3-56,7 16,2-53,1 12,6-62,1 16,2-59,4 |
30,9-36,4 29,4-34,3 28,8-33,7 28,0-33,5 28,4-33,6 |
|
Aumento de FIX (UI/dl por UI/kg) |
0 6 12 18 24 |
56 53 50 47 47 |
0,75 0,71 0,70 0,68 0,69 |
0,70 0,69 0,68 0,64 0,68 |
0,23 0,20 0,19 0,21 0,20 |
0,34-1,38 0,34-1,26 0,36-1,18 0,28-1,38 0,36-1,32 |
0,69-0,81 0,65-0,76 0,64-0,75 0,62-0,74 0,63-0,75 |
|
Vida media de eliminación (horas) |
0 6 12 18 24 |
56 53 49 46 45 |
19,3 19,8 18,5 18,9 18,9 |
19,1 18,2 16,6 16,3 17,3 |
4,97 6,26 5,89 7,02 6,84 |
11,1-36,4 9,6-38,2 10,6-33,7 10,7-38,3 10,9-42,2 |
18,0-20,7 18,1-21,6 16,8-20,2 16,8-21,0 16,8-20,9 |
|
AUC0 0-?(UI x hora/dL) |
0 6 12 18 24 |
56 53 49 46 45 |
619,8 579,8 575,7 561,8 577,6 |
605,2 562,2 566,0 560,9 551,7 |
155,7 146,1 151,0 155,6 154,7 |
366,5-1072,6 330,9-900,1 290,3-1080,8 254,5-940,8 284,1-1045,4 |
578,1-661,5 539,5-620,1 532,4-619,1 515,7-608,0 531,1-624,1 |
|
Vida Media |
0 |
54 |
2,0 |
1,5 |
1,60 |
0,07-5,73 |
1,6-2,5 |
|
Fase Inicial (horas) |
6 12 18 24 |
52 48 44 43 |
2,3 2,2 2,0 1,8 |
1,0 1,2 1,3 0,78 |
2,62 2,70 1,94 2,07 |
0,12-9,98 0,13-14,34 0,13-6,21 0,11-7,43 |
1,5-3,0 1,5-3,0 1,4-2,6 1,1-2,4 |
|
Depuración (ml/hora/kg) |
0 6 12 18 24 |
56 53 49 46 45 |
8,4 9,2 9,3 9,6 9,2 |
8,2 8,9 8,8 8,9 9,1 |
2,01 2,48 2,53 2,85 2,40 |
4,66-13,64 5,55-15,11 4,63-17,22 5,31-19,65 4,78-17,60 |
7,86-8,94 8,53-9,89 8,56-10,01 8,78-10,47 8,52-9,96 |
|
MRT (horas) |
0 6 12 18 24 |
56 53 49 46 45 |
26,0 25,6 24,6 24,7 25,1 |
25,8 25,3 22,2 22,7 23,9 |
6,07 5,68 6,47 7,40 6,94 |
15,81-46,09 13,44-42,26 14,83-38,75 15,30-50,75 15,65-47,52 |
24,35-27,60 24,01-27,15 22,75-26,47 22,55-26,94 23,00-27,17 |
|
Se excluyen los datos de un paciente después de que se observó a los 9 meses evidencia de desarrollo de inhibidor.50 AUC00-?= Área Bajo la Curva MRT = Tiempo Medio de Residencia DE = Desviación Estándar IC = Intervalo de Confianza |
|||||||
En el estudio farmacocinético original aleatorio transversal en pacientes previamente tratados (PTP), la recuperación in vivo utilizando BENEFIX® previamente comercializado fue estadísticamente menos significativa (28% menos) que la recuperación utilizando un producto altamente purificado de factor IX derivado de plasma.51 No existió diferencia significativa en la vida media biológica.52 Las diferencias estructurales de la molécula de BENEFIX® en comparación con las de pdFIX demostraron contribuir a la baja recuperación.53
En un estudio farmacocinético aleatorio transversal, BENEFIX® reconstituido en un diluyente de cloruro de sodio 0,234% demostró bioequivalencia con el BENEFIX® comercializado previamente (reconstituido con Agua Estéril para Inyección) en 24 pacientes tratados previamente (=12 años) a una dosis de 75 UI/kg. Las medias (± DE) de los valores de recuperación incremental (valores K) fueron 0,73 ± 0,20 UI/dL por UI/kg para BENEFIX® y 0,68 ± 0,18 UI/dL por UI/kg para BENEFIX® previamente comercializado. Las medias (± DE) para los valores del área bajo la curva (AUC) fueron 940 ± 237 y 880 ± 220 UI·h/dL para BENEFIX® y BENEFIX® previamente comercializado, respectivamente. Las medias (± DE) para los valores de vida media fueron 22,4 ± 5,3 horas para BENEFIX® y 23,4 ± 5,2 horas para BENEFIX® previamente comercializado. Los parámetros farmacocinéticos se sometieron a seguimiento en 23 pacientes previamente tratados (=12 años) después de la administración repetida de BENEFIX® durante seis meses y se encontró que no cambiaban en comparación con los obtenidos en la evaluación inicial. Los valores K, determinados por edad, fueron en promedio 0,78 ± 0,19 UI/dL por UI/kg (rango 0,39 a 1,2 UI/dL por UI/kg) para los pacientes >15 años de edad (n=16), y 0,66 ± 0,16 UI/dL por UI/kg (rango 0,44 a 0,92 UI/dL por UI/kg) para los pacientes =15 años de edad (n=7).54,55
FARMACODINÁMICA, EFICACIA CLÍNICA44,45,46
En 4 estudios clínicos de BENEFIX® , un total de 128 sujetos (56 pacientes tratados previamente [PTP], 9 sujetos que participaron únicamente en el estudio quirúrgico y 63 pacientes no tratados previamente [PUP]) recibieron más de 28 millones de UI administradas durante un periodo de hasta 64 meses. Los estudios incluyeron 121 sujetos VIH negativos y 7 VIH positivos.
Cincuenta y seis PTP recibieron aproximadamente 20,9 millones de UI de BENEFIX® en dos estudios clínicos. La mediana de de días de exposición fue 83,5. Estos PTP que fueron tratados por episodios hemorrágicos a demanda o para prevenir hemorragias se sometieron a seguimiento durante una mediana de intervalo de 24 meses (rango 1 a 29 meses; media 23,4 ± 5,34 meses). Cincuenta y cinco de estos PTP recibieron una dosis mediana de 42,8 UI/kg (rango 6,5 a 224,6 UI/kg; media 46,6 ± 23,5 UI/kg) por infusión para los episodios hemorrágicos. Todos los sujetos fueron evaluados para establecer la eficacia. Un sujeto se retiró del estudio después de un mes de tratamiento debido a episodios hemorrágicos que fueron difíciles de controlar; este sujeto no tenía un inhibidor detectable. La dosis del sujeto no se había titulado adecuadamente. Los 55 sujetos restantes fueron tratados exitosamente. Los episodios hemorrágicos que fueron manejados exitosamente incluyeron hemartrosis y hemorragia en tejido blando y músculo. No fueron reportados los datos relacionados con la severidad de los episodios hemorrágicos. Ochenta y ocho por ciento del total de infusiones administradas por episodios hemorrágicos se calificaron como que proporcionaban una respuesta “excelente” o “buena”. Ochenta y uno por ciento del total de episodios hemorrágicos fueron manejados con una única infusión de BENEFIX® . Un sujeto desarrolló un bajo título de inhibidor transitorio (título máximo 1,5 UB). Este sujeto había recibido previamente productos derivados de plasma sin antecedentes de desarrollo de inhibidores. Pudo continuar el tratamiento con BENEFIX® sin ningún aumento anamnésico en el inhibidor o anafilaxis; sin embargo, fue necesario aumentar la frecuencia de administración de BENEFIX® ; posteriormente, se resolvió el inhibidor del factor IX del sujeto y su efecto sobre la vida media de BENEFIX® .
A cuarenta y uno de los sujetos se les realizó mediciones de fibrinopéptido A y del fragmento 1+2 de la protrombina antes de la infusión, 4 a 8 horas y 24 horas después de la infusión. Veintinueve de los sujetos presentaron elevaciones en el fibrinopéptido A con un valor máximo de 35,3 nmol/L (22 de los 29 sujetos presentaron valores elevados al inicio del estudio). Diez de los sujetos presentaron elevación del fragmento 1+2 de la protrombina con un valor máximo de 1,82 nmol/L (3 de los 10 sujetos presentaron valores elevados al inicio del estudio).
Un total de 20 PTP fueron tratados con BENEFIX® para profilaxis secundaria (administración regular de terapia de reemplazo FIX para prevenir la hemorragia en pacientes que pueden tener evidencia clínica ya demostrada de artropatía hemofílica o enfermedad de las articulaciones) a algún intervalo regular durante el estudio con una media de 2,0 infusiones por semana. Se le administró BENEFIX® a 19 sujetos para profilaxis secundaria rutinaria (al menos dos veces a la semana) para un total de 345 pacientes-mes con una mediana de seguimiento promedio de 24 meses por sujeto. La dosis promedio utilizada por estos 19 sujetos fue 40,3 UI/kg, con un rango entre 13 y 78 UI/kg. Un sujeto adicional fue tratado semanalmente, utilizando una dosis promedio de 33,3 UI/kg, durante un periodo de 21 meses. Noventa y tres por ciento de las respuestas fueron calificadas como “excelente” o “efectiva”. Estos 20 PTP recibieron un total de 2.985 infusiones de BENEFIX® para profilaxis de rutina. Siete de estos PTP experimentaron un total de 26 episodios hemorrágicos espontáneos dentro de las 48 horas después de la infusión.
Se evaluó el manejo de la hemostasis en el ambiente quirúrgico. Treinta y seis procedimientos quirúrgicos se realizaron en 28 sujetos. Trece (13) procedimientos quirúrgicos menores se realizaron en 12 sujetos, que incluyeron 7 procedimientos dentales, 1 biopsia de la piel con sacabocados, 1 remoción de quiste, 1 esterilización masculina, 1 ablación de nevus y 2 remociones de uñas encarnadas. Veintitrés (23) procedimientos quirúrgicos mayores fueron realizados en 19 sujetos, que incluyeron un transplante de hígado, esplenectomía, 3 reparaciones de hernia inguinal, 11 procedimientos ortopédicos, un desbridamiento de la pantorrilla y 6 extracciones dentales con complicaciones.
Veintitrés (23) sujetos se sometieron a 27 procedimientos quirúrgicos con régimen de reemplazo de pulso. La dosis perioperatoria (preoperatoria e intraoperatoria) media para estos procedimientos fue 85 ± 32,8 UI/kg (rango 25-154,9 UI/kg). La dosis postoperatoria (pacientes hospitalizados y de consulta externa) total media fue 63,1 ± 22,0 UI/kg (rango 28,6-129,0).
La cobertura total de BENEFIX® durante el periodo quirúrgico para los procedimientos mayores estuvo dentro del rango de 4.230 a 385.800 UI. La dosis preoperatoria para los procedimientos mayores estuvo dentro del rango de 75 a 155 UI/kg. Nueve de los procedimientos quirúrgicos mayores fueron realizados en 8 sujetos utilizando un régimen continuo de infusión. Después de la dosis de bolo preoperatoria (94,1 -144,5 UI/kg), se administró infusión continua de BENEFIX® a una tasa media de 6,7 UI/kg/h (rango de tasas promedio: 4,3-8,6 UI/kg/h; media 6,4 ± 1,5 UI/kg/h) con una duración mediana de 5 días (rango 1-11 días; media 4,9 ± 3,1). Seis de los 8 sujetos que habían recibido infusión continua de BENEFIX® con las cirugías mayores fueron cambiados a regímenes de pulso intermitente con una dosis mediana de 56,3 UI/kg (rango 33,6-89,1 UI/kg; media 57,8 ± 18,1 UI/kg DE) con una mediana de 3,5 días de exposición (rango 1-5 días, media 3,3 ± 1,4 DE) durante el periodo postoperatorio. Aunque los niveles circulantes de factor IX buscados para mantener la hemostasis fueron alcanzados con los regímenes de reemplazo de pulso y de infusión continua, la experiencia en los estudios clínicos con la infusión continua de BENEFIX® para profilaxis quirúrgica en hemofilia B es demasiado limitada para establecer la seguridad y eficacia clínica de la administración del producto por infusión continua. A los sujetos que se les administró BENEFIX® mediante infusión continua para profilaxis quirúrgica recibieron también infusiones intermitentes en bolo del producto.
Entre los sujetos sometidos a cirugía, el aumento en la mediana de la actividad del factor IX circulante fue 0,7 UI/dL por UI/kg aplicada por infusión (rango 0,3-1,2 UI/dL; media 0,8 ± 0,2 UI/dL por UI/kg). La mediana de la vida media de eliminación para los sujetos sometidos a cirugía fue 19,4 horas (rango 10-37 horas; media 21,3 ± 8,1 horas).
La hemostasis fue mantenida durante el periodo quirúrgico; sin embargo, un sujeto requirió de drenaje de un hematoma en el sitio de la herida quirúrgica y otro sujeto que recibió BENEFIX® después de una extracción dental requirió intervención quirúrgica adicional debido a exudación en el sitio de extracción. No existió evidencia clínica de complicaciones trombóticas en ninguno de los sujetos. En siete sujetos para los que el fibrinopéptido A y el fragmento 1+2 de la protrombina se midieron antes de la infusión, a las 4 a 8 horas y posteriormente a diario hasta las 96 horas, no existió evidencia de aumento significativo en la activación de la coagulación. Los datos de los otros dos sujetos se consideraron no evaluables.
En un estudio de seguridad y eficacia de etiqueta abierta durante una mediana de 89 días de exposición, 63 pacientes previamente no tratados (PUP) recibieron aproximadamente 6,2 millones de UI de BENEFIX® . A estos PUP se les realizó seguimiento durante una mediana de intervalo de 37 meses (rango 4 a 64 meses; media 38,1 ± 16,4 meses). Cincuenta y cuatro de estos PUP recibieron una dosis mediana de 62,7 UI/kg (intervalo 8,2 a 292,0 UI/kg; media 75,6 ± 42,5 UI/kg) por infusión para los episodios hemorrágicos. Los datos relacionados con la severidad de los episodios hemorrágicos no fueron reportados. Noventa y cuatro por ciento de las infusiones administradas al inicio del tratamiento de la hemorragia se calificaron como que proporcionaban una respuesta “excelente” o “buena”.
Setenta y cinco por ciento de todos los episodios hemorrágicos fueron manejados con una única infusión de BENEFIX® . Tres de estos 54 sujetos no fueron tratados exitosamente, incluyendo un episodio en un sujeto debido al tiempo de demora para la infusión y a la dosis insuficiente, y en 2 sujetos debido a la formación de inhibidor. Un sujeto desarrolló un inhibidor de alto título (título máximo 42 UB) el día 7 de la exposición. Un segundo sujeto desarrolló un inhibidor de título alto (título máximo 18 UB) después de 15 días de exposición. Ambos sujetos experimentaron manifestaciones alérgicas asociadas al tiempo de desarrollo de su inhibidor.
A treinta y dos PUP se les administró BENEFIX® para profilaxis de rutina. A 24 PUP se administró BENEFIX® por lo menos dos veces a la semana para un total de 2.587 infusiones. La dosis media por infusión fue 72,5 ± 37,1 UI/kg, y la duración media de la profilaxis fue 13,4 ± 8,2 meses. A 8 PUP se les administró BENEFIX® una vez a la semana para un total de 571 infusiones. La dosis media por infusión fue 75,9 ± 17,9 UI/kg, y la duración media de la profilaxis fue 17,6 ± 7,4 meses. Cinco PUP experimentaron un total de 6 episodios hemorrágicos espontáneos dentro de las 48 horas después de la infusión.
Veintitrés PUP recibieron BENEFIX® para profilaxis quirúrgica en 30 procedimientos quirúrgicos. Todos los procedimientos quirúrgicos fueron menores, excepto 2 reparaciones de hernia. La dosis preoperatoria de bolo estuvo dentro del rango de 32,3 UI/kg y 247,2 UI/kg. La dosis preoperatoria total estuvo dentro del rango de 385 a 23.280 UI. Cinco de los procedimientos quirúrgicos fueron realizados utilizando un régimen de infusión continua durante 3 a 5 días. La experiencia en estudios clínicos con la infusión continua de BENEFIX® para profilaxis quirúrgica de la hemofilia B es muy limitada para establecer la seguridad y eficacia clínica de la administración del producto mediante infusión continua.
CONTRAINDICACIONES: BENEFIX® está contraindicado en pacientes con una historia conocida de hipersensibilidad a cualquiera de los componentes de la preparación o en pacientes con historia conocida de hipersensibilidad a las proteínas de hámster.
EMBARAZO: No se han llevado a cabo estudios de reproducción animal o durante la lactancia con el uso de BENEFIX® . No hay suficiente experiencia con el uso de productos factor IX en mujeres embarazadas. Por lo tanto, el factor IX debe ser administrado en mujeres embarazadas solo si está indicado claramente.
LACTANCIA: No hay suficiente experiencia con el uso de los productos del factor IX en mujeres en periodo de lactancia, por lo tanto BENEFIX® debe administrarse a mujeres lactantes solo si está indicado claramente.
REACCIONES ADVERSAS: En la tabla de abajo, se utilizaron las siguientes categorías de frecuencia y términos del CIOMS (Council for Internacional Organizations of Medical Sciences):
|
Muy común: |
> 10% |
|
Común: |
> 1% y < 10% |
|
Poco común: |
> 0.1% y < 1% |
|
Raro: |
> 0.01% y < 0.1% |
|
Muy raro: |
< 0.01% |
La siguiente tabla enumera las reacciones adversas reportadas en los estudios clínicos pivotales con pacientes previamente tratados y en el entorno poscomercialización. Las frecuencias presentadas se basan en un estudio clínico con 65 pacientes.
|
Sistema Corporal |
Reacción Adversa34 |
|
Frecuencia por Infusión |
|
|
Cuerpo como un todo |
|
|
Raro |
Hipersensibilidad/reacciones alérgicas (incluidas, entre otras urticaria, urticaria generalizada, escalofríos (rigidez), ruborización, angioedema, presión en el pecho, laringoespasmo, broncoespasmo, disnea, sibilancias, desmayo, hipotensión, taquicardia, visión borrosa, anafilaxia) |
|
Anafilaxia |
|
|
Alteraciones de los Sistemas Linfático y Sanguíneo |
|
|
Raro |
Inhibición del Factor IXa |
|
Alteraciones Vasculares |
|
|
Raro |
Flebitis en el sitio de aplicación |
|
Alteraciones del Sistema Nervioso |
|
|
Poco común |
Mareo, cefalea |
|
Raro |
Temblor, somnolencia |
|
Alteraciones Renales y Urinarias |
|
|
Raro |
Infarto renalb |
|
Alteraciones Cardiacas |
|
|
Raro |
Hipotensión, taquicardia |
|
Alteraciones Respiratorias, Torácicas y Mediastinales |
|
|
Raro |
Dificultad respiratoria |
|
Muy raro |
Tos seca |
|
Alteraciones Gastrointestinales |
|
|
Poco común |
Náusea |
|
Raro |
Vómito |
|
Piel |
|
|
Raro |
Angioedema, celulitis en el sitio de la inyección, urticaria, rash35 |
|
Órganos de los Sentidos |
|
|
Poco común |
Alteración del gusto |
|
Alteraciones generales o en el sitio de administración |
|
|
Poco común |
Reacción en el sitio de inyección (incluido prurito en el sitio de infusión, eritema en el sitio de infusión), dolor en el sitio de infusión (incluida irritación en el sitio de infusión). |
|
Raro |
Fiebre |
|
a Formación transitoria del inhibidor de baja titulación. b El infarto renal se desarrolló en un paciente positivo para el anticuerpo de la hepatitis C 12 días después de una dosis de BENEFIX® para tratar un episodio hemorrágico. La relación del infarto con la administración previa de BENEFIX® es incierta. |
|
La siguiente tabla enumera las reacciones adversas reportadas en los estudios clínicos pivotales con pacientes previamente tratados, previamente no tratados y en el entorno poscomercialización. Las frecuencias presentadas en la siguiente tabla se basan en estudios clínicos con 213 pacientes.36
|
Clase de Sistema Corporal |
Reacción Adversa37 |
|
Frecuencia por Paciente (N=213) |
|
|
Alteraciones de los Sistemas Linfático y Sanguíneo |
|
|
Común |
Inhibición del Factor IXa |
|
Alteraciones Oculares |
|
|
Poco común |
Visión borrosa |
|
Alteraciones Gastrointestinales |
|
|
Común |
Náuseas |
|
Poco común |
Vómito |
|
Alteraciones generales o en el sitio de administración |
|
|
Común |
Reacción en el sitio de infusión (incluido prurito en el sitio de infusión, eritema en el sitio de infusión), dolor en el sitio de infusión (incluida irritación en el sitio de infusión), fiebre |
|
Poco común |
Hipersensibilidad (incluida anafilaxia), escalofríos (rigidez) |
|
Infecciones e Infestaciones |
|
|
Poco común |
Celulitis en el sitio de inyección IV, flebitis en el sitio de inyección IV |
|
Alteraciones del Sistema Nervioso |
|
|
Común |
Mareo, cefalea, disgeusia (alteración funcional del sentido del gusto / distorsión del sentido del gusto) |
|
Poco común |
Agitación, somnolencia |
|
Alteraciones Renales y Urinarias |
|
|
Poco común |
Infarto renalb |
|
Alteraciones Cardiacas |
|
|
Raro |
Hipotensión, taquicardia |
|
Alteraciones Respiratorias, Torácicas y Mediastinales |
|
|
Poco común |
Dificultad respiratoria (disnea, hipoxia), molestia en el pecho, tos. |
|
Alteraciones de la Piel y Cutáneas |
|
|
Común |
Angioedema, urticaria, sarpullido35 |
|
Alteraciones Vasculares |
|
|
Común |
Rubefacción |
|
a Formación transitoria del inhibidor de baja titulación. b El infarto renal se desarrolló en un paciente positivo para el anticuerpo de la hepatitis C 12 días después de una dosis de BENEFIX® para tratar un episodio hemorrágico. La relación del infarto con la administración previa de BENEFIX® es incierta. |
|
En algunos casos, las reacciones de hipersensibilidad han progresado a una anafilaxia severa. Reacciones alérgicas han ocurrido en asociación temporal estrecha con el desarrollo de inhibidores del factor IX. Si se presentan reacciones alérgicas/anafilácticas se debe descontinuar inmediatamente la administración de BENEFIX® . En caso de reacciones alérgicas severas, deben considerarse medidas hemostáticas alternas. El tratamiento requerido depende de la naturaleza y severidad de los efectos adversos. Aún, no ha sido elucidada la etiología de las reacciones alérgicas con BENEFIX® ni con otros productos con factor IX.
Si ocurre alguna reacción adversa que se considere relacionada con la administración de BENEFIX® , se debe disminuir la velocidad de la infusión o suspender la infusión.
Doce días después de la administración de una dosis de BENEFIX® para un episodio de sangrado, un paciente que tenía anticuerpos positivos para hepatitis C desarrolló un infarto renal. La relación del infarto con la administración previa de BENEFIX® es desconocida. Este paciente continúa siendo tratado con BENEFIX® .
Pacientes con hemofilia B pueden desarrollar anticuerpos neutralizantes (inhibidores).
Uno de 65 pacientes de BENEFIX® (incluyendo 9 pacientes participando solo en un estudio de cirugía) que previamente habían recibido productos derivados del plasma (PTPs), presentó un inhibidor transitorio de baja respuesta (titulación máxima 1,5 UB) clínicamente relevante.38 Este paciente pudo continuar el tratamiento con BENEFIX® sin presentar aumento del inhibidor ni anafilaxis.
De los resultados del estudio en pacientes previamente no tratados (PUP), 2/63 pacientes desarrollaron inhibidores después de 7 y 15 días de exposición. Ambos tuvieron elevados títulos de inhibidores. Ambos pacientes experimentaron manifestaciones alérgicas en asociación temporal con el desarrollo del inhibidor.39
Experiencia poscomercialización. Se han reportado para BENEFIX® y para los productos del factor IX derivados de plasma las siguientes reacciones adversas poscomercialización: Recuperación inadecuada del factor IX, respuesta terapéutica inadecuada, desarrollo del inhibidor (ver Farmacodinámica, Eficacia clínica), anafilaxis (ver Advertencias especiales), disnea, hipotensión y trombosis.40,41
No se ha establecido la seguridad y eficacia de la administración de BENEFIX® mediante infusión continua (ver Advertencias especiales). Se han presentado informes poscomercialización de eventos trombóticos, que incluyen síndrome de la vena cava superior (SVC) que pone en peligro la vida en neonatos críticamente enfermos, mientras recibían BENEFIX® por infusión continua a través de un catéter venoso central.42 También se han reportado casos de tromboflebitis periférica y trombosis venosa profunda (DVT).43 En algunos casos, BENEFIX® se administró vía infusión continua, que no es el método aprobado de administración (ver Administración y Advertencias especiales).
Si se presenta alguna reacción adversa que se considera relacionada con la administración de BENEFIX® , se debe disminuir la tasa de infusión o interrumpir la infusión
INTERACCIONES: No se conocen interacciones de los productos de coagulación recombinante del factor IX con otros productos medicinales.
INFORMACIÓN DE SEGURIDAD PRECLÍNICA: BENEFIX® ha demostrado en el test de Ames que no es mutagénico y en el análisis de aberraciones cromosómicas que no es clastogénico. No se han llevado a cabo investigaciones sobre la carcinogénesis o el deterioro de la fertilidad.
INTERFERENCIA CON EXÁMENES DE LABORATORIO Y OTROS EXÁMENES DE DIAGNÓSTICO: Se observó una corrección temporal del tiempo parcial de tromboplastina (TPT) anormal; no se observó ningún efecto sobre el tiempo parcial de tromboplastina (TPT) normal.
PRECAUCIONES: Históricamente la administración de concentrados del complejo de factor IX derivado del plasma humano, que contienen los factores II, VII, IX y X ha sido asociada con el desarrollo de complicaciones tromboembólicas.23 Aunque BENEFIX® solo contiene el factor IX, se debe reconocer el riesgo potencial de trombosis y de coagulación intravascular diseminada observado con otros productos que contienen factor IX. Debido al riesgo potencial de complicaciones tromboembólicas, se debe tener mucha precaución cuando se administre este producto a pacientes con enfermedad hepática, en el post operatorio, neonatos, o a pacientes en riesgo de fenómenos tromboembólicos o de coagulación intravascular diseminada (CID). En cada uno de estos casos se debe evaluar el beneficio del tratamiento con BENEFIX® frente al riesgo de estas complicaciones.
Los anticuerpos neutralizantes de la actividad (inhibidores) han sido detectados en pacientes con el uso de productos que contienen el factor IX. Al igual que con todos los productos del factor IX, pacientes en tratamiento con BENEFIX® deben ser monitorizados para el desarrollo de inhibidores del factor IX. Los pacientes con inhibidores del factor IX pueden encontrarse en un riesgo aumentado de anafilaxis en la medida en que se pongan en contacto con el factor IX.24 Los pacientes que presenten reacciones alérgicas deben ser evaluados para la presencia de inhibidores. La información preliminar sugiere que puede existir una relación entre la presencia de mutaciones importantes de deleción en el gen del factor IX del paciente y un riesgo aumentado para la formación de inhibidores y de reacciones agudas de hipersensibilidad. Los pacientes a los que se les conoce que tienen una mutación importante de deleción en el gen del factor IX, deben ser supervisados estrictamente para signos y síntomas de reacciones de hipersensibilidad aguda, particularmente durante las fases tempranas de exposición al producto.25,26,27 En vista del potencial para reacciones alérgicas con concentrados del factor IX, las administraciones iniciales (aproximadamente 10-20) del factor IX deben ser llevadas a cabo bajo estricta supervisión médica y en donde exista una atención médica adecuada que pueda manejar casos de reacción alérgica.
No se ha establecido la seguridad y eficacia de la administración de BENEFIX® mediante infusión continua. Se han presentado reportes poscomercialización de eventos trombóticos incluyendo Síndrome de Vena Cava Superior en neonatos críticamente enfermos, que estaban recibiendo BENEFIX® mediante infusión continua a través de catéter venoso central.28
ADVERTENCIAS ESPECIALES: Para todos los productos de factor IX, incluyendo a BENEFIX® , se han reportado reacciones de hipersensibilidad, de tipo alérgico incluyendo anafilaxis11. Con frecuencia, estos eventos han ocurrido en cercana asociación temporal con el desarrollo de inhibidores del factor IX.12 Se debe informar a los pacientes de los síntomas y signos tempranos de reacciones de hipersensibilidad, incluyendo urticaria, urticaria generalizada, escalofríos (rigidez),13 ruborización,14 angioedema, presión en el pecho, laringoespasmo,15 broncoespasmo,16 disnea, sibilancias, desmayo, hipotensión, taquicardia, visión borrosa17 y anafilaxia. Si se presentan reacciones alérgicas o anafilácticas se debe suspender inmediatamente la administración de BENEFIX® y se debe proporcionar tratamiento médico adecuado, que puede incluir tratamiento para choque. Si alguno de los síntomas descritos ocurren, se debe aconsejar a los pacientes descontinuar la utilización del producto y contactar a su médico y/o buscar inmediatamente cuidado de urgencias dependiendo del tipo y la severidad de la reacción.
Se ha reportado síndrome nefrótico después de la inducción de tolerancia inmune con productos del factor IX en pacientes con hemofilia B, que desarrollaron inhibidores del factor IX y con antecedentes de reacciones alérgicas al factor IX.18 No se ha establecido la seguridad y eficacia de la utilización de BENEFIX® para la inducción de tolerancia inmune.
Como la utilización de concentrados del complejo de factor IX, se ha asociado históricamente con el desarrollo de complicaciones tromboembólicas, la utilización de productos que contienen factor IX puede ser potencialmente peligrosa en pacientes con signos de fibrinólisis y en pacientes con Coagulación Intravascular Diseminada (CID).19,20,21,22
DOSIS Y ADMINISTRACIÓN
Dosis: El tratamiento debe iniciarse bajo la supervisión de un médico experimentado en el tratamiento de la hemofilia B.
El tratamiento con cualquier producto de factor IX, incluyendo BENEFIX® , requiere un ajuste individualizado de la dosis. La dosis y la duración del tratamiento, para todos los productos del factor IX, dependen de la severidad de la deficiencia del factor IX, la localización y la extensión del sangrado y la condición clínica del paciente. La dosificación de BENEFIX® puede diferir de los productos del factor IX derivados del plasma.
Para asegurarse que el nivel de actividad del factor IX deseado ha sido alcanzado, se recomienda la monitorización precisa empleando el análisis de la actividad del factor IX, en particular para intervenciones quirúrgicas. Con el fin de ajustar la dosis más apropiada, las dosis deben ser tituladas teniendo en cuenta la actividad del factor IX, los parámetros farmacocinéticos (tales como la vida media y recuperación), así como la situación clínica.
El número de unidades del factor IX administradas está expresado en Unidades Internacionales (UI), las cuales se relacionan con los estándares actuales de la Organización Mundial de la Salud (OMS) para los productos del factor IX. La actividad del factor IX en el plasma está expresada bien como porcentaje (relacionado al plasma normal humano) o en Unidades Internaciones (relacionadas al estándar internacional para el factor IX en plasma). Una Unidad Internacional (UI) de actividad del factor IX equivale a aquella cantidad de factor IX en un mL de plasma normal humano. La estimación de la dosis requerida de BENEFIX® se puede basar en el hallazgo de que la actividad de una unidad de factor IX por kg/peso corporal se espera que aumente el nivel circulante del factor IX, en un promedio de 0.8 UI/dL +/- 0.2 (rango promedio 0.4 a 1.4 UI/dL) en pacientes adultos (>15 años) y un promedio de 0.7 +/- 0.3 (rango de 0.2 a 2.1UI/dL) en pacientes pediátricos (< 15 años). En cada paciente se debe evaluar regularmente la farmacocinética y ajustar la dosis de conformidad.
La dosis requerida se puede determinar mediante la siguiente fórmula:
|
Número de UI de factor IX requeridas |
= |
Peso corporal |
x |
Incremento deseado de factor IX |
x |
El Recíproco de la Recuperación Observada* |
|
(Kg) |
(% o U.I./dL) |
(UI/Kg por UI/dL) |
* 1.2 UI/kg en adultos2
* 1.4 UI/kg en niños < 15 años3
Dosificación para los episodios de sangrado y cirugía: En caso de que se presenten eventos hemorrágicos como los mencionados en la tabla a continuación, la actividad del factor IX no debe estar por debajo del nivel de actividad plasmática dada (en % de lo normal o UI/dL) durante el periodo correspondiente.
|
Tipo de Hemorragia |
Actividad requerida de factor IX circulante (% o UI/dL) |
Frecuencia de las dosis (horas) |
Duración del tratamiento (días) |
|
Menor Hemartrosis no complicada, músculo superficial o tejido blando |
20 - 30 |
12 - 24 |
1 - 2 |
|
Moderada Intramuscular o de tejidos blandos con disección de las membranas mucosas, extracciones dentales, o hematuria |
25 - 50 |
12 - 24 |
Tratar hasta que se detenga el sangrado y se inicie la cicatrización; aprox. 2 a 7 días |
|
Severa Faringe, retrofaringe, retroperitoneo, SNC, cirugía. |
50 - 100 |
12 - 24 |
7 - 10 |
|
Adaptado de Roberts y Eberst4 |
|||
Dosis para profilaxis: En un estudio clínico para la profilaxis secundaria de rutina, la dosis promedio para pacientes adultos previamente tratados (PPT) fue de 40 UI/kg (rango 13 a 78 UI/kg) en intervalos de 3 o 4 días. En pacientes más jóvenes pueden ser necesarios intervalos más cortos o dosis más altas.
Inhibidores: Al igual que con todos los productos con factor IX, los pacientes con BENEFIX® deben ser monitorizados para el desarrollo de inhibidores del factor IX.
Administración: BENEFIX® se debe administrar teniendo en cuenta los cuidados de asepsia durante todo el procedimiento. BENEFIX® se administra intravenosamente después de reconstituir el polvo liofilizado para solución inyectable con el diluyente suministrado (Ver Manipulación). Debe ser inyectado durante varios minutos. La velocidad de administración debe ser determinada por el nivel de comodidad del paciente.
1. Conecte la jeringa al extremo ahusado del tubo del juego de infusión suministrado.
2. Coloque un torniquete y prepare el sitio de inyección limpiando bien la piel con una de las torundas humedecidas con alcohol suministradas con el kit.
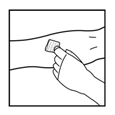
3. Realice la venopunción. Inserte en la vena la aguja del tubo del juego de infusión y retire el torniquete. BENEFIX® reconstituido se debe inyectar vía intravenosa durante varios minutos. La tasa de administración se debe establecer tomando en cuenta el grado de comodidad del paciente.
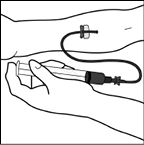
BENEFIX® reconstituido no debe administrarse por la misma vía con otros productos medicinales.
Luego de finalizar el tratamiento con BENEFIX® , retire el juego de infusión y deséchelo. Deseche toda la solución no utilizada, los viales vacíos y las agujas y jeringas utilizadas depositándolos en un recipiente apropiado para eliminación de desechos que pueden hacer daño a los demás si no se manipulan apropiadamente.
No se ha establecido la seguridad y eficacia de la administración mediante infusión continua (Ver también Advertencias especiales, Reacciones adversas).
BENEFIX® , cuando se reconstituye, contiene polisorbato 80, conocido por incrementar la velocidad de extracción del compuesto di-(2-etilhexil) ftalato (DEHF) del cloruro de polivinilo (PVC). Esto debe ser considerado durante la preparación y administración de BENEFIX® , incluyendo el tiempo de almacenamiento transcurrido en un contenedor de PVC luego de la reconstitución. Es importante que las recomendaciones incluidas en, Dosis y Administración sean seguidas estrechamente.6
BENEFIX® se debe administrar utilizando el juego de infusión suministrado en el kit y la jeringa prellenada con diluyente o una jeringa plástica desechable estéril. Además, la solución se debe extraer del vial utilizando el adaptador del vial.
La solución reconstituida antes de administrarla se puede almacenar a temperatura ambiente. Sin embargo, BENEFIX® se debe administrar dentro de las tres horas después de la reconstitución.7
NOTA: Se ha reportado aglutinación de glóbulos rojos en el catéter /jeringa con la administración de BENEFIX® . No se han reportado eventos adversos relacionados con esta observación. Para minimizar la posibilidad de aglutinación, es importante limitar la cantidad de sangre que entra al catéter. No debe entrar sangre a la jeringa. Si se observa aglutinación de glóbulos rojos en el catéter o en la jeringa, descarte todo el material (catéter, jeringa y solución de BENEFIX® ) y reinicie la administración con una nueva caja.8
RECONSTITUCIÓN: Siempre lave sus manos antes de realizar el siguiente procedimiento. Se deben utilizar técnicas de asepsia (es decir limpieza y ausencia de gérmenes) durante el procedimiento de reconstitución. Todos los componentes utilizados en la reconstitución y administración de este producto se deben utilizar tan pronto como sea posible después de abrir los contenedores estériles para minimizar la exposición innecesaria a la atmósfera.
BENEFIX® se administra mediante infusión intravenosa IV después de la reconstitución con el diluyente (diluyente cloruro de sodio al 0,234%) suministrado en la jeringa prellenada.
1. Permita que el vial del liofilizado de BENEFIX® y la jeringa prellenada de diluyente alcancen la temperatura ambiente.
2. Retire la tapa plástica del vial de BENEFIX® para exponer la porción central del tapón de goma.
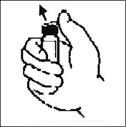
Limpie la tapa del vial con la torunda de alcohol suministrada, o utilice otra solución antiséptica y espere que seque. Después de limpiado, no toque el tapón de goma con sus manos ni permita que éste toque alguna superficie.
3. Desprenda la cubierta del empaque que contiene el adaptador del vial plástico transparente. No retire el adaptador de su empaque.
4. Coloque el vial sobre una superficie plana. Manteniendo el adaptador en el empaque, coloque el adaptador del vial sobre el vial. Presione el empaque firmemente hacia abajo hasta que el adaptador chasquee dentro de la tapa del vial en el momento en que la punta del adaptador penetra el tapón del vial. Deje el empaque del adaptador en su lugar.
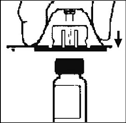
5. Tome el émbolo como se muestra en el diagrama. Evite el contacto con el eje del émbolo. Ensamble el extremo roscado del émbolo al émbolo de la jeringa con diluente empujándolo y girándolo firmemente.
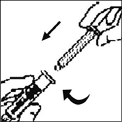
6. Retire la tapa plástica de seguridad de la punta de la jeringa de diluyente doblando hacia arriba y hacia abajo la tapa hasta romper la perforación. No toque el interior de la tapa ni la punta de la jeringa. Coloque la tapa sobre su costado en una superficie limpia en un sitio donde tenga la menor probabilidad para recibir contaminación ambiental.
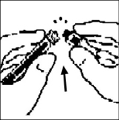
7. Retire el empaque del adaptador y deséchelo.
8. Coloque el vial sobre una superficie plana. Conecte la jeringa con el diluyente al adaptador del vial insertando la punta de la jeringa dentro de la abertura del adaptador mientras empuja firmemente y gira la jeringa en dirección de las manecillas del reloj hasta que se asegure la conexión.
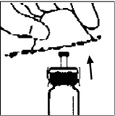
9. Lentamente empuje el émbolo para inyectar todo el diluyente dentro del vial de BENEFIX® .
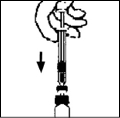
10. Sin retirar la jeringa, rote suavemente el contenido del vial hasta que se disuelva el polvo.
11. Antes de la administración inspeccione la solución final para determinar la presencia de manchitas. La solución debe ser transparente e incolora.
Nota: Si utiliza más de un vial de BENEFIX® por infusión, reconstituya cada vial siguiendo las instrucciones anteriores.
12. Asegúrese de que el émbolo de la jeringa está completamente hundido, invierta el vial. Extraiga lentamente la solución hacia la jeringa.
Nota: Si preparó más de un vial de BENEFIX® , retire la jeringa del diluyente del adaptador del vial, dejando el adaptador del vial puesto en el vial. Rápidamente coloque una jeringa luer lock grande separada y extraiga el contenido reconstituido como se indicó anteriormente. Repita este procedimiento con cada vial. No desensamble las jeringas con diluyente o la jeringa luer lock grande hasta que se esté listo para colocar la jeringa luer lock grande al siguiente adaptador de vial.
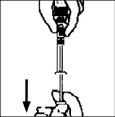
13. Retire la jeringa del adaptador vial jalándola y girándola suavemente en el sentido contrario a las manecillas del reloj. Descarte el vial con el adaptador puesto.
Nota: Si la solución no se va a utilizar inmediatamente, coloque cuidadosamente de nuevo la tapa de la jeringa. No toque la punta de la jeringa o el interior de la tapa.
BENEFIX® se debe administrar dentro de las 3 horas después de reconstituido. La solución reconstituida se puede almacenar a temperatura ambiente antes de su administración. 9
BENEFIX® , cuando se reconstituye, contiene polisorbato 80, conocido por aumentar la velocidad de extracción de di-(2-etilhexil) ftalato (DEHF) del cloruro de polivinilo (PVC).10 Esto se debe tener en cuenta durante la preparación y administración de BENEFIX® , incluyendo el tiempo de almacenamiento transcurrido en un contenedor de PVC luego de la reconstitución. Es importante que las recomendaciones incluidas en la sección Dosis y administración, sean seguidas estrictamente.
SOBREDOSIS: No se han reportado síntomas de sobredosis con los productos de coagulación recombinante del factor IX.
PRESENTACIÓN: Polvo para reconstitución e inyección intravenosa: (Reg. San. BENEFIX® 250 UI: INVIMA 2010 M-14055 R1. BENEFIX® 500 UI: INVIMA 2010 M-14078 R1. BENEFIX® 1000 UI: INVIMA 2013M-0014223. BENEFIX® 2000 UI: INVIMA 2014M-0015282. BENEFIX® 3000 UI: INVIMA 2014M-0015520.
Fecha de CDS reemplazado: Marzo 10, 2009
Fecha Efectiva: Enero 22, 2010
Versión CDS: 11.0
PFIZER S.A.S.
ALMACENAMIENTO Y CONSERVACIÓN: Se debe evitar congelar para prevenir el daño de la jeringa prellenada de diluyente.59
Eliminación: Todas las soluciones usadas, los viales, las agujas y jeringas vacías deben ser desechados de acuerdo a los requerimientos locales.
REFERENCIAS
1. WHO resources page. WHO Collaborative Centre for Drug Statistics Methodology Web site http://www.whocc.no/atacddd. Accessed March, 2009
2. Fernands A, Gencarella N, Appleton T, McCarthy K, Rup B, LeFevre Lerman VF. Safety and Efficacy Studies of Coagulation Factor IX (recombinant) (rFIX) in Previously Treated Patients with Severe and Moderate Hemophilia B. Genetics Institute Report Protocols C9407-21, C9408-21. Date of report: 21-Jul-1999.
3. Tam N, Wu M, Johnston M, Lilly L. A Study of the Safety and Efficacy of Recombinant Human Factor IX (rFIX) in the Treatment of Previously Untreated Patients (PUPs) with Severe or Moderately Severe Hemophilia B: Final Report (protocol 3090A1-300-WW). Wyeth Research CSR-51082. Date of report: 22-Sep-2003.
4. Roberts HR, Eberst ME. Current management of hemophilia B. Hematol Oncol Clin North Am. 1993;7(6):1269-1280.
5. eCTD STN 103677 Submission 0000 Module 3, Drug Product (Wyeth Farma, BENEFIX, intravenous) section 3.2.P.1.
6. Justification Document: Di-(2-ethylhexyl)phthalate and products containing polysorbate 80.
7. eCTD STN 103677 Submission 0000 Module 3, Drug Product (Wyeth Farma, BENEFIX, intravenous) section 3.2.P.8.1.
8. eCTD STN 103677 Submission 0000 Module 4, section 4.2.3.7.7.
9. eCTD STN 103677 Submission 0000 Module 3, Drug Product (Wyeth Farma, BENEFIX, intravenous) section 3.2.P.8.1.
10. Justification Document: Di-(2-ethylhexyl)phthalate and products containing polysorbate 80.
11. Committee for Proprietary Medical Products, European Agency for the Evaluation of Medicinal Products, Core SPC for Human Plasma Derived and Recombinant Coagulation Factor IX Products, London, 29 June 2000, CPMP/BPWG/1625/99. The following literature citations support the proposed change of ‘all factor IX products, including BENEFIX’ to “with factor IX products including BENEFIX.” For hypersensitivity reactions Warning. 1.Warrier I, Ewenstein BM, Koerper MA, et al. Factor IX inhibitors and anaphylaxis in hemophilia B. J Pediatr Hematol Oncol. 1997 Jan-Feb;19(1):23-7. 2. Thorland EC, Drost JB, Lusher JM, et al. Anaphylactic response to factor IX replacement therapy in haemophilia B patients: complete gene deletions confer the highest risk. Haemophilia. 1999 Mar;5(2):101-5. 3. Shapiro AD, Ragni MV, Lusher JM, et al. Safety and efficacy of monoclonal antibody purified factor IX concentrate in previouslyuntreated patients with hemophilia B. Thromb Haemost. 1996 Jan;75(1):30-5.
12. Committee for Proprietary Medical Products, European Agency for the Evaluation of Medicinal Products, Core SPC for Human Plasma Derived and Recombinant Coagulation Factor IX Products, London, 29 June 2000, CPMP/BPWG/1625/99.
13 Justification Document: Factor IX, Recombinant: Chills (rigors).
14. Justification Document: Factor IX, Recombinant: Flushing.
15. Justification Document: Justification for a Safety Labeling Decision for Nonacog alfa: Laryngospasm, 11-Apr-2008.
16. Justification Document: Justification for a Safety Labeling Decision for Nonacog alfa: Bronchospasm, 11-Apr-2008.
17. Justification Document: Justification for a Safety Labeling Decision for Nonacog alfa: Blurred vision, 24-Feb-2009.
18. Committee for Proprietary Medical Products, European Agency for the Evaluation of Medicinal Products, Core SPC for Human Plasma Derived and Recombinant Coagulation Factor IX Products, London, 29 June 2000, CPMP/BPWG/1625/99.
19. Franchini M, Veneri D. Thrombosis and bleeding: when opposites are not so far apart. Clin Lab. 2005;51:173-182.
20. Kapural L, Sprung J. Perioperative anticoagulation and thrombolysis in congenital and acquired coagulopathies. Anesthesiol Clin North America. 1999;17(4):923-958.
21. Sakuragawa N, Takahashi K, Itoh M, et al. Characteristics and thrombogenicity of factor IX concentrate. Bibl Haematol. 1977;44:88-93.
22. Shapiro AD, Paola JD, Cohen A, et al. The safety and efficacy of recombinant human blood coagulation factor IX in previously untreated patients with severe or moderately severe hemophilia B. Blood. 2005;105(2):518-525.
23. Lusher JM. Thrombogenicity associated with factor IX complex concentrates. Semin Hematol.1991;28(3 Suppl. 6):3-5.
24. Shapiro AD, Ragni MV, Lusher JM, et al. Safety and efficacy of monoclonal antibody purified factor IX concentrate in previously untreated patients with hemophilia B. Thromb Haemost. 1996;75(1):30-35.
25. Lusher JM. Inhibitor antibodies to factor VIII and factor IX: management. Semin Thromb Hemost. 2000;26(2):179-188.
26. Warrier I, Ewenstein BM, Koerper MA, et al. Factor IX inhibitors and anaphylaxis in hemophilia B. J Pediatr Hematol Oncol. 1997;19(1):23-27.
27. Thorland EC, Drost JB, Lusher JM, et al. Anaphylactic response to factor IX replacement therapy in haemophilia B patients: complete gene deletions confer the highest risk. Haemophilia. 1999;5(2):101-105.
28. Justification For a Safety Labeling Decision for Nonacog Alfa: Thrombophlebitis/Thrombosis with Continuous Infusion BENEFIX, 06-Aug-2007.
29. Tam N, Wu M, Johnston M, Lilly L. A Study of the Safety and Efficacy of Recombinant Human Factor IX (rFIX) in the Treatment of Previously Untreated Patients (PUPs) with Severe or Moderately Severe Hemophilia B: Final Report (protocol 3090A1-300-WW). Wyeth Research CSR-51082. Date of report: 22-Sep-2003.
30. Fernands A, Gencarella N, Appleton T, McCarthy K, Rup B, LeFevre Lerman VF. Safety and Efficacy Studies of Coagulation Factor IX (recombinant) (rFIX) in Previously Treated Patients with Severe and Moderate Hemophilia B. Genetics Institute Report Protocols C9407-21, C9408-21. Date of report: 21-Jul-1999.
31. CRS-72433. Version 1.1. Final report: An open-label, single arm, safety and efficacy study of recombinant human factor IX (rFIX; BENEFIX® ) in children less than 6 years of age with severe hemophilia B. Protocol 3090A1-301-WW.06-Jun-2008.
32. CRS-63359. Version 1.0. Final report: An open-label safety and efficacy study of recombinant human factor IX (rFIX; BENEFIX® ) in previously treated patients (PTPs) with hemophilia B. (FIX:C=2%). Protocol 3090A1-302-WW (C0124-21). 26-Jun-2006.
33. CRS-61849. Version 1.1. Final report: A double-blind, randomized, crossover evaluation of the pharmacokinetics of recombinant human factor IX (BENEFIX) rFIX and a new formulation of BENEFIX® (rFIX-R); and an open-label safety and efficacy evaluation of rFIX-R in previously treated patients with moderate a severe (FIX:C=2%) hemophilia B. Protocol 3090A1-304-WW. 18-Apr-2006.
34. Justification Document (J1 Form) relative to the Adverse Reactions frequency table prepared by James O’Shaughnessy, dated 05 Sep 2001.
35. Justification Document: Factor IX, Recombinant: Rash.
36. Strategy for updating the Adverse Drug Reaction list for incorporation into the BENEFIX® Core Data Sheet. 04-Aug-2008.
37. BENEFIX® Pivotal ADRs.04-Aug-2008.
38. Fernands A, Gencarella N, Appleton T, McCarthy K, Rup B, LeFevre Lerman VF. Safety and Efficacy Studies of Coagulation Factor IX (recombinant) (rFIX) in Previously Treated Patients with Severe and Moderate Hemophilia B. Genetics Institute Report Protocols C9407-21, C9408-21. Date of report: 21-Jul-1999.
39. Tam N, Wu M, Johnston M, Lilly L. A Study of the Safety and Efficacy of Recombinant Human Factor IX (rFIX) in the Treatment of Previously Untreated Patients (PUPs) with Severe or Moderately Severe Hemophilia B: Final Report (protocol 3090A1-300-WW). Wyeth Research CSR-51082. Date of report: 22-Sep-2003.
40. Wyeth Correspondence dated 20-Oct-2000.
41. Safety Query Response: BENEFIX: Post-marketing Overview. 11-Jan-2007.
42. Justification For a Safety Labeling Decision for Nonacog Alfa: Thrombophlebitis/Thrombosis with Continuous Infusion BENEFIX, 06-Aug-2007.
43. Justification For a Safety Labeling Decision for Nonacog Alfa: Thrombophlebitis/Thrombosis with Continuous Infusion BENEFIX, 06-Aug-2007.
44. Fernands A, Gencarella N, Appleton T, McCarthy K, Rup B, LeFevre Lerman VF. Safety and Efficacy Studies of Coagulation Factor IX (recombinant) (rFIX) in Previously Treated Patients with Severe and Moderate Hemophilia B. Genetics Institute Report Protocols C9407-21, C9408-21. Date of report: 21-Jul-1999.
45. Tam N, Wu M, Johnston M, Lilly L. A Study of the Safety and Efficacy of Recombinant Human Factor IX (rFIX) in the Treatment of Previously Untreated Patients (PUPs) with Severe or Moderately Severe Hemophilia B: Final Report (protocol 3090A1-300-WW). Wyeth Research CSR-51082. Date of report: 22-Sep-2003.
46. Rodriguez D, Magill M, Dubois D, McCarthy K, Rup B, Kaye J. A Safety and Efficacy Study of Coagulation Factor IX Recombinant) (rFIX) in Previously Treated Patients with Mild, Moderate, and Severe Hemophilia B during Elective Surgical Procedures. Protocols C9417-21, C9407-21 (Segment 3), C9408-21 (Segment 3). Date of report: 24-Jul-1998.
47. Fernands A, Gencarella N, Appleton T, McCarthy K, Rup B, LeFevre Lerman VF. Safety and Efficacy Studies of Coagulation Factor IX (recombinant) (rFIX) in Previously Treated Patients with Severe and Moderate Hemophilia B. Genetics Institute Report Protocols C9407-21, C9408-21. Date of report: 21-Jul-1999.
48. Fernands A, Gencarella N, Appleton T, McCarthy K, Rup B, LeFevre Lerman VF. Safety and Efficacy Studies of Coagulation Factor IX (recombinant) (rFIX) in Previously Treated Patients with Severe and Moderate Hemophilia B. Genetics Institute Report Protocols C9407-21, C9408-21. Date of report: 21-Jul-1999.
49. Fernands A, Gencarella N, Appleton T, McCarthy K, Rup B, LeFevre Lerman VF. Safety and Efficacy Studies of Coagulation Factor IX (recombinant) (rFIX) in Previously Treated Patients with Severe and Moderate Hemophilia B. Genetics Institute Report Protocols C9407-21, C9408-21. Date of report: 21-Jul-1999.
50. Fernands A, Gencarella N, Appleton T, McCarthy K, Rup B, LeFevre Lerman VF. Safety and Efficacy Studies of Coagulation Factor IX (recombinant) (rFIX) in Previously Treated Patients with Severe and Moderate Hemophilia B. Genetics Institute Report Protocols C9407-21, C9408-21. Date of report: 21-Jul-1999.
51. CSR for Protocol C9407-21: A three-Segment, Phase 1/2 Study in Previously Treated Severe Hemophilia B Patients, Consisting of (1) a Double-Masked, Randomized, Crossover Evaluation of the Pharmacokinetics of Coagulation Factor IX (Recombinant) (rFIX) and Mononine®, (2) a Continuation into an Open-Label Study to Assess the Safety and Efficacy of rFIX in the Treatment and Prevention of Bleeding, and (3) a Treatment of Bleeding Intra- and Postoperatively. Segment 1: A Double-Masked, Randomized, Crossover Evaluation of the Pharmacokinetics of Coagulation Factor IX (Recombinant) (rFIX) and Mononine®. Date of Final Report: 12-Mar-1996.
52. CSR for Protocol C9407-21: A three-Segment, Phase 1/2 Study in Previously Treated Severe Hemophilia B Patients, Consisting of (1) a Double-Masked, Randomized, Crossover Evaluation of the Pharmaco kinetics of Coagulation Factor IX (Recombinant) (rFIX) and Mononine®, (2) a Continuation into an Open-Label Study to Assess the Safety and Efficacy of rFIX in the Treatment and Prevention of Bleeding, and (3) a Treatment of Bleeding Intra- and Postoperatively. Segment 1: A Double-Masked, Randomized, Crossover Evaluation of the Pharmacokinetics of Coagulation Factor IX (Recombinant) (rFIX) and Mononine®. Date of Final Report: 12-Mar-1996.
53. CSR-63359 Final Report: An Open-Label Safety and Efficacy Study of Recombinant Human Factor IX (rFIX; BENEFIX® ) in Previously Treated Patients (PTPs) with Hemophilia B (FIX:C=2%). Protocol 3090A1-302-WW (C0124-21), Version No.:1.0, Date of report: 26-Jun-2006.
54. CSR-61849 Final Report: A Double-Blind, Randomized, Crossover Evaluation of the Pharmacokinetics of Recombinant Human Factor IX (BENEFIX) and a New Formulation of BENEFIX® (rFIX-R); and an Open-Label Safety and Efficacy Evaluation of rFIX-R in Previously Treated Patients with Moderate to Severe (FIX:C=2%) Hemophilia B. Date of report: 18-Apr-2006.
55. Pharmacokinetic Data Summary Table for Study 304, 09-Aug-2006.
56. eCTD STN 103677 Submission 0000 Module 3, Drug Product (Wyeth Farma, BENEFIX, intravenous) section 3.2.P.1.
57. eCTD STN 103677 Submission 0000 Module 3, Drug Product (Wyeth Farma, BENEFIX, intravenous) section 3.2.P.1.
58. eCTD STN 103677 Submission 0000 Module 3, Drug Product (Wyeth Farma, BENEFIX, intravenous) section 3.2.P.8.3.4.
59. eCTD STN 103677 Submission 0000 Module 3, Drug Product (Diluent) section 3.2.P.7.1.1.1.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá - Colombia.