
ATIVAN
LORAZEPAM
Tabletas
Caja , 30 Tabletas , 1 Miligramos
Caja , 30 Tabletas , 2 Miligramos
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN Y CARACTERÍSTICAS FARMACÉUTICAS: Cada TABLETA contiene 1.0 o 2.0 mg de lorazepam.
Naturaleza y contenido del envase: Caja de cartón por 30 Tabletas en Blister Aluminio/PVC
INDICACIONES: Tratamiento a corto plazo de los trastornos de ansiedad, incluyendo:
• Alivio a corto plazo de los síntomas de la ansiedad
• Trastornos de la ansiedad generalizada
• Ansiedad en estados psicóticos
• Ansiedad asociada con síntomas somáticos
• Ansiedad asociada con depresión o síntomas depresivos
• Ansiedad reactiva
• Insomnio asociado con ansiedad
• Tratamiento del síndrome de abstinencia al alcohol
• Prevención del “delirium tremens”
• Premedicación quirúrgica
• ATIVAN® TABLETAS se utiliza junto con medicamentos antieméticos estándar para la profilaxis y el tratamiento sintomático de la náusea y el vómito asociado con la quimioterapia para el cáncer.
MECANISMO DE ACCIÓN: El lorazepam es una benzodiacepina que interactúa con el complejo receptor del ácido g-aminobutírico (GABA)-benzodiacepina y aumenta la capacidad de enlace del GABA.79
USO GERIÁTRICO: (Ver “Dosis y administración” y “Precauciones”).
FARMACOCINÉTICA: Absorción: La biodisponibilidad absoluta es mayor del 90% siguiendo a la administración oral en sujetos sanos.82,83
Las concentraciones plasmáticas pico se presentan en aproximadamente dos horas luego de la administración oral en sujetos sanos.82,83
Distribución: El volumen de distribución es aproximadamente 1.3 L/kg.83 El lorazepam no enlazado penetra la barrera hematoencefálica libremente por difusión pasiva. Lorazepan se enlaza aproximadamente en un 92% a las proteínas plasmáticas humanas a una concentración de lorazepam de 160 ng/mL.84
Metabolismo: El lorazepam se conjuga rápidamente en su grupo 3-hidroxi en glucorónido de lorazepam, un metabolito inactivo.85
Eliminación: La vida media de eliminación del lorazepam no conjugado en el plasma humano es de aproximadamente 12 a 16 horas.82,85
Después de administrar una dosis oral simple de 2 mg de 14C-lorazepam a 8 sujetos sanos, aproximadamente 88% de la dosis administrada fue recobrada en orina y el 7% fue recuperada en las heces.85 Aproximadamente 74% del glucurónido de lorazepam fue recobrado en la orina.85
Pacientes ancianos: Los pacientes ancianos responden típicamente a dosis más bajas de benzodiacepinas que los pacientes jóvenes.86
Insuficiencia renal: Se ha informado en los estudios de farmacocinética de dosis única en pacientes con diferentes grados de insuficiencia renal, que iban del deterioro leve hasta la falla renal, que no se presentan cambios significativos en la absorción, depuración o excreción de lorazepam. La hemodiálisis no tiene ningún efecto significativo sobre la farmacocinética del lorazepam intacto pero removió sustancialmente el glucurónido inactivo del plasma.75
Insuficiencia hepática: No se informó de cambios en la depuración de lorazepam en pacientes con un deterioro hepático leve o moderado (ejemplo: hepatitis, cirrosis alcohólica).87
Relación de la concentración y el efecto: Los niveles plasmáticos de lorazepam son proporcionales a la dosis administrada.82 No existe evidencia de acumulación de lorazepam después de la administración oral por hasta seis meses.88
FARMACODINÁMICA, EFICACIA CLÍNICA: Las consecuencias farmacodinámicas de las acciones agonistas de las benzodiacepinas incluyen efectos contra la ansiedad, sedación y reducción de la actividad convulsiva.80,81
La intensidad de la acción está directamente relacionada con el grado de ocupación del receptor de las benzodiacepinas.
CONTRAINDICACIONES: Hipersensibilidad a las benzodiacepinas o a cualquiera de los componentes de la fórmula. ATIVAN® 2 mg: Contiene tartrazina que puede producir reacciones alérgicas tales como urticaria, angioedema, broncoconstricción y/o shock anafiláctico en pacientes con sensibilidad a la tartrazina.
EMBARAZO: Lorazepam no debe ser usado durante el embarazo. Un riesgo aumentado de malformaciones congénitas asociadas con el uso de benzodiacepinas durante el primer trimestre del embarazo ha sido sugerido en varios estudios.4 En humanos, las muestras de sangre obtenidas del cordón umbilical indican que se produce la transferencia placentaria de las benzodiacepinas y de sus metabolitos glucuronizados.5 Se ha informado que los lactantes nacidos de madres que ingieren benzodiacepinas por varias semanas o más antes del parto, han presentado síndrome de abstinencia durante el periodo postnatal. Se han presentado signos de hipoactividad, hipotonía, hipotermia, apnea, depresión respiratoria, problemas para la alimentación y una respuesta metabólica deteriorada al estrés del frío en los recién nacidos de madres que recibieron benzodiacepinas durante la fase tardía del embarazo o durante el parto.6
LACTANCIA: Se ha detectado lorazepam en la leche materna; 6,7 por lo tanto no se debe administrar a mujeres en periodo de lactancia, a menos que el beneficio esperado en la mujer sobrepase el riesgo potencial para el niño.8
En neonatos bajo alimentación materna de madres que usan benzodiacepinas ha ocurrido sedación y la incapacidad para succionar.9 Los niños de madres lactantes deberían ser vigilados para efectos farmacológicos (incluyendo sedación e irritabilidad).
EFECTOS EN ACTIVIDADES QUE REQUIEREN CONCENTRACIÓN: Al igual que todos los medicamentos que actúan en el sistema nervioso central los pacientes deben ser advertidos de no operar maquinaria peligrosa o vehículos automotores, hasta que se conozca que ellos no presentan mareo o somnolencia por el uso de lorazepam.
REACCIONES ADVERSAS: Las reacciones adversas son listadas en la siguiente tabla, de acuerdo con las categorías de frecuencia del CIOMS.32
|
Muy común |
> 10% |
|
Común |
> 1% |
|
Poco común |
> 0.1 y <1% |
|
Raro |
>0.01 y <0.1% |
|
Muy raro |
<0.01% |
|
Sistema corporal |
Reacción adversa |
|
Cuerpo como un todo |
|
|
Frecuencia no determinada |
Reacciones de hipersensibilidad,33 reacciones anafilácticas/anafilactóides,34 Angioedema1, Síndrome de secreción inadecuada de hormona antidiurética,35 hiponatremia,36 hipotermia37. |
|
Común |
Debilidad muscular, astenia. |
|
Sistema cardiovascular |
|
|
Frecuencia no determinada |
Hipotensión,38 disminución de la presión arterial38. |
|
Sistema digestivo |
|
|
Poco común |
Náusea. |
|
Frecuencia no determinada |
Estreñimiento,39 aumento en la bilirrubina,40 ictericia,40 elevación de las transaminasas hepáticas,41 aumento de la fosfatasa alcalina41. |
|
Sistema linfático y hematológico |
|
|
Frecuencia no determinada |
Trombocitopenia,42 agranulocitosis,43 pancitopenia44. |
|
Sistema nervioso y órganos de los sentidos |
|
|
Frecuencia no determinada |
Los efectos de las benzodiacepinas sobre el sistema nervioso central son dependientes de la dosis, presentando una depresión más severa del sistema nervioso central con las dosis más altas. Síntomas extrapiramidales,45 temblor,46 vértigo,47 trastornos visuales (incluyendo diplopía y visión borrosa), disartria, pronunciación dificultosa,48 cefalea, convulsiones;49 amnesia, desinhibición,50 euforia,51 coma,52 ideas o intento de suicidio53, deterioro de la atención/concentración54, trastornos del equilibrio55. Las reacciones paradójicas incluyen la ansiedad,45,56 agitación57, excitación58, hostilidad59, agresión60, venganza60, trastornos en el sueño/ insomnio, excitación sexual61, alucinaciones62. |
|
Muy común |
Sedación,63 fatiga,64 somnolencia63. |
|
Común |
Ataxia,65 confusión66, depresión, desenmascaramiento de la depresión, mareo. |
|
Poco común |
Cambios en la líbido61, impotencia67, orgasmos disminuidos68. |
|
Sistema respiratorio |
|
|
Frecuencia no determinada |
Depresión respiratoria,69 apnea70, empeoramiento de la apnea2 del sueño (la extensión de la depresión respiratoria con benzodiacepinas es dosis-dependiente y la depresión severa ocurre con las dosis más altas). Empeoramiento de la enfermedad pulmonar obstructiva71. |
|
Piel |
|
|
Frecuencia no determinada |
Reacciones alérgicas en la piel, alopecia72. |
INTERACCIONES: Las benzodiacepinas, incluso el lorazepam, producen efectos depresivos adictivos sobre el sistema nervioso central cuando se coadministran con otros depresores del sistema nervioso central, como el alcohol y los barbitúricos, antipsicóticos, sedantes/hipnóticos, ansiolíticos, antidepresivos, analgésicos narcóticos, antihistamínicos sedantes, anticonvulsivos y anestésicos.
El uso concomitante de clozapina y lorazepam puede producir una sedación marcada, salivación excesiva y ataxia. 10,11
La administración concurrente de lorazepam con valproato puede resultar en concentraciones plasmáticas aumentadas y reducción de la depuración del lorazepam. 12,13 La dosis de lorazepam debe ser reducida a aproximadamente el 50% cuando se coadministra con valproato.
La administración concurrente de lorazepam con probenecid puede llevar a un inicio más rápido o a un efecto prolongado del lorazepam debido al aumento de la vida media y a la disminución de la depuración total.14 Se debe reducir la dosis de lorazepam en un 50% aproximadamente cuando es coadministrado con probenecid.
La administración de teofilina o aminofilina puede reducir los efectos sedantes de las benzodiacepinas, incluyendo lorazepam. 15,16,17
INFORMACIÓN DE SEGURIDAD PRECLÍNICA: El glucurónido de lorazepam, el mayor metabolito de lorazepam, no tiene actividad demostrable sobre el sistema nervioso central de los animales.
Carcinogenicidad: En un estudio experimental durante 18 meses con lorazepam oral en ratas y ratones, no existió evidencia que se haya presentado un potencial carcinogénico.89,90
Mutagenicidad: Un estudio de la actividad mutagénica de lorazepam experimental en Drosophila melanogaster, indicó que este agente era inactivo desde el punto de vista de mutación.91
Deterioro de la fertilidad: En un estudio de preimplantación llevado a cabo ratas utilizando lorazepam oral a una dosis de 20 mg/kg, no se evidenció deterioro de la fertilidad.92
Almacenamiento y vida útil: Almacenar en su envase y empaque original a una temperatura inferior a 30ºC.
PRECAUCIONES: Lorazepam debe ser usado con precaución en pacientes con una función respiratoria comprometida (ejemplo: EPOC, el síndrome de apnea durante el sueño)2.
Puede emerger la depresión preexistente o empeorarse durante el uso de benzodiacepinas, incluyendo lorazepam. El uso de las benzodiacepinas puede desenmascarar tendencias suicidas en pacientes deprimidos y no debe ser usado sin una terapia antidepresiva adecuada.
Los pacientes débiles o ancianos pueden ser más susceptibles a los efectos del lorazepam; por lo tanto estos pacientes deben ser monitorizados frecuentemente y se debe ajustar la dosis cuidadosamente de acuerdo a la respuesta del paciente. (Ver Dosis y administración).
Ocasionalmente se han reportado reacciones paradójicas durante el uso de benzodiacepinas (ver Reacciones adversas)3. Tales reacciones son más frecuentes en niños y en ancianos. En caso de que esto ocurra, se debe suspender el uso del medicamento.
Uso en pacientes con deterioro hepático: Como con todas las benzodiacepinas, el uso de lorazepam puede empeorar la encefalopatía hepática; por lo tanto, lorazepam debe ser usado con precaución en pacientes con insuficiencia hepática severa y/o encefalopatía.
ABUSO Y DEPENDENCIA: El uso de las benzodiacepinas puede conducir a una dependencia física y psicológica. 18,19 El riesgo de dependencia se aumenta con las dosis más altas y con el uso a largo plazo, así como en pacientes con antecedentes de alcoholismo o de abuso de drogas o en pacientes con trastornos significativos de la personalidad. La dependencia potencial se reduce cuando lorazepam se utiliza en dosis apropiadas en un tratamiento a corto plazo.,18,20,21,22
En general, las benzodiacepinas únicamente deben ser prescritas para periodos cortos de tiempo solamente (de 2-4 semanas). No se recomienda el uso continuo a largo plazo de lorazepam.
La suspensión abrupta del tratamiento puede ocasionar síntomas de abstinencia (por ejemplo el insomnio por rebote) inclusive con dosis recomendadas por periodos cortos de tiempo como de una semana de terapia. Se debe evitar la discontinuación abrupta de lorazepam y se debe programar una disminución gradual de la dosis después de una terapia de largo plazo.18,20,23,24,25
La terminación abrupta del tratamiento puede estar acompañada de los síntomas de abstinencia. Los síntomas reportados cuando se descontinúan las benzodiacepinas incluyen: dolor de cabeza, ansiedad, tensión, depresión, insomnio, desasosiego, confusión, irritabilidad, sudoración, fenómeno de rebote, disforia, mareo, desrealización, despersonalización, hiperacusia, adormecimiento/hormigueo de las extremidades, hipersensibilidad a la luz, al ruido y a los cambios físicos de contacto/percepción, movimientos involuntarios, náusea, vómito, diarrea, pérdida del apetito, alucinaciones/delirio, convulsiones, temblor, cólicos abdominales, mialgia, agitación, palpitaciones, taquicardia, ataques de pánico, vértigo, hiperreflexia, pérdida momentánea de la memoria e hipertermia. 18,19,20,23,24,25 Las convulsiones pueden ser más comunes en pacientes con trastornos convulsivos preexistentes o aquellos que reciben medicamentos que disminuyen el umbral convulsivo como los antidepresivos.20,24,26,27
Existe evidencia de que se puede desarrollar tolerancia a los efectos sedantes de las benzodiacepinas.28
Se puede presentar abuso potencial del lorazepam, especialmente en pacientes con historia de abuso con el alcohol y /o las drogas. 29,30,31
ADVERTENCIAS ESPECIALES: El uso de benzodiacepinas, incluyendo el lorazepam puede conducir a una depresión respiratoria potencialmente fatal.
El uso de benzodiacepinas, incluyendo lorazepam, puede conducir a una dependencia física y psicológica (ver Abuso y dependencia).
Han sido reportadas reacciones anafilácticas/anafilactoides graves con el uso de Benzodiazepinas. Casos de angioedema involucrando la lengua, glotis o laringe han sido reportados en pacientes después de recibir la primera o subsecuente dosis de Benzodiazepinas. Algunos pacientes que toman Benzodiazepinas han tenido síntomas adicionales tales como disnea, estrechamiento de garganta, o náuseas y vómito. Algunos pacientes han requerido tratamiento médico en el servicio de urgencias. Si el angioedema involucra la lengua, glotis o laringe, la obstrucción de las vías aéreas puede ocurrir y ser fatal. Los pacientes que desarrollan angioedema después del tratamiento con una benzodiazepina no deben ser expuestos de nuevo a este fármaco1.
DOSIS Y ADMINISTRACIÓN: La dosis y la duración de la terapia debe ser individualizada. Se debe prescribir la dosis efectiva más baja, por el menor tiempo posible. El riesgo de la abstinencia y el fenómeno de rebote es grande después de la discontinuación abrupta; por lo tanto el medicamento debe ser discontinuado gradualmente. (Ver Precauciones y Advertencias).
La prolongación del periodo de tratamiento no debe tener lugar sin una reevaluación de la necesidad de una terapia continuada.
El rango recomendado de la dosis es de 2 a 6 mg/día, pero la dosis puede variar de 1 a 10 mg/día. Los aumentos en la dosis de lorazepam deberían ser hechos gradualmente ayudando de esta forma a evitar que se presenten los eventos adversos. La dosis vespertina deber ser incrementada antes que las dosis matutinas.
Manejo a corto plazo de los trastornos de ansiedad: La dosis inicial recomendada es de 2 a 3 mg/día, en dosis divididas 2 o 3 veces diariamente.
Insomnio asociado con ansiedad: La dosis recomendada es de 0.5 a 4 mg/día, a la hora de acostarse.
Síndrome de abstinencia por alcohol: La dosis inicial recomendada es de 2 a 3 mg/día, en dosis divididas 2 o 3 veces diariamente.
Prevención del “delirium tremens”: La dosis inicial recomendada es de 2 a 3 mg/día, en dosis divididas 2 o 3 veces diariamente.
Premedicación quirúrgica: La dosis recomendada es de 2 a 4 mg la noche antes de un procedimiento y/o 1-2 horas antes del procedimiento.
ATIVAN® TABLETAS se utiliza junto con medicamentos antieméticos estándar para la profilaxis y el tratamiento sintomático de la náusea y el vómito asociados con la quimioterapia para el cáncer
La dosis recomendada es de 1 mg a la hora de acostarse la noche antes de la quimioterapia y/o 1 mg administrado 60 minutos antes de la quimioterapia, y repetidos 6 horas o 12 horas después de la quimioterapia si fuera necesario.
Pacientes débiles o ancianos: En pacientes ancianos o débiles la dosis inicial debe reducirse aproximadamente en un 50% y se debe ir ajustando de acuerdo a las necesidades y a la tolerancia.
Uso en pacientes con deterioro hepático: La dosis en pacientes con insuficiencia hepática severa debe ser ajustada gradualmente de acuerdo a la respuesta del paciente. Las dosis bajas pueden ser suficientes en estos pacientes (ver Precauciones).
Uso en pacientes con deterioro renal: No hay recomendaciones específicas en la dosificación (ver Farmacocinética).
SOBREDOSIS: En la experiencia postmercadeo, ha ocurrido la sobredosis de lorazepam primordialmente en combinación con el alcohol y/o otras drogas73.
Síntomas: Los síntomas pueden variar en severidad e incluyen somnolencia, confusión mental, letargia, disartria, ataxia, reacciones paradójicas, depresión del sistema nervioso central, hipotonía, hipotensión, depresión respiratoria, depresión cardiovascular, coma y muerte73,74.
Tratamiento: Se recomienda tomar medidas de soporte general y sintomáticas; se deben monitorear los signos vitales.
Cuando existe un riesgo de aspiración, no se recomienda la inducción de la emesis.
El lavado gástrico puede ser indicado si se realiza poco después de la ingestión o en los pacientes sintomáticos. La administración de carbón activado también puede limitar la absorción de la droga.
El lorazepam es pobremente dializable.75 El glucorónido del lorazepam, su metabolito inactivo, puede ser altamente dializable.
El antagonista de las benzodiacepinas, el flumazenil, puede ser utilizado en pacientes hospitalizados como una ayuda de, no como un sustituto para, el apropiado manejo de la sobredosis por benzodiacepinas.76, 77 El médico debe estar consciente del riesgo de convulsiones asociado al tratamiento con flumazenil, particularmente en pacientes usuarios de benzodiacepinas por largo tiempo y en la sobredosis con antidepresivos cíclicos.78
DESCRIPCIÓN: Principio activo: Lorazepam (INN).
Es un polvo blanco a casi blanco, inodoro y cristalino, prácticamente insoluble en agua, parcialmente soluble en alcohol, ligeramente soluble en cloroformo y parcial o ligeramente soluble en diclorometano.
Nombre químico: 7-cloro-5-(o-clorofenil)-1,3-dihidro-3-hidroxi-2H-1,4-benzodiacepin-2-ona.
Estructura
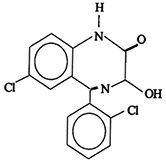
Fórmula molecular: C15H10Cl2N2O2
Peso Molecular: 321.2
Nombres registrados: ATIVAN® TABLETAS
Clase farmacológica y terapéutica: Benzodiacepina. Ansiolítico.
Código ATC: NO5BA06
Forma de dosificación y ruta de administración: Tabletas vía oral.
PRESENTACIÓN:
ATIVAN® 1 mg Tabletas: INVIMA 2009 M-013247 - R1
ATIVAN® 2 mg Tabletas: INVIMA 2009 M-013234 R1
(Con base en CDS v 4.0)
PFIZER S.A.S.
BIBLIOGRAFÍA
1. Justification for a Safety Labeling Decision: Lorazepam, Lormetazepam, Oxazepam, Temazepam: Angioedema, dated 09 October 2007.
2. Guilleminault C. Benzodiazepines, breathing, and sleep. American Journal of Medicine. 1990;88(supp3A):25S-28S.
3. Hall RCW, Zisook S. Paradoxical reactions to benzodiazepines. Br J Clin Pharmacol. 1981;11:99S-104S.
4. Safra MJ, Godfrey PJ. Association between cleft lip with or without cleft palate and prenatal exposure to diazepam. Lancet. 1975;2:478-480.
5. Kanto J, Aaltonen L, Liukko P, et al. Transfer of lorazepam and its conjugate across the human placenta. Acta Pharmacol et Toxicol. 1980;47:130-134.
6. Whitelaw AG, Cummings AJ, McFadyen IR. Effect of maternal lorazepam on the neonate. Br Med J. 1981;282(6270):1106-1108.
7. Summerfield RJ, Nielsen MS. Excretion of lorazepam into breast milk. Br J Anaesth. 1985;57(10):1042-1043.
8. Anonymous: American Academy of Pediatrics Committee on Drugs. Transfer of drugs and other chemicals into human milk. Pediatrics. 1994;93(1):137-150.
9. McElhatton PR. The effects of benzodiazepine use during pregnancy and lactation. Reprod Toxicol. 1994;8(6):461-475.
10. Cobb CD, Anderson CB, Seidel DR. Possible interaction between clozapine and lorazepam. Am J Psychiatry. 1991;148(11):1606-1607.
11. Jackson CW, Marlowitz JS, Brewerton TD. Delirium associated with clozapine and benzodiazepine combinations. Ann Clin Psychiatry. 1995;7(3):139-141.
12. Samara EE, Granneman RG, Galen FW, et al. Effect of valproate on the pharmacokinetics and pharmacodynamics of lorazepam. J Clin Pharmacol. 1997;37:442-450.
13. Anderson GD, Gidal BE, Kantor ED, et al. Lorazepam-valproate interaction: studies in normal subjects and isolated perfused rat liver. Epilepsia. 1994;35(1):221-225.
14. Abernethy DR, Greenblatt DJ, Ameer B, et al. Probenecid impairment of acetaminophen and lorazepam clearance: direct inhibition of ether glucuronide formation. J Pharmacol Exp Ther. 1985;234(2):345-349.
15. Kleindienst G, Usinger P. Diazepam sedation is not antagonised completely by aminophylline. Lancet. 1984;i:113.
16. Niemand D, et al. Aminophylline inhibition of diazepam sedation: is adenosine blockade of GABA receptors the mechanism? Lancet. 1984;i: 463-464.
17. Henauer SA, et al. Theophylline antagonises diazepam-induced psychomotor impairment. Eur J Clin Pharmacol. 1983; 25: 743-747.
18. Ashton H. Benzodiazepine withdrawal: an unfinished story. BMJ. 1984;288:1135-1140.
19. Busto U, Sellers E, Naranjo C, et al. Withdrawal reaction after long-term therapeutic use of benzodiazepines. N Engl J Med. 1986;315(14):854:859.
20. Soni SD, Smith ED, Shah A, et al. Lorazepam withdrawal seizures: Role of predisposition and multidrug therapies. Int Clin Psychopharmacol. 1986;1:165-169.
21. Clare AW. Diazepam, alcohol, and barbiturate abuse. BMJ. 1971;4:340.
22. Busto UE, Romach MK, Sellers EM. Multiple drug use and psychiatric comorbidity in patients admitted to the hospital with severe benzodiazepine dependence. J Clin Psychopharmacol. 1996;16(1):51-57.
23. Petursson H, Lader MH. Withdrawal from long-term benzodiazepine treatment. BMJ. 1981;283:643-645.
24. Martinez-Cano H, Vela-Bueno A, de Iceta M, et al. Benzodiazepine withdrawal syndrome seizures. Pharmacopsychiat. 1995;28:257-262.
25. Mandos LA, Rickels K, Cutler N. Placebo-controlled comparison of the clinical effects of rapid discontinuation of ipsapirone and lorazepam after 8 weeks of treatment for generalized anxiety disorder. Int Clin Pyschopharmacol. 1995;10:251-256.
26. Fialip J, Aumaitre O, Eschalier A. Benzodiazepine withdrawal seizures: Analysis of 48 case reports. Clin Neuropharmacol. 1987;10(6):538-44.
27. De La Fuente JR, Rosenbaum A, Martin HR. Lorazepam-related withdrawal seizures. Mayo Clin Proc. 1980;55:190-192.
28. Van Steveninck AL, Wallnofer AE, Schoemaker RC, et al. A study of the effects of long-term use on individual sensitivity to temazepam and lorazepam in a clinical study. Br J Clin Pharmacol. 1997;44:267-275.
29. Griffiths RR, Wolf B. Relative abuse liability of different benzodiazepines in drug abusers. J Clin Psychopharmacol. 1990;10(4):237-243.
30. Preston KL, Wolf B, Guarino JJ, et al. Subjective and behavioral effects of diphenhydramine, lorazepam and methocarbamol: evaluation of abuse liability. J Pharmacol Exp Ther. 1992;262(2):707- 720.
31. Orzack MH, Friedman L, Dessain E, et al. Comparative study of the abuse liability of alprazolam, lorazepam, diazepam, methaqualone, and placebo. Int J Addictions. 1988;23(5):449-467.
32. Fontaine L: Justification document: Frequency estimates for lorazepam adverse reactions, 10 September 2001.
33. Warner L: Justification Document: Hypersensitivity, 27 July 2001.
34. Warner L: Justification Document: Anaphylaxis/anaphylactoid reaction, 23 July 2001.
35. Warner L: Justification Document: Syndrome of inapproriate ADH secretion, 27 July 2001.
36. Warner L: Justification Document: Hyponatremia, 30 July 2001.
37. Warner L: Justification Document: Hypothermia, 26 July 2001. 38 Warner L: Justification Document: Hypotension, 30 July 2001.
39. Warner L: Justification Document: Constipation, 27 July 2001.
40. Warner L: Justification Document: Increased bilirubin/jaundice, 23 July 2001.
41. Warner L: Justification Document: Increased liver function tests and increased alkaline phosphatase, 23 July 2001.
42. Warner L: Justification Document: Thrombocytopenia, 28 August 2001.
43. Warner L: Justification Document: Agranulocytosis, 28 August 2001.
44. Warner L: Justification Document: Pancytopenia, 28 August 2001.
45. Warner L: Justification Document: Extrapyramidal symptoms, 31 July 2001.
46. Warner L: Justification Document: Tremor, 27 July 2001.
47. Warner L: Justification Document: Vertigo, 30 July 2001.
48. Warner L: Justification Document: Dysarthria/slurred speech, 24 July 2001.
49. Warner L: Justification Document: Seizure/convulsion, 28 August 2001.
50. Warner L: Justification Document: Disinhibition, 25 July 2001.
51. Warner L: Justification Document: Euphoria, 23 July 2001.
52. Warner L: Justification Document: Coma, 24 July 2001.
53. Warner L: Justification Document: Suicidal ideation and suicide attempt, 31 July 2001.
54. Justification for a safety labeling decision: Lorazepam, Lormetazepam, Oxazepam and Temazepam: Impaired attention/concentration, dated 14-May-2008.
55. Justification for a safety labeling decision: Lorazepam, Lormetazepam, Oxazepam and Temazepam: Balance disorder, dated 22-May-2008.
56. Warner L: Justification Document: Anxiety, 31 July 2001.
57. Warner L: Justification Document: Agitation, 25 July 2001.
58. Warner L: Justification Document: Excitability, 25 July 2001.
59. Warner L: Justification Document: Hostility, 26 July 2001.
60. Warner L: Justification Document: Rage and aggression, 25 July 2001.
61. Warner L: Justification Document: Change in libido and sexual arousal, 25 July 2001.
62. Warner L: Justification Document: Hallucinations, 27 July 2001.
63. Warner L: Justification Document: Drowsiness/sedation, 30 July 2001.
64. Warner L: Justification Document: Fatigue, 26 July 2001.
65. Warner L: Justification Document: Ataxia, 20 July 2001
66. Warner L: Justification Document: Confusion, 24 July 2001.
67. Warner L: Justification Document: Impotence, 24 July 2001
68. Warner L: Justification Document: Anorgasmia, 25 July 2001.
69. Warner L: Justification Document: Respiratory depression, 31 July 2001.
70. Warner L: Justification Document: Apnea, 28 August 2001.
71. Warner L: Justification Document: Worsening of obstructive pulmonary diseases, 28 August 2001.
72. Warner L: Justification Document: Alopecia, 25 July 2001.
73. Serfaty M, Masterton G. Fatal poisonings attributed to benzodiazepines in Britain during the 1980s. Br J Psychiatry. 1993;163:386-393.
74. Vlachos P, Kentarchou P, Poulos L, et al. Lorazepam poisoning. Toxicol Lett. 1978;2:109-110.
75. Morrison G, Chiang ST, Koepke HH. Effect of renal impairment and hemodialysis on lorazepam kinetics. Clin Pharmacol Ther. 1984;35(5):646-652.
76. Hojer J, Baehrendtz S. The effect of flumazenil (Ro 15-1788) in the management of self-induced benzodiazepine poisoning. Acta Med Scand. 1988;224:357-365.
77. O’Sullivan GF, Wade DN. Flumazenil in the management of acute drug overdosage with benzodiazepines and other agents. Clin Phamacol Ther. 1987;42:254-259.
78. Spivey WH. Flumazenil and seizures: analysis of 43 cases. Clin Ther. 1992;14(2):292-305
79. Goodchild CS. Gaba receptors and benzodiazepines. Br J Anaesth. 1993;71:127-33.
80. Paul SM, Syapin PJ, Paugh BA, et al. Correlation between benzodiazepine receptor occupation and anticonvulsant effects of diazepam. Nature. 1979;281:688-689.
81. Facklam M, Schoch P, Bonetti E, et al. Relationship between benzodiazepine receptor occupancy and functional effects in vivo of four ligands of differing intrinsic efficacies. J Pharmacol Exp Ther.
1992;261(3);1113-1121.
82. Greenblatt DJ, Shader RI, Franke K, et al. Pharmacokinetics and bioavailability of intravenous intramuscular, and oral lorazepam in humans. J Pharm Sci. 1979;68(1):57-63.
83. Greenblatt DJ, Divoll M, Harmatz J, et al. Pharmacokinetic comparison of sublingual lorazepam with intravenous, intramuscular, and oral lorazepam. J Pharm Sci. 1982;71(2):248-252.
84. Fluck ER. The binding of lorazepam (Wy-4036) to the proteins of human plasma. Wyeth-Ayerst Laboratories GTR 8011, 1980.
85. Greenblatt DJ, Schillings RT, Kyriakopoulos AA, et al. Clinical pharmacokinetics of lorazepam. I. Absorption and disposition of oral 14C-lorazepam. Clin Pharmacol Ther. 1976;20(3):329-341.
86. Greenblatt DJ, Harmatz JS, Shader RI. Clinical Pharmacokinetcs of anxiolytics and hypnotics in the elderly: Therapeutic considerations (Part I). Clin Pharmacokinet. 1991;21:165-177.
87. Wilkinson GR. The effects of liver disease and aging on the disposition of diazepam, chlorodiazepoxide, oxazepam, and lorazepam in man. Acta Psychiatrica Scandinavica. 1978;274:56-74.
88. Greenblatt DJ, Knowles JA, Comer WH, et al. Clinical pharmacokinetics of lorazepam. IV. Longterm oral administration. J Clin Pharmacol. 1977;17:495-500.
89. Hudyma GM. WY-04036 80-week carcinogenic study in mice drug diet. Wyeth-Ayerst Laboratories GTR 05764, 1976.
90. Tucker WE. Histopathology report chronic drug safety study 78-weeks WY-04036 rats. Wyeth-Ayerst Laboratories GTR 04440, 1973.
91. Filippova LM, Rapoport IA, Shapiro YL, et al. Mutagenic activity of psychotropic preparations. Genetica. 1975;11(6):77-82.
92 Owen G. WY-04036 reproductive study in rats. Wyeth-Ayerst Laboratories GTR 00930, 1967.
Es posible que la información de prescripción de este producto haya sido revisada y actualizada después de la fecha de impresión del PLM 2016. Para obtener información más actualizada comuníquese con la Dirección Médica de Pfizer S.A.S Teléfono: (1) 6002300 Ext. 2509 Bogotá - Colombia.