
AIMAFIX 500 UI/10 ML
FACTOR IX (CHRISTMAS, FACTOR ANTIHEMOFÍLICO B)
Polvo y solvente para solución inyectable
Vial(es) , Polvo para solución de infusión , 500/10 U.I./ml
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
COMPOSICIÓN: La sustancia activa es el Factor IX de coagulación de plasma humano.
AIMAFIX se presenta como un POLVO y solvente para solución para infusión que contiene:
|
AIMAFIX 500 UI/10mL |
|
|
Factor IX de coagulación de plasma humano |
500 UI/vial |
|
Factor IX de coagulación de plasma humano reconstituido con agua para inyecciones |
50 UI/ mL (500 UI/10mL ) |
|
Volumen de solvente |
10 mL |
La potencia (UI) se determina utilizando el método de coagulación de La Farmacopea Europea.
La actividad específica de AIMAFIX es aproximadamente 100 UI/mg proteína.
Excipientes: Los excipientes son cloruro de Sodio, citrato de Sodio, glicina, heparina sódica, concentrado de antitrombina III humana, agua para inyecciones.
El vial de polvo contiene el Factor IX de coagulación de plasma humano, cloruro de Sodio, citrato de Sodio, glicina, heparina sódica, concentrado de antitrombina III humana.
El vial de solvente contiene agua para inyecciones.
Cómo aparece AIMAFIX y contenido del empaque: La solución es clara y ligeramente opalescente.
Los productos reconstituidos deben inspeccionarse visualmente en cuanto a materia particulada o decoloración antes de la administración. No utilice soluciones que estén turbias o que tienen depósitos.
POSOLOGÍA, MÉTODO Y TIEMPO DE ADMINISTRACIÓN
Posología: El tratamiento se debe iniciar bajo la supervisión de un médico experimentado en el tratamiento de hemofilia.
La dosis y la duración de la terapia de sustitución dependen de la severidad de la deficiencia del Factor IX, del sitio y del grado de la hemorragia y de la condición clínica del paciente.
El número de unidades de Factor IX administrados se expresa en unidades internacionales (UI) que se relacionan con la norma actual de la OMS para productos de Factor IX. La actividad del Factor IX en el plasma se expresa como un porcentaje (en relación con el plasma humano normal) o en Unidades Internacionales (en relación con el estándar internacional del Factor IX en el plasma).
Una Unidad Internacional (UI) de actividad del Factor IX es equivalente a la de la cantidad de Factor IX en un mL de plasma humano normal. El cálculo de la dosis requerida de Factor IX se basa en el hallazgo empírico de que 1 UI de Factor IX por kg. de peso corporal eleva la actividad del Factor IX del plasma en 0.8% de la actividad normal.
La dosis requerida se determina utilizando la siguiente fórmula:
Unidades requeridas = peso corporal (kg) x elevación de Factor IX deseado (%) (UI/dl) x recíproco de recuperación observada.
La cantidad que se debe administrar y la frecuencia de administración siempre deben ser orientadas según la efectividad clínica en el caso individual. Los productos de Factor IX raras veces requieren ser administrados más de una vez al día. En el caso de los siguientes eventos hemorrágicos, la actividad del Factor IX no debe estar por debajo del nivel dado de actividad plasmática (en % del normal) en el periodo correspondiente. Se puede utilizar la siguiente tabla para guiar la dosificación en episodios hemorrágicos y en cirugía.
|
Grado de hemorragia/tipo de procedimiento quirúrgico |
Nivel de Factor IX requerido (%) (UI/dl) |
Frecuencia de dosis (horas)/duración de las terapias (días) |
|
Hemorragia |
||
|
Hemartrosis inicial, sangrado muscular o sangrado oral |
20-40 |
Repita cada 24 horas. Por lo menos un día hasta que el episodio de sangrado indicado por el dolor se resuelva o se logre la curación |
|
Hemartrosis más extensa, sangrado muscular o hematoma |
30-60 |
Repita la infusión cada 24 horas por 3-4 días o mas, hasta que el dolor y la incapacidad aguda se resuelvan |
|
Hemorragias que ponen en peligro la vida |
60-100 |
Repita la infusión cada 8 a 24 horas hasta que se resuelva la amenaza |
|
Cirugía |
||
|
Cirugía menor, Incluyendo extracción dental. |
30-60 |
Cada 24 horas, al menos un día hasta que se logre la curación. |
|
Cirugía mayor |
80-100 (pre-y post-operatorio) |
Repita la infusión cada 8-24 horas hasta que la herida sane adecuadamente; luego terapia durante al menos 7 días para mantener una actividad del Factor IX del 30% al 60% (30 UI/dl-60UI/dl) |
Durante el curso del tratamiento se aconseja la determinación apropiada de los niveles de Factor IX para guiar la dosis que se va a administrar y la frecuencia de las infusiones repetidas. En caso de intervenciones quirúrgicas mayores en particular, se debe realizar monitoreo de la terapia de sustitución por medio del análisis de coagulación (Actividad del Factor IX del plasma) es indispensable. Los pacientes individuales pueden variar en cuanto a la respuesta al Factor IX, logrando niveles diferentes de recuperación in vivo, y demostrando diferente vida media plasmática.
Profilaxis: Para profilaxis por largo tiempo contra hemorragia en pacientes con hemofilia B severa, las dosis usuales son de 20 a 40 UI de Factor IX por kg. de peso corporal a intervalos de 3 a 4 días. En algunos casos, especialmente en pacientes más jóvenes, pueden requerirse intervalos de dosis más cortos, o dosis más altas.
Los pacientes deben ser monitoreados en cuanto al desarrollo de inhibidores del Factor IX. Si no se obtienen los niveles de actividades de Factor IX esperados, o si no se controla la hemorragia con una dosis apropiada, se debe realizar un ensayo para determinar si está presente un inhibidor de Factor IX. En pacientes con niveles altos de inhibidor, la terapia con Factor IX puede no ser efectiva y se deben considerar otras opciones terapéuticas. El manejo de estos pacientes debe ser orientada por médicos con experiencia en el cuidado de pacientes con hemofilia.
Método de Administración: Disuelva el polvo como se describe en el parágrafo Reconstitución del polvo con el solvente.
El producto debe ser administrado por vía intravenosa, por inyección o por infusión lenta.
Se recomienda no administrar más de 100 UI/kg de peso corporal por día.
La velocidad de infusión debe evaluarse en cada paciente.
Instrucciones para el uso adecuado
Reconstitución del polvo con el diluyente:
1. Llevar el polvo y el diluyente a temperatura ambiente;
2. Quitar las tapas de protección de los viales de polvo y diluyente;
3. Limpiar con alcohol las superficies de los tapones de ambos viales;
4. Abrir el empaque del dispositivo mediante la eliminación de la parte superior; tenga cuidado de no tocar el interior (fig. A);
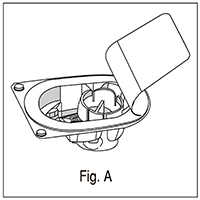
5. No sacar el dispositivo del empaque;
6. Dar vuelta al revés a la caja del dispositivo e insertar la punta de plástico a través del tapón del diluyente (fig. B);
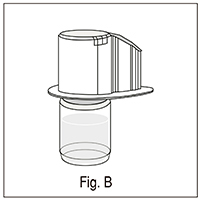
7. Agarrar y tirar del borde de la caja, liberando el dispositivo (fig. C);
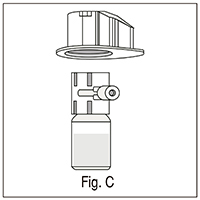
8. Tener el dispositivo conectado al vial del diluyente; invertir el sistema de tal forma que el vial del diluyente esté en la parte superior del dispositivo;
9. Insertar la otra punta de plástico a través del tapón del vial con el polvo; el vacío en el vial de polvo atraerá el solvente dentro del vial del polvo (fig. D);
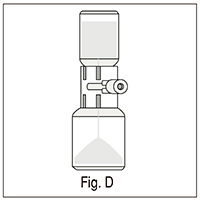
10. Agitar suavemente hasta completa disolución (fig. E); asegúrese de que el producto esté completamente disuelto, de otra manera el principio activo no pasará a través del filtro del dispositivo.
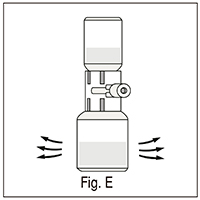
El tiempo de reconstitución es inferior a los 3 minutos.
El liofilizado puede ser disuelto más rápidamente calentando el diluyente en baño maría y continuando el calentamiento del vial después de su reconstitución teniendo cuidado de no sobrepasar la temperatura de 37 °C.
Si el polvo no se disuelve totalmente, existe una pérdida de actividad debida a filtración. Bajando el disolvente lentamente por las paredes del vial se evita la formación de espuma.
Administración de la solución: La solución deberá verse clara o ligeramente opalescente.
Antes de la administración inspeccionar visualmente la solución para detectar materia particulada o decoloración.
No utilizar soluciones que estén turbias o presenten depósitos.
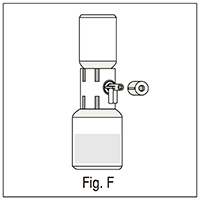
1. Girar la válvula inferior del dispositivo hacia el vial que contiene la solución reconstituida y eliminar la tapa que la cubre (fig. F);
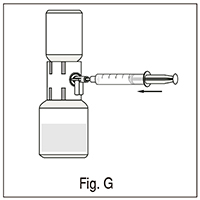
2. Llenar la jeringa con aire, tirando del émbolo hacia atrás, conectar el dispositivo e inyectar el aire dentro del vial del polvo que contiene la solución (fig. G);
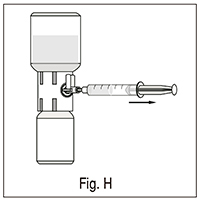
3. Mantener el émbolo en su lugar, de forma que el vial del polvo que contiene la solución reconstituida esté en la parte superior del equipo y atraiga el concentrado dentro de la jeringa tirando del émbolo hacia atrás lentamente (fig. H);
4. Volver la válvula lentamente a su posición original y desconectar la jeringa;
5. Conectar la aguja mariposa a la jeringa y infundir o inyectar lentamente por vía intravenosa.
INDICACIONES TERAPÉUTICAS: Tratamiento y profilaxis de hemorragia en pacientes con hemofilia B (deficiencia congénita del Factor IX).
Este producto se puede usar como tratamiento de la deficiencia adquirida del Factor IX.
GRUPO FARMACOTERAPÉUTICO: Antihemorrágicos, Factor IX de coagulación sanguínea.
CONTRAINDICACIONES: Coagulación intravascular diseminada (CID) y/o trombosis. Una vez interrumpidos estos procesos mediante el tratamiento adecuado solo deberá administrarse para el tratamiento de hemorragias con peligro para la vida.
Si aparecen reacciones de hipersensiblidad por la administración debe interrumpirse. Las variaciones leves pueden controlarse administrando antihistamínicos, mientras que en las reacciones graves con hipotensión deben seguirse las pautas actuales de la terapia de shock.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y OPERAR MÁQUINAS: No se han observado efectos sobre la capacidad para conducir y operar máquinas.
EFECTOS INDESEABLES: Como todos los medicamentos, AIMAFIX puede causar efectos indeseables aunque no siempre se presentan a todos los pacientes.
Se han observado raras veces en pacientes tratados con productos que contienen Factor IX hipersensibilidad o reacciones alérgicas (que pueden incluir angioedema, ardor y pinchazos en el lugar de infusión, escalofríos, rubefacción, urticaria generalizada, cefaleas, habón urticarial, hipotensión, letargia, náuseas, inquietud, taquicardia, malestar torácico, parestesia, vómitos, sibilancia). En algunos casos, estas reacciones han progresado a anafilaxia aguda y han ocurrido en estrecha asociación temporal con el desarrollo de inhibidores del Factor IX. Se ha reportado síndrome nefrótico luego de intento de inducción de tolerancia inmune en pacientes con hemofilia B con inhibidores del Factor IX y una historia de reacción alérgica.
En ocasiones raras se ha observado fiebre. Los pacientes con hemofilia B, pueden desarrollar anticuerpos neutralizantes (inhibidores) contra el Factor IX. Si ocurren estos inhibidores, la condición se manifestará como una respuesta clínica insuficiente. En estos casos, se recomienda que se acuda a un centro especializado en hemofilia. No hay datos acerca de la evidencia de los inhibidores en pacientes tratados con AIMAFIX.
Existe un riesgo potencial de acontecimientos tromboembólicos luego de la administración de productos de Factor IX con un riesgo más alto en preparaciones con pureza baja. El uso de productos de Factor IX con pureza baja ha estado asociado a casos de infarto de miocardio, coagulación intravascular diseminada, trombosis venosa y embolia pulmonar. El uso de Factor IX de alta pureza raras veces está asociado con estos efectos colaterales.
Para información sobre seguridad en términos de agentes transmisibles, ver Seguridad viral.
De acuerdo con las instrucciones contenidas en el inserto, reduce el riesgo de efectos colaterales.
Si uno de estos efectos colaterales se vuelve serio, o si se observan algunos efectos colaterales que no se incluyeron en este inserto, hable con su médico (o Farmacéutico).
INTERACCIONES: Informe a su médico (o Farmacéutico) si usted recientemente ha tomado otra medicina, incluyendo los medicamentos obtenidos sin fórmula médica.
No se conocen interacciones del concentrado de Factor IX de coagulación de plasma humano con otros medicamentos.
Incompatibilidades: AIMAFIX no se debe mezclar con otros medicamentos.
Solamente se deben utilizar los sets de infusión/inyección suministrados, porque puede ocurrir falla del tratamiento como consecuencia de la adsorción del Factor IX de coagulación de plasma humano en las superficies internas de algún equipo de infusión.
ADVERTENCIAS ESPECIALES:
Embarazo y lactancia: Pregunte a su médico (o Farmacéutico) para asesoría antes de tomar cualquier medicamento.
No se han realizado estudios de reproducción en animales con el Factor IX. Con base en la ocurrencia rara de hemofilia B en mujeres, todavía no existen experiencias respecto del uso del Factor IX durante el embarazo y la lactancia.
Por consiguiente, el concentrado de Factor IX de coagulación de plasma humano debe utilizarse durante el embarazo y la lactancia solamente si está claramente indicado.
Seguridad viral: Cuando las medicinas se fabrican de sangre o plasma humano, se deben poner en práctica algunas medidas para evitar que la infección se pase a los pacientes. Estas medidas incluyen selección cuidadosa de los donantes de sangre y plasma para asegurar que se excluyan portadores de infecciones y que se realice la prueba de cada donación de plasma en cuanto a signos de virus/infecciones. Los fabricantes de estos productos también incluyen pasos en el procesamiento de la sangre o plasma que puedan inactivar o eliminar los virus. A pesar de estas medidas, cuando se administran medicamentos preparados de sangre o plasma humano, no se puede excluir totalmente la posibilidad de transmitir una infección. Esto también se aplica a cualquiera de los virus desconocidos o emergentes o a otros tipos de infecciones.
Las medidas tomadas se consideran efectivas para los virus encapsulados como el virus de inmunodeficiencia humana (VIH), virus de hepatitis B (HBV), virus de hepatitis C (HCV) y para el virus no encapsulado de hepatitis A (HAV).
Las medidas tomadas pueden ser de valor limitado contra los virus no encapsulados como el parvovirus B19. La infección por parvovirus B19 puede ser grave en mujeres embarazadas (infección fetal) y para personas cuyos sistemas inmunes está disminuido o que tienen algún tipo de anemia (por ejemplo, enfermedad de células falciformes, o anemia hemolítica).
La vacunación apropiada contra hepatitis A y B debe considerarse en pacientes cuando reciben en forma regular el Factor IX de coagulación de plasma humano.
Se recomienda insistentemente que cada vez que usted reciba una dosis de AIMAFIX, se registre el nombre y el número de lote del producto, con el fin de mantener un registro de los lotes utilizados.
PRECAUCIONES DE USO: Como con cualquier producto intravenoso de proteína, son posibles reacciones de hipersensibilidad de tipo alérgico.
El producto contiene vestigios de proteínas humanas, diferentes del Factor IX.
Los pacientes deben ser informados sobre los signos prematuros de reacciones de hipersensibilidad incluyendo habón urticarial, urticaria generalizada, malestar torácico, sibilancia, hipotensión y anafilaxia. Si ocurren estos síntomas, los pacientes deben ser informados para que suspendan el uso del producto inmediatamente y acudan a su médico.
En caso de shock, las normas médicas actuales para tratamiento de shock se deben observar.
Después del tratamiento repetido con productos de Factor IX de coagulación de plasma humano, los pacientes deben ser monitoreados en cuanto al desarrollo de anticuerpos neutralizantes (inhibidores) que se deben cuantificar en unidades de Bethesda (BU) utilizando el correspondiente examen biológico. Han existido reportes en la literatura que indican una correlación entre la ocurrencia de un inhibidor del Factor IX y las reacciones alérgicas. Por consiguiente, los pacientes que experimentan reacciones alérgicas, deben ser evaluados en cuanto a la presencia de un inhibidor. Se debe observar que los pacientes con inhibidores del Factor IX pueden estar en aumento de riesgo de anafilaxia con posterior desafío con Factor IX.
Debido al riesgo de reacciones alérgicas con concentrados del Factor IX, las administraciones iniciales del Factor IX, de acuerdo con el criterio del médico tratante, deben realizarse bajo observación médica donde se pueda prestar atención médica apropiada en caso de reacciones alérgicas.
Como el uso de concentrados de Factor IX históricamente ha estado asociado con el desarrollo de acontecimientos tromboembólicos, siendo más alto el riesgo en preparaciones de pureza baja, el uso de productos que contienen el Factor IX pueden ser potencialmente peligrosos en pacientes con signos de fibrinólisis y en pacientes con coagulación intravascular diseminada (CID). Debido al posible riesgo de acontecimientos tromboembólicos, la vigilancia clínica de los signos iniciales de coagulopatía trombótica y de consumo debe iniciarse con el examen biológico apropiado cuando se administra este producto a pacientes con enfermedad hepática, pacientes después de operaciones, o a pacientes en riesgo de fenómenos trombóticos o de coagulación intravascular diseminada (DIC). En cada una de estas situaciones, se debe ponderar el beneficio del tratamiento con AIMAFIX frente al riesgo de estas complicaciones.
SOBREDOSIS: No se han reportado síntomas de sobredosis con el Factor IX de coagulación de plasma humano.
En caso de ingestión accidental o de una sobredosis con AIMAFIX, comuníquese inmediatamente con el médico o el hospital más cercano.
Si usted tiene alguna duda sobre el uso de AIMAFIX consulte al médico (o al Farmacéutico).
PRESENTACIÓN: El empaque de AIMAFIX contiene: AIMAFIX 500 UI/10 mL : Un vial de polvo con 500 UI + Un vial de solvente 10 mL + set para reconstitución y administración (Reg. San. No. INVIMA 2009 M-013380 R1).
Fabricante
Kedrion S.p.A.- 55027 Bolognana, Gallicano (Lucca).
Importador
FIAC FARMACÉUTICA S.A.S.
Para mayor información y/o reportes de farmacovigilancia:
Línea de Servicio al Cliente 018000911756
Calle 79 B Sur N° 50 - 150 Bodega 175
La Estrella, Antioquia, Colombia
FECHA DE VENCIMIENTO Y ALMACENAMIENTO
Fecha de vencimiento: ver fecha de vencimiento indicada en el empaque. La fecha de vencimiento se refiere al producto en su empaque intacto almacenado como se recomienda.
Precaución: No utilice AIMAFIX después de la fecha de vencimiento que aparece en la etiqueta y en la caja externa. La fecha de vencimiento se refiere al último día de ese mes.
Conserve en un refrigerador (+2 ºC/+8 ºC). No congelar.
Mantenga el vial en la caja externa, para protegerlo de la luz. Una vez que se ha abierto el recipiente de la infusión, se debe utilizar inmediatamente el contenido.
El contenido del vial se debe utilizar en una sola administración.
Los medicamentos no se deben desechar por las aguas residuales o las aguas de hogar. Pregunte a su Farmacéutico cómo desechar las medicinas que ya no se requieren. Estas medidas ayudarán a proteger el medio ambiente.
MANTÉNGASE FUERA DEL ALCANCE Y DE LA VISTA DE LOS NIÑOS.