
VICTOZA 6 MG/ML
LIRAGLUTIDA (ADN RECOMBINANTE)
Solución para inyección
Envase(s), 1 Dispositivo, 3 ml,
Envase(s), 2 Dispositivo, 3 ml,
Envase(s), 3 Dispositivo, 3 ml,
COMPOSICIÓN: De liraglutida 6.0 mg/ml: Cada mL contiene:
|
Sustancia |
Cantidad por mL |
Referencia de Calidad |
|
Liraglutida |
6.0 mg |
NOVO NORDISK A/S |
|
Fosfato disódico, dihidratado |
1.42 mg |
Ph. Eur., USP |
|
Fenol |
5.5 mg Nota 1 |
Ph. Eur., USP, JP |
|
Propilenglicol |
14.0 mg |
Ph. Eur., USP, JP |
|
Hidróxido de sodio |
Cantidad apropiada |
Ph. Eur., USP, JP |
|
Ácido clorhídrico |
Cantidad apropiada |
Ph. Eur., USP, JP |
|
Agua para inyecciones |
Hasta 1.0 ml |
Ph. Eur., USP, JP |
|
Nota 1: Se agrega un exceso de 2% de fenol para compensar la pérdida potencial durante la fabricación y el llenado. |
||
Plazo de validez: 30 meses.
Después del primer uso: 1 mes.
FORMA FARMACÉUTICA: Solución para inyección en un dispositivo pre-llenado.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Otros fármacos que disminuyen la glucosa sanguínea, excluyendo las insulinas. Código ATC: A10BX07
Mecanismo de acción: Liraglutida es un análogo de GLP-1 con 97% de homología de secuencia a la GLP-1 humana que se une y activa al receptor de GLP-1. El receptor de GLP-1 es el objetivo para el GLP-1 natural, una hormona incretina endógena que potencializa la secreción de insulina dependiente de la glucosa de las células beta pancreáticas. A diferencia del GLP-1 natural, la liraglutida tiene un perfil farmacocinético y farmacodinámico en humanos adecuado para la administración una vez al día. Luego de la administración subcutánea, el perfil de acción prolongado se basa en tres mecanismos: la auto-asociación, que resulta en absorción lenta: unión a albúmina; y estabilidad enzimática superior hacia la dipeptidil peptidasa IV (DPP-IV) y enzimas de endopeptidasa neutra (NEP), lo que resulta en una vida media en plasma larga.
La acción de Liraglutida se media a través de la interacción específica con receptores de GLP-1, lo que lleva a un incremento en el adenosín monofosfato cíclico (AMPc). Liraglutida estimula la secreción de insulina de manera dependiente a la glucosa. De modo simultáneo, la liraglutida disminuye la secreción inadecuadamente alta de glucagón, también de manera dependiente de la glucosa. Así, cuando la glucosa sanguínea está elevada, la secreción de insulina se estimula y se inhibe la secreción de glucagón. De manera inversa, durante la hipoglucemia la liraglutida disminuye la secreción de insulina y no afecta la secreción de glucagón. El mecanismo de disminución de la glucosa sanguínea también implica un retraso menor en el vaciado gástrico. La liraglutida reduce el peso corporal y la masa de grasa corporal a través de mecanismos que implican la reducción del hambre y disminución de ingesta energética.
Efectos de farmacodinamia: La liraglutida tiene una duración de 24 horas de acción y mejora el control glicémico disminuyendo la glucosa sanguínea en ayuno y postprandial en pacientes con diabetes mellitus tipo 2.
Secreción de insulina dependiente de la glucosa: La liraglutida aumentó la secreción de insulina en relación con el aumento en las concentraciones de glucosa. Mediante una infusión de glucosa graduada de forma escalonada, el índice de secreción de insulina aumentó luego de una dosis sencilla de liraglutida en pacientes con diabetes tipo 2 a un nivel comparable al observado en sujetos saludables (Fig. 2).
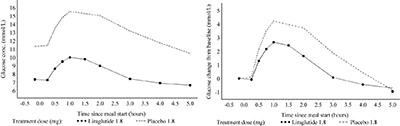
Figura 2. Media del Índice de Secreción de Insulina (ISI) versus concentración de glucosa luego de una dosis sencilla de 7.5 μg/kg (~0.66 mg) o el placebo en sujetos con diabetes tipo 2 (N=10) y sujetos saludables no tratados (N=10) durante la infusión de glucosa graduada.
Eficacia clínica: Se realizaron cinco estudios clínicos controlados, doble ciego, aleatorizados para evaluar los efectos de VICTOZA® sobre el control glicémico. El tratamiento con VICTOZA® produjo mejorías clínica y estadísticamente significativas en la hemoglobina glucosilada A1c (HbA1c), glucosa plasmática en ayuno y glucosa post-prandial comparado con el placebo.
Estos estudios incluyeron a 3,978 pacientes expuestos con diabetes tipo 2 (2,501 sujetos tratados con VICTOZA®), 53.7% hombres y 46.3% mujeres, 797 sujetos (508 tratados con VICTOZA®) tenían ≥65 años de edad y 113 sujetos (66 tratados con VICTOZA®) tenían ≥75 años de edad.
Hubo un estudio controlado, aleatorizado, sin enmascaramiento adicional que comparó a VICTOZA® con exenatida.
En un estudio clínico de 52 semanas, la adición de insulina detemir a VICTOZA® 1.8 mg y metformina en pacientes que no lograron su objetivo glicémico con VICTOZA® y metformina sola, resultó en una disminución de HbA1c de la evaluación basal de 0.54%, en comparación con 0.20% en el grupo de VICTOZA® 1.8 mg y de control de metformina. La disminución de peso fue sostenida.
Control glicémico:
|
Tabla 2. Resultados de un estudio de 52 semanas de VICTOZA® en monoterapia en pacientes con un control de glucosa inadecuado de dieta y ejercicio previo o tratamiento con un fármaco antidiabético oral (OAD). |
|||
|
Monoterapia |
|||
|
Liraglutida 1.8 mg |
Liraglutida 1.2 mg |
Glimepirida |
|
|
N |
246 |
251 |
248 |
|
HbA1c (%) (Media) |
|||
|
Evaluación basal |
8.19 |
8.18 |
8.23 |
|
Pacientes (%) que lograron HbA1c <7% |
|||
|
Todos los pacientes |
50.9 |
42.8 |
27.8 |
|
Peso corporal (kg) (Media) |
|||
|
Evaluación basal |
92.6 |
92.1 |
93.3 |
VICTOZA® en tratamiento combinado, durante 26 semanas, con metformina, glimepirida o metformina y rosiglitazona resultaron en un una reducción estadísticamente significativa (p<0.0001) y sostenida en HbA1c en comparación con los pacientes que recibieron el placebo (Tablas 3 y 4).
|
Tabla 3. Resultados de dos estudios de 26 semanas. VICTOZA® en combinación con metformina y VICTOZA® en combinación con glimepirida. |
||||
|
Adición de metformina |
1.8 mg liraglutida |
1.2 mg liraglutida |
Placebo + |
Glimepirida2 + |
|
N |
242 |
240 |
121 |
242 |
|
Media HbA1c (%) |
||||
|
Eval. basal |
8.4 |
8.3 |
8.4 |
8.4 |
|
Cambio de eval. basal |
-1.00 |
-0.97 |
0.09 |
-0.98 |
|
Monoterapia ADO previa |
-1.34 |
-1.30 |
-0.43 |
-1.19 |
|
Pacientes (%) con éxito |
||||
|
Todos los pacientes |
42.4 |
35.3 |
10.8 |
36.3 |
|
Monoterapia ADO previa |
66.3 |
52.8 |
22.5 |
56.0 |
|
Media peso corporal (kg) |
||||
|
Eval. basal |
88.0 |
88.5 |
91.0 |
89.0 |
|
Cambio de la ev. basal |
-2.79 |
-2.58 |
-1.51 |
0.95 |
|
Tratamiento añadido de glimepirida |
1.8 mg liraglutida + glimepirida2 |
1.2 mg liraglutida + glimepirida2 |
placebo + glimepirida2 |
rosiglitazona1 + glimepirida |
|
N |
234 |
228 |
114 |
231 |
|
Media HbA1c (%) |
||||
|
Eval. basal |
8.5 |
8.5 |
8.4 |
8.4 |
|
Cambio de eval. basal |
-1.13 |
-1.08 |
0.23 |
-0.44 |
|
Monoterapia ADO previa |
-1.42 |
-1.48 |
-0.31 |
-0.81 |
|
Pacientes (%) con éxito |
||||
|
Todos los pacientes |
41.6 |
34.5 |
7.5 |
21.9 |
|
Monoterapia ADO previa |
55.9 |
57.4 |
11.8 |
36.1 |
|
Media peso corporal (kg) |
||||
|
Línea de base |
83.0 |
80.0 |
81.9 |
80.6 |
|
Cambio de línea de base |
-0.23 |
0.32 |
-0.10 |
2.11 |
|
1 Rosiglitazona, 4 mg/día; 2 glimepirida 4 mg/día; 3 metformina 2000 mg/día. |
||||
|
Metformina + Rosiglitazona, en Tratamiento añadido |
1.8 mg liraglutida + metformina2 + rosiglitazona3 |
1.2 mg liraglutida + metformina2 + rosiglitazona3 |
placebo + metformina2 + rosiglitazona3 |
N/A |
|
N |
178 |
177 |
175 |
|
|
Media HbA1c (%) |
||||
|
Eval. basal |
8.56 |
8.48 |
8.42 |
|
|
Cambio de eval. basal |
-1.48 |
-1.48 |
-0.54 |
|
|
Pacientes (%) con éxito |
||||
|
Todos los pacientes |
53.7 |
57.5 |
28.1 |
|
|
Media peso corporal (kg) |
||||
|
Eval. basal |
94.9 |
95.3 |
98.5 |
|
|
Cambio de eval. basal |
-2.02 |
-1.02 |
0.60 |
|
|
Metformina + glimepirida, en tratamiento añadido |
1.8 mg Liraglutida + metformina2 + glimepirida4 |
N/A |
Placebo + metformina2 + glimepirida4 |
insulina glargina1 + metformina + glimepirida |
|
N |
230 |
114 |
232 |
|
|
Media HbA1c (%) |
||||
|
Eval. basal |
8.3 |
8.3 |
8.1 |
|
|
Cambio de eval. basal |
-1.33 |
-0.24 |
-1.09 |
|
|
Pacientes (%) con éxito |
||||
|
Todos los pacientes |
53.1 |
15.3 |
45.8 |
|
|
Media peso corporal |
||||
|
Eval. basal |
85.8 |
85.4 |
85.2 |
|
|
Cambio de eval. Basal |
-1.81 |
-0.42 |
1.62 eval. Basal |
|
|
1 La dosificación de insulina glargina fue sin enmascaramiento y se aplicó de acuerdo a la siguiente guía de titulación. La titulación de la dosis de insulina glargina la manejó el paciente a partir de las instrucciones del investigador. |
||||
|
Guía para titulación de insulina glargina: |
||||
|
Glucosa plasmática en ayuno medida por el paciente |
Aumento de dosis de insulina glargina (unidad) |
|||
|
— ≤5.5 mmol/l (≤100 mg/dl) Objetivo |
— Sin ajuste |
|||
|
— >5.5 y < 6.7 mmol/l (>100 y <120 mg/dl) |
— 0 – 2 a |
|||
|
— ≥6.7 mmol/l (≥120 mg/dl) |
— 2 |
|||
|
a De acuerdo a la recomendación individualizada del investigador en la consulta previa, por ejemplo, dependiendo de si el sujeto experimentó hipoglucemia. 2 Metformina 2000 mg/día; 3 rosiglitazona 4 mg dos veces al día; 4 glimepirida 4 mg/día. La monoterapia de VICTOZA® por 52 semanas resultó en reducciones estadísticamente significativas (p < 0.0014) y reducciones sostenidas en HbA1c en comparación con los pacientes que recibieron glimepirida. |
||||
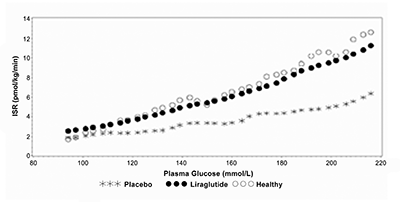
Figura 3. El nivel de HbA1c se redujo a menos de 7% y se sostuvo luego de 12 meses cuando se administró VICTOZA® a pacientes tratados previamente con dieta y ejercicio
Los pacientes con un HbA1c de más de 9.5% en la evaluación basal experimentaron una media en la reducción de HbA1c de 2.1% después del tratamiento con [liraglutida] como tratamiento, mientras que los pacientes tratados con [liraglutida] en estudios combinados experimentaron una media en la reducción de HbA1c de 1.1 a 2.5%.
Proporción de pacientes que lograron reducción de HbA1c: VICTOZA® como monoterapia resultó en una proporción mayor estadísticamente significativa (p≤ 0.0007) de pacientes que lograron un HbA1c de ≤7% a las 52 semanas en comparación con los pacientes que recibieron glimepirida.
VICTOZA® en combinación con metformina, una sulfonilurea o metformina y una tiazolidinediona resultó en una proporción mayor estadísticamente significativa (p≤ 0.0001) de pacientes que lograron un HbA1c de ≤ 6.5% a las 26 semanas en comparación con los pacientes que recibieron estos agentes solos.
En todos los estudios combinados de 26 semanas más sujetos lograron una HbA1c de < 7% cuando VICTOZA® se utilizó como complemento que como tratamiento de reemplazo.
Glucosa plasmática en ayuno: El tratamiento con VICTOZA® solo o en combinación con uno o dos fármacos antidiabéticos orales resultó en una reducción en la glucosa plasmática en ayuno de 13-43.5 mg/dl (0.72-2.42 mmol/l). Esta reducción se observó dentro de las primeras dos semanas de tratamiento.
Glucosa post-prandial: VICTOZA® reduce la glucosa post-prandial a lo largo de las tres comidas diarias en 31-49 mg/dl (1.68-2.71 mmol/l).
Función de las células beta: Estudios clínicos con VICTOZA® indican una mejoría en la función de las células beta basada en las medidas como la evaluación del modelo de homeostasis para la función de las células beta (HOMA-B) y la relación pro-insulina - insulina. Se demostró la mejoría en la secreción de insulina de primera y segunda fase después de 52 semanas de tratamiento con VICTOZA® en un sub-grupo de pacientes con diabetes tipo 2 (N=29).
Peso corporal: VICTOZA® en monoterapia por 52 semanas se asoció con una reducción sostenida de peso.
VICTOZA® en combinación con metformina, metformina y glimepirida o metformina y rosiglitazona se asoció con una reducción sostenida de peso a lo largo de los estudios en un rango de 1.0 kg a 2.8 kg.
Se observó una reducción mayor de peso con un aumento en el índice de masa corporal (IMC) en la evaluación basal.
Se observó una reducción en el peso corporal en pacientes tratados con VICTOZA® independientemente de la incidencia de náuseas.
En combinación con metformina, VICTOZA® redujo el tejido adiposo visceral en un rango de 13- 17%.
Presión arterial: Durante los estudios, VICTOZA® disminuyó la presión sistólica en un promedio de 2.3 a 6.7 mmHg de la evaluación basal y comparado con el comparador activo la disminución fue de 1.9 a 4.5 mmHg. La reducción en la presión sistólica ocurrió antes de la pérdida de peso.
Otros datos clínicos: En un estudio que comparó la eficacia y seguridad de VICTOZA® (1.2 mg y 1.8 mg) y sitagliptina (un inhibidor DPP—4, 100 mg) en pacientes con un control inadecuado con tratamiento de metformina. VICTOZA® a ambas dosis fue superior al tratamiento de sitagliptina para reducir el HbA1c después de 26 semanas (-1.24%, -1.50% vs -0.90%, p <0.0001). Significativamente más pacientes lograron un HbA1c de menos de 7% con VICTOZA® en comparación con sitagliptina (43.7% y 56.0% vs 22.0%, p <0.0001). Los pacientes tratados con VICTOZA® tuvieron una disminución significativa en el peso corporal en comparación con la de los pacientes tratados con sitagliptina (-2.9 kg y -3.4 kg vs -1.0 kg, p <0.0001). Una mayor proporción de pacientes tratados con VICTOZA® experimentó náuseas vs. los sujetos tratados con sitagliptina.
Sin embargo, se demostró que las náuseas eran temporales. El índice de hipoglucemia menor no fue significativamente diferente entre VICTOZA® y el tratamiento de sitagliptina (0.178 y 0.161 vs 0.106 episodios por año sujeto). Las reducciones de HbA1c y la superioridad vs sitagliptina observadas después de 26 semanas de tratamiento de VICTOZA® (1.2 mg y 1.8 mg) se sostuvieron después de 52 semanas de tratamiento (-1.29% y -1.51% vs -0.88%, p <0.0001). El cambio del tratamiento de los pacientes de sitagliptina a VICTOZA® después de 52 semanas de tratamiento resultó en una reducción, estadística y adicionalmente significativa en HbA1c (0.24% y 0.45%, 95% CI: 0.41 a 0.07 y -0.67 a 0.23) a la semana 78, pero no hubo disponible un grupo formal de control.
En un estudio que comparó la eficacia y seguridad de VICTOZA® 1.8 mg y exenatida 10 mg dos veces al día en pacientes con un control inadecuado sobre el tratamiento de metformina y/o sulfonilurea, VICTOZA® fue superior al tratamiento de exenatida para reducir la HbA1c después de 26 semanas (-1.12% vs - 0.79%, p <0.0001). Significativamente más pacientes lograron una HbA1c de menos de 7% con VICTOZA® en comparación con exenatida (54.2% vs 43.4%, p= 0.0015). Ambos tratamientos resultaron en una media de baja de peso corporal de aproximadamente 3 kg. La proporción de pacientes que reportó náuseas fue menor con VICTOZA® que con exenatida.
El índice de hipoglucemia menor en el grupo de VICTOZA® fue significativamente menor en comparación con el del grupo de exenatida (1.932 versus 2.600 eventos por sujeto año, p= 0.01). El cambio de los pacientes de exenatida a VICTOZA® después de 26 semanas de tratamiento resultó en una reducción adicional de HbA1c (-0.32%, p< 0.0001) a la semana 40 mientras que hubo 13% de pacientes con un HbA1c de menos de 7%.
PROPIEDADES FARMACOCINÉTICAS:
Absorción: La absorción de liraglutida luego de la administración subcutánea es lenta, logrando una concentración máxima 8-12 horas post-dosis. La concentración de liraglutida máxima estimada fue de 9.4 nmol/l para una dosis sencilla subcutánea de liraglutida de 0.6 mg. A 1.8 mg de liraglutida, la concentración en estado estacionario promedio de liraglutida (ABCτ/24) alcanzó aproximadamente 34 nmol/l. La exposición de liraglutida aumentó proporcionalmente con la dosis. El coeficiente intra- sujetos de variación para el ABC de liraglutida fue de 11% después de la administración de una dosis sencilla.
La biodisponibilidad absoluta de liraglutida después de la administración subcutánea es de aproximadamente 55%.
Distribución: El volumen aparente de distribución después de la administración subcutánea es de 11-17 l. La media del volumen de distribución después de la administración intravenosa de liraglutida es de 0.07 l/kg. Liraglutida se une de manera extensiva a las proteínas de plasma (>98%).
Metabolismo: Durante las 24 horas posteriores a la administración de una dosis sencilla radiomarcada [3H] de liraglutida a sujetos saludables, el componente principal en plasma fue liraglutida intacto. Se detectaron dos metabolitos en plasma menores (≤9% y ≤5% de la exposición total de radioactividad en plasma). Liraglutida se metaboliza de manera similar a las proteínas grandes sin un órgano específico identificado como vía de eliminación principal.
Eliminación: Luego de una dosis de [3H]-liraglutida, no se detectó liraglutida intacto en la orina o en las heces. Sólo una parte menor de la radioactividad administrada se excretó como metabolitos relacionados con liraglutida en la orina o heces (6% y 5%, respectivamente). La radioactividad en orina y heces se excretó principalmente durante los primeros 6-8 días y correspondió a tres metabolitos menores, respectivamente.
La media de depuración luego de la administración subcutánea de una dosis sencilla de liraglutida es de aproximadamente 1.2 l/h con una vida media de eliminación de aproximadamente 13 horas.
Poblaciones especiales:
Adultos mayores: La edad no tiene un efecto clínicamente relevante en la farmacocinética de liraglutida con base en los resultados de un estudio de farmacocinética en sujetos saludables y análisis de datos de farmacocinética de una población de pacientes (18 a 80 años).
Sexo: El sexo no tuvo un efecto clínicamente significativo sobre la farmacocinética de liraglutida con base en los resultados de los análisis de datos de farmacocinética de población de pacientes masculinos y femeninos y un estudio de farmacocinética en sujetos saludables.
Origen étnico: El origen étnico no tuvo un efecto clínicamente relevante sobre la farmacocinética de liraglutida con base a los resultados del análisis de farmacocinética de población que incluyó a sujetos de grupos blancos, negros, asiáticos e hispanos.
Obesidad: El análisis de farmacocinético de población sugiere que el índice de masa corporal (IMC) no tuvo un efecto significativo sobre la farmacocinética de liraglutida.
Deterioro hepático: Se evaluó la farmacocinética de liraglutida en sujetos con un grado variable de insuficiencia hepática en un estudio de dosis sencilla. La exposición de liraglutida disminuyó 13-23% en sujetos con insuficiencia hepática de leve a moderada en comparación con sujetos saludables.
La exposición fue significativamente menor (44%) en sujetos con deficiencia hepática grave (Puntaje de Child Pugh >9).
Deterioro renal: La exposición de liraglutida se redujo levemente en sujetos con deficiencia renal en comparación con individuos con una función renal normal. La exposición de liraglutida disminuyó 33%, 14%, 27% y 28%, respectivamente, en sujetos con deterioro renal leve (depuración de creatinina, CrCL 50-80 ml/min), moderada (CrCL 30-50 ml/min) y grave (CrCL <30 ml/min) y en la enfermedad renal en etapa terminal con necesidad de diálisis.
CONTRAINDICACIONES: Hipersensibilidad a la sustancia activa o a alguno de los excipientes listados a continuación:
• Fosfato disódico dihidratado.
• Propilenglicol.
• Fenol.
• Agua para inyecciones.
ADVERTENCIAS Y PRECAUCIONES: VICTOZA® no debe utilizarse en pacientes con diabetes mellitus tipo 1 o para el tratamiento de la cetoacidosis diabética.
VICTOZA® no es un sustituto de insulina.
No se ha evaluado la adición de liraglutida en pacientes con tratamientos de insulina en curso.
Existe una experiencia limitada en pacientes con insuficiencia cardiaca congestiva, New York Heart Association (NYHA) clase I-II. No hay experiencia en pacientes con insuficiencia cardiaca congestiva NYHA clase III-IV.
Hay experiencia limitada en pacientes con la enfermedad inflamatoria intestinal y gastroparesia diabética, por lo que no se recomienda VICTOZA® para estos pacientes. El uso de VICTOZA® se asocia con reacciones adversas gastrointestinales pasajeras, como náuseas, vómito y diarrea.
Se ha asociado al uso de otros análogos de GLP-1 con el riesgo de padecer pancreatitis. Se han reportado algunos eventos de pancreatitis aguda. Debe informarse a los pacientes sobre los síntomas característicos de pancreatitis aguda: dolor abdominal grave y persistente. Si se sospecha de pancreatitis, debe descontinuarse el uso de VICTOZA® y otros productos medicinales que se sospecha que también podrían ser la causa.
En estudios clínicos, se han reportado eventos adversos de tiroides, como el aumento en la calcitonina sanguínea, bocio y neoplasia tiroidea, en particular en pacientes con enfermedad tiroidea pre-existente (véase efectos indeseables).
Se han reportado signos y síntomas de deshidratación, como deterioro renal e insuficiencia renal aguda en pacientes tratados con VICTOZA®. Deberá avisarse a los pacientes tratados con VICTOZA® del posible riesgo de deshidratación en relación con los efectos secundarios gastrointestinales y tomar precauciones para evitar la pérdida de líquidos.
Los pacientes que recibieron VICTOZA® en combinación con una sulfonilurea pueden tener un aumento en el riesgo de hipoglucemia. Puede disminuirse el riesgo de hipoglucemia mediante la reducción de la dosis de sulfonilurea.
Hipoglucemia: La mayoría de los episodios de hipoglucemia confirmada en estudios clínicos fueron menores. No se observaron episodios de hipoglucemia mayor en el estudio con VICTOZA® utilizada como monoterapia. Puede ocurrir hipoglucemia mayor de manera poco común y principalmente se observó cuando se combinó VICTOZA® con una sulfonilurea (0.02 eventos/sujeto año). Se observaron muy pocos episodios (0.001 eventos/sujeto año) con la administración de VICTOZA® en combinación con un antidiabético oral distinto a las sulfonilureas.
Cuando se agregó insulina detemir a liraglutida 1.8 mg y metformina, no se observaron eventos hipoglucémicos mayores. El índice de episodios de hipoglucemia menor fue de 0.286 eventos por sujeto año. En los grupos del comparador tratados con liraglutida 1.8 mg y metformina, los índices de eventos de hipoglucemia menor fueron de 0.029 y 0.129 eventos por años sujeto, respectivamente.
Reacciones adversas gastrointestinales: La mayoría de los episodios de náuseas fueron de leves a moderados, temporales y rara vez causaron la descontinuación del tratamiento. Como monoterapia, los pacientes tratados con ambas dosis de VICTOZA® reportaron una incidencia mayor de náuseas en las semanas iniciales del tratamiento (14%) en comparación con glimepirida (3%). La proporción de pacientes tratados con VICTOZA® con náuseas disminuyó con el tiempo y después de 16 semanas la proporción fue similar a la de pacientes tratados con glimepirida.
Los pacientes de >70 años pueden experimentar más efectos gastrointestinales cuando se tratan con VICTOZA®.
Los pacientes con deficiencia renal leve (depuración de creatinina ≤60-90 ml/min) pueden experimentar más efectos gastrointestinales cuando se tratan con VICTOZA®.
Abandonos: La incidencia de abandonos debido a reacciones adversas fue de 7.8% para pacientes tratados con VICTOZA® y de 3.4% para pacientes tratados con comparador en los estudios controlados a largo plazo (26 semanas o más). Las reacciones adversas más frecuentes que llevaron al abandono para pacientes tratados con VICTOZA® fueron náuseas (2.8% de pacientes) y vómito (1.5%).
Inmunogenicidad: En consistencia con las propiedades potencialmente inmunogénicas de los productos medicinales con proteínas o péptidos, los pacientes pueden desarrollar anticuerpos anti-liraglutida luego del tratamiento con VICTOZA®. En promedio, 8.6% de pacientes desarrollaron anticuerpos. No se ha asociado a la formación de anticuerpos con la reducción de la eficacia de VICTOZA®.
Pancreatitis: Se han reportado pocos casos (<0.2%) de pancreatitis aguda durante estudios clínicos a largo plazo con VICTOZA®. Tampoco puede establecerse ni excluirse una relación causal entre VICTOZA® y la pancreatitis.
Eventos de tiroides: Los índices generales de eventos adversos de tiroides en todos los estudios a plazo largo e intermedio fueron de 33.5, 30.0 y 21.7 eventos por 1,000 sujetos año de exposición para total de liraglutida, el placebo y el total de comparadores; 5.4, 2.1 y 1.2 eventos conciernen, respectivamente, a eventos adversos de tiroides graves.
La neoplasia tiroidea, aumento en la calcitonina sanguínea y bocio fueron los eventos adversos de tiroides más frecuentes y los índices por 1,000 sujetos año de exposición fueron de 6.8, 10.9 y 5.4 de los pacientes tratados con liraglutida en comparación con 6.4, 10.7 y 2.1 de los tratados con el placebo y de 2.4, 6.0 y 1.8 de los pacientes tratados con el comparador, respectivamente.
Reacciones alérgicas: Las reacciones alérgicas como urticaria, salpullido y prurito se reportaron a partir del uso comercial de VICTOZA®.
Se han reportado pocos casos de reacciones anafilácticas con síntomas adicionales como hipotensión, palpitaciones, disnea y edema con el uso comercial de VICTOZA®.
USO EN EMBARAZO Y LACTANCIA:
Embarazo: No hay datos adecuados del uso de VICTOZA® en mujeres embarazadas. Los estudios en animales han demostrado toxicidad reproductiva. El riesgo potencial para los humanos se desconoce.
No debe utilizarse VICTOZA® durante el embarazo; por el contrario, se recomienda el uso de insulina. Si una paciente desea embarazarse o se embaraza, debe descontinuar el tratamiento con VICTOZA®.
Lactancia: No se sabe si liraglutida se excreta en la leche humana. Estudios en animales han demostrado que la transferencia de liraglutida y los metabolitos de relación estructural cercana en la leche es baja. Debido a la falta de experiencia, no debe utilizarse VICTOZA® durante la lactancia.
EFECTOS EN LA CONDUCCIÓN DE VEHÍCULOS/MAQUINARIAS: No se han realizado estudios sobre los efectos en la capacidad para manejar y utilizar maquinaria. Debe aconsejarse a los pacientes que tomen precauciones para evitar la hipoglucemia mientras manejan o utilizan maquinaria, en particular cuando se utiliza VICTOZA® en combinación con una sulfonilurea.
Debe evitar que se le baje el azúcar (hipoglucemia) mientras conduce o utiliza maquinaria o herramientas, ya que esto podría reducir sus capacidades para concentrarse.
EFECTOS INDESEABLES:
Resumen del perfil de seguridad: En cinco estudios clínicos grandes a largo plazo, más de 2500 pacientes recibieron tratamiento con VICTOZA® sola o en combinación con metformina, una sulfonilurea (con o sin metformina) o metformina más rosiglitazona.
La frecuencia se define como: Muy común (≥1/10); común (≥1/100 a <1/10); poco común (≥1/1,000 a <1/100); raro (≥1/10,000 a <1/1,000); muy raro (<1/10,000); desconocido (no puede estimarse a partir de los datos disponibles). Dentro de cada agrupamiento de frecuencias, se presentan los efectos indeseables en orden descendente de gravedad.
Las reacciones adversas reportadas con mayor frecuencia durante los estudios clínicos fueron los trastornos gastrointestinales: las náuseas y diarrea fueron muy comunes, mientras que el vómito, estreñimiento, dolor abdominal y dispepsia fueron comunes. Al principio del tratamiento con VICTOZA®, estas reacciones gastrointestinales adversas pueden ocurrir con mayor frecuencia y por lo regular disminuyeron en algunos días o semanas de continuación del tratamiento. También fueron comunes el dolor de cabeza y la infección del tracto respiratorio superior. Además, la hipoglucemia fue común y muy común cuando se utilizó VICTOZA® en combinación con una sulfonilurea. Se ha observado hipoglucemia mayor principalmente cuando se combinó con una sulfonilurea.
Lista tabulada de reacciones adversas: La Tabla 1 lista las reacciones adversas con VICTOZA® reportadas en estudios controlados de Fase 3 y reportes espontáneos (post comercialización). Las reacciones adversas identificadas en estudios de fase 3 de largo plazo se presentaron si ocurrían con una frecuencia de >5% y si la frecuencia era mayor entre los pacientes tratados con VICTOZA® que los tratados con un comparador. También se incluyeron las reacciones adversas con una frecuencia de ≥1% si la frecuencia fue de > 2 veces la frecuencia para los sujetos tratados con el comparador.
Las frecuencias para los reportes espontáneos relacionados (post comercialización) se calcularon con base en su incidencia en los estudios clínicos de fase 3.
|
Tabla 1. Reacciones adversas reportadas en estudios controlados fase 3 y reportes espontáneos (post comercialización). |
||
|
Sistema corporal / reacción adversa |
Frecuencia de incidencia |
|
|
Estudios de fase 3 |
Reportes espontáneos |
|
|
Trastornos del metabolismo y nutrición |
||
|
Hipoglucemia |
común |
|
|
Anorexia |
común |
|
|
Disminución de apetito |
común |
|
|
Trastornos del sistema nervioso |
||
|
Dolor de cabeza |
Común |
|
|
Trastornos gastrointestinales |
||
|
Náuseas |
Muy común |
|
|
Diarrea |
Muy común |
|
|
Vómito |
común |
|
|
Dispepsia |
común |
|
|
Dolor abdominal superior |
común |
|
|
Estreñimiento |
común |
|
|
Gastritis |
común |
|
|
Flatulencias |
común |
|
|
Distensión abdominal |
común |
|
|
Enfermedad reflujo gastroesofágico |
común |
|
|
Eructos |
común |
|
|
Trastornos del sistema inmunitario |
||
|
Reacción anafiláctica |
raro |
|
|
Infecciones e infestaciones |
||
|
Infección tracto resp. superior |
común |
|
|
Trastornos generales y administración |
||
|
Malestar |
Poco común |
|
|
Reacciones en el sitio de inyección |
común |
|
|
Trastornos renales y urinarios |
||
|
Insuficiencia renal aguda |
Poco común |
|
|
Afección renal# |
Poco común |
|
|
Trastornos del metabolismo y nutrición |
||
|
Deshidratación |
Poco común |
|
|
Trastornos de la piel y tejido subcutáneo |
||
|
Urticaria |
Poco común |
|
|
Salpullido |
Común |
|
|
Prurito |
Poco común |
|
En un ensayo clínico con VICTOZA® como monoterapia, los índices de hipoglucemia reportados con VICTOZA® fueron menores que los reportados para los pacientes tratados con un comparador activo (glimepirida). Los eventos adversos reportados con mayor frecuencia fueron las infecciones e infestaciones gastrointestinales.
POSIBLES EFECTOS SECUNDARIOS: Como todos los medicamentos, VICTOZA® puede causar efectos secundarios aunque no todas las personas los presentan.
Los efectos secundarios pueden ocurrir con cierta frecuencia y se definen de la siguiente manera:
• Muy común: afecta a más de 1 usuario en 10.
• Común: afecta a 1 a 10 usuarios en 100.
• Poco común: afecta 1 a 10 usuarios en 1,000.
• Raro: afecta 1 a 10 usuarios en 10,000.
• Muy raro: afecta a menos de 1 usuario en 10,000.
• Desconocido: No puede estimarse la frecuencia a partir de la información disponible.
Efectos secundarios muy comunes:
Náuseas: Por lo regular desaparecen con el tiempo.
Diarrea: Por lo regular desaparece con el tiempo.
Efectos secundarios comunes:
• Hipoglucemia (azúcar baja en la sangre): Las señales de advertencia de azúcar baja en la sangre pueden aparecer de repente y son: sudor frío, piel fría y pálida, dolor de cabeza, latidos del corazón rápidos, náuseas, mucha hambre, cambios en la visión, somnolencia, debilidad, nerviosismo, ansiedad, confusión, dificultades para concentrarse, temblores. Su médico le indicará cómo tratar el azúcar baja en la sangre y qué hacer si nota alguna de las señales de advertencia. Si ya está tomando algún medicamento de sulfonilurea cuando empiece con VICTOZA®, su médico puede indicarle que reduzca la dosis de la sulfonilurea.
• Anorexia.
• Disminución del apetito.
• Dolor de cabeza.
• Vómito.
• Dispepsia.
• Inflamación de estómago (gastritis). Los signos son dolor estomacal, náuseas y vómito.
• Enfermedad del reflujo gastroesofágico (ERGE). Un signo es la acidez.
• Distensión abdominal.
• Dolor en la parte superior del abdomen.
• Estreñimiento.
• Flatulencias.
• Eructos.
• Infección en el tracto respiratorio superior.
• Reacciones en el sitio de inyección (como moretones, dolor, irritación, comezón y salpullido).
Reacciones alérgicas como salpullido.
Efectos secundarios poco comunes:
• Pancreatitis.
• Eventos de tiroides, como nódulos, aumento de la calcitonina en la sangre y bocio.
• Reacciones alérgicas como prurito (comezón) y urticaria (un tipo de salpullido en la piel).
• Malestar (sensación de incomodidad).
• Deshidratación, a veces con una disminución en la función renal.
Efectos secundarios raros:
• Una forma severa de reacción alérgica (reacción anafiláctica) con síntomas adicionales como problemas para respirar, inflamación de la garganta y cara, latidos rápidos del corazón, etc. Si usted experimenta estos síntomas debe buscar ayuda médica de inmediato e informarle a su doctor lo más pronto posible.
Si alguno de los efectos secundarios empeora o si usted nota algún efecto que no se liste en este folleto, consulte a su médico, enfermera o farmacéutico.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: In vitro, la liraglutida ha demostrado tener un potencial muy bajo para involucrarse en interacciones farmacocinéticas con otras sustancias activas relacionadas con el citocromo P450 y unión de proteínas en plasma.
El pequeño retraso del vaciado gástrico con liraglutida puede influir en la absorción de los productos medicinales orales administrados de manera concomitante. Los estudios de interacción no mostraron algún retraso clínicamente relevante de absorción. Algunos pacientes tratados con liraglutida reportaron al menos un episodio de diarrea grave. La diarrea puede afectar la absorción de los productos medicinales orales concomitantes.
Paracetamol: La liraglutida no cambió la exposición general de paracetamol luego de una dosis sencilla de 1000 mg. El Cmáx paracetamol disminuyó 31% y la mediana de tmáx se retrasó hasta 15 min. No se requiere un ajuste de dosis para el uso concomitante de paracetamol.
Atorvastatina: La liraglutida no cambió la exposición general de la atorvastatina a un grado clínico relevante luego de la administración sencilla de la dosis de atorvastatina de 40 mg. Por lo tanto, no se requiere ajuste de dosis de atorvastatina cuando se administra con liraglutida. El Cmáx de atorvastatina disminuyó 38% y la mediana de tmáx se retrasó de 1 h a 3 h con liraglutida.
Griseofulvina: La liraglutida no cambió la exposición general de la griseofulvina luego de la administración de una dosis sencilla de griseofulvina 500 mg. El Cmáx de griseofulvina aumentó 37% mientras que la mediana de tmáx no cambió. No se requieren ajustes de dosis de griseofulvina y otros compuestos con baja solubilidad y alta permeabilidad.
Digoxina: La administración de una dosis sencilla de digoxina 1 mg con liraglutida resultó en una reducción del AUC de la digoxina de 16%; el Cmáx disminuyó 31%. La mediana de tiempo de digoxina a la concentración máxima (tmáx) se retrasó de 1 h a 1.5 h. No se requiere el ajuste de la dosis de digoxina con base en estos resultados.
Lisinopril: La administración de una dosis sencilla de lisinopril 20 mg con liraglutida resultó en una reducción del AUC del lisinopril de 15%; el Cmáx disminuyó 27%. La mediana de tmáx se retrasó de 6 h a 8 h con liraglutida. No se requiere el ajuste de la dosis de lisinopril con base en estos resultados.
Anticonceptivos orales: La liraglutida disminuyó el Cmáx de etinilestradiol y levonorgestrel en 12 y 13%, respectivamente, luego de la administración de una dosis sencilla de un producto anticonceptivo oral. El Tmáx se retrasó en 1.5 h con liraglutida para ambos compuestos. No hubo un efecto clínicamente relevante en la exposición general ya sea de etinilestradiol o levonorgestrel. Por lo tanto, se anticipa que el efecto anticonceptivo no resulta afectado cuando se co-administra con liraglutida.
Warfarina y otros derivados de la cumarina: No se han realizado estudios de interacción. Luego del inicio del tratamiento de VICTOZA® en pacientes con warfarina u otros derivados de la cumarina se recomienda un monitoreo más frecuente del INR (Relación Normalizada Internacional).
Insulina: No se han observado interacciones de farmacodinamia o farmacocinética entre la liraglutida y la insulina detemir cuando se administró una dosis sencilla de insulina detemir 0.5 U/kg con liraglutida 1.8 mg en estado estacionario en pacientes con diabetes tipo 2.
POSOLOGÍA Y MODO DE ADMINISTRACIÓN:
Posología: La dosis inicial es de 0.6 mg de liraglutida a diario. Después de al menos una semana, la dosis debe aumentar a 1.2 mg. Se espera que algunos pacientes se beneficien de un aumento en la dosis de 1.2 mg a 1.8 mg y se basa en la respuesta clínica; después de al menos una semana la dosis puede aumentarse a 1.8 mg para mejorar aún más el control glicémico. No se recomiendan las dosis diarias mayores de 1.8 mg.
Puede agregarse VICTOZA® al tratamiento actual de metformina o a una combinación de metformina y tiazolidinediona. La dosis actual de metformina y tiazolidinediona puede continuar sin cambios.
Puede agregarse VICTOZA® al tratamiento actual de sulfonilurea o a una combinación de metformina y sulfonilurea. Cuando se agrega VICTOZA® al tratamiento de sulfonilurea, debe considerarse una reducción en la dosis de sulfonilurea para reducir el riesgo de hipoglucemia.
No es necesario que el paciente realice el monitoreo de la glucosa sanguínea para ajustar la dosis de VICTOZA®. Sin embargo, cuando se inicia el tratamiento con VICTOZA® en combinación con una sulfonilurea, podría requerirse que sí realice este monitoreo de glucosa para ajustar la dosis de la sulfonilurea.
Poblaciones especiales:
Adultos mayores (> 65 años): No se requiere ajuste de dosis con base en la edad. La experiencia terapéutica en pacientes de ≥ 75 años está limitada.
Deterioro renal: No se requiere ajuste de dosis para los pacientes con deterioro renal leve. Existe experiencia limitada en pacientes con deterioro renal moderado. Actualmente, no se puede recomendar VICTOZA® para uso en pacientes con deterioro renal grave, incluyendo a pacientes con enfermedad renal en etapa terminal.
Deterioro hepático: La experiencia terapéutica en pacientes con deterioro hepático actualmente es muy limitada para recomendar el uso en pacientes con deterioro hepático leve, moderado o grave.
Población pediátrica: No se recomienda utilizar VICTOZA® en niños de menos de 18 años de edad debido a la falta de información.
Método de administración: VICTOZA® se administra una vez al día a cualquier hora, independientemente de las comidas y puede inyectarse por vía subcutánea en el abdomen, muslo o parte superior del brazo. El sitio de inyección y hora pueden cambiarse sin ajustar la dosis. Sin embargo, es preferible que VICTOZA® se inyecte aproximadamente a la misma hora del día, cuando se haya elegido la hora más conveniente del día.
VICTOZA® no debe administrarse por vía intravenosa o intramuscular.
VÍA DE ADMINISTRACIÓN: Subcutánea.
Concentración: 6 mg / mL.
SOBREDOSIS: En estudios clínicos y a partir del uso comercial, se han reportado sobredosis de hasta 40 veces la dosis de mantenimiento recomendada (72 mg). Los eventos reportados fueron náuseas severas y vómito severo, pero ningún caso de hipoglucemia severa. Todos los pacientes se recuperaron sin complicaciones.
En caso de sobredosis, debe iniciarse el tratamiento de soporte adecuado de acuerdo a los signos y síntomas clínicos del paciente.
PRESENTACIÓN: Empaque con 1, 2 o 3 dispositivos pre-llenados.
Cada dispositivo contiene 3 ml de solución que suministra 30 dosis de 0.6 mg, 15 dosis de 1.2 mg o 10 dosis de 1.8 mg.
Nombre del producto (comercial y genérico): VICTOZA®, Liraglutida.
Nombre del fabricante y país: NOVO NORDISK A/S, Dinamarca.
Titular de la autorización: NOVO NORDISK A/S, Dinamarca.
No todas las presentaciones mencionadas están disponibles en todos los países.
Última revisión local: Agosto 2019 basada en el SmPC Septiembre 2017.
Pueden existir diferencias en cuanto a las indicaciones aprobadas para cada país. Siempre refiérase a la información prescriptiva completa local a disposición en el departamento médico de NOVO NORDISK.
NOVO NORDISK
® Marca registrada
CONDICIONES DE ALMACENAMIENTO: Almacenar en refrigerador a temperatura de 2 a 8 °C. No congelar.
Después de usar por primera vez el dispositivo, guarde a menos de 30 °C o en el refrigerador (2 °C a 8 °C). No congelar.
Conserve la tapa del dispositivo para protegerlo de la luz.
Indicaciones terapéuticas: Indicado para el tratamiento de adultos con 2 diabetes mellitus tipo 2 para lograr el control glicémico:
Como monoterapia, como adyuvante a la dieta y el ejercicio:
• Metformina o una sulfonilurea, en pacientes con control glicémico insuficiente a pesar de la dosis máxima tolerada del monoterapia con metformina o sulfonilurea.
En combinación con:
• Metformina y una sulfonilurea o metformina y una tiazolidinediona en pacientes con un control glicémico insuficiente a pesar del tratamiento dual.
Tratamiento combinado con insulina basal en pacientes que no lograron un control glicémico adecuado con VICTOZA® y metformina.
INSTRUCCIONES DE USO, MANIPULACIÓN Y DESTRUCCIÓN DEL REMANENTE NO UTILIZABLE DEL PRODUCTO: Lea estas instrucciones con atención antes de utilizar su dispositivo VICTOZA®.
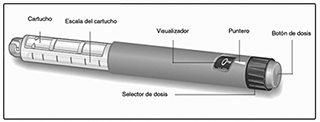
VICTOZA® contiene 18 mg de liraglutida. Puede seleccionar dosis de 0.6 mg, 1.2 mg y 1.8 mg.
VICTOZA® puede administrarse con agujas de un largo de hasta 8 mm y delgadas como 32G. El dispositivo está diseñado para utilizarse con agujas desechables NovoFine® o NovoTwist®.
Dispositivo VICTOZA®:
Aguja (ejemplo)
Prepare el dispositivo VICTOZA®.
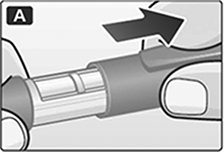
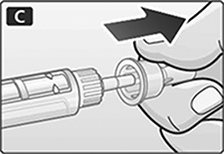
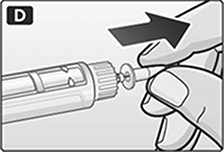
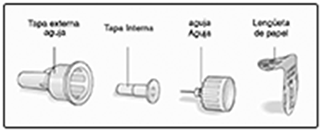
A. Retire la tapa del dispositivo.
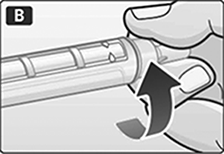
B. Retire la lengüeta de papel de una aguja desechable nueva. Enrosque bien la aguja en posición recta en el dispositivo.
C. Retire la tapa externa de la aguja y consérvela.
D. Retire la tapa interna de la aguja y deséchela.
 Siempre utilice una aguja nueva para cada inyección para evitar contaminar el producto.
Siempre utilice una aguja nueva para cada inyección para evitar contaminar el producto.
 Tenga cuidado de no doblar o dañar la aguja.
Tenga cuidado de no doblar o dañar la aguja.
 Nunca ponga la tapa interna de la aguja cuando la haya retirado de la aguja. Esto reduce el riesgo de lastimarse con la aguja.
Nunca ponga la tapa interna de la aguja cuando la haya retirado de la aguja. Esto reduce el riesgo de lastimarse con la aguja.
Revise el flujo: Siempre revise el flujo de la siguiente manera antes de inyectarse con un dispositivo nuevo.

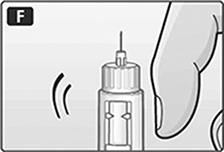
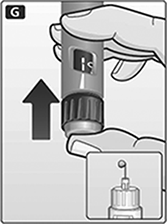
E. Gire el selector de dosis hasta que el símbolo de revisión de flujo se alinee con el puntero.
F. Mantenga el dispositivo con la aguja hacia arriba. De un ligero golpe al cartucho con el dedo varias veces para hacer que las burbujas de aire se acumulen hasta arriba del cartucho.
G. Mantenga la aguja apuntando hacia arriba y presione el botón de dosis hasta que 0 mg se alinee con el puntero.
Repita los pasos E a G hasta que aparezca una gota de liraglutida en la punta de la aguja. Si no aparece después de seis veces, cambie la aguja y repita los pasos E a G hasta otras seis veces. Si aún no ve una gota de liraglutida, el dispositivo está dañado y debe utilizar uno nuevo.
 Si se le cayó el dispositivo contra una superficie dura o sospecha que tiene algún defecto, siempre coloque una aguja desechable nueva y revise el flujo antes de inyectarse.
Si se le cayó el dispositivo contra una superficie dura o sospecha que tiene algún defecto, siempre coloque una aguja desechable nueva y revise el flujo antes de inyectarse.
Seleccione la dosis: Siempre revise que el puntero se alinee con 0 mg.

H. Gire el selector de dosis hasta que la dosis requerida se alinee con el puntero (0.6 mg, 1.2 mg o 1.8 mg).
Si usted seleccionó una dosis equivocada por error, simplemente cámbiela girando el selector de dosis hacia atrás o adelante hasta que la dosis correcta se alinee con el puntero. Tenga cuidado de no presionar el botón de dosis cuando el selector de dosis se gira hacia atrás, ya que podría salir algo de liraglutida.
Si el selector de dosis se detiene antes de que la dosis requerida se alinee con el puntero, no hay suficiente cantidad de liraglutida para una dosis completa. Cuando esto pase, usted puede:
• Divida la dosis en dos inyecciones: Girar el selector de dosis en cualquier dirección hasta que 0.6 mg o 1.2 mg se alinee con el puntero. Inyecte la dosis. Prepare un nuevo dispositivo para inyección e inyecte la cantidad restante de mg para completar la dosis.
• Inyecte la dosis completa con un dispositivo nuevo: Si el selector de dosis se detiene antes de que 0.6 mg se alinee con el puntero, prepare un nuevo dispositivo e inyecte la dosis completa con el dispositivo nuevo.
 El selector de dosis hace un clic cuando usted lo gira. No debe utilizar estos sonidos para seleccionar la cantidad de liraglutida para inyectar.
El selector de dosis hace un clic cuando usted lo gira. No debe utilizar estos sonidos para seleccionar la cantidad de liraglutida para inyectar.
 No utilice la escala del cartucho para medir qué cantidad de liraglutida inyectar, no es suficientemente exacta.
No utilice la escala del cartucho para medir qué cantidad de liraglutida inyectar, no es suficientemente exacta.
 No intente seleccionar otra dosis que no sea 0.6 mg, 1.2 mg o 1.8 mg. Los números del visualizador deben alinearse exactamente con el puntero para garantizar que se obtenga una dosis correcta.
No intente seleccionar otra dosis que no sea 0.6 mg, 1.2 mg o 1.8 mg. Los números del visualizador deben alinearse exactamente con el puntero para garantizar que se obtenga una dosis correcta.
Utilice la inyección: Inserte la aguja en la piel con la técnica de inyección que le indicó su médico o enfermera. Posteriormente, siga las instrucciones de a continuación:
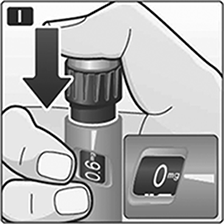
I. Presione el botón de dosis para inyectar hasta que 0 mg se alinee con el puntero. Tenga cuidado de no tocar el visualizador con los otros dedos ni de presionar el selector de dosis a los lados cuando inyecte. Podría bloquear la inyección. Mantenga el botón de dosis presionado hacia abajo y deje la aguja debajo de la piel por al menos seis segundos para asegurarse de que obtuvo la dosis completa.
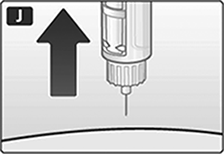
J. Saque la aguja. Después de esto, podría ver una gota de liraglutida en la punta de la aguja.
Esto es normal y no tiene efecto sobre la dosis que acaba de aplicar.
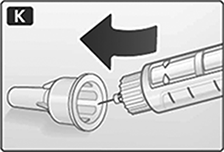
K. Guíe la tapa de la aguja a la tapa exterior de la aguja sin tocarla.
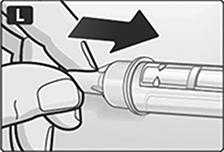
L. Cuando la aguja esté cubierta, presione con cuidado la tapa exterior de la aguja por completo. Luego desenrosque la aguja. Con cuidado deseche la aguja y vuelva a tapar el dispositivo. Cuando el dispositivo esté vacío, deséchelo sin la aguja puesta. Deseche el dispositivo y la aguja de acuerdo con los requisitos locales.
 Siempre retire la aguja después de cada inyección y guarde el dispositivo VICTOZA® sin la aguja.
Siempre retire la aguja después de cada inyección y guarde el dispositivo VICTOZA® sin la aguja.
 Esto evita la contaminación o infección o fugas de liraglutida. También garantiza que la dosificación sea exacta.
Esto evita la contaminación o infección o fugas de liraglutida. También garantiza que la dosificación sea exacta.
 Las personas que manejan las agujas deben tener cuidado de no lastimarse con ellas.
Las personas que manejan las agujas deben tener cuidado de no lastimarse con ellas.
Cuidados para el dispositivo VICTOZA®: El dispositivo VICTOZA® es exacto y seguro de utilizar. Sin embargo, debe tener en cuenta:
• No intentar repararlo o desarmarlo.
• Mantenerla lejos del polvo, suciedad y todo tipo de líquidos.
• Limpiar el dispositivo con un paño humedecido con detergente suave. No trate de lavarlo, mojarlo o lubricarlo, pues podría dañarlo.
 Información importante:
Información importante:
• No comparta su dispositivo VICTOZA® con nadie.
• Mantenga el dispositivo VICTOZA® fuera del alcance de los demás, en especial de los niños.
VICTOZA® no debe utilizarse si no tiene una apariencia clara e incolora.
VICTOZA® no debe utilizarse si se ha congelado.
Debe aconsejarse al paciente que deseche la aguja de inyección de acuerdo con los requisitos locales después de cada inyección y que guarde el dispositivo de VICTOZA® sin la aguja puesta. Esto evita la contaminación, infección y fugas. También garantiza que la dosificación sea exacta.