
TRAYENTA DUO PANAMA
Tabletas
Caja, Blíster, 30 y 60 Tabletas, 2.5/500 mg/mg
Caja, Blíster, 30 y 60 Tabletas, 2.5/850 mg/mg
Caja, Blíster, 30 y 60 Tabletas, 2.5/1000 mg/mg
Caja, Blíster, 7 Tabletas, MM
Caja, Frasco(s), 30, 60 y 80 Tabletas, 2.5/500 mg/mg
Caja, Frasco(s), 30, 60 y 80 Tabletas, 2.5/850 mg/mg
Caja, Frasco(s), 30, 60 y 80 Tabletas, 2.5/1000 mg/mg
Caja, Frasco(s), 14 Tabletas, MM
FORMA FARMACÉUTICA Y FORMULACIÓN:
Tabletas recubiertas: Cada TABLETA RECUBIERTA contiene:
Linagliptina: 2.5 mg
Clorhidrato de metformina: 500 mg, 850 mg, 1000 mg
Excipiente cbp: 1 tableta recubierta
Código ATC: A10BD11.
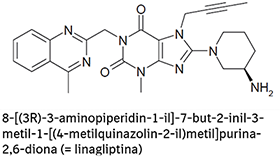
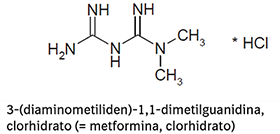
FORMAS FARMACÉUTICAS Y CONCENTRACIONES:
TRAYENTA® DUO es una combinación de linagliptina y clorhidrato de metformina. Las tabletas de TRAYENTA® DUO están disponibles en las siguientes formas de dosificación y concentraciones:
• Las tabletas de 2.5 de linagliptina/500 mg de clorhidrato de metformina son tabletas ovaladas de color amarillo claro, biconvexas, grabadas con “D2/500” en una cara y con el logo de Boehringer Ingelheim en la otra cara.
• Las tabletas de 2.5 de linagliptina/850 mg de clorhidrato de metformina son tabletas ovaladas de color naranja claro, biconvexas, grabadas con “D2/850” en una cara y con el logo de Boehringer Ingelheim en la otra cara.
• Las tabletas de 2.5 de linagliptina/1000 mg de clorhidrato de metformina son tabletas ovaladas de color rosa claro, biconvexas, grabadas con “D2/1000” en una cara y con el logo de Boehringer Ingelheim en la otra cara.
TOXICOLOGÍA PRECLÍNICA:
Carcinogénesis, mutagénesis y alteración de la fertilidad: TRAYENTA® DUO: No se han realizado estudios en animales con los productos combinados en TRAYENTA® DUO para evaluar la carcinogénesis, mutagénesis o alteración de la fertilidad. Se realizaron estudios de toxicidad general con TRAYENTA® DUO en ratas de hasta 13 semanas.
Los siguientes datos se basan en los hallazgos de los estudios con linagliptina y metformina individualmente.
Linagliptina: La linagliptina no incrementó la incidencia de tumores en ratas machos y hembras en un estudio de 2 años, a dosis de 6, 18 y 60 mg/kg. La dosis más alta de 60 mg/kg es aproximadamente 418 veces la dosis clínica de 5 mg/día, con base en la exposición expresada como el ABC. La linagliptina no incrementó la incidencia de tumores en ratones en un estudio de 2 años a dosis de hasta 80 mg/kg (machos) y 25 mg/kg (hembras), o aproximadamente 35 y 270 veces la dosis clínica, con base en la exposición expresada como el ABC. Dosis más altas de linagliptina en ratones hembra (80 mg/kg) incrementaron la incidencia de linfoma a dosis aproximadamente 215 veces la dosis clínica, con base en la exposición expresada como el ABC.
La linagliptina no resultó ser mutagénica ni clastogénica con o sin activación metabólica en la prueba de Ames de mutagenicidad bacteriana, en una prueba de aberraciones cromosómicas en linfocitos humanos, y en un estudio de micronúcleos in vivo.
En estudios de fertilidad realizados en ratas, la linagliptina no tuvo efectos adversos en el desarrollo embrionario temprano, en el apareamiento, la fertilidad o la gestación de crías vivas hasta la dosis más alta de 240 mg/kg (aproximadamente 943 veces la dosis clínica con base en la exposición expresada como el ABC).
Clorhidato de metformina: Se han hecho estudios a largo plazo sobre la carcinogenicidad en ratas (duración de la dosificación de 104 semanas) y en ratones (duración de la dosificación de 91 semanas) con dosis de hasta 900 mg/kg/día y 1500 mg/kg/día, respectivamente. Estas dosis son aproximadamente cuatro veces mayores que la dosis diaria máxima de 2,000 mg/kg/día recomendada para humanos, con base en comparaciones de las áreas de superficie corporal.
No se encontró ningún indicio de carcinogenicidad con metformina en los ratones machos o hembras. Similarmente, no se observó potencial tumorigénico con metformina en las ratas machos. Sin embargo, se observó un aumento en la incidencia de pólipos benignos del estroma uterino en las ratas hembras tratadas con 900 mg/kg/día.
No hubo ningún indicio de potencial mutagénico de la metformina en las siguientes pruebas in vitro: Prueba de Ames (Salmonella typhimurium), prueba de mutación genética (en células de linfoma de ratón) o prueba de aberraciones cromosómicas (en linfocitos humanos). Los resultados de la prueba de micronúcleos in vivo en ratones también fueron negativos.
La fertilidad de las ratas machos o hembras no fue afectada por la metformina administrada a dosis tan altas como 600 mg/kg/día, que son aproximadamente tres veces mayor que la dosis diaria máxima recomendada en humanos, con base en la comparación de las áreas de superficie corporal.
INDICACIONES Y USO: TRAYENTA® DUO está indicado como un complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2 [ver Posología y administración (2.1) y Estudios Clínicos (14.1)].
Limitaciones de uso: No se debe usar TRAYENTA® DUO en pacientes con diabetes tipo 1 o para el tratamiento de la cetoacidosis diabética, ya que no sería eficaz en estos casos.
TRAYENTA® DUO no se ha estudiado en pacientes con antecedentes de pancreatitis. Se desconoce si los pacientes con antecedentes de pancreatitis tienen un mayor riesgo depadecer pancreatitis al usar TRAYENTA® DUO [ver Advertencias y precauciones (5.2)].
CONTRAINDICACIONES:
TRAYENTA® DUO está contraindicado en pacientes con:
• Insuficiencia renal grave (por ejemplo, tasa de filtración glomerular estimada (TFGe) por debajo de 30 mL/min/1.73 m2 [ver Advertencias y precauciones (5.1)]
• Acidosis metabólica aguda o crónica, incluida la cetoacidosis diabética. [ver Advertencias y precauciones (5.1)]
• Antecedentes de hipersensibilidad a la linagliptina, a la metformina o a cualquier excipiente en TRAYENTA® DUO; se han producido reacciones como anafilaxia, angioedema, condiciones cutáneas exfoliativas, urticaria o hiperreactividad bronquial con linagliptina [ver Advertencias y precauciones (5.5) y Reacciones adversas (6.1)]..
ADVERTENCIAS Y PRECAUCIONES:
Acidosis láctica:
Metformina: Durante la etapa posterior a la comercialización se han informado casos de acidosis láctica relacionada con la metformina, incluso casos mortales. Estos casos tuvieron un inicio sutil y estuvieron acompañados de síntomas no específicos tales como malestar general, mialgias, dolor abdominal, disnea o aumento de la somnolencia. Sin embargo, en los casos graves de acidosis se produjo hipotermia, hipotensión y bradiarritmias resistentes. La acidosis láctica relacionada con la metformina se caracterizó por la elevación de las concentraciones de lactato en sangre (>5 mmol/L), acidosis con desequilibrio aniónico (sin indicios de cetonuria o cetonemia), un mayor cociente lactato/piruvato y concentraciones plasmáticas de metformina por lo general >5 mcg/mL. La metformina disminuye la absorción de lactato en el hígado a la vez que aumenta los niveles de lactato en la sangre, lo que puede aumentar el riesgo de acidosis láctica, particularmente en los pacientes en riesgo.
Si se sospecha acidosis láctica relacionada con la metformina, se deben iniciar prontamente las medidas generales de apoyo en el ámbito hospitalario e interrumpir de inmediato el tratamiento con TRAYENTA® DUO. En los pacientes tratados con TRAYENTA® DUO que tengan un diagnóstico de acidosis láctica o una fuerte sospecha de la presencia de esta afección, se recomienda hacer hemodiálisis de inmediato para corregir la acidosis y eliminar la cantidad acumulada de metformina (el clorhidrato de metformina puede dializarse, con una depuración de hasta 170 mL/min en buenas condiciones hemodinámicas). La hemodiálisis con frecuencia ha revertido los síntomas y ha ayudado a la recuperación de los pacientes.
Se debe informar a los pacientes y a sus familiares sobre los síntomas de la acidosis láctica e indicarles que suspendan la administración de TRAYENTA® DUO y notifiquen de inmediato a su proveedor de atención médica si se presentan estos síntomas.
A continuación, se detallan las recomendaciones para reducir el riesgo de acidosis láctica relacionada con metformina, para cada uno de sus factores de riesgo confirmados y posibles, así como para su tratamiento:
Insuficiencia renal: Los casos de acidosis láctica relacionada con metformina posteriores a la comercialización se presentaron principalmente en pacientes con insuficiencia renal importante. El riesgo de acumulación de metformina y de acidosis láctica relacionada con la metformina aumenta con la gravedad de la insuficiencia renal porque la metformina se excreta principalmente por la vía renal. Las recomendaciones clínicas basadas en la función renal del paciente comprenden [ver Posología y administración (2.2) y Farmacología clínica (12.3)].
• Antes de iniciar la administración de TRAYENTA® DUO, obtener la tasa de filtración glomerular estimada (TFGe).
• TRAYENTA® DUO está contraindicado en pacientes con una TFGe de menos de 30 m/min/1.73 m2 [ver Contraindicaciones (4)].
• No se recomienda iniciar la administración de TRAYENTA® DUO en pacientes con una TFGe entre 30 y 45 mL/min/1.73 m2.
• Obtener la TFGe al menos una vez al año en todos los pacientes tratados con TRAYENTA® DUO. En los pacientes que tengan un mayor riesgo de desarrollar insuficiencia renal (p. ej., los pacientes de edad avanzada), la función renal deberá evaluarse con más frecuencia.
• En los pacientes tratados con TRAYENTA® DUO cuya TFGe después disminuye pordebajo de 45 mL/min/1.73 m2, evaluar el beneficio y el riesgo que implica continuar con el tratamiento.
REACCIONES ADVERSAS: Las siguientes reacciones adversas graves se describen a continuación o en otra parte de la
información para prescribir:
• Acidosis láctica [ver Advertencias y precauciones (5.1)]
• Pancreatitis [ver Advertencias y precauciones (5.2)]
• Insuficiencia cardiaca [ver Advertencias y precauciones (5.3)]
• Uso con medicamentos que causan hipoglucemia [ver Advertencias y precauciones (5.4)]
• Reacciones de hipersensibilidad [ver Advertencias y precauciones (5.5)]
• Niveles de vitamina B12 [ver Advertencias y precauciones (5.6)]
• Artralgia grave y discapacitante [ver Advertencias y precauciones (5.7)]
• Penfigoide ampolloso [ver Advertencias y precauciones (5.8)]
Experiencia en estudios clínicos: Debido a que los estudios clínicos se realizan en condiciones sumamente variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no pueden compararse de manera directa con las tasas obtenidas en los estudios clínicos de otro fármaco, y es posible que no reflejen las tasas observadas en la práctica.
Linagliptina/Metformina: La seguridad de la linagliptina (diaria dosis de 5 mg) administrada concomitantemente con metformina (dosis diaria promedio de aproximadamente 1800 mg) se ha evaluado en 2816 pacientes con diabetes mellitus tipo 2 tratados durante ≥ 12 semanas en estudios clínicos.
Se realizaron tres estudios de linagliptina + metformina controlados con un placebo: 2 estudios tuvieron una duración de 24 semanas, y 1 estudio tuvo una duración de 12 semanas.
En los 3 estudios clínicos controlados con placebo, las reacciones adversas que ocurrieron en ≥ 5% de los pacientes que recibieron linagliptina + metformina (n = 875) y que fueron más frecuentes que en los pacientes que recibieron placebo + metformina (n = 539) incluyeron nasofaringitis (5.7% vs 4.3%).
En un estudio de 24 semanas de diseño factorial, los eventos adversos reportados en ≥ 5% de los pacientes tratados con linagliptina + metformina y que fueron más frecuentes que en los pacientes que recibieron placebo se muestran en la Tabla 1.
|
Tabla 1. Reacciones adversas notificadas en ≥ 5% de los pacientes tratados con linagliptina + metformina, y más frecuentes que con el placebo en un estudio de 24 semanas de diseño factorial |
||||
|
Placebo n = 72 |
Monoterapia con linagliptina n = 142 |
Monoterapia con metformina n = 291 |
Combinación de linagliptina con metformina n = 286 |
|
|
n (%) |
n (%) |
n (%) |
n (%) |
|
|
Nasofaringitis |
1 (1.4) |
8 (5.6) |
8 (2.7) |
18 (6.3) |
|
Diarrea |
2 (2.8) |
5 (3.5) |
11 (3.8) |
18 (6.3) |
Otras reacciones adversas informadas en los estudios clínicos del tratamiento con linagliptina + metformina fueron hipersensibilidad (por ejemplo, urticaria, angioedema, o hiperreactividad bronquial), tos, disminución del apetito, náuseas, vómitos, prurito, y pancreatitis.
Linagliptina: Las reacciones adversas notificadas en ≥ 2% de los pacientes tratados con linagliptina 5 mg y más frecuentemente que en los pacientes tratados con placebo fueron: nasofaringitis (7.0% vs 6.1%), diarrea (3.3% vs 3.0%) y tos (2.1% vs 1.4 %).
Las tasas de otras reacciones adversas con linagliptina 5 mg frente al placebo cuando la linagliptina se administró en combinación con antidiabéticos específicos fueron: infección de las vías urinarias (3.1% frente a 0%) e hipertrigliceridemia (2.4% frente a 0%) cuando la linagliptina se administró como terapia complementaria a una sulfonilurea; hiperlipidemia (2.7% frente a 0.8%) y aumento de peso (2.3% frente a 0.8%) cuando la linagliptina se administró como terapia complementaria a la pioglitazona; y estreñimiento (2.1% frente a 1%) cuando la linagliptina se administró como terapia complementaria a la insulina basal.
Otras reacciones adversas informadas en los estudios clínicos del tratamiento con linagliptina como monoterapia fueron: hipersensibilidad (p. ej., urticaria, angioedema, exfoliación cutánea localizada o hiperreactividad bronquial) y mialgia. En el programa de estudios clínicos se reportó pancreatitis en 15.2 casos por 10,000 años paciente de exposición durante el tratamiento con linagliptina, en comparación con 3.7 casos por 10,000 años paciente de exposición durante el tratamiento con el comparador (placebo y comparador activo sulfonilurea). Después de la última dosis administrada de linagliptina se registraron tres casos adicionales de pancreatitis.
Metformina: Las reacciones adversas más comunes debidas al inicio del tratamiento con metformina son diarrea, náuseas/vómito, flatulencia, astenia, indigestión, malestar abdominal y cefalea.
Hipoglucemia:
Linagliptina/metformina: En un estudio de 24 semanas de diseño factorial, la hipoglucemia se informó en 4 (1.4%) de 286 sujetos tratados con linagliptina + metformina, 6 (2.1%) de 291 sujetos tratados con metformina, y 1 (1.4%) de 72 sujetos tratados con el placebo. La incidencia de hipoglucemia con glucosa plasmática <54 mg/dL fue del 8.1% en el grupo de linagliptina (N = 792), en comparación con el 5.3% en el grupo del placebo (N = 263) cuando se administró en combinación con metformina y sulfonilurea en un estudio de 24 semanas.
Linagliptina: La incidencia de hipoglucemia grave (que requiere asistencia) fue del 1.7% en el grupo de la linagliptina (N = 631) en comparación con el 1.1% en el grupo del placebo (N = 630) cuando se administró en combinación con insulina basal en un estudio de 52 semanas.
Análisis clínicos:
Linagliptina: Aumento del ácido úrico: los cambios en los valores de laboratorio que se produjeron con mayor frecuencia en el grupo de linagliptina y ≥ 1% más que en el grupo del placebo fueron aumentos del ácido úrico (1.3% en el grupo del placebo, 2.7% en el grupo de la linagliptina).
Aumento de la lipasa: En un estudio clínico de linagliptina controlado con placebo en pacientes con diabetes mellitus tipo 2 con micro o macroalbuminuria, se observó un aumento promedio del 30% en las concentraciones de lipasa desde el inicio hasta las 24 semanas en el grupo de linagliptina, mientras que en el grupo del placebo hubo una disminución promedio del 2%. Se observaron niveles de lipasa superiores a 3 veces el límite superior del intervalo normal en 8.2% de los pacientes del grupo de linagliptina, en comparación con 1.7% de los pacidentes en el grupo del placebo.
Aumento de la amilasa: En un estudio de seguridad cardiovascular que comparó linagliptina frente a glimepirida en pacientes con diabetes mellitus tipo 2, se observaron niveles de amilasa superiores a 3 veces el límite superior del rango normal en 1.0% de los pacientes tratados con linagliptina, en comparación con 0.5% de los pacientes tratados con glimepirida.
Se desconoce la importancia clínica de las elevaciones de la lipasa y la amilasa con linagliptina en ausencia de posibles signos y síntomas de pancreatitis [ver Advertencias y precauciones (5.2)].
Metformina:
Disminución de la absorción de vitamina B12: El tratamiento a largo plazo con metformina se ha asociado a una disminución de la absorción de vitamina B12 que puede causar una deficiencia clínicamente significativa de vitamina B12 (p. ej., anemia megaloblástica) [ver Advertencias y precauciones (5.6)].
• Experiencia posterior a la comercialización:
Las siguientes reacciones adversas se han identificado durante el uso después de la aprobación. Como estas reacciones se informan de forma voluntaria por parte de una población cuyo tamaño se desconoce, por lo general no resulta posible estimar de manera fiable su frecuencia ni establecer una relación causal con la exposición al medicamento.
Linagliptina:
• Pancreatitis aguda, incluyendo pancreatitis mortal [ver Indicaciones y uso (1)]
• Reacciones de hipersensibilidad que incluyen anafilaxia, angioedema y exfoliación cutánea
• Artralgia grave y discapacitante
• Erupción cutánea
• Úlceras bucales, estomatitis
• Rabdomiólisis
Metformina:
• Lesión hepática colestásica, hepatocelular y hepatocelular mixta
INTERACCIONES FARMACOLÓGICAS: El uso concomitante de TRAYENTA® DUO con determinados fármacos puede aumentar el riesgo de acidosis láctica relacionada con metformina; los fármacos que alteran la función renal provocan un cambio hemodinámico importante, interfieren con el equilibrio ácido-básico o aumentan la acumulación de metformina [ver Interacciones farmacológicas (7.1)]. Por lo tanto, se debe considerar el monitoreo de los pacientes con mayor frecuencia.
Edad de 65 años o más: El riesgo de acidosis láctica relacionada con metformina aumenta con la edad del paciente porque los pacientes de edad avanzada tienen una mayor probabilidad de presentar insuficiencia hepática, renal o cardiaca que los pacientes más jóvenes. Evaluar la función renal con mayor frecuencia en los pacientes geriátricos [ver Uso en poblaciones específicas (8.5)].
Estudios radiológicos con contraste: La administración de agentes de contraste yodados por vía intravascular a pacientes tratados con metformina ha resultado en la disminución aguda de la función renal y la aparición de acidosis láctica. Suspender la administración de TRAYENTA® DUO en el momento o antes de un procedimiento de diagnóstico por imágenes con contraste yodado en los pacientes con una TFGe entre 30 y 60 mL/min/1.73 m2; en los pacientes con antecedentes de insuficiencia hepática, alcoholismo o insuficiencia cardiaca; o en los pacientes que recibirán contraste yodado por vía intraarterial. Se debe volver a evaluar la TFGe 48 horas después del procedimiento de diagnóstico por imágenes y reanudar la administración de TRAYENTA® DUO si la función renal es estable.
Cirugía y otros procedimientos: Las restricciones en el consumo de alimentos y líquidos durante los procedimientos quirúrgicos o de otro tipo pueden aumentar el riesgo de hipovolemia, hipotensión e insuficiencia renal. TRAYENTA® DUO debe suspenderse temporalmente mientras los pacientes tengan restringido el consumo de alimentos y líquidos.
Estados hipóxicos: Varios de los casos de acidosis láctica relacionada con metformina posteriores a la comercialización ocurrieron en un cuadro de insuficiencia cardiaca congestiva aguda (especialmente cuando estaba acompañada de hipoperfusión e hipoxemia).
El colapso cardiovascular (choque), el infarto agudo de miocardio, septicemia y otras afecciones relacionadas con hipoxemia se han asociado con la acidosis láctica y también pueden causar azoemia prerrenal. Si ocurren dichos eventos, interrumpir la administración de TRAYENTA® DUO.
Consumo excesivo de alcohol: El alcohol potencia el efecto de la metformina en el metabolismo del lactato, lo que puede aumentar el riesgo de acidosis láctica relacionada con metformina. Se debe advertir a los pacientes que no consuman alcohol en exceso mientras reciben tratamiento con TRAYENTA® DUO.
Insuficiencia hepática: Pacientes con insuficiencia hepática han presentado casos de acidosis láctica relacionada con metformina. Esto puede deberse a la alteración de la depuración del lactato que deriva en niveles más altos de lactato en la sangre. Por lo tanto, se debe evitar el uso de TRAYENTA® DUO en pacientes con pruebas clínicas o analíticas de hepatopatía.
Pancreatitis: Se ha informado pancreatitis aguda, incluida pancreatitis mortal, en pacientes tratados con linagliptina. En el estudio CARMELINA [ver Estudios clínicos (14.2)], se notificó pancreatitis aguda en 9 (0.3%) pacientes tratados con linagliptina y en 5 (0.1%) pacientes tratados con placebo. Dos pacientes tratados con linagliptina en el estudio CARMELINA tuvieron pancreatitis aguda con un desenlace mortal. Ha habido informes posteriores a la comercialización de pancreatitis aguda, incluida pancreatitis mortal, en pacientes tratados con linagliptina.
Se deben tener en cuenta los posibles signos y síntomas de pancreatitis. Si se sospecha pancreatitis, suspender inmediatamente la administración de TRAYENTA® DUO e iniciar el tratamiento adecuado. Se desconoce si los pacientes con antecedentes de pancreatitis tienen un mayor riesgo de desarrollar pancreatitis mientras usan TRAYENTA® DUO.
Insuficiencia cardiaca:
En estudios de resultados cardiovasculares para otros dos miembros de la clase de inhibidores de la DPP-4 se ha observado una asociación entre el tratamiento con inhibidores de la DPP-4 y la insuficiencia cardiaca. Estos estudios evaluaron pacientes con diabetes mellitus tipo 2 y enfermedad cardiovascular aterosclerótica.
Se deben considerar los riesgos y beneficios de TRAYENTA® DUO antes de iniciar el tratamiento en pacientes con riesgo de insuficiencia cardiaca, como los que tienen antecedentes de insuficiencia cardiaca y antecedentes de insuficiencia renal, y durante la terapia se debe observar a estos pacientes en busca de signos y síntomas de insuficiencia cardiaca. Se debe informar a los pacientes sobre los síntomas característicos de la insuficiencia cardiaca y decirles que inmediatamente reporten dichos síntomas. Si se presenta insuficiencia cardiaca, evaluar y tratar de acuerdo con los estándares actuales de atención y considerar la interrupción de TRAYENTA® DUO.
Uso con medicamentos que causan hipoglucemia: Se sabe que los secretagogos de insulina y la insulina causan hipoglucemia. En un estudio clínico, el uso de linagliptina en combinación con un secretagogo de insulina (p. ej., sulfonilurea) se asoció con una mayor tasa de hipoglucemia en comparación con el placebo [ver Reacciones adversas (6.1)]. La metformina puede aumentar el riesgo de hipoglucemia cuando se combina con insulina y/o un secretagogo de insulina. Por consiguiente, es posible que sea necesario administrar una dosis más baja del secretagogo de insulina o de insulina para reducir el riesgo de hipoglucemia cuando se administran en combinación con TRAYENTA® DUO [ver Interacciones medicamentosas (7.3)].
Reacciones de hipersensibilidad:
Posterior a la comercialización se han informado reacciones graves de hipersensibilidad en pacientes tratados con linagliptina (uno de los componentes de TRAYENTA® DUO). Entre estas reacciones se encuentran anafilaxia, angioedema y exfoliación cutánea. La aparición de estas reacciones ocurrió predominantemente dentro de los tres primeros meses después de iniciar el tratamiento con linagliptina, y algunos informes se presentaron después de la primera dosis. Si se sospecha una reacción de hipersensibilidad grave, suspender la administración de TRAYENTA® DUO, evaluar otras posibles causas del acontecimiento y establecer un tratamiento antidiabético alternativo.
También se han informado casos de angioedema con otros inhibidores de la dipeptidil peptidasa-4 (DPP-4). Debe tenerse precaución en pacientes con antecedentes de angioedema con otro inhibidor de DPP-4, ya que se desconoce si estos pacientes tendrán predisposición a sufrir angioedema con TRAYENTA® DUO.
Niveles de vitamina B12: En estudios clínicos controlados de 29 semanas de duración con metformina, en alrededor del 7% de los pacientes que recibieron tratamiento con metformina se observó una disminución a niveles inferiores a los normales de niveles séricos de vitamina B12 que antes eran normales, sin manifestaciones clínicas. No obstante, esa disminución, que posiblemente esté causada por la interferencia del complejo del factor intrínseco B12 en la absorción de B12, puede estar asociada con anemia o a manifestaciones neurológicas. Este riesgo puede ser más relevante para los pacientes que reciben tratamiento a largo plazo con metformina, y posterior a la comercialización se han comunicado reacciones adversas de índole hematológico y neurológico. La disminución en los niveles de vitamina B12 parece ser rápidamente reversible con la interrupción de la metformina o con la administración de complementos de vitamina B12. Se recomienda la medición de los parámetros hematológicos anualmente y la medición de rutina de vitamina B12 en suero a intervalos de 2 a 3 años en los pacientes tratados con TRAYENTA® DUO, y cualquier anormalidad aparente debe investigarse y manejarse adecuadamente. Ciertos individuos (aquellos con ingesta o absorción inadecuada de vitamina B12 o calcio) parecen estar predispuestos a desarrollar niveles subnormales de vitamina B12.
Artralgia grave y discapacitante: Posterior a la comercialización se han informado casos de artralgia severa e incapacitante en pacientes que toman inhibidores de la DPP-4. El tiempo hasta la aparición de los síntomas luego del inicio de la terapia con el medicamento varía de un día hasta años. Los pacientes experimentaron el alivio de los síntomas tras la interrupción de la medicación. Un subconjunto de pacientes experimentó una recurrencia de los síntomas al reiniciar el mismo medicamento o un inhibidor de la DPP-4 diferente. Se deben considerar a los inhibidores de la DPP-4 como una posible causa del dolor articular intenso y se debe interrumpir el medicamento, en caso necesario.
Penfigoide ampolloso: El penfigoide ampolloso se informó en 7 (0.2%) pacientes tratados con linagliptina en comparación con ninguno en los pacientes tratados con placebo en el estudio CARMELINA [ver Estudios clínicos (14.2)], y 3 de estos pacientes fueron hospitalizados debido a penfigoide ampolloso. Posterior a la comercialización, los casos de penfigoide ampolloso requirieron hospitalización se han reportado con el uso del inhibidor de la DPP-4. En los casos informados, los pacientes generalmente se recuperaron con tratamiento inmunosupresor tópico o sistémico y la suspensión del inhibidor de la DPP-4. Se debe decir a los pacientes que informen sobre el desarrollo de ampollas o erosiones mientras reciben TRAYENTA® DUO. Si se sospecha penfigoide ampolloso, se debe suspender la administración de TRAYENTA® DUO y se debe considerar la derivación a un dermatólogo para el diagnóstico y tratamiento adecuado.
INTERACCIONES MEDICAMENTOSAS:
No se han realizado estudios farmacocinéticos de interacción medicamentosa con TRAYENTA® DUO; sin embargo, este tipo de estudios se han realizado con los componentes individuales de TRAYENTA® DUO (linagliptina y clorhidrato de metformina).
Linagliptina:
Evaluación de las interacciones medicamentosas in vitro: La linagliptina es un inhibidor débil a moderado de CYP3A4, una isoenzima CYP, pero no inhibe otras isoenzimas CYP y no es un inductor de las isoenzimas CYP, entre ellas CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 y 4A11.
La linagliptina es un sustrato de la glicoproteína P (P-gp), y a concentraciones altas inhibe el transporte de digoxina mediado por la P-gp. Con base en estos resultados y en estudios in vivo de interacciones medicamentosas, se considera muy poco probable que la linagliptina produzca interacciones con otros sustratos de la P-gp a concentraciones terapéuticas.
Evaluación de las interacciones medicamentosas in vivo: Los inductores potentes de CYP3A4 o P-gp (p. ej., rifampicina) disminuyen la exposición a la linagliptina a concentraciones por debajo de las terapéuticas y probablemente inefectivas. [ver Interacciones medicamentosas (7)] Estudios in vivo mostraron indicios de una predisposición baja a la aparición de interacciones medicamentosas con sustratos de CYP3A4, CYP2C9, CYP2C8, P-gp y transportadores de cationes orgánicos (OCT).
|
Tabla 2. Efecto de los fármacos administrados simultáneamente sobre la exposición sistémica de la linagliptina |
||||
|
Fármaco administrado simultáneamente |
Dosis del fármaco administrado simultáneamente* |
Dosis de linagliptina* |
Cociente de la media geométrica (cociente con/sin el fármaco administrado simultáneamente) Sin efecto = 1.0 |
|
|
ABC† |
Cmáx |
|||
|
Metformina |
850 mg tres veces al día |
10 mg una vez al día |
1.20 |
1.03 |
|
Gliburida** |
1.75 mg# |
5 mg una vez al día |
1.02 |
1.01 |
|
Pioglitazona |
45 mg una vez al día |
10 mg una vez al día |
1.13 |
1.07 |
|
Ritonavir |
200 mg dos veces al día |
5 mg# |
2.01 |
2.96 |
|
Rifampicina*** |
600 mg una vez al día |
5 mg una vez al día |
0.60 |
0.56 |
|
*Dosis múltiples (estado estacionario) a menos que se indique otra cosa ** La administración conjunta de TRAYENTA® DUO con un secretagogo de insulina (p.ej., Sulfonilurea) o insulina puede requerir dosis más bajas del secretagogo de insulina o de insulina para reducir el riesgo de hipoglucemia [ver Advertencias y precauciones (5.4) e Interacciones farmacológicas (7.3)] *** Para sobre las recomendaciones clínicas [ver Interacciones farmacológicas (7.2)]. # Dosís única †ABC = ABC(0 a 24 horas) para los tratamientos con dosis única y ABC = ABC(TAU) para los tratamientos con dosis múltiples |
||||
|
Tabla 3. Efecto de la linagliptina en la exposición sistémica de los fármacos administrados simultáneamente |
|||||
|
Fármaco administrado simultáneamente |
Dosis del fármaco administrado simultáneamente* |
Dosis de linagliptina* |
Cociente de las medias geométricas (cociente con/sin el fármaco administrado simultáneamente) Sin efecto = 1.0 |
||
|
ABC† |
Cmáx |
||||
|
Metformina |
850 mg tres veces al día |
10 mg una vez al día |
metformina |
1.01 |
0.89 |
|
Gliburida*** |
1.75 mg# |
5 mg una vez al día |
gliburida |
0.86 |
0.86 |
|
Pioglitazona |
45 mg una vez al día |
10 mg una vez al día |
pioglitazona metabolito M-III metabolito M-IV |
0.94 0.98 1.04 |
0.86 0.96 1.05 |
|
Digoxina |
0.25 mg una vez al día |
5 mg una vez al día |
digoxin |
1.02 |
0.94 |
|
Simvastatina |
40 mg una vez al día |
10 mg una vez al día |
simvastatina simvastatina ácida |
1.34 1.33 |
1.10 1.21 |
|
Warfarina |
10 mg# |
5 mg una vez al día |
R-warfarina S-warfarina IIN TP |
0.99 1.03 0.93** 1.03** |
1.00 1.01 1.04** 1.15** |
|
Etinilestradiol y levonorgestrel |
etinilestradiol 0.03 mg y levonorgestrel 0.150 mg una vez al día |
5 mg una vez al día |
etinilestradiol levonorgestrel |
1.01 1.09 |
1.08 1.13 |
|
*Dosis múltiples (estado estacionario) a menos que se indique otra cosa #Dosis única †ABC = ABC(INF) para los tratamientos con dosis única y ABC = ABC(TAU) para los tratamientos con dosis múltiples **ABC=ABC(0-168) y Cmáx=Emáx para los criterios de valoración farmacodinámicos *** La administración conjunta de TRAYENTA® DUO con un secretagogo de insulina (por ejemplo, Sulfonilurea) o con insulina puede requerir dosis más bajas del secretagogo de insulina o insulina para reducir el riesgo de hipoglucemia [ver Advertencias y precauciones (5.4) e Interacciones farmacológicas (7.3)]. IIN = Índice internacional normalizado TP = Tiempo de protrombina |
|||||
• Clorhidrato de metformina:
|
Tabla 4. Efecto de fármacos coadministrados en la exposición sistémica plasmática de la metformina |
|||||
|
Fármaco coadministrado |
Dosificación del fármaco coadministrado* |
Dosificación de metformina * |
Cociente de las medias geométricas (cociente con/sin el fármaco administrado simultáneamente) Sin efecto = 1.0 |
||
|
ABC† |
Cmáx |
||||
|
Gliburida*** |
5 mg |
850 mg |
metformina |
0.91‡ |
0.93‡ |
|
Furosemida |
40 mg |
850 mg |
metformina |
1.09‡ |
1.22‡ |
|
Nifedipino |
10 mg |
850 mg |
metformina |
1.16 |
1.21 |
|
Propranolol |
40 mg |
850 mg |
metformina |
0.90 |
0.94 |
|
Ibuprofeno |
400 mg |
850 mg |
metformina |
1.05‡ |
1.07‡ |
|
Los fármacos eliminados por secreción tubular renal pueden aumentar la acumulación de metformina [ver Advertencias y precauciones (5.1) e Interacciones medicamentosas (7.1)]. |
|||||
|
Cimetidina |
400 mg |
850 mg |
metformina |
1.40 |
1.61 |
|
Los inhibidores de la anhidrasa carbónica pueden causar acidosis metabólica [ver Advertencias y precauciones (5.1) e Interacciones medicamentosas (7.1)]. |
|||||
|
Topiramato** |
100 mg |
500 mg |
metformina |
1.25 |
1.17 |
|
* Todos los fármacos coadministrados con metformina se administraron como dosis única † ABC = ABC (INF) *** La administración conjunta de TRAYENTA® DUO con un secretagogo de insulina (p. ej., sulfonilurea) o con insulina puede requerir dosis más bajas del secretagogo de insulina o de insulina para reducir el riesgo de hipoglucemia [ver Advertencias y precauciones (5.4) e Interacciones farmacológicas (7.3)]. ‡ Cociente de las medias aritméticas ** En el estado estacionario con topiramato 100 mg cada 12 horas y metformina 500 mg cada 12 horas; ABC = ABC0-12h |
|||||
|
Tabla 5. Efecto de la metformina en la exposición sistémica de fármacos coadministrados |
|||||
|
Fármaco coadministrado |
Dosificación del fármaco coadministrado* |
Dosificación de metformina * |
Cociente de las medias geométricas (cociente con/sin metformina) Sin efecto = 1.0 |
||
|
ABC† |
Cmáx |
||||
|
Gliburida** |
5 mg |
500 mg |
gliburida |
0.78‡ |
0.63‡ |
|
Furosemida |
40 mg |
850 mg |
furosemida |
0.87‡ |
0.69‡ |
|
Nifedipino |
10 mg |
850 mg |
nifedipino |
1.10§ |
1.08 |
|
Propranolol |
40 mg |
850 mg |
propranolol |
1.01§ |
1.02 |
|
Ibuprofeno |
400 mg |
850 mg |
ibuprofeno |
0.97¶ |
1.01¶ |
|
Cimetidina*** |
400 mg |
850 mg |
cimetidina |
0.95§ |
1.01 |
|
* La metformina y todos los fármacos coadministrados se administraron como dosis únicas ** La administración conjunta de TRAYENTA® DUO con un secretagogo de insulina (p. ej., sulfonilurea) o con insulina puede requerir dosis más bajas del secretagogo de insulina o de insulina para reducir el riesgo de hipoglucemia [ver Advertencias y precauciones (5.4) e Interacciones farmacológicas (7.3)]. † ABC = ABC (INF) a menos que se indique lo contrario ‡ Cociente de las medias aritméticas, valor p de la diferencia <0.05 § ABC (0-24 hr) reportada ¶ Cociente de las medias aritméticas |
|||||
INTERACCIONES MEDICAMENTOSAS:
Interacciones medicamentosas con metformina:
Inhibidores de la anhidrasa carbónica: El topiramato u otros inhibidores de la anhidrasa carbónica (por ejemplo, zonisamida, acetazolamida o diclorfenamida), con frecuencia reducen la concentración sérica de bicarbonato e inducen desequilibrios no aniónicos y acidosis metabólica hiperclorémica. El uso concomitante de estos fármacos con TRAYENTA® DUO puede incrementar el riesgo de acidosis láctica. Se debe considerar un monitoreo más frecuente de estos pacientes [ver Advertencias y precauciones (5.1) y Farmacología clínica (12.3)].
Fármacos que reducen la depuración de la metformina: El uso concomitante de fármacos que interfieren en los sistemas de transporte tubular renal comunes que intervienen en la eliminación renal de la metformina (p. ej., inhibidores del transportador catiónico orgánico 2 [OCT2] /familia de multirresistencia y extrusión de compuestos tóxicos [MATE] tales como ranolazina, vandetanib, dolutegravir y cimetidina) podría aumentar la exposición sistémica a la metformina y el riesgo de sufrir acidosis láctica [ver Farmacología clínica (12.3)]. Deben tomarse en consideración los beneficios y riesgos del uso concomitante.
Alcohol: Se sabe que el alcohol potencia el efecto de la metformina en el metabolismo del lactato. Se debe advertir a los pacientes que no consuman alcohol en exceso mientras reciben tratamiento con TRAYENTA® DUO.
Interacciones medicamentosas con linagliptina
Inductores de la glicoproteína P y de enzimas CYP 3A4
La rifampicina disminuyó la exposición a la linagliptina, lo que indica que la eficacia de la
linagliptina puede verse reducida cuando se administra en combinación con un inductor
potente de la P-gp o de las enzimas CYP 3A4. Dado que TRAYENTA® DUO es una combinación
de dosis fijas de linagliptina y metformina, se recomienda enfáticamente el uso de
tratamientos alternativos (que no contengan linagliptina) cuando se requiera el tratamiento
concomitante con un inductor potente de la P-gp o de las enzimas CYP3A4 [ver Farmacología
clínica (12.3)].
Insulina o secretagogos de insulina: La coadministración de TRAYENTA® DUO con un secretagogo de insulina (p. ej., una sulfonilurea) o con insulina puede requerir dosis más bajas del secretagogo de insulina o de insulina para reducir el riesgo de hipoglucemia [ver Advertencias y precauciones (5.4)].
Medicamentos que afectan el control glucémico: Ciertos fármacos tienden a producir hiperglucemia y pueden ocasionar una pérdida del control glucémico. Estos medicamentos incluyen las tiazidas y otros diuréticos, corticosteroides, fenotiazinas, productos tiroideos, estrógenos, anticonceptivos orales, fenitoína, ácido nicotínico, simpaticomiméticos, fármacos que bloquean los canales de calcio e isoniazida. Cuando estos fármacos se administran a un paciente que recibe TRAYENTA® DUO, el paciente debe ser observado de cuidadosamente para mantener el control glucémico adecuado [ver Farmacología Clínica (12.3)]. Cuando estos fármacos son retirados de un paciente que recibe TRAYENTA® DUO, el paciente debe ser observado atentamente para identificar la aparición de hipoglucemia.
FARMACOLOGÍA CLÍNICA:
Mecanismo de acción: TRAYENTA® DUO combina 2 agentes antihiperglucémicos con mecanismos de acción complementarios para mejorar el control glucémico en pacientes con diabetes mellitus tipo 2: linagliptina, un inhibidor de la dipeptidil peptidasa-4 (DPP-4), y metformina, un miembro de la clase de las biguanidas.
Linagliptina: La linagliptina es un inhibidor de la DPP-4, una enzima que degrada las hormonas incretinas péptido similar al glucagón tipo 1 (GLP-1) y el polipéptido insulinotrópico dependiente de glucosa (GIP). Por consiguiente, la linagliptina incrementa la concentración de las hormonas incretinas activas, lo que estimula la liberación de insulina de manera dependiente de glucosa, y disminuye los niveles de glucagón en la circulación. Ambas hormonas incretinas participan en la regulación fisiológica de la homeostasis de la glucosa. El organismo segrega hormonas incretinas a un nivel basal bajo a lo largo del día, y estos niveles aumentan inmediatamente después de la ingestión de alimentos. El GLP-1 y el GIP incrementan la biosíntesis de la insulina y la secreción de esta desde las células beta pancreáticas en presencia de niveles normales y elevados de glucosa en sangre. Además, el GLP-1 también reduce la secreción de glucagón desde las células alfa pancreáticas, lo que causa una reducción de la producción hepática de glucosa.
Metformina: La metformina es un agente antihiperglucémico que mejora la tolerancia a la glucosa en los pacientes con diabetes mellitus tipo 2, disminuyendo los niveles de glucosa plasmática tanto basales como postprandiales. La metformina disminuye la producción hepática y la absorción intestinal de glucosa, y mejora la sensibilidad a la insulina aumentando la captación y la utilización periférica de glucosa. El tratamiento con metformina no modifica la secreción de insulina, mientras que puede disminuir los niveles de insulina en ayunas y la respuesta de la insulina plasmática durante todo el día.
Farmacodinámica:
Linagliptina: La linagliptina se une a la DPP-4 en una forma reversible, y de esta manera aumenta las concentraciones de hormonas incretinas. La linagliptina aumenta la secreción de insulina y disminuye la secreción de glucagón en una forma que es dependiente de la glucosa, y por lo tanto produce una mejor regulación de la homeostasis de la glucosa. La linagliptina se une de manera selectiva a la DPP-4 e inhibe de manera selectiva la actividad de la DPP-4, pero no la actividad in vitro de DPP-8 o DPP-9 a concentraciones que se aproximan a las exposiciones terapéuticas.
Electrofisiología cardiaca: En un estudio aleatorizado, con diseño cruzado de 4 vías, controlado con un placebo y comparado con un fármaco activo, a 36 sujetos sanos se les administró una sola dosis oral de linagliptina 5 mg, linagliptina 100 mg (20 veces la dosis recomendada), moxifloxacino y un placebo. No se observó ningún aumento en el QTc ni con la dosis recomendada de 5 mg ni con la dosis de 100 mg. Con la dosis de 100 mg, las concentraciones plasmáticas máximas de linagliptina fueron aproximadamente 38 veces más altas que las concentraciones máximas luego de la dosis de 5 mg.
Farmacocinética: Los resultados de un estudio de bioequivalencia en sujetos sanos demostraron que las tabletas de combinación TRAYENTA® DUO (linagliptina/clorhidrato de metformina) 2.5 mg/500 mg, 2.5 mg/850 mg, y 2.5 mg/1000 mg son bioequivalentes a la coadministración de dosis correspondientes de linagliptina y metformina como tabletas individuales. La administración de la combinación de dosis fijas de linagliptina 2.5 mg/clorhidrato de metformina 1000 mg con alimentos no altera la exposición global de la linagliptina. No hubo ningún cambio en el ABC de la metformina; Sin embargo, la concentración sérica máxima promedio de metformina disminuyó en un 18% cuando se administró con alimentos. Se observó un retraso de 2 horas en el tiempo para alcanzar las concentraciones séricas máximas para la metformina cuando se administró con alimentos. No es probable que estos cambios sean clínicamente significativos.
Absorción:
Linagliptina: La biodisponibilidad absoluta de la linagliptina es de aproximadamente 30%. Después de la administración oral, las concentraciones plasmáticas de linagliptina disminuyen en por lo menos una manera bifásica con una vida media terminal larga (mayor de 100 horas), que se relaciona con la unión saturable de la linagliptina a la DPP-4. Sin embargo, la prolongada fase de eliminación no contribuye a la acumulación del fármaco. La vida media efectiva para la acumulación de linagliptina, determinada mediante la administración oral de dosis múltiples de linagliptina 5 mg, es de aproximadamente 12 horas. Luego de la dosificación una vez al día, las concentraciones plasmáticas en el estado estacionario se alcanzan alrededor de tercera dosis de linagliptina 5 mg, y la Cmáx y el ABC aumentaron en un factor de 1.3 en el estado estacionario, en comparación con la primera dosis. El ABC de la concentración plasmática de linagliptina aumentó de una manera menor que proporcional a la dosis, en el intervalo de dosis de 1 a 10 mg. La farmacocinética de la linagliptina es similar en los sujetos sanos y en los pacientes con diabetes tipo 2.
Metformina: La biodisponibilidad absoluta de una tableta de 500 mg de clorhidrato de metformina administrada en ayunas es de aproximadamente 50-60%. Los estudios con dosis orales únicas de tabletas de clorhidrato de metformina de 500 a 1500 mg y de 850 a 2550 mg indican que el efecto no es proporcional a las dosis al aumentar estas, lo que se debe a una disminución de la absorción y no a una alteración de la eliminación.
Distribución:
Linagliptina: El promedio del volumen aparente de distribución en el estado estacionario luego de una dosis intravenosa única de linagliptina 5 mg en sujetos sanos es de aproximadamente 1110 L, lo que indica que la linagliptina se distribuye ampliamente a los tejidos. La unión de la linagliptina a las proteínas plasmáticas depende de la concentración; disminuye de aproximadamente 99% a 1 nmol/L hasta 75%-89% a ≥30 nmol/L, lo que refleja una saturación de la unión a la DPP-4 conforme aumenta la concentración de linagliptina. A concentraciones altas, donde la DPP-4 está totalmente saturada, el 70% al 80% de la linagliptina permanece unida a las proteínas plasmáticas, y el 20% al 30% está libre en el plasma. La unión a las proteínas plasmáticas no se ve afectada en los pacientes con insuficiencia renal o hepática.
Metformina: El volumen aparente de distribución (V/F) de la metformina tras la administración de dosis orales únicas de liberación inmediata de tabletas con 850 mg de clorhidrato de metformina fue en promedio de 654 ± 358 litros. A diferencia de las sulfonilureas, que se unen en más del 90% a las proteínas plasmáticas, la metformina se une escasamente a estás. Parte de la metformina penetra en los eritrocitos, muy probablemente en función del tiempo. A las dosis clínicas y horarios de administración usuales de las tabletas de clorhidrato de metformina, las concentraciones plasmáticas máximas de metformina en el estado estacionario se alcanzan en 24 a 48 horas, y generalmente son menores de 1 mcg/mL. Durante los estudios clínicos controlados de metformina, sus concentraciones máximas en plasma no fueron mayores de 5 mcg/mL, incluso con las dosis máximas.
Eliminación:
Linagliptina: La linagliptina tiene una vida media terminal de aproximadamente 200 horas en el estado estacionario, aunque la vida media de acumulación es de aproximadamente 11 horas. La depuración renal en el estado estacionario fue de aproximadamente 70 mL/min.
Metformina: La metformina tiene una vida media de eliminación plasmática de aproximadamente 6.2 horas. En sangre, la vida media de eliminación es de aproximadamente 17.6 horas, lo que sugiere que la masa de eritrocitos puede ser un compartimento de distribución.
Metabolismo:
Linagliptina: Luego de la administración oral, la mayor parte (alrededor del 90%) de la linagliptina se elimina sin cambio, lo que indica que el metabolismo representa una vía menor de eliminación. Una pequeña fracción de la linagliptina absorbida es metabolizada y produce un metabolito farmacológicamente inactivo, que muestra una exposición en el estado estacionario de 13.3% en relación con la linagliptina.
Metformina: Los estudios con dosis únicas por vía intravenosa en personas normales demostraron que la metformina se excreta sin cambio en la orina y no es metabolizada en el hígado (no se ha identificado ningún metabolito en humanos) ni excretada con la bilis.
Excreción:
Linagliptina: Después de la administración por vía oral de una dosis de [14C]-linagliptina a sujetos sanos, aproximadamente el 85% de la radioactividad administrada se eliminó a través del sistema enterohepático (80%) o a través de la orina (5%) dentro de 4 días a partir de la administración de la dosis. La depuración renal en el estado estacionario fue de aproximadamente 70 mL/min.
Metformina: La depuración renal de la metformina es aproximadamente 3.5 veces mayor que la de la creatinina, lo que indica que la secreción tubular es la principal vía de eliminación de la metformina. Tras la administración por vía oral, aproximadamente 90% del fármaco absorbido se elimina por la vía renal en las primeras 24 horas, con una vida media de eliminación del plasma de 6.2 horas aproximadamente. En la sangre, la vida media de eliminación es de aproximadamente 17.6 horas, lo que sugiere que la masa eritrocitaria puede ser un compartimiento de distribución del fármaco.
Poblaciones específicas:
Insuficiencia renal: TRAYENTA® DUO: No se han realizado estudios para caracterizar la farmacocinética de linagliptina y metformina después de la administración de TRAYENTA® DUO en pacientes con insuficiencia renal. [ver Contraindicaciones (4) y Advertencias y precauciones (5.1)].
Linagliptina: En el estado estacionario, la exposición a la linagliptina en los pacientes con insuficiencia renal leve fue similar a la de los sujetos sanos. En los pacientes con insuficiencia renal moderada en condiciones del estado estacionario, se vio un aumento del valor promedio de la exposición a la linagliptina (ABCτ,ss en 71% y Cmáx en 46%) en comparación con los sujetos sanos. Este aumento no estuvo asociado con una vida media de acumulación o una vida media terminal prolongadas, o con un factor de acumulación aumentado. La excreción renal de linagliptina fue de menos del 5% de la dosis administrada, y no se vio afectada por un funcionamiento renal disminuido.
Los pacientes con diabetes mellitus tipo 2 e insuficiencia renal grave mostraron una exposición en el estado estacionario aproximadamente 40% mayor que la de los pacientes con diabetes mellitus tipo 2 y funcionamiento renal normal (aumento en el ABCτ,ss de 42% y en la Cmáx de 35%). Para ambos grupos con diabetes mellitus tipo 2, la excreción renal fue de menos del 7% de la dosis administrada.
Metformina: En los pacientes con disminución de la función renal se ve un aumento de la vida media plasmática y sanguínea de la metformina, y una disminución de la depuración renal [ver Contraindicaciones (4) y Advertencias y Precauciones (5.1)].
Insuficiencia hepática: TRAYENTA® DUO: No se han realizado estudios para caracterizar la farmacocinética de la linagliptina y de la metformina después de la administración de TRAYENTA® DUO en pacientes con insuficiencia hepática [ver Advertencias y precauciones (5.1)].
Linagliptina: En los pacientes con insuficiencia hepática leve (Child-Pugh clase A), la exposición en el estado estacionario (ABCτ,ss) de la linagliptina fue aproximadamente 25% menor, y la Cmáx,ss fue aproximadamente 36% menor que en los sujetos sanos. En los pacientes con insuficiencia hepática moderada (Child-Pugh clase B), el ABCss de la linagliptina fue aproximadamente 14% menor y la Cmáx,ss fue aproximadamente 8% menor que en los sujetos sanos. Los pacientes con insuficiencia hepática grave (Child-Pugh clase C) tuvieron una exposición similar a la linagliptina, en términos del ABC0-24, y una Cmáx aproximadamente 23% menor en comparación con los sujetos sanos. Las reducciones en los parámetros farmacocinéticos, vistas en los pacientes con insuficiencia hepática no causaron reducciones en la inhibición de la DPP-4.
Clorhidrato de metformina: No se han hecho estudios sobre la farmacocinética de la metformina en pacientes con insuficiencia hepática.
Índice de masa corporal (IMC)/Peso:
Linagliptina: El IMC y el peso no tuvieron ningún efecto clínicamente importante en la farmacocinética de la linagliptina, con base en un análisis farmacocinético poblacional.
Sexo: Linagliptina: El sexo no tuvo ningún efecto clínicamente importante en la farmacocinética de la linagliptina, de acuerdo con un análisis farmacocinético poblacional.
Clorhidrato de metformina: Los parámetros farmacocinéticos de la metformina no difirieron significativamente entre las personas normales y los pacientes con diabetes mellitus tipo 2 cuando se analizaron según el sexo. Similarmente, en estudios clínicos controlados en pacientes con diabetes mellitus tipo 2, el efecto antihiperglucémico de la metformina fue similar en los hombres y en las mujeres.
Población geriátrica: TRAYENTA® DUO: No se han realizado estudios para caracterizar la farmacocinética de la linagliptina y de la metformina después de la administración de TRAYENTA® DUO en pacientes geriátricos [ver Advertencias y precauciones (5.1) y Uso en poblaciones específicas (8.5)].
Linagliptina: La edad no tuvo ningún efecto clínicamente importante en la farmacocinética de la linagliptina, de acuerdo con un análisis farmacocinético poblacional.
Clorhidrato de metformina: Los datos limitados de los estudios farmacocinéticos controlados de la metformina en personas de edad avanzada sanas sugieren que la depuración plasmática total de la metformina está disminuida, la vida media está prolongada y la Cmáx está aumentada, en comparación con las personas jóvenes sanas. Según estos datos, el cambio en la farmacocinética de la metformina al aumentar la edad se debe principalmente al cambio en la función renal.
Población pediátrica: Aún no se han realizado estudios para caracterizar la farmacocinética de la linagliptina y la metformina después de la administración de TRAYENTA® DUO en pacientes pediátricos.
Raza:
Linagliptina: La raza no tuvo ningún efecto clínicamente importante en la farmacocinética de la linagliptina, de acuerdo con los datos farmacocinéticos disponibles, que incluyen sujetos de raza blanca, hispanos, de raza negra y asiáticos.
Clorhidrato de metformina: No se han hecho estudios de los parámetros farmacocinéticos de la metformina según la raza. En estudios clínicos controlados de la metformina en pacientes con diabetes mellitus tipo 2, su efecto antihiperglucémico fue similar en sujetos blancos (n=249), negros (n= 51) e hispanos (n=24).
ESTUDIOS CLÍNICOS: La coadministración de linagliptina y metformina se ha estudiado en pacientes con diabetes mellitus tipo 2 que no se ha controlado adecuadamente con dieta y ejercicio y en combinación con sulfonilurea.
No se han realizado estudios de eficacia clínica con TRAYENTA® DUO; sin embargo, la bioequivalencia de TRAYENTA® DUO con linagliptina y metformina coadministrados como tabletas individuales se demostró en sujetos sanos.
Estudios del control glucémico:
Terapia inicial de combinación con linagliptina y metformina: Un total de 791 pacientes con diabetes mellitus tipo 2 y con un control deficiente de la glucosa plasmática con dieta y ejercicio participaron en la porción de 24 semanas aleatorizada y doble ciega de este estudio factorial controlado con un placebo, diseñado para evaluar la eficacia de linagliptina como tratamiento inicial con metformina. Los pacientes que recibían un antihiperglucemiante (52%) fueron sometidos a un periodo de lavado del fármaco durante 4 semanas. Después del periodo de lavado, y tras completar un periodo de preinclusión con placebo de 2 semanas, ciego simple, los pacientes que presentaban un control deficiente de la glucosa plasmática (A1C ≥ 7.0% a ≤ 10.5%) fueron asignados aleatoriamente. Los pacientes que presentaban un control deficiente de la glucosa plasmática (A1C ≥ 7.5% a < 11.0%) y que no recibían antihiperglucemiantes al ingresar al estudio (48%) entraron de inmediato al periodo de preinclusión con placebo de 2 semanas, ciego simple, y luego fueron asignados aleatoriamente. La aleatorización fue estratificada según el valor inicial de la A1C (<8.5% frente a ≥8.5%) y el uso previo de antidiabéticos orales (ninguno frente a monoterapia). Los pacientes fueron asignados aleatoriamente en una proporción de 1:2:2:2:2:2 al grupo del placebo o a uno de los 5 grupos de tratamiento activo. Aproximadamente el mismo número de pacientes fueron asignados aleatoriamente para recibir tratamiento inicial con 5 mg de linagliptina una vez al día, 500 mg o 1000 mg de metformina dos veces al día, o 2.5 mg de linagliptina dos veces al día en combinación con 500 mg o 1000 mg de metformina dos veces al día. Los pacientes que no alcanzaron los objetivos específicos para la glucosa plasmática durante el estudio recibieron tratamiento de rescate con una sulfonilurea, tiazolidindiona o insulina.
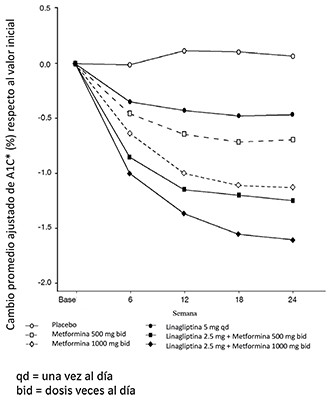
El tratamiento inicial con la combinación de linagliptina y metformina produjo mejoras significativas en la A1C y en la glucosa plasmática en ayunas (GPA) en comparación con placebo, con metformina sola y con linagliptina sola (Tabla 6, Figura 1). El promedio ajustado de la diferencia entre los tratamientos en el valor de A1C desde el inicio hasta la semana 24 (LOCF) fue -0.5% (IC 95% -0.7, -0.3; p<0.0001) para el grupo de linagliptina 2.5 mg/metformina 1000 mg dos veces al día, en comparación con metformina 1000 mg dos veces al día; -1.1% (IC 95% -1.4, -0.9; p<0.0001) para el grupo de linagliptina 25 mg/metformina 1000 mg dos veces al día, en comparación con linagliptina 5 mg una vez al día; -0.6% (IC 95% -0.8, -0.4; p<0.0001) para el grupo de linagliptina 2.5 mg/metformina 500 mg dos veces al día, en comparación con metformina 500 mg dos veces al día; y -0.8% (IC 95% -1.0, -0.6; p<0.0001) para el grupo de linagliptina 2.5 mg/metformina 500 mg dos veces al día, en comparación con linagliptina 5 mg una vez al día.
Los efectos sobre los lípidos generalmente fueron neutros. No se observó ningún cambio importante en el peso corporal en ninguno de los 6 grupos de tratamiento.
|
Tabla 6. Parámetros glucémicos en la visita final (estudio de 24 semanas) para linagliptina y metformina, solos y en combinación, en pacientes asignados aleatoriamente que padecían diabetes tipo 2 no controlada adecuadamente con la dieta y ejercicio** |
||||||
|
Placebo |
Linagliptina 5 mg una vez al día* |
Metformina 500 mg dos veces al día |
Linagliptina 2.5 mg dos veces al día* + Metformina 500 mg dos veces al día |
Metformina 1000 mg dos veces al día |
Linagliptina 2.5 mg dos veces al día* + Metformina 1000 mg dos veces al día |
|
|
A1C (%) |
||||||
|
Número de pacientes |
n=65 |
n=135 |
n=141 |
n=137 |
n=138 |
n=140 |
|
Valores iniciales (media) |
8.7 |
8.7 |
8.7 |
8.7 |
8.5 |
8.7 |
|
Cambio respecto a los valores iniciales (media ajustada****) |
0.1 |
-0.5 |
-0.6 |
-1.2 |
-1.1 |
-1.6 |
|
Diferencia respecto al placebo (media ajustada) (IC 95%) |
- |
-0.6 (-0.9, -0.3) |
-0.8 (-1.0, -0.5) |
-1.3 (-1.6, -1.1) |
-1.2 (-1.5, -0.9) |
-1.7 (-2.0, -1.4) |
|
Pacientes [n (%)] que alcanzaron A1C <7%*** |
7 (10.8) |
14 (10.4) |
26 (18.6) |
41 (30.1) |
42 (30.7) |
74 (53.6) |
|
Pacientes (%) que recibieron medicamentos de rescate |
29.2 |
11.1 |
13.5 |
7.3 |
8.0 |
4.3 |
|
Glucosa plasmática en ayunas (mg/dL) |
||||||
|
Número de pacientes |
n = 61 |
n = 134 |
n = 136 |
n = 135 |
n = 132 |
n = 136 |
|
Valores iniciales (media) |
203 |
195 |
191 |
199 |
191 |
196 |
|
Cambio respecto a los valores iniciales (media ajustada****) |
10 |
-9 |
-16 |
-33 |
-32 |
-49 |
|
Diferencia respecto al placebo (media ajustada) (IC 95%) |
- |
-19 (-31, -6) |
-26 (-38, -14) |
-43 (-56, -31) |
-42 (-55, -30) |
-60 (-72, -47) |
|
*La dosis diaria total de linagliptina es igual a 5 mg **Población completa para el análisis utilizando la última observación en el estudio ***Metformina 500 mg dos veces al día, n=140; linagliptina 2.5 mg dos veces al día + metformina 500 mg dos veces al día, n=136; metformina 1000 mg dos veces al día, n=137; linagliptina 2.5 mg dos veces al día + metformina 1000 mg dos veces al día, n=138 ****HbA1c: el modelo ANCOVA incluyó el tratamiento y el número de medicamentos antidiabéticos orales previos como efectos de clase, además del valor de la HbA1c inicial como covariables continuas. Glucosa plasmática en ayunas: el modelo ANCOVA incluyó el tratamiento y el número de medicamentos antidiabéticos orales previos como efectos de clase, además del valor de la HbA1c inicial y el valor de la glucosa plasmática en ayunas inicial como covariables continuas. |
||||||
Figura 1. Cambio promedio ajustado de A1C (%) inicial durante 24 semanas con linagliptina y metformina, solos y en combinación en pacientes con diabetes mellitus tipo 2 no controlada adecuadamente con dieta y ejercicio - sujetos que completaron el estudio para el conjunto completo para análisis (FAS).
Terapia inicial de combinación con linagliptina y metformina vs linagliptina en pacientes sin tratamiento previo: Un total de 316 pacientes con diabetes tipo 2 diagnosticada en los 12 meses anteriores y sin tratamiento previo (sin tratamiento antidiabético durante 12 semanas antes de la aleatorización) y sin un control glucémico adecuado (A1C ≥8.5% a ≤12.0%) participaron en un estudio de 24 semanas, aleatorizado, doble ciego, diseñado para evaluar la eficacia de linagliptina en combinación con metformina vs linagliptina. Después de un periodo de preinclusión de 2 semanas, los pacientes fueron aleatorizados (1:1) a linagliptina 5 mg más metformina (1500 a 2000 mg por día, n = 159) o a linagliptina 5 mg más placebo (n = 157) administrada una vez al día. Los pacientes en el grupo de tratamiento con linagliptina y metformina recibieron dosis crecientes de metformina hasta una dosis máxima tolerada (1000 a 2000 mg por día) durante un periodo de tres semanas.
El tratamiento inicial con la combinación de linagliptina y metformina produjo mejoras estadísticamente significativas en A1C, en comparación con la linagliptina (Tabla 7). La diferencia de los promedios entre los grupos, en el cambio del valor inicial de A1C fue de - 0.8% con un intervalo de confianza bilateral al 95% (-1.23%, -0.45%).
|
Tabla 7. Parámetros glucémicos en el estudio de 24 semanas que comparó la combinación de linagliptina con metformina frente a linagliptina en pacientes sin tratamiento previo* |
||
|
Linagliptina 5 mg + metformina |
Linagliptina 5 mg + Placebo |
|
|
A1C (%) |
||
|
Número de pacientes |
n=153 |
n=150 |
|
Valores iniciales (media) |
9.8 |
9.9 |
|
Cambio respecto a los valores iniciales (media ajustada) |
-2.9 |
-2 |
|
Diferencia respecto a la linagliptina (media ajustada**) (IC 95%) |
-0.84† (-1.23,-0.45) |
-- |
|
Pacientes [n (%)] que alcanzaron A1C <7%* |
82 (53.6) |
45(30) |
|
Glucosa plasmática en ayunas (mg/dL) |
||
|
Número de pacientes |
n=153 |
n=150 |
|
Valores iniciales (media) |
196 |
198 |
|
Cambio respecto a los valores iniciales (media ajustada) |
-54 |
-35 |
|
Diferencia respecto a la linagliptina (media ajustada**) (IC 95%) |
-18†† (-31,-5.5) |
-- |
|
† p <0.0001 en comparación con linagliptina, †† p = 0.0054 en comparación con linagliptina * Población del conjunto completo para análisis ** A1C: El Modelo MMRM incluyó el tratamiento, A1C basal continua, la interacción A1C basal por visita, la interacción visita por tratamiento, la interacción insuficiencia renal basal por tratamiento, y la interacción insuficiencia renal basal por tratamiento por visita. GPA: El Modelo MMRM incluyó el tratamiento, A1C basal continua, GPA basal continua, la interacción GPA basal continua por visita, la interacción visita por tratamiento, la interacción insuficiencia renal basal por tratamiento y la interacción insuficiencia renal basal por tratamiento por visita. |
||
Los cambios promedio ajustados para A1C (%) respecto al valor basal en el tiempo para linagliptina y metformina en comparación con linagliptina sola se mantuvieron durante todo el periodo de tratamiento de 24 semanas. Utilizando el análisis de los sujetos que completaron el estudio, los respectivos promedios ajustados para los cambios de A1C (%) desde el inicio para linagliptina y metformina en comparación con linagliptina sola fueron - 1.9 y -1.3 en las semanas 6, -2.6 y -1.8 en la semana 12, -2.7 y -1.9 en la semana 18, y -2.7 y -1.9 en la semana 24.
Los cambios en el peso corporal respecto al valor inicial no fueron clínicamente significativos en ninguno de los grupos de tratamiento.
Terapia de combinación complementaria con metformina: Un total de 701 pacientes con diabetes tipo 2 participaron en un estudio de 24 semanas aleatorizado, doble ciego y controlado con un placebo, diseñado para evaluar la eficacia de linagliptina en combinación con metformina. Los pacientes que ya recibían metformina (n = 491) a una dosis de por lo menos 1500 mg por día fueron asignados aleatoriamente después de completar un periodo abierto de preinclusión con placebo de 2 semanas. Los pacientes que recibían metformina y otro antihiperglucemiante (n = 207) fueron asignados aleatoriamente después de un periodo de preinclusión de aproximadamente 6 semanas con administración de metformina (a una dosis de por lo menos 1500 mg por día) en monoterapia. Los pacientes fueron asignados aleatoriamente para añadir la administración de linagliptina 5 mg o de un placebo, administrados una vez al día. Los pacientes que no alcanzaron los objetivos específicos para la glucosa plasmática durante estos estudios recibieron tratamiento de rescate con glimepirida.
En combinación con metformina, la linagliptina produjo mejoras estadísticamente significativas en la A1C, en la glucosa plasmática en ayunas y en la glucosa plasmática postprandial a las 2 horas, en comparación con el placebo (Tabla 8). El tratamiento de rescate para el control de la glucosa plasmática se utilizó en el 7.8% de los pacientes tratados con linagliptina 5 mg y en el 18.9% de los pacientes tratados con el placebo. En ambos grupos de tratamiento se observó una disminución similar del peso corporal.
|
Tabla 8. Parámetros glucémicos para linagliptina en combinación con metformina en un estudio controlado con un placebo* |
||
|
Linagliptina 5 mg + Metformina |
Placebo + Metformina |
|
|
A1C (%) |
||
|
Número de pacientes |
n=513 |
n=175 |
|
Valores iniciales (media) |
8.1 |
8.0 |
|
Cambio respecto a los valores iniciales |
-0.5 |
0.15 |
|
Diferencia respecto al placebo + metformina |
-0.6 (-0.8,-0.5) |
- |
|
Pacientes [n (%)] que alcanzaron A1C <7%** |
127 (26.2) |
15 (9.2) |
|
Glucosa plasmática en ayunas (mg/dL) |
||
|
Número de pacientes |
n=495 |
n=159 |
|
Valores iniciales (media) |
169 |
164 |
|
Cambio respecto a los valores iniciales (media ajustada***) |
-11 |
11 |
|
Diferencia respecto al placebo + metformina |
-21 (-27,-15) |
- |
|
Glucosa plasmática postprandial a las 2 horas (mg/dL) |
||
|
Número de pacientes |
n=78 |
n=21 |
|
Valores iniciales (media) |
270 |
274 |
|
Cambio respecto a los valores iniciales (media ajustada***) |
-49 |
18 |
|
Diferencia respecto al placebo + metformina |
-67 (-95, -40) |
- |
|
*Población completa para el análisis utilizando la última observación en el estudio **Linagliptina 5 mg + metformina, n=485; placebo + metformina, n=163 ***HbA1c: el modelo ANCOVA incluyó el tratamiento y el número de medicamentos antidiabéticos orales previos como efectos de clase, además del valor de la HbA1c inicial como covariables continuas. Glucosa plasmática en ayunas: el modelo ANCOVA incluyó el tratamiento y el número de medicamentos antidiabéticos orales previos como efectos de clase, además del valor de la HbA1c inicial y el valor de la glucosa plasmática en ayunas inicial como covariables continuas. Glucosa plasmática postprandial: el modelo ANCOVA incluyó el tratamiento y el número de medicamentos antidiabéticos orales previos como efectos de clase, además del valor de la HbA1c inicial y de la glucosa plasmática postprandial a las dos horas como covariables. |
||
Estudio controlado con un fármaco activo frente a glimepirida en combinación con metformina:
La eficacia de la linagliptina se evaluó en un estudio de no inferioridad de 104 semanas, doble ciego, controlado con glimepirida, en pacientes con diabetes tipo 2 y con un control insuficiente de la glucosa plasmática a pesar de recibir tratamiento con metformina. Los pacientes que recibían tratamiento solo con metformina ingresaron a un periodo de preinclusión de 2 semanas de duración, mientras que los pacientes con tratamiento previo con metformina y otro antihiperglucemiante ingresaron a un periodo de pretratamiento de 6 semanas de duración con monoterapia con metformina (dosis ≥1500 mg/día) y lavado del otro fármaco. Después de un periodo adicional de preinclusión de 2 semanas con placebo, los pacientes que presentaban un control deficiente de la glucosa plasmática (A1C 6.5% a 10%) fueron asignados aleatoriamente en una proporción de 1:1 para la adición de linagliptina 5 mg una vez al día o glimepirida. La aleatorización se estratificó según el valor de la HbA1c inicial (<8.5% frente a ≥8.5%) y el uso previo de antidiabéticos (metformina sola frente a metformina más otro antidiabético oral). A los pacientes que recibían glimepirida se les dio una dosis inicial de 1 mg/día y luego se les ajustó la dosis de manera opcional durante las siguientes 12 semanas hasta una dosis máxima de 4 mg/día, según fuera necesario para optimizar el control de la glucosa plasmática. A partir de ahí, la dosis de glimepirida debía mantenerse constante, excepto en los momentos en que debía disminuirse la dosis para prevenir una hipoglucemia.
Después de 52 y 104 semanas, tanto linagliptina como glimepirida produjeron disminuciones del valor de A1C inicial (52 semanas: -0.4% para el grupo de linagliptina, -0.6% para el grupo de glimepirida; 104 semanas: -0.2% para el grupo de linagliptina, -0.4% para el grupo de glimepirida) desde un valor promedio inicial de 7.7% (Tabla 9). La diferencia promedio entre los grupos en el cambio del valor de A1C desde el inicio fue de 0.2% con un intervalo de confianza bilateral al 97.5% (0.1%, 0.3%) para el análisis de la población por intención de tratar, utilizando la última observación considerada. Estos resultados fueron congruentes con el análisis de los pacientes que completaron el estudio.
|
Tabla 9. Parámetros glucémicos a las 52 y a las 104 semanas en un estudio que comparó linagliptina con glimepirida como tratamiento complementario en pacientes no controlados adecuadamente con metformina** |
||||
|
Semana 52 |
Semana 104 |
|||
|
Linagliptina 5 mg + Metformina |
Glimepirida + Metformina (dosis media de glimepirida 3 mg) |
Linagliptina 5 mg + Metformina |
Glimepirida + Metformina (dosis media de glimepirida 3 mg) |
|
|
A1C (%) |
||||
|
Número de pacientes |
n=764 |
n=755 |
n=764 |
n=755 |
|
Valores iniciales (media) |
7.7 |
7.7 |
7.7 |
7.7 |
|
Cambio respecto a los valores iniciales (media ajustada****) |
-0.4 |
-0.6 |
-0.2 |
-0.4 |
|
Diferencia respecto de la glimepirida (media ajustada) (IC 97.5%) |
0.2 (0.1, 0.3) |
– |
0.2 (0.1, 0.3) |
– |
|
Glucosa plasmática en ayunas (mg/dL) |
||||
|
Número de pacientes |
n=733 |
n=725 |
n=733 |
n=725 |
|
Valores iniciales (media) |
164 |
166 |
164 |
166 |
|
Cambio respecto a los valores iniciales (media ajustada****) |
-8* |
-15 |
-2† |
-9 |
|
*p<0.0001 frente a glimepirida; †p=0.0012 frente a glimepirida **Población completa para el análisis utilizando la última observación en el estudio ***HbA1c: el modelo ANCOVA incluyó el tratamiento y el número de medicamentos antidiabéticos orales previos como efectos de clase, además del valor de la HbA1c inicial como covariables continuas. GPA: el modelo ANCOVA incluyó el tratamiento y el número de medicamentos antidiabéticos orales previos como efectos de clase, además del valor de la HbA1c inicial y GPA inicial como covariables continuas. |
||||
Los pacientes tratados con linagliptina tuvieron un peso corporal inicial promedio de 86 kg, y se observó que tuvieron una disminución de la media ajustada del peso corporal de 1.1 kg a las 52 semanas y de 1.4 kg a las 104 semanas. Los pacientes que recibieron glimepirida tuvieron un peso corporal inicial promedio de 87 kg, y se observó que tuvieron un incremento de la media ajustada del peso corporal desde el valor inicial de 1.4 kg a las 52 semanas y de 1.3 kg a las 104 semanas (diferencia entre los tratamientos p<0.0001 en ambos tiempos de medición).
Terapia de combinación complementaria con metformina y una sulfonilurea: Un total de 1058 pacientes con diabetes mellitus tipo 2 participaron en un estudio de 24 semanas aleatorizado, doble ciego, controlado con un placebo, diseñado para evaluar la eficacia de linagliptina en combinación con una sulfonilurea y metformina. Las sulfonilureas utilizadas con mayor frecuencia por los pacientes del estudio fueron: glimepirida (31%), glibenclamida (26%) y gliclazida (26%, no está disponible en los Estados Unidos). Los pacientes que recibían una sulfonilurea y metformina fueron asignados aleatoriamente para recibir linagliptina 5 mg o un placebo, cada uno administrado una vez al día. Los pacientes que no alcanzaron los objetivos específicos de glucosa plasmática durante el estudio recibieron tratamiento de rescate con pioglitazona. Los criterios de valoración glucémicos determinados incluyeron la A1C y la glucosa plasmática en ayunas.
En combinación con una sulfonilurea y metformina, la linagliptina produjo mejoras estadísticamente significativas en la A1C y en la glucosa plasmática en ayunas, en comparación con el placebo (Tabla 10). En la población total del estudio (pacientes que recibieron linagliptina en combinación con una sulfonilurea y metformina), se observó una disminución promedio de los valores iniciales de A1C de -0.6% y de la glucosa plasmática en ayunas de -13 mg/dL, en comparación con el placebo. Se utilizó tratamiento de rescate en el 5.4% de los pacientes tratados con linagliptina 5 mg y en el 13% de los pacientes tratados con el placebo. El cambio respecto a los valores iniciales del peso corporal no difirió de manera significativa entre los grupos.
|
Tabla 10. Parámetros glucémicos en la visita final (estudio de 24 semanas) para linagliptina en combinación con metformina y una sulfonilurea* |
||
|
Linagliptina 5 mg + Metformina + SU |
Placebo + Metformina + SU |
|
|
A1C (%) |
||
|
Número de pacientes |
n=778 |
n=262 |
|
Valores iniciales (media) |
8.2 |
8.1 |
|
Cambio respecto a los valores iniciales (media ajustada***) |
-0.7 |
-0.1 |
|
Diferencia respecto al placebo (media ajustada) (IC 95%) |
-0.6 (-0.7,-0.5) |
– |
|
Pacientes [n (%)] que alcanzaron A1C <7%** |
217 (29.2) |
20 (8.1) |
|
Glucosa plasmática en ayunas (mg/dL) |
||
|
Número de pacientes |
n=739 |
n=248 |
|
Valores iniciales (media) |
159 |
163 |
|
Cambio respecto a los valores iniciales (media ajustada***) |
-5 |
8 |
|
Diferencia respecto al placebo (media ajustada) (IC 95%) |
-13 (-18,-7) |
– |
|
SU = sulfonilurea *Población completa para el análisis utilizando la última observación en el estudio **Linagliptina 5 mg + metformina + SU, n=742; placebo + metformina + SU, n=247 ***HbA1c: el modelo ANCOVA incluyó el tratamiento como efectos de clase y el valor de la HbA1c inicial como covariables continuas. Glucosa plasmática en ayunas; el modelo ANCOVA incluyó el tratamiento como efectos de clase, además del valor de la HbA1c inicial y el valor de la glucosa plasmática en ayunas inicial como covariables continuas |
||
Estudios de seguridad cardiovascular de linagliptina:
Carmelina: El riesgo cardiovascular de la linagliptina se evaluó en CARMELINA, un estudio multinacional, multicéntrico, controlado con placebo, doble ciego, de grupos paralelos, que comparó linagliptina (N = 3494) con placebo (N = 3485) en pacientes adultos con diabetes mellitus tipo 2 y antecedentes de enfermedad macrovascular y/o renal establecida. El estudio comparó el riesgo de eventos adversos cardiovasculares mayores (MACE, major adverse cardiovascular events) entre la linagliptina y el placebo cuando se agregaron a los tratamientos estándar de atención para la diabetes y otros factores de riesgo cardiovascular. Este fue un estudio de duración determinada por eventos (resultados); la duración mediana del seguimiento fue de 2.2 años y se obtuvo el estado vital para el 99.7% de los pacientes.
Los pacientes fueron elegibles para ingresar al estudio si eran adultos con diabetes tipo 2, con HbA1c de 6.5% a 10%, y tenían albuminuria y enfermedad macrovascular previa (39% de la población inscrita), o evidencia de insuficiencia renal por TFGe y criterios del cociente de albúmina/creatinina en orina (UACR) (42% de la población inscrita), o ambos (18% de la población inscrita).
Al inicio del estudio, la edad promedio era de 66 años y el 63% la población era masculina, 80% caucásica, 9% asiática y 6% negra. La HbA1c media fue del 8.0% y la duración promedio de la diabetes mellitus tipo 2 fue de 15 años. La población del estudio incluyó 17% de pacientes ≥ 75 años de edad y 62% de pacientes con insuficiencia renal definida como TFGe < 60 mL/min/1.73 m2. La TFGe promedio fue de 55 mL/min/1.73 m2 y 27% de los pacientes tenían insuficiencia renal leve (TFGe de 60 a 90 mL/min/1.73 m2); 47% de los pacientes tenían insuficiencia renal moderada (TFGe de 30 a < 60 mL/min/1.73 m2) y 15% de los pacientes tenían insuficiencia renal grave (TFGe < 30 mL/min/1.73 m2). Los pacientes tomaban al menos un fármaco antidiabético (97%), y los más comunes fueron insulina y análogos (57%), metformina (54%) y sulfonilurea (32%). Los pacientes también estaban tomando antihipertensivos (96%), fármacos hipolipemiantes (76%) con 72% de estatinas y aspirina (62%).
El criterio principal de valoración, MACE, fue el tiempo hasta la primera aparición de uno de los tres resultados compuestos que incluyeron muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal. El estudio fue diseñado como un estudio de no inferioridad con un margen de riesgo preespecificado de 1.3 para la razón de riesgo de MACE.
Los resultados de CARMELINA, incluida la contribución de cada componente al criterio de valoración compuesto primario, se muestran en la Tabla 11. La razón de riesgo estimada para MACE asociados con linagliptina en relación con placebo fue de 1.02 con un intervalo de confianza al 95% de (0.89, 1.17). El límite superior de este intervalo de confianza, 1.17, excluyó el margen de riesgo de 1.3. La curva de Kaplan-Meier que representa el tiempo hasta la primera aparición de MACE se muestra en la Figura 2.
|
Tabla 11 Eventos cardiovasculares adversos mayores (MACE) por grupo de tratamiento en el estudio CARMELINA |
|||||
|
linagliptina 5 mg n = 3494 |
Placebo n = 3485 |
Cociente de riesgo |
|||
|
Número de asignaturas (%) |
Tasa de incidencia por 1000 AP* |
Número de asignaturas (%) |
Tasa de incidencia por 1000 AP* |
(IC 95%) |
|
|
Compuesto del primer evento de muerte CV, infarto de miocardio(IM) no mortal o accidente cerebrovascular no mortal (MACE) |
434 (12.4) |
57.7 |
420 (12.1) |
56.3 |
1.02 |
|
Muerte CV** |
255 (7.3) |
32.6 |
264 (7.6) |
34.0 |
0.96 (0.81, 1.14) |
|
MI no mortal** |
156 (4.5) |
20.6 |
135 (3.9) |
18.0 |
1,15 (0.91, 1.45) |
|
Accidente cerebrovascular no mortal** |
65 (1.9) |
8.5 |
73 (2.1) |
9.6 |
0.88 (0.63, 1.23) |
|
* AP = años del paciente ** Un paciente puede haber experimentado más de un componente; por lo tanto, la suma de los componentes es mayor que el número de pacientes que experimentaron el resultado compuesto. |
|||||
Figura 2 Kaplan-Meier: Tiempo hasta la primera aparición de MACE en el estudio CARMELINA
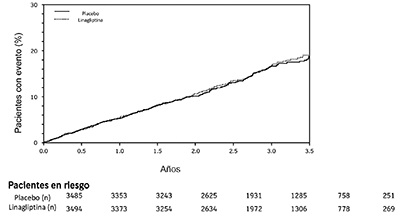
Carolina: El riesgo cardiovascular de la linagliptina se evaluó en CAROLINA, un estudio multicéntrico, multinacional, aleatorizado, doble ciego, de grupos paralelos, que comparó linagliptina (N = 3023) con glimepirida (N = 3010) en pacientes adultos con diabetes mellitus tipo 2 y antecedentes de enfermedad cardiovascular establecida y/o múltiples factores de riesgo cardiovascular. El estudio comparó el riesgo de eventos cardiovasculares adversos mayores (MACE, major adverse cardiovascular events) entre linagliptina y glimepirida cuando se agregaron a los tratamientos estándar de atención para la diabetes y otros factores de riesgo cardiovascular. Este fue un estudio de duración determinada por eventos (event driven), la duración mediana del seguimiento fue de 6.23 años y el estado vital se obtuvo para el 99.3% de los pacientes.
Los pacientes eran elegibles para ingresar al estudio si eran adultos con diabetes tipo 2 con un control glucémico insuficiente (definido como HbA1c de 6.5% a 8.5% o 6.5% a 7.5%, dependiendo de si habían recibido tratamiento previo, monoterapia o terapia combinada) y se definieron como de alto riesgo cardiovascular con enfermedad vascular previa, evidencia de daño vascular en órganos específicos relacionados, edad ≥70 años y/o dos factores de riesgo cardiovascular (duración de la diabetes > 10 años, presión arterial sistólica > 140 mmHg, fumador actual, colesterol LDL ≥ 135 mg dL).
Al inicio del estudio, la edad promedio era de 64 años y 60% de la población eran hombres, 73% caucásica, 18% asiática y 5% negra. El nivel promedio de HbA1c fue del 7.15% y la duración promedio de la diabetes tipo 2 fue de 7.6 años. 34% de los pacientes de la población del estudio eran ≥70 años de edad, y 19% tenían insuficiencia renal definida como TFGe < 60 mL/min/1.73 m2. La TFGe promedio fue de 77 mL/ min/1.73 m2. Los pacientes tomaban al menos un medicamento antidiabético (91%) y los más comunes fueron metformina (83%) y sulfonilurea (28%). Los pacientes también estaban tomando antihipertensivos (89%), fármacos hipolipemiantes (70%) con 65% de estatinas y aspirina (47%).
El criterio principal de valoración, MACE, fue el tiempo hasta la primera aparición de uno de los tres resultados compuestos que incluyeron muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal. El estudio fue diseñado como un estudio de no inferioridad con un margen de riesgo preespecificado de 1.3 para el límite superior del IC al 95% para el cociente de riesgos (HR) de MACE.
Los resultados de CAROLINA, incluida la contribución de cada componente al criterio principal de valoración, se muestran en la Tabla 12. La curva de Kaplan-Meier que representa el tiempo hasta la primera aparición de MACE se muestra en la Figura 3.
|
Tabla 12. Eventos cardiovasculares adversos mayores (MACE) por grupo de tratamiento en el estudio CAROLINA |
|||||
|
Linagliptina 5 mg n=3023 |
Glimepirida (1 mg a 4 mg) n=3010 |
Cociente de riesgos (HR) |
|||
|
Número de sujetos (%) |
Tasa de incidencia por 1000 AP* |
Número de sujetos (%) |
Tasa de incidencia por 1000 AP* |
(IC 95%) |
|
|
Compuesto del primer evento de muerte CV, infarto de miocardio (IM) no mortal o accidente cerebrovascular no mortal (MACE) |
356 (11.8) |
20.7 |
362(12.0) |
21.2 |
0.98(0.84,1.14) |
|
Muerte CV** |
169 (5.6) |
9.2 |
168 (5.6) |
9.2 |
1.00 (0.81,1.24) |
|
IM no mortal** |
145 (4.8) |
8.3 |
142 (4.7) |
8.2 |
1.01 (0.80,1.28) |
|
Accidente cerebrovascular no mortal** |
91 (3.0) |
5.2 |
104 (3.5) |
6.0 |
0.87 (0.66,1.15) |
|
*AP = años paciente ** Un paciente puede haber experimentado más de un componente; por lo tanto, la suma de los componentes es mayor que la cantidad de pacientes que experimentaron el resultado compuesto. |
|||||
Figura 3. Tiempo hasta la primera aparición de 3P-MACE en CAROLINA
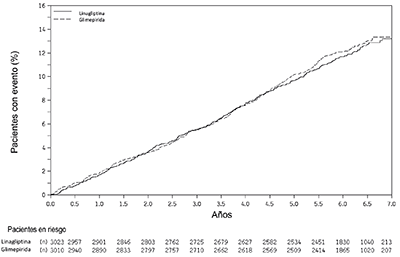
POSOLOGÍA Y ADMINISTRACIÓN:
Dosis recomendada: La dosis de TRAYENTA® DUO debe individualizarse con base en la eficacia y tolerabilidad, sin exceder la dosis máxima recomendada de 2.5 mg de linagliptina/1000 mg de clorhidrato de metformina dos veces al día. TRAYENTA® DUO debe administrarse dos veces al día con las comidas. El aumento de la dosis debe ser gradual para reducir los efectos secundarios gastrointestinales (GI) asociados con el uso de metformina. Para las formas de dosificación y concentraciones disponibles ver [Formas farmacéuticas y concentraciones (3)].
Dosis inicial recomendada:
• En los pacientes actualmente no tratados con metformina, iniciar el tratamiento con 2.5 mg de linagliptina/500 mg de clorhidrato de metformina mg dos veces al día.
• En los pacientes ya tratados con metformina, comenzar con 2.5 mg de linagliptina y la dosis actual de clorhidrato de metformina tomada en cada una de las dos comidas diarias (por ejemplo, un paciente tratado con clorhidrato de metformina 1000 mg dos veces al día iniciaría con 2.5 mg de linagliptina/1000 mg de clorhidrato de metformina dos veces al día con las comidas).
• Los pacientes ya tratados con los componentes individuales linagliptina y metformina pueden cambiar a TRAYENTA® DUO que contiene las mismas dosis de cada componente.
No se han hecho estudios para evaluar específicamente la seguridad y la eficacia de TRAYENTA® DUO en pacientes previamente tratados con otros antihiperglucemiantes orales que luego cambiaron a TRAYENTA® DUO. Cualquier cambio que se haga en el tratamiento de la diabetes mellitus de tipo 2 se debe llevar a cabo con cuidado y bajo una vigilancia adecuada, ya que pueden ocurrir cambios en el control de la glucemia.
Dosis recomendada en personas con insuficiencia renal: Evaluar la función renal antes de iniciar el tratamiento con TRAYENTA® DUO y periódicamente de allí en adelante.
TRAYENTA® DUO está contraindicado en pacientes con una tasa de filtración glomerular estimada (TFGe) por debajo de 30 mL/min/1.73 m2.
No se recomienda iniciar la administración de TRAYENTA® DUO en pacientes con una TFGe entre 30 y 45 mL/min/1.73 m2.
En los pacientes que toman TRAYENTA® DUO cuya TFGe disminuye después por debajo de 45 mL/min/1.73 m2, evaluar la relación riesgo/beneficio que implica continuar con el tratamiento.
Interrumpir la administración de TRAYENTA® DUO si, más adelante, la TFGe del paciente disminuye por debajo de 30 mL/min/1.73 m2 [ver Contraindicaciones (4) y Advertencias y precauciones (5.1)].
Suspensión en caso de procedimientos de diagnóstico por imágenes con contraste yodado: Suspender la administración de TRAYENTA® DUO en el momento o antes de un procedimiento de diagnóstico por imágenes con contraste yodado en pacientes con una TGFe entre 30 y 60 mL/min/1.73 m2; en pacientes con antecedentes de enfermedad hepática, alcoholismo o insuficiencia cardíaca; o en pacientes que recibirán contraste yodado por vía intraarterial.
Volver a evaluar la TFGe 48 horas después del procedimiento de diagnóstico por imágenes; reanudar la administración de TRAYENTA® DUO si la función renal es estable [ver Advertencias y precauciones (5.1)].
USO EN POBLACIONES ESPECÍFICAS:
Embarazo:
Resumen de los riesgos: Los escasos datos sobre el uso de TRAYENTA® DUO y linagliptina en mujeres embarazadas no son suficientes para informar que existe el riesgo de defectos congénitos importantes y de aborto espontáneo relacionados con TRAYENTA® DUO o con linagliptina.
En los estudios publicados sobre el uso de metformina durante el embarazo no se ha informado una clara asociación entre la metformina y el riesgo de defectos congénitos importantes o de aborto espontáneo [ver Datos]. Existen riesgos para la madre y el feto asociados con un control deficiente de la diabetes durante la gestación [ver Consideraciones clínicas].
En estudios sobre la reproducción en animales, no se observaron efectos adversos en el desarrollo cuando se administró la combinación de linagliptina y metformina a ratas preñadas durante el periodo de organogénesis en dosis similares a la dosis clínica máxima recomendada, con base en la exposición [ver Datos].
El riesgo de base estimado de defectos congénitos importantes es del 6% al 10% en mujeres con diabetes pregestacional con una HbA1c > 7, y se ha reportado un riesgo de entre el 20% y el 25% en mujeres con una HbA1c > 10. Se desconoce el riesgo de base estimado de abortos espontáneos para la población indicada. En la población estadounidense general, el riesgo de base estimado de defectos congénitos importantes y de aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Consideraciones clínicas:
Riesgo materno y/o embriofetal asociado a la enfermedad: La diabetes mal controlada durante la gestación aumenta el riesgo materno de cetoacidosis diabética, preeclampsia y complicaciones en el parto. La diabetes mal controlada aumenta el riesgo fetal de defectos congénitos importantes, muerte intrauterina y morbilidad relacionada con macrosomía.
Datos:
Datos en humanos: Los datos publicados de estudios posteriores a la comercialización no han informado una clara asociación entre la metformina y defectos congénitos importantes, aborto espontáneo o resultados adversos en la madre o el feto con la administración de metformina durante la gestación. Sin embargo, estos estudios no pueden establecer de manera definitiva la ausencia de algún riesgo relacionado con metformina debido a las limitaciones metodológicas que presentan, como, por ejemplo, el tamaño reducido de las muestras y la falta de uniformidad entre los grupos comparativos.
Datos en animales: La linagliptina y la metformina, los componentes de TRAYENTA® DUO, se coadministraron a ratas Wistar Han preñadas durante el periodo de organogénesis. No se observaron resultados adversos en el desarrollo con dosis similares a la dosis clínica máxima recomendada, con base en la exposición. A dosis más altas asociadas con toxicidad materna, el componente metformina de la combinación se asoció a una mayor incidencia de malformaciones fetales en costillas y omóplatos con una dosis ≥9 veces la dosis clínica de 2000 mg, con base en la exposición.
Linagliptina: No se observó ningún resultado adverso en el desarrollo cuando se administró linagliptina a ratas Wistar Han y a conejas Himalaya preñadas durante el periodo de organogénesis en dosis de hasta 240 mg/kg y 150 mg/kg, respectivamente. Estas dosis representan aproximadamente 943 veces (ratas) y 1943 veces (conejas) la dosis clínica de 5 mg, con base en la exposición.
No se observó ningún resultado adverso funcional, conductual ni en la reproducción en las crías tras la administración de linagliptina a ratas hembra Wistar Han desde el día 6 de la gestación hasta el día 21 de la lactancia, a una dosis 49 veces más alta que la dosis clínica de 5 mg, con base en la exposición.
Clorhidrato de metformina: El clorhidrato de metformina no causó efectos adversos en el desarrollo cuando se administró a conejas preñadas en dosis de hasta 600 mg/kg durante el periodo de organogénesis. Esto representa una exposición de aproximadamente 6 veces la dosis clínica de 2000 mg, con base en la superficie corporal.
Lactancia:
Resumen de los riesgos: No existe información sobre la presencia de TRAYENTA® DUO o linagliptina en la leche humana, los efectos en un lactante alimentado con leche materna ni los efectos sobre la producción de leche. Sin embargo, la linagliptina está presente en la leche de ratas. Un número limitado de estudios publicados indican que la metformina está presente en la leche humana [ver Datos]. Sin embargo, no hay suficiente información para determinar los efectos de la metformina en el lactante alimentado con leche materna y no se dispone de información sobre los efectos de la metformina en la producción de leche. Por lo tanto, se deben considerar los beneficios de la lactancia materna para el desarrollo y la salud junto con la necesidad clínica de la madre de recibir TRAYENTA® DUO y los posibles efectos adversos de TRAYENTA® DUO o de la enfermedad materna subyacente en el lactante alimentado con leche materna.
Datos: Los estudios clínicos publicados sobre la lactancia señalan la presencia de metformina en la leche humana, que tuvo como resultado dosis en los lactantes de aproximadamente el 0.11% al 1% de la dosis materna ajustada según el peso y un cociente leche/plasma que varió entre 0.13 y 1. Sin embargo, los estudios no estaban diseñados para establecer en forma definitiva el riesgo del uso de metformina durante la lactancia, debido tamaño reducido de las muestras y a los datos limitados sobre eventos adversos recopilados en los lactantes.
Mujeres y varones con capacidad de procrear: Se debe discutir con las mujeres premenopáusicas la posibilidad de un embarazo no deseado, ya que el tratamiento con metformina puede inducir la ovulación en algunas mujeres con anovulación.
Uso pediátrico: No se ha establecido la seguridad ni la eficacia de TRAYENTA® DUO en pacientes pediátricos menores de 18 años de edad.
Uso geriátrico: La excreción de linagliptina por la vía renal es mínima. Sin embargo, la excreción de metformina por la vía renal es sustancial [ver Advertencias y precauciones (5.1) y Farmacología clínica (12.3)].
Linagliptina: En 15 estudios de diabetes tipo 2 con linagliptina, 1085 pacientes tratados con linagliptina tenían 65 años de edad o más, (incluidos 131 pacientes tratados con linagliptina que tenían 75 años de edad o más). De estos 15 estudios, 12 fueron doble ciego controlados con placebo.
En estos 12 estudios, 591 pacientes tratados con linagliptina tenían 65 años de edad o más (incluidos 82 pacientes tratados con linagliptina que tenían 75 años de edad o más). En estos estudios con linagliptina no se observaron diferencias globales en la seguridad o la efectividad entre los pacientes geriátricos y los pacientes más jóvenes.
Metformina: Los estudios clínicos controlados de metformina no incluyeron una cantidad suficiente de pacientes de edad avanzada para determinar si estos responden de forma diferente a los pacientes más jóvenes. En general, la dosis de un paciente de edad avanzada debe seleccionarse con cuidado, normalmente, comenzando por el extremo inferior del intervalo de dosis, lo que refleja la mayor frecuencia de las funciones hepática, renal o cardíaca disminuidas y de enfermedad concomitante o de otro tratamiento farmacológico, y el mayor riesgo de acidosis láctica. Evaluar la función renal con mayor frecuencia en los pacientes geriátricos [ver Contraindicaciones (4), Advertencias y precauciones (5.1) yFarmacología clínica (12.3)].
Insuficiencia renal: La excreción de metformina por vía renal es sustancial, y el riesgo de acumulación de metformina y de acidosis láctica aumenta con el grado de insuficiencia renal. TRAYENTA® DUO está contraindicado en la insuficiencia renal grave: pacientes con una tasa de filtración glomerular estimada (TFGe) por debajo de 30 mL/min/1.73 m2 [ver Posología y administración (2.2), Contraindicaciones (4), Advertencias y precauciones (5.1) y Farmacología clínica (12.3)].
Si se interrumpe el tratamiento con TRAYENTA® DUO por evidencia de insuficiencia renal, se puede continuar con la administración de linagliptina en una tableta de un solo componente en la misma dosis diaria total de 5 mg. No se recomienda ningún ajuste de la dosis de linagliptina en pacientes con insuficiencia renal.
En el grupo de tratamiento con linagliptina del estudio CARMELINA [ver Estudios clínicos (14.2)], 2200 (63%) pacientes tenían insuficiencia renal (TFGe < 60 mL/min/1.73 m2). Aproximadamente el 20% de la población tenía una TFGe ≥ 45 a < 60 mL/min/1.73 m2, el 28% de la población tenía una TFGe ≥ 30 a < 45 mL/min/1.73 m2 y el 15% tenía una TFGe < 30 mL/min/1.73 m2. La incidencia global de reacciones adversas fue generalmente similar entre los grupos de tratamiento con linagliptina y placebo.
Insuficiencia hepática: El uso de metformina en pacientes con insuficiencia hepática se ha asociado con algunos casos de acidosis láctica. No se recomienda administrar TRAYENTA® DUO a pacientes con insuficiencia hepática [ver Advertencias y precauciones (5.1)].
SOBREDOSIS: En caso de una sobredosis de TRAYENTA® DUO, comunicarse con las autoridades locales. La eliminación de linagliptina por hemodiálisis o diálisis peritoneal resulta poco probable. Sin embargo, la metformina puede dializarse con una depuración de hasta 170 mL/min en buenas condiciones hemodinámicas. Por lo tanto, la hemodiálisis puede ser de utilidad en parte para eliminar la cantidad de metformina acumulada en los pacientes con una presunta sobredosis de TRAYENTA® DUO.
Metformina: Se han producido sobredosis de metformina, que incluyen la ingestión de cantidades superiores a 50 gramos. Se informó hipoglucemia en aproximadamente el 10% de los casos, pero no se ha establecido ninguna asociación causal con la metformina. Se ha informado acidosis láctica en aproximadamente el 32% de los casos de sobredosis de metformina [ver Advertencia destacada y Advertencias y precauciones (5.1)].
DESCRIPCIÓN: TRAYENTA® DUO tabletas contiene 2 fármacos hipoglucemiantes orales utilizados en el tratamiento de la diabetes mellitus tipo 2: linagliptina y clorhidrato de metformina.
Linagliptina: La linagliptina es un inhibidor oralmente activo de la enzima dipeptidil peptidasa-4 (DPP-4).
La linagliptina se describe químicamente como 1H-purina-2,6-diona, 8-[(3R)-3-amino-1 - piperidinil] -7-(2-butin-1-il)-3,7-dihidro-3-metil-1- [(4-metil-2- quinazolinil) metil]-
La fórmula empírica es C25H28N8O2 y el peso molecular es 472.54 g/mol. La fórmula estructural es:
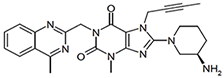
La linagliptina es una sustancia sólida blanca a amarillenta, no higroscópica o solo ligeramente higroscópica. Es muy ligeramente soluble en agua (0.9 mg/mL). La linagliptina es soluble en metanol (aprox. 60 mg/mL), parcialmente soluble en etanol (aprox. 10 mg/mL), muy ligeramente soluble en isopropanol (<1 mg/mL) y muy ligeramente soluble en acetona (aprox. 1 mg/mL).
Clorhidrato de metformina: El clorhidrato de metformina (clorhidrato de diamina N,N-dimetilimidodicarbonimídica) no está relacionado química ni farmacológicamente con ninguna otra clase de agentes antihiperglucémicos orales. El clorhidrato de metformina es un compuesto cristalino de color blanco a blanquecino con una fórmula molecular de C4H11N5• HCl y un peso molecular de 165.63 g/mol. El clorhidrato de metformina es libremente soluble en agua y prácticamente insoluble en acetona, éter y cloroformo. El pKa de la metformina es 12.4. El pH de una solución acuosa al 1% de clorhidrato de metformina es 6.68.
Su fórmula estructural es:
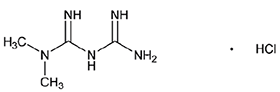
TRAYENTA® DUO está disponible para la administración oral en forma de tabletas que contienen 2.5 mg de linagliptina y 500 mg de clorhidrato de metformina (TRAYENTA® DUO 2.5 mg/500 mg), 850 mg de clorhidrato de metformina (TRAYENTA® DUO 2.5 mg/850 mg) o 1000 mg de clorhidrato de metformina (TRAYENTA® DUO 2.5 mg/1000 mg). Cada tableta de TRAYENTA® DUO recubierta con una película contiene los siguientes ingredientes inactivos: arginina, almidón de maíz, copovidona, dióxido de silicio coloidal, estearato de magnesio, dióxido de titanio, propilenglicol, hipromelosa, talco, óxido férrico amarillo (2.5 mg/500 mg; 2.5 mg/850 mg) y/u óxido férrico rojo (2.5 mg/850 mg; 2.5 mg/1000 mg).
PRESENTACIONES: La disponibilidad de las presentaciones depende de cada país.
Blíster:
• Muestra médica - Caja con 7 tabletas en blíster de 2.5 mg/500 mg, 2.5 mg/850 mg o 2.5 mg/1000 mg.
• Caja con 30 y 60 tabletas en blíster de 2.5 mg/500 mg, 2.5 mg/850 mg o 2.5 mg/1000 mg.
Frasco:
• Muestra médica - Caja con frasco con 14 tabletas 2.5 mg/500 mg, 2.5 mg/850 mg o 2.5 mg/1000 mg.
• Caja con frasco con 30, 60 y 180 tabletas de 2.5 mg/500 mg, 2.5 mg/850 mg o 2.5 mg/1000 mg.
RECOMENDACIONES PARA EL ALMACENAMIENTO: Consérvese a no más de 30 °C.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica.
No se deje al alcance de los niños.
No se use en el embarazo, en la lactancia ni en niños menores de 18 años.
Nombre y domicilio del laboratorio
Hecho en México por:
BOEHRINGER INGELHEIM PROMECO S.A. DE C.V.
Calle del Maíz No. 49, Col. Barrio Xaltocan, C.P. 16090, Deleg. Xochimilco, D.F., México.
® Marca registrada
USPI 0277-11-12
FECHA DE REVISIÓN DE LA MONOGRAFÍA: 30 de Marzo de 2020