
RYALTRIS
MOMETASONA FUROATO, OLOPATADINA
Suspensión nasal
1 Caja, 1 Frasco(s), 56 Pulverizaciones,
1 Caja, 1 Frasco(s), 120 Pulverizaciones,
COMPOSICIÓN:
Composición cualitativa y cuantitativa:
Cada PULVERIZACIÓN contiene:
Hidrocloruro de olopatadina 665 mcg (equivalente a 600 mcg de olopatadina)
Furoato de mometasona 25 mcg
Para consultar la lista completa de excipientes ver sección Forma farmacéutica, concentraciones, composición y envase
Forma farmacéutica, concentraciones, composición y envase:
Tabla 1: Forma farmacéutica, concentraciones,
composición y envase
|
Vía de administración |
Forma farmacéutica/concentración/composición |
Excipientes |
|
Intranasal |
Suspensión para pulverización nasal/665 microgramos de hidrocloruro de olopatadina (equivalente a 600 mcg de olopatadina), y 25 microgramos de furoato de mometasona, por dosis liberada |
Cloruro de benzalconio, carboximetilcelulosa sódica, edetato disódico, ácido clorhídrico (para ajustar el pH), celulosa microcristalina, polisorbato 80, cloruro de sodio, hidróxido de sodio (para ajustar el pH), fosfato dibásico de sodio heptahidratado y agua para inyección. |
Envase:
RYALTRIS® se presenta en un frasco de plástico blanco como se indica a continuación:
- Caja conteniendo frasco con 56 pulverizaciones permite una dosificación de hasta una semana para los adultos, o de dos semanas para los niños.
- Caja conteniendo frasco con 120 pulverizaciones permite una dosificación de hasta dos semanas para los adultos, o de un mes para los niños.
INDICACIONES TERAPÉUTICAS:
Indicaciones:
RYALTRIS® (hidrocloruro de olopatadina y furoato de mometasona en pulverizador nasal) está indicado para el tratamiento sintomático de la rinitis alérgica estacional (RAE) de moderada a grave y los síntomas oculares asociados en adultos, adolescentes y niños a partir de 6 años.
Población pediátrica:
Pediatría (6 años de edad en adelante): Con base en los datos presentados y revisados se ha establecido la seguridad y eficacia de RYALTRIS® para el tratamiento sintomático de la RAE de moderada a grave en pacientes pediátricos de 6 años o más; por lo tanto, se ha autorizado una indicación para el uso pediátrico.
No se recomienda el uso de RYALTRIS® en niños menores de 6 años, ya que no se ha establecido la seguridad y eficacia en este grupo de edad.
Población geriátrica:
Población geriátrica (≥ 65 años de edad): La evidencia de los estudios clínicos y la experiencia sugieren que no es probable que el uso en la población geriátrica se asocie con diferencias en la seguridad o la eficacia.
CONTRAINDICACIONES:
El pulverizador nasal de hidrocloruro de olopatadina y furoato de mometasona está contraindicado en pacientes que:
• Son hipersensibles a este medicamento o a cualquier ingrediente de la formulación, incluyendo cualquier ingrediente no medicinal, o componente del envase. Para consultar la lista completa. Ver sección Forma farmacéutica, concentraciones, composición y envase.
• Presentan infecciones fúngicas, bacterianas o tuberculosas del tracto respiratorio no tratadas.
PRECAUCIONES:
Advertencias y precauciones:
General: Durante la transición de los corticosteroides sistémicos a RYALTRIS®, algunos pacientes pueden experimentar síntomas de abstinencia de los corticosteroides sistémicos (por ejemplo, dolor articular y/o muscular, fatiga y depresión inicial) a pesar del alivio de los síntomas nasales, y necesitarán que se les inste a continuar el tratamiento con RYALTRIS®. Dicha transición también puede desenmascarar afecciones alérgicas preexistentes, como la conjuntivitis alérgica y el eczema, previamente reducidos por el tratamiento con corticosteroides sistémicos.
Conducción y uso de maquinaria:
RYALTRIS® puede causar somnolencia, lo que puede influir en la capacidad para conducir o manejar maquinaria (ver sección Reacciones adversas). En los ensayos clínicos, se ha notificado la aparición de somnolencia en algunos pacientes [4 de 974 pacientes adultos y adolescentes y, ninguno en 225 niños] que se aplicaban RYALTRIS®. Debe evitarse el uso simultáneo de RYALTRIS® con alcohol u otros depresores del sistema nervioso central (SNC), ya que pueden producirse reducciones adicionales del estado de alerta y mayor deterioro del funcionamiento del SNC.
Oído/nariz/garganta:
En los ensayos clínicos de 2 a 52 semanas de duración, se observó hemorragia nasal con mayor frecuencia en los pacientes tratados con RYALTRIS® que en los que recibieron placebo (ver sección Reacciones adversas).
RYALTRIS® no debe utilizarse en caso de infección localizada no tratada que afecte a la mucosa nasal.
Se presentaron infecciones localizadas de la nariz y la faringe con Candida albicans debido a las formulaciones de furoato de mometasona por vía intranasal. Suspender el uso si se desarrolla dicha infección e instituir la terapia adecuada.
Debido al efecto inhibidor de los corticosteroides sobre la cicatrización de las heridas, los pacientes que hayan tenido una cirugía o un traumatismo nasal reciente no deben utilizar un corticosteroide nasal hasta que haya cicatrizado.
Se han notificado casos de úlcera nasal y perforación del tabique nasal en pacientes después de la aplicación intranasal de antihistamínicos. Después del uso de corticosteroides en pulverizador intranasal, se han notificado casos de perforación del tabique nasal en muy raras ocasiones.
Al igual que con cualquier tratamiento a largo plazo, los pacientes que utilizan RYALTRIS® durante varios meses o más deben ser examinados periódicamente para detectar posibles cambios en la mucosa nasal. Si se desarrolla una infección fúngica localizada en la nariz o la faringe, puede ser necesario interrumpir la terapia con RYALTRIS® o aplicar un tratamiento adecuado. La persistencia de la irritación nasofaríngea puede ser una razón para interrumpir RYALTRIS®.
Endocrinología y metabolismo:
Los pacientes que se transfieren de la administración a largo plazo de corticosteroides sistémicamente activos a RYALTRIS® requieren una atención cuidadosa. La suspensión de los corticosteroides sistémicos en estos pacientes puede dar lugar a una insuficiencia suprarrenal durante varios meses hasta la recuperación de la función del eje hipotálamo-hipófisis-suprarrenal (HHS). Si estos pacientes presentan signos y síntomas de insuficiencia suprarrenal, debe reanudarse la administración de corticosteroides sistémicos e instituirse otro tipo de terapia y medidas apropiadas. En general, la mometasona no se asocia con síntomas de supresión del eje HHS.
Inmune:
Los pacientes que reciben corticosteroides y que están inmunodeprimidos tienen que ser prevenidos del riesgo de exposición a ciertas infecciones (por ejemplo, varicela, sarampión) y de la importancia de obtener asesoramiento médico si se produce dicha exposición. La varicela y el sarampión pueden tener un curso más grave o incluso mortal en niños susceptibles o adultos que utilizan corticosteroides. En aquellos pacientes que no han tenido estas enfermedades, se debe tener especial cuidado para evitar la exposición. Se desconoce cómo la dosis, la vía y la duración de la administración de corticosteroides afecta al riesgo de desarrollar una infección generalizada. Tampoco se conoce la contribución de la enfermedad subyacente y/o el tratamiento previo con corticosteroides sobre el riesgo. En caso de exposición a la varicela, se puede indicar la profilaxis con inmunoglobulina contra la varicela zóster (VZIG). Si se expone al sarampión, puede indicarse la profilaxis con inmunoglobulina intramuscular (IG) combinada, según proceda. Si se desarrolla la varicela, puede considerarse el tratamiento con agentes antivirales.
Los corticosteroides pueden enmascarar algunos signos de infección y pueden aparecer nuevas infecciones. Se ha observado una disminución de la resistencia a las infecciones localizadas durante el tratamiento con corticosteroides; esto puede requerir el tratamiento con una terapia adecuada o suspender la administración de RYALTRIS®. Este producto no debe utilizarse en pacientes con tuberculosis de las vías respiratorias (ver sección Contraindicaciones), y debe utilizarse con precaución, si es que se utiliza, en pacientes con infecciones fúngicas o bacterianas locales o sistémicas no tratadas, infecciones virales o parasitarias sistémicas o herpes simple ocular, debido a la posibilidad de que estas infecciones empeoren.
Oftalmología:
Se pueden notificar alteraciones visuales con el uso de corticosteroides sistémicos y tópicos (incluyendo, intranasal, inhalado e intraocular). Si un paciente presenta síntomas como visión borrosa u otras alteraciones visuales, debe considerarse la posibilidad de remitirlo a un oftalmólogo para que evalúe las posibles causas de las alteraciones visuales; éstas pueden ser cataratas, glaucoma o enfermedades raras como la coriorretinopatía serosa central (CSCR) que se han notificado después del uso de corticosteroides sistémicos y tópicos.
Se debe supervisar atentamente a los pacientes con un cambio en la visión o con antecedentes de aumento de la presión intraocular, glaucoma y/o cataratas.
Salud reproductiva:
Potencial femenino y masculino:
Fertilidad: No se han realizado estudios para evaluar el efecto de la administración intranasal de RYALTRIS® sobre la fertilidad humana.
Poblaciones especiales:
Mujeres embarazadas: No se han realizado estudios con RYALTRIS® en mujeres embarazadas.
RYALTRIS® sólo debe utilizarse en mujeres embarazadas, madres en periodo de lactancia o mujeres en edad fértil si el beneficio potencial justifica el riesgo potencial para la madre, el feto o lactante. Los bebés de madres que recibieron corticosteroides durante el embarazo deben ser observados cuidadosamente para detectar hipoadrenalismo.
El hidrocloruro de olopatadina no fue teratogénico en ratas ni en conejos. Sin embargo, el furoato de mometasona, al igual que otros glucocorticoides, es teratógeno en roedores y conejos. Se realizaron estudios de teratología por administración vía oral, tópica (dérmica) y/o subcutánea en ratas, ratones y conejos.
Lactancia: Los glucocorticosteroides se excretan en la leche humana. Se ha identificado olopatadina en la leche de ratas en periodo de lactancia después de su administración oral. No puede excluirse un riesgo para los recién nacidos/niños.
Se desconoce si el hidrocloruro de olopatadina y/o sus metabolitos o el furoato de mometasona y/o sus metabolitos administrados por vía intranasal, se excretan en la leche materna humana. RYALTRIS® debe ser utilizado por madres en periodo de lactancia sólo si el beneficio potencial para la paciente supera los riesgos potenciales para el lactante.
Pediatría: No se ha establecido la seguridad y eficacia de RYALTRIS® en niños menores de 6 años. No se dispone de datos.
Los corticosteroides intranasales pueden causar una desaceleración en la velocidad de crecimiento cuando se administran a pacientes pediátricos. Se debe controlar de forma rutinaria el crecimiento de los pacientes pediátricos que reciben RYALTRIS®.
Geriatría: Los ensayos clínicos de RYALTRIS® incluyeron un pequeño número de pacientes de 65 años o más. Con base en los datos disponibles para RYALTRIS®, no se prevé un ajuste de dosis de RYALTRIS® en pacientes geriátricos (ver sección Posología y formas de administración).
REACCIONES ADVERSAS:
Generalidades de las reacciones adversas:
Las reacciones adversas más frecuentes observadas en los ensayos clínicos con RYALTRIS® son disgeusia, cefalea, hemorragia nasal y molestias nasales. No se observaron nuevos hallazgos clínicamente significativos en comparación con el hidrocloruro de olopatadina o el furoato de mometasona solos. El perfil de seguridad de RYALTRIS® es el habitual que se observa con los medicamentos intranasales de su misma clase.
Reacciones adversas en los ensayos clínicos:
Los ensayos clínicos se realizan en condiciones muy específicas. Las tasas de reacciones adversas observadas en los ensayos clínicos, por lo tanto, pueden no reflejar las tasas observadas en la práctica y no deben ser comparadas con las tasas de los ensayos clínicos de otro medicamento. La información sobre las reacciones adversas de los ensayos clínicos puede ser útil para identificar y aproximar las tasas de reacciones adversas a medicamentos en el mundo real.
Rinitis alérgica estacional en adolescentes y adultos:
La base de datos de seguridad de los ensayos clínicos de RYALTRIS® consiste en un total de 3,062 pacientes inscritos en cuatro estudios (tres pivotales y uno no pivotal) de dos semanas de duración, aleatorizados, doble ciego y controlados con placebo en pacientes con rinitis alérgica estacional (RAE). Los pacientes fueron tratados con dos pulverizaciones por fosa nasal de RYALTRIS®, dos veces al día.
Los eventos adversos emergentes del tratamiento (EAET) para RYALTRIS® y los otros brazos de tratamiento se agruparon en los cuatro estudios clínicos.
Se notificaron disgeusia, hemorragia nasal y molestias nasales en ≥ 1% de los pacientes tratados con RYALTRIS® y con una incidencia mayor que la del placebo (Tabla 2).
Tabla 2: Eventos adversos emergentes del tratamiento notificados en ≥ 1% de los pacientes tratados con RYALTRIS® y con una mayor incidencia que la del placebo en estudios de RAE de 14 días, sólo tratamientos BID-Conjunto de análisis de seguridad:
|
Clasificación por órganos y sistemas |
Placebo BID |
RYALTRIS® BID |
Hidrocloruro de olopatadina BID (N = 751)a n (%)b |
Furoato de mometasona BID (N = 746)a n (%)b |
|
Término preferido |
||||
|
Trastornos del sistema nervioso |
||||
|
Disgeusia |
2 (0.3) |
24 (3.0) |
16 (2.1) |
0 |
|
Trastornos del sistema respiratorio, torácico y mediastino |
||||
|
Hemorragia nasal |
5 (0.6) |
8 (1.0) |
11 (1.5) |
6 (0.8) |
|
Molestia nasal |
6 (0.8) |
8 (1.0) |
4 (0.5) |
4 (0.5) |
BID = dos veces al día; RAE: rinitis alérgica estacional.
a N = Número total de pacientes en cada grupo de tratamiento en el Conjunto de los Análisis de Seguridad.
b n = Número de pacientes con eventos adversos en cada Término Preferente (TP) de MedDRA; Número (%) de pacientes con RA, en orden alfabético para el TP y según la Clasificación por Órganos y Sistemas (SOC). Los porcentajes se basan en el número total de pacientes en el conjunto de seguridad dentro de cada grupo de tratamiento. Nota: Los eventos adversos se codificaron utilizando MedDRA versión 20.0.
Ensayo de seguridad a largo plazo en adultos y adolescentes:
Un estudio de seguridad controlado con placebo de 52 semanas, incluyó un total de 593 pacientes con rinitis alérgica perenne (RAP) en el conjunto de análisis de seguridad. Un total de 326 pacientes fueron expuestos a RYALTRIS® durante 6 meses y 250 fueron expuestos a RYALTRIS® durante 1 año.
Los EAET notificados para ≥ 2% de los pacientes tratados con RYALTRIS® y con una incidencia mayor que para el placebo con un pH 3.7 (que coincide con el pH de RYALTRIS®) fueron: infección de las vías respiratorias altas, hemorragia nasal, cefalea, molestias nasales, infección viral de las vías respiratorias altas, infección del tracto urinario, tos y disgeusia (Tabla 3).
Tabla 3: Eventos adversos emergentes del tratamiento notificados por ≥ 2% de los pacientes tratados con RYALTRIS® y con una mayor incidencia que la del placebo pH 3.7* en el estudio de seguridad de 52 semanas-Conjunto de análisis de seguridad
|
Término preferente MedDRA |
Placebo pH 3.7 (N = 99)a n (%)b |
RYALTRIS® BID |
|---|---|---|
|
Infección de las vías respiratorias altas |
6 (6.1) |
25 (6.4) |
|
Hemorragia nasal |
2 (2.0) |
18 (4.6) |
|
Cefalea |
3 (3.0) |
16 (4.1) |
|
Molestias nasales |
2 (2.0) |
11 (2.8) |
|
Infección viral de las vías respiratorias altas |
2 (2.0) |
9 (2.3) |
|
Infección de las vías urinarias |
2 (2.0) |
9 (2.3) |
|
Tos |
2 (2.0) |
9 (2.3) |
|
Disgeusia |
0 |
8 (2.0) |
MedDRA = Diccionario Médico para Actividades Reguladoras.
a N = Número total de pacientes en cada grupo de tratamiento en el Conjunto de los Análisis de Seguridad.
b n = Número de pacientes con eventos adversos en cada Término Preferente (TP) de MedDRA; los porcentajes se basan en el número total de pacientes en el conjunto de seguridad dentro de cada grupo de tratamiento. Nota: Los eventos adversos se codificaron utilizando MedDRA (versión 18.1).
*Mismo pH que RYALTRIS®.
Reacciones adversas del ensayo clínico-pediatría:
Los datos de seguridad descritos a continuación en niños de 6 a 11 años de edad reflejan la exposición a RYALTRIS® en 225 pacientes con rinitis alérgica estacional (RAE) inscritos en un estudio de 2 semanas, doble ciego, aleatorizado, de grupos paralelos y controlado con placebo. Los pacientes del estudio fueron tratados con una pulverización de RYALTRIS® en cada fosa nasal, dos veces al día.
Los EAET notificados con mayor frecuencia (≥ 1% en cualquier grupo de tratamiento) fueron considerados por el investigador como potencialmente relacionados con RYALTRIS® o el placebo en el ensayo clínico controlado de RAS (Tabla 4).
Tabla 4: Resumen de los EAETs con una incidencia
de ≥ 1.0% en cualquier grupo de tratamiento
en niños de 6 a 11 años de edad
|
Término preferente MedDRA |
Placebo |
RYALTRIS® |
|
Hemorragia nasal |
0 |
3 (1.3) |
|
Disgeusia |
3 (1.4) |
1 (0.4) |
|
Examen de oídos, nariz y garganta con resultados anómalos |
2 (0.9) |
3 (1.3) |
MedDRA = Diccionario Médico para Actividades Reguladoras; EAET = Evento adverso emergente al tratamiento.
a N = Número total de pacientes en cada grupo de tratamiento en el Conjunto de los Análisis de Seguridad.
b n = Número de pacientes con eventos adversos en cada Término Preferente (TP) de MedDRA; los porcentajes se basan en el número total de pacientes en el conjunto de seguridad dentro de cada grupo de tratamiento. Nota: Los eventos adversos se codificaron utilizando MedDRA (versión 21.0).
Reacciones adversas menos frecuentes en los ensayos clínicos:
Las siguientes reacciones adversas adicionales relacionadas con el tratamiento se produjeron en ensayos clínicos en pacientes que utilizaban RYALTRIS® con una incidencia de < 1% y se produjeron con una incidencia mayor que la del placebo*:
Trastornos generales y condiciones del lugar de administración: Fatiga.
Trastornos del sistema nervioso: Somnolencia.
Trastornos respiratorios, torácicos y mediastínicos: Hemorragia nasal, irritación de garganta.
*Eventos adversos reportados por más de 1 paciente.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones medicamentosas:
Resumen de las interacciones medicamentosas:
No se han realizado estudios puntuales sobre las interacciones medicamentosas con RYALTRIS®. Se espera que cualquier interacción con otros medicamentos de la combinación de olopatadina y furoato de mometasona refleje las de los componentes individuales.
Olopatadina:
Los estudios in vitro han demostrado que la olopatadina no inhibe las reacciones metabólicas que implican a las isoenzimas del citocromo P-450 (1A2, 2C8, 2C9, 2C19, 2D6, 2E1 y 3A4). La olopatadina se une moderadamente a las proteínas plasmáticas (aproximadamente un 55%). Estos resultados indican que es poco probable que la olopatadina cause interacciones con otros medicamentos administrados de forma concomitante.
Furoato de mometasona:
Los estudios han demostrado que el furoato de mometasona se metaboliza principal y extensamente en el hígado de todas las especies investigadas y experimenta un amplio metabolismo a múltiples metabolitos sin que se detecten metabolitos importantes en el plasma. El furoato de mometasona se metaboliza por el CYP3A4.
Se espera que el tratamiento combinado con inhibidores del CYP3A aumente el riesgo de efectos secundarios de los corticosteroides sistémicos. La combinación debe evitarse a menos que el beneficio supere el aumento del riesgo de efectos secundarios de los corticosteroides sistémicos, en cuyo caso los pacientes deben ser observados para detectar los efectos secundarios de los corticosteroides sistémicos.
Debe evitarse el uso simultáneo de RYALTRIS® con alcohol u otros depresores del sistema nervioso central, ya que pueden producirse reducciones adicionales del estado de alerta y un deterioro adicional del funcionamiento del sistema nervioso central.
Interacciones medicamento-medicamento:
Los medicamentos que se presentan en esta tabla se basan en informes de casos o estudios de interacciones de medicamentos, o en interacciones potenciales debido a la magnitud y gravedad esperada de la interacción (es decir, los que se identifican como contraindicados).
Tabla 5: Interacciones entre medicamentos establecidas o potenciales
|
Nombre propio/común |
Origen de las pruebas |
Efecto |
Comentario clínico |
|
Inhibidores del CYP3A (por ejemplo, ketoconazol, itraconazol, claritromicina, atazanavir, indinavir, nelfinavir, saquinavir, ritonavir, productos que contienen cobicistat). |
Estudio de caso |
Después de la administración oral de ketoconazol, un potente inhibidor de CYP3A4, la concentración plasmática media del furoato de mometasona inhalado por vía oral aumentó, y los niveles de cortisol en plasma aparentemente disminuyeron. |
Se espera que el tratamiento combinado con inhibidores de CYP3A aumente el riesgo de efectos secundarios sistémicos. La combinación debe evitarse a menos que el beneficio supere el riesgo elevado de efectos secundarios sistémicos de los corticosteroides, en cuyo caso los pacientes deben ser observados para detectar los efectos secundarios sistémicos de los corticosteroides. |
Interacciones con alimentos:
No se han establecido interacciones con los alimentos.
Interacciones con hierbas:
No se han establecido interacciones con productos herbales.
Interacciones con pruebas de laboratorio:
No se han establecido interacciones con las pruebas de laboratorio.
FARMACOLOGÍA CLÍNICA:
Código ATC: R01AD59.
Mecanismo de acción:
RYALTRIS® contiene tanto hidrocloruro de olopatadina como furoato de mometasona; por lo tanto, los mecanismos de acción descritos a continuación para los componentes individuales se aplican a RYALTRIS®. Éstos representan dos clases diferentes de medicamentos (antagonistas del receptor de la histamina tipo H1 y corticosteroide sintético).
Hidrocloruro de olopatadina:
La olopatadina es un antagonista H1. La actividad antihistamínica de la olopatadina se ha documentado en tejidos aislados, modelos animales y seres humanos.
Furoato de mometasona:
El furoato de mometasona es un glucocorticosteroide con propiedades antiinflamatorias locales a dosis mínimamente activas a nivel sistémico.
Farmacodinámica:
Hidrocloruro de olopatadina:
Efectos cardiacos:
En un estudio de 12 meses en 429 pacientes con rinitis alérgica perenne tratados con hidrocloruro de olopatadina en monoterapia nasal, 665 mcg por pulverización, 2 pulverizaciones por fosa nasal dos veces al día, no se observaron evidencias de ningún efecto de hidrocloruro de olopatadina sobre la prolongación del intervalo QT.
Furoato de mometasona monohidrato:
En dos estudios clínicos en los que se utilizó la provocación nasal con antígenos, el furoato de mometasona monohidratado en pulverizador nasal acuoso mostró una actividad antiinflamatoria en las respuestas alérgicas de fase temprana y tardía. Esto se ha demostrado por la disminución (frente al placebo) de la histamina y la actividad de los eosinófilos y la reducción (frente al valor inicial) de los eosinófilos, los neutrófilos y las proteínas de adhesión de las células epiteliales.
Farmacocinética:
Absorción: Después de la administración de RYALTRIS® (2660 mcg de hidrocloruro de olopatadina y 100 mcg de furoato de mometasona), por vía intranasal, liberando 2 pulverizaciones en cada fosa nasal dos veces al día en pacientes con rinitis alérgica estacional, la media (± desviación estándar) de la exposición plasmática máxima (Cmáx) fue de 19.80 ± 7.01 ng/ml para olopatadina y 9.92 ± 3.74 pg/ml para el furoato de mometasona, y la exposición media durante el régimen de dosificación (AUCtau) fue de 88.77 ± 23.87 ng/ml*hr para la olopatadina y 58.40 ± 27.00 pg/ml*hr para el furoato de mometasona. La mediana del tiempo de exposición máxima a partir de una dosis única fue de 1 hora tanto para la olopatadina como para el furoato de mometasona.
Se estimó que la biodisponibilidad sistémica de la olopatadina y el furoato de mometasona de RYALTRIS®, después de la administración intranasal, era comparable a la de los pulverizadores nasales de hidrocloruro de olopatadina y furoato de mometasona administrados en monoterapia.
Distribución:
La unión a proteínas de la olopatadina fue moderada, aproximadamente del 55% en suero humano, e independiente de la concentración del medicamento en un intervalo de 0.1 a 1000 ng/ml. La olopatadina se une predominantemente a la albúmina sérica en el cuerpo humano.
La unión a proteínas in vitro para el furoato de mometasona fue del 98% al 99% en un rango de concentración de 5 a 500 ng/ml.
Metabolismo: La olopatadina no se metaboliza extensamente. Según los perfiles de metabolitos plasmáticos después de la administración oral de [14C] olopatadina, en el plasma del cuerpo humano circulan al menos 6 metabolitos menores.
La olopatadina representa el 77% del máximo de radiactividad plasmática total y todos los metabolitos ascendieron a < 6% combinados. Dos de éstos se identificaron como N-óxido de olopatadina y N-desmetil olopatadina. En estudios in vitro con isoenzimas CYP en humanos expresadas mediante ADNc y monooxigenasas que contienen flavina (FMO), la formación de N-desmetil olopatadina (Ml) fue catalizada en su mayor parte por CYP3A4, mientras que el N-óxido de olopatadina (M3) fue catalizado principalmente por FMO1 y FMO3. La olopatadina a concentraciones de hasta 33900 ng/ml no inhibió el metabolismo in vitro de sustratos específicos para CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1 y CYP3A4. No se ha evaluado el potencial de la olopatadina y sus metabolitos para actuar como inductores de las enzimas CYP.
Los estudios han demostrado que cualquier porción de una dosis de furoato de mometasona que se ingiere y absorbe sufre de un metabolismo extensivo a múltiples metabolitos. No hay metabolitos significativos detectables en plasma. Después de la incubación in vitro, uno de los metabolitos menores formados es el 6β-hidroxi-mometasona furoato. En los microsomas hepáticos en humanos, la formación del metabolito está regulada por la CYP3A4.
Eliminación: Después de la administración intranasal de una dosis única de una combinación de olopatadina y furoato de mometasona (2660 mcg de HCl de olopatadina y 200 mcg de furoato de mometasona), las medias de las semividas de eliminación de olopatadina y furoato de mometasona fueron de 8.63 y 18.11 horas, respectivamente.
La olopatadina se elimina principalmente por excreción urinaria. Aproximadamente el 70% de una dosis oral de hidrocloruro de olopatadina [14C] se recuperó en la orina y el 17% en las heces. Del material relacionado con el medicamento que se recuperó en las primeras 24 horas en la orina, el 86% era olopatadina no modificada, y el resto estaba compuesto por N-óxido de olopatadina y N-desmetil olopatadina.
El furoato de mometasona absorbido se excreta en forma de metabolitos, principalmente a través de la bilis y, en menor medida, en la orina.
Poblaciones y condiciones especiales:
Pediatría: El modelado farmacocinético sugiere rangos comparables de estimaciones de exposición en niños de 6 a 11 años de edad en comparación con los valores de exposición en adolescentes y adultos, cuando se utilizan las dosis recomendadas para cada grupo de edad. No se ha investigado la farmacocinética de RYALTRIS® en pacientes menores de 6 años (ver sección Advertencias y precauciones).
Geriatría: Con base en el análisis farmacocinético poblacional entre pacientes de 65 años de edad y mayores, la farmacocinética de olopatadina y furoato de mometasona en RYALTRIS® no se vio afectada por la edad.
Género: Con base en el análisis farmacocinético poblacional, la farmacocinética de olopatadina y furoato de mometasona en RYALTRIS® no se vio afectada por el género.
Raza: Según el análisis farmacocinético poblacional, la farmacocinética de olopatadina y furoato de mometasona en RYALTRIS® no se vio afectada por la raza.
Insuficiencia hepática: No se realizó ningún estudio farmacocinético específico que examinara el efecto de la insuficiencia hepática con RYALTRIS®. El metabolismo de la olopatadina es una vía de eliminación menor. La administración de una dosis única inhalada de 400 mcg de furoato de mometasona a pacientes con insuficiencia hepática leve (n = 4), moderada (n = 4) y grave (n = 4) dio lugar a que sólo 1 o 2 pacientes de cada grupo presentaran concentraciones plasmáticas máximas detectables de furoato de mometasona (que oscilaban entre 50 y 105 pcg/ml). Las concentraciones plasmáticas máximas observadas parecían aumentar con la gravedad de la insuficiencia hepática; sin embargo, el número de niveles detectables fue bajo.
Insuficiencia renal: Los valores medios de Cmáx para olopatadina después de dosis intranasales únicas no fueron significativamente diferentes entre los pacientes sanos (18.1 ng/ml) y pacientes con insuficiencia renal leve, moderada y grave (entre 15.5 y 21.6 ng/ml). El valor medio del área bajo la curva de concentración plasmática del medicamento frente al tiempo (AUC0-12) fue 2 veces superior en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min/1.73 m2). En estos pacientes, las concentraciones plasmáticas máximas en estado estacionario de olopatadina fueron aproximadamente 10 veces inferiores a las observadas después de dosis orales más elevadas, 20 mg dos veces al día, que fueron bien toleradas.
No se han investigado específicamente los efectos de la insuficiencia renal sobre la farmacocinética del furoato de mometasona.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y formas de administración:
Consideraciones sobre la dosis: Se observa un alivio de los síntomas alérgicos nasales en los 15 minutos siguientes a la administración de RYALTRIS®. Sin embargo, dado que el efecto completo de RYALTRIS® depende de su uso regular, debe indicarse a los pacientes la inhalación nasal en intervalos regulares.
Dosis recomendadas y ajuste de dosis:
Adultos y adolescentes (mayores de 12 años): La dosis recomendada de RYALTRIS® es de dos pulverizaciones en cada fosa nasal, dos veces al día (mañana y noche).
Niños (6 a 11 años de edad): La dosis recomendada de RYALTRIS® es de una pulverización en cada fosa nasal, dos veces al día (por la mañana y por la noche).
Poblaciones especiales:
Mujeres embarazadas y lactancia: RYALTRIS® debe utilizarse durante el embarazo sólo si el beneficio potencial supera el riesgo potencial para el feto, especialmente durante el primer trimestre del embarazo. RYALTRIS® debe utilizarse durante la lactancia sólo si el beneficio potencial supera el riesgo potencial para los recién nacidos/bebés (ver sección Advertencias y precauciones).
Pediatría: No se recomienda el uso de RYALTRIS® en niños menores de 6 años, ya que no se ha establecido la seguridad y eficacia en este grupo de edad.
Geriatría: Con base en los datos disponibles para RYALTRIS®, no se prevé un ajuste de dosis de RYALTRIS® en pacientes geriátricos (ver sección Advertencias y precauciones). En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, comenzando por lo general en el nivel más bajo del rango de dosificación, reflejando la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otros tratamientos farmacológicos.
Insuficiencia hepática: No se han realizado estudios específicos con RYALTRIS® en pacientes con insuficiencia hepática. La información disponible para el furoato de mometasona y el hidrocloruro de olopatadina no ha indicado la necesidad de ajustar la dosis en pacientes con insuficiencia hepática.
Insuficiencia renal: No se han realizado estudios específicos con RYALTRIS® en pacientes con insuficiencia renal.
Administración:
Administrar RYALTRIS® sólo por vía intranasal. Evitar rociar RYALTRIS® en los ojos o en la boca. Agitar bien el frasco durante un mínimo de 20 segundos antes de cada uso.
Después de cada uso, el paciente debe limpiar la punta del pulverizador con un papel o paño limpio y seco, y luego volver a tapar el frasco con el tapón protector hasta que quede ajustado.
Preparación:
Prepare RYALTRIS® antes de su uso inicial liberando 6 pulverizaciones. Cuando RYALTRIS® no se haya utilizado durante 7 días o más, se debe volver a preparar liberando 2 pulverizaciones o hasta que se forme una ligera niebla.
Omisión de dosis:
Si se omite una dosis única, la siguiente dosis debe aplicarse cuando corresponda. No debe administrarse una dosis doble al mismo tiempo.
PROPIEDADES FARMACÉUTICAS:
Información farmacéutica:
Principio activo:
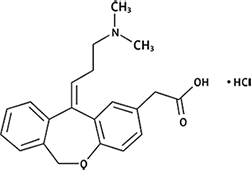
Nombre propio: Hidrocloruro de olopatadina.
Nombre químico: Ácido dibenz[b,e]oxepin-2-acético, 11-[3-(dimetilamino)propilideno]-6,11-dihidro-, hidrocloruro, (Z)-
o,
Ácido 11-[(Z)-3-(dimetilamino)propilideno]-6,11-dihidrodibenzo[b,e]oxepin-2-acético, hidrocloruro
Fórmula molecular: C21H23NO3• HCl;
Masa molecular: 373.87 g mol-1
Fórmula estructural:
Principio activo:
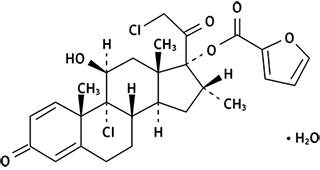
Nombre propio: Furoato de Mometasona Monohidrato
Nombre químico: [(8S,9R,10S,11S,13S,14S,16R,17R)-9-cloro-17-(2-cloroacetil)-11-hidroxi-10,13,16-trimetil-3-oxo-6,7,8,11,12,14,15,16-octahidrociclopenta[a]fenantren-17-il] furan-2-carboxilato;hidrato
o,
9,21-Dicloro-11β,17-dihidroxi-16α-metilpregna-1,4-dieno-3,20-diona 17-(2-furoato) monohidrato
Fórmula moleculares: C27H30Cl2O6• H2O
Masa molecular: 539.45 g mol-1
Fórmula estructural:
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis:
RYALTRIS® contiene hidrocloruro de olopatadina y furoato de mometasona; por lo tanto, los riesgos asociados a la sobredosis de los componentes individuales descritos a continuación se aplican a este producto.
Hidrocloruro de olopatadina:
Los síntomas de la sobredosis de antihistamínicos pueden incluir somnolencia en los adultos e, inicialmente, agitación e inquietud, seguidos de somnolencia en los niños. No se conoce ningún antídoto específico para RYALTRIS®. Si ocurre una sobredosis, se recomienda un tratamiento sintomático o de apoyo, teniendo en cuenta cualquier medicamento que se haya ingerido al mismo tiempo.
Furoato de mometasona:
Debido a que la biodisponibilidad sistémica es < 1% (utilizando un ensayo de sensibilidad con un límite inferior de cuantificación de 0.25 pg/ml) después de la administración de furoato de mometasona con RYALTRIS®, es poco probable que la sobredosis requiera cualquier otro tratamiento que no sea la observación, seguido de la administración de la dosis adecuada prescrita.
Para el control de una presunta sobredosis de medicamentos, contacte a su centro regional de control de intoxicaciones.
PRESENTACIÓN:
Caja conteniendo frasco con 56 pulverizaciones.
Caja conteniendo frasco con 120 pulverizaciones.
Titular de la autorización de comercialización:
LATIN FARMA, S.A.
Guatemala
Fabricante:
Glenmark Pharmaceuticals Limited
India
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Almacenamiento, estabilidad y eliminación:
Consérvese a temperatura inferior a 30 °C. Proteger de la luz. No congelar ni refrigerar.
Mantener fuera del alcance de los niños.
BIBLIOGRAFÍA:
1 La información detallada y actualizada de este medicamento está disponible en la página Web de la Autoridad de Canadá (Health Canada) https://pdf.hres.ca/dpd_pm/00067564.PDF
2 NASONEX® (Pulverizador nasal de solución acuosa que contiene furoato de mometasona monohidrato, 50 mcg/aerosol dosificador), Control de Presentación No. 256864, Monografía del Producto, Organon Canada Inc. (21 de marzo de 2022). [Mometasone furoate monohydrate aqueous nasal spray, 50 mcg/metered spray]
3 PATANOL® (Solución oftálmica de hidrocloruro de olopatadina, 0.1% p/v olopatadina como hidrocloruro de olopatadina), Control de Presentación NO. 211652, Monografía del Producto, Novartis Pharmaceuticals Canada Inc. (Mar 2, 2018) [Olopatadine Hydrochloride Ophthalmic Solution].