
ROSUGRAS
ROSUVASTATINA
Tabletas recubiertas
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA recubierta contiene:
Rosuvastatina cálcica
Equivalente a 10 mg y 20 mg de rosuvastatina
Excipiente cbp una tableta
Estructura y nombre químico del principio activo:
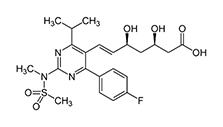
Fórmula molecular: C44H54CaF2N6O12S2 Nombre Químico: Rosuvastatina
Fórmula: (E,3R,5S)-7-[4-(4-fluorofenil)-2-(metil-metilsulfonilamino)-6-propan-2-ylpirimidin-5-yl]- 3,5- dihidroxihepta-6-enoato de calcio
Peso molecular: 1001.14 g/mol
INDICACIONES TERAPÉUTICAS:
Indicaciones y uso clínico:
Hipercolesterolemia
Adultos:
ROSUGRAS® (rosuvastatina cálcica) está indicado como complemento de la dieta, por lo menos al equivalente a la Tabla III de Tratamiento de Adultos (dieta TLC ATP III), para la reducción de colesterol total elevado (Total-C), LDL-C, ApoB, el porcentajeTotal-C/HDL-C y triglicéridos (TG) y para aumentar el HDL-C; En condiciones hiperlipidémicas y dislipidémicas, cuando la respuesta a la dieta y el ejercicio solo ha sido inadecuado, incluyendo:
• La hipercolesterolemia primaria (tipo IIa, incluidas las Hipercolesterolemia no familiar grave)
• Dislipidemia combinada (mixta) (Tipo IIb)
• Hipercolesterolemia familiar homocigótica en la que se utiliza ROSUGRAS® ya sea solo o como un complemento a la dieta y otros tratamientos hipolipemiantes como la aféresis
FARMACOCINÉTICA:
Absorción:
ROSUGRAS® se administra oralmente tras lo cual la rosuvastatina, el resto del activo, se absorbe rápidamente, alcanzando su concentración plasmática máxima de 3 a 5 horas después de la dosificación.
Tanto la concentración máxima (Cmax) como el área bajo la curva de concentración plasmática-tiempo (AUC) en proporción a la dosis de rosuvastatina. La biodisponibilidad absoluta de rosuvastatina es aproximadamente 20% y no hay acumulación en dosis repetidas. La rosuvastatina cálcica puede administrase con o sin alimentos. La administración por la mañana o por la noche no afectó la tasa y el grado de absorción ni la capacidad de la rosuvastatina para reducir el LDL-C.
Distribución:
La rosuvastatina se somete a una extracción de primer paso en el hígado, que es el sitio primario del colesterol síntesis y eliminación de LDL-C. El volumen medio de distribución en estado estacionario de rosuvastatina es de aproximadamente 134 litros. La rosuvastatina está aproximadamente un 90% ligada a las proteínas plasmáticas, principalmente a la albúmina. Esta unión es reversible e independiente de las concentraciones plasmáticas.
Metabolismo:
La rosuvastatina no se metaboliza ampliamente con aproximadamente el 10% de una dosis radiomarcada recuperado como metabolito. El principal metabolito es la N-desmetil rosuvastatina, que se forma principalmente por el citocromo P450 2C9, y en los estudios in vitro ha demostrado tener aproximadamente la mitad de la actividad inhibidora de HMG-CoA reductasa de rosuvastatina. El principal compuesto representa más del 87% del activo circulante HMG-Coa inhibidor de la actividad reductasa
Excreción:
Después de una dosis oral, la rosuvastatina y sus metabolitos se excretan principalmente en las heces (90%) y el resto se excreta en la orina. La recuperación fecal representa el fármaco absorbido, metabolitos en la bilis y fármaco no absorbido. La semivida de eliminación (t½) de rosuvastatina es aproximadamente 19 horas y no aumenta con dosis crecientes.
Información Farmacodinámica:
Estudios epidemiológicos, clínicos y experimentales han establecido que el alto contenido de LDL-C, bajo HDL-C y el TG plasmático alto promueven la aterosclerosis humana y son factores de riesgo para el desarrollo de enfermedad cardiovascular. Algunos estudios también han demostrado que la relación C/HDL-C total es el mejor predictor de la enfermedad coronaria.
En contraste, el aumento de los niveles de HDL-C se asocian con una disminución del riesgo cardiovascular. Terapias con fármaco reducen los niveles de LDL-C o disminuyen TG mientras simultáneamente aumentan el HDL-C que han demostrado reducciones en las tasas de mortalidad y morbilidad cardiovasculares.
Detalles de farmacología
Farmacología humana:
Rosuvastatina cálcica disminuye el colesterol total elevado (Total-C), LDL-C, TG y aumenta HDL-C en pacientes con hipercolesterolemia familiar homocigótica (FH), formas no familiares de hipercolesterolemia y dislipidemia mixta. En estos pacientes, la rosuvastatina cálcica también disminuye la apoliproteina B, nonHDL-C, VLDL-TG, el LDL-C/HDL-C, TOTAL – C/HDL-C, nonHDL-C/HDL-C, proporción ApoB / ApoA-I y aumenta la ApoA-I.
Una respuesta terapéutica a la rosuvastatina cálcica es evidente dentro de una semana después del inicio de la terapia y el 90% de la respuesta máxima se obtiene generalmente después de 2 semanas. La respuesta máxima es generalmente alcanzada en 4 semanas y se ha mantenido en los pacientes de los ensayos clínicos hasta 1 año.
CONTRAINDICACIONES:
La rosuvastatina está contraindicada en pacientes con hipersensibilidad conocida a cualquier componente de la fórmula. Rosuvastatina está contraindicado en pacientes con enfermedad hepática activa.
Rosuvastatina está contraindicado durante el embarazo, en periodo de lactancia y en mujeres con potencial de concebir que no utilicen medidas anticonceptivas adecuadas.
PRECAUCIONES Y ADVERTENCIAS:
Hígado: como con otros inhibidores de la reductasa de HMG-CoA, la rosuvastatina debe utilizarse con precaución en pacientes que consuman cantidades excesivas de alcohol y/o que tengan antecedentes de enfermedad hepática.
Musculosquelético: como con otros inhibidores de HMG-CoA, se han reportado efectos en el músculo esquelético, como mialgia no complicada, miopatía y raramente rabdomiólisis en pacientes tratados con rosuvastatina. Al igual que con otros inhibidores de la HMG-CoA reductasa, la frecuencia de reportes de rabdomiólisis es mayor cuanto más alta es la más alta. En aquellos pacientes que desarrollen cualquier signo o síntoma indicativo de miopatía, se deberán determinar los niveles de CK.
La administración de rosuvastatina debe suspenderse si los niveles de CK (Creatin fosfoquinasa) están considerablemente elevados (> 10xULN) o si se diagnostica o sospecha miopatía.
No se tiene evidencia de aumento de los efectos musculosqueléticos cuando rosuvastatina se administró con otra terapia concomitante. Sin embargo, se sabe de mayor incidencia de miositis y miopatía en pacientes que reciben otros inhibidores de HMG-CoA reductasa junto con ciclosporina, derivados de ácido fíbrico incluyendo gemfibrosilo; ácido nicotínico; antimicóticos azoles y antibióticos macrólidos.
Rosuvastatina debe prescribirse con precaución en pacientes con factores predisponentes a miopatía, como disfunción renal, edad avanzada e hipotiroidismo o bien en situaciones donde puedan ocurrir aumentos en los niveles plasmáticos.
La rosuvastatina debe suspenderse temporalmente en cualquier paciente que presente una condición seria aguda sugerente de miopatía o con predisposición a desarrollar insuficiencia renal secundaria a rabdomiólisis como sepsis, hipotensión, cirugía mayor, traumatismos, trastornos metabólicos graves, alteraciones endocrinas, desórdenes electrolíticos o en status epilepticus.
Raza: Los estudios farmacocinéticos han mostrado un incremento en la concentración plasmática de rosuvastatina en sujetos asiáticos en comparación con sujetos caucásicos.
ABUSO Y ADICCIÓN:
No aplica por el tipo de medicamento y el uso al que está destinado.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: No se ha establecido la seguridad con rosuvastatina durante el embarazo y la lactancia. Las mujeres con potencial de concebir deben utilizar medidas anticoncepcionales adecuadas y efectivas.
EFECTOS ADVERSOS:
Rosuvastatina generalmente es bien tolerada.
Los eventos adversos observados por lo general son leves y transitorios y se cuantifican de acuerdo a la siguiente convención:
Comunes (= 1/100, < 1/10); Poco comunes (= 1/1.000, < 1/100) Raras (= 1/10 000, < 1/1.000); Muy raros (<1/10 000)
Sistema músculo esquelético:
Comunes: mialgia, miopatía (incluyendo miositis).
Raras: se han presentado casos de rabdomiolisis ocasionalmente asociados con deterioro de la función renal.
Muy raro: artralgia.
Sistema tegumentario:
Poco comunes: prurito, erupción cutánea y urticaria. Aparato inmunológico:
Raras: reacciones de hipersensibilidad incluyendo angioedema. Aparato digestivo y anexos:
Raras: pancreatitis, incremento en transaminasas hepáticas. Comunes: estreñimiento, náusea, dolor abdominal.
Muy raros: ictericia, hepatitis.
Trastornos del sistema nervioso:
Muy raro: pérdida de la memoria. Otros:
Comunes: cefalea, astenia, mareo.
Niños y adolescentes de 10 a 17 años de edad:
El perfil de seguridad de Rosuvastatina es similar en pacientes niños, adolescentes y adultos, aunque fueron observados más frecuencia el incremento en los niveles de Creatin fosfoquinasa (CK) > 10 x Límite normal superior (ULN) y síntomas musculares después del ejercicio o del aumento en la actividad física, estos efectos se resolvieron con tratamiento continuo se deben de aplicar las mismas advertencias y precauciones especiales que para uso en adultos.
Al igual que con otros inhibidores de la HMG-CoA reductasa, la incidencia de reacciones adversas al medicamento tiende a aumentar con dosis altas.
No se han observado efectos adversos sobre el cristalino ni deterioro de la función adrenocortical.
EFECTOS EN LA HABILIDAD PARA CONDUCIR U OPERAR MAQUINARIA: No hay evidencia de un efecto sedante y no se espera que la rosuvastatina afecte la capacidad de manejar u operar maquinaria.
INTERACCIONES:
Warfarina: la farmacocinética de warfarina no se afecta considerablemente después de la coadministración con rosuvastatina, no obstante, al igual que otros inhibidores de HMG-CoA reductasa, la coadministración de rosuvastatina y warfarina puede dar como resultado un aumento en INR (International Normalized Ranges) o en los tiempos de coagulación en comparación con warfarina sola.
En pacientes que reciben antagonistas de la vitamina K, se recomienda el monitoreo del INR, tanto al inicio como al término de la terapia con rosuvastatina o después de un ajuste de la dosis.
Ciclosporina: la coadministración de rosuvastatina con ciclosporina puede dar como resultado cambios no significativos en la concentración plasmática de ciclosporina. Sin embargo, el ABC (0-t) para rosuvastatina en estado estable puede aumentar hasta 7 veces más.
Gemfibrosilo: el uso concomitante de rosuvastatina y gemfibrosilo da como resultado un aumento de 2 veces en la Cmáx y ABC(0-t) de rosuvastatina.
Inhibidores de proteasa:
Se ha observado aumento de la exposición sistémica a rosuvastatina en pacientes que reciben concomitantemente varios inhibidores de la proteasa. Se deberá considerar el beneficio en la reducción de lípidos mediante el uso de rosuvastatina en pacientes con VIH que reciben inhibidores de proteasa y el aumento potencial de las concentraciones plasmáticas de rosuvastatina hasta el momento de iniciar la valoración con dosis de rosuvastatina en pacientes tratados con inhibidores de proteasa.
Antiácidos:
La dosificación simultánea de rosuvastatina con una suspensión antiácida conteniendo hidróxido de aluminio y magnesio provoca una disminución de aproximadamente 50% en la concentración plasmática de rosuvastatina. Este efecto disminuye cuando el antiácido se administra 2 horas después de rosuvastatina. No se ha estudiado la relevancia clínica de esta interacción.
Enzimas del citocromo P450: Rosuvastatina no tiene interacciones clínicamente significativas con el citocromo P450 (como sustrato, inhibidor o inductor).
Otros medicamentos:
No hay interacciones clínicamente significativas con anticonceptivos orales, digoxina, ezetimibe o fenofibrato. No se ha observado ninguna evidencia de interacciones adversas clínicamente significativas al administrar rosuvastatina con agentes antihipertensivos, antidiabéticos y terapia de reemplazo hormonal.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Como con otros inhibidores de HMG-CoA reductasa, se ha observado un aumento relacionado con la dosis, en las transaminasas hepáticas y CK así como aumento de la Hemoglobina glicosilada (HbA1c) en un pequeño número de pacientes que recibieron rosuvastatina.
Se han observado pruebas de urianálisis anormales (prueba con tira reactiva positiva para proteinuria) en un pequeño número de pacientes que han recibido rosuvastatina y otros inhibidores de HMG-CoA reductasa. La proteína detectada fue principalmente de origen tubular. En la mayoría de los casos la proteinuria disminuye o desaparece espontáneamente al continuar la terapia y no es predictiva de enfermedad renal aguda o progresiva.
En Panamá: Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o mala absorción de glucosa o galactosa no deben tomar este medicamento.
DOSIS Y ADMINISTRACIÓN: Oral
Los pacientes deben ser colocados en una dieta estándar para bajar el colesterol (al menos equivalente para el Tratamiento III (dieta TLC ATP III)) antes de recibir ROSUGRAS® (rosuvastatina Calcica), y debe continuar con esta dieta durante el tratamiento con ROSUGRAS®. Si es Apropiado, debe implementarse un programa de control de peso y ejercicio físico.
Antes de iniciar el tratamiento con ROSUGRAS®, deben excluirse las causas secundarias de elevaciones en los niveles de lípidos plasmáticos. También debe realizarse un perfil lipídico.
ROSUGRAS® puede tomarse por la mañana o por la noche, con o sin alimentos.
Dosis recomendada y ajuste de dosis:
Adultos Hipercolesterolemia:
El rango de dosis de ROSUGRAS® es de 5 a 40 mg por vía oral una vez al día. La dosis inicial recomendada de ROUGRAS en la mayoría de los pacientes es de 10 mg por vía oral una vez al día. La mayoría de los pacientes se controlan a la dosis de 10 mg. Si es necesario, se puede ajustar la dosis a intervalos de 2-4 semanas. La respuesta máxima se logra habitualmente dentro de 2-4 semanas y es mantenido durante la terapia crónica
La iniciación del tratamiento con ROSUGRAS® 5 mg una vez al día puede ser considerado para pacientes que requieren reducciones menos agresivas del LDL-C o que tienen factores predisponentes para miopatía.
Los pacientes que se cambian a ROSUGRAS® del tratamiento con otro HMG-CoA Reductasa se debe iniciar con 10 mg, incluso si se encontraban en una dosis alta del anterior Inhibidor de HMGCoA reductasa. Se puede considerar una dosis de 20 mg para pacientes con Hipercolesterolemia severa.
Para los pacientes con hipercolesterolemia severa (incluyendo aquellos con Hipercolesterolemia), puede considerarse una dosis inicial de 20 mg. Estos pacientes deben ser cuidadosamente seguidos.
Una dosis de 40 mg una vez al día sólo debe utilizarse en pacientes con hipercolesterolemia severa que no logran el efecto deseado sobre 20 mg y no tienen factores predisponentes para miopatía / rabdomiólisis. La consulta con un especialista es recomendado al iniciar la dosis de 40 mg de ROSUGRAS®.
La dosificación de ROSUGRAS® debe individualizarse de acuerdo con la línea base LDL-C, Total de la relación C / HDL-C y / o los niveles de TG para lograr los valores recomendados de lípidos deseados en la dosis más baja posible.
Consideraciones de Dosis en Poblaciones Especiales:
Pacientes con insuficiencia hepática:
El intervalo de dosis habitual se aplica en pacientes con insuficiencia hepática de leve a moderada. Aumentado la exposición sistémica se ha observado en pacientes con insuficiencia hepática grave y, por lo tanto, en estos pacientes la dosis de ROSUGRAS® no debe exceder de 20 mg una vez al día.
Pacientes con Insuficiencia Renal:
El intervalo de dosis habitual se aplica en pacientes con insuficiencia renal leve a moderada. Aumentado una exposición sistémica se ha observado a rosuvastatina en pacientes con insuficiencia renal grave. En pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml / min / 1.73 m2) la dosis inicial de ROSUGRAS® debe ser de 5 mg y no exceder de 10 mg una vez al día.
Raza:
La dosis inicial de ROSUGRAS®, en pacientes asiáticos, debe ser de 5 mg una vez al día. El potencial aumento de la exposición sistémica debe ser considerado al tomar decisiones de tratamiento. La dosis máxima no debe exceder de 20 mg de ROSUGRAS® una vez al día.
ROSUGRAS® no es para uso en niños y adolescentes menores de 18 años de edad.
Uso en ancianos:
No es necesario ajustar la dosis en los ancianos.
Polimorfismos genéticos:
Se han mostrado genotipos de SLCO1B1 (OATP1B1) c.521CC y ABCG2 (BCRP) c.421AA Para asociarse con un aumento en la exposición a la rosuvastatina (AUC) en comparación con SLCO1B1 c.521TT y ABCG2 c.421CC. Para los pacientes que se sabe que tienen el genotipo c.521CC o c.421AA, se recomienda una dosis máxima de 20 mg de ROSUGRAS® una vez al día.
Terapia concomitante:
La rosuvastatina es un sustrato de diversas proteínas transportadoras (por ejemplo, OATP1B1 y BCRP). El riesgo de miopatía (incluyendo rabdomiolisis) aumenta cuando ROSUGARS es Administrado concomitantemente con ciertos medicamentos que pueden aumentar la concentración plasmática de rosuvastatina debido a interacciones con estas proteínas transportadoras (por ejemplo, ciclosporina y ciertos inhibidores de proteasa incluyendo combinaciones de ritonavir con atazanavir, darunavir, lopinavir, Y / o tipranavir,).
Siempre que sea posible, se deben considerar los medicamentos alternativos y, si es necesario, Suspender temporalmente la terapia con calcio de rosuvastatina. En situaciones en las que la coadministración de estos medicamentos con ROSUGRAS® es inevitable, el beneficio y el riesgo del tratamiento concomitante y los ajustes de dosificación de calcio de rosuvastatina deben ser cuidadosamente considerados.
RECOMENDACIÓN EN CASO DE SOBREDOSIFICACIÓN SEGÚN EL PERFIL TOXICOLÓGICO:
No hay un tratamiento específico en el caso de sobredosis.
Debe tratarse al paciente de manera sintomática y deben instituirse medidas generales de apoyo de acuerdo a necesidades para mantener las constantes vitales en rangos aceptables.
Es poco probable que la hemodiálisis aporte algún beneficio.
CONDICIONES DE ALMACENAMIENTO:
Consérvese a temperatura ambiente a no más de 30 °C y en lugar seco.
FECHA DE REVISIÓN DE LA MONOGRAFÍA: 09 de mayo de 2017
LISTADO DE REFERENCIAS BIBLIOGRÁFICAS:
1. Monografía de Canadá No de control 185532, 07 octubre 2015 Apotex, Canadá.
2. Martindale The Complete Drug Reference. Part I Monographs on Drugs and ancillary substances. Cardiovascular Drugs.Rosuvastatin. 2006; pp 1249, 35va Ed. Pharmaceutical Press
3. USP Dispensing Information. Rosuvastatin, Systemic. Vol. I Monographs. 2007 pp 2645-2649, 26th Ed. Thomson Micromedex
4. Mijeong S Pharmacokinetic Interaction Between Rosuvastatin and Telmisartan in Healthy Korean Male Volunteers: A Randomized, Open-label, Two-period, Crossover, Multiple-dose Study Clinical Therapeutics 2014;36(8):1148-1158
5. Hanaa A. Safety and vasopressor effect of rosuvastatin in septic patients Egyptian Journal of Anaesthesia 2014;30:311–317
6. Jun Li J Impact of 10 mg rosuvastatin daily or alternate-day on lipid profile and inflammatory markers Clinica Chimica Acta 2012;413:139-142
7. Savarese G. Effects of atorvastatin and rosuvastatin on renal function: A meta-analysis International Journal of Cardiology 2013;167:2482–2489
8. Silveira PC. The beneficial effects of rosuvastatin are independent of zinc supplementation in patients with atherosclerosis Journal of Trace Elements in Medicine and Biology 2014;28:194–199
9. Galani VJ In vivo and In vitro Drug Interactions Study of Glimepride with Atorvastatin and Rosuvastatin J Young Pharm. 2010;2(2):196-200
10. Rogers J - Effect of Rosuvastatin on Repeat Heart Failure Hospitalizations. The CORONA Trial (Controlled Rosuvastatin Multinational Trial in Heart Failure) JACC: Heart Failure 2014;2(3):289–297
11. Gounari P Rosuvastatin but not ezetimibe improves endothelial function in patients with heart failure, by mechanisms independent of lipid lowering, International Journal of Cardiology 2010;142:87–91
12. Han Y Short-Term Rosuvastatin Therapy for Prevention of Contrast-Induced Acute Kidney Injury in Patients With Diabetes and Chronic Kidney Disease, Journal of the American College of Cardiology 2014;63(1):62-70
13. Joo B S Effect of Rosuvastatin on Coronary Flow Reserve in Patients With Systemic Hypertension Am J Cardiol 2014;114:1234-1237
14. Binbrek A S. Rosuvastatin versus atorvastatin in achieving lipid goals in patients at high risk for cardiovascular disease in clinical practice: A randomized, open-label, parallel-group, multicenter study (DISCOVERY Alpha study), Curr Ther Res Clin Exp. 2006;67(1):21-43.
15. Welty FK. A Comparison of Statin Therapies in Hypercholesterolemia in Women: A Subgroup Analysis of the STELLAR Study. J Womens Health (Larchmt). 2016;25(1):50-56.
16. Brown WV et al Therapies on the horizon for cholesterol reduction. Clin Cardiol. 2001;24(8 Suppl):24-27.
17. Olsson A G. A new statin: a new standard. Am J Manag Care. 2001 May;7(5 Suppl):S152-4.
18. Fox K M.Comparison of Low-density Lipoprotein Cholesterol Reduction After Switching Patients on Other Statins to Rosuvastatin or Simvastatin in a Real-world Clinical Practice Setting Am J Manag Care. 2007;13(10):270-275
19. Ballantyne CM Statin therapy alters the relationship between apolipoprotein B and low-density lipoprotein cholesterol and non-high-density lipoprotein cholesterol targets in high-risk patients: the MERCURY II (Measuring Effective Reductions in Cholesterol Using Rosuvastatin) trial. Am Coll Cardiol;2008;52(8):626-632.
20. SECURITY DATA Rosuvastatin Calcium Salt sc-208316 SUPPLIER Company: Santa Cruz Biotechnology, Inc. Address: 2145 Delaware Ave Santa Cruz, CA 95060. 2010
Categoría terapéutica según clasificación ATC: C10AA07
Forma de preparación: No aplica.
Documento preparado por el Departamento de Apotex, México
MAYO 2017
APOTEX Inc.