
RISPERDAL
RISPERIDONA
Comprimidos recubiertos
Caja, 2 Blíster de PVC aluminio, 10 Comprimidos recubiertos, 1 Miligramos
Caja, 6 Blíster de PVC aluminio, 10 Comprimidos recubiertos, 1 Miligramos
Caja, 2 Blíster de PVC aluminio, 10 Comprimidos recubiertos, 2 Miligramos
Caja, 6 Blíster de PVC aluminio, 10 Comprimidos recubiertos, 2 Miligramos
Caja, 2 Blíster de PVC aluminio, 10 Comprimidos recubiertos, 3 Miligramos
Caja, 6 Blíster de PVC aluminio, 10 Comprimidos recubiertos, 3 Miligramos
Caja, 2 Blíster de PVC aluminio, 10 Comprimidos recubiertos, 4 Miligramos
Caja, 6 Blíster de PVC aluminio, 10 Comprimidos recubiertos, 4 Miligramos
Caja, 4 Blíster de PVC aluminio, 7 Comprimidos recubiertos, 6 Miligramos
Caja , 4 Blíster de PVC aluminio , 7 Comprimidos recubiertos , 6 Miligramos
FORMAS FARMACÉUTICAS Y CONCENTRACIONES:
Comprimidos recubiertos para uso oral:
— 1 mg de risperidona en forma de comprimidos oblongos semirranurados de color blanco (con la marca RIS 1);
— 2 mg de risperidona en forma de comprimidos oblongos semirranurados de color naranja (con la marca RIS 2);
— 3 mg de risperidona en forma de comprimidos oblongos semirranurados de color amarillo (con la marca RIS 3);
— 4 mg de risperidona en forma de comprimidos oblongos semirranurados de color verde (con la marca RIS 4);
— 6 mg de risperidona en forma de comprimidos biconvexos circulares de color amarillo (con la marca RIS 6).
Solución oral de 1 mg/ml:
Cada COMPRIMIDO contiene 1, 2, 3, 4 o 6 mg de risperidona.
La solución oral contiene 1 mg/ml de risperidona.
Consulte los excipientes en la Lista de excipientes.
INDICACIONES: RISPERDAL® está indicado para el tratamiento de una amplio gama de pacientes con esquizofrenia, incluido el primer episodio psicótico, las exacerbaciones agudas de la esquizofrenia, la esquizofrenia crónica y otras enfermedades psicóticas con predominio de síntomas positivos (como alucinaciones, delirios, alteraciones del pensamiento, hostilidad, desconfianza) y/o negativos (como afecto aplanado, aislamiento emocional y social, lenguaje pobre). RISPERDAL® también alivia los síntomas afectivos (como la depresión, los sentimientos de culpa o la ansiedad) asociados a la esquizofrenia. En pacientes adultos que muestran respuesta inicial a esta terapia, el tratamiento continuado con RISPERDAL® mantiene la mejoría clínica.
RISPERDAL® está indicado en el tratamiento de episodios maníacos asociados a trastornos bipolares. Estos episodios se caracterizan por síntomas tales como un estado de ánimo irritable, expansivo o elevado, autoestima exagerada, menor necesidad de dormir, habla apresurada, pensamientos desbocados, tendencia a la distracción o escasa capacidad de juicio, con comportamientos problemáticos o agresivos.
RISPERDAL® está indicado en el tratamiento de alteraciones del comportamiento en pacientes con demencia, en los que predominan los síntomas de agresividad (estallidos verbales, violencia física) o de alteraciones de la actividad (agitación, conducta errática), o síntomas psicóticos.
RISPERDAL® está indicado en el tratamiento de trastornos conductuales y de comportamientos problemáticos en los que predominan la agresividad y otros comportamientos perjudiciales. RISPERDAL® también es efectivo para mantener la mejoría clínica durante el tratamiento continuado en niños y adolescentes que hayan mostrado una respuesta inicial al tratamiento.
PROPIEDADES FARMACOLÓGICAS:
Propiedades farmacodinámicas: La risperidona es un antagonista monoaminérgico selectivo que posee propiedades únicas. Tiene una gran afinidad por los receptores serotoninérgicos 5-HT2 y dopaminérgicos D2. La risperidona se une además a los receptores alfa1-adrenérgicos y, con menor afinidad, a los receptores H1-histaminérgicos y alfa2-adrenérgicos.
Carece de afinidad por los receptores colinérgicos. Aunque la risperidona es un potente antagonista D2 que se considera que mejora los síntomas positivos de la esquizofrenia, provoca menos depresión de la actividad motora e inducción de catalepsia que los neurolépticos clásicos. El equilibrio entre el antagonismo central de la serotonina y la dopamina puede reducir la susceptibilidad a los efectos secundarios extrapiramidales y extender la actividad terapéutica del fármaco a los síntomas negativos y afectivos de la esquizofrenia.
Propiedades farmacocinéticas: La risperidona se absorbe completamente después de su administración oral, alcanzando concentraciones plasmáticas máximas en un plazo de 1 a 2 horas. Su absorción no se modifica con la ingesta, por lo que la risperidona se puede administrar con o sin alimentos.
La risperidona es metabolizada por la CYP 2D6 a 9-hidroxi-risperidona, que posee una actividad farmacológica similar a la de la risperidona. La risperidona y la 9-hidroxi-risperidona forman la fracción antipsicótica activa. Otra vía metabólica de la risperidona es la N-desalquilación.
Tras la administración oral a pacientes psicóticos, la risperidona se elimina con una semivida aproximada de 3 horas. La semivida de eliminación de la 9-hidroxirisperidona y de la fracción antipsicótica activa es de 24 horas.
El estado de equilibrio de la risperidona se alcanza en el plazo de un día en la mayoría de los pacientes. El estado de equilibrio de la 9-hidroxi-risperidona se alcanza a los 4-5 días de tratamiento. Las concentraciones plasmáticas de la risperidona son proporcionales a la dosis, dentro del intervalo terapéutico.
La risperidona se distribuye con rapidez. El volumen de distribución es de 1-2 l/kg.
En el plasma, la risperidona se une a la albúmina y a la glicoproteína ácida alfa 1. La risperidona se une a las proteínas plasmáticas en un 88%, mientras que la 9-hidroxirisperidona lo hace en un 77%.
El 70% de la dosis se excreta en la orina y el 14% en las heces, una semana después de su administración. En la orina, la risperidona y la 9-hidroxi-risperidona representan el 35-45% de la dosis. El resto son metabolitos inactivos.
Un estudio de dosis única mostró la presencia de mayores concentraciones plasmáticas del principio activo y una reducción de la depuración de la fracción antipsicótica activa del 30% en pacientes ancianos y del 60% en pacientes con insuficiencia renal. Las concentraciones plasmáticas de risperidona fueron normales en pacientes con insuficiencia hepática, pero la fracción libre media de risperidona en el plasma aumentó aproximadamente un 35%.
La farmacocinética de la risperidona, de la 9-hidroxi-risperidona y de la fracción con actividad antipsicótica en niños es similar a la observada en adultos.
RISPERDAL® Solución oral es bioequivalente a RISPERDAL® Comprimidos orales.
Datos no-clínicos: En estudios de toxicidad (sub) de larga duración en los que se inició el tratamiento en ratas y perros sexualmente inmaduros, se observaron efectos dependientes de la dosis en el aparato genital y las glándulas mamarias de machos y hembras. Estos efectos obedecían al aumento secundario de la prolactina sérica que resultaba del bloqueo de los receptores dopaminérgicos D2 de la risperidona. En un estudio de toxicidad con ratas jóvenes, se observó un aumento de la mortalidad de cachorros cachorro y un retraso en el desarrollo físico. En un estudio de 40 semanas con los perros jóvenes, la maduración sexual se retrasó. El crecimiento de huesos largos no se vio afectado a dosis similares a la dosis máxima en humanos en adolescentes (6 mg/día); se observaron efectos a dosis 4 veces (a partir del AUC) o 7 veces (en mg/m2) la dosis máxima en humanos en adolescentes.
Todos los demás datos de seguridad, de interés para quien prescribe el medicamento se han incluido en la sección pertinente.
DATOS FARMACÉUTICOS:
Lista de excipientes:
— Comprimidos recubiertos:
— Núcleo del comprimido:
• Lactosa monohidrato
• Almidón de maíz
• Celulosa microcristalina
• Hipromelosa 2910 15 mPa.s(e)
• Estearato de magnésico
• Sílice coloidal anhidro
• Laurilsulfato sódico
— Cubierta pelicular:
• Hipromelosa 2910 5 mPa.s
• Propilenglicol
• Dióxido de titanio(a)
• Talco(a)
• Amarillo quinolina(b)
• Laca de disulfonato de indigotina-aluminio(c)
• Laca de aluminio S amarillo anaranjado(d)
— Solución oral:
• Ácido tartárico
• Ácido benzoico
• Hidróxido de sodio
• Agua purificada
(a) Solamente en comprimidos de 2 mg, 3 mg, 4 mg y 6 mg.
(b) Solamente en comprimidos de 3 mg, 4 mg y 6 mg.
(c) Solamente en comprimidos de 4 mg.
(d) Solamente en comprimidos de 2 mg y 6 mg.
(e) Solamente en comprimidos de 1 mg, 2 mg, 3 mg y 4 mg.
Incompatibilidades:
— RISPERDAL® Comprimidos: Ninguna.
— RISPERDAL® Solución oral: Incompatible con el té.
Período de validez: Observe la fecha de caducidad en el embalaje exterior.
Condiciones de almacenamiento:
— RISPERDAL® Comprimidos se debe almacenar entre 15 °C y 30 °C.
— RISPERDAL® Solución oral se debe almacenar entre 15 °C y 30 °C y debe evitarse que se congele.
Manténgase fuera del alcance de los niños.
CONTRAINDICACIONES: RISPERDAL® está contraindicado en pacientes con hipersensibilidad conocida a este medicamento.
ADVERTENCIAS Y PRECAUCIONES:
Pacientes ancianos con demencia:
— Mortalidad global: Los pacientes ancianos con demencia tratados con antipsicóticos atípicos presentan mayor mortalidad que los tratados con placebo, según un meta-análisis de 17 ensayos controlados sobre antipsicóticos atípicos, incluido RISPERDAL®. En los estudios controlados con placebo, realizados con RISPERDAL® por vía oral en esta población, la incidencia de mortalidad fue del 4,0% entre los pacientes tratados con RISPERDAL® y del 3,1% entre los pacientes tratados con placebo. La edad promedio de los pacientes que fallecieron fue de 86 años, con un intervalo de entre 67 y 100 años.
— Uso concomitante de furosemida: En los ensayos controlados con placebo realizados con RISPERDAL® por vía oral en pacientes ancianos con demencia, se observó una mayor incidencia de mortalidad entre los que recibieron furosemida más risperidona (7,3%; edad promedio 89 años con un intervalo de 75 a 97) que entre los que recibieron risperidona sola (3,1%; edad promedio 84 años con un intervalo de 70 a 96) o furosemida sola (4,1%; edad promedio 80 años con un intervalo de 67 a 90). Se observó un aumento de la mortalidad en pacientes tratados con furosemida más risperidona en dos de los cuatro estudios clínicos.
No se ha identificado ningún mecanismo fisiopatológico que explique este resultado y no se ha observado un patrón consistente en las causas de mortalidad. Sin embargo, se debe tener precaución y sopesar los riesgos y beneficios de esta combinación antes de tomar la decisión de usarla. La incidencia de mortalidad no aumentó en los pacientes que tomaban otros diuréticos simultáneamente con risperidona.
Independientemente del tratamiento, la deshidratación fue un factor global de riesgo de mortalidad y por lo tanto, ésta se debe evitar cuidadosamente en pacientes ancianos con demencia.
— Eventos Adversos Cerebrovasculares (EAC): Durante los estudios controlados con placebo, realizados en pacientes ancianos con demencia, hubo mayor incidencia de eventos adversos cerebrovasculares (accidentes cerebrovasculares y ataques isquémicos transitorios), incluida la muerte, entre los pacientes (edad promedio 85 años, con un intervalo de 73 a 97) tratados con RISPERDAL® por vía oral que en los que recibieron un placebo.
Hipotensión ortostática: Debido a la actividad alfa bloqueante de la risperidona, puede aparecer hipotensión (ortostática), en especial en las fases iniciales de titulación de la dosis. Se han observado casos de hipotensión clínicamente significativa durante la experiencia posterior a la comercialización, con el uso concomitante de risperidona y un tratamiento antihipertensivo. RISPERDAL® se debe utilizar con precaución en pacientes con enfermedades cardiovasculares (por ejemplo, insuficiencia cardíaca, infarto de miocardio, anomalías de la conducción, deshidratación, hipovolemia o enfermedad cerebrovascular), y se debe titular gradualmente la dosis según las recomendaciones (véase Posología y forma de administración). En caso de hipotensión, debe considerarse la posibilidad de reducir la dosis.
Leucopenia, neutropenia y agranulocitosis: Con los fármacos antipsicóticos, incluido RISPERDAL®, se han comunicado episodios de leucopenia, neutropenia y agranulocitosis. Durante la vigilancia postcomercialización, a agranulocitosis se ha comunicado muy raramente (<1/10000 pacientes). Se debe controlar a los pacientes con antecedentes de recuento leucocitario significativamente bajo o de leucopenia/neutropenia inducida por fármacos, durante los primeros meses de tratamiento, y considerar la interrupción de RISPERDAL® al primer signo de una reducción clínicamente significativa en el recuento leucocitario, en ausencia de otros factores causantes.
En pacientes con neutropenia clínicamente significativa se deben controlar cuidadosamente la fiebre y otros síntomas de infección, y tratarlos con prontitud, si éstos se presentan. Los pacientes con neutropenia grave (recuento absoluto de neutrófilos < 1 x 109/l) deben suspender RISPERDAL® y se debe monitorizar sus niveles de leucocitos hasta la recuperación.
Tromboembolismo venoso: Se han comunicado casos de tromboembolismo venoso (TEV) con el uso de fármacos antipsicóticos. Dado que los pacientes tratados con antipsicóticos a menudo presentan factores de riesgo de TEV adquiridos, se deben identificar todos los posibles factores de riesgo de TEV antes y durante el tratamiento con RISPERDAL®, así como tomar medidas preventivas.
Discinesia tardía/síntomas extrapiramidales (DT/SEP): Los fármacos con propiedades antagonistas de los receptores dopaminérgicos han sido relacionados con la inducción de discinesia tardía, caracterizada por movimientos rítmicos involuntarios, sobre todo de la lengua y/o de la cara. Se ha observado que la aparición de síntomas extrapiramidales supone un factor de riesgo de desarrollar discinesia tardía. Dado que el RISPERDAL® conlleva un menor riesgo de inducir síntomas extrapiramidales que los neurolépticos clásicos, también tendría menor riesgo de inducir discinesia tardía. Si aparecen signos y síntomas de discinesia tardía, se debe considerar la interrupción de todos los fármacos antipsicóticos.
Síndrome neuroléptico maligno (SNM): Se ha informado la aparición del síndrome neuroléptico maligno, caracterizado por hipertermia, rigidez muscular, inestabilidad autónoma, trastorno de la conciencia y elevación de los niveles de creatina fosfoquinasa, en relación con la administración de antipsicóticos. Otros signos pueden ser la mioglobinuria (rabdomiólisis) y la insuficiencia renal aguda. En este caso, se interrumpirán todos los antipsicóticos, incluido el RISPERDAL®.
Enfermedad de Parkinson y demencia con cuerpos de Lewy: El médico deberá sopesar los riesgos y los beneficios de prescribir antipsicóticos, incluido RISPERDAL®, a los pacientes con enfermedad de Parkinson o demencia con cuerpos de Lewy (DCL), ya que ambos grupos pueden presentar un mayor riesgo de padecer síndrome neuroléptico maligno y mayor sensibilidad a la medicación antipsicótica. Las manifestaciones de esta mayor sensibilidad incluyen desorientación, obnubilación e inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
Hiperglucemia y diabetes mellitus: Se han registrado casos de hiperglucemia, diabetes mellitus o empeoramiento de una diabetes preexistente durante el tratamiento con RISPERDAL®. Evaluar la relación entre el uso de antipsicóticos atípicos y las anomalías en la glucosa es complicado, debido a la posibilidad de que los pacientes con esquizofrenia tengan un mayor riesgo intrínseco de sufrir diabetes mellitus y dada la creciente incidencia de la diabetes mellitus en la población general. Debido a estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia aún no se comprende totalmente. Se debe vigilar a todo paciente tratado con antipsicóticos atípicos, incluido RISPERDAL®, en busca de síntomas de hiperglucemia y de diabetes mellitus. (Véase también Reacciones adversas).
Aumento de peso: Se han registrado aumentos significativos de peso. Se recomienda controlar el aumento de peso cuando se utiliza RISPERDAL®.
Intervalo QT: Al igual que con otros antipsicóticos, se debe actuar con precaución al prescribir RISPERDAL® a pacientes con antecedentes de arritmias cardíacas, a pacientes con síndrome de QT largo congénito o al utilizar fármacos que prolongan el intervalo QT de forma concomitante.
Priapismo: Se ha comunicado que fármacos con efecto bloqueante alfa-adrenérgico inducen priapismo. Se han notificado casos de priapismo con RISPERDAL® durante la vigilancia posterior a su comercialización (véase Reacciones adversas).
Regulación de la temperatura corporal: Se ha atribuido a algunos agentes antipsicóticos, la alteración de la capacidad del organismo para reducir la temperatura corporal central. Se recomienda tomar las precauciones adecuadas al prescribir RISPERDAL® a pacientes que van a experimentar situaciones que aumenten la temperatura corporal central, como ejercicio extenuante, exposición a calor extremo o medicación anticolinérgica concomitante, así como a los que estén sujetos a deshidratación.
Efecto antiemético: En los estudios preclínicos se observó que la risperidona tenía un efecto antiemético.
Este efecto, si se produce en los seres humanos, puede enmascarar los signos y síntomas de la sobredosis de algunos medicamentos o de condiciones tales como obstrucción intestinal, síndrome de Reye, o tumores cerebrales.
Convulsiones: Al igual que otros fármacos antipsicóticos, RISPERDAL® se debe utilizar con precaución en pacientes con antecedentes de convulsiones o de otros trastornos que puedan reducir el umbral de convulsiones.
Síndrome del iris flácido intraoperatorio: El Síndrome del iris flácido intraoperatorio (IFIS) se ha observado durante la cirugía de cataratas en pacientes tratados con medicamentos de efecto antagonista sobre los adrenérgicos alfa 1a, incluido el RISPERDAL® (véase Reacciones adversas).
El IFIS puede incrementar el riesgo de complicaciones oculares quirúrgicas y posquirúrgicas. Debe advertirse al cirujano oftalmólogo del consumo actual o pasado de medicamentos con efecto antagonista sobre los adrenérgicos alfa 1a antes de la cirugía. No se ha establecido el beneficio potencial derivado de interrumpir la terapia de bloqueadores de alfa 1a antes de la cirugía de cataratas y deberá compararse con el riesgo que implica la interrupción de la terapia antipsicótica .
Otros: Consulte la sección Posología y forma de administración para recomendaciones específicas sobre la posología en pacientes de edad avanzada, en pacientes de edad avanzada con demencia, en pacientes con manía bipolar, en pacientes pediátricos con trastornos de conducta y otros trastornos perturbadores del comportamiento y en pacientes con insuficiencia renal o hepática.
EMBARAZO, LACTANCIA Y FERTILIDAD: No se ha establecido la seguridad del RISPERDAL® durante el embarazo en seres humanos. Aunque, en animales experimentales, la risperidona no mostró toxicidad reproductiva directa, se observaron algunos efectos indirectos mediados por la prolactina y el SNC. La risperidona no mostró efectos teratógenos en ninguno de los estudios.
Los neonatos expuestos a fármacos antipsicóticos (incluido RISPERDAL®) durante el tercer trimestre de embarazo, corren el riesgo de sufrir síntomas extrapiramidales y/o síntomas de abstinencia de intensidad variada, después del parto. Estos síntomas, en los neonatos, pueden incluir agitación, hipertonía, hipotonía, temblores, somnolencia, distrés respiratorio y trastornos alimentarios.
RISPERDAL® sólo se debe usar durante el embarazo si los beneficios superan a los riesgos.
En estudios con animales, se ha observado que la risperidona y la 9-hidroxirisperidona pasan a la leche. Se ha comprobado que tanto la risperidona como la 9-hidroxi-risperidona también pasan a la leche materna humana. Por lo tanto, las mujeres que estén recibiendo RISPERDAL® no deben amamantar.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: RISPERDAL® puede afectar a las actividades que requieran alerta mental. Por lo tanto, se debe aconsejar a los pacientes que no conduzcan ni utilicen maquinaria hasta que se conozca su sensibilidad individual.
REACCIONES ADVERSAS:
Datos de ensayos clínicos: Se evaluó la seguridad de RISPERDAL® a partir de la base de datos obtenida de ensayos clínicos en los que participaron 9803 pacientes que recibieron una o más dosis de RISPERDAL® para el tratamiento de diversos trastornos psiquiátricos en adultos, ancianos con demencia y pacientes pediátricos. De estos 9803 pacientes, 2687 habían recibido RISPERDAL® durante su participación en ensayos dobles ciegos, controlados con placebo. Las condiciones y la duración del tratamiento con RISPERDAL® fueron muy variables e incluyeron (en categorías que se superponían) estudios dobles ciegos, de dosis fijas y flexibles, controlados con placebo o con comparador activo, y las fases abiertas de algunos estudios, pacientes hospitalizados y ambulatorios y exposiciones a corto plazo (hasta 12 semanas) y largo plazo (hasta tres años).
La mayoría de las reacciones adversas fueron de intensidad leve a moderada.
Datos dobles ciegos, controlados con placebo: pacientes adultos: La tabla 1 muestra las reacciones adversas al medicamento (RAM) registradas en el ≥ 1% de los pacientes adultos tratados con RISPERDAL® en nueve ensayos dobles ciegos y controlados con placebo, de 3 a 8 semanas de duración.
|
Tabla 1. Reacciones adversas al medicamento registradas en ≥ 1% de los pacientes adultos tratados con RISPERDAL® en los estudios dobles ciegos y controlados con placebo. |
|||
|
Clase de órgano o sistema Reacción adversa |
RISPERDAL® ≤8 mg/día (N = 853) % |
RISPERDAL® >8-16 mg/día (N = 198) % |
PLACEBO (N = 687) % |
|
Infecciones e infestaciones |
|||
|
Nasofaringitis |
2,1 |
4,0 |
1,7 |
|
Infección de vías respiratorias altas |
1,5 |
2,5 |
1,5 |
|
Sinusitis |
0,7 |
1,5 |
0,6 |
|
Infección del tracto urinario |
0,5 |
2,5 |
0,1 |
|
Trastornos de la sangre y del sistema linfático |
|||
|
Anemia |
0,1 |
1,0 |
0,1 |
|
Trastornos del sistema inmunológico |
|||
|
Hipersensibilidad |
0,1 |
1,0 |
0,1 |
|
Trastornos psiquiátricos |
|||
|
Insomnio |
16,2 |
25,3 |
13,2 |
|
Ansiedad |
7,7 |
11,1 |
4,4 |
|
Nerviosismo |
0,5 |
1,0 |
0,1 |
|
Trastornos del sistema nervioso |
|||
|
Parkinsonismo* |
19,3 |
17,2 |
7,9 |
|
Acatisia* |
9,8 |
10,1 |
2,7 |
|
Somnolencia |
6,8 |
1,5 |
2,0 |
|
Mareos |
6,3 |
3,5 |
3,9 |
|
Sedación |
4,6 |
3,0 |
1,3 |
|
Temblores* |
4,2 |
2,5 |
2,5 |
|
Distonía* |
3,8 |
3,5 |
1,0 |
|
Letargo |
2,6 |
0 |
1,3 |
|
Mareos posturales |
1,2 |
0 |
0,1 |
|
Discinesia* |
1,2 |
2,0 |
0,9 |
|
Síncope |
0,4 |
1,0 |
0 |
|
Trastornos oculares |
|||
|
Visión borrosa |
2,1 |
1,0 |
0,7 |
|
Trastornos del oído y del laberinto |
|||
|
Dolor de oídos |
0,1 |
1,0 |
0,3 |
|
Trastornos cardíacos |
|||
|
Taquicardia |
1,1 |
2,5 |
0,1 |
|
Trastornos vasculares |
|||
|
Hipotensión ortostática |
1,3 |
0,5 |
0,1 |
|
Hipotensión |
0,2 |
1,0 |
0,3 |
|
Trastornos respiratorios, torácicos y mediastínicos |
|||
|
Congestión nasal |
2,0 |
6,1 |
1,3 |
|
Disnea |
0,8 |
2,0 |
0 |
|
Epistaxis |
0,5 |
1,5 |
0,1 |
|
Congestión sinusal |
0,5 |
1,0 |
0,6 |
|
Trastornos gastrointestinales |
|||
|
Náuseas |
6,4 |
4,0 |
2,6 |
|
Estreñimiento |
4,6 |
9,1 |
3,6 |
|
Dispepsia |
4,3 |
6,1 |
2,6 |
|
Vómitos |
3,9 |
4,5 |
3,8 |
|
Diarrea |
2,3 |
0,5 |
1,9 |
|
Hipersecreción salivar |
2,3 |
1,0 |
0,4 |
|
Boca seca |
2,1 |
0 |
1,0 |
|
Malestar abdominal |
1,5 |
1,0 |
0,9 |
|
Dolor abdominal |
1,1 |
0,5 |
0,7 |
|
Molestias gástricas |
1,1 |
1,0 |
0,6 |
|
Dolor abdominal superior |
0,7 |
1,0 |
0,1 |
|
Trastornos de la piel y del tejido subcutáneo |
|||
|
Erupción |
0,8 |
3,5 |
0,9 |
|
Piel seca |
0,5 |
2,5 |
0,3 |
|
Caspa |
0,2 |
1,0 |
0 |
|
Dermatitis seborreica |
0,2 |
1,0 |
0 |
|
Hiperqueratosis |
0 |
1,0 |
0,3 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|||
|
Dolor de espalda |
2,5 |
1,0 |
1,6 |
|
Artralgia |
1,5 |
2,5 |
0,6 |
|
Dolor en las extremidades |
1,2 |
1,0 |
2,2 |
|
Trastornos renales y urinarios |
|||
|
Incontinencia urinaria |
0,2 |
1,0 |
0,3 |
|
Trastornos del sistema reproductor y de la mama |
|||
|
Trastornos de la eyaculación |
0,4 |
1,0 |
0 |
|
Trastornos generales |
|||
|
Fatiga |
2,3 |
1,0 |
1,0 |
|
Astenia |
1,3 |
0,5 |
0,6 |
|
Pirexia |
1,3 |
1,0 |
0,7 |
|
Dolor torácico |
0,8 |
1,5 |
0,4 |
|
Investigaciones |
|||
|
Aumento de la creatina fosfoquinasa sanguínea |
0,4 |
1,5 |
0,1 |
|
Aumento de la frecuencia cardíaca |
0,2 |
1,5 |
0,1 |
|
* El término parkinsonismo incluye: trastorno extrapiramidal, rigidez musculoesquelética, parkinsonismo, rigidez en rueda dentada, acinesia, bradicinesia, hipocinesia, hipomimia, rigidez muscular y enfermedad de Parkinson. El término acatisia incluye: acatisia y agitación. El término distonía incluye: distonía, espasmos musculares, contracciones musculares involuntarias, contractura muscular, giro oculares y parálisis de la lengua. El término temblores incluye: temblores y temblor de reposo parkinsoniano. El término discinesia incluye: discinesia, espasmos musculares, el corea y la coreoatetosis. |
|||
Datos de estudios dobles ciegos y controlados con placebo: pacientes ancianos con demencia: La tabla 2 muestra las reacciones adversas al medicamento (RAM) informadas en el ≥1% de los pacientes ancianos con demencia tratados con RISPERDAL® en seis estudios dobles ciegos y controlados con placebo, de 4 a 12 semanas de duración. La Tabla 2 incluye solamente las RAM que o bien no están enumeradas en la Tabla 1 o las RAM que ocurrieron en ≥2 veces la frecuencia de las RAM enumeradas en la Tabla 1.
|
Tabla 2. Reacciones adversas al medicamento (RAM) registradas en ≥1% de los pacientes ancianos con demencia tratados con RISPERDAL® en los estudios dobles ciegos y controlados con placebo: RAM no mencionados en la Tabla 1 o comunicadas con ≥2 veces la frecuencia de las RAM enumeradas en la Tabla 1. |
||
|
Clase de órgano o sistema Reacción adversa |
RISPERDAL® (N = 1009) % |
PLACEBO (N = 712) % |
|
Infecciones e infestaciones |
||
|
Infección del tracto urinario |
12,9 |
10,3 |
|
Neumonía |
3,1 |
2,4 |
|
Celulitis |
1,1 |
1,3 |
|
Trastornos del metabolismo y de la nutrición |
||
|
Reducción del apetito |
2,3 |
1,4 |
|
Trastornos psiquiátricos |
||
|
Estado de confusión |
2,7 |
0,1 |
|
Trastornos del sistema nervioso |
||
|
Letargo |
7,6 |
2,2 |
|
Ataque isquémico transitorio |
1,6 |
0,6 |
|
Disminución del nivel de conciencia |
1,3 |
0,3 |
|
Babeo |
1,3 |
0 |
|
Accidente cerebrovascular |
1,1 |
0,4 |
|
Trastornos oculares |
||
|
Conjuntivitis |
2,7 |
1,1 |
|
Trastornos vasculares |
||
|
Hipotensión |
2,2 |
1,4 |
|
Trastornos respiratorios, torácicos y mediastínicos |
||
|
Tos |
4,6 |
3,1 |
|
Rinorrea |
1,5 |
0,8 |
|
Trastornos gastrointestinales |
||
|
Disfagia |
1,5 |
1,3 |
|
Fecaloma |
1,1 |
0,4 |
|
Trastornos de la piel y del tejido subcutáneo |
||
|
Eritema |
4,0 |
4,6 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
||
|
Postura anómala |
1,8 |
0,8 |
|
Hinchazón articular |
1,5 |
0,3 |
|
Trastornos generales |
||
|
Edema periférico |
7,7 |
3,9 |
|
Pirexia |
4,0 |
1,8 |
|
Trastornos de la marcha |
3,5 |
1,5 |
|
Edema con fóvea |
1,5 |
0,3 |
|
Investigaciones |
||
|
Aumento de la temperatura corporal |
2,6 |
0,8 |
Datos dobles ciegos, controlados con placebo: pacientes pediátricos: La tabla 3 muestra las reacciones adversas al medicamento (RAM) registradas en ≥1% de los pacientes pediátricos tratados con RISPERDAL® en ocho estudios dobles ciegos y controlados con placebo, de 3 a 8 semanas de duración. La Tabla 3 incluye solamente las RAM que o bien no están enumerados en la Tabla 1 o las RAM que ocurrieron en ≥2 veces la frecuencia de las RAM enumeradas en la Tabla 1.
|
Tabla 3. Reacciones adversas a medicamentos (RAM) notificadas en ≥1% de los pacientes pediátricos tratados con RISPERDAL® en estudios dobles ciegos controlados con placebo: RAM no mencionados en la Tabla 1 o comunicadas con ≥ 2 veces la frecuencia de las RAM enumeradas en la Tabla 1. |
|||
|
Clase de órgano o sistema Reacción adversa |
RISPERDAL® ≤3 mg/día (N=344) % |
RISPERDAL® >3-6 mg/día (N=95) % |
PLACEBO (N=349) % |
|
Infecciones e infestaciones |
|||
|
Infección de vías respiratorias altas |
5,2 |
2,1 |
3,4 |
|
Rinitis |
3,5 |
1,1 |
3,2 |
|
Gripe |
1,7 |
0 |
1,7 |
|
Trastornos del metabolismo y de la nutrición |
|||
|
Apetito aumentado |
17,2 |
3,2 |
7,2 |
|
Trastornos psiquiátricos |
|||
|
Insomnio leve |
1,7 |
0 |
0,9 |
|
Apatía |
0,9 |
1,1 |
0 |
|
Trastornos del sistema nervioso |
|||
|
Somnolencia |
26,5 |
15,8 |
7,7 |
|
Dolor de cabeza |
22,4 |
21,1 |
14,9 |
|
Sedación |
20,1 |
14,7 |
4,0 |
|
Mareos |
8,1 |
13,7 |
2,3 |
|
Temblores |
6,1 |
8,4 |
1,1 |
|
Babeo |
4,9 |
2,1 |
1,1 |
|
Disartria |
1,5 |
1,1 |
0 |
|
Trastornos de la atención |
0,9 |
1,1 |
0,6 |
|
Trastornos del equilibrio |
0,9 |
1,1 |
0 |
|
Hipersomnia |
0,6 |
1,1 |
0,9 |
|
Trastornos cardíacos |
|||
|
Palpitaciones |
0,6 |
2,1 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos |
|||
|
Tos |
8,7 |
3,2 |
6,6 |
|
Rinorrea |
4,9 |
2,1 |
3,4 |
|
Epistaxis |
3,8 |
4,2 |
1,7 |
|
Dolor faringolarígeo |
3,8 |
2,1 |
1,7 |
|
Congestión pulmonar |
0,3 |
1,1 |
0,3 |
|
Trastornos gastrointestinales |
|||
|
Vómitos |
13,7 |
8,4 |
9,2 |
|
Dolor abdominal superior |
8,4 |
6,3 |
4,6 |
|
Diarrea |
6,7 |
2,1 |
6,0 |
|
Hipersecreción salivar |
3,5 |
6,3 |
0,9 |
|
Molestias gástricas |
2,9 |
0 |
1,4 |
|
Dolor abdominal |
2,3 |
2,1 |
0,6 |
|
Trastornos de la piel y del tejido subcutáneo |
|||
|
Prurito |
1,2 |
0 |
0 |
|
Acné |
0,9 |
1,1 |
0 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|||
|
Mialgia |
1,2 |
1,1 |
0,9 |
|
Dolor cervical |
0,3 |
1,1 |
0,3 |
|
Trastornos renales y urinarios |
|||
|
Enuresis |
6,4 |
1,1 |
5,2 |
|
Incontinencia urinaria |
2,0 |
0 |
1,4 |
|
Polaquiuria |
1,5 |
1,1 |
0,3 |
|
Trastornos del sistema reproductor y de la mama |
|||
|
Galactorrea |
0,6 |
2,1 |
0 |
|
Trastornos generales |
|||
|
Fatiga |
19,2 |
18,9 |
4,9 |
|
Pirexia |
8,4 |
3,2 |
6,3 |
|
Sensación anormal |
1,2 |
0 |
0 |
|
Letargia |
0,9 |
1,1 |
0 |
|
Molestias torácicas |
0,3 |
1,1 |
0 |
|
Investigaciones |
|||
|
Aumento de peso |
4,9 |
2,1 |
0,9 |
|
Aumento de prolactina sérica |
3,8 |
0 |
0,3 |
Datos de otros estudios clínicos: La paliperidona es el metabolito activo de la risperidona, por lo cual el perfil de reacciones adversas de cada uno de estos compuestos (tanto en formulaciones orales como inyectables) es relevante para el otro. Esta subsección incluye otras RAM informadas con risperidona y/o paliperidona en ensayos clínicos. En la Tabla 4a se muestran las RAM comunicadas con risperidona y/o paliperidona en ≥ 1% de los pacientes tratados con RISPERDAL® en un análisis combinado de datos de 23 estudios determinantes dobles ciegos, controlados con placebo (9 en adultos, 6 en pacientes ancianos con demencia, y 8 en pacientes pediátricos).
|
Tabla 4a. RAM informadas con risperidona y/o paliperidona en ≥ 1% de los pacientes tratados con RISPERDAL® en un análisis combinado de datos de 23 estudios determinantes dobles ciegos y controlados con placebo, de los cuales 9 fueron en adultos, 6 en pacientes ancianos con demencia, y 8 en pacientes pediátricos (los términos dentro de cada clase de órgano o sistema están ordenados alfabéticamente). |
|
Clase de órgano o sistema Reacción adversa |
|
Trastornos psiquiátricos Agitación, insomnio* |
|
Trastornos del sistema nervioso Acatisia*, discinesia*, distonía*, parkinsonismo* |
|
Trastornos vasculares Hipertensión |
|
Trastornos musculoesqueléticos y del tejido conjuntivo Dolor musculoesquelético |
|
Trastornos generales y alteraciones en el lugar de administración Marcha anormal, edema*, dolor |
|
Lesiones, intoxicaciones y complicaciones de los procedimientos Caídas |
|
* El término insomnio incluye: Insomnio inicial, insomnio medio; el término acatisia incluye: hipercinesia, síndrome de las piernas inquietas, desasosiego; el término discinesia incluye: atetosis, corea, coreoatetosis, trastornos del movimiento, espasmos musculares, mioclonías; el término distonía incluye: blefaroespasmo, espasmo cervical, emprostótonos, espasmo facial, hipertonía, laringoespasmo, contracciones musculares involuntarias, miotonía, movimientos oculógiros, opistótonos, espasmo orofaríngeo, pleurotótonos, risa sardónica, tetania, parálisis lingual, espasmo lingual, tortícolis y trismo; el término parkinsonismo incluye: acinesia, bradicinesia, rigidez en rueda dentada, babeo, síntomas extrapiramidales, reflejo glabelar anormal, rigidez muscular, tensión muscular, rigidez musculoesquelética; el término edema incluye: edema generalizado, edema periférico y edema depresible. |
En la Tabla 4b se muestran las RAM comunicadas con risperidona y/o paliperidona en < 1% de los pacientes tratados con RISPERDAL® en un análisis combinado de datos de 23 estudios fundamentales a doble ciego, controlados con placebo (9 en adultos, 6 en pacientes ancianos con demencia, y 8 en pacientes pediátricos).
|
Tabla 4b. RAM informadas con risperidona y/o paliperidona en < 1% de los pacientes tratados con RISPERDAL® en un análisis combinado de datos de 23 estudios fundamentales a doble ciego, controlados con placebo (9 en adultos, 6 en pacientes ancianos con demencia y 8 en pacientes pediátricos). (Los términos de cada clase o sistema orgánico están ordenados alfabéticamente). |
|
Clase de órgano o sistema Reacción adversa |
|
Infecciones e infestaciones: Acarodermatitis, bronquitis, cistitis, infección del oído, infección ocular, infección, infección localizada, onicomicosis, infección del tracto respiratorio, amigdalitis, infección viral. |
|
Trastornos de la sangre y del sistema linfático: Hipereosinofilia, disminución del hematocrito, neutropenia, disminución del recuento de leucocitos |
|
Trastornos endocrinos: Glucosuria, hiperprolactinemia. |
|
Trastornos del metabolismo y de la nutrición: Anorexia, hipercolesterolemia, hipertrigliceridemia, hiperglucemia, polidipsia, pérdida de peso |
|
Trastornos psiquiátricos: Embotamiento afectivo, depresión, disminución de la libido, pesadillas, trastornos del sueño. |
|
Trastornos del sistema nervioso: Trastorno cerebrovasculares, convulsiones*, coordinación anormal, coma diabético, hipoestesia, pérdida de la conciencia, parestesia, hiperactividad psicomotora, discinesia tardía, ausencia de respuesta a los estímulos. |
|
Trastornos oculares: Ojo seco, ojo en blanco, costras en el margen del párpado, glaucoma, aumento de lagrimeo, hiperemia ocular. |
|
Trastornos del oído y del laberinto: Tinnitus, vértigo |
|
Trastornos cardíacos: Bloqueo auriculoventricular, bradicardia, trastornos de la conducción, electrocardiograma anormal, prolongación del QT en el electrocardiograma, arritmia sinusal. |
|
Trastornos vasculares: Rubefacción. |
|
Trastornos respiratorios, torácicos y mediastínicos: Disfonía, hiperventilación, neumonía por aspiración, estertores, trastornos respiratorios, congestión de las vías respiratorias, sibilancias |
|
Trastornos gastrointestinales: Queilitis, incontinencia fecal, flatulencia, gastroenteritis, lengua hinchada, odontalgias. |
|
Trastornos hepatobiliares: Aumento de la gamma-glutamil transferasa, aumento de las enzimas hepáticas, aumento de las transaminasas |
|
Trastornos de la piel y del tejido subcutáneo: Eczema, decoloración de la piel, trastornos de la piel, lesiones cutáneas. |
|
Trastornos musculoesqueléticos y del tejido conjuntivo: Rigidez en las articulaciones, debilidad muscular, rabdomiolisis. |
|
Trastornos renales y urinarios: Disuria |
|
Trastornos del sistema reproductor y de la mama: Amenorrea, secreción mamaria, trastornos de la eyaculación, disfunción eréctil, ginecomastia, trastornos menstruales*, disfunción sexual, secreción vaginal |
|
Trastornos generales y alteraciones en el lugar de administración Disminución de la temperatura corporal, escalofríos, malestar, síndrome de abstinencia, edema facial, malestar general, frialdad periférica, sed |
|
Lesiones, intoxicaciones y complicaciones de los procedimientos: Dolor en los procedimientos |
|
* El término convulsiones incluye: Convulsiones generalizadas; El término trastorno menstrual incluye: Menstruación irregular, oligomenorrea. |
En la Tabla 4c se muestran las RAM notificadas la risperidona y/o paliperidona en otros ensayos clínicos, pero no comunicadas en pacientes tratados con RISPERDAL® en un análisis combinado de 23 estudios determinantes dobles ciegos, controlados con placebo.
|
Tabla 4c. RAM notificadas la risperidona y/o paliperidona en otros ensayos clínicos pero no comunicadas en pacientes tratados con RISPERDAL® en un análisis combinado de 23 estudios fundamentales dobles ciegos y controlados con placebo. (Los términos de cada clase o sistema orgánico están ordenados alfabéticamente). |
|
Clase de órgano o sistema Reacción adversa |
|
Trastornos del sistema inmunológico Reacción anafiláctica |
|
Trastornos del metabolismo y de la nutrición Hiperinsulinemia |
|
Trastornos psiquiátricos Anorgasmia |
|
Trastornos del sistema nervioso Temblor de la cabeza, síndrome neuroléptico maligno |
|
Trastornos oculares Trastornos de los movimientos oculares, fotofobia |
|
Trastornos cardíacos Síndrome de taquicardia ortostática postural |
|
Trastornos gastrointestinales Obstrucción intestinal |
|
Trastornos de la piel y del tejido subcutáneo Erupción farmacológica, urticaria |
|
Trastornos del sistema reproductor y de la mama Molestias en las mamas, ingurgitación mamaria, aumento de senos, menstruación retrasada |
|
Trastornos generales y alteraciones en el lugar de administración Induración |
Datos posteriores a la comercialización: Los eventos adversos que se identificaron en primera instancia como RAM durante el período posterior a la comercialización vinculados con risperidona y/o paliperidona se incluyen en la Tabla 5. En esta tabla, las frecuencias se muestras según la siguiente convención:
— Muy frecuentes ≥1/10
— Frecuentes ≥1/100 a <1/10
— Poco frecuentes ≥1/1.000 a <1/100
— Raras ≥1/10.000 y < 1/1.000
— Muy raras < 1/10.000, incluso informes aislados.
La tabla 5 presenta las RAM categorizadas por frecuencia, según sus tasas de comunicación espontánea.
|
Tabla 5. Reacciones adversas al medicamento identificadas durante el período posterior a la comercialización de risperidona categorizadas por frecuencia, estimada a partir de sus tasas de comunicación espontánea |
|
|
Trastornos de la sangre y del sistema linfático |
|
|
Muy raros |
Agranulocitosis, trombocitopenia |
|
Trastornos endocrinos |
|
|
Muy raros |
Secreción inadecuada de la hormona antidiurética |
|
Trastornos del metabolismo y de la nutrición |
|
|
Muy raros |
Diabetes mellitus, cetoacidosis diabética, hipoglucemia, intoxicación por agua |
|
Trastornos psiquiátricos |
|
|
Muy raros |
Manía |
|
Trastornos del sistema nervioso |
|
|
Muy raros |
Disgeusia |
|
Trastornos oculares |
|
|
Muy raros |
Síndrome del iris flácido (intraoperatorio) |
|
Trastornos cardíacos |
|
|
Muy raros |
Fibrilación auricular |
|
Trastornos vasculares |
|
|
Muy raros |
Trombosis venosa profunda, embolismo pulmonar |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Muy raros |
Síndrome de apnea del sueño |
|
Trastornos gastrointestinales |
|
|
Muy raros |
Pancreatitis, Íleo |
|
Trastornos hepatobiliares |
|
|
Muy raros |
Ictericia |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Muy raros |
Alopecia, angioedema |
|
Trastornos renales y urinarios |
|
|
Muy raros |
Retención de orina |
|
Embarazo, puerperio y enfermedades perinatales |
|
|
Muy raros |
Síndrome de abstinencia neonatal |
|
Trastornos del sistema reproductor y de la mama |
|
|
Muy raros |
Priapismo |
|
Trastornos generales |
|
|
Muy raros |
Hipotermia |
INTERACCIONES: Dados los efectos primarios del RISPERDAL® sobre el SNC, debe utilizarse con precaución cuando se combine con otros fármacos de acción central. RISPERDAL® puede contrarrestar el efecto de la levodopa y otros agonistas de la dopamina.
Se han observado casos de hipotensión clínicamente significativa durante la experiencia posterior a la comercialización, con el uso concomitante de risperidona y un tratamiento antihipertensivo.
Se recomienda precaución al prescribir RISPERDAL® junto con fármacos que prolongan el intervalo QT.
Se ha demostrado que la carbamazepina disminuye la concentración plasmática de la fracción antipsicótica activa de la risperidona. Se pueden observar efectos similares con otros inductores de las enzimas hepáticas CYP 3A4. El médico debe reevaluar la posología de RISPERDAL® al iniciar o interrumpir un tratamiento con carbamazepina u otros inductores de la enzima hepática CYP 3A4.
La fluoxetina y la paroxetina, inhibidores de la CYP 2D6, aumentan la concentración plasmática de risperidona pero, en menor medida, la de la fracción antipsicótica activa. Cuando se inicie o se interrumpa un tratamiento concomitante con fluoxetina o paroxetina, el médico debe reevaluar la posología de RISPERDAL®.
El topiramato reduce moderadamente la biodisponibilidad de la risperidona, pero no la de la fracción antipsicótica activa. Por lo tanto, es poco probable que esta interacción tenga importancia clínica.
Las fenotiazinas, los antidepresivos tricíclicos y algunos betabloqueantes pueden elevar la concentración plasmática de la risperidona pero no la de la fracción antipsicótica activa. La amitriptilina no afecta a la farmacocinética de la risperidona ni a la de la fracción antipsicótica activa. La cimetidina y la ranitidina aumentan la biodisponibilidad de la risperidona, pero sólo marginalmente por encima de la fracción antipsicótica activa. La eritromicina, un inhibidor de CYP 3A4, no cambia la farmacocinética de la risperidona ni la de la fracción antipsicótica activa. Los inhibidores de la colinesterasa, galantamina y donepezilo, no muestran efectos clínicamente relevantes sobre la farmacocinética de la risperidona y de la fracción antipsicótica activa.
Si se toma RISPERDAL® junto con otros fármacos con elevada unión a las proteínas, ninguno de los fármacos es desplazado de las proteínas plasmáticas de forma clínicamente relevante.
RISPERDAL® no muestra efectos clínicamente relevantes sobre la farmacocinética del litio, el valproato, la digoxina ni del topiramato.
Véase la sección Advertencias y precauciones sobre el aumento de la mortalidad en ancianos con demencia tratados conjuntamente con furosemida.
La ingesta de alimentos no afecta a la absorción de RISPERDAL®.
INSTRUCCIONES DE USO Y MANIPULACIÓN:
Instrucciones para abrir el frasco y utilizar la pipeta:
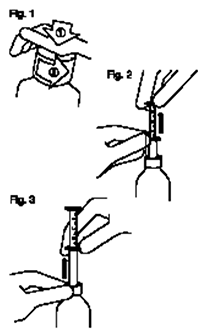
— Fig. 1: El frasco viene con un tapón de seguridad a prueba de niños y debe abrirse de la siguiente manera.
• Apriete el tapón plástico de rosca y gírelo al mismo tiempo en sentido contrario a las agujas del reloj.
• Retire el tapón desenroscado.
— Fig. 2: Introduzca la pipeta en el frasco. Sujete el aro inferior y tire del aro superior hasta la marca que corresponda al número de mililitros o miligramos que deba dispensar.
— Fig. 3: Sin dejar de sujetar el aro inferior, extraiga toda la pipeta del frasco. Vacíe el contenido en cualquier bebida no alcohólica a excepción del té, deslizando el aro superior hacia abajo. Cierre el frasco.
Enjuague la pipeta con un poco de agua.
Instrucciones para la eliminación: Cualquier producto no utilizado o material de desecho debe eliminarse de acuerdo con las normas locales.
Fabricado por: Véase el embalaje exterior.
Fecha de revisión del texto: 11 de enero 2013
JANSSEN PHARMACEUTICAL COMPANIES
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN: RISPERDAL® se puede administrar en comprimidos o en solución oral.
Esquizofrenia:
— Cambio del tratamiento con otros antipsicóticos: Siempre que resulte adecuado desde el punto de vista médico, se recomienda interrumpir gradualmente el tratamiento anterior mientras se inicia la terapia con RISPERDAL®. Además, si es clínicamente adecuado, al sustituir un tratamiento con antipsicóticos de depósito, se administrará RISPERDAL® en lugar de la siguiente inyección programada. Se reevaluará periódicamente la necesidad de continuar con la medicación antiparkinsoniana.
— Adultos: RISPERDAL® se puede administrar una o dos veces al día.
Los pacientes deben comenzar con 2 mg/día de RISPERDAL®. Esta dosis se puede incrementar al segundo día hasta 4 mg. A partir de ese momento, la posología se puede mantener sin cambios o ajustar, según las necesidades. La mayoría de los pacientes responde a dosis diarias de 4 a 6 mg. En algunos pacientes, se precisa una fase de titulación más lenta, y dosis iniciales y de mantenimiento más bajas.
Las dosis mayores que 10 mg/día no han demostrado tener una mayor eficacia y pueden provocar síntomas extrapiramidales. No se ha evaluado la seguridad de las dosis superiores a 16 mg/día, por lo que no se debe aplicar ninguna dosis mayor a este nivel.
Cuando se necesite mayor sedación, se puede añadir una benzodiazepina al tratamiento con RISPERDAL®.
— Ancianos: Se recomienda una dosis inicial de 0,5 mg, dos veces al día. Esta posología se ajustará en incrementos de 0,5 mg, dos veces al día, hasta alcanzar 1 a 2 mg, dos veces al día.
— Adolescentes: Se recomienda una dosis inicial de 0,5 mg una vez al día, administrada en una sola dosis al día, ya sea por la mañana o por la noche. En caso indicado, se puede ajustar esta dosis a intervalos no inferiores a 24 horas en incrementos de 0,5 o 1 mg/día, según la tolerancia, hasta la dosis recomendada de 3 mg/día. Se ha demostrado eficacia con dosis de entre 1 y 6 mg/día. No han sido estudiadas las dosis superiores a 6 mg/día.
Los pacientes que experimentan somnolencia persistente pueden beneficiarse de la administración de la mitad de la dosis diaria dos veces al día.
Se carece de experiencia en esquizofrenia con niños menores de 13 años.
Manía bipolar:
— Adultos: RISPERDAL® se debe administrar una vez al día, comenzando con 2 o 3 mg. Si es necesario ajustar la dosis, esto se debe realizar con intervalos de al menos 24 horas, mediante incrementos de 1 mg por día. Se ha demostrado su eficacia con dosis flexibles de entre 1 y 6 mg al día.
Como sucede con todo tratamiento sintomático, el uso continuado de RISPERDAL® se debe evaluar y justificar periódicamente.
— Niños y adolescentes: Se recomienda una dosis inicial de 0,5 mg una vez al día, administrada en una sola dosis al día, ya sea por la mañana o por la noche. En caso indicado, se puede ajustar esta dosis a intervalos no inferiores a 24 horas en incrementos de 0,5 o 1 mg/día, según la tolerancia, hasta la dosis recomendada de 2,5 mg/día. Se ha demostrado eficacia con dosis de entre 0,5 y 6 mg/día. No han sido estudiadas las dosis superiores a 6 mg/día.
Los pacientes que experimentan somnolencia persistente pueden beneficiarse de la administración de la mitad de la dosis diaria dos veces al día.
Como sucede con todo tratamiento sintomático, el uso continuado de RISPERDAL® se debe evaluar y justificar periódicamente.
Se carece de experiencia en manía bipolar con niños menores de 10 años.
Alteraciones conductuales en pacientes con demencia: Se recomienda una dosis inicial de 0,25 mg, dos veces al día. En caso de necesidad, esta posología se puede ajustar de forma individual en incrementos de 0,25 mg, dos veces al día, con una frecuencia no superior a cada dos días. La dosis óptima es de 0,5 mg, dos veces al día, en la mayoría de los casos. Algunos pacientes, sin embargo, se pueden beneficiar de dosis de hasta 1 mg dos veces al día.
Una vez que el paciente ha alcanzado la dosis objetivo, se puede considerar cambiar a un régimen de dosificación de una vez al día. Como sucede con todo tratamiento sintomático, el uso continuado de RISPERDAL® se debe evaluar y justificar periódicamente.
Trastornos de la conducta y otros trastornos perturbadores del comportamiento: En personas con un peso ≥ 50 kg, se recomienda empezar con una dosis de 0,5 mg una vez al día. En caso de necesidad, esta posología se puede ajustar de forma individual en incrementos de 0,5 mg, una vez al día, con una frecuencia no superior a cada dos días. La dosis óptima es de 1 mg, una vez al día, en la mayoría de los casos. Sin embargo, algunos pacientes pueden responder a 0,5 mg, una vez al día, y otros requieren 1,5 mg, una vez al día.
En personas con un peso < 50 kg, se recomienda empezar con una dosis de 0,25 mg, una vez al día. En caso de necesidad, esta posología se puede ajustar de forma individual en incrementos de 0,25 mg, una vez al día, con una frecuencia no superior a cada dos días. La dosis óptima es de 0,5 mg, una vez al día, en la mayoría de los casos. Sin embargo, algunos pacientes pueden responder a 0,25 mg, una vez al día, y otros requieren 0,75 mg, una vez al día.
Como sucede con todo tratamiento sintomático, el uso continuado de RISPERDAL® se debe evaluar y justificar periódicamente.
No se dispone de experiencia con niños menores de 5 años.
Insuficiencia renal y hepática: Los pacientes con insuficiencia renal tienen menor capacidad para eliminar la fracción antipsicótica activa que los adultos sanos. Los pacientes con alteraciones de la función hepática muestran incrementos en la concentración plasmática de la fracción libre de risperidona.
Al margen de la indicación, se reducirá a la mitad la dosis inicial y consecutiva y la titulación de la dosis se ajustará más lentamente si el paciente sufre insuficiencia renal o hepática.
RISPERDAL® se debe utilizar con precaución en este grupo de pacientes.
SOBREDOSIS:
Síntomas: En general, los signos y síntomas descritos son los correspondientes a la potenciación de los efectos farmacológicos conocidos del medicamento. Estos incluyen: Somnolencia y sedación, taquicardia e hipotensión y síntomas extrapiramidales. En casos de sobredosis, se ha descrito la prolongación del intervalo QT y la aparición de convulsiones. Se ha registrado Torsade de Pointes en casos de sobredosis combinada de RISPERDAL® oral y paroxetina.
En caso de sobredosis aguda, se contemplará la posibilidad de que el paciente haya tomado varios fármacos.
Tratamiento: Establecer y mantener una vía respiratoria despejada y asegurar una adecuada oxigenación y ventilación. Considerar el lavado gástrico (después de intubar al paciente si está inconsciente) y la administración de carbón activado junto con un laxante. Se establecerá de inmediato la monitorización cardiovascular, con registro electrocardiográfico continuo para detectar posibles arritmias.
No existe ningún antídoto específico para RISPERDAL®. Por lo tanto, se adoptarán las medidas de apoyo adecuadas. La hipotensión y el colapso circulatorio se tratarán con medidas adecuadas, como la administración intravenosa de líquidos y/o agentes simpaticomiméticos. Si aparecen síntomas extrapiramidales graves, se debe administrar una medicación anticolinérgica. Se vigilará estrechamente al paciente hasta que se recupere.
NATURALEZA Y CONTENIDO DEL ENVASE:
Comprimidos:
— Blíster de PVC-PE-PVDC/Al constituido por una lámina de aluminio de 20 Tm con una cubierta termosellada de 6 g/m² y una lámina tricapa de PVC de 200 Tm, LDPE de 25 Tm y PVCD de 90 g/m².
— Los comprimidos RISPERDAL® de 1, 2, 3 y 4 mg se envasan en blísteres de 10 unidades.
— Los blísteres vienen en una caja de cartón (2 o 6 blísteres por caja).
— Los comprimidos RISPERDAL® de 6 mg se envasan en blísteres de 7 unidades (envase calendario). Los blísteres vienen en una caja de cartón (4 blísteres por caja).
Solución oral:
— RISPERDAL® Solución oral se presenta en frascos de vidrio ámbar de 30 ml y de 100 ml con cierres de seguridad de plástico a prueba de niños.
— La pipeta que viene con el frasco de 30 ml está calibrada en miligramos y mililitros, con un volumen mínimo de 0,25 ml y máximo de 3 ml. Esta pipeta tiene marcas de calibración impresas cada 0,25 ml hasta llegar a los 3 ml.
— La pipeta que viene con el frasco de 100 ml está calibrada en miligramos y mililitros, con un volumen mínimo de 0,25 ml y máximo de 3 ml. Esta pipeta tiene marcas de calibración impresas cada 0,25 ml hasta llegar a los 3 ml.