
PRISTIQ
DESVENLAFAXINA
Tabletas de liberación prolongada
Tabletas de liberación prolongada, 50 Miligramos
Tabletas de liberación prolongada, 100 Miligramos
FORMA FARMACÉUTICA Y FORMULACIÓN: PRISTIQ® es un comprimido de liberación prolongada para la administración oral.
Ingrediente activo: Cada comprimido contiene 76 o 152 mg de succinato de desvenlafaxina, equivalente a 50 o 100 mg de desvenlafaxina, respectivamente.
INDICACIÓN FARMACÉUTICA: El succinato de desvenlafaxina no está indicado para su uso en ninguna población pediátrica.
La desvenlafaxina está indicada para el tratamiento del trastorno depresivo mayor.
FARMACODINAMIA: La eficacia de la desvenlafaxina como terapia para la depresión quedó establecida en cuatro ensayos de ocho semanas, randomizados, a doble ciego, controlados con placebo y con dosis fijas, en pacientes ambulatorios adultos 128 quienes cumplieron con los criterios del Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-IV, por sus siglas en inglés)129 para el trastorno depresivo mayor. En el primer ensayo, los pacientes recibieron 100 mg (n = 114), 200 mg (n = 116) o 400 mg (n = 113) de desvenlafaxina una vez al día o placebo (n = 118). En el segundo ensayo, los pacientes recibieron ya fuera 200 mg (n = 121) o 400 mg (n = 124)131 de desvenlafaxina una vez al día o placebo (n = 124). En dos ensayos clínicos adicionales, los pacientes recibieron 50 mg (n = 150 y n = 164) o 100 mg (n = 147 y n = 158) de desvenlafaxina una vez al día o placebo (n = 150 y n = 161).
La desvenlafaxina demostró ser superior al placebo, según se midió por la mejoría en la calificación total en la Escala de Calificación de Hamilton de 17 ítems para la depresión (HAM-D17) en cuatro ensayos y según la Escala de Impresiones Clínicas Globales - Mejoría (CGI-I) en tres de los cuatro ensayos. No hubo alguna evidencia clara de que dosis mayores que 50 mg/día confirieran un beneficio adicional.
En un ensayo a largo plazo, los pacientes ambulatorios adultos que cumplieron con los criterios del DSM-IV para el trastorno depresivo mayor y quienes respondieron a 12 semanas de tratamiento agudo con la desvenlafaxina fueron asignados en forma aleatoria a la misma dosis (200 o 400 mg/día) que habían recibido durante el tratamiento agudo o a placebo, hasta por 26 semanas de observación por recaídas. La respuesta durante la fase abierta se definió como una calificación total en la escala HAM-D17 de ≤ 11 en la evaluación del día 84. Se definió la recaída durante la fase a doble ciego de la siguiente manera: (1) una calificación total HAM-D17 ≥ 16 en cualquier visita al consultorio, (2) una calificación CGI-I de ≥ 6 (versus el día 84) en cualquier visita al consultorio o (3) la descontinuación del ensayo debido a una respuesta insatisfactoria. Los pacientes que recibieron el tratamiento continuo con la desvenlafaxina presentaron tasas de recaída significativamente menores a lo largo de las 26 semanas posteriores en comparación con quienes recibieron el placebo.
Los análisis de las relaciones entre el resultado del tratamiento y la edad y el resultado del tratamiento y el género no sugirió alguna capacidad de respuesta diferencial con base en estas características de los pacientes. No hubo suficiente información para determinar el efecto de la raza sobre el resultado en estos ensayos.
FARMACOCINÉTICA Y FARMACODINAMIA EN LOS SERES HUMANOS:
Mecanismo de acción: Los ensayos no clínicos han demostrado que la desvenlafaxina es un inhibidor selectivo de la recaptación de la serotonina y la norepinefrina (IRSN). Se cree que la eficacia clínica de la desvenlafaxina se relaciona con la potenciación de estos neurotransmisores en el sistema nervioso central.
La desvenlafaxina careció de afinidad hacia numerosos receptores, incluidos los receptores muscarínicos colinérgicos, H1 histaminérgicos o ?1 adrenérgicos in vitro. Se ha planteado la hipótesis de que la actividad farmacológica en estos receptores se asocia con los diversos efectos anticolinérgicos, sedantes y cardiovasculares que se observan con otros agentes psicotrópicos. En el mismo ensayo comprensivo sobre el perfil de unión, también se vio que la desvenlafaxina carece de una afinidad significativa hacia diversos canales de iones, incluidos los canales de los iones calcio, cloruros, potasio y sodio y tampoco presentó actividad inhibidora hacia la monoaminooxidasa (MAO). La desvenlafaxina no presentó actividad significativa en el ensayo in vitro sobre el canal del potasio cardiaco (hERG).
En los modelos preclínicos en roedores, la desvenlafaxina demostró una actividad predictiva de acciones antidepresivas, ansiolíticas y termorregulatorias, así como propiedades inhibidoras del dolor.
FARMACOCINÉTICA: La farmacocinética de una sola dosis de la desvenlafaxina es lineal y proporcional a la dosis en un rango de dosis de 100 a 600 mg/día. La vida media terminal media, t½, es de aproximadamente 11 horas. Con la dosificación una vez al día, se logran las concentraciones plasmáticas del estado estable en aproximadamente 4 a 5 días. En el estado estable, la acumulación de dosis múltiples de la desvenlafaxina es lineal y predecible a partir del perfil farmacocinético de la dosis única.
La farmacocinética de la desvenlafaxina se ha evaluado exhaustivamente tanto en las mujeres como en los hombres. Hay diferencias mínimas según el género; a continuación se presentan los datos de todos los sujetos.
Absorción y distribución: El succinato de desvenlafaxina se absorbe bien, con una biodisponibilidad oral absoluta del 80%. El tiempo medio hasta lograr las concentraciones plasmáticas máximas (Tmáx) es de aproximadamente 7,5 horas después de la administración oral. Puede predecirse el ABC y la Cmáx de 6747 ng•hr/mL y 376 ng/mL, respectivamente, después de una sola dosis de 100 mg.156
Efectos de los alimentos: Un ensayo sobre el efecto de los alimentos que incluyó la administración de desvenlafaxina a sujetos sanos en ayunas y alimentados (comida alta en grasa) indicó que la Cmáx aumentó en un 16% cuando se habían alimentado, mientras que el ABC fue similar. Esta diferencia no es clínicamente significativa; por lo tanto, la desvenlafaxina puede tomarse independientemente de las comidas.
La unión de la desvenlafaxina con las proteínas plasmáticas es baja (30%) y es independiente de la concentración del medicamento. El volumen de distribución de la desvenlafaxina en el estado estable después de la administración intravenosa es de 3,4 L/kg, lo que indica una distribución hacia los compartimientos no vasculares.
Metabolismo y eliminación: Aproximadamente el 45% de la desvenlafaxina se excreta por la orina sin cambio alguno. La desvenlafaxina se metaboliza principalmente por medio de la conjugación (mediada por las isoformas UGT, incluidas UGT1A1, UGT1A3, UGT2B4, UGT2B15 y UGT2B17) y, en menor grado, por medio del metabolismo oxidativo. Aproximadamente el 19% de la dosis administrada se excreta como el metabolito glucurónido y <5% como el metabolito oxidativo (N, O-didesmetilvenlafaxina) en la orina. La isoenzima predominante del citocromo P450 que media en el metabolismo oxidativo (N-desmetilación) de la desvenlafaxina es CYP3A4.
Población geriátrica: En un ensayo con sujetos sanos quienes recibieron dosis de hasta 300 mg, hubo una disminución del aclaramiento de la desvenlafaxina que dependió de la edad, lo que produjo un aumento del 32% en la Cmáx y un aumento del 55% en los valores del ABC en los sujetos mayores de 75 años de edad, en comparación con sujetos con 18 a 45 años de edad. No se requiere realizar un ajuste de la dosis solo con base en la edad; sin embargo, cuando se determina la dosis debe considerarse la posibilidad de un menor aclaramiento renal de la desvenlafaxina.
Población pediátrica: No se ha establecido la seguridad y eficacia en los pacientes menores de 18 años de edad.
Pacientes con insuficiencia renal: La farmacocinética del succinato de desvenlafaxina 100 mg se estudió en sujetos con una enfermedad renal leve (n = 9), moderada (n = 8), severa (n = 7) y en fase terminal que requería diálisis (n = 9), así como en sujetos sanos como controles, pareados por edad (n = 8). La eliminación se correlacionó significativamente con el aclaramiento de la creatinina. El aclaramiento corporal total se redujo en un 29% en la insuficiencia renal leve, 39% en la moderada, 51% en la severa y 58% en la enfermedad en fase terminal, en comparación con los sujetos sanos. Este aclaramiento reducido causó aumentos del ABC del 42% en la insuficiencia renal leve (aclaramiento de la creatinina en 24 horas = 50-80 mL/min), 46% en la moderada (aclaramiento de la creatinina en 24 horas = 30-50 mL/min), 108% en la severa (aclaramiento de la creatinina en 24 horas <30 ml/min) y 116% en los sujetos en fase terminal.
La vida media terminal media (t½) se prolongó de 11,1 horas en los sujetos sanos a 13,5, 15,5, 17,6 y 22,8 horas en los sujetos con insuficiencia renal leve, moderada, severa y en fase terminal, respectivamente.
Menos del 5% del medicamento en el cuerpo se eliminó durante un procedimiento estándar de hemodiálisis de 4 horas. Por lo tanto, no debe administrarse dosis suplementales a los pacientes después de una diálisis. Se recomienda un ajuste de la dosis en los pacientes con una insuficiencia renal significativa.
Pacientes con insuficiencia hepática: Se estudió la farmacocinética del succinato de desvenlafaxina 100 mg en sujetos con insuficiencia hepática leve (Child-Pugh A, n = 8), moderada (Child-Pugh B, n = 8) y severa (Child-Pugh C, n = 8) así como en sujetos sanos (n = 12).
El ABC promedio aumentó en aproximadamente el 31% y el 35% en los pacientes con una insuficiencia hepática moderada y severa, respectivamente, en comparación con los sujetos sanos. Los valores promedio del ABC fueron comparables en los sujetos con insuficiencia hepática leve y los sujetos sanos (<5% de diferencia).
El aclaramiento sistémico se redujo en aproximadamente el 20% y el 36% en los pacientes con una insuficiencia hepática moderada y severa, respectivamente, en comparación con los sujetos sanos. Los valores del aclaramiento sistémico fueron comparables en los sujetos con insuficiencia hepática leve y los sujetos sanos (<5% de diferencia).
El t½ cambió desde aproximadamente 10 horas en los sujetos sanos y los sujetos con una insuficiencia hepática leve a 13 y 14 horas en los pacientes con insuficiencia hepática moderada y severa, respectivamente.
Ensayo QTc exhaustivo: En un ensayo exhaustivo sobre QTc con criterios determinados prospectivamente en mujeres sanas, la desvenlafaxina no causó una prolongación de QT. Adicionalmente, no se observó algún efecto sobre el intervalo QRS.
Género: No se requiere un ajuste de la dosificación con base en el género.
CONTRAINDICACIONES: Hipersensibilidad al succinato de desvenlafaxina, el clorhidrato de desvenlafaxina o a cualquiera de los excipientes en la formulación de la desvenlafaxina.
La desvenlafaxina es un inhibidor de la recaptación de la norepinefrina y la serotonina. El succinato de desvenlafaxina no debe usarse en combinación con un inhibidor de la monoaminooxidasa (IMAO) o en por los menos 14 días después de suspender el tratamiento con un IMAO. Con base en la vida media del succinato de desvenlafaxina, debe permitirse que pasen por lo menos 7 días después de terminar el tratamiento con el succinato de desvenlafaxina antes de iniciar un IMAO.
ABUSO Y DEPENDENCIA:
Dependencia física y psicológica: Aunque no se ha estudiado sistemáticamente la desvenlafaxina en ensayos clínicos preclínicos o clínicos para determinar su potencial para abuso, en los ensayos clínicos no se observó un comportamiento de búsqueda del medicamento.
ADVERTENCIAS ESPECIALES: Empeoramiento clínico de los síntomas depresivos, cambios inusuales en el comportamiento y suicidalidad.
El succinato de desvenlafaxina es un IRSN, una clase de medicamentos que puede usarse para tratar la depresión. Todos los pacientes tratados con la desvenlafaxina deben monitorearse apropiadamente y observados cuidadosamente para detectar el empeoramiento clínico y la suicidalidad. Los pacientes, sus familias y las personas que les cuidan deben estar alertas ante el surgimiento de ansiedad, agitación, ataques de pánico, insomnio, irritabilidad, hostilidad, agresividad, impulsividad, acatisia (inquietud psicomotora), hipomanía, manía, otros cambios inusuales en el comportamiento, empeoramiento de la depresión e ideación suicida, especialmente al iniciar el tratamiento o durante cualquier cambio de la dosis o el esquema de dosificación. Debe considerarse el riesgo de intento de suicido, especialmente en los pacientes deprimidos, y debe suministrarse la cantidad más pequeña del medicamento que sea consistente con un buen manejo del paciente, para reducir el riesgo de una sobredosis.
El suicidio es un riesgo conocido de la depresión y ciertos otros trastornos psiquiátricos y estos mismos trastornos son factores pronósticos fuertes de suicidio. Los análisis agrupados de ensayos a corto plazo controlados con placebo con medicamentos antidepresivos (ISRS y otros) demostraron que estos medicamentos aumentan el riesgo de suicidalidad en los niños, adolescentes y adultos jóvenes (con edades entre 18 y 24 años) con un trastorno depresivo mayor y otros trastornos psiquiátricos. Los ensayos a corto plazo no demostraron un aumento del riesgo de suicidalidad con los antidepresivos en comparación con el placebo en los adultos mayores de 24 años; hubo una reducción del riesgo de suicidalidad con los antidepresivos en comparación con el placebo en los adultos con 65 años de edad y más.
Manía e hipomanía: En los ensayos clínicos, se reportó la manía en el 0,1% de los pacientes tratados con la desvenlafaxina. También se ha reportado la activación de la manía y la hipomanía en una proporción pequeña de pacientes con un trastorno afectivo mayor quienes fueron tratados con otros antidepresivos en el mercado. Al igual que con todos los antidepresivos, la desvenlafaxina debe utilizarse con cuidado en los pacientes con antecedentes personales o familiares de manía o hipomanía.
Síndrome de la serotonina: Al igual que con otros agentes serotoninérgicos, puede desarrollarse un síndrome de la serotonina que potencialmente atente contra la vida con el tratamiento con la desvenlafaxina, en particular con el uso concomitante de otros medicamentos serotoninérgicos (incluidos los ISRS, IRSN y triptanos) y con agentes que afectan el metabolismo de la serotonina (como los IMAO). Los síntomas del síndrome de la serotonina pueden ser cambios en el estado mental (por ejemplo, agitación, alucinaciones y coma), inestabilidad autonómica (por ejemplo, taquicardia, presión arterial lábil e hipertermia), aberraciones neuromusculares (por ejemplo, hiperreflexia, incoordinación) y/o síntomas gastrointestinales (por ejemplo, náuseas, vómito y diarrea).
Si se justifica clínicamente el tratamiento concomitante con la desvenlafaxina y un ISRS, otro IRSN o un agonista del receptor de la 5-hidroxitriptamina (triptano), se recomienda la observación cuidadosa del paciente, particularmente durante el inicio del tratamiento y los aumentos de la dosis.
No se recomienda el uso concomitante de la desvenlafaxina con los precursores de la serotonina (tales como los suplementos de triptofano).
Glaucoma del ángulo cerrado: Se ha reportado la midriasis asociada a la desvenlafaxina. Por lo tanto, debe darse seguimiento a los pacientes con una presión intraocular alta o aquellos con un riesgo de glaucoma agudo de ángulo cerrado.
PRECAUCIONES ESPECIALES:
Coadministración de medicamentos que contienen venlafaxina y/o desvenlafaxina: La desvenlafaxina es el principal metabolito activo de la venlafaxina, un medicamento utilizado para el tratamiento de los trastornos depresivo mayor, de ansiedad generalizada, de ansiedad social y de pánico. Los productos que contienen succinato de desvenlafaxina no deben usarse concomitantemente con productos que contienen clorhidrato de venlafaxina u otros productos que contienen succinato de desvenlafaxina.
Efectos sobre la presión arterial: En los ensayos clínicos, se observó un aumento de la presión arterial en algunos pacientes, sobre todo con las dosis más altas. Debe controlarse la hipertensión preexistente antes del tratamiento con la desvenlafaxina. Debe monitorearse en forma regular la presión arterial de los pacientes que reciben la desvenlafaxina. Se han reportado algunos casos de aumento de la presión arterial con la desvenlafaxina, que requirieron el tratamiento inmediato. El aumento sostenido de la presión arterial puede tener consecuencias adversas. En los pacientes que presenten un aumento sostenido de la presión arterial mientras reciben la desvenlafaxina, se debe considerar la reducción de la dosis o la descontinuación.
Debe tenerse cuidado al tratar pacientes con condiciones subyacentes que puedan verse comprometidas con un aumento de la presión arterial.
Cardiovasculares y vascular cerebrales: Se recomienda tener cuidado al administrar la desvenlafaxina a pacientes con trastornos cardiovasculares, vascular cerebrales o del metabolismo de los lípidos. En los ensayos clínicos con la desvenlafaxina, se observaron aumentos de la presión arterial y la tasa cardiaca. La desvenlafaxina no se ha evaluado en forma sistemática en los pacientes con antecedentes recientes de infarto de miocardio, enfermedad cardiaca inestable, hipertensión sin controlar o enfermedad vascular cerebral. Los pacientes con estos diagnósticos, excepto la enfermedad vascular cerebral, fueron excluidos de los ensayos clínicos.
Lípidos séricos: En los ensayos clínicos se observaron aumentos relacionados con la dosis en los valores séricos en ayunas del colesterol total, el colesterol LDL (lipoproteínas de baja densidad, por sus siglas en inglés) y los triglicéridos. Durante el tratamiento con la desvenlafaxina, debe considerarse la medición de los lípidos séricos.
Convulsiones: En los ensayos clínicos con la desvenlafaxina, antes de la comercialización, se reportaron algunos casos de convulsiones. La desvenlafaxina no se ha evaluado sistemáticamente en los pacientes con un trastorno convulsivo. Los pacientes con antecedentes de convulsiones fueron excluidos de los ensayos clínicos previos a la comercialización. La desvenlafaxina debe recetarse con cuidado en los pacientes con un trastorno convulsivo.
Efectos con la descontinuación: Durante la comercialización de los IRSN (inhibidores de la recaptación de la serotonina y la norepinefrina) y los ISRS (inhibidores selectivos de la recaptación de la serotonina), se han presentado algunos reportes espontáneos de eventos adversos que ocurrieron al suspender estos medicamentos, en particular, cuando la suspensión fue abrupta, como los siguientes: ánimo disfórico, irritabilidad, agitación, mareos, trastornos sensoriales (por ejemplo, parestesias como sensaciones de choques eléctricos), ansiedad, confusión, cefalea, letargo, labilidad emocional, insomnio, hipomanía, tinnitus y convulsiones. Aunque estos eventos en general fueron autolimitados, hay reportes de síntomas serios de descontinuación.
Los pacientes deben monitorearse cuando se descontinúa el tratamiento con la desvenlafaxina. Siempre que sea posible, se recomienda una reducción gradual de la dosis en vez de la suspensión abrupta. Si se presentan síntomas intolerables tras la disminución de la dosis o la descontinuación del tratamiento, puede considerarse reiniciar la dosis prescrita anteriormente.
Sangrado anormal: Los medicamentos que inhiben la recaptación de la serotonina pueden causar anormalidades de la agregación plaquetaria. Al igual que otros agentes que inhiben la recaptación de la serotonina, la desvenlafaxina debe utilizarse con cuidado en los pacientes con predisposición al sangrado, incluidos los pacientes que reciben anticoagulantes e inhibidores plaquetarios.
El uso concomitante de agentes antiinflamatorios no esteroideos (AINEs), la warfarina y otros anticoagulantes puede aumentar este riesgo. Los reportes de casos y estudios epidemiológicos (con diseños de casos y controles y de cohorte) han demostrado una asociación entre el uso de medicamentos que interfieren con la recaptación de la serotonina y la presentación de sangrado gastrointestinal. Los eventos de sangrado relacionados con los ISRS y los IRSN han variado desde equimosis, hematomas, epistaxis y petequias hasta hemorragias que atentan contra la vida. Debe advertirse a los pacientes sobre este riesgo de sangrado asociado con el uso concomitante de PRISTIQ® y los AINEs, la aspirina u otros medicamentos que afecta la coagulación o el sangrado.
Hiponatremia: Se han descrito casos de hiponatremia y/o el síndrome de secreción inapropiada de la hormona antidiurética con los IRSN y los ISRS, por lo general en pacientes con agotamiento de volumen o deshidratados, incluidos los pacientes ancianos y aquellos que toman diuréticos.
Insuficiencia renal: En los pacientes con una insuficiencia renal moderada o severa o con una enfermedad renal de fase terminal (ESRD, por sus siglas en inglés), se observó la disminución del aclaramiento de PRISTIQ®, y por lo tanto la prolongación de la vida media de eliminación del medicamento. Como resultado, hubo aumentos potencialmente clínicamente significativos en las exposiciones a PRISTIQ®. Es necesario el ajuste de la dosis (50 mg de día de por medio) en los pacientes con una insuficiencia renal severa o ESRD. Las dosis no deben escalarse en los pacientes con una insuficiencia renal moderada o severa con ESRD (ver Dosificación y administración).
Poblaciones especiales:
a. Uso pediátrico: No se ha establecido la seguridad y eficacia en los pacientes menores de 18 años de edad.
b. Uso geriátrico: No se requiere un ajuste de la dosis solo con base en la edad. Sin embargo, cuando se determina la dosis debe considerarse la posibilidad de una reducción del aclaramiento renal.
No puede descartarse una mayor sensibilidad a la desvenlafaxina en algunos pacientes de más edad.
Interferencia con el desempeño cognitivo y motor: Los resultados de un ensayo clínico que evaluó los efectos de la desvenlafaxina sobre el desempeño conductual de personas sanas no reveló alguna alteración clínicamente significativa en el desempeño psicomotor, cognitivo o de conductas complejas. Sin embargo, debido a que cualquier agente activo sobre el SNC puede alterar el juicio, el pensamiento o las destrezas motoras, debe advertirse a los pacientes sobre el uso de maquinaria peligrosa, incluidos los automóviles, hasta que estén razonablemente seguros de que la terapia con la desvenlafaxina no afecta adversamente su capacidad para asumir tales actividades.
PRECAUCIONES O RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: No se ha establecido la seguridad de la desvenlafaxina en el embarazo humano. La desvenlafaxina debe administrarse a las mujeres embarazadas solo si los beneficios esperados superan los riesgos posibles. Si la desvenlafaxina se usa hasta el nacimiento o poco antes de este, deben considerarse los efectos de descontinuación en el neonato.
Se han reportado complicaciones, incluida la necesidad de soporte respiratorio, alimentación por sonda o la hospitalización prolongada en los neonatos expuestos a los IRSN o los ISRS a finales del tercer trimestre. Tales complicaciones pueden surgir inmediatamente después del parto.
Lactancia: La desvenlafaxina se excreta en la leche materna. Debido al potencial de reacciones adversas serias en los lactantes causadas por la desvenlafaxina, debe tomarse la decisión de continuar o descontinuar la lactancia o descontinuar el medicamento, tomando en cuenta la importancia del agente para la madre. La desvenlafaxina debe administrarse a madres lactantes únicamente si los beneficios esperados superan los riesgos posibles.
Trastorno depresivo mayor: De los 3292 pacientes en los ensayos clínicos previos a la comercialización de la desvenlafaxina, el 5% de los pacientes tenía 65 años de edad o más. No se observaron diferencias globales en la seguridad o la eficacia entre estos pacientes y los pacientes más jóvenes; sin embargo, en los ensayos a corto plazo controlados con placebo, hubo una mayor incidencia de hipotensión ortostática sistólica en los pacientes mayores de 65 años de edad, en comparación con todos los adultos tratados con la desvenlafaxina.
REACCIONES SECUNDARIAS Y ADVERSAS:
Experiencia de los ensayos clínicos: La eficacia de la desvenlafaxina se estableció antes de la comercialización en un total de 4724 pacientes quienes fueron expuestos a por lo menos una dosis de la desvenlafaxina, entre 50 y 400 mg/día, en los ensayos clínicos sobre el trastorno depresivo mayor y los síntomas vasomotores (3292 en ensayos del trastorno depresivo mayor y 1432 en ensayos sobre los síntomas vasomotores). La seguridad a largo plazo se evaluó en 1576 pacientes (1070 sobre el trastorno depresivo mayor y 506 sobre los síntomas vasomotores) quienes fueron expuestos a la desvenlafaxina por lo menos por 6 meses y en 575 pacientes (274 con el trastorno depresivo mayor y 301 con los síntomas vasomotores) expuestos por 1 año.
Las reacciones adversas en la siguiente lista fueron reportadas por los pacientes que recibieron la desvenlafaxina en todo el rango de dosis estudiado (50 a 400 mg) durante los ensayos clínicos a corto y largo plazo realizados antes de la comercialización. En general, las reacciones adversas fueron más frecuentes durante la primera semana de tratamiento.
Las reacciones adversas se categorizan por sistema corporal y se anotan en orden decreciente de frecuencia, utilizando las siguientes definiciones:
La frecuencia esperada de las reacciones adversas se presenta según las categorías de frecuencia de CIOMS:
|
Muy comunes: |
≥ 10% |
|
Comunes: |
≥ 1% y < 10% |
|
Poco comunes: |
≥ 0,1% y <10% |
|
Infrecuentes: |
≥ 0,01% y < 0,1% |
|
Muy infrecuentes: |
<0,01% |
|
Clase de sistema de órganos |
Reacción adversa |
|
Trastornos cardiacos |
|
|
Comunes |
Palpitaciones, taquicardia. |
|
Trastornos del oído y laberinto |
|
|
Comunes |
Tinnitus. |
|
Trastornos oculares |
|
|
Comunes |
Visión borrosa, midriasis. |
|
Trastornos gastrointestinales |
|
|
Muy comunes |
Náuseas, boca seca, estreñimiento. |
|
Comunes |
Diarrea, vómito. |
|
Trastornos generales y condiciones en el sitio de administración |
|
|
Muy comunes |
Fatiga. |
|
Comunes |
Escalofríos, astenia, nerviosismo, irritabilidad. |
|
Poco comunes |
Síndrome de abstinencia del medicamento. |
|
Trastornos del sistema inmune |
|
|
Poco comunes |
Hipersensibilidad. |
|
Investigaciones |
|
|
Comunes |
Aumento de peso, aumento de la presión arterial, disminución de peso, aumento del colesterol sanguíneo. |
|
Poco comunes |
Aumento de los triglicéridos sanguíneos, anormalidades en las pruebas de función hepática, aumento de la prolactina sanguínea. |
|
Trastornos del metabolismo y nutricionales |
|
|
Comunes |
Disminución del apetito. |
|
Trastornos musculoesqueléticos, del tejido conectivo y óseo |
|
|
Comunes |
Rigidez musculoesquelética. |
|
Trastornos del sistema nervioso |
|
|
Muy comunes |
Mareos, dolor de cabeza. |
|
Comunes |
Somnolencia, temblores, parestesias, disgeusia, trastornos en la atención. |
|
Poco comunes |
Síncope. |
|
Infrecuentes |
Convulsión, trastorno extrapiramidal. |
|
Trastornos psiquiátricos |
|
|
Muy comunes |
Insomnio. |
|
Comunes |
Ansiedad, sueños anormales, nerviosismo, disminución de la libido, anorgasmia, orgasmo anormal. |
|
Poco comunes |
Despersonalización, hipomanía. |
|
Trastornos renales y urinarios |
|
|
Comunes |
|
|
Infrecuentes |
Vacilación urinaria. Proteinuria |
|
Trastornos del sistema reproductivo y las mamas |
|
|
Comunes |
Disfunción eréctil, retraso en la eyaculación, trastorno en la eyaculación*, falla en la eyaculación*. |
|
Poco comunes |
Disfunción sexual. |
|
Trastornos respiratorios, torácicos y del mediastino |
|
|
Comunes |
Bostezos. |
|
Poco comunes |
Epistaxis. |
|
Trastornos cutáneos y del tejido subcutáneo |
|
|
Muy comunes |
Hiperhidrosis. |
|
Comunes |
Salpullido. |
|
Trastornos vasculares |
|
|
Comunes |
Bochornos. |
|
Poco comunes |
Hipotensión ortostática. |
|
*Se calcula la frecuencia solo en los hombres |
|
Eventos adversos por isquemia cardiaca: En los ensayos clínicos, hubo algunos reportes poco frecuentes de eventos adversos por isquemia cardiaca, incluida la isquemia del miocardio, el infarto del miocardio y la oclusión coronaria que requirió revascularización; estos pacientes tenían numerosos factores subyacentes de riesgo cardiaco. Más pacientes presentaron estos eventos durante el tratamiento con la desvenlafaxina en comparación con el placebo.
Síntomas de descontinuación: Las reacciones medicamentosas adversas reportadas asociadas a la descontinuación abrupta, la reducción de la dosis o la reducción gradual del tratamiento en los ensayos clínicos sobre el trastorno depresivo mayor, con una tasa de ≥ 5% fueron las siguientes: mareos, náuseas, cefalea, irritabilidad, diarrea, ansiedad, sueños anormales, fatiga e hiperhidrosis. En general, los síntomas de descontinuación se presentaron con mayor frecuencia con una duración más larga de la terapia.
Reacciones adversas que causaron la descontinuación del tratamiento: Las reacciones adversas más comunes que causaron la descontinuación en por lo menos el 2% de los pacientes tratados con la desvenlafaxina en los ensayos a corto plazo, de hasta 8 semanas, fueron: náuseas (4%), mareos y vómito (2% cada una); en el ensayo a largo plazo, de hasta 9 meses, la reacción más común fue el vómito (2%).
PRECAUCIONES Y RELACIÓN CON LOS EFECTOS DE LA CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FECUNDIDAD:
Mutagenicidad: La desvenlafaxina no fue mutagénica en los ensayos de mutación bacteriana in vitro (prueba de Ames) y no fue clastogénica en un ensayo de aberración cromosómica in vitro en células CHO cultivadas, un ensayo in vivo de micronúcleos de ratón o un ensayo in vivo de aberración cromosómica en ratas. Además, la desvenlafaxina no fue genotóxica en el ensayo in vitro de mutación prospectiva de células CHO de mamíferos y fue negativa en el ensayo in vitro de transformación de células embrionarias de ratón BALB/c-3T3.
Alteración de la fecundidad: Se observó una menor fecundidad en un ensayo preclínico en el cual las ratas machos y hembras recibieron el succinato de desvenlafaxina.
Se observó este efecto con dosis orales de aproximadamente 30 veces, con base en mg/kg, y 5 veces, con base en mg/m2, la dosis humana máxima recomendada (MRHD) de 200 mg/día. No hubo algún efecto sobre la fecundidad con las dosis orales aproximadamente 9 veces la MRHD con base en mg/kg y 1,5 veces la MRHD con base en mg/m2. No se sabe cuál es la relevancia de este hallazgo para los seres humanos.
Teratogenicidad: Cuando se administró por vía oral la desvenlafaxina a ratas y conejas preñadas durante el periodo de organogénesis, no hubo evidencias de teratogenicidad en las ratas con ninguna de las dosis ensayadas, hasta 30 veces con base en mg/kg y hasta 5 veces la dosis humana máxima recomendada (MRHD) de 200 mg/día (con base en mg/m2) en las ratas. En las conejas, no hubo evidencias de teratogenicidad con dosis de hasta 23 veces (con base en mg/kg) la MRHD de 200 mg/día o 7 veces la MRHD (con base en mg/m2). Sin embargo, el peso de los fetos fue menor en las ratas con una dosis sin efecto de 30 veces la MRHD (con base en mg/kg) y 5 veces la MRHD (con base en mg/m2).
Cuando se administró la desvenlafaxina por vía oral a ratas preñadas durante la gestación y lactancia, hubo una reducción de los pesos de los cachorros y un aumento en las muertes de los cachorros durante los primeros cuatro días de lactancia. No se sabe cuál fue la causa de estas muertes. La dosis sin efecto para la mortalidad de los cachorros de rata fue 30 veces con base en mg/kg y 5 veces con base en mg/m2 la MRHD de 200 mg/día. El tratamiento de las madres con desvenlafaxina con una dosis 90 veces la MRHD (con base en mg/kg) y 15 veces la MRHD (con base en mg/m2) no afectó el crecimiento posterior al destete y el desarrollo reproductivo de la progenie.
INTERACCIONES MEDICAMENTOSAS Y OTRAS:
Inhibidores de la monoaminooxidasa (IMAO): Se han reportado reacciones adversas, algunas serias, en los pacientes que recientemente habían suspendido un inhibidor de la monoaminooxidasa (IMAO) y que iniciaron un antidepresivo con propiedades farmacológicas similares a la desvenlafaxina (IRSN o ISRS) o quienes habían suspendido recientemente la terapia con IRSN o ISRS antes de iniciar un IMAO. El uso concomitante de la desvenlafaxina en los pacientes que toman IMAO está contraindicado.
Agentes activos en el sistema nervioso central (SNC): El riesgo de usar la desvenlafaxina en combinación con otros agentes activos en el sistema nervioso central (SNC) no se ha evaluado en forma sistemática. Por lo tanto, se aconseja tener cuidado cuando se usa la desvenlafaxina en combinación con otros agentes activos en el SNC.
Síndrome de la serotonina: Al igual que con otros agentes serotoninérgicos, puede desarrollarse un síndrome de la serotonina que potencialmente atente contra la vida con el tratamiento con la desvenlafaxina, en particular con el uso concomitante de otros medicamentos que puedan afectar el sistema serotoninérgico de neurotransmisores (incluidos los triptanos, ISRS, IRSN, el litio, la sibutramina, el tramadol o la hierba de San Juan [Hypericum perforatum]), con agentes que afectan el metabolismo de la serotonina (como los IMAO, incluido el linezolid [un antibióticos que es un IMAO no selectivo y reversible]) o con los precursores de la serotonina (tales como los suplementos de triptofano). Entre los síntomas del síndrome de la serotonina puede haber cambios en el estado mental, inestabilidad autonómica, aberraciones neuromusculares y/o síntomas gastrointestinales.
Si se justifica clínicamente el tratamiento concomitante con la desvenlafaxina y un ISRS, un IRSN o un agonista del receptor de la 5-hidroxitriptamina (triptano), se recomienda la observación cuidadosa del paciente, particularmente durante el inicio del tratamiento y los aumentos de la dosis. No se recomienda el uso concomitante de la desvenlafaxina con los precursores de la serotonina (tales como los suplementos de triptofano).
Etanol: Se demostró en un ensayo clínico que la desvenlafaxina no aumenta la alteración de las destrezas mentales y motoras causadas por el etanol. Sin embargo, al igual que con todos los agentes activos sobre el SNC, se debe aconsejar a los pacientes que eviten el consumo de bebidas alcohólicas cuando toman la desvenlafaxina.
Potencial de otros medicamentos para afectar la desvenlafaxina:
• Inhibidores de CYP3A4: La isoenzima CYP3A4 tiene un efecto mínimo en la eliminación de la desvenlafaxina. En un ensayo clínico, el ketoconazol (200 mg BID) aumentó el área bajo la curva (ABC) de concentración vs. tiempo de la desvenlafaxina (400 mg en una sola dosis) en aproximadamente el 43%, una interacción débil, y la Cmáx en alrededor del 8%. El uso concomitante de la desvenlafaxina con los inhibidores potentes de CYP3A4 podría causar una mayor exposición a la desvenlafaxina.
• Inhibidores de otras enzimas CYP: Con base en los datos in vitro, no se espera que los medicamentos que inhiben las isoenzimas CYP 1A1, 1A2, 2A6, 2D6, 2C8, 2C9, 2C19 y 2E1 tengan un impacto significativo sobre el perfil farmacocinético de la desvenlafaxina.
Potencial de la desvenlafaxina para afectar otros medicamentos:
• Agentes metabolizados por CYP2D6: Los ensayos clínicos han demostrado que la desvenlafaxina de CYP2D no tiene un efecto clínicamente relevante sobre el metabolismo de CYP2D6 a una dosis de 100 mg al día. Cuando se administró el succinato de desvenlafaxina a una dosis de 100 mg al día junto a una dosis única de 50 mg de desipramina, un sustrato para CYP2D6, el ABC de la desipramina aumentó en aproximadamente un 17%. Cuando se administraron 400 mg, el ABC de la desipramina aumentó en aproximadamente un 90%. El uso concomitante de la desvenlafaxina con un agente metabolizado por la CYP2D6 podría causar concentraciones más altas de ese agente.
• Agentes metabolizados por CYP3A4: In vitro, la desvenlafaxina no inhibe ni induce las isoenzimas CYP3A4. En un ensayo clínico, la desvenlafaxina (400 mg al día) redujo el ABC del midazolam (una sola dosis de 4 mg), un sustrato de CYP3A4, en aproximadamente el 31%.98 El uso concomitante de la desvenlafaxina con un agente metabolizado por la CYP3A4 puede causar concentraciones más bajas de ese agente.
• Agentes metabolizados por CYP1A2, 2A6, 2C8, 2C9 y 2C19: In vitro, la desvenlafaxina no inhibe las isoenzimas CYP1A2, 2A6, 2C8, 2C9 y 2C19 y no se esperaría que afectara la farmacocinética de aquellos agentes que son metabolizados por esas isoenzimas CYP.
Transportador de P-glucoproteínas: In vitro, la desvenlafaxina no es un sustrato 101 ni un inhibidor 102 del transportador de las P-glucoproteínas.
Terapia electroconvulsiva: No hay datos clínicos que establezcan los riesgos y/o beneficios de la terapia electroconvulsiva en combinación con el tratamiento con la desvenlafaxina para el trastorno depresivo mayor.
DOSIS, ADMINISTRACIÓN Y MANEJO:
Trastorno depresivo mayor: La dosis recomendada para la desvenlafaxina es 50 mg una vez al día, con o sin alimentos. En los ensayos clínicos, se demostró que dosis de 50-400 mg/día fueron eficaces, aunque no se demostró un beneficio adicional con las dosis mayores que 50 mg/día. Con base en el criterio clínico, si está indicado un aumento de la dosis para el paciente individual, debe realizarse en forma gradual y en intervalos no menores que 7 días. La dosis máxima no debe ser mayor que 200 mg/día.
PRISTIQ® debe tomarse a aproximadamente la misma hora todos los días. Los comprimidos deben tragarse enteros con un líquido y no deben partirse, triturarse, masticarse o disolverse.
Pacientes con insuficiencia renal: No se requiere un ajusto de la dosificación en los pacientes con una insuficiencia renal leve (aclaración de la creatinina en 24 horas = 50-80 mL/min).
La dosis recomendada en los pacientes con una insuficiencia renal moderada (aclaramiento de la creatinina en 24 horas = 30-50 mL/min) es de 50 mg por día.
La dosis inicial recomendada en los pacientes con insuficiencia renal severa (aclaramiento de la creatinina en 24 horas <30 mL/min) o con enfermedad renal en fase terminal es de 50 mg de día de por medio. Debido a la variabilidad individual en el aclaramiento de estos pacientes, es deseable individualizar la dosificación. No deben administrarse dosis suplementales a los pacientes después de la diálisis.
Uso en los pacientes con insuficiencia hepática: No se requiere un ajuste de la dosis en los pacientes con insuficiencia hepática.
No se recomienda escalar la dosis más allá de 100 mg/día.
Uso pediátrico: No se ha establecido la seguridad y eficacia en los pacientes menores de 18 años de edad.
Uso en los pacientes ancianos: No se requiere un ajuste de la dosificación solo con base en la edad; sin embargo, cuando se determina la dosis, debe considerarse una posible reducción del aclaramiento renal de la desvenlafaxina.
Descontinuación de la desvenlafaxina: Se han reportado síntomas asociados a la descontinuación de la desvenlafaxina, otros IRSN y ISRS. Es necesario monitorear a los pacientes para detectar estos síntomas al suspender el tratamiento. Siempre que sea posible, se recomienda una reducción gradual de la dosis en vez de la suspensión abrupta. Si ocurren síntomas intolerables tras la disminución de la dosis o la descontinuación del tratamiento, puede considerarse reiniciar la dosis prescrita anteriormente y luego el médico puede continuar reduciendo la dosis pero a una velocidad más gradual.
SOBREDOSIFICACIÓN: La experiencia clínica con la sobredosificación con el succinato de desvenlafaxina es limitada en los seres humanos.
Entre los pacientes incluidos en los ensayos clínicos sobre el trastorno depresivo mayor con el succinato de desvenlafaxina antes de la comercialización, hubo cuatro adultos que ingirieron dosis mayores que 800 mg del succinato de desvenlafaxina (4000 mg [solo desvenlafaxina], 900, 1800 y 5200 mg [en combinación con otros medicamentos]); todos los pacientes se recuperaron. Además, el niño de 11 meses de edad de un paciente accidentalmente ingirió 600 mg de succinato de desvenlafaxina, fue tratado y se recuperó.
No se sabe si hay antídotos específicos para la desvenlafaxina. No se recomienda la inducción de emesis, debido al volumen moderado de distribución de este medicamento, no es probable que la diuresis forzada, diálisis, hemoperfusión o transfusión de intercambio sanguíneo sean de beneficio.
El tratamiento debe consistir de las medidas generales utilizadas para el manejo de la sobredosis con cualquier ISRS o IRSN. Debe asegurarse que las vías respiratorias, la oxigenación y ventilación sean adecuadas. Debe monitorearse el ritmo cardiaco y los signos vitales. También se recomienda aplicar las medidas generales sintomáticas y de apoyo. El lavado gástrico con un tubo orogástrico de gran calibre, con protección apropiada para las vías respiratorias, podría estar indicado si fuera necesario, siempre y cuando se realice poco tiempo después de la ingestión o en los pacientes sintomáticos. Debe administrarse carbón activado.
PFIZER
® Marca registrada
DESCRIPCIÓN: El producto PRISTIQ® consiste en tabletas de liberación prolongada compuestas por succinato de desvenlafaxina, el cual es un polvo blanco a blanco hueso, que es soluble en el agua. La solubilidad del succinato de desvenlafaxina depende del pH. Su coeficiente de reparto en octanol:sistema acuoso (a pH 7,0) es de 0,21, su nombre químico es Succinato de (R,S’)-4-[2-(dimetilamino)-1-(1-hidroxiciclohexil)etil]fenol monohidratada 1 y su compuesto activo corresponde a la desvenlafaxina.
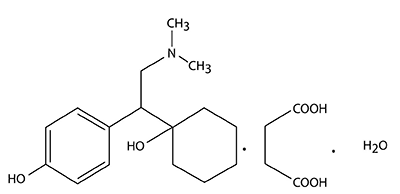
Fórmula molecular:
C16H25NO2 (base libre).
C16H25NO2•C4H6O4•H2O (sal monohidratada del succinato).
Categoría farmacológica: Antidepresivo. Inhibidor de la recaptación de la serotonina y norepinefrina.