
PREMARIN
ESTRÓGENOS CONJUGADOS
Tabletas
Tabletas,
FORMULACIÓN Y FORMA FARMACÉUTICA: Crema vaginal PREMARIN® (estrógenos conjugados), cada gramo contiene 0,625 mg de estrógenos conjugados, USP.
ESTRUCTURA QUÍMICA DE INGREDIENTES ACTIVOS:
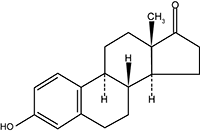
Estrona: 3-Hidroxiestra-1,3,5(10)-trien-17-ona
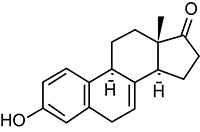
Equilino: 1,3,5,7-estratetraen-3-ol-17-ona
INDICACIONES:
Crema vaginal con EC: Tratamiento de la atrofia vaginal vulvar o Kraurosis vulvae.
MODO DE ACCIÓN: Los estrógenos endógenos son en gran parte responsables del desarrollo y mantenimiento del sistema productivo femenino y de las características sexuales secundarias. A pesar de que los estrógenos circulantes se encuentran en un equilibrio dinámico de interconversiones metabólicas, estradiol es el principal estrógeno humano intracelular y es sustancialmente más potente que sus metabolitos, estrona y estriol, a nivel del receptor.
La fuente primaria de estrógeno en mujeres adultas con ciclo normal es el folículo ovárico, el cual secretas de 70 a 500 mcg de estradiol diariamente, dependiendo de la fase del ciclo menstrual. Tras la menopausia, la mayor parte del estrógeno endógeno es producido por conversión de androstenediona, la cual es secretada por la corteza adrenal, a estrona en los tejidos periféricos. Por lo tanto, estrona y la forma sulfato-conjugada, estrona sulfato, son los estrógenos circulantes más abundantes en mujeres postmenopáusicas.
Los estrógenos generalmente actúan mediante la unión a los receptores nucleares en los tejidos receptivos al estrógeno. A la fecha, se han identificado dos receptores del estrógeno. La proporción de estos receptores varía de un tejido a otro. Los estrógenos circulantes modulan la secreción pituitaria de las gonadotropinas, la hormona luteinizante (HL) y la hormona folículo estimulante (FSH, por sus siglas en inglés), mediante un mecanismo de retroalimentación negativa. Los estrógenos actúan para reducir los niveles elevados de estas gonadotropinas observados en las mujeres posmenopáusicas.
FARMACOCINÉTICA:
Absorción: Generalmente, los estrógenos se eliminan en forma casi paralela con vidas medias que varían de 10 a 20 horas, cuando se corrigen por las concentraciones endógenas según se requiera.
Distribución: La distribución de los estrógenos exógenos es similar a la de los estrógenos endógenos. Los estrógenos se distribuyen ampliamente en el cuerpo y por lo general se encuentran en una concentración mayor en los órganos meta de las hormonas sexuales. Los estrógenos circulan en la sangre en su mayoría unidos a la globulina fijadora de hormonas sexuales (SHBG, por sus siglas en inglés) y la albúmina.
Metabolismo: Los estrógenos exógenos se metabolizan de la misma forma que los estrógenos endógenos. Los estrógenos circulantes existen en un equilibrio dinámico de interconversiones metabólicas. Estas transformaciones ocurren especialmente en el hígado. El estradiol se convierte reversiblemente a estrona y ambos pueden convertirse en estriol, que es el principal metabolito urinario. Los estrógenos también pasan por la recirculación enterohepática por medio de la conjugación con sulfato y glucurónido en el hígado, la secreción biliar de los conjugados en el intestino y la hidrólisis en el intestino seguida de reabsorción. En las mujeres posmenopáusicas, una proporción significativa de los estrógenos circulantes existe como conjugados con sulfato, especialmente el sulfato de estrona, que actúa como una reserva circulante para la formación de más estrógenos activos.
Excreción: El estradiol, la estrona y el estriol se excretan en la orina, junto con los conjugados con glucurónido y sulfato.
Poblaciones especiales: No se realizaron estudios farmacocinéticos en las poblaciones especiales, incluidos los pacientes con insuficiencia renal o hepática.
FARMACODINAMIA, EFICACIA CLÍNICA
Categoría terapéutica: Estrógenos conjugados para terapia de reemplazo hormonal.
Efectos sobre la atrofia vulvar y vaginal: Los resultados de las tasas de maduración vaginal en los ciclos 6 y 13 mostraron que las diferencias desde el placebo fueron estadísticamente significativas (p < 0,001) para todos los grupos de tratamiento.
Crema vaginal con EC:
Efectos sobre la vaginitis atrófica: Se realizó un estudio aleatorio, prospectivo, a doble ciego, controlado con placebo, de 12 semanas, para comparar la seguridad y eficacia de 2 esquemas con estrógenos conjugados en una crema vaginal [Crema vaginal PREMARIN® [PVC]): 0,5 g [0,3 mg de estrógenos conjugados (EC)] administrados dos veces por semana y 0,5 g (0,3 mg EC) administrados en forma secuencial por 21 días con el medicamento seguidos de 7 días sin el medicamento, con esquemas con los placebos concordantes, para el tratamiento de los síntomas moderados a severos de la atrofia vulvar y vaginal debida a la menopausia. Después de la fase inicial de 12 semanas, a doble ciego y controlada con placebo, siguió una fase a etiqueta abierta para evaluar la seguridad endometrial hasta la semana 52. El estudio aleatorizó a 423 mujeres postmenopáusicas en general sanas entre 44 y 77 años de edad (media de 57,8 años), quienes en la línea de base habían tenido <5 por ciento de células superficiales en un frotis vaginal, un pH vaginal >5 y quienes identificaron el síntoma moderado a severo más molesto de la atrofia vulvar y vaginal. En su mayoría (92,2 por ciento), las mujeres eran caucásicas (n = 390), el 7,8 por ciento era de otra raza (n = 33).
Todas las participantes fueron evaluadas para determinar la mejoría en el cambio medio desde la línea de base hasta la semana 12 en las variables coprimarias de eficacia: El síntoma más molesto de la atrofia vulvar y vaginal (definido como el síntoma moderado a severo que había sido identificado por la mujer como el más molesto para ella en la línea de base), el porcentaje de células vaginales superficiales y el porcentaje de células vaginales parabasales y el pH vaginal.
En la fase a doble ciego de 12 semanas, se observó un cambio medio estadísticamente significativo entre la línea de base y la semana 12 en el síntoma de dispareunia para los dos esquemas con estrógenos conjugados en la crema vaginal [Crema vaginal PREMARIN® [PVC])(0,5 g dos veces por semana y 0,5 g por 21 días con el medicamento seguidos de 7 días sin el medicamento), en comparación con el placebo respectivo; ver Cuadro 2. También se demostró para cada esquema con estrógenos conjugados en la crema vaginal [Crema vaginal PREMARIN® [PVC]), en comparación con el placebo, un aumento estadísticamente significativo en el porcentaje de células superficiales en la semana 12 (28 por ciento y 26 por ciento, respectivamente, en comparación con 3 por ciento y 1 por ciento para el placebo correspondiente), una disminución estadísticamente significativa de las células parabasales (-61 por ciento y -58 por ciento, respectivamente, en comparación con -21 por ciento y -7 por ciento para el placebo correspondiente) y una reducción media estadísticamente significativa entre la línea de base y la semana 12 en el pH vaginal (-1,62 y -1,57, respectivamente, en comparación con -0,36 y -0,26 para el placebo correspondiente). En este estudio, no hubo diferencias estadísticamente significativas entre la PVC y el placebo.
La seguridad endometrial se evaluó mediante biopsia endometrial en todas participantes asignadas aleatoriamente en la semana 52. En las 115 participantes (83 con el esquema 21/7 y 72 con el esquema dos veces por semana) que terminaron el periodo de 52 semanas con un seguimiento completo y biopsias endometriales evaluables, no hubo reportes de hiperplasia endometrial o carcinoma endometrial.
|
Cuadro 1. Cambio medio en la severidad de la dispareunia en comparación con el placebo población mitt del valor del síntomas más molesto para la dispareunia, locf |
||||
|
Dispareunia* |
PVC 0,5 g 2x/sema |
Placebo 0,5 g 2x/sema |
PVC 0,5 g 21/7b |
Placebo 0,5 g 21/7b |
|
n media (DE) |
n media (DE) |
n media (DE) |
n media (DE) |
|
|
Línea de base |
52 2,43 (0,76) |
22 2,28 (1,04) |
50 2,26 (0,99) |
18 2,32 (0,88) |
|
Semana 12 |
52 0,88 (0,96) |
21 1,63 (1,16) |
50 0,77 (1,05) |
18 1,92 (1,03) |
|
Semana 12 cambio desde la línea de base |
52 -1,55 (0,92) |
21 -0,62 (1,23) |
20 -1,48 (1,17) |
18 -0,40 (1,01) |
|
Valor de p vs. placebo |
<0,001c |
- - |
<0,001d |
- - |
|
a PVC 2x/sem = aplicar PVC dos veces por semana b PVC 21/7 = aplicar PVC por 21 días y luego 7 días sin tratamiento c Comparación de PVC 2x/sem con placebo 2x/sem d Comparación de PVC 21/7 con placebo 21/7 * Escala de evaluación de síntomas: 0 (ninguno), 1 (leve), 2 (moderado), 3 (severo) |
||||
Estudios de la Iniciativa de Salud de las Mujeres (WHI): El Estudio de la Iniciativa de la Salud de las Mujeres (WHI, por sus siglas en inglés) reclutó a unas 27.000 mujeres posmenopáusicas predominantemente sanas en dos subestudios, para evaluar los riesgos y beneficios de los estrógenos conjugados (EC) [0,625 mg diarios] solos o combinados con acetato de medroxiprogesterona (AMP) [0,625 mg/2,5 mg diarios] en comparación con el placebo. El punto final primario fue la incidencia de la enfermedad cardiaca coronaria (CHD, por sus siglas en inglés), es decir, el infarto del miocardio (IM) no mortal, el IM silencioso y la muerte coronaria. El punto final primario de seguridad fue la incidencia del cáncer de mama invasivo. El subestudio no evaluó los efectos de la terapia de reemplazo hormonal sobre los síntomas menopáusicos.
El subestudio con estrógeno solo se detuvo en forma prematura debido a que se observó un mayor riesgo de accidente vascular cerebral y se consideró que no se obtendría más información sobre los riesgos y beneficios del estrógeno solo en los puntos finales primarios predeterminados.
No se reportó ningún efecto general en los eventos de la enfermedad cardiaca coronaria (CHD) (definida como IM no mortal, IM silencioso o muerte, debidos a la CHD) en las mujeres que recibieron estrógeno solo en comparación con el placebo. El siguiente cuadro muestra los resultados del subestudio sobre estrógeno solo, que incluyó a 10.739 mujeres (edad promedio de 63 años, rango de 50 a 79; el 75,3% caucásicas, 15,1% negras, 6,1% hispanas, 3,6% otras), después de un seguimiento promedio de 6,8 años.
En el subestudio de la WHI sobre el estrógeno solo, no se observó ningún efecto general en el riesgo relativo (RR) de la CHD (RR 0,95, intervalo de confianza nominal del 95% [nIC] 0,78- 1,16; se reportó un RR de CHD ligeramente elevado en el periodo de seguimiento temprano y disminuyó con el tiempo. No se reportó ningún efecto significativo en el RR de cáncer de mama invasivo (RR 0,80, nIC del 95% 0,62 - 1,04) o cáncer colorrectal (RR 1,08, nIC del 95% 0,75 - 1,55). El uso del estrógeno se asoció a un riesgo significativamente mayor de accidente vascular cerebral (RR 1,33, 95% nIC 1,05 - s1,68) y trombosis de venas profundas (TVP) (RR 1,47, nIC del 95% 1,06 - 2,06). El RR de EP (RR 1,37, nIC del 95% 0,9 0- 2,07) no aumentó significativamente. Se reportó un menor riesgo estadísticamente significativo de fracturas de cadera, vertebrales y totales con el uso de estrógeno [(RR 0,65, nIC del 95% 0,45 - 0,94), (RR 0,64, nIC del 95% 0,44 - 0,93) y (RR 0,71, nIC del 95% 0,64 - 0,80), respectivamente]. El subestudio sobre estrógeno solo no reportó un efecto estadísticamente significativo en la muerte por otras causas (RR 1,08, nIC del 95% 0,88 - 1,32) o un efecto en los riesgos de mortalidad general (RR 1,04, nIC del 95% 0,88 - 1,22). Estos intervalos de confianza no están ajustados según vistas y comparaciones múltiples.
|
Cuadro 2. |
|||
|
Evento |
Riesgo relativo de EC vs. placebo (ICn 95%)a |
Placebo n = 5429 |
EC n = 5310 |
|
Riesgo absoluto por 10.000 años mujer |
|||
|
Eventos por enfermedad coronaria b |
0,95 (0,78 - 1,16) |
57 |
54 |
|
Infarto del miocardio no mortal b |
0,91 (0,73 - 1,14) |
43 |
40 |
|
Muerte por enfermedad coronaria b |
1,01 (0,71 - 1,43) |
16 |
16 |
|
Todos los accidentes vascular cerebrales b |
1,33 (1,05 - 1,68) |
33 |
45 |
|
Isquémicos b |
1,55 (1,19 - 2,01) |
25 |
38 |
|
Trombosis de venas profundas b, c |
1,47 (1,06 - 2,06) |
15 |
23 |
|
Embolia pulmonar b |
1,37 (0,90 - 2,07) |
10 |
14 |
|
Cáncer de mama invasivo b |
0,80 (0,62 - 1,04) |
34 |
28 |
|
Cáncer colorrectal d |
1,08 (0,75 - 1,55) |
16 |
17 |
|
Fractura de cadera b |
0,65 (0,45 - 0,94) |
19 |
12 |
|
Fracturas vertebrales b, c |
0,64 (0,44 - 0,93) |
18 |
11 |
|
Fracturas del brazo inferior o muñeca b, c |
0,58 (0,47 - 0,72) |
59 |
35 |
|
Fracturas totales b, c |
0,71 (0,64 - 0,80) |
197 |
144 |
|
Muertes por otras causas d, e |
1,08 (0,88 - 1,32) |
50 |
53 |
|
Mortalidad global b, c |
1,04 (0,88 - 1,22) |
75 |
79 |
|
Índice global f |
1,02 (0,92 - 1,13) |
201 |
206 |
|
a Intervalos de confianza nominales sin ajustar por vistas múltiples y comparaciones múltiples. b Los resultados se basan en datos adjudicados centralmente para un seguimiento promedio de 7,1 años. c No se incluyó en el índice global. d Los resultados se basan en un seguimiento promedio de 6,8 años. e Todas las muertes, excepto por cáncer de mama o colorrectal, enfermedad coronaria definitiva o probable, embolia pulmonar o enfermedad vascular cerebral. f Un subgrupo de los eventos se combinó en un “índice global”, definido como la primera presentación de eventos coronarios, cáncer de mama invasivo, accidente vascular cerebral, embolia pulmonar, cáncer colorrectal, fractura de cadera o muerte debida a otras causas. |
|||
El Cuadro 3 describe los resultados primarios del subestudio sobre estrógeno solo estratificado por edad en la línea de base.
|
Cuadro 3. |
||||||
|
Edad |
||||||
|
Punto final |
50 - 59 años |
60 - 69 años |
70 - 79 años |
|||
|
EC |
Placebo |
EC |
Placebo |
EC |
Placebo |
|
|
CHD a,b |
||||||
|
Número de casos |
21 |
34 |
96 |
106 |
84 |
77 |
|
Riesgo absoluto (N)c |
17 |
27 |
58 |
62 |
98 |
88 |
|
Razón de riesgo (IC del 95%) |
0,63 (0,36 - 1,09) |
0,94 (0,71 - 1,24) |
1,13 (0,82 - 1,54) |
|||
|
Accidente vascular cerebral b |
||||||
|
Número de casos |
18 |
21 |
84 |
54 |
66 |
52 |
|
Riesgo absoluto (N)c |
15 |
17 |
51 |
31 |
76 |
59 |
|
Razón de riesgo (IC del 95%) |
0,89 (0,47 - 1,69) |
1,62 (1,15 - 2,27) |
1,21 (0,84 - 1,75) |
|||
|
TVP b |
||||||
|
Número de casos |
16 |
10 |
39 |
29 |
30 |
20 |
|
Riesgo absoluto (N)c |
13 |
8 |
23 |
17 |
34 |
22 |
|
Razón de riesgod (IC del 95%) |
1,64 (0,74 - 3,60) |
3,02 (1,51 - 6,06) |
4,54 (2,22 - 9,31) |
|||
|
TEV b |
||||||
|
Número de casos |
20 |
15 |
54 |
43 |
37 |
28 |
|
Riesgo absoluto (N)c |
16 |
12 |
32 |
25 |
42 |
31 |
|
Razón de riesgod (IC del 95%) |
1,37 (0,70 - 2,68) |
2,82 (1,59 - 5,01) |
3,77 (2,07 - 6,89) |
|||
|
Embolia pulmonarb |
||||||
|
Número de casos |
12 |
8 |
28 |
17 |
12 |
14 |
|
Riesgo absoluto (N)c |
10 |
6 |
17 |
10 |
14 |
16 |
|
Razón de riesgod (IC del 95%) |
1,54 (0,63 - 3,77) |
2,80 (1,28 - 6,16) |
2,36 (0,96 - 5,80) |
|||
|
Cáncer de mama invasivo |
||||||
|
Número de casos |
25 |
35 |
42 |
60 |
27 |
29 |
|
Riesgo absoluto (N)c |
21 |
29 |
26 |
36 |
32 |
34 |
|
Razón de riesgo (IC del 95%) |
0,72 (0,43 - 1,21) |
0,72 (0,49 - 1,07) |
0,94 (0,56 - 1,60) |
|||
|
Cáncer colorrectal |
||||||
|
Número de casos |
8 |
14 |
26 |
31 |
27 |
13 |
|
Riesgo absoluto (N)c |
7 |
12 |
16 |
19 |
32 |
15 |
|
Razón de riesgo (IC del 95%) |
0,59 (0,25 - 1,41) |
0,88 (0,52 - 1,48) |
2,09 (1,08 - 4,04) |
|||
|
Fractura de cadera b |
||||||
|
Número de casos |
5 |
1 |
9 |
20 |
32 |
52 |
|
Riesgo absoluto (N)c |
4 |
1 |
5 |
12 |
37 |
58 |
|
Razón de riesgo (IC del 95%) |
5,02 (0,59 - 43,02) |
0,47 (0,22 - 1,04) |
0,64 (0,41 - 0,99) |
|||
|
Fracturas totales b |
||||||
|
Número de casos |
153 |
173 |
220 |
348 |
167 |
240 |
|
Riesgo absoluto (N)c |
126 |
139 |
132 |
201 |
191 |
269 |
|
Razón de riesgo (IC del 95%) |
0,90 (0,72 - 1,12) |
0,63 (0,53 - 0,75) |
0,70 (0,57 - 0,85) |
|||
|
Mortalidad general b |
||||||
|
Número de casos |
34 |
48 |
129 |
131 |
134 |
113 |
|
Riesgo absoluto (N) |
28 |
38 |
77 |
75 |
153 |
127 |
|
Razón de riesgo (IC del 95%) |
0,71 (0,46 - 1,11) |
1,02 (0,80 - 1,30) |
1,20 (0,93 - 1,55) |
|||
|
a CHD definida como infarto del miocardio o muerte coronaria. b Con base en los datos adjudicados en una duración media de la terapia de 7,1 años. c El riesgo absoluto es por 10.000 años persona. d Las razones de riesgo de la TEV comparadas con las mujeres entre 50 y 59 años que tomaron placebo. |
||||||
El lapso de tiempo entre el inicio de la menopausia y de la terapia con estrógeno puede afectar el perfil general de riesgo/beneficio. El subestudio de la WHI sobre estrógeno solo, estratificado por edad, mostró una tendencia no significativa de un riesgo reducido de CHD y mortalidad total en comparación con el placebo en las mujeres que iniciaron la terapia hormonal cerca de la menopausia que en las que iniciaron la terapia más tiempo después de la menopausia.
Estudio sobre la memoria de la iniciativa de salud de las mujeres: En el Estudio de la Memoria de la Iniciativa de Salud de las Mujeres (WHIMS, por sus siglas en inglés) sobre estrógeno solo, un estudio complementario de la WHI, se aleatorizó una población de 2947 mujeres postmenopáusica, histerectomizadas y predominantemente sanas, con edades entre 65 y 79 años, a recibir estrógenos conjugados (EC) (0,625 mg diarios) o placebo. El riesgo relativo de una demencia probable para los EC solos vs. el placebo fue de 1.49 (IC 95%: 0.83 – 2.66). El riesgo absoluto de demencia probable para los EC solos versus el placebo fue de 37 vs. 25 casos por 10.000 años mujer. Se definió la demencia probable en este estudio para incluir la enfermedad de Alzheimer (AD, por sus siglas en inglés), la demencia vascular (VaD, por sus siglas en inglés) y tipos mixtos (con características de AD y VaD). Debido a que el subestudio se realizó en mujeres entre 65 y 79 años, se desconoce si estos hallazgos son aplicables a las mujeres posmenopáusicas más jóvenes (ver Demencia y Uso geriátrico).
CONTRAINDICACIONES:
• Embarazo conocido o sospechado (ver Embarazo).
• Sangrado uterino anormal no diagnosticado.
• Cáncer de mama conocido, sospechado o pasado (excepto el uso de comprimidos en ciertas pacientes seleccionadas apropiadamente que estén siendo tratadas por una enfermedad metastásica).
• Neoplasia conocida o sospechada dependiente de estrógeno (p. ej., cáncer endometrial, hiperplasia endometrial).
• Enfermedad tromboembólica arterial activa o antecedentes de esta (p. ej., accidente vascular cerebral, infarto del miocardio) o tromboembolismo venoso (como trombosis de venas profundas, embolia pulmonar).
• Disfunción o enfermedad hepática activa o crónica.
• Transtornos tromboembólicos conocidos (p. ej., proteina C, proteína S o la deficiencia antitrombina).
• Hipersensibilidad conocida o sospechada a ingredientes.
PRECAUCIONES:
Adición de progestina cuando una mujer no se ha sometido a una histerectomía: Los estudios sobre la adición de una progestina por 10 días o más de un ciclo de administración de estrógeno o diariamente con el estrógeno en un esquema continuo, han reportado una incidencia menor de hiperplasia endometrial que la que podría inducir el tratamiento solo con estrógenos. La hiperplasia endometrial puede ser un precursor del cáncer endometrial.
Existen, sin embargo, riesgos posibles que pueden asociarse al uso de progestinas con estrógenos en comparación con los esquemas con estrógeno solo. Estos incluyen un posible riesgo mayor de cáncer de mama, efectos adversos en el metabolismo de las lipoproteínas (reducir el HDL, aumentar el LDL) y alteración de la tolerancia a la glucosa.
Retención de líquidos: Debido a que los estrógenos pueden causar algún grado de retención de líquidos, cuando se recetan los estrógenos es necesario observar cuidadosamente a las pacientes con condiciones que pueden verse afectadas por este factor, como la disfunción cardiaca o renal.
Hipertrigliceridemia: En el Estudio de la Salud y Osteoporosis, Progestinas y Estrógenos (HOPE), los aumentos porcentuales medios de los triglicéridos séricos desde la línea de base después de un año de tratamiento con EC de 0,625 mg, 0,45 mg y 0,3 mg en comparación con el placebo fueron de 34,3, 30,2, 25,1 y 10,8, respectivamente.
Debe procederse con precaución en el caso de pacientes con hipertrigliceridemia preexistente, ya que se han reportado casos infrecuentes de grandes aumentos de triglicéridos plasmáticos que causan pancreatitis con la terapia con estrógenos en esta población.
Función hepática alterada y antecedentes de ictericia colestásica: Para las pacientes con antecedentes de ictericia colestásica asociada al uso de estrógenos en el pasado o al embarazo, debe procederse con precaución y en el caso de recurrencia, se debe descontinuar el medicamento. Los estrógenos podrían ser pobremente metabolizados en pacientes con función hepática alterada.
Presión arterial elevada: En un reducido número de reportes de casos, los aumentos sustanciales en la presión arterial durante la TE se han atribuido a las reacciones idiosincrásicas a los estrógenos. En un ensayo clínico grande, aleatorizado y controlado con placebo, no se observó un efecto generalizado de la TE en la presión arterial.
Exacerbación de otras condiciones: La terapia con estrógenos puede exacerbar el asma, la epilepsia, las migrañas con o sin aura, otosclerosis, la porfiria, el lupus eritematoso sistémico y los hemangiomas hepáticos y debe usarse con precaución en las mujeres con estas condiciones.
La endometriosis puede exacerbarse con la administración de la TE. Debe considerarse la adición de una progestina en aquellas mujeres que se han sometido a una histerectomía pero que se sabe presentan endometriosis residual, ya que se ha reportado la transformación maligna después de la terapia solo con estrógeno.
Hipocalcemia: Los estrógenos deben usarse con precaución en las personas con hipocalcemia severa preexistente.
Hipotiroidismo: La administración de estrógenos conlleva a niveles incrementados de globulina transportadora de la hormona tiroidea (TBG, por sus siglas en inglés). Las pacientes dependientes de la terapia de reemplazo de las hormonas tiroideas, y que estén recibiendo estrógenos, pueden requerir mayores dosis para mantener sus niveles de hormonas tiroideas libres en un rango aceptable (ver Interacciones entre las pruebas de laboratorio).
Monitoreo de laboratorio: La administración de estrógenos debe ser guiada por respuesta clínica, en vez de los niveles hormonales (p. ej., estradiol, FSH).
Condones de látex: Se ha demostrado que la crema vaginal con EC debilita los condones de látex. Debe considerarse el potencial de la crema vaginal con EC para debilitar y contribuir a que fallen los condones, diafragmas o tapones cervicales hechos de látex o hule.
ABUSO Y DEPENDENCIA: No hay evidencia disponible sobre abuso y dependencia.
ADVERTENCIAS ESPECIALES:
General:
Crema vaginal con EC: Puede ocurrir absorción sistémica con el uso de la crema vaginal con EC. Deben considerarse las advertencias y precauciones asociadas al tratamiento oral con EC.
Riesgo cardiovascular: Se ha reportado que la TE aumenta el riesgo de accidente vascular cerebral y la trombosis de venas profundas (TVP).
Pacientes que tienen factores de riesgo de sufrir desórdenes tromboembólicos deben mantenerse bajo observación.
Pacientes que se encuentran bajo riesgo de desarrollar migrañas con aura podrían encontrarse en riesgo de accidente vascular cerebral isquémico y deben mantenerse bajo observación.
Accidente vascular cerebral: En el subestudio de la WHI sobre estrógeno solo, se reportó un riesgo mayor estadísticamente significativo reportado en mujeres de 50 a 79 años de edad que recibieron diariamente 0,625 mg EC en comparación con las mujeres que recibieron placebo (45 frente a 33 por 10.000 años personas). El aumento del riesgo se demostró en el primer año y persistió.
Los análisis de subgrupo de mujeres de 50 a 59 años de edad sugieren que no hay mayor riesgo de accidente cerebrovascular en las mujeres que reciben dosis de 0,625 mg de crema vaginal versus las que recibieron el placebo (18 frente a 21 por 10.000 años personas).
En caso de que ocurra o se sospeche un accidente vascular cerebral, debe descontinuarse inmediatamente el uso de los estrógenos (ver Farmacodinamia).
Tromboembolismo venoso: En el subestudio de la WHI sobre estrógeno solo, se reportó un mayor riesgo de trombosis de vena profunda (TVP) estadísticamente significativo (23 vs. 15 por 10.000 años persona). Se reportó un aumento en el riesgo de embolia pulmonar (EP), aunque no alcanzó una significancia estadística. Se demostró un aumento en el riesgo de TEV (TVP y EP) durante los primeros dos años (30 vs. 22 por 10.000 años persona).
En caso de ocurrir o haber sospecha de TEV, deben descontinuarse los estrógenos inmediatamente (ver Farmacodinamia).
En caso que se presente anormalidades visuales, debe descontinuarse el medicamento si hubiera de pérdida parcial o total de la visión o aparición repentina de proptosis, diplopía o migraña, hasta no haber realizado la evaluación. Si la evaluación indica papiledema o lesiones vasculares retinales, debe suspenderse el medicamento. Se ha reportado trombosis vascular en la retina en pacientes que reciben estrógenos.
De ser factible, se deben descontinuar los estrógenos al menos cuatro a seis semanas antes de una cirugía de un tipo asociado con un mayor riesgo de tromboembolismo o durante los periodos prolongados de inmovilización.
Neoplasias malignas:
Cáncer endometrial: El uso de estrógenos no opuestos se ha asociado a un riesgo mayor de cáncer endometrial (ver Farmacodinamia).
Se ha reportado que el riesgo de cáncer endometrial entre las usuarias de estrógenos no opuestos es aproximadamente 2 a 12 veces mayor que en las no usuarias y parece depender de la duración del tratamiento y de la dosis de estrógenos. El riesgo mayor parece estar asociado con el uso prolongado, con riesgos aumentados de 15 a 24 veces mayor para 5 a 10 años o más y se ha demostrado que este riesgo persiste durante al menos 8 a 15 años después de descontinuar la TE. Se ha demostrado que agregar una progestina a la terapia posmenopáusica con estrógenos reduce el riesgo de hiperplasia endometrial, que puede ser un precursor para el cáncer endometrial (ver General).
Es importante la vigilancia clínica de todas las mujeres que toman estrógenos o combinaciones de estrógenos y progestinas. Deben tomarse medidas de diagnóstico adecuadas para descartar una malignidad en todos los casos de sangrado uterino anormal persistente o recurrente.
Cáncer de mama: Los estudios sobre el uso de estrógenos por parte de las mujeres posmenopáusicas han reportado resultados inconsistentes sobre el riesgo del cáncer de mama. El ensayo clínico aleatorizado más importante con información sobre este tema es la Iniciativa de Salud de las Mujeres (WHI) (ver Farmacodinamia). En el subestudio de la WHI sobre estrógeno solo, después de un promedio de 7,1 años de seguimiento, no se asociaron los EC (0,625 mg diarios) a un riesgo mayor de cáncer de mama invasivo. Un análisis de resultados sobre la salud, posterior a la intervención con EC a través de un seguimiento con promedio de 10,7 años, demostró que el riesgo de cáncer de mama invasivo en mujeres histerectomizadas aleatorizado a EC vs. placebo fue similar durante las fases de intervención y post-intervención. Una incidencia acumulativa de cáncer de mama más baja estadísticamente significativa de 0,27 por ciento (HR, 0,77; 95%CI, 0,62-0,95) se observó en el grupo con EC (N=151) comparado con 0,35 por ciento en el grupo placebo (N=199).
Algunos estudios observacionales han reportado un riesgo mayor de cáncer de mama para la terapia con estrógeno solo después de varios años de uso. El riesgo aumentó con la duración de uso y pareció regresar a la línea de base aproximadamente cinco años después de interrumpir el tratamiento (solo los estudios observacionales cuentan con datos sustanciales sobre el riesgo después de la interrupción).
Se ha reportado que el uso de estrógeno produce un aumento de mamografías anormales que requieren evaluación adicional.
Cáncer ovárico: En algunos estudios epidemiológicos, el uso de productos de estrógeno solo se ha asociado a un aumento en el cáncer ovárico con varios años de uso. Otros estudios epidemiológicos no han encontrado estas asociaciones.
Demencia: Un subestudio del Estudio sobre la Memoria de la Iniciativa de la Salud de las Mujeres (WHIMS), un estudio complementario de la WHI realizado con mujeres entre 65 y 79 años, reportó un mayor riesgo de desarrollar demencia probable al compararse con el placebo (ver Uso geriátrico y Farmacodinamia).
Se desconoce si estos hallazgos son aplicables a mujeres postmenopáusicas más jóvenes (ver Uso geriátrico).
Enfermedad vesicular: Se ha reportado un aumento de 2 a 4 veces mayor en el riesgo de enfermedad vesicular que requiere cirugía en las mujeres que reciben TE.
Hipercalcemia: En caso de utilizar el producto para el tratamiento paliativo del cáncer de mama, tomar en cuenta que la administración de estrógenos puede causar hipercalcemia severa en los pacientes con cáncer de mama y metástasis ósea. Si esto ocurre, debe interrumpirse el uso del medicamento y deben tomarse las medidas apropiadas para reducir el nivel de calcio sérico.
Terapia paliativa en los hombres: En caso de utilizar el producto para el tratamiento paliativo del cáncer de mama y de próstata avanzado dependiente de andrógenos (solo como paliativo), tomar en cuenta que en un ensayo clínico prospectivo grande con hombres, se ha demostrado que las dosis altas de estrógeno (5 mg diarios de estrógenos conjugados), comparables a las usadas para tratar el cáncer de próstata y mama, aumentan los riesgos de infarto del miocardio no mortal, la embolia pulmonar y la tromboflebitis.
Sistema inmunológico:
Angioedema: El uso de estrógenos exógenos puede inducir o exacerbar los síntomas de angioedema, particularmente en mujeres con angioedema hereditario.
EMBARAZO: No deben usarse los estrógenos durante el embarazo (ver Contraindicaciones).
LACTANCIA: Se ha demostrado que la administración de estrógenos en las madres lactantes reduce la cantidad y calidad de la leche materna. Se han identificado cantidades detectables de estrógenos en la leche de las madres que reciben el medicamento. Debe procederse con precaución al administrar estrógenos a una mujer lactante.
PRECAUCIONES Y RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: La administración continua a largo plazo de los estrógenos naturales y sintéticos en ciertas especies animales aumenta la frecuencia de cánceres de mama, cérvix, vagina, testículos e hígado.
REACCIONES ADVERSAS:
El cuadro muestra las reacciones adversas según las categorías de frecuencia de CIOMS:
|
Muy común: |
≥ 10% |
|
Común: |
≥ 1% y < 10% |
|
Poco común: |
≥ 0,1% y < 1% |
|
Infrecuente: |
≥ 0,01% y < 0,1% |
|
Muy infrecuente: |
< 0,01 |
Crema vaginal con EC: Puede ocurrir la absorción sistémica con el uso de la crema vaginal con EC. Deben considerarse las reacciones adversas asociadas al tratamiento oral con EC.
En un ensayo aleatorizado de 12 semanas, a doble ciego y controlado con placebo, con la crema vaginal de estrógenos conjugados [Crema vaginal PREMARIN® (PVC)], 423 mujeres postmenopáusicas recibieron al menos una dosis del medicamento del estudio y fueron incluidas en todos los análisis de seguridad: 143 mujeres en el grupo de tratamiento con PVC-21/7 (administración diaria de 0,5 g de PVC por 21 días, luego 7 días sin medicamento), 72 mujeres en el grupo de tratamiento con el placebo correspondiente; 140 mujeres en el grupo de tratamiento con PVC-2x/semana (administración de 0,5 g de PVC dos veces por semana) y 68 mujeres en el grupo de tratamiento con el placebo correspondiente. Luego siguieron en un estudio abierto de extensión durante 40 semanas, en el cual un total de 394 mujeres recibió el tratamiento con PVC, que incluyó a las participantes aleatorizadas al placebo en la línea de base. En este estudio, no hubo diferencias estadísticamente significativas entre la PVC y el placebo.
Las siguientes reacciones adversas se han reportado con la crema vaginal con estrógenos conjugados o son efectos indeseados que se asocian a los estrógenos. No es posible calcular las frecuencias para estos eventos con base en los datos de prescripción para la exposición de las pacientes, ya que la dosis de la crema vaginal con estrógenos conjugados varía de una paciente a otra y el producto está disponible en todo el mundo en diversas unidades de tamaño.
|
Clase de sistemas de órganos |
Reacción adversa |
|
Trastornos del sistema reproductivo y las mamas |
Sangrado intermitente/manchado de sangre; dismenorrea/dolor pélvico |
|
Trastornos gastrointestinales |
Náuseas; vómito; hinchazón; dolor abdominal. |
|
Trastornos del sistema nervioso |
Mareos; cefalea; migraña; nerviosismo. |
|
Trastornos musculoesqueléticos, de los tejidos conectivos y óseos |
Artralgias; calambres en las piernas. |
|
Trastornos psiquiátricos |
Cambios en la libido; trastornos del ánimo; irritabilidad; depresión; demencia. |
|
Trastornos vasculares |
Embolia pulmonar; trombosis venosa. |
|
Trastornos generales y condiciones de los sitios de administración |
Edema. |
|
Trastornos de la piel y los tejidos subcutáneos |
Alopecia. |
|
Trastorno hepatobiliar |
Enfermedad vesicular. |
|
Infecciones e infestaciones |
Vaginitis, incluida la candidiasis vaginal. |
|
Neoplasias benignas y malignas (incluidos los quistes y pólipos) |
Cáncer de mama; cáncer ovárico; cambios fibroquísticos en mamas. |
|
Trastornos del sistema inmunológico |
Urticaria, angioedema; hipersensibilidad; reacciones anafilácticas/anafilactoides. |
|
Trastornos del metabolismo y la alimentación |
Intolerancia a la glucosa; hipocalcemia (en pacientes con condiciones preexistentes de hipocalcemia). |
|
Trastornos oculares |
Intolerancia a lentes de contacto. |
|
Trastornos cardiacos |
Infarto del miocardio. |
|
Investigaciones |
Cambios en el peso (aumento o disminución). |
|
Endocrinología |
Pubertad precoz. |
EFECTOS SOBRE ACTIVIDADES QUE REQUIEREN DE CONCENTRACIÓN Y DESEMPEÑO: No hay evidencia disponible de efectos sobre actividades que requieren de concentración y desempeño.
INTERACCIONES: Los datos de un estudio sobre interacciones medicamentosas con estrógenos conjugados y acetato de medroxiprogesterona indican que la disposición farmacocinética de ambos medicamentos no se ve alterada cuando se coadministran los medicamentos. No se han realizado otros estudios sobre interacciones medicamentosas con estrógenos conjugados.
Los estudios in vitro e in vivo han demostrado que los estrógenos son metabolizados parcialmente por el citocromo P450 3A4 (CYP3A4). Por lo tanto, los inductores o inhibidores del CYP3A4, como las preparaciones de la hierba de San Juan (Hipericum perforatum), fenobarbital, fenitoína, carbamazepina, rifampicina y dexametasona pueden reducir las concentraciones plasmáticas de los estrógenos, posiblemente causando una disminución de los efectos terapéuticos y/o cambios en el perfil de sangrado uterino. Los inhibidores del CYP3A4, como cimetidina, eritromicina, claritromicina, ketoconazol, itraconazol, ritonavir y jugo de toronja, pueden aumentar las concentraciones plasmáticas de los estrógenos y pueden causar efectos secundarios.
INTERFERENCIA CON LAS PRUEBAS DE LABORATORIO Y OTRAS PRUEBAS DE DIAGNÓSTICO:
Interacciones con las pruebas de laboratorio: Aceleración del tiempo de protrombina, el tiempo parcial de tromboplastina y el tiempo de agregación plaquetaria; aumento del recuento plaquetario; aumento de los factores II, antígeno VII, antígeno VIII, actividad coagulante VIII, complejo IX, X, XII, el complejo VII-X, el complejo II-VII-X, la beta-tromboglobulina; disminución de los niveles del antifactor Xa y la antitrombina III, disminución de la actividad de la antitrombina III; aumento de los niveles de fibrinógeno y la actividad del fibrinógeno; aumento del antígeno y la actividad del plasminógeno.
Los estrógenos aumentan la globulina transportadora de la hormona tiroidea (TBG, por sus siglas en inglés), lo que causa un aumento de la hormona tiroidea total, medida con el yodo ligado a proteínas (PBI, por sus siglas en inglés), los niveles de T4 mediante columna o radioinmunoensayo o los niveles de T3 mediante radioinmunoensayo. Se disminuye la captación de la resina por parte de T3, lo que refleja un aumento de TBG. Las concentraciones libres de T4 y T3 permanecen inalteradas.
Otras proteínas fijadoras pueden estar elevadas en el suero, es decir, la globulina de unión a los corticosteroides (CBG, por sus siglas en inglés), la globulina fijadora de las hormonas sexuales (SHBG), causando un aumento de los corticosteroides y los esteroides sexuales circulantes, respectivamente. Las concentraciones de las hormonas libres o biológicamente activas pueden estar reducidas. Otras proteínas plasmáticas pueden estar aumentadas (el sustrato de angiotensinógeno/renina, alfa-1-antitripsina, ceruloplasmina).
Aumento de las concentraciones plasmáticas de las subfracciones HDL y HDL2 del colesterol, disminución de las concentraciones del colesterol LDL, aumento de los niveles de los triglicéridos.
Alteración de la tolerancia a la glucosa.
Puede reducirse la respuesta a la metirapona.
DOSIS Y ADMINISTRACIÓN: Si se receta un estrógeno para una mujer posmenopáusica con útero, puede ser apropiado agregar una progestina (ver Neoplasias malignas). En algunos casos, las mujeres histerectomizadas con antecedentes clínicos de endometriosis podrían requerir una progestina (ver Exacerbación de otras condiciones).
En un ensayo de 52 semanas con una crema vaginal con estrógenos conjugados solamente (sin progestina) [Crema vaginal PREMARIN® (PVC)], 0,5 g dos veces por semana intravaginalmente, no hubo evidencias de hiperplasia endometrial o carcinoma endometrial.
Puede hacerse un ajuste de la dosificación con base en la respuesta de cada paciente.
El uso de la crema vaginal PREMARIN®, sola o en combinación con una progestina, debe limitarse al menor tiempo posible que sea consistente con las metas de tratamiento y los riesgos para cada mujer. Se debe reevaluar a las pacientes periódicamente según sea clínicamente apropiado (p. ej., a intervalos de 3 a 6 meses) para determinar si el tratamiento sigue siendo necesario. Para las mujeres con útero y cuando esté indicado, deben tomarse las medidas diagnósticas adecuadas, como la toma de una muestra del endometrio, para descartar una malignidad en los casos de sangrado vaginal persistente o anormal recurrente no diagnosticado.
Tratamiento de la atrofia vaginal vulvar o Kraurosis vulvae: La crema vaginal es administrada intravaginalmente en un regimen cíclico (aplicar diariamente durante tres semanas y dejar de utilizarlo una semana). Generalmente, las mujeres deben empezar con una dosis de PREMARIN® de 0,5 g. Los ajustes de dosificación (0,5 a 2 g) pueden hacerse con base en la respuesta de cada paciente.
Instrucciones de uso del aplicador:
1. Retirar la tapa del tubo.
2. Enroscar el extremo de la boquilla del aplicador en el tubo.
3. Oprimir el tubo suavemente desde la parte inferior para forzar suficiente crema hacia el aplicador y proporcionar la dosis prescrita. Usar los puntos marcados en el aplicador como guía para medir la dosis correcta.
4. Desenroscar el aplicador del tubo.
5. Recostarse sobre la espalda con las rodillas elevadas. Para administrar el medicamento, insertar suave y profundamente el aplicador dentro de la vagina y presionar el émbolo hacia abajo hasta su posición original.
Para limpiar: Halar el émbolo para retirarlo del aplicador. Lavar con jabón suave y agua tibia.
NO HERVIR NI USAR AGUA CALIENTE.
USO GERIÁTRICO: No ha habido suficiente número de mujeres geriátricas involucradas en estudios clínicos para determinar si existe diferencia entre la respuesta a estrógenos de pacientes mayores a 65 años y la de sujetos más jóvenes.
El subestudio de la Iniciativa de la Salud de las Mujeres (WHI) sobre el estrógeno solo reportó un riesgo mayor de accidente vascular cerebral en comparación con el placebo en las mujeres posmenopáusicas con 65 años de edad o mayores (ver Riesgo cardiovascular y Farmacodinamia).
Un subestudio del Estudio sobre la Memoria de la Iniciativa de la Salud de las Mujeres (WHIMS), un estudio complementario de la WHI realizado con mujeres entre 65 y 79 años, reportó un riesgo mayor de desarrollar demencia probable al comparase con el placebo. Se desconoce si estos hallazgos son aplicables a mujeres postmenopáusicas más jóvenes (ver Demencia y Farmacodinamia).
USO PEDIÁTRICO: Aunque la terapia con estrógenos se ha usado para inducir la pubertad en adolescentes con algunas formas de retraso de la pubertad, la seguridad y eficiencia en los pacientes pediátricos no se ha establecido de otra forma. El tratamiento con estrógenos en las niñas prepuberales también induce el desarrollo prematuro de las mamas y la cornificación vaginal y puede inducir el sangrado uterino.
Como se ha demostrado que las dosis altas y repetidas de estrógenos durante un periodo extenso aceleran el cierre de las epífisis, la terapia hormonal no debe iniciarse antes de que ocurra el cierre de las epífisis, para no comprometer el crecimiento final.
La crema vaginal de estrógenos conjugados no está indicada en niños.
En los niños varones, el tratamiento puede modificar el proceso normal de la pubertad e inducir la ginecomastia.
SOBREDOSIS: Los síntomas en los adultos y niños de la sobredosis de los productos que contienen estrógenos pueden ser náuseas, vómito, sensibilidad en las mamas, mareos, dolor abdominal, somnolencia/fatiga; puede ocurrir sangrado por descontinuación del medicamento en las mujeres. No existe un antídoto específico y, de ser necesario, el tratamiento adicional debe ser sintomático.
DESCRIPCIÓN: La crema vaginal PREMARIN® (estrógenos conjugados) contiene una mezcla de estrógenos conjugados obtenidos exclusivamente de fuentes naturales, que se presentan como sales sódicas de los sulfatos de estrógeno solubles en agua, que se mezclan para representar la composición promedio del material derivado de la orina de yeguas preñadas. Es una mezcla de sulfato sódico de estrona y sulfato sódico equilino. Contiene componentes concomitantes, como conjugados de sulfato sódico, 17 alfa-dihidroequilina, 17 alfa-estradiol y 17 beta-dihidroequilina.
CONDICIONES DE ALMACENAMIENTO: Almacenar a una temperatura menor a 30 °C.
Documento de producto referencia No.:
Fecha: 14 de junio 2012
Reemplaza: 24 de febrero 2012
Fecha de la revisión de la monografía CDS 27.0 (06 Feb. 2012): 14 de junio 2012
PFIZER
® Marca registrada