
NOVOSEVEN RT 1, 2MG
EPTACOG ALFA (FACTOR DE COAGULACIÓN VII ALFA RECOMBINANTE)
Polvo y disolvente para solución inyectable
Estuche, Polvo para solución inyectable y diluyente, 1/1,1 mg/ml
Estuche, Polvo para solución inyectable y diluyente, 2/2,1 mg/ml
Estuche, Polvo para solución inyectable y diluyente, 5/5,1 mg/ml
Estuche, Vial(es), Polvo y disolvente para solución inyectable, 1/1,1 mg/ml
Estuche, Vial(es), Polvo y disolvente para solución inyectable, 2/2,1 mg/ml
Estuche, Jeringa(s) prellenada(s), Polvo y disolvente para solución inyectable, 1/1 mg/ml
Estuche, Jeringa(s) prellenada(s), Polvo y disolvente para solución inyectable, 2/2 mg/ml
Estuche, Vial(es), Polvo y disolvente para solución inyectable, 5/5,2 mg/ml
Estuche, Jeringa(s) prellenada(s), Polvo y disolvente para solución inyectable, 5/5 mg/ml
COMPOSICIÓN: Cada bulbo de POLVO contiene:
|
Sustancia |
Cantidad |
Referencia de calidad |
|
|
Eptacog alfa activado (rFVIIa) |
1 mg |
2 mg |
Fabricante |
|
Cloruro de calcio dihidratado* |
|||
|
Glicilglicina |
|||
|
Polisorbato 80 |
|||
|
Manitol |
|||
|
Sacarosa |
|||
|
Metionina |
|||
Cada bulbo de disolvente o jeringa pre-llenada con 1.1 (1.0) ml, 2.1 (2.0) ml contiene:
|
Sustancia |
Cantidad |
Referencia de calidad |
|
|
Histidina |
1.74 mg |
3.26 mg |
Ph. Eur., USP, JP |
|
Agua para inyección |
|||
|
Plazo de validez: |
Producto sin reconstituir: 24 meses. Producto reconstituido: El producto debe utilizarse inmediatamente. Si no se utiliza inmediatamente, el tiempo de conservación y las condiciones de conservación antes de su uso son responsabilidad del usuario y no deberán ser más de 24 horas a 2 °C - 8 °C 6 horas o 24 horas. |
FORMA FARMACÉUTICA: Polvo y disolvente para solución para inyección .
Concentraciones:
• 1 mg (50 KUI).
• 2 mg (100 KUI).
INDICACIONES TERAPÉUTICAS: NOVOSEVEN® está indicado en el tratamiento de hemorragias y para la prevención de las mismas en personas que se someten a cirugías o procedimientos invasivos en los siguientes grupos de pacientes:
• En pacientes con hemofilia congénita con inhibidores a factor VIII o IX de coagulación > 5UB.
• En pacientes con hemofilia congénita de quienes se espera tengan una alta respuesta anamnésica a la administración del factor VIII o factor IX.
• En pacientes con hemofilia adquirida.
• En pacientes con deficiencia congénita del factor VII.
• En pacientes con trombastenia de Glanzmann con anticuerpos anti GP IIb – IIIa y/o HLA, y con resistencia presente o pasada a transfusiones de plaquetas.
PROPIEDADES FARMACODINÁMICAS:
Grupo farmacoterapéutico: Factores de coagulación en la sangre, código ATC: B02BD08.
NOVOSEVEN® contiene el factor VII de coagulación recombinante activado. El mecanismo de acción incluye la unión del factor VIIa con el factor hístico expuesto. Este complejo activa el factor IX en factor IXa y el factor X en factor Xa, lo que produce la conversión inicial de pequeñas cantidades de protrombina en trombina. La trombina produce la activación de las plaquetas y factores V y VIII en el lugar de la lesión y la formación de un trombo hemostático al convertir el fibrinógeno en fibrina. Las dosis farmacológicas de NOVOSEVEN® activan el factor X directamente en la superficie de las plaquetas activadas, localizadas en el lugar de la lesión, independientemente del factor hístico. Esto resulta en la conversión de protrombina en grandes cantidades de trombina independientemente del factor hístico. En consecuencia, el efecto farmacodinámico del factor VIIa da lugar a un aumento en la formación local del factor Xa, trombina y fibrina.
El riesgo teórico para el desarrollo de la activación sistémica del sistema de coagulación en pacientes que padezcan enfermedades subyacentes que los predisponen a DIC no puede excluirse por completo.
En un registro por observación (F7HAEM-3578) que cubrió a sujetos con deficiencia congénita de FVII 3 de 91 pacientes quirúrgicos experimentaron eventos tromboembólicos.
PROPIEDADES FARMACOCINÉTICAS (ABSORCIÓN, DISTRIBUCIÓN, BIOTRANSFORMACIÓN, ELIMINACIÓN):
Sujetos sanos: Mediante el ensayo del factor VII de coagulación, se investigó la farmacocinética de NOVOSEVEN® en 35 sujetos caucásicos y japoneses sanos en un estudio de aumento de la dosis. Se estratificó a los sujetos de acuerdo con el sexo, grupo étnico y con dosis de 40, 80 y 160 mg de NOVOSEVEN® por kg de peso corporal y/o placebo (tres dosis cada uno). Los perfiles farmacocinéticos indicaron proporcionalidad de la dosis. La farmacocinética fue similar en los grupos por sexo y origen étnico. El volumen promedio de distribución del estado estacionario comprendió de 130 a 165 ml/kg, los valores promedio de depuración comprendieron de 33.3 a 37.2 ml/h por kg y la vida media terminal comprendió de 3.9 a 6.0 horas.
Hemofilia A y B con inhibidores: Con el ensayo del FVIIa, se estudiaron las propiedades farmacocinéticas de NOVOSEVEN® en 12 pacientes pediátricos (2 a 12 años) y cinco pacientes adultos en estado no hemorrágico. La proporcionalidad de la dosis se estableció en los niños para las dosis investigadas de 90 y 180 mg por kg de peso corporal, que coincide con los resultados previos en dosis más bajas (17.5 a 70 mg/kg rFVIIa). La depuración promedio fue aproximadamente 50% más alta en los pacientes pediátricos en relación con los adultos (78 en comparación con 53 mL/h por kg), mientras que la vida media terminal se determinó 2.3 horas para ambos grupos. El volumen promedio de distribución en estado estacionario fue de 196 ml/kg en pacientes pediátricos frente a 159 ml/kg en adultos. Al parecer la depuración se relaciona con la edad, por lo que la depuración en pacientes más jóvenes puede aumentar más del 50%.
Deficiencia del factor VII: La farmacocinética de dosis únicas de rFVIIa, 15 y 30 mg por kg de peso corporal no presentó diferencias significativas entre las dos dosis utilizadas con respecto a los parámetros independientes de la dosis: depuración corporal total (70.8 a 79.1 ml/h x kg), volumen de distribución en estado estacionario (280 a 290 ml/kg), tiempo promedio de permanencia (3.75 a 3.80 h) y vida media (2.82 a 3.11 h). La recuperación promedio in vivo plasmática fue de aproximadamente 20%.
Trombastenia de Glanzmann: No se ha investigado la farmacocinética de NOVOSEVEN® en pacientes con trombastenia de Glanzmann, pero se espera que sea similar a la farmacocinética de los pacientes con hemofilia A y B.
CONTRAINDICACIONES: Hipersensibilidad a la sustancia activa, a los excipientes o a la proteína ratón, de hámster o bovina.
Contiene sacarosa, no administrar en pacientes con intolerancia hereditaria a la fructosa, mala absorción a la glucosa o galactosa o deficiencia de sacarasa isomaltasa.
PRECAUCIONES: Ver acápite de Advertencias especiales y precauciones de uso.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES DE USO: En condiciones patológicas en las que el factor tisular sea mayor de lo que se considera normal, puede haber un riesgo potencial de desarrollar acontecimientos trombóticos o inducción de una Coagulación Intravascular Diseminada (CID) asociada al tratamiento con NOVOSEVEN®.
En dicha situación se pueden encontrar pacientes con enfermedad aterosclerótica avanzada, traumatismo por aplastamiento, septicemia o CID. Debido al riesgo de complicaciones tromboembólicas, se debe tener cuidado a la hora de administrar NOVOSEVEN® a pacientes con antecedentes de enfermedad coronaria, con enfermedad hepática, pacientes post-operados, neonatos o pacientes con riesgo de sufrir fenómenos tromboembólicos o coagulación intravascular diseminada. En cada una de estas situaciones se debe sopesar el posible beneficio del tratamiento con NOVOSEVEN® en relación con el riesgo de estas complicaciones.
Como factor de coagulación VIIa recombinante, NOVOSEVEN® puede contener cantidades mínimas de IgG de ratón, IgG bovina y otras proteínas residuales del cultivo (proteínas de hámster y proteínas de suero bovino). Existe la posibilidad remota de que los pacientes tratados con el producto puedan desarrollar hipersensibilidad a estas proteínas. En estos casos, se debe considerar el tratamiento con antihistamínicos por vía intravenosa.
Se debe suspender la administración inmediatamente si se producen reacciones alérgicas o de tipo anafiláctico. En caso de shock, se debe implementar el tratamiento médico estándar para el mismo. Se debe informar a los pacientes de los síntomas iniciales de las reacciones de hipersensibilidad. Si estos síntomas aparecen, se debe advertir al paciente que debe interrumpir el uso del producto inmediatamente y contactar con su médico.
En caso de hemorragias graves, el producto se debe administrar preferentemente en hospitales especializados en el tratamiento de pacientes hemofílicos con inhibidores del factor de coagulación VIII o IX, o si no es posible, en estrecha colaboración con un médico especializado en el tratamiento de la hemofilia.
Si no se puede controlar la hemorragia es obligatoria la atención en el hospital. Los pacientes/cuidadores deben informar cuanto antes al médico/hospital supervisor sobre cualquier uso de NOVOSEVEN®.
El tiempo de protrombina y la actividad coagulante del factor VII se debe monitorizar en pacientes con deficiencia de factor VII, antes y después de la administración de NOVOSEVEN®. En caso de que la actividad del factor VIIa no consiga alcanzar el nivel esperado o la hemorragia no se controle después del tratamiento con las dosis recomendadas, se puede sospechar la formación de anticuerpos y se debe realizar un análisis de anticuerpos. Se han notificado casos de trombosis en pacientes con deficiencia del FVII que recibieron NOVOSEVEN® durante una intervención quirúrgica, pero el riesgo de trombosis en pacientes con deficiencia del factor VII tratados con NOVOSEVEN® se desconoce.
USO EN EMBARAZO Y LACTANCIA:
Embarazo: Como medida de precaución, es preferible evitar el uso de NOVOSEVEN® durante el embarazo. Los datos obtenidos de un número limitado de embarazos expuestos dentro de las indicaciones aprobadas, indican que no hay efectos adversos de rFVIIa en el embarazo o en la salud del feto o recién nacido. A la fecha, no existen otros datos epidemiológicos relevantes disponibles. Los estudios con animales no indican efectos nocivos directos o indirectos con respecto al embarazo, el desarrollo embrionario o fetal, el desarrollo del parto o el posparto.
Lactancia: Se desconoce si rFVIIa se excreta en la leche materna humana. No se ha estudiado en animales la excreción de rFVIIa por la leche. La decisión de continuar o suspender el periodo de lactancia o de continuar o suspender la terapia con NOVOSEVEN® debe tomarse considerando el beneficio de la lactancia para el niño y el beneficio de la terapia con NOVOSEVEN® para la madre.
EFECTOS EN LA CONDUCCIÓN DE VEHÍCULOS/MAQUINARIAS: No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
EFECTOS INDESEABLES:
Resumen del perfil de seguridad: Las reacciones adversas notificadas más frecuentemente son disminución de la respuesta terapéutica, pirexia, exantema, acontecimientos tromboembólicos venosos, prurito y urticaria.
Estas reacciones se presentan como:
• Poco frecuentes: (≥ 1/1.000 a < 1/100).
Tabla resumen de reacciones adversas:
Tabla 1: Enumeración de las reacciones adversas notificadas durante los ensayos clínicos y de notificaciones espontáneas (posautorización). Dentro de cada grupo de frecuencia, se presentan las reacciones adversas en orden decreciente de gravedad. Solo las reacciones adversas postautorización notificadas (es decir, no en ensayos clínicos) se presentan con una frecuencia “no conocida”.
Los ensayos clínicos llevados a cabo en 484 pacientes (que incluyen 4297 episodios tratados) con hemofilia A y B, hemofilia adquirida, deficiencia del factor VII o trombastenia de Glanzmann han mostrado que las reacciones adversas al medicamento son frecuentes (≥ 1/100 a < 1/10). Dado que el número total de episodios tratados en ensayos clínicos es inferior a 10.000, la menor frecuencia posible de reacciones adversas al medicamento que se puede asignar es rara (> 1/10.000 to < 1/1.000).
Las reacciones adversas al medicamento más frecuentes son pirexia y exantema (poco frecuentes: > 1/1.000 a < 1/100), y las reacciones adversas más graves son acontecimientos tromboembólicos.
Las frecuencias de las reacciones adversas tanto graves como no graves se enumeran de acuerdo a las clasificaciones de órganos del sistema en la siguiente tabla.
|
Tabla 1 Reacciones adversas en ensayos clínicos y de notificaciones espontáneas (posautorización) |
|||
|
Clasificación de Órganos del Sistema de MedDRA |
Poco frecuentes (≥1/1.000 a <1/100) |
Raras (≥1/10.000 a <1/1.000) |
Frecuencia No Conocida |
|
Trastornos de la sangre y del sistema linfático |
Coagulación intravascular diseminada - Resultados analíticos relacionados, que incluyen niveles aumentados de Dímero D y niveles disminuidos de AT (ver sección 4.4) - Coagulopatía |
||
|
Trastornos gastrointestinales |
- Náuseas |
||
|
Trastornos generales y alteraciones en el lugar de administración |
- Disminución de la respuesta terapéutica* - Pirexia |
-Reacción en el lugar de inyección, que incluyedolor en el lugar deinyección |
|
|
Trastornos del sistema inmunológico |
-Hipersensibilidad |
-Reacción anafiláctica |
|
|
Exploraciones complementarias |
-Aumento de productosde degradación de lafibrina -Aumento de alaninaamino |
||
|
Trastornos del sistema nervioso |
-Cefalea |
||
|
Trastornos de la piel y del tejido subcutáneo |
- Exantema (como dermatitis alérgica y exantema eritematoso) - Prurito y urticaria |
- Rubefacción - Angioedema |
|
|
Trastornos vasculares |
- Acontecimientos tromboembólicos venosos (trombosis venosa profunda, trombosis en el lugar de inyección, embolia pulmonar, acontecimientos tromboembólicos en el hígado que incluyen trombosis de la vena porta, trombosis de la vena renal, tromboflebitis, tromboflebitis superficial e isquemia intestinal) |
- Acontecimientos tromboembólicos arteriales (infarto de miocardio, infarto cerebral, isquemia cerebral, oclusión arterial cerebral, accidente cerebrovascular, trombosis arterial renal, isquemia periférica, trombosis arterial periférica e isquemia intestinal) - Angina de pecho |
- Trombos intracardiacos |
|
* Se han notificado casos de falta de eficacia (disminución de la respuesta terapéutica). Es importante que la pauta posológica de NOVOSEVEN® cumpla las recomendaciones posológicas recogidas en la sección Posología y Administración. |
|||
• Descripción de determinadas reacciones adversas:
Formación de anticuerpos inhibidores: Durante el periodo post-comercialización, no se ha notificado la formación de anticuerpos inhibidores frente a NOVOSEVEN® o frente a FVII en pacientes con hemofilia A o B. Se ha notificado el desarrollo de anticuerpos inhibidores a NOVOSEVEN® en un registro observacional de pacientes con deficiencia congénita de FVII en el periodo post-comercialización.
La única reacción adversa notificada en los ensayos clínicos en pacientes con deficiencia de factor VII es la formación de anticuerpos frente a NOVOSEVEN® y FVII (frecuente (≥1/100 a <1/10)). En algunos casos los anticuerpos mostraron un efecto inhibitorio in vitro. Estaban presentes factores de riesgo que pueden haber contribuido al desarrollo de anticuerpos como tratamiento previo con plasma humano y/o factor VII derivado de plasma, mutación grave del gen FVII y sobredosis de NOVOSEVEN®. Se debe monitorizar a los pacientes con deficiencia de factor VII tratados con NOVOSEVEN® en busca de anticuerpos frente al factor VII.
Acontecimientos tromboembólicos- arteriales y venosos: Cuando se administra NOVOSEVEN® a pacientes para indicaciones no autorizadas, son frecuentes los acontecimientos tromboembólicos arteriales (≥1/100 a <1/10). Se ha realizado un meta-análisis con datos de ensayos controlados con placebo llevados a cabo fuera de las indicaciones actualmente autorizadas, en distintos ámbitos clínicos, cada uno con pacientes de distintas características y por lo tanto con distintos perfiles de riesgo subyacentes. Este análisis ha mostrado que existe un riesgo mayor de sufrir eventos tromboembólicos arteriales (5,6% en pacientes tratados con NOVOSEVEN® versus 3,0% en pacientes que recibieron placebo). (Ver tabla: Trastornos vasculares).
No se ha establecido la seguridad y eficacia de NOVOSEVEN® fuera de las indicaciones aprobadas y, por tanto, NOVOSEVEN® no debe utilizarse de este modo.
Los acontecimientos tromboembólicos pueden dar lugar a parada cardiaca.
• Otras poblaciones especiales:
Pacientes con hemofilia adquirida: Ensayos clínicos llevados a cabo en 61 pacientes con hemofilia adquirida con un total de 100 episodios de tratamiento, mostraron que ciertas reacciones adversas fueron notificadas más frecuentemente (1% en base a los episodios de tratamiento): Eventos tromboembólicos arteriales (oclusión arterial cerebral, accidente cerebrovascular), eventos tromboembólicos venosos (embolismo pulmonar y trombosis venosa profunda), angina de pecho, náusea, fiebre, exantema eritematoso y niveles elevados de los productos de degradación de la fibrina.
Notificación de sospechas de reacciones adversas: Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de farmacovigilancia
INTERACCIONES CON OTROS PRODUCTOS MEDICINALES Y OTRAS FORMAS DE INTERACCIÓN: Se desconoce el riesgo de una interacción potencial entre NOVOSEVEN® y concentrados de factores de coagulación. Debe evitarse el uso simultáneo de concentrados de complejo de protrombina, ya sea que estén o no activados.
Se ha reportado que los antifibrinolíticos reducen la pérdida de sangre asociada con cirugías en pacientes hemofílicos, en especial en cirugía ortopédica y cirugía en regiones ricas en actividad fibrinolítica, tal como la cavidad bucal. Sin embargo, la experiencia con la administración concomitante de antifibrinolíticos y tratamiento con rFVIIa es limitada.
Con base en un estudio no clínico no se recomienda combinar rFVIIa y rFXIII. No hay datos clínicos disponibles sobre la interacción entre rFVIIa y rFXIII.
DATOS DE SEGURIDAD PRECLÍNICA: Todos los resultados del programa preclínico de seguridad se relacionaron con el efecto farmacológico de rFVIIa.
Un efecto sinérgico potencial del tratamiento combinado con rFXIII y rFVII en un modelo cardiovascular avanzado en monos cynomolgus resultó en una farmacología exagerada (trombosis y muerte) a un nivel de dosis más bajo que cuando se administran los compuestos individuales.
MODO DE ADMINISTRACIÓN: Reconstituya la preparación y administre lentamente como una inyección intravenosa rápida durante 2 a 5 minutos.
No debe mezclarse NOVOSEVEN® con soluciones para infusión ni administrarse por goteo:
Supervisión del tratamiento – pruebas de laboratorio: No existe necesidad de supervisar la terapia con NOVOSEVEN®. La gravedad de la hemorragia y la respuesta clínica a las administración de NOVOSEVEN® deben conducir a las necesidades de administración.
Después de la administración de rFVIIa, se observó una reducción de tiempo de protrombina (PT) y del tiempo de tromboplastina parcial activada (aPTT); sin embargo, no se ha demostrado una correlación entre PT y aPTT y la eficacia clínica de rFVIIa.
POSOLOGÍA Y MODO DE ADMINISTRACIÓN: El tratamiento debe iniciar bajo la supervisión de un médico con experiencia en el tratamiento de hemofilia y/o trastornos hemorrágicos.
Posología: Hemofilia A o B con inhibidores o que se espera que tengan una elevada respuesta anamnésica.
Dosis: NOVOSEVEN® debe administrarse cuanto antes después de iniciarse un episodio hemorrágico. Se recomienda una dosis inicial de 90 microgramos por kg de peso corporal administrada como inyección en bolo intravenoso.
Después de la dosis inicial de NOVOSEVEN® puede ser necesario administrar inyecciones adicionales. La duración del tratamiento y el intervalo entre inyecciones variará según la gravedad de la hemorragia, el procedimiento invasivo o la intervención quirúrgica realizada.
Población pediátrica: La experiencia clínica actual no justifica una diferenciación general en la dosificación entre niños y adultos, aunque el aclaramiento es más rápido en niños que en adultos. Por lo tanto, puede ser necesario utilizar dosis mayores de rFVIIa en pacientes pediátricos, con el fin de alcanzar unas concentraciones plasmáticas similares a las de los pacientes adultos.
Intervalo posológico: Inicialmente cada 2 - 3 horas hasta conseguir la hemostasia.
Si se precisa continuar el tratamiento, una vez conseguida la hemostasia eficaz, el intervalo entre las dosis se puede aumentar sucesivamente a cada 4, 6, 8 o 12 horas mientras esté indicado el tratamiento.
Episodios hemorrágicos de leves a moderados (incluyendo tratamiento en el domicilio): La administración precoz ha demostrado ser eficaz en el tratamiento de hemorragias articulares, musculares y mucocutáneas, de intensidad leve a moderada. Se recomiendan dos regímenes posológicos:
1. Dos a tres inyecciones de 90 microgramos por kg de peso administradas a intervalos de tres horas. Si se requiere un tratamiento posterior, se deberá administrar una dosis adicional de 90 microgramos por kg de peso.
2. Una única inyección de 270 microgramos por kg de peso.
La duración del tratamiento en el domicilio no debe superar las 24 horas. Se puede considerar el tratamiento continuado en el domicilio sólo después de la consulta con el centro de tratamiento de la hemofilia.
No hay experiencia clínica en la administración de una dosis única de 270 µg por kg de peso en pacientes de edad avanzada.
Episodios hemorrágicos graves: Se recomienda una dosis inicial de 90 µg por kg de peso corporal que se puede administrar en el camino hacia el hospital donde el paciente es tratado habitualmente. La dosificación posterior variará según el tipo y gravedad de la hemorragia. La frecuencia de la dosis debe ser, inicialmente, cada 2 horas hasta que se observe mejoría clínica. Si está indicado continuar la terapia, el intervalo entre las dosis se puede aumentar a 3 horas durante 1 - 2 días. A continuación, el intervalo entre las dosis se puede aumentar, sucesivamente, a cada 4, 6, 8 o 12 horas durante el período que se considere que está indicado el tratamiento. Una hemorragia importante puede ser tratada durante 2 - 3 semanas pero se puede alargar más el tratamiento si está clínicamente justificado.
Procedimiento invasivo/cirugía: Se debe administrar una dosis inicial de 90 µg por kg de peso corporal inmediatamente antes de la intervención. La dosis debe repetirse después de 2 horas y a continuación a intervalos de 2 - 3 horas durante las primeras 24 - 48 horas, dependiendo de la intervención practicada y del estado clínico del paciente. En cirugía mayor, se debe mantener la administración de la dosis a intervalos de 2 - 4 horas, durante 6 - 7 días. A continuación, se puede aumentar el intervalo de dosificación a 6 - 8 horas durante otras 2 semanas de tratamiento. Los pacientes sometidos a cirugía mayor pueden ser tratados durante 2 - 3 semanas, hasta que se haya producido cicatrización.
• Hemofilia adquirida:
Dosis e intervalo de dosis: NOVOSEVEN® se debe administrar tan pronto como sea posible después del inicio de un episodio hemorrágico. La dosis inicial recomendada es de 90 µg por kg de peso, administrada mediante inyección en bolo intravenoso.
Después de la dosis inicial de NOVOSEVEN®, se pueden administrar otras inyecciones si se necesitan. La duración del tratamiento y el intervalo entre inyecciones variará según la gravedad de la hemorragia, el carácter invasivo de los procedimientos o la cirugía a realizar.
El intervalo tras la dosis inicial debe ser de 2 - 3 horas. Una vez que se ha conseguido el control de la hemostasia, el intervalo de dosis se puede aumentar sucesivamente a cada 4, 6, 8 o 12 horas durante tanto tiempo como se considere necesario.
• Deficiencia de Factor VII
Dosis, rango de dosificación e intervalo de dosificación: Para el tratamiento de episodios hemorrágicos y para la prevención de hemorragias en pacientes sometidos a cirugía o procedimientos invasivos, en adultos y niños se recomienda una dosis de 15 - 30 µg por kg de peso corporal administrada cada 4 - 6 horas hasta conseguir un control de la hemostasia. La dosis y frecuencia de inyección deben adaptarse individualmente a cada persona.
Población pediátrica: Se ha recogido la limitada experiencia clínica en la profilaxis a largo plazo en la población pediátrica menor de 12 años de edad, con un fenotipo clínico grave.
La dosis y la frecuencia de las inyecciones para la profilaxis deben basarse en la respuesta clínica y adaptarse individualmente a cada persona.
• Trombastenia de Glanzmann:
Dosis, rango de dosificación e intervalo de dosificación: Para el tratamiento de episodios hemorrágicos en pacientes que sufren cirugía o procedimientos invasivos, se recomienda una dosis de 90 µg (rango 80 - 120 µg) por kg de peso corporal administrada a intervalos de 2 horas (1,5-2,5 horas). Deben administrarse por lo menos 3 dosis para asegurar una hemostasia eficaz. La vía de administración recomendada es en bolo intravenoso ya que puede darse una falta de eficacia relacionada con la perfusión continua.
Para aquellos pacientes sin resistencia, las plaquetas es la primera línea de tratamiento en la trombastenia de Glanzmann.
SOBREDOSIS: No se ha investigado la toxicidad limitante de la dosis de NOVOSEVEN® en ensayos clínicos.
Se ha notificado unos cuantos casos de sobredosis en pacientes con hemofilia. La única complicación reportada relacionada con una sobredosis fue un ligero aumento transitorio de la presión arterial en un paciente de 16 años de edad a quien se le administró 24 mg de rFVIIa en vez de 5.5 mg.
No se han notificado casos de sobredosis en pacientes con hemofilia adquirida o trombastenia de Glanzmann.
En pacientes con deficiencia del factor VII, donde la dosis recomendada es de 15 - 30 μg/kg de rFVIIa, se asoció un episodio de sobredosis con un evento trombótico (infarto occipital) en un paciente varón de la tercera edad (> 80 años) tratado con 10 a 20 veces la dosis recomendada. Además, el desarrollo de anticuerpos contra NOVOSEVEN® y contra FVII se asoció con una sobredosis en un paciente con deficiencia del factor VII.
No debe aumentarse el esquema de dosis de manera intencional por encima de las dosis recomendadas ante la falta de información sobre los riesgos adicionales que pudiera suponer.
PRESENTACIONES:
PRESENTACIÓN CON SOLVENTE EN VIAL: Estuche con un bulbo de polvo para solución para inyección con 1 mg de eptacog alfa activado y un bulbo con 1,1 mL de disolvente para reconstitución.
Estuche con un bulbo de polvo para solución para inyección con 2 mg de eptacog alfa activado y un bulbo con 2,1 mL de disolvente para reconstitución.
PRESENTACIÓN CON SOLVENTE EN JERINGA PRE-LLENADA MIXPRO®: Estuche con un bulbo de polvo para solución para inyección con 1 mg de eptacog alfa activado y una jeringa pre-llenada con 1 mL de disolvente para reconstitución. Estuche con un bulbo de polvo para solución para inyección con 2 mg de eptacog alfa activado y una jeringa pre-llenada con 2 mL de disolvente para reconstitución.
Nombre del producto: NOVOSEVEN® RT (Eptacog alfa activado). Titular del registro sanitario, país: NOVO NORDISK A/S, Dinamarca.
Fabricante, país: NOVO NORDISK A/S, Dinamarca. No todas las presentaciones mencionadas están disponibles en todos los países.
Última revisión local: Julio 2018 basada en el ENDS V.1.0 Diciembre 2012. Pueden existir diferencias en cuanto a las indicaciones aprobadas para cada país. Siempre refiérase a la información prescriptiva completa local a disposición en el departamento médico de NOVO NORDISK.
NOVO NORDISK
® Marca registrada
PRESENTACIÓN CON SOLVENTE EN JERINGA PRE-LLENADA MIXPRO®:
Instrucciones sobre cómo usar NOVOSEVEN® RT:
LEA ESTAS INSTRUCCIONES CUIDADOSAMENTE ANTES DE USAR NOVOSEVEN®.
NOVOSEVEN® se da como un polvo. Antes de la inyección (administración) debe mezclarse (reconstituido) con el disolvente proporcionado en la jeringa. El disolvente es una solución de histidina.
El NOVOSEVEN® mezclado debe inyectarse en su vena (inyección intravenosa).
El equipo en este empaque está diseñado para mezclar e inyectar NOVOSEVEN®.
Usted también necesitará un equipo de infusión (sondas y aguja de mariposa) toallitas con alcohol estériles, gasas y apósitos adhesivos.
No use el equipo sin el entrenamiento apropiado de su médico o enfermera.
Siempre use una técnica limpia y libre de gérmenes (aséptica).
Es importante que usted se lave las manos y se asegure que el área a su alrededor esté limpia.
No abra el equipo hasta que esté listo para usarlo.
El equipo es para usarse una sola vez.
VISTA GENERAL:
1. Preparar el frasco y la jeringa:
• Saque el número de empaques de NOVOSEVEN® que necesita.
• Verifique la fecha de caducidad.
• Verifique el nombre y el color del empaque, para asegurarse que contiene el producto correcto.
• Lávese las manos y séquelas apropiadamente usando una toalla limpia o aire seco.
• Saque el contenido de la caja.
A. Lleve el frasco y la jeringa pre-llenada a temperatura ambiente (no por arriba de 37 ºC). Usted puede hacer esto manteniéndolos en sus manos hasta que se sientan tan calientes como sus manos.
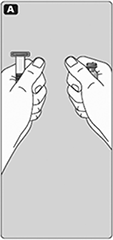
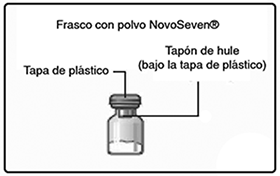
B. Quite la tapa de plástico del frasco.
Si no tiene la tapa o está floja, no use el frasco.
Frote el tapón de hule del frasco con un algodón estéril con alcohol y déjelo secar por algunos segundos antes de usarlo. No toque el tapón de hule después de frotarlo.
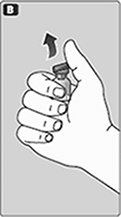
No use el equipo si se ha dejado caer, o si está dañado. Use un nuevo empaque en su lugar.
No use el equipo si ha caducado. Use un nuevo empaque en su lugar. La fecha de caducidad está impresa en la caja exterior y en el frasco, el adaptador del frasco y en la jeringa pre-llenada.
No deseche ninguno de los artículos hasta después de que haya inyectado la solución mezclada.
2. Acoplar el adaptador del frasco:
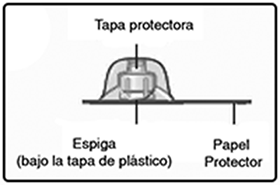
C. Quite el papel protector del adaptador del frasco.
No saque el adaptador del frasco fuera de su tapa protectora.
No toque la espiga del adaptador de frasco.
Si el papel protector no está completamente sellado o si está roto, no use el adaptador de frasco.
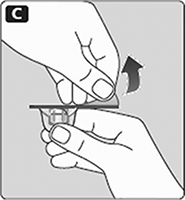
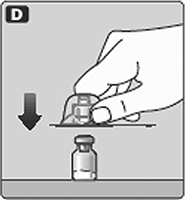
D. Coloque el frasco sobre una superficie plana y sólida.
Voltee la tapa protectora e inserte el adaptador del frasco en el frasco.
Una vez acoplado, no quite el adaptador del frasco del frasco.
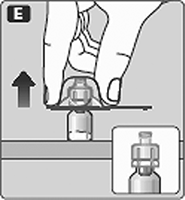
E. Apriete ligeramente la tapa protectora con su pulgar e índice como se muestra.
Quite la tapa protectora del adaptador del frasco.
No levante el adaptador del frasco cuando quite la tapa protectora.
3. Acople la varilla del émbolo y la jeringa:
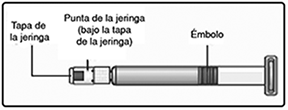
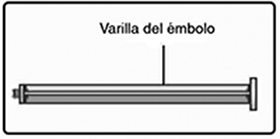
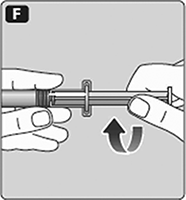
F. Enrosque la varilla del émbolo hacia la derecha en el émbolo dentro de la jeringa pre-llenada hasta que se sienta resistencia.
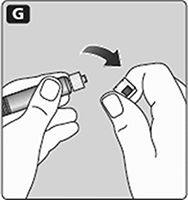
G. Quite la tapa de la jeringa de la jeringa pre-llenada doblándola hacia abajo hasta que la perforación se rompa.
No toque la punta de la jeringa bajo la tapa de la jeringa.
Si la tapa de la jeringa no está o está floja, no use la jeringa pre-llenada.
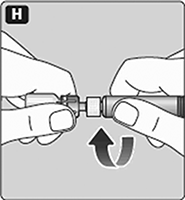
H. Enrosque la jeringa pre-llenada firmemente en el adaptador del frasco hasta que se sienta resistencia.
4. Mezcle el polvo con el disolvente:
I. Sostenga la jeringa pre-llenada ligeramente inclinada con el frasco apuntando hacia abajo.
Empuje la varilla del émbolo para inyectar todo el disolvente en el frasco.
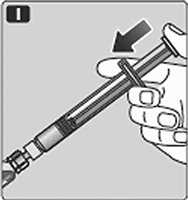
J. Mantenga la varilla del émbolo presionada y gire el frasco suavemente hasta que se disuelva todo el polvo.
No agite el frasco ya que esto puede causar espuma.
Verifique la solución mezclada. Debe ser incolora. Si nota partículas visibles o cambio de color, no la use. En su lugar use un empaque nuevo.

Use la solución mezclada de NOVOSEVEN® de inmediato para evitar infecciones.
Si no la puede usar de inmediato, vea la sección Cómo almacenar NOVOSEVEN® en el otro lado de este instructivo. No almacene la solución mezclada sin consultar a su médico o enfermera.
(I) Si su dosis requiere de más de un frasco, repita los pasos A a J con frascos, adaptadores de frasco y jeringas pre-llenadas adicionales hasta que haya alcanzado su dosis requerida.
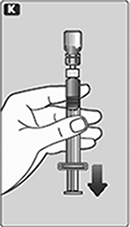
K. Mantenga la varilla del émbolo presionada hasta adentro.
Voltee la jeringa con el frasco invertido.
Deje de presionar el émbolo y deje que se mueva hacia atrás por sí mismo mientras que la solución llena la jeringa.
Jale ligeramente la varilla del émbolo hacia abajo para sacar la solución mezclada a la jeringa.
Si en algún punto hay demasiado aire en la jeringa, inyecte el aire de regreso al frasco.
Mientras sostiene el frasco invertido, golpee ligeramente la jeringa para hacer que las burbujas de aire vayan hacia arriba.
Empuje la varilla del émbolo lentamente hasta que todas las burbujas de aire se hayan eliminado.
En caso de que necesite sólo una parte de la dosis, use la escala en la jeringa para ver cuánta solución mezclada saca, como le instruyó su médico o enfermera.
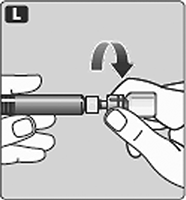
L. Desatornille el adaptador del frasco con el frasco.
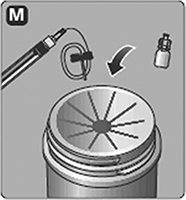
5. Inyecte la solución mezclada: NOVOSEVEN® está listo para inyectarse en su vena, en un catéter venoso central o en un puerto subcutáneo.
Inyecte la solución mezclada como le instruyó su médico o enfermera.
Inyecte lentamente por 2 a 5 minutos.
M. Desecho: Después de la inyección, deseche de manera segura la jeringa con el equipo de infusión, el adaptador de frasco con el frasco, cualquier parte no usada de NOVOSEVEN® y otros materiales de desecho como le instruyó su médico o enfermera.
No lo tire con la basura ordinaria de la casa.
No desarme el equipo antes de desecharlo.
No reúse el equipo.
PRESENTACIÓN CON SOLVENTE EN VIAL:
Instrucciones de uso, manipulación y destrucción del remanente no utilizable del producto: Utilice siempre una técnica aséptica.
INSTRUCCIONES PARA EL USUARIO DE NOVOSEVEN® RT
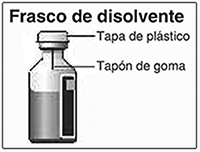
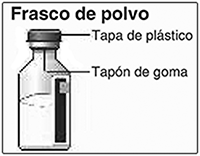
Preparación de la solución: Lávese las manos. Los frascos de disolvente y de polvo NOVOSEVEN® deben conservarse a temperatura ambiente en la reconstitución. Retire las tapas de plástico de los dos frascos. Si los frascos no tienen tapa o está floja no los utilice. Limpie los tapones de goma en los frascos con las toallitas con alcohol y déjelos secar antes de utilizarlos. Utilice una jeringa desechable del tamaño adecuado y un adaptador de frasco, aguja de transferencia (20-26 G) u otro dispositivo apropiado.
A. Retire el papel protector del adaptador del frasco sin quitarlo de la tapa protectora. Una el adaptador del frasco al frasco del disolvente. Una vez unidos, retire la tapa protectora. Tenga cuidado de no tocar la agujilla en el adaptador del frasco. Si utiliza una aguja, retírela del envase sin quitarla de la tapa protectora. Enrosque la jeringa de transferencia con fuerza en la jeringa.
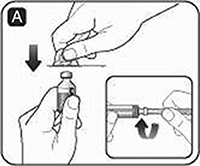
B. Jale el émbolo para cargar un volumen de aire equivalente a la cantidad de disolvente contenido en el frasco del mismo (ml equivale a cc en la jeringa).
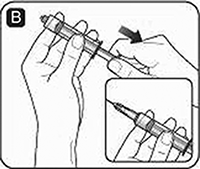
C. Enrosque la jeringa con fuerza en el adaptador del frasco sobre el frasco de disolvente. Si utiliza una aguja, retire la tapa protectora e inserte la aguja en el tapón de goma del frasco del disolvente. Tenga cuidado de no tocar el extremo de la aguja de transferencia. Inyecte aire en el frasco presionando el émbolo hasta que sienta una clara resistencia.
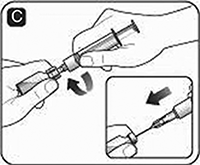
D. Sujete la jeringa con el frasco de disolvente invertido. Si utiliza una aguja de transferencia, asegúrese de que la punta de la aguja esté en el disolvente. Jale el émbolo para extraer el disolvente y pasarlo a la jeringa.
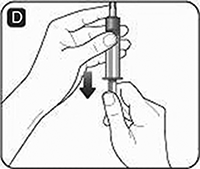
E. Retire el frasco vacío del disolvente. Si utiliza un adaptador de frasco, incline la jeringa para retirarla del frasco.
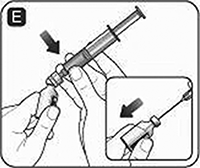
F. Una la jeringa con el adaptador del frasco o la aguja de transferencia al frasco del polvo. Si utiliza una aguja de transferencia, asegúrese de penetrar el centro del tapón de goma. Sujete la jeringa ligeramente inclinada con el frasco hacia abajo. Presione el émbolo lentamente para inyectar el disolvente en el frasco de polvo. Asegúrese de no dirigirse de manera directa al polvo de NOVOSEVEN®, pues esto podría producir espuma.
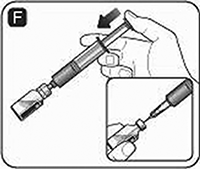
G. Gire suavemente el frasco hasta que se disuelva todo el polvo. No agite el frasco pues esto podría producir espuma. Verifique la solución en busca de partículas visibles y decoloración. Si nota alguna de las dos, no utilice el producto. NOVOSEVEN® reconstituido es una solución transparente. Mantenga el adaptador del frasco o la aguja de transferencia unida al frasco.
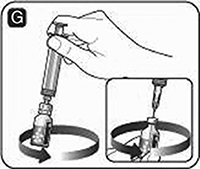
Aunque NOVOSEVEN® seguirá estable durante 24 horas después de haber sido mezclado, debe utilizarlo de inmediato para evitar infección. Si no lo utiliza inmediatamente después de mezclarlo, debe almacenar el frasco con la jeringa unida al mismo en refrigeración a 2 °C-8 °C durante no más de 24 horas. No almacene la solución sin tomar en cuenta la opinión de su médico.
Inyección de la solución:
H. Asegúrese de que el émbolo está presionado a fondo antes de dar la vuelta a la jeringa (puede haber sido expulsado por la presión de la jeringa). Si utiliza una aguja de transferencia, asegúrese de que la punta de la misma está en la solución. Sujete la jeringa con el frasco invertido y jale el émbolo para cargar toda la solución en la jeringa.
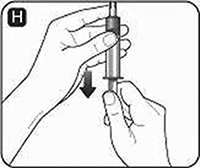
I. Si utiliza un adaptador de frasco, desenrosque el adaptador del frasco con el frasco vacío. Si utiliza una aguja de transferencia, retírela del frasco, cambie la tapa de la aguja y gire la aguja de transferencia para retirarla de la jeringa.
Ahora NOVOSEVEN® está listo para inyectar. Siga las instrucciones de inyección que le indique su médico.
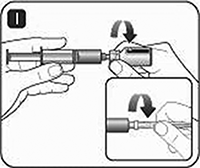
J. Deseche de manera segura la jeringa, los frascos, cualquier producto sin utilizar y demás materiales de desperdicio como le indique su médico.
CONDICIONES DE ALMACENAMIENTO: Producto sin reconstituir (polvo y disolvente): Almacenar por debajo de 30 ºC. No congelar. Protéjase de la luz.
Producto reconstituido: El producto es estable química y físicamente durante 6 horas a 25ºC y 24 horas a 5°C.
Desde un punto de vista microbiológico, el producto debe utilizarse inmediatamente. Si no se utiliza inmediatamente, el tiempo de conservación y las condiciones de conservación antes de su uso son responsabilidad del usuario y no deberán ser más de 24 horas a 2°C - 8°C, a menos que la reconstitución se haya realizado en condiciones asépticas controladas y validadas. La solución reconstituida debe conservarse en el vial.