MOTILIUM
DOMPERIDONA
Tabletas recubiertas
Caja, 30 Tabletas, 10 Miligramos
CARACTERÍSTICAS FARMACÉUTICAS:
Incompatibilidades: Ninguna conocida.
Precauciones especiales durante el almacenamiento: Mantener fuera del alcance de los niños.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Una TABLETA contiene 10 mg de domperidona.
La SUSPENSIÓN ORAL contiene 1 mg de domperidona por mL.
FORMA FARMACÉUTICA: Tabletas recubiertas.
Suspensión oral.
INSTRUCCIONES PARA EL USO Y MANIPULACIÓN:
Suspensión oral: Mezclar el contenido del frasco completamente con el uso de movimientos suaves en posición inclinada para evitar la formación de espuma.
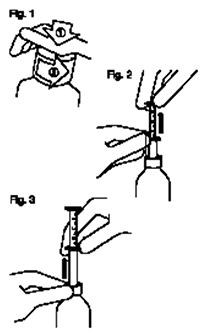
Instrucciones para abrir el frasco:
— Fig. 1: El frasco viene con una tapa a prueba de niños y debe abrirse de la siguiente manera:
• Oprimir la tapa plástica a rosca mientras gira en contra de las agujas del reloj.
• Retirar la tapa desenroscada.
Instrucciones para el uso de la pipeta (suministrada solo con el frasco de 100 mL):
— Fig. 2: Insertar la pipeta en el frasco.
Mientras sostiene el aro de la parte inferior, hale el aro superior hasta la marca correspondiente al peso en kilogramos del niño.
— Fig. 3: Sosteniendo el aro de la parte inferior, retire la pipeta del frasco.
Vacíe la pipeta.
Cierre el frasco.
Lave la pipeta con agua.
INDICACIONES TERAPÉUTICAS:
1. El complejo de síntomas dispépticos que a menudo están asociados con retraso del vaciamiento gástrico, reflujo gastroesofágico y esofagitis:
— Sensación de plenitud epigástrica, saciedad temprana, sensación de distensión abdominal, dolor abdominal superior;- sensación de llenura, eructos, flatulencia;
— Sensación de llenura, náuseas y vómitos;
— Acidez gástrica con o sin regurgitación del contenido gástrico hacia la boca.
2. Náuseas y vómitos de origen funcional, orgánico, infeccioso o dietético.
3. Nausea y vomito inducido por:
— Radioterapia o quimioterapia.
— Agonistas de la dopamina, usados en la enfermedad de Parkinson (tales como L-dopa y bromocriptina).
CONTRAINDICACIONES: MOTILIUM® está contraindicada en los siguientes casos:
— Conocida hipersensibilidad a domperidona o cualquiera de los excipientes.
— Tumor hipofisiario secretor de prolactina (prolactinoma).
— Co-administración con ketoconazol oral, eritromicina u otro potente inhibidor de CYP3A4 que prolongan el intervalo QTc tal como fluconazol, voriconazol, claritromicina, amiodarona, y telitromicina (véase Interacciones).
— Cuando la estimulación de la motilidad gástrica pudiera ser peligrosa, por ejemplo, en presencia de hemorragia gastrointestinal, obstrucción mecánica o perforación.
— En pacientes con moderada o severa insuficiencia hepática (véase Propiedades farmacocinéticas)1.
EMBARAZO Y LACTANCIA:
Embarazo: Existen datos post-comercialización limitados en mujeres embarazadas. Un estudio en ratas ha mostrado toxicidad reproductiva a una dosis alta, dosis tóxica materna. Se desconoce el riesgo potencial en humanos. Por lo tanto, MOTILIUM® debe ser únicamente utilizada durante el embarazo cuando los beneficios terapéuticos esperados lo justifiquen.
Lactancia: El fármaco se elimina por la leche materna de ratas lactantes (principalmente en forma de metabolitos: concentración máxima de 40 y 800 ng/mL, tras la administración oral e intravenosa de 2,5 mg/kg, respectivamente). En mujeres que están amamantando las concentraciones de domperidona en la leche materna son del 10% al 50% de las correspondientes concentraciones plasmáticas y no se espera supere 10 ng/ml. La cantidad total de domperidona excretada en la leche humana se espera sea menor de 7 µg por día en los regímenes de dosificación mayores. Se desconoce si esto resulta perjudicial para el recién nacido. Por lo tanto, no se recomienda la lactancia en madres que estén tomando MOTILIUM®.
REACCIONES ADVERSAS:
Datos de ensayos clínicos: La seguridad de MOTILIUM® fue evaluada en 1.275 pacientes con dispepsia, trastorno de reflujo gastro-esofágico (GERD), síndrome de colon irritable (IBS), náuseas y vómitos u otras condiciones relacionadas en 31 estudios controlados con placebo, doble ciegos. Todos los pacientes tenían una edad igual o mayor de 15 años y recibieron al menos una dosis de MOTILIUM® oral (domperidona base). La dosis total diaria promedio fue de 30 mg (rango de 10 a 80 mg) y la duración promedio (mediana) de la exposición fue de 28 días (rango. 1 a 28 días). Fueron excluidos los estudios realizados en gastroparesis diabética o síntomas secundarios a la quimioterapia o parkinsonismo.
|
Tabla 1. Reacciones adversas reportadas por ≥ 1% de los pacientes tratados con domperidona en 31 investigaciones clínicas |
|
|
Sistema/Clase de órganos Reacción adversa |
Domperidona (n=1275) % |
|
Desordenes gastrointestinales |
|
|
Boca seca |
1.7 |
|
Tabla 2. Reacciones adversas reportadas por <1% de los pacientes tratados con domperidona en 31 investigaciones clínicas |
|
|
Clase de Sistema/Órgano Reacción adversa |
Domperidona (n= 1.275) % |
|
Trastornos psiquiátricos Pérdida de libido Ansiedad |
0,2 0,1 |
|
Trastornos del sistema nervioso Somnolencia Cefaleas |
0,8 0,6 |
|
Trastornos gastrointestinales Diarrea |
0,4 |
|
Trastornos de la piel y tejido subcutáneo Rash Prurito |
0,1 |
|
Trastornos del aparato reproductor y de las mamas Galactorrea Dolor en las mamas Sensibilidad en las mamas |
0,5 0,2 0,2 |
|
Trastornos generales y condiciones del sitio de administración Astenia |
|
En 45 estudios donde fue usada domperidona a dosis superiores, por una duración más larga y para indicaciones adicionales incluyendo gastroparesis diabética, la frecuencia de eventos adversos (aparte de boca seca) fue considerablemente superior. Esto fue especialmente evidente para los eventos farmacológicamente presumibles relacionados con el incremento de niveles de prolactina. Además de las reacciones listadas en las Tablas 1 y 2, también fue observada acatisia, secreción de las mamas, engrandecimiento de las mamas, inflamación de las mamas, depresión, hipersensibilidad, trastorno de lactancia y menstruación irregular.
Datos post-comercialización: Además de los efectos adversos reportados durante los estudios clínicos y listados arriba, han sido reportadas las siguientes reacciones adversas a fármacos (Tabla 3). En la Tabla 3, se proporcionan las frecuencias de acuerdo al siguiente criterio:
|
Muy frecuentes |
≥ 1/10 |
|
Frecuentes |
≥ 1/100 y < 1/10 |
|
Poco frecuentes |
≥ 1/1.000 y < 1/100 |
|
Raras |
≥ 1/10.000 y < 1/1.000 |
|
Muy raras |
<1/10.000, incluyendo casos aislados |
Las reacciones adversas a fármacos (ADRs) se presentan por categoría de frecuencia basada en tasas de reportes espontáneos.
|
Tabla 3. |
|
|
Trastornos del sistema inmune |
|
|
Muy rara |
Reacción anafiláctica (incluyendo shock anafiláctico) |
|
Trastornos psiquiátricos |
|
|
Muy rara |
Agitación, nerviosismo |
|
Trastornos del sistema nervioso |
|
|
Muy rara |
Trastorno extrapiramidal, convulsiones |
|
Trastornos cardiacos |
|
|
Muy rara |
Muerte cardiaca súbita*, arritmias ventriculares graves* |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Muy rara |
Angioedema, urticaria |
|
Trastornos renales y del tracto urinario |
|
|
Muy rara |
Retención urinaria |
|
Trastornos del aparato reproductor y de las mamas |
|
|
Muy rara |
Ginecomastia, amenorrea |
|
Investigaciones |
|
|
Muy rara |
Pruebas de función hepática alterada, aumento de niveles sanguíneos de prolactina |
|
* Basada en datos epidemiológicos (véase más adelante) |
|
Población pediátrica: En experiencia postventa, no hubo diferencias en el perfil de seguridad de adultos y niños, con la excepción de trastorno extrapiramidal ocurrido sobre todo en neonatos y lactantes (hasta un año de edad) y otros efectos relacionados con el sistema nervioso central de convulsión y agitación reportados principalmente en bebés y niños
INTERACCIONES: Los antiácidos o agentes antisecretores no deben ser tomados simultáneamente con formulaciones orales de MOTILIUM® ya que disminuyen su biodisponibilidad oral (véase advertencias especiales y precauciones especiales para uso).
La administración concomitante de fármacos anticolinérgicos puede antagonizar el efecto antidispéptico de MOTILIUM®.
La ruta metabólica principal de domperidona es mediante CYP3A4. Datos in vitro y humanos demuestran que el uso concomitante de fármacos que inhiben significativamente esta enzima puede producir el aumento de los niveles plasmáticos de domperidona. Ejemplos de inhibidores potentes de CYP3A4 incluyen:
— Antifúngicos azólicos como el fluconazol*, itraconazol, ketoconazol* y voriconazol*.
— Antibióticos macrólidos como claritromicina* y eritromicina*.
— Inhibidores de la proteasa del VIH como amprenavir, atazanavir, fosamprenavir, indinavir, nelfinavir, ritonavir y saquinavir. Antagonista de calcio como diltiazem y verapamil,
— Amiodarona*.
— Aprepitant
— Nefazodona
— Telitromicina*
(* También prolonga el intervalo QTc; véase Contraindicaciones).
Estudios independientes de interacción farmacocinética/farmacodinámica in vivo con ketoconazol oral o ertitromicina oral en sujetos sanos confirmaron una notoria inhibición del metabolismo de primer paso de la domperidona mediado por el CYP3A4 producido por estos fármacos.
Con la combinación de domperidona oral 10 mg cuatro veces al día y ketoconazol 200 mg dos veces al día se constató una prolongación media del intervalo QT de 9,8 mseg durante el período de observación, con cambios en determinados momentos que oscilaban entre 1,2 y 17,5 mseg.
Con la combinación de 10 mg de domperidona cuatro veces al día y 500 mg de eritromicina oral tres veces al día, el intervalo QT medio durante el período de observación se vio prolongado en 9,9 mseg, con cambios en determinados momentos que oscilaban entre 1,6 y 14,3 mseg. Tanto la concentración máxima (Cmáx) como el área bajo la curva (AUC) de la domperidona en estado de equilibrio se vieron multiplicadas aproximadamente por tres en cada uno de estos estudios de interacción (véase Contraindicaciones).
Se desconoce la contribución de las aumentadas concentraciones plasmáticas de domperidona en el efecto observado sobre el QTc.
En estos estudios, la monoterapia oral con 10 mg de domperidona cuatro veces al día produjo aumentos del QT medio de 1,6 mseg (estudio con ketoconazol) y de 2,5 mseg (estudio con eritromicina), mientras que la monoterapia con ketoconazol (200 mg dos veces al día) y la monoterapia con eritromicina (500 mg tres veces al día) produjeron aumentos del intervalo QT de 3,8 y 4,9 mseg respectivamente durante el período de observación.
En otro estudio de múltiples dosis realizado en sujetos sanos, no fueron observados aumentos significativos en el intervalo QTc durante el tratamiento en fase estable con monoterapia de domperidona a 40 mg cuatro veces al día (dosis total diaria de 160 mg que es el doble de la dosis diaria máxima) a concentraciones plasmáticas de domperidona que fueron al menos similares a las encontradas en los brazos de combinación de los estudios de interacción.
Teóricamente, como MOTILIUM® tiene efectos gastrocinéticos, esto pudiera tener influencia sobre la absorción de los fármacos administrados concomitantemente por vía oral, especialmente aquellas formulaciones de liberación prolongada o con cubierta entérica. Sin embargo, en los pacientes ya estabilizados con digoxina o paracetamol, la administración concomitante de domperidona no afecta los niveles sanguíneos de esos fármacos.
MOTILIUM® también puede administrase con:
— Neurolépticos, la acción de los cuales no es potenciada;
— Agonistas dopaminérgicos (bromocriptina, L-dopa) cuyos efectos periféricos no deseados como trastornos digestivos, náuseas y vómitos éste suprime sin contrarrestar sus propiedades a nivel central.
ADVERTENCIAS Y PRECAUCIONES PARA SU USO:
Efectos cardíacos: MOTILIUM® se debe utilizar con precaución en pacientes de edad avanzada o con las antecedentes de o enfermedad cardíaca. Algunos estudios epidemiológicos han mostrado que la domperidona puede estar asociada con un mayor riesgo de arritmias ventriculares graves o muerte súbita cardíaca (ver Reacciones adversas). Esos estudios sugieren que este aumento del riesgo puede ser mayor en pacientes mayores de 60 años de edad o en pacientes que toman dosis orales superiores a 30 mg por día.
El uso de domperidona y otras drogas que prolongan el interval QTc requiere precaución en pacientes con antecedentes de prolongación de intervalos de la conducción cardiaca, particularmente QTc y pacientes con trastornos electrolíticos significativos o enfermedades cardiacas subyacentes como insuficiencia cardiaca congestiva.
Antiácidos o agentes antisecretores, no deben ser tomados simultáneamente con formulaciones orales de MOTILIUM®, pues reducen la biodisponibilidad oral de domperidona (ver Interacciones). Cuando se utilizan de forma concomitante, MOTILIUM® debe ser tomado antes de las comidas y los agentes antiácidos o agentes antisecretores después de las comidas.
Las tabletas recubiertas contienen lactosa y puede ser inadecuado para pacientes con intolerancia a la lactosa, galactosemia o malabsorción de glucosa/galactosa.
La suspensión oral contiene sorbitol y puede ser inadecuado para pacientes con intolerancia al sorbitol.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN: Se recomienda tomar MOTILIUM® oral antes de las comidas. Si se toma después de las comidas, la absorción del fármaco se retrasa ligeramente.
La terapia con MOTILIUM® no debe exceder los 14 días de tratamiento continuo sin consultar al médico.
Adultos y adolescentes ≥ 12 años de edad y con un peso ≥ a 35 kg, y niños pesando ≥ a 35 kg: La dosis de MOTILIUM® debe ser la menor dosis efectiva para la situación individual (generalmente 30 mg/día) y se puede aumentar si es necesario a una dosis máxima diaria oral de 80 mg (o 120 mg para supositorios). La duración inicial del tratamiento es de hasta cuatro semanas. Si el tratamiento es mayor a cuatro semanas, los pacientes deben ser reevaluados y la necesidad de continuar el tratamiento reevaluada.
|
Formulación (domperidona por unidad) |
Dosis |
Dosis máxima al día |
|
Tabletas recubiertas (10 mg/tableta) |
1 a 2 tabletas tres o cuatro veces al día |
80 mg (8 x 10 mg tableta) |
|
Suspensión oral (1 mg/mL) |
10 mL a 20 mL tres o cuatro veces al día |
80 mg (80 mL de suspensión oral de 1 mg/mL) |
Infantes y niños < de 12 años de edad y pesando < de 35 kg, y adultos y adolescentes pesando < de 35 kg: La dosis de MOTILIUM® debe ser la menor dosis efectiva. La dosis diaria total depende del peso (ver Tabla siguiente). Dado que las funciones metabólicas y la barrera hematoencefálica no están completamente desarrolladas en los primeros meses de vida, el riesgo de efectos secundarios neurológicos es mayor en niños pequeños (ver Reacciones adversas). La sobredosis puede causar trastornos del sistema nervioso en los niños. La dosis debe ser determinada con precisión y no exceder el máximo individual y la dosis diaria recomendados en recién nacidos, lactantes, infantes y niños pequeños. La duración inicial del tratamiento es de hasta cuatro semanas. Si el tratamiento es mayor a cuatro semanas, los pacientes deben ser reevaluados y la necesidad de continuar el tratamiento reevaluada.
Las tabletas recubiertas no son adecuadas para uso en niños, adultos y adolescentes de menos de 35 kg.
|
Formulación (domperidona por unidad) |
Dosis |
Dosis máxima al día |
|
Suspensión oral (1 mg/mL) |
0,25 – 0,5 mg/kg tres o cuatro veces al día |
80 mg (2,4 mg/kg pero no más de 80 mL) |
Adultos y adolescentes ≥ 12 años de edad y ≥ 35 kg: Si MOTILIUM® no se usa bajo supervisión médica:
— Puede tomarse en una dosis diaria máxima de 40 mg.
— La terapia no debe exceder 14 días de tratamiento continuo sin consulta médica.
Infantes y niños menores de 12 años de edad: NOTA: El uso de tabletas no es adecuado en niños que pesan menos de 35 kg.
Uso en insuficiencia renal: Dado que la vida media de eliminación de domperidona se prolonga en insuficiencia renal grave, la administración repetida en la frecuencia de dosificación de MOTILIUM® debe reducirse a una o dos veces al día, dependiendo de la gravedad de la insuficiencia y puede ser necesario reducir la dosis. Los pacientes en tratamientos prolongados deben ser revisados regularmente (ver Propiedades farmacocinéticas).
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y USAR MÁQUINAS: MOTILIUM® tiene un efecto nulo o insignificante sobre la capacidad para conducir vehículos y operar maquinaria.
SOBREDOSIS:
Síntomas y signos: La sobredosis ha sido reportada especialmente en infantes y niños. Los síntomas de sobredosis pueden incluir, agitación, inconciencia alterada, convulsión, desorientación, somnolencia y reacciones extrapiramidales.
Tratamiento: No existe un antídoto específico para domperidona, sin embargo, en caso de sobredosis, el lavado gástrico, así como la administración de carbón activado, pueden ser útiles. Se recomienda la supervisión médica estrecha y terapia de sostén. La administración de fármacos anticolinérgicos o anti-Parkinson, puede ser útil para controlar las reacciones extrapiramidales.
PRESENTACIONES:
Tabletas: Caja con 30 tabletas de 10 mg.
Suspensión oral: Frasco con 60 ml (1 mg/ml) con pipeta dosificadora.
Alineada a CCDS -MOTILIUM® - Julio 02, 2012.
JANSSEN PHARMACEUTICAL COMPANIES