
LIPITOR
ATORVASTATINA
Tabletas recubiertas
Tabletas recubiertas, 10 Miligramos
Tabletas recubiertas, 20 Miligramos
Tabletas recubiertas, 40 Miligramos
Tabletas recubiertas, 80 Miligramos
Tabletas recubiertas , 10 Miligramos
Tabletas recubiertas , 10 Miligramos
Tabletas recubiertas, 10 Miligramos
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Ingrediente activo: Atorvastatina.
Las TABLETAS recubiertas para administración oral, contienen atorvastatina cálcica equivalente a 10, 20, 40 u 80 mg de atorvastatina, respectivamente.
FORMA FARMACÉUTICA:
Tabletas recubiertas: 10 mg, 20 mg, 40 mg, 80 mg.
INDICACIONES TERAPÉUTICAS: La atorvastatina está indicada como auxiliar a la dieta para el tratamiento de pacientes con triglicéridos, apolipoproteína B, colesterol-LDL y colesterol total elevados y para incrementar el colesterol HDL en pacientes con hipercolesterolemia primaria (hipercolesterolemia familiar y no familiar heterocigótica), hiperlipidemia combinada (mixta) (Fredrickson Tipos IIa y IIb), aumento de niveles de triglicéridos séricos (Fredrickson Tipo IV), y para pacientes con disbetalipoproteinemia (Fredrickson Tipo III) que no responden adecuadamente a la dieta.
Atorvastatina también está indicada para la reducción de colesterol total y colesterol-LDL en pacientes con hipercolesterolemia familiar homocigótica cuando la respuesta a la dieta y a otras medidas no farmacológicas es inadecuada.
Prevención de complicaciones cardiovasculares: En pacientes sin enfermedad cardiovascular clínicamente evidente, y con o sin dislipidemia, pero con factores de riesgo múltiple para enfermedad cardiaca coronaria tales como tabaquismo, hipertensión, diabetes, HDL-C bajo, o un historial familiar de enfermedad cardiaca coronaria en etapa temprana, atorvastatina está indicada para:
— Reducir el riesgo de enfermedad cardiaca coronaria fatal e infarto al miocardio no fatal,
— Reducir el riesgo de accidente cerebrovascular,
— Reducir el riesgo de procedimientos de revascularización y angina de pecho.
En pacientes con enfermedad cardiaca coronaria evidente, atorvastatina está indicada para:
— Reducir el riesgo de infarto al miocardio no fatal,
— Reducir el riesgo de accidente cerebrovascular fatal y no fatal,
— Reducir el riesgo de procedimientos de revascularización,
— Reducir el riesgo de hospitalización por CHF,
— Reducir el riesgo de angina.
Pacientes pediátricos (10-17 años de edad): Atorvastatina está indicada como auxiliar de la dieta para reducir los niveles de apo B, LDL-C, y C totales en niños y niñas luego de la menarquía, de 10 a 17 años de edad, con hipercolesterolemia familiar heterocigótica si después de un adecuado manejo con terapia dietética se presentan los siguientes hallazgos:
a. LDL-C permanece ? 190 mg/dL o
b. LDL-C permanece ? 160 mg/dL y:
• Existe un historial familiar positivo de enfermedad cardiovascular prematura o
• Dos o más factores de riesgo CVD están presentes en el paciente pediátrico.
PROPIEDADES FARMACODINÁMICAS: La atorvastatina cálcica es un agente sintético para la disminución de los lípidos, inhibidor de la reductasa de la 3-hidroxi-3-metilgutaril-coenzima A (HMG-CoA), enzima que cataliza la conversión de HMG-CoA a mevalonato, un paso temprano y limitante de la velocidad en la biosíntesis del colesterol. La fórmula empírica de la atorvastatina cálcica es (C33H34FN2O5)2Ca?3H2O con peso molecular de 1209.42 y cuya fórmula estructural es:
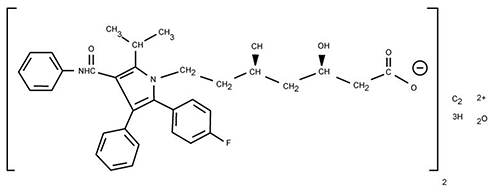
La atorvastatina cálcica es un polvo cristalino blanco a grisáceo particularmente insoluble en soluciones acuosas de pH 4 e inferior, muy poco soluble en agua destilada, amortiguador de fosfato de pH 7.4 y acetonitrilo, ligeramente soluble en etanol y por completo soluble en metanol.
Mecanismo de acción: La atorvastatina es un inhibidor selectivo competitivo de la reductasa de HMG-CoA, enzima limitante de la velocidad de la reacción que convierte en la 3-hdroxi-3-metilglutaril-co enzima A en mevalonato, un precursor de los esteroides, incluido el colesterol. En pacientes con hipercolesterolemia familiar (FH) homocigota y heterocigota, formas no familiares de hipercolesterolemia y dislipidemia mixta, la atorvastatina disminuye el C-total (colesterol total), LDL-C (colesterol de lipoproteínas de baja densidad) y apoB (apolipoproteína B). La atorvastatina también disminuye VLDL-C (colesterol de lipoproteínas de muy baja densidad) y TG (triglicéridos) y produce aumentos variables de HDL-C (colesterol de lipoproteínas de alta densidad).
La atorvastatina disminuye las concentraciones de colesterol plasmático y lipoproteínas por inhibición de la reductasa de HMG-CoA y la síntesis de colesterol en el hígado, y aumenta el número de receptores hepáticos en el LDL en la superficie celular para una captación y un catabolismo de LDL mayores.
La atorvastatina disminuye la producción y el número de partículas de LDL. Causa un incremento intenso y sostenido de la actividad del receptor de LDL acoplado con un cambio benéfico en la calidad de las partículas circulantes de LDL. La atorvastatina es eficaz para disminuir las LDL en pacientes con hipercolesterolemia familiar homocigota, una población que no ha respondido normalmente a los medicamentos de disminución de lípidos.
La atorvastatina y algunos de sus metabolitos tienen actividad farmacológica en seres humanos. El principal sitio de acción de la atorvastatina es el hígado, que es sitio de síntesis de colesterol y depuración de LDL más importante. La disminución de LDL-C se correlaciona mejor con la dosis de fármaco que con su concentración sistémica. La individualización de la dosis de uso del fármaco debería basarse en la respuesta terapéutica (véase Posología y método de administración).
En un estudio de dosis- respuesta, la atorvastatina (10-80 mg) disminuyó el C-total (30%-46%), el LDL-C (41%-61%), la apoB (34%-50%) y los TG (14%-33%), resultados consistentes en pacientes con hipercolesterolemia familiar heterocigota, formas no familiares de hipercolesterolemia, e hiperlipidemia mixta, incluidos aquellos con diabetes mellitus no insulinodependiente.
En pacientes con hipertrigliceridemia aislada, la atorvastatina disminuye C-total, LDL-C, VLDL-C, apoB, TG y no-HDL- C, y aumenta HDL-C. En pacientes con disbetalipoproteinemia, la atorvastatina disminuye IDL-C (colesterol de lipoproteínas de densidad intermedia).
En pacientes con los tipos IIa y IIb de la hiperlipoproteinemia de Fredrickson conjuntados de 24 estudios controlados, el incremento porcentual promedio respecto de la basal en HDL-C para atorvastatina (10-80 mg) fue de 5.1 a 8.7% en una forma no relacionada con la dosis. Adicionalmente, el análisis de esos datos acumulados demostró un decremento en las razones C-total/HDL-C y LDL-C/HDL-C significativamente relacionado con la dosis, con variación de -29 a -44% y -37 a -55%, respectivamente.
Los efectos de la atorvastatina sobre eventos isquémicos y mortalidad total se estudiaron en el estudio Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL), estudio multicéntrico aleatorio, doble ciego, con placebo, controlado, de vigilancia de 3086 pacientes con síndromes coronarios agudos; angina inestable o infarto miocárdico sin onda Q. Los pacientes se trataron con las medidas estándar, incluida la dieta, y atorvastatina a dosis de 80 mg diarios o placebo durante un promedio de 16 semanas. Las cifras finales de LDL-C, C-total, HDL-C y TG fueron 72, 147, 48, 139 mg/dL, en ese orden, en el grupo con atorvastatina, y de 135, 217, 46 y 187 mg/dL, respectivamente, en el grupo con placebo. La atorvastatina disminuyó significativamente el riesgo de eventos isquémicos y muerte en 16%. El riesgo de rehospitalización por angina de pecho, con datos demostrados de isquemia miocárdica, disminuyó significativamente en 26%. La atorvastatina aminoró el riesgo de eventos isquémicos y muerte en un grado similar dentro de la variación del LDL-C basal. Además, la atorvastatina disminuyó el riesgo de eventos isquémicos y muerte en grados similares en pacientes con IM sin onda Q y angina inestable, así como en hombres y mujeres y en pacientes ≤65 y >65 años de edad.
Prevención de las complicaciones cardiovasculares: En el estudio Anglo-Scandinavian Cardiac Outcomes Lipid Lowering Arm (ASCOT-LLA) se valoró el efecto de la atorvastatina sobre la cardiopatía coronaria mortal y no mortal, en 10,305 pacientes hipertensos de 40 a 80 años de edad (promedio de 63 años) sin infarto del miocardio previo y con cifras de TC <6.5 mmol/l (251 mg/dL). Adicionalmente, todos los pacientes tenían al menos tres de los siguientes factores de riesgo cardiovascular: género masculino, edad >55 años, tabaquismo, diabetes, antecedente de CHD en un pariente de primer grado, TC: HDL >6, enfermedad vascular periférica, hipertrofia ventricular izquierda, antecedente de un evento vascular cerebral, una anomalía específica en el ECG, proteinuria/albuminuria. En este estudio doble ciego controlado con placebo se trató a los pacientes con antihipertensivos (metas de BP <140/90 mm Hg para los no diabéticos y <130/80 mm Hg para los diabéticos) y se asignaron para recibir atorvastatina 10 mg diarios (n=5,168) o placebo (n=5,137). Como el efecto del tratamiento con atorvastatina en comparación con placebo rebasó el umbral de significancia durante un análisis interino del ASCOT-LLA, el estudio concluyó a los 3.3 y no a los cinco años. Adicionalmente, la presión arterial fue bien controlada y similar en pacientes asignados para recibir atorvastatina y placebo. Esos cambios persistieron durante el periodo de tratamiento. La atorvastatina disminuyó significativamente las tasas de los siguientes eventos.
|
Eventos |
Decremento del riesgo (%) |
Número de eventos (atorvastatina vs. Placebo) |
Valor de p |
|
Coronarios (CHD mortal más AMI no mortal). |
36% |
100 vs. 154 |
0.0005 |
|
Cardiovasculares totales y en procedimientos de revascularización) |
20% |
389 vs. 483 |
0.0008 |
|
Coronarios totales |
29% |
178 vs. 247 |
0.0006 |
|
Apoplejía mortal y no mortal |
26% |
89 vs. 119 |
0.0332 |
La mortalidad total y la mortalidad cardiovascular no han sido reducidas significativamente, si bien se observó una tendencia favorable. En el estudio Collaborative Atorvastatin Diabetes (CARDS) se valoró el efecto de la atorvastatina sobre la enfermedad cardiovascular fatal y no fatal, en 2,838 pacientes con diabetes de tipo II de 40 a 75 años de edad sin antecedente de enfermedad cardiovascular y con LDL ≤ 4.14 mmol/l (160 mg/dl) y TG ≤ 6.78 mmol/l (600 mg/dl). Adicionalmente todos los pacientes tenían al menos uno de los siguientes factores de riesgo: hipertensión, tabaquismo actual, retinopatía, microalbuminuria o macroalbuminuria.
En este estudio aleatorio, doble ciego, multicéntrico, controlado con placebo, se trató a los pacientes con atorvastatina 10 mg diarios (n=1,428 o placebo (n=1,410) durante un promedio de 3.9 años de vigilancia de la evolución. Como el efecto del tratamiento con atorvastatina sobre el Criterio de Valoración primario alcanzó las reglas predefinidas de detención en cuanto a eficacia, el CARDS concluyó dos años antes de lo previsto. El efecto de disminución del riesgo absoluto y relativo por la atorvastatina es el siguiente:
|
Eventos |
Disminución del riesgo relativo (%) |
Número de eventos (atorvastatina vs. placebo) |
Valor de p |
|
Cardiovasculares mayores [IM fatal y no fatal IMA, IM silente, muerte aguda por CHD, angina inestable, CABG, ACTP, revascularización, |
|||
|
apoplejía]. IM (fatal y no fata IMA, IM silente). |
37% |
83 vs 127 |
0.0010 |
|
Apoplejía (fatal y no fatal). |
42% |
38 vs 64 |
0.0070 |
|
48% |
21 vs 39 |
0.0163 |
|
|
IMA = infarto miocárdico agudo; CABG =injerto de derivación de arterias coronarias; CHD= cardiopatía coronaria; IM = infarto miocárdico; ACTP = angioplastía coronaria transluminal percutánea. |
|||
No hubo evidencia de una diferencia en el efecto del tratamiento por género, edad o cifra basal de LDL-C del paciente. Se observó una disminución del riesgo relativo de muerte de 27% (82 muertes en el grupo con placebo en comparación con 61 en el de tratamiento), con una significación estadística limítrofe (p=0.0592). La incidencia global de eventos adversos o eventos adversos serios fue similar entre los grupos de tratamiento.
Aterosclerosis: En el estudio Reversing Atherosclerosis with Aggressvive Lipid-Lowering (REVERSAL), se determinó el efecto de atorvastatina 80 mg y pravastatina 40 mg sobre la aterosclerosis coronaria por ultrasonografía intravascular (IVUS), durante la angiografía, en pacientes con cardiopatía coronaria. En ese estudio clínico, doble ciego, aleatorio, multicéntrico, controlado, se hizo IVUS basal y a los 18 meses en 502 pacientes. En el grupo de atorvastatina (n=253), el cambio porcentual promedio respecto de la basal en el volumen total del ateroma (principal criterio de estudio) fue de -0.4% (p=0.98) en el grupo de atorvastatina y +2.7% (p=0.001) en el de pravastatina (p=249). Al compararlos con pravastatina, los efectos de atorvastatina fueron estadísticamente significativos (p=0.02).
En el grupo de atorvastatina, el LDL-C disminuyó hasta un promedio de 2.04 mmol/L ± 0.8 (78.9 mg/dL ± 30) respecto de la basal de 3.89 mmol/L ± 0.7 (150 mg/dL± 28), y en el grupo de pravastatina, el LDL-C disminuyó hasta una media de 2.85 mmol/L ± 0.7 (110 mg/dL) ± 26 respecto de la basal de 3.89 mmol/L ± 0.7 (150 mg/dL ±26 ) (p<0.0001). La atorvastatina también disminuyó significativamente el TC promedio por 34.1% (pravastatina: -18.4%, p<0.001), la cifras promedio de TG por 20% (pravastatina:-6.8%, p<0.0009) y la apolipoproteína B promedio por 39.1% (pravastatina: -22.0%, p<0.0001). La atorvastatina aumentó el HDL-C promedio por 2.9% (pravastatina: +5.6% p=NS). Hubo una disminución promedio de 36.4% en PCR en el grupo con atorvastatina, en comparación con la de 5.2% en el de pravastatina (p<0.0001).
Los perfiles de seguridad y tolerabilidad de los dos grupos de tratamiento fueron comparables.
Apoplejía recurrente: En el estudio Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL), se valoró el efecto de la dosis de atorvastatina de 80 mg diarios o placebo sobre las apoplejías en 4,731 pacientes con apoplejía o un ataque isquémico transitorio (TIA) en los seis meses precedentes y ninguno de cardiopatía coronaria (CHD). Los pacientes fueron 60% hombres, de 21 a 92 años de edad (media de 63) y tenían una cifra de LDL basal promedio de 133 mg/dL (3.4mmol/L). La media de LDL-C fue de 73 mg/dL (1.9 mmol/L) durante el tratamiento con atorvastatina y 129 mg/dL (3.3 mmol/L) durante el uso de placebo. El tiempo promedio de vigilancia de la evolución fue de 4.9 años.
La atorvastatina a dosis de 80 mg disminuyó el riesgo del punto final primario, de evento vascular cerebral fatal o no fatal en 15% (HR 0.85; CI del 95%, 0.72-1.00; p=0.05 o 0.84; CI del 95%, 0.71-0.99; p=0.03 después del ajuste de factores basales) en comparación con placebo. La atorvastatina a dosis de 80 mg disminuyó significativamente el riesgo de eventos coronarios mayores (HR 0.67; CI 95% 0.51-0.89; p=0.006), cualquier evento de CHD (HR 0.60; CI del 95%, 0.48-0.74; p<0.001) y de los procedimientos de revascularización (HR 0.57; CI del 95%, 0.44-0.74; p<0.001). En un análisis posterior, la atorvastatina a dosis de 80 mg disminuyó la incidencia de evento vascular cerebral isquémico (218/2,365, 9.2% vs. 274/2,366, 11.6%, p=0.01) y aumentó la incidencia de evento vascular cerebral hemorrágico (55/2,365, 2.3% vs 33/2,366, 1.4%, p=0.02) en comparación con placebo. La incidencia de evento vascular cerebral hemorrágico mortal fue similar entre los grupos (17 con atorvastatina vs. 18 con placebo). Se demostró disminución en el riesgo de eventos cardiovasculares con atorvastatina a dosis de 80 mg en todos los grupos de pacientes, excepto quienes ingresaron al estudio con un evento vascular cerebral hemorrágico y presentaron un evento vascular cerebral hemorrágico recurrente (7 con atorvastatina vs. 2 con placebo).
En pacientes tratados con atorvastatina a dosis de 80 mg hubo menos eventos vasculares cerebrales de cualquier tipo (265 con atorvastatina vs. 311 con placebo) y menos eventos de CHD (123 con atorvastatina vs. 204 con placebo). La mortalidad global fue similar en los grupos de tratamiento (216 con atorvastatina vs. 211 con placebo). La incidencia global de eventos adversos y eventos adversos serios fue similar entre los grupos de tratamiento.
Prevención secundaria de eventos cardiovasculares: En el Treating to New Targets Study (TNT), se valoró el efecto de atorvastatina a dosis de 80 mg/día vs. atorvastatina 10 mg/día sobre la disminución de eventos cardiovasculares en 10,001 sujetos (94% de raza blanca 81% hombres, 38% ≥65 años) con cardiopatía coronaria clínicamente evidente que habían alcanzado una cifra blanco de LDL-C < 130 mg/dL después de concluir un periodo de ocho semanas de tipo abierto con atorvastatina 10 mg/día. Los sujetos se distribuyeron en forma aleatoria para recibir 10 mg u 80 mg/día de atorvastatina y se vigilaron durante un promedio de 4.9 años. Las cifras promedio de LDL-C, TC, TG, no-HDL y HDL a las doce semanas fueron 73, 145, 128, 98 y 47 mg/dL durante el tratamiento con 80 mg de atorvastatina y 99, 177, 152, 129 y 48 mg/dL durante el tratamiento con 10 mg de atorvastatina.
El tratamiento con atorvastatina a dosis de 80 mg/día disminuyó significativamente la tasa de eventos cardiovasculares mayores (MCVE) (434 eventos en el grupo de 80 mg/día vs. 548 en el de 10 mg/día) con una disminución relativa del riesgo de 22%.
La atorvastatina a dosis de 80 mg disminuyó significativamente el riesgo de lo siguiente:
|
Punto final significativo |
Atorvastatina 10 mg (N=5,006) |
Atorvastatina 80 mg (N=4,995) |
HRa (CI del 95%) |
||
|
Punto final primario* |
N |
(%) |
N |
(%) |
|
|
Punto final cardiovascular mayor principal |
548 |
(10.9) |
434 |
(8.7) |
0.78 (0.69, 0.89) |
|
Componentes del punto final primario |
|||||
|
IM no mortal sin relación con el procedimiento |
308 |
(6.2) |
243 |
(4.9) |
0.78 (0.66, 0.93) |
|
Evento vascular cerebral (fatal y no fatal) |
155 |
(3.1) |
117 |
(2.3) |
0.75 (0.59, 0.96) |
|
Puntos finales secundarios* |
|||||
|
Primer CHF con hospitalización |
164 |
(3.3) |
122 |
(2.4) |
0.74 (0.59, 0.94) |
|
Primer CAGB u otro procedimiento de revascularización coronariab |
904 |
(18.1) |
667 |
(13.4) |
0.72 (0.65, 0.80) |
|
Primer Punto Final de angina documentado b |
615 |
(12.3) |
545 |
(10.9) |
0.88 (0.79, 0.99) |
|
a atorvastatina 80 mg: atorvastatina 10 mg b componente de criterios de valoración secundarios. * Criterio de Valoración cardiovascular mayor (MCVE= muerte por CHD, infarto miocárdico no mortal, paro cardiaco con reanimación y apoplejía mortal y no. * los criterios de valoración secundarios no se incluyeron en el primario. HR= razón de riesgo; CI= intervalo de confianza; MI= infarto miocárdico; CHF= insuficiencia cardiaca congestiva; CABG= injerto de derivación de arterias coronarias. Los intervalos de confianza para los criterios de valoración secundarios no se ajustaron para comparaciones múltiples. |
|||||
No hubo diferencia significativa entre los grupos de tratamiento para la mortalidad de todas las causas: 282 muertes (5.6%) en el grupo con 10 mg/día vs. 284 (5.7%) en el de 80 mg/día de atorvastatina. Los porcentajes de sujetos que experimentaron muerte cardiovascular, incluidos los componentes de la muerte por CHD y la apoplejía mortal, fueron numéricamente menores en el grupo de tratamiento con 80 mg que en el de 10 mg de atorvastatina. Los porcentajes de sujetos que experimentaron una muerte no cardiovascular fueron numéricamente mayores en el grupo con tratamiento de 80 mg que en el de 10 mg de atorvastatina.
En el estudio Incremental Decrease in EndPoints Through Aggressive Lipid Lowering (IDEAL), se comparó el tratamiento con atorvastatina a dosis de 80 mg/día con el de simvastatina de 20-40 mg/día en 8,888 sujetos de hasta 80 años de edad con antecedente de CHD para valorar si podría lograrse la disminución del riesgo CV. Los pacientes fueron principalmente hombres (81%) de raza blanca (99%) con una edad promedio de 61.7 años y un LDL-C promedio de 121.5 mg/dL en el momento de la distribución aleatoria. 76% estaba bajo tratamiento con estatinas. En este estudio prospectivo, aleatorio, abierto, de criterio de valoración ciego (PROBE), sin periodo de inclusión, los sujetos se vigilaron durante una duración promedio de 4.8 años. Las cifras promedio de LDL-C, TC, TG, colesterol de HDL y no HDL en la semana 12 fueron 78, 145, 115, 45 y 100 mg/dL, en ese orden, durante el tratamiento con 80 mg de atorvastatina y 105, 179, 142, 47 y 132 mg/dL, respectivamente, durante el tratamiento con 20-40 mg de simvastatina.
No hubo diferencia significativa entre los grupos de tratamiento para el punto final primario, la tasa de primeros eventos coronarios mayores (CHD mortal, MI no fatal y reanimación después de un parto cardiaco): 411 (9.3%) en el grupo de atorvastatina a dosis de 80 mg/día vs. 463 (10.4%) en el de simvastatina a dosis de 20-40 mg/día, HR 0.89, CI del 95% (0.78, 1.01), p=0.07.
No hubo diferencias significativas entre los grupos de tratamiento en cuanto a la mortalidad por todas las causas; 366 (8.2%) en el grupo con atorvastatina a dosis de 80 mg/día vs 374 (8.4%) en el grupo de simvastatina a dosis de 20-40 mg/día. Los porcentajes de sujetos que experimentaron muerte CV o de origen no cardiovascular, fueron similares para el grupo de atorvastatina de 80 mg y el de 20-40 mg de simvastatina.
Hipercolesterolemia familiar heterocigota en pacientes pediátricos: En un estudio doble ciego, controlado y con placebo, seguido por una fase de tipo abierto, 187 niños y niñas premenárquicas de 10 a 17 años de edad (edad promedio 14.1 años) con hipercolesterolemia familiar heterocigota (FH) o hipercolesterolemia grave se distribuyeron en forma aleatoria para recibir atorvastatina (n=140)
o placebo (n=47) durante 26 semanas. La inclusión en el estudio requería: (1) una cifra basal de LDL-C ≥190 mg/dL o 2) un LDL-C basal ≥160 mg/dL y el antecedente familiar positivo de FH o enfermedad cardiovascular prematura demostrada en un pariente de primero o segundo grados. La cifra basal promedio de LDL-C fue de 218.6 mg/dL (variación: 138.5-385.0 mg/dL) en el grupo de atorvastatina, en comparación con 230.0 mg/dL (variación: 160.0-324.5 mg/dL) en el grupo con placebo. La dosis de atorvastatina (una vez al día) fue de 10 mg para las primeras cuatro semanas y se aumentaba de manera gradual hasta 20 mg si la cifra de LDL-C era mayor de 130 mg/dL. El número de pacientes tratados con atorvastatina que requirió aumento de la dosis hasta 20 mg después de la semana 4 durante la fase doble ciego del estudio fue de 80 (57.1%).
La atorvastatina disminuyó significativamente las cifras plasmáticas de C total, LDL-C, triglicéridos y apolipoproteína B durante la fase doble ciego de 26 semanas del estudio. (Véase Tabla 5).
|
Tabla 5. Efectos hipolipemiantes de la atorvastatina en muchachos y muchachas adolescentes con hipercolesterolemia familiar heterocigota o hipercolesterolemia severa |
||||||
|
(Media del cambio porcentual desde línea-base hasta el punto-final en la población intención de tratar) |
||||||
|
Dosis |
N |
C-Total |
LDL-C |
HDL-C |
TG |
Apoliproteína B |
|
Placebo |
47 |
-1,5 |
-0,4 |
-1,9 |
1,0 |
0,7 |
|
Atorvastatina |
140 |
-31,4 |
-39,6 |
2,8 |
-12,0 |
-34,0 |
La cifra promedio de LDL-C alcanzada fue de 130.7 mg/dL (variación: 70.0-242.0 mg/dL) en el grupo de atorvastatina, en comparación con 228.5 mg/dL (variación: 152.0-385.0 mg/dL) en el grupo con placebo durante la fase doble ciego de 26 semanas.
En este estudio controlado, limitado, no hubo efecto detectable sobre el crecimiento o la maduración sexual en niños o la duración del ciclo menstrual en niñas. La atorvastatina no se ha estudiado en esquemas clínicos controlados que incluyan pacientes prepúberes o aquellas menores de 10 años de edad. No se han estudiado la seguridad y eficacia de las dosis mayores de 20 mg en estudios controlados de niños. No se ha establecido la eficacia a largo plazo del tratamiento con atorvastatina en la infancia para disminuir la morbilidad y mortalidad en la edad adulta.
PROPIEDADES FARMACOCINÉTICAS:
Farmacocinética y metabolismo:
Absorción: La atorvastatina es rápidamente absorbida después de su administración oral; las concentraciones plasmáticas máximas ocurren dentro de una a dos horas. El grado de absorción y las concentraciones plasmáticas de atorvastatina aumentan en proporción a la dosis de atorvastatina. Las tabletas recubiertas de atorvastatina son de 95% a 99% biodisponibles en comparación con las soluciones. La biodisponibilidad absoluta de atorvastatina es aproximadamente 14% y la disponibilidad sistémica de la actividad inhibitoria de HMG-CoA reductasa es aproximadamente 30%. La disponibilidad sistémica baja se atribuye a la depuración presistémica en la mucosa gastrointestinal y/o al metabolismo hepático en su primer paso. A pesar de que los alimentos disminuyen la tasa y el grado de absorción del fármaco en aproximadamente 25% y 9% respectivamente, según se evalúa por Cmáx y AUC, la reducción de LDL-C es similar ya sea que atorvastatina se administre con o sin alimentos. Las concentraciones plasmáticas de atorvastatina son menores (aproximadamente 30% para Cmáx y AUC) tras administración farmacológica por la noche en comparación con la mañana. Sin embargo, la reducción de LCL-C es la misma sin importar la hora del día de la administración del fármaco (ver Posología y método de administración).
Distribución: El volumen medio de distribución de atorvastatina es aproximadamente 381 litros. Atorvastatina tiene un enlace ?98% con las proteínas plasmáticas. Una proporción de eritrocitos/plasma de aproximadamente 0.25 indica una penetración deficiente del fármaco en los eritrocitos.
Metabolismo: La atorvastatina es extensamente metabolizada a derivados orto y parahidroxilados y a varios productos de beta-oxidación. La inhibición in vitro de HMG-CoA reductasa por medio de metabolitos orto y parahidroxilados es equivalente a la de atorvastatina. Aproximadamente 70% de la actividad inhibitoria circulante para HMG-CoA reductasa se atribuye a los metabolitos activos. Los estudios in vitro sugieren la importancia del metabolismo de atorvastatina mediante citocromo P450 3A4 hepático, consistente con el aumento de las concentraciones plasmáticas de atorvastatina en humanos tras coadministración con eritromicina, un inhibidor conocido de esta isoenzima. Los estudios in vitro también indican que atorvastatina es un inhibidor débil del citocromo P450 3A4. La coadministración de atorvastatina no produjo un efecto clínicamente significativo en las concentraciones plasmáticas de terfenadina, un compuesto predominantemente metabolizado por citocromo P450 3A4; por lo tanto, es improbable que atorvastatina altere significativamente la farmacocinética de otros sustratos de citocromo P450 3A4 (ver Interacción con otros productos medicinales y otras formas de interacción). En animales, el metabolito orto-hidroxi sufre glucuronidación adicional.
Excreción: La atorvastatina y sus metabolitos son eliminados principalmente en la bilis tras metabolismo hepático y/o extrahepático; sin embargo, no parece que el fármaco sufra recirculación enterohepática. La vida media de eliminación plasmática promedio de atorvastatina en humanos es aproximadamente 14 horas, pero la vida media de la actividad inhibitoria para HMG-CoA reductasa es de 20 a 30 horas debido a la contribución de los metabolitos activos. Menos del 2% de una dosis de atorvastatina se recupera en la orina tras la administración oral.
Poblaciones especiales:
Edad avanzada: Las concentraciones plasmáticas de atorvastatina son mayores (aproximadamente 40% para Cmáx y 30% para AUC) en sujetos saludables de edad avanzada (edad ?65 años) que en adultos jóvenes. El estudio ACCESS específicamente evaluó a pacientes de edad avanzada en relación al alcance de sus metas del tratamiento NCEP. El estudio incluyó a 1087 pacientes menores de 65 años de edad, 815 pacientes mayores de 65 años de edad, y 185 pacientes mayores de 75 años de edad. No se observaron diferencias en seguridad, eficacia o logro de la meta del tratamiento de lípidos entre pacientes de edad avanzada y la población general.
Niños: No se han realizado estudios de farmacocinética en la población pediátrica.
Género: Las concentraciones plasmáticas de atorvastatina son diferentes en mujeres (aproximadamente 20% más elevadas para Cmáx y 10% más bajas para AUC) que en los hombres. Sin embargo, no hubo diferencias clínicamente significativas en efectos de lípidos entre hombres y mujeres.
Insuficiencia renal: La enfermedad renal no tiene influencia sobre las concentraciones plasmáticas o sobre los efectos de lípidos de atorvastatina. Por lo tanto, el ajuste de dosis en pacientes con disfunción renal no es necesario (ver Posología y método de administración).
Hemodiálisis: Debido a que no se han realizado estudio en pacientes con enfermedad renal en etapa terminal, no se espera que la hemodiálisis mejore significativamente la depuración de atorvastatina debido al enlace extenso del fármaco a las proteínas plasmáticas insuficiencia hepática – Las concentraciones plasmáticas de atorvastatina están notablemente aumentadas (aproximadamente 16 veces en Cmáx y 11 veces en AUC) en pacientes con enfermedad hepática alcohólica crónica (niños-Pugh B) (ver Contraindicaciones).
Datos preclínicos de seguridad:
Carcinogénesis, mutagénesis, daño de la fertilidad: La atorvastatina no fue carcinogénica en ratas. La dosis máxima utilizada fue 63 veces mayor que la dosis más alta en humanos (80 mg/día) sobre una base mg/kg de peso corporal y 8 a 16 veces mayor sobre valores de AUC(0-24). En un estudio de 2 años en ratones, las incidencias de adenomas hepatocelulares en machos y carcinomas hepatocelulares en hembras se incrementó con la dosis máxima utilizada, la cual fue 250 veces mayor a la dosis más alta en humanos sobre una base mg/kg de peso corporal. La exposición sistémica fue de 6 a 11 veces mayor en AUC(0-24).
Todos los demás fármacos químicamente similares de esta clase han inducido tumores tanto en ratones como en ratas a múltiplos de 12 a 125 veces las dosis clínicas más altas recomendadas sobre una base mg/kg de peso corporal.
La atorvastatina no demostró potencial mutagénico ni clastogénico en cuatro pruebas in vitro con y sin activación metabólica o en un ensayo in vivo. Fue negativo en la prueba Ames con Salmonella typhimurium y Escherichia coli, y en el ensayo de mutación precoz HGPRT in vitro en células pulmonares de hámster Chino. La atorvastatina no produjo aumentos significativos en aberraciones cromosomales en el ensayo de células pulmonares de hámster Chino in vitro y fue negativo en la prueba de micronúcleo en ratón in vivo.
No se observaron efectos adversos en la fertilidad o reproducción en ratas macho a las que se les administró dosis de atorvastatina de hasta 175 mg/kg/día o en ratas hembra a las que se les dio dosis de hasta 225 mg/kg/día. Estas dosis son de 100 a 140 veces la dosis humana máxima recomendada en una base mg/kg. La atorvastatina no produjo efectos adversos en los parámetros de espermas o semen, ni en la histopatología del órgano reproductivo en perros a los que se les administraron dosis de 10, 40, o 120 mg/kg durante dos años.
PFIZER
® Marca registrada
CONTRAINDICACIONES:
La atorvastatina está contraindicada en pacientes que tienen: Hipersensibilidad a cualquier componente de este medicamento, enfermedad hepática activa o elevaciones persistentes inexplicables de transaminasas séricas que excedan tres veces el límite superior de lo normal, o quienes estén:
Embarazadas, lactando, o con potencial reproductivo que no estén tomando medidas anticonceptivas adecuadas. Atorvastatina debe administrarse a mujeres en edad reproductiva sólo cuando sea altamente improbable que dichas pacientes conciban y han sido informadas de las amenazas potenciales para el feto.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES DE USO:
Efectos hepáticos: Como con otros agentes lípido reductores de la misma clase, se han reportado elevaciones moderadas (>3 x límite superior de lo normal [ULN]) de transaminasas séricas tras terapia con atorvastatina. El funcionamiento hepático fue monitoreado durante los estudios clínicos pre-comercialización así como en los de post-comercialización de atorvastatina administrada a dosis de 10, 20, 40 y 80 mg.
Ocurrieron aumentos persistentes en transaminasas séricas (>3 x ULN en dos o más ocasiones) en 0.7% de los pacientes que recibieron atorvastatina en estos estudios clínicos. La incidencia de estas anormalidades fue 0.2%, 0.2%, 0.6%, y 2.3% para 10, 20, 40 y 80 mg respectivamente. Los incrementos generalmente no fueron asociados con ictericia u otros signos o síntomas clínicos. Cuando se redujo la dosis de atoravastatina, o se interrumpió o descontinuó el tratamiento farmacológico, los niveles de transaminasas regresaron a los niveles pre-tratamiento. La mayoría de los pacientes continuó el tratamiento con una dosis reducida de atorvastatina sin secuelas. Las pruebas de funcionamiento hepático deben realizarse antes del inicio del tratamiento y periódicamente después de esto. A los pacientes que desarrollen cualquier signo o síntoma que sugiera lesión hepática deben realizárseles pruebas del funcionamiento hepático. A los pacientes que desarrollen aumento en los niveles de transaminasas se les debe monitorear hasta que se resuelva(n) la(s) anormalidad(es). En caso de que persista un aumento en ALT o AST que sea mayor a tres veces el límite superior de lo normal, se recomienda reducción de dosis o la suspensión de atorvastatina. La atorvastatina puede provocar una elevación en las transaminasas (ver Efectos indeseables).
La atorvastatina debe utilizarse con precaución en pacientes que consumen cantidades sustanciales de alcohol y/o tienen un historial de enfermedad hepática. La enfermedad hepática activa o elevaciones de transaminasas inexplicables persistentes son contraindicaciones para el uso de atorvastatina (ver Contraindicaciones).
Efectos musculoesqueléticos: Se reportó mialgia en los pacientes tratados con atorvastatina (ver Efectos indeseables). La miopatía, definida como dolor muscular o debilidad muscular en conjunto con aumentos en los valores de creatina fosfoquinasa (CPK) >10 x ULN, debe considerarse en cualquier paciente con mialgias difusas, debilitamiento o sensibilidad muscular, y/o elevación marcada de CPK.
Se les debe aconsejar a los pacientes que reporten con prontitud en caso de experimentar debilidad o sensibilidad y dolor muscular inexplicable, particularmente si está acompañado de malestar o fiebre. La terapia con atorvastatina debe descontinuarse en caso de que ocurra elevación notable de niveles CPK o si hay sospecha de o se diagnostica miopatía. El riesgo de miopatía durante el tratamiento con fármacos de esta clase se incrementa con la administración concurrente de ciclosporina, derivados de ácido fíbrico, eritromicina, niacina, o antifungales azoles. Muchos de estos fármacos inhiben el metabolismo de citocromo P450 3A4 y/o el trasporte del fármaco. CYP 3A4 es la isoenzima hepática primaria que se sabe está involucrada en la biotransformación de atorvastatina. Los médicos que consideren terapia combinada con atorvastatina y derivados del ácido fíbrico, eritromicina, fármacos inmunosupresores, antifungales azoles, o dosis de modificación de lípidos de niacina deben valorar cuidadosamente los riesgos y beneficios potenciales y deben monitorear cuidadosamente a los pacientes en busca de cualquier signo y síntoma de debilitamiento, sensibilidad o dolor muscular, particularmente durante los meses iniciales de terapia y durante cualquier periodo de titulación de dosis ascendente de cualquier fármaco. Por lo tanto, el inicio de reducción y mantenimiento de dosis de atorvastatina también debe considerarse cuando se toma concomitante con los fármacos anteriormente mencionados. (Ver Interacción con otros productos medicinales y otras formas de interacción). En dichas situaciones se deben considerar mediciones periódicas de creatina fosfoquinasa (CPK), pero no existe garantía de que dicho monitoreo prevenga la ocurrencia de miopatía severa. Atorvastatina puede provocar una elevación de creatina fosfocinasa (ver Efectos indeseables).
Como con otros fármacos de la misma clase, se han reportado casos raros de rabdomiólisis con insuficiencia renal aguda secundaria a mioglobinuria. La terapia con atorvastatina debe ser temporalmente suspendida o descontinuada en cualquier paciente con afección seria y aguda que sugiera miopatía o que tengan un factor de riesgo predispuesto a desarrollar insuficiencia renal secundaria a rabdomiólisis, (por ejemplo, infección aguda severa, hipotensión, intervención quirúrgica mayor, trauma, trastornos metabólicos, endocrinos y electrolíticos severos, y convulsiones incontrolables).
Accidente cerebrovascular hemorrágico: Un análisis post-hoc (luego a consecuencia de esto) de un estudio clínico en 4,731 pacientes sin CHD que tuvieron un accidente cerebrovascular o TIA dentro de los 6 meses anteriores y comenzaron a tomar atorvastatina 80 mg, reveló una incidencia mayor de accidente cerebrovascular hemorrágico en el grupo de atorvastatina 80 mg en comparación con el grupo placebo (55 atorvastatina vs. 33 placebo). Los pacientes con accidente cerebrovascular al inicio parecieron estar en mayor riesgo de experimentar accidente cerebrovascular hemorrágico recurrente (7 atorvastatina vs. 2 placebo). Sin embargo, en pacientes tratados con atorvastatina 80 mg hubo menos accidentes cerebrovasculares de cualquier tipo (265 vs. 311) y menos eventos de CHD (123 vs. 204). (Ver Propiedades farmacodinámicas: Accidente cerebrovascular recurrente).
EMBARAZO Y LACTANCIA: La atorvastatina está contraindicada en mujeres embarazadas. Las mujeres con potencial reproductivo deben usar medidas anticonceptivas adecuadas. La atorvastatina debe ser administrada a mujeres en edad reproductiva sólo cuando sea altamente improbable que dichas pacientes conciban y han sido informadas de las amenazas potenciales para el feto.
La atorvastatina está contraindicada en mujeres que estén lactando. No se sabe si este fármaco es excretado en la leche humana. Debido a las reacciones adversas potenciales en infantes lactantes, las mujeres que to-men atorvastatina no deben lactar.
EFECTOS INDESEABLES: La atorvastatina generalmente es bien tolerada. Las reacciones adversas han sido usualmente leves y transitorias. Menos del 2% de los pacientes fueron descontinuados de los estudios clínicos debido a efectos secundarios atribuidos a atorvastatina.
Los efectos adversos más frecuentes (?1%) asociados con la terapia de atorvastatina, en pacientes que participaron en estudios clínicos controlados fueron:
Trastornos psiquiátricos: Insomnio.
Trastornos del sistema nervioso: Cefalea.
Trastornos gastrointestinales: Náusea, diarrea, dolor abdominal, dispepsia, estreñimiento, flatulencia.
Trastornos musculoesqueléticos y del tejido conectivo: Mialgia.
Trastornos generales y afecciones en el sitio de administración: Astenia.
Los siguientes efectos adversos adicionales fueron reportados en estudios clínicos con atrovastatina:
Trastornos nutricionales y del metabolismo: Hipoglucemia, hiperglucemia, anorexia.
Trastornos del sistema nervioso: Neuropatía periférica, parestesia.
Trastornos gastrointestinales: Pancreatitis, vómito.
Trastornos hepatobiliares: Hepatitis, ictericia colestática.
Trastornos de la piel y del tejido subcutáneo: Alopecia, prurito, erupción.
Tejidos musculoesqueléticos y del tejido conectivo: Miopatía, miositis, calambres musculares.
Trastornos del sistema reproductivo y de mama: Impotencia. No todos los efectos listados anteriormente han sido asociados causalmente con la terapia de atorvastatina.
Pacientes pediátricos (edad de 10 a 17 años): Los pacientes tratados con atorvastatina tuvieron un perfil de experiencia adversa generalmente similar a aquel de los pacientes tratados con placebo; las experiencias adversas más comunes observadas en ambos grupos, sin importar la evaluación de causalidad, fueron infecciones.
En la experiencia post-comercialización se han reportado los siguientes efectos indeseables adicionales:
Trastornos sanguíneos y del sistema linfático: Trombocitopenia.
Trastornos del sistema inmunológico: Reacciones alérgicas (incluyendo anafilaxia).
Lesiones, envenenamiento y complicaciones del procedimiento: Ruptura de tendón.
Trastornos nutricionales y del metabolismo: Aumento de peso.
Trastornos del sistema nervioso: Hipoestesia, amnesia, mareo, disgeusia.
Trastornos del oído y del laberinto: Tinnitus.
Trastornos de la piel y del tejido subcutáneo: Síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, eritema multiforme, erupciones con ampollas, urticaria.
Trastornos musculoesqueléticos y del tejido conectivo: Rabdomiólisis, artralgia, dolor de espalda.
Trastornos generales y afecciones en el sitio de administración: Dolor torácico, edema periférico, malestar, fatiga.
EFECTOS SOBRE LA HABILIDAD PARA MANEJAR Y USAR MAQUINARIA: No se conoce ninguno.
INTERACCIÓN CON OTROS PRODUCTOS MEDICINALES Y OTRAS FORMAS DE INTERACCIÓN: El riesgo de miopatía durante el tratamiento con inhibidores de HMG-CoA reductasa se incrementa con administración concurrente de ciclosporina, derivados del ácido fíbrico, dosis modificadoras de lípidos de niacina o inhibidores de citocromo P450 3A4 (por ejemplo, eritromicina, y antifungales azoles). (Ver Posología y método de administración: Uso en combinación con otros compuestos medicinales y Advertencias especiales y precauciones para uso: Efectos musculoesqueléticos).
Inhibidores de citocromo P450 3A4: La atorvastatina se metaboliza mediante citocromo P450 3A4. La administración concomitante de atorvastatina con inhibidores de citocromo P450 3A4 puede conducir a aumentos en las concentraciones plasmáticas de atorvastatina. El grado de interacción y potenciación de los efectos depende de la variabilidad del efecto sobre el citocromo P450 3A4.
Inhibidores de transportadores: La atorvastatina y los metabolitos de la atorvastatina son sustratos del transportador OATP1B1. Los inhibidores de OATP1B1 (por ejemplo, ciclosporina) pueden incrementar la biodisponibilidad de atorvastatina. La administración concomitante de atorvastatina 10 mg y ciclosporina 5.2 mg/kg/día resultó en un aumento 7.7 veces en exposición a atorvastatina. (Ver Posología y método de administración: Uso en combinación con otros compuestos medicinales).
Eritromicina/claritromicina: La co-administración de atorvastatina y eritromicina (500 mg cuatro veces al día), o claritromicina (500 mg dos veces al día) inhibidores conocidos de citocromo P450 3A4, fue asociada con concentraciones plasmáticas más altas de atorvastatina (ver Advertencias especiales y precauciones para uso: Efectos musculoesqueléticos).
Inhibidores de proteasa: La co-administración de atorvastatina e inhibidores de proteasa, inhibidores conocidos de citocromo P450 3A4, fue asociada con el aumento de concentraciones plasmáticas de atorvastatina.
Clorhidrato de diltiazem: La co-administración de atorvastatina (40 mg) con diltiazem (240 mg) fue asociada con concentraciones plasmáticas mayores de atorvastatina.
Cimetidina: Se realizó un estudio de interacción de atorvastatina con cimetidina, y no se observó interacción clínicamente significativa.
Itraconazol: La administración concomitante de atorvastatina (20 a 40 mg) e itraconazol (200 mg) fue asociada con un incremento en el AUC de atorvastatina.
Jugo de toronja: Contiene uno o más componentes que inhiben CYP 3A4 y pueden incrementar las concentraciones plasmáticas de atorvastatina, especialmente con un consumo excesivo de jugo de toronja (> 1.2 litros pro día).
Inductores de citocromo P450 3A: La administración concomitante de atorvastatina con inductores de citocromo P450 3A4 (por ejemplo, efavirenz, rifampicina) puede conducir a reducciones variables en las concentraciones plasmáticas de atorvastatina. Debido al mecanismo de interacción dual de rifampicina, (inducción de citocromo P450 3A4 e inhibición del transportador de captación de hepatocitos OATP1B1), se recomiendan co-administraciones simultáneas de atorvastatina con rifampin, ya que la administración retardada de atorvastatina después de la administración de rifampin ha sido asociada con una reducción significativa en las concentraciones plasmáticas de atorvastatina.
Antiácidos: La co-administración de atorvastatina con una suspensión de antiácido oral que contiene magnesio e hidróxidos de aluminio, disminuyó las concentraciones plasmáticas de atorvastatina en aproximadamente 35%; sin embargo, no se alteró la reducción de LDL-C.
Antipirina: Debido a que la atorvastatina no afecta la farmacocinética de antipirina, no se esperan interacciones con otros fármacos metabolizados mediante la misma isoenzima de citocromo.
Colestipol: Las concentraciones plasmáticas de atorvastatina fueron más bajas (aproximadamente 25%) cuando colestipol fue administrado con atorvastatina. Sin embargo, los efectos de lípidos fueron mayores cuando atorvastatina y colestipol fueron co-administrados que cuando cada fármaco se administró por separado.
Digoxina: Las concentraciones plasmáticas en estado estable de digoxina no se vieron afectadas cuando se co-administraron dosis múltiples de digoxina y 10 mg de atorvastatina. Sin embargo, las concentraciones de digoxina aumentaron aproximadamente 20% tras administración de digoxina con 80 mg de atorvastatina diariamente. Los pacientes que toman digoxina deben ser monitoreados de manera apropiada.
Azitromicina: La co-administración de atorvastatina (10 mg una vez al día) y azitromicina (500 mg una vez al día) no alteró las concentraciones plasmáticas de atorvastatina.
Anticonceptivos orales: La co-administración con un anticonceptivo oral que contiene noretindrona y estradiol etinil aumentó los valores AUC de noretindrona y estradiol etinil por aproximadamente 30% y 20%. Estos aumentos deben considerarse cuando se selecciona un anticonceptivo oral para una mujer que toma atorvastatina.
Warfarina: Se realizó un estudio de interacción de atorvastatina con warfarina, y no se observaron interacciones significativas clínicas.
Amlodipino: En un estudio de interacción fármaco-fármaco en sujetos saludables, la co-administración de atorvastatina 80 mg y amlodipino 10 mg resultó en un 18% de aumento en la exposición a atorvastatina, lo cual no fue clínicamente significativo.
Otras terapias concomitantes: En estudios clínicos, la atorvastatina fue utilizada concomitantemente con agentes antihipertensivos y con terapia de reemplazo de estrógenos sin evidencia de interacciones adversas clínicamente significativas. No se ha realizado estudios de interacción con agentes específicos.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN:
General: Antes de instituir terapia con atorvastatina, debe hacerse un intento para controlar la hipercolesterolemia con dieta apropiada, ejercicio y reducción de peso en pacientes obesos, y para tratar problemas médicos subyacentes. El paciente debe continuar con una dieta estándar para bajar el colesterol durante el tratamiento con atorvastatina. El rango de dosificación es de 10 a 80 mg una vez al día. Las dosis pueden administrarse en cualquier hora del día, con o sin alimentos. La dosis inicial y de mantenimiento deben individualizarse de acuerdo con los niveles de LDL-C basales, la meta de la terapia, y la respuesta del paciente. Después del inicio y/o al momento de la titulación de atorvastatina, los niveles de lípidos deben analizarse dentro de 2 a 4 semanas, así como el ajuste de dosificación de manera acorde.
Hipercolesterolemia primaria e hiperlipidemia combinada (mixta): La mayoría de los pacientes están controlados con 10 mg de atorvastatina una vez al día. Es evidente una respuesta terapéutica dentro de dos semanas, y la respuesta máxima se alcanza usualmente dentro de cuatro semanas. La respuesta se mantiene durante la terapia crónica.
Hipercolesterolemia familiar homocigótica: En un estudio de uso compasivo de pacientes con hipercolesterolemia familiar homocigótica, la mayoría de los pacientes respondió a 80 mg de atorvastatina con una reducción mayor a 15% en LDL-C (18%-45%).
Hipercolesterolemia familiar heterocigótica en pacientes pediátricos (10-17 años de edad): La dosis inicial recomendada de atorvastatina es 10 mg/día; la dosis máxima recomendada es 20 mg/día (las dosis mayores a 20 mg no han sido estudiadas en esta población de pacientes). Las dosis deben individualizarse de acuerdo a la meta recomendada de la terapia (ver Indicaciones terapéuticas, y Propiedades farmacodinámicas). Los ajustes deben realizarse a intervalos de 4 semanas o más. Uso en pacientes con insuficiencia hepática – (Ver Contraindicaciones y Advertencias especiales y precauciones para uso).
Uso en pacientes con insuficiencia renal: La enfermedad renal no tiene influencia sobre las concentraciones plasmáticas o sobre la reducción de LDL-C con atorvastatina. Por lo tanto, no se requiere de ajuste de dosis.
Uso en pacientes de edad avanzada: No se observaron diferencias en seguridad, eficacia o logro de la meta del tratamiento de lípidos entre pacientes de edad avanzada y la población general (ver Propiedades farmacocinéticas: Poblaciones especiales).
Uso en combinación con otros compuestos medicinales: En los casos en los que es necesaria la co-administración de atorvastatina con ciclosporina83, la dosis de atorvastatina no debe exceder los 10 mg (ver Advertencias especiales y precauciones para uso: Efectos musculoesqueléticos y Interacción con otros productos medicinales y otras formas de interacción: Inhibidores de transportadores).
SOBREDOSIS: No existe un tratamiento específico para la sobredosis de atorvastatina. En caso de que ocurra una sobredosis, el paciente debe ser tratado sintomáticamente y deben instituirse medidas de apoyo, según se requieran.
Debido al enlace extenso del fármaco a las proteínas plasmáticas, no se espera que la hemodiálisis mejore significativamente la depuración de atorvastatina.