LANTUS
INSULINA GLARGINA
Solución inyectable
Vial(es) , 10 ml , 1000 Unidades Internacionales
Caja, 1,2,5 y 10 Viales, 10 U/ml
FÓRMULA: Insulina glargina de acción prolongada, producida mediante la tecnología de ADN recombinante.
Cada mL de SOLUCIÓN Inyectable contiene: 3,6378 mg de insulina glargina recombinante equivalente a 100 U de insulina humana.
Cada Vial contiene 10 mL (36,378 mg de insulina glargina recombinante) equivalente a 1000 U de insulina humana.
Excipientes: Metacresol, polisorbato 20, cloruro de zinc, glicerol (85%), hidróxido de sodio y ácido clorhídrico concentrado (para ajustar el pH), agua para inyección c.s.
Cada Cartucho contiene 3 mL (10,9134 mg de insulina glargina recombinante) equivalente a 300 U de insulina humana.
Excipientes: Metacresol, cloruro de zinc, glicerol (85%), hidróxido de sodio y ácido clorhídrico concentrado (para ajustar el pH), agua para inyección c.s.
Los cartuchos LANTUS® deben usarse únicamente con las plumas/ dispositivos reutilizables de Sanofi; consulte con su Médico o Farmacéutico. Estos cartuchos no deben ser usados con otras plumas/ dispositivos reutilizables porque la exactitud de la dosis no se ha establecido con dispositivos de otros fabricantes.
INDICACIONES: Tratamiento de adultos, adolescentes y niños mayores de 2 años con diabetes mellitus, cuando se requiere el tratamiento con insulina.
FARMACODINAMIA: La insulina glargina es un análogo de insulina humana diseñado para tener una baja solubilidad en un pH neutro. Es completamente soluble en el pH ácido de la solución para inyección de LANTUS® (pH 4).
Después de la inyección en el tejido subcutáneo, la solución ácida se neutraliza conduciendo a la formación de microprecipitados desde los cuales son liberadas continuamente pequeñas cantidades de insulina glargina, proporcionando un perfil concentración/tiempo uniforme, sin picos y predecible, con una duración de acción prolongada.
La insulina glargina se metaboliza rápidamente en dos metabolitos activos M1 y M2 (ver sección Farmacocinética).
Unión al receptor de insulina: Los estudios in vitro indican que la afinidad de la insulina glargina y sus metabolitos M1 y M2 por el receptor de insulina humana es similar a la de insulina humana.
Unión al receptor del IGF-1: La afinidad de la insulina glargina por el receptor del IGF-1 humano es aproximadamente 5 a 8 veces mayor que la afinidad de la insulina humana; sin embargo la afinidad de la insulina glargina por el receptor del IGF-1 es aproximadamente 70 a 80 veces menor que la del IGF-1 endógeno, en tanto que los metabolitos M1 y M2 se unen al receptor del IGF-1 con una afinidad ligeramente menor en comparación con la de insulina humana.
La concentración terapéutica total de la insulina (insulina glargina y sus metabolitos) que se encuentra en los pacientes diabéticos tipo 1, fue marcadamente inferior a la que se requeriría para alcanzar la mitad de la ocupación máxima del receptor de IGF-1 y la subsecuente activación de la vía proliferativa mitogénica que es iniciada por el receptor IGF-1. Las concentraciones fisiológicas de IGF-1 endógenas son capaces de activar la vía proliferativa mitogénica; sin embargo, las concentraciones terapéuticas encontradas durante la terapia con insulina, incluso en la terapia con LANTUS®, son considerablemente inferiores a las concentraciones farmacológicas requeridas para activar la vía proliferativa mitogénica mediada por el IGF-1.
En estudios de clamp euglucémico realizados en sujetos sanos o en pacientes diabéticos tipo 1, el inicio de acción de la insulina glargina fue más lento que el de la insulina humana NPH. El perfil de acción de la insulina glargina fue constante y sin picos y el efecto fue más prolongado. La duración promedio de acción medida desde la inyección del medicamento hasta el final de su efecto terapéutico fue de 14,5 horas para la insulina NPH y de 24 horas para la insulina glargina. La mayoría de los pacientes tratados con insulina glargina aún mostraban efecto terapéutico en este punto, indicando una duración de acción todavía mayor.
La duración de acción más prolongada de la insulina glargina está directamente relacionada con su tasa de absorción más lenta, lo cual apoya la administración de insulina glargina una vez al día.
Ensayo ORIGIN (Estudio 4032): El ensayo ORIGIN (Reducción de eventos con una intervención temprana con Glargina) fue un estudio, internacional, multicéntrico, aleatorizado, de diseño factorial 2x2 realizado en 12.537 participantes con alteración de la glucosa en ayunas (IFG), intolerancia a la glucosa (IGT) o principio de diabetes mellitus tipo 2 y evidencia de enfermedad cardiovascular (CV). Los participantes fueron aleatorizados para recibir LANTUS® (n=6.264), titulada a una FPG (por sus siglas en inglés, glucemia en ayunas) de 95 mg/dl (5,3 mM) o menos, o Atención estándar (n=6.273). Al inicio, los participantes tenían una edad media de 63,5 años, una duración media de la diabetes de 5,8 años en aquellos con diabetes pre-existente y HbA1c media de 6,4%. La duración media del seguimiento fue de aproximadamente 6,2 años.
Al final del ensayo, el 81% de los participantes aleatorizados para recibir LANTUS® todavía se encontraban en tratamiento. Los valores medios de HbA1c durante el tratamiento oscilaron entre 5,9 y 6,4% en el grupo de LANTUS®, y entre 6,2% y 6,6% en el grupo de atención estándar, a lo largo del periodo de seguimiento. La media de glucemia en ayunas luego de la titulación de dosis, estuvo dentro del objetivo (≤95 mg/dL) en el grupo de LANTUS® durante el estudio.
La tasa de hipoglucemia severa (participantes afectados por cada 100 participantes expuestos durante años), fue de 1,05 para la insulina glargina y de 0,30 para el grupo de atención estándar.
Globalmente se reportó hipoglucemia severa en el 3,7% de los participantes, durante los 6 años del estudio (aproximadamente 0,6% por participante-año).
La media del cambio del peso corporal desde el inicio hasta la última visita durante el tratamiento, fue 2,2 kg mayor en el grupo LANTUS® que en el grupo de atención estándar.
El objetivo primario de este estudio fue examinar el efecto de LANTUS® en dos resultados de eficacia compuestos co-primarios. El primero fue el tiempo hasta la primera ocurrencia de muerte CV, infarto miocardio (IM) o accidente cerebrovascular no fatal; el segundo fue el tiempo hasta la primera aparición de cualquiera de los primeros eventos co-primarios, procedimiento de revascularización (cardiaca, carotídea, o periférica), u hospitalización por falla cardiaca.
Los puntos finales secundarios fueron:
— Mortalidad por cualquier causa.
— Un resultado microvascular compuesto.
— Desarrollo de la diabetes tipo 2, en los participantes con IGT y/o IFG basal.
Los resultados de los desenlaces primarios y secundarios, así como los resultados para cada componente de los co-primarios, se muestran en las dos tablas a continuación:
|
Tabla 1: ORIGIN - Tiempo hasta el inicio de los puntos finales primarios y secundarios |
|||
|
LANTUS® N=6264 |
Atención estándar N=6273 |
LANTUS® vs. Atención estándar |
|
|
Participantes con evento N (%) |
Participantes con evento N (%) |
Razón de riesgos (95% CI) |
|
|
Puntos finales primarios |
|||
|
Muerte CV infarto miocardio (IM) o ACV no fatal |
1041 (16,6) |
1013 (16,1) |
1,02 (0,94; 1,11) |
|
Muerte CV, infarto miocardio (IM) o ACV hospitalización por insuficiencia cardiaca o procedimiento de revascularización |
1792 (28,6) |
1727 (27,5) |
1,04 (0,97; 1,11) |
|
Puntos finales secundarios |
|||
|
Todas las causas de mortalidad |
951 (15,2) |
965 (15,4) |
0,98 (0,90; 1,08) |
|
Resultado microvascular compuesto* |
1323 (21,7) |
1363 (21,7) |
0,97 (0,90; 1,05) |
|
Componentes del punto final co-primario |
|||
|
Muerte CV |
580 (9,3) |
576 (9,2) |
1,00 (0,89; 1,13) |
|
MI (Fatal o No Fatal) |
336 (5,4) |
326 (5,2) |
1,03 (0,88; 1,19) |
|
ACV (Fatal o No Fatal) |
331 (5,3) |
319 (5,1) |
1,03 (0,89; 1,21) |
|
Revascularización |
908 (14,5) |
860 (13,7) |
1,06 (0,96; 1,16) |
|
Hospitalización por falla cardiaca |
310 (4,9) |
343 (5,5) |
0,90 (0,77; 1,05) |
|
*con componentes de: fotocoagulación láser o la vitrectomía o ceguera por retinopatía diabética, progresión de albuminuria, o duplicación de la creatinina sérica o desarrollo de la necesidad de terapia de reemplazo renal. |
|||
|
Tabla 2: Tasa de incidencia de diabetes hacia el final del estudio OGTT* |
||
|
Tratamiento |
LANTUS® |
Atención estándar |
|
Número de participantes** |
737 |
719 |
|
# Participantes que desarrollaron diabetes (%) |
182 (24,7) |
224 (31,2) |
|
Odds Ratio (95%CI) |
0,72 (0,58 a 0,91) |
|
|
* El fin del estudio OGTT se realizó 3-4 semanas después de suspender LANTUS® ** Participantes con pre-diabetes (IFG o IGT) al inicio del estudio, basado en una OGTT realizada entonces. |
||
No hubo diferencias estadísticamente significativas entre los grupos de tratamiento, en la incidencia global de cáncer (todos los tipos combinados) o muerte por cáncer. El tiempo hasta el primer evento de cualquier tipo de cáncer o nuevo cáncer durante el estudio, fue similar entre los dos grupos de tratamiento con los respectivos índices de riesgo de 0,99 (0,88; 1,11) y 0,96 (0,85; 1,09).
La participación en ORIGIN durante un promedio de aproximadamente 6,2 años, mostró que el tratamiento con LANTUS® no alteró el riesgo de eventos cardiovasculares, mortalidad por cualquier causa o cáncer, en comparación con la terapia estándar de reducción de glucosa. Además el control metabólico se mantuvo en el nivel inferior de glucemia, con una disminución en el porcentaje de participantes desarrollando diabetes, a expensas de un modesto aumento de hipoglucemia y peso.
FARMACOCINÉTICA:
Distribución: Después de la inyección subcutánea de insulina glargina en sujetos sanos y pacientes diabéticos, las concentraciones séricas de insulina indicaron una absorción más lenta y mucho más prolongada y una carencia de pico en comparación con la insulina NPH humana. Las concentraciones fueron por lo tanto, consistentes con el perfil de tiempo de acción farmacodinámica de la insulina glargina.
Después de la inyección subcutánea de 0,3 U/Kg de insulina glargina en pacientes diabéticos, se ha demostrado un perfil concentración-tiempo plano; esto se refleja también en el amplio rango de valores de tmax (entre 1,5 y 22,5 horas) comparado con el de NPH (2,5 a 10,0 horas).
Cuando se administra por vía intravenosa, los perfiles de concentración y la vida media de eliminación aparente de la insulina glargina y la insulina humana fueron comparables.
No hubo diferencias relevantes en los niveles séricos de insulina después de la administración de insulina glargina en el abdomen, el deltoides o el muslo.
La insulina glargina tiene menos variabilidad intra e interindividual en el perfil farmacocinético, comparada con la insulina humana ultralenta.
Metabolismo: Después de la inyección subcutánea de LANTUS® en individuos sanos y en pacientes diabéticos, la insulina glargina se metaboliza rápidamente a nivel de la terminación carboxilo de la cadena Beta, lo cual resulta en la formación de dos metabolitos activos: M1 (21A- Gly- insulina) y M2 (21A-Gly-des-30B-Thr-insulina). El principal compuesto circulante en el plasma es el metabolito M1. La exposición a M1 aumentó en relación con la dosis de LANTUS® administrada. Los hallazgos farmacocinéticos y farmacodinámicos señalan que el efecto de la inyección subcutánea de LANTUS®, depende principalmente de la exposición a M1. La insulina glargina y el metabolito M2, no fueron detectados en la gran mayoría de sujetos y cuando se detectaron, sus concentraciones fueron independientes de la dosis de LANTUS® administrada.
CONTRAINDICACIONES: LANTUS® no debe utilizarse en pacientes con hipersensibilidad a la insulina glargina o a cualquiera de sus excipientes.
ADVERTENCIAS Y PRECAUCIONES: Se requiere control periódico de glucemia. En caso de control inadecuado de la glucosa o de una tendencia a episodios de hiper o hipoglucemia, deberá revisarse el cumplimiento del paciente con el régimen de insulina prescrito, los sitios de inyección, la técnica apropiada de inyección, el manejo de los dispositivos para aplicación y todos los demás factores relevantes deben ser revisados antes de considerar el ajuste de la dosis.
Es recomendable alternar continuamente el sitio de aplicación en el tejido celular subcutáneo, con el fin de evitar la aparición de trastornos tipo lipodistrofia.
Hipoglucemia: El momento en que ocurre la hipoglucemia depende del perfil de acción de las insulinas usadas y por ende puede cambiar cuando se realizan cambios en el régimen de tratamiento.
Al igual que con todas las insulinas debe actuarse con especial precaución y se recomienda una intensificación del monitoreo glucémico en los pacientes con secuelas por episodios hipoglucémicos, que podrían revestir particular relevancia clínica. Por ejemplo en los pacientes con estenosis significativa de las arterias coronarias o de los vasos que irrigan al cerebro, así como en los pacientes con retinopatía proliferativa, especialmente si no se han tratado con láser.
El efecto prolongado de insulina glargina subcutánea puede retardar la recuperación del paciente en caso de hipoglucemia.
La presencia de factores que aumentan la susceptibilidad a la hipoglucemia, requiere un control particularmente estricto y puede ser necesario un ajuste de dosis, p. ej.: Cambio en la zona de inyección, aumento de la sensibilidad a la insulina (ej., por eliminación de factores de estrés), actividad física desacostumbrada o ejercicio físico más intenso o prolongado, enfermedad intercurrente (ej., vómitos, diarrea), consumo inadecuado de alimentos y/o alcohol, trastornos endocrinos no compensados y tratamiento concomitante con determinados medicamentos.
En pacientes con compromiso renal, los requerimientos de insulina pueden estar disminuidos debido a la reducción del metabolismo de la insulina. En el anciano, el deterioro progresivo de la función renal puede conducir a una reducción constante de los requerimientos de insulina.
En los pacientes con compromiso hepático severo, los requerimientos de insulina pueden estar disminuidos debido a la capacidad reducida para la gluconeogénesis y la reducción del metabolismo de la insulina.
En general la hipoglucemia puede corregirse mediante la ingesta inmediata de carbohidratos. Los pacientes deben cargar consigo 20 g de carbohidratos todo el tiempo.
Enfermedades concomitantes: La enfermedad concomitante requiere la intensificación del control metabólico. En muchos casos está indicada la realización de análisis de orina para detectar la presencia de cuerpos cetónicos y a menudo es necesario ajustar la dosis de insulina, siendo frecuente el aumento de la misma.
En pacientes con diabetes mellitus Tipo 1, el suministro de carbohidratos se debe mantener incluso si los pacientes sólo pueden ingerir poca cantidad de alimentos o si está vomitando, etc.; en pacientes con diabetes mellitus Tipo 1 nunca se debe omitir la insulina completamente.
LANTUS® no es la insulina de elección para el tratamiento de la cetoacidosis diabética.
Se han reportado errores accidentales en la administración de la insulina glargina debido a confusión con otras insulinas, particularmente insulinas de acción corta. Se sugiere instruir al paciente sobre la importancia de la verificación previa del nombre de la insulina en la etiqueta y empaque, antes de cada aplicación.
Excipientes: Este medicamento contiene menos de 1mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
EMBARAZO: No hay estudios clínicos controlados aleatorizados con el uso de insulina glargina en la mujer embarazada. Un número elevado (más de 1000 resultados del embarazo restrospectivo y prospectivo) de exposiciones durante el embarazo registradas en la vigilancia post-comercialización, no indican ningún efecto adverso específico de la insulina glargina sobre el embarazo o sobre la salud del feto y del recién nacido. Además se realizó un meta-análisis de ocho estudios clínicos observacionales incluyendo 331 mujeres que usaban insulina glargina y 371 mujeres que utilizaban insulina NPH, para evaluar la seguridad de estas insulinas en la diabetes gestacional o pregestacional. No se observaron diferencias significativas relacionadas a la seguridad materna o neonatal respecto al uso de insulina glargina e insulina NPH durante el embarazo.
Para las pacientes con diabetes preexistente o gestacional es esencial mantener un buen control metabólico a lo largo del embarazo, para prevenir resultados adversos asociados a la hiperglucemia. LANTUS® puede ser usado durante el embarazo si es clínicamente necesario.
Los requerimientos de insulina pueden disminuir durante el primer trimestre, generalmente aumentan durante el segundo y tercer trimestre, y declinan rápidamente después del parto. Es esencial un control cuidadoso de la glucosa en dichas pacientes. Las pacientes con diabetes deben informar a su médico si están embarazadas o están planeando un embarazo.
LACTANCIA: La mujer en periodo de lactancia puede requerir ajustes de la dosis de insulina y de la dieta.
REACCIONES ADVERSAS:
Hipoglucemia: Es por lo general el efecto indeseable más frecuente de la terapia con insulina, puede presentarse si la dosis de insulina es demasiado alta en relación con el requerimiento de la misma.
Visión: Un cambio notable en el control glucémico puede causar deterioro transitorio de la visión debido a la alteración temporal en la turgencia y en el índice refractivo del cristalino. Igual que sucede con todos los regímenes insulínicos, la intensificación de la terapia con insulina con una abrupta mejoría del control glucémico, puede estar asociada con un empeoramiento temporal de la retinopatía diabética.
Los efectos de LANTUS® sobre la retinopatía diabética fueron evaluados en un gran estudio controlado con NPH a 5 años, en el cual se investigó la progresión de la retinopatía diabética por fondo de ojo utilizando un protocolo de graduación derivado del estudio ETDRS (Early Treatment Diabetic Retinopathy Study). El objetivo primario en este estudio fue progresión por 3 o más pasos en la escala ETDRS al final del estudio. Los resultados de este análisis se muestran en la tabla 3 para ambos grupos de población: Por Protocolo (primario) y Por intención de tratar (ITT); e indican no inferioridad de LANTUS® sobre NPH en la progresión de la retinopatía diabética como evaluación de este desenlace.
|
Tabla 3: Número (%) de pacientes con 3 o más pasos de progresión en la Escala ETDRS. |
||||
|
LANTUS (%) |
NPH (%) |
Diferencia a, b (SE) |
95% CI para diferencia |
|
|
Por protocolo |
53/374 (14,2%) |
57/363 (15,7%) |
-1,98% (2,57%) |
-7,02% a 3,06% |
|
Intención de Tratar |
63/502 (12,5%) |
71/487 (14,6%) |
- 2,10% (2,14%) |
-6,29% a 2,09% |
|
a= diferencia LANTUS – NPH b= usando un modelo lineal generalizado (SAS GENMOD) con estratos de HbA1c en el tratamiento y línea base como variables independientemente clasificadas, con distribución binomial y función de asociación de identidad. |
||||
Lipodistrofia: Al igual que con cualquier terapia insulínica en el sitio de la inyección puede presentarse lipodistrofia y retraso en la absorción local de la insulina.
Es recomendable que su administración se realice alternando los sitios de aplicación en el tejido celular subcutáneo, a fin de evitar la aparición de trastornos tipo lipodistrofia.
Sitio de la inyección y reacciones alérgicas: En los estudios clínicos, en los regímenes que incluyeron insulina glargina, se observaron reacciones en el sitio de la inyección en el 3 a 4% de los pacientes. Como con cualquier terapia de insulina, tales reacciones incluyeron enrojecimiento, dolor, prurito, urticaria, pápulas e inflamación.
Las reacciones alérgicas de tipo inmediato son raras. Tales reacciones a las insulinas (inclusive insulina glargina) o a los excipientes pueden por ejemplo, estar asociadas con reacciones generalizadas de la piel, angioedema, broncoespasmo, hipotensión y shock, y pueden amenazar la vida.
Otras reacciones: La administración de insulina puede causar la formación de anticuerpos a la insulina. En casos raros, la insulina puede causar retención de sodio y edema.
Población pediátrica: El perfil de seguridad para los pacientes ≤ 18 años de edad es similar al perfil de seguridad para los pacientes > 18 años. No hay datos clínicos de seguridad disponibles en pacientes menores de 2 años de edad.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y USAR MAQUINARIAS: La capacidad del paciente de concentrarse y reaccionar puede verse deteriorada como resultado de la hipoglucemia o la hiperglucemia o por ejemplo, como resultado del deterioro de la visión.
INCOMPATIBILIDADES: LANTUS® no debe mezclarse con ningún otro producto. Las jeringas no deben contener ningún otro producto o residuo.
INTERACCIONES CON OTROS MEDICAMENTOS Y CON ALIMENTOS: Varias sustancias afectan el metabolismo de la glucosa y pueden requerir un ajuste de la dosis de la insulina glargina y particularmente un estrecho monitoreo.
Las sustancias que pueden aumentar el efecto reductor de la glucosa en sangre (efecto hipoglucemiante) y la susceptibilidad a la hipoglucemia incluyen: agentes antidiabéticos orales, inhibidores de la ECA, disopiramida, fibratos, fluoxetina, inhibidores de la MAO, pentoxifilina, propoxifeno, salicilatos y los antibióticos de tipo sulfonamidas.
Las sustancias que pueden reducir el efecto hipoglucemiante incluyen los corticosteroides, danazol, diazóxido, diuréticos, agentes simpaticomiméticos (p.ej., epinefrina, salbutamol, terbutalina), glucagón, isoniazida, derivados de fenotiazina, somatotropina, hormonas tiroideas, estrógenos y progestágenos (p.ej., anticonceptivos orales), inhibidores de proteasas y medicamentos antipsicóticos atípicos (p.ej., olanzapina y clozapina).
Los betabloqueadores, clonidina, sales de litio o alcohol pueden tanto potenciar como debilitar el efecto reductor de la glucosa sanguínea de la insulina. La pentamidina puede causar hipoglucemia, que algunas veces puede ser seguida por hiperglucemia.
Adicionalmente, bajo la influencia de medicamentos simpaticolíticos tales como betabloqueadores, clonidina, guanetidina y reserpina, pueden reducirse o desaparecer los signos de contrarregulación adrenérgica.
Excipientes: Este medicamento contiene sodio.
Debe tenerse en cuenta en los pacientes con una dieta baja en sodio.
DOSIS Y ADMINISTRACIÓN:
Adultos, adolescentes y niños mayores de 2 años:
Dosis Inicial: En un estudio clínico con pacientes diabéticos tipo 2 en los cuales se añadió LANTUS® a la terapia oral antidiabética, la terapia combinada se inició con una dosis de 10 U de insulina glargina una vez al día y se continuo titulando la dosis de acuerdo a los requerimientos individuales de cada paciente.
Dosis de mantenimiento: Individualizada según los requerimientos del paciente.
LANTUS® es una insulina análoga, de acción prolongada y que debe ser administrada por vía subcutánea una vez al día, en cualquier momento del día, pero siempre a la misma hora cada día.
Los niveles deseados de glucosa en sangre, la dosis de insulina glargina y el tiempo de administración de la medicación antidiabética, deben ser determinados y ajustados individualmente.
Puede requerirse ajuste en la dosis, p. ej., si hay cambios en el peso o en el estilo de vida del paciente, cambios en el momento de administración, en la dosis de insulina o en otras circunstancias que originen un incremento en la susceptibilidad a la hipo o hiperglucemia. Cualquier cambio en la dosis de insulina debe ser hecho cuidadosamente y solamente bajo supervisión médica.
Cambio de otras insulinas a LANTUS®: Cuando se pasa de un régimen de tratamiento con una insulina de acción intermedia o con otra insulina de acción prolongada a un régimen con LANTUS®, la cantidad y el momento de administración de un análogo de insulina de acción corta o insulina de acción rápida, o de la dosis de cualquier medicamento antidiabético oral puede requerir un ajuste.
Para reducir el riesgo de hipoglucemia, cuando los pacientes son transferidos de insulina glargina 300 U/mL, una vez al día, a LANTUS® una vez al día, la dosis inicial recomendada de LANTUS® es el 80% de dosis de la insulina glargina 300 U/mL que se está descontinuando.
En estudios clínicos en los que se transfirieron pacientes de insulina NPH una vez al día o de insulina ultralenta a LANTUS® una vez al día, usualmente no se cambió la dosis inicial (ej., cantidad de Unidades U de LANTUS® por día igual a U de insulina NPH).
En estudios en los que se transfirieron pacientes de insulina NPH dos veces al día a LANTUS® una vez al día al momento de acostarse, para reducir el riesgo de hipoglucemia la dosis inicial (U) por lo general fue reducida un 20% aproximadamente (en comparación con la dosis total de U diarias de insulina NPH) y luego se ajustó con base en la respuesta del paciente.
Se recomienda realizar un estricto monitoreo metabólico bajo supervisión médica durante la transferencia y en las primeras semanas posteriores al cambio. Igual que con todos los análogos de insulina, esto es particularmente cierto para pacientes que requieren dosis elevadas de insulina y pueden experimentar una marcada mejoría de la respuesta a la insulina con insulina glargina, debido a la producción de anticuerpos contra la insulina humana.
No debe mezclarse ni diluirse con ninguna otra insulina ya que puede cambiar su perfil de acción/tiempo y la mezcla puede provocar su precipitación.
• Uso pediátrico:
La administración en niños menores de 2 años no ha sido estudiada.
• Uso geriátrico:
En los pacientes ancianos con diabetes, se recomienda que la dosis inicial, los incrementos en la dosis y la dosis de mantenimiento sean conservadoras, para evitar reacciones de hipoglucemia. La hipoglucemia puede ser difícil de reconocer en los ancianos.
• Administración:
LANTUS® se administra por inyección en el tejido subcutáneo.
LANTUS® NO DEBE ADMINISTRARSE POR VÍA INTRAVENOSA.
La duración prolongada de la actividad de Insulina glargina depende de la inyección en el espacio subcutáneo. La administración intravenosa de la dosis subcutánea usual puede producir hipoglucemia severa.
Como con todas las insulinas, los sitios de inyección dentro de un área de inyección subcutánea (abdomen, muslo o deltoides) se deben rotar de una inyección a otra.
La absorción de la insulina glargina no es diferente entre el área de inyección subcutánea del abdomen, muslo o deltoides. Como todas las insulinas, la tasa de absorción y en consecuencia, el inicio y la duración de la acción pueden ser afectados por el ejercicio y otras variables.
LANTUS® es una solución transparente, no es una suspensión. Por tanto, no requiere resuspensión antes del uso.
Las jeringas no deben contener ningún otro producto o residuo.
TRATAMIENTO EN CASO DE SOBREDOSIS:
Síntomas: La sobredosis de insulina puede inducir a hipoglucemia severa y algunas veces a hipoglucemia prolongada y amenazante para la vida.
Manejo: Usualmente los episodios leves de hipoglucemia pueden ser tratados con carbohidratos orales. Puede ser necesario hacer ajustes en la dosificación de la insulina, patrones de alimentación o actividad física.
Los episodios más severos con un desenlace de coma, convulsiones o deterioro neurológico pueden tratarse con glucagón intramuscular o intravenoso o con glucosa concentrada intravenosa. La ingesta sostenida de carbohidratos y la observación clínica pueden ser necesarias puesto que la hipoglucemia puede recurrir después de una recuperación clínica aparente.
PRESENTACIONES: No todas las presentaciones están disponibles en todos los países.
LANTUS® 100 U/mL solución inyectable en Vial de 10mL. Caja por 1, 2, 5 y/o 10 Viales.
LANTUS® 100 U/mL solución inyectable en cartucho de 3 mL incorporado a la pluma/ dispositivo SoloStar®.
Imp./Dist.: SANOFI-AVENTIS DE Colombia S.A., Bogotá. Reg. San.: INVIMA 2011M-0000384-R1 e INVIMA 2011M-0000394-R1. Venta bajo fórmula médica.
SANOFI-AVENTIS DEl Ecuador S.A., Quito-Ecuador. Venta con receta médica. Medicamento Innovador. Medicamento Biotecnológico. Código CUM: A10AE04SLYB5712
TODO MEDICAMENTO DEBE CONSERVARSE FUERA DEL ALCANCE DE LOS NIÑOS.
Bolivia: Distribuido por Quimiza Ltda. Q.F Maysa Claros Paz.. Venta bajo receta médica.
SANOFI-AVENTIS DE Venezuela S.A., RIF J-30308848-1. Farmacéutico Patrocinante: Dra. Sandra Carrillo. CPE040798874
Insulin Glargine CCDS v.18 (LRC 5 Aug 2015)
Revisión: Febrero 2018
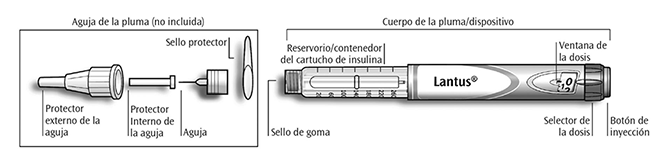
SOLOSTAR® INSTRUCCIONES DE USO:
Pluma/ dispositivo prellenado desechable para dispensar insulina.
LANTUS® Solución inyectable en cartucho incorporado al dispositivo SoloStar®.
SoloStar® es una pluma/dispositivo prellenado para la inyección de insulina. Su profesional de la salud ha decidido que SoloStar® es adecuado para usted basado en su habilidad para manejar el dispositivo SoloStar®. Antes de usar SoloStar® hable con su profesional de la salud sobre la técnica de inyección adecuada.
Lea estas instrucciones detenidamente antes de usar su SoloStar®. Si usted no está capacitado para seguir completamente las instrucciones por sí mismo, usted debe usar SoloStar® sólo si cuenta con la ayuda de una persona que siga completamente las instrucciones.
Sostenga la pluma/ dispositivo como se muestra en este prospecto/ inserto. Para asegurarse que usted leyó correctamente la dosis, sostenga la pluma/ dispositivo horizontalmente, con la aguja hacia la izquierda y el selector de la dosis hacia la derecha como se muestra en la siguiente figura.
Usted puede fijar dosis de 1 a 80 unidades, en pasos de 1 unidad. Cada pluma/dispositivo prellenado desechable contiene dosis múltiples.
Guarde este prospecto/ inserto para futuras consultas.
Información importante para utilizar SoloStar®
— Antes de cada uso, inserte siempre una aguja nueva. Utilice únicamente las agujas compatibles con SoloStar®. Se recomienda la utilización de agujas BD (Becton Dickinson), Ypsomed, Owen Mumford y Artsana.
— No seleccione la dosis y/o pulse el botón de inyección sin antes colocar la aguja.
— Antes de cada inyección, realice siempre la prueba de seguridad (ver Paso 3).
— Esta pluma/dispositivo es únicamente para su uso. No lo comparta con nadie más.
— Si otra persona le administra su inyección, él/ella deberá tener especial precaución para evitar accidentes con la aguja y transmisión de infecciones.
— Nunca utilice SoloStar® si está dañado o si no está seguro de que funciona correctamente.
— Disponga siempre de un SoloStar® de reserva, en caso de que su SoloStar® se pierda o se dañe.
Paso 1. Comprobación de la insulina:
A. Revise la etiqueta de su SoloStar® para comprobar que tiene la insulina correcta. El LANTUS® SoloStar® es gris con un botón de inyección púrpura.
B. Retire la tapa de la pluma/dispositivo.
C. Compruebe el aspecto de su insulina. LANTUS® es una insulina transparente. No utilice SoloStar® si la insulina es opaca, con color o contiene partículas.
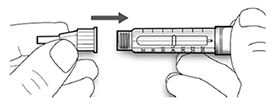
Paso 2. Colocación de la aguja:
Utilice siempre una aguja nueva y estéril para cada inyección. Esto ayuda a prevenir contaminaciones y posibles bloqueos de la aguja.
Antes de colocar la aguja lea cuidadosamente las “Instrucciones de Uso” que acompañan las agujas.
Favor considere las agujas mostradas solo para fines ilustrativos.
• Limpie el sello de goma con alcohol.
A. Retire el sello protector de la aguja nueva.
B. Alinee la aguja con la pluma/ dispositivo y manténgala recta mientras la inserta (enrósquela o empújela dependiendo del tipo de aguja).
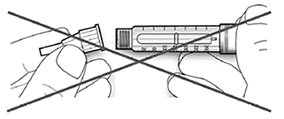
• Si la aguja no se mantiene recta mientras se inserta, el sello de goma puede romperse y dar lugar a pérdidas o a la rotura de la aguja.
Paso 3. Prueba de seguridad:
Antes de cada inyección realice siempre la prueba de seguridad. Esto garantiza que usted recibe la dosis exacta ya que:
• Se asegura el funcionamiento correcto de la pluma/ dispositivo y la aguja.
• Se eliminan las burbujas de aire.
A. Seleccione una dosis de 2 unidades girando el selector de la dosis.

B. Retire el protector externo de la aguja y guárdelo para retirar la aguja utilizada después de cada inyección. Retire el protector interno de la aguja y deséchelo.
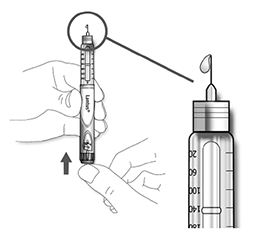
C. Sujete la pluma/ dispositivo con la aguja apuntando hacia arriba.
D. Golpee ligeramente el reservorio del cartucho de insulina para que las burbujas de aire se muevan en dirección a la aguja.
E. Presione el botón de inyección completamente. Compruebe que la insulina sale por el extremo de la aguja.
Puede realizar la prueba de seguridad varias veces hasta que vea la insulina.
— Si no sale insulina, verifique si hay burbujas de aire y repita la prueba de seguridad dos veces más hasta eliminarlas.
— Si aun así no sale insulina, la aguja podría estar bloqueada. Cambie de aguja e inténtelo de nuevo.
— Si no sale insulina después de cambiar la aguja, su SoloStar® podría estar dañado. No use este SoloStar®.
Paso 4. Selección de la dosis:
Puede seleccionar la dosis en pasos de 1 unidad, desde 1 unidad como mínimo y máximo hasta 80 unidades. Si usted necesita una dosis superior a 80 unidades, deberá administrarla en dos o más inyecciones.
A. Compruebe que en la ventana de la dosis aparece “0” después de la prueba de seguridad.
B. Seleccione su dosis (en el siguiente ejemplo la dosis seleccionada es 30 unidades). Si usted sobrepasa la dosis, gire hacia atrás el selector de la dosis.
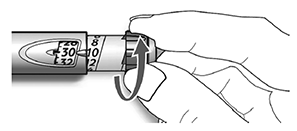
— No presione el botón de inyección mientras gira el selector, de lo contrario saldrá insulina del dispositivo.
— No podrá girar el selector de la dosis si las unidades requeridas superan a las que quedan en la pluma/ dispositivo. No fuerce el selector de la dosis. En este caso usted puede inyectarse la cantidad que queda en la pluma/ dispositivo y completar la dosis con un SoloStar® nuevo o utilizar un SoloStar® nuevo para la dosis completa.
Paso 5. Inyectar la dosis:
A. Utilice el método de inyección que le enseñó su profesional de la salud.
B. Inserte la aguja en la piel.
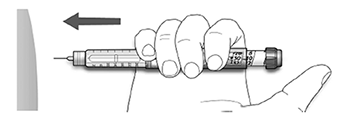
C. Libere la dosis presionando el botón de inyección por completo. En la ventana de la dosis aparecerá el número “0” cuando se inyecte.
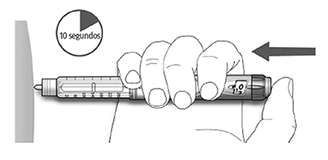
D. Mantenga el botón de inyección presionado por completo. Lentamente cuente hasta 10 antes de retirar la aguja de la piel. Esto garantiza la liberación completa de la dosis. El émbolo de la pluma/ dispositivo se desplaza con cada dosis. El émbolo llega al final del cartucho cuando se han utilizado las 300 unidades de insulina.
Paso 6. Retiro y eliminación de la aguja:
Después de cada inyección retire la aguja y conserve SoloStar® sin la aguja. Esto ayuda a prevenir:
— Contaminaciones y/o infecciones.
— Entrada de aire en el reservorio del cartucho de insulina y pérdida de insulina, que puede ocasionar dosificación inexacta.
A. Coloque el protector externo de la aguja en la aguja y utilícelo para desenroscar la aguja de la pluma/ dispositivo. Para reducir el riesgo de accidentes con la aguja, no vuelva a colocar el protector interno.
— Si otra persona le administra su inyección, él/ella deberá tener especial precaución al retirar y desechar la aguja. Siga las recomendaciones de seguridad para retirar y desechar la aguja (ej.: contacte al profesional de la salud), para reducir el riesgo de accidentes y transmisión de enfermedades infecciosas.
B. Deseche la aguja de forma segura, tal cual le enseñó su profesional de la salud.
C. Coloque siempre la tapa de la pluma/dispositivo prellenado desechable después de cada aplicación y guarde la pluma/dispositivo prellenado desechable hasta su próxima inyección.
ALMACENAMIENTO:
Vial, cartucho y cartucho incorporado al dispositivo SoloStar® no abierto/ sin usar:
LANTUS® debe ser almacenado entre +2 °C y + 8 °C (esto es, en el refrigerador) y protegido de la luz. No permita que la insulina se congele. Debe desecharse en caso de congelación.
No almacene LANTUS® al lado del compartimento del congelador o de un paquete refrigerante.
Abiertos/ en uso: No permita que la insulina se congele. Debe desecharse en caso de congelación.
Una vez realizada la primera aplicación del vial o cartucho, estén refrigerados o no, deben ser desechados después de 28 días (4 semanas). Si la refrigeración no es posible, el Vial de 10 ml o cartucho de LANTUS® iniciado, puede mantenerse sin refrigerar hasta por 28 días (4 semanas), lejos del calor y la luz directa, siempre y cuando la temperatura no sea mayor de 30 °C (86°F).
Los viales de 10 ml y cartuchos de 3 ml sin refrigeración, estén en uso o no, deben ser desechados después de un periodo de 28 días (4 semanas).
Si un cartucho se coloca en una pluma/dispositivo, y se realiza la primera aplicación, éste no debe ser colocado nuevamente en el refrigerador.
Inspeccione el vial o cartucho antes de usar. Sólo debe usarse si la solución es transparente, incolora, sin partículas sólidas visibles y si tiene consistencia similar a la del agua. Como LANTUS® es una solución, no requiere resuspensión antes del uso.
Antes del primer uso, el cartucho incorporado al dispositivo SoloStar® (Pluma/dispositivo) debe conservarse a temperatura ambiente durante 1 o 2 horas.
Se recomienda que la fecha del primer uso del vial se anote en la etiqueta.
Las plumas/dispositivos vacíos nunca deben reutilizarse y deben desecharse de forma segura.
Para prevenir la posible transmisión de enfermedades, cada pluma/dispositivo debe ser utilizado exclusivamente por un solo paciente.
Fabricado por: SANOFI-AVENTIS DEutschland GmbH, Industriepark Hoechst, D-65926 Frankfurt/ Main, Alemania.
INSTRUCCIONES DE CONSERVACIÓN: Revise la sección de “Almacenamiento” de este prospecto/ inserto para las instrucciones de conservación del LANTUS®.
Si SoloStar® está conservado en frío (refrigerado), debe retirarse 1 a 2 horas antes de la primera inyección para que alcance la temperatura ambiente (inferior a 30 °C). La inyección de insulina fría es más dolorosa.
SoloStar® debe desecharse de acuerdo con las exigencias de las autoridades locales.
Mantenga al SoloStar® fuera del alcance y la vista de los niños.
No use el SoloStar® después de la fecha de expiración impresa en la etiqueta de la pluma/dispositivo o en la caja.
Proteja al SoloStar® de la luz.
Mantenimiento:
— Proteja su SoloStar® del polvo y la suciedad.
— Puede limpiar la parte exterior de su SoloStar® con un paño húmedo.
— No ponga en remojo, lave o lubrique la pluma/dispositivo prellenado desechable, ya que podría dañarla.
— SoloStar® está diseñado para funcionar con precisión y seguridad. Debe manipularse con cuidado. Evite las situaciones que puedan dañar al SoloStar®. Si le preocupa que su SoloStar® esté dañado, utilice uno nuevo.
SoloStar for LANTUS CCDM v.3 (LRC 30 Sep 2010)
Revisión: Febrero 2018