LANTUS
INSULINA GLARGINA
Solución inyectable
1 Vial(es), 10 mL, 100 U/mL
1 Caja, 1 Vial(es), 3 mL, 100 U/mL
1 Caja, 2 Vial(es), 3 mL, 100 U/mL
1 Caja, 5 Vial(es), 3 mL, 100 U/mL
COMPOSICIÓN:
Composición cualitativa y cuantitativa:
Cada mL de Solución inyectable contiene:
3,6378 mg de insulina glargina recombinante equivalente a 100 U de insulina humana.
Cada vial contiene 10 mL (36,378 mg de insulina glargina recombinante) equivalente a 1000 U de insulina humana.
Cada cartucho contiene 3mL (10,9134 mg de insulina glargina recombinante) equivalente a 300 U de insulina humana.
Los cartuchos LANTUS® deben usarse únicamente con las plumas/ dispositivos reutilizables de Sanofi; consulte con su Médico o Farmacéutico. Estos cartuchos no deben ser usados con otras plumas/ dispositivos reutilizables porque la exactitud de la dosis no se ha establecido con dispositivos de otros fabricantes.
*La insulina glargina se obtiene por tecnología de ADN recombinante de Escherichia coli.
Para consultar la lista completa de excipientes, ver sección Lista de excipientes.
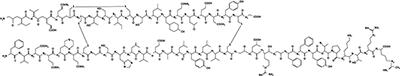
ESTRUCTURA QUÍMICA DE INSULINA GLARGINA – HOE901
Posología:
Nombre químico de la INSULINA GLARGINA: [21A-Gli-30Ba-L-Arg-30Bb-L-Arg-insulina humana]
FORMA FARMACÉUTICA Y FORMULACIÓN:
Forma farmacéutica:
Solución inyectable.
Solución incolora y transparente.
INDICACIONES TERAPÉUTICAS:
Datos clínicos:
Tratamiento de diabetes mellitus en adultos, adolescentes y niños a partir de los 2 años.
PROPIEDADES:
Datos farmacéuticos:
Lista de excipientes:
Vial de 10 ml:
metacresol
polisorbato 20
cloruro de zinc
glicerol (85%)
hidróxido de sodio
ácido clorhídrico concentrado (para ajustar el pH)
agua para inyección c.s.
Cartucho y pluma precargada SoloStar:
metacresol
cloruro de zinc
glicerol (85%)
hidróxido de sodio
ácido clorhídrico concentrado (para ajustar el pH)
agua para inyección c.s.
Este medicamento contiene sodio:
Debe tenerse en cuenta en los pacientes con una dieta baja en sodio.
CONTRAINDICACIONES:
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección Lista de excipientes.
PRECAUCIONES:
Advertencias y precauciones especiales de empleo:
Trazabilidad:
Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
LANTUS no es la insulina de elección para el tratamiento de la cetoacidosis diabética. En cambio, se recomienda en estos casos el uso de insulina regular administrada por vía intravenosa.
Si el control de la glucemia es insuficiente o si el paciente muestra tendencia a episodios hiper o hipoglucémicos, antes de considerar el ajuste de la dosis de insulina es esencial revisar el grado de cumplimiento del tratamiento por parte del paciente, los puntos y las técnicas oportunas de inyección, y todos los demás factores relevantes.
Cambiar a un paciente a otro tipo o marca de insulina debe realizarse bajo estricta supervisión médica. Cambios de concentración, marca (fabricante), tipo (regular, NPH, lenta, de acción prolongada, etc.), origen (animal, humana, análogo de insulina humana) y/o método de fabricación puede necesitar un cambio de dosis.
Se debe enseñar a los pacientes a realizar una rotación continua del punto de inyección para reducir el riesgo de sufrir lipodistrofia y amiloidosis cutánea. Hay un posible riesgo de retraso de la absorción de insulina y empeoramiento del control de la glucemia tras las inyecciones de insulina en puntos con estas reacciones. Se ha notificado que un cambio repentino en el punto de inyección en una zona no afectada produce hipoglucemia. Se recomienda vigilar la glucosa en sangre después de cambiar el punto de inyección y podrá considerarse el ajuste de las medicaciones antidiabéticas.
Hipoglucemia:
El momento de incidencia de la hipoglucemia depende del perfil de acción de las insulinas empleadas y puede, por tanto, cambiar cuando se modifica el régimen de tratamiento. Dado que LANTUS proporciona insulina basal de forma más continuada, se puede esperar que la hipoglucemia nocturna sea menor, aunque la matutina será mayor.
Hay que tener especial cuidado, y es recomendable intensificar el control de la glucemia, en pacientes en los cuales los episodios hipoglucémicos puedan tener especial relevancia clínica, como los pacientes con estenosis significativa de las arterias coronarias o de los vasos que irrigan el cerebro (riesgo de complicaciones cardíacas o cerebrales de la hipoglucemia), así como en pacientes con retinopatía proliferativa, especialmente si no se han tratado con fotocoagulación (riesgo de amaurosis subsiguiente a la hipoglucemia).
Los pacientes deben conocer las circunstancias en que los síntomas de alarma de hipoglucemia se ven reducidos. Los síntomas de alarma de hipoglucemia pueden verse modificados, y ser menos pronunciados o estar ausentes en ciertos grupos de riesgo. Éstos incluyen a los pacientes:
- cuyo control glucémico ha mejorado notablemente,
- en los que la hipoglucemia se desarrolla gradualmente,
- de edad avanzada,
- después de cambiar de una insulina de origen animal a una insulina de origen humano,
- que presentan una neuropatía autónoma,
- con un largo historial de diabetes,
- que padecen una enfermedad psiquiátrica,
- que reciben tratamiento simultáneo con determinados medicamentos (ver sección Interacción con otros medicamentos y otras formas de interacción).
Estas situaciones pueden ocasionar una hipoglucemia grave (y posiblemente la pérdida del conocimiento) antes de que el paciente sea consciente de su hipoglucemia.
El efecto prolongado de la insulina glargina subcutánea puede retrasar la recuperación de la hipoglucemia.
Si se observan valores normales o disminuidos de hemoglobina glucosilada, hay que considerar la posibilidad de que existan episodios recurrentes e inadvertidos (especialmente nocturnos) de hipoglucemia.
El cumplimiento por parte del paciente de la dosis prescrita, el régimen dietético, la correcta administración de insulina y el reconocimiento de los síntomas de hipoglucemia, son esenciales para reducir el riesgo de hipoglucemia. Los factores que incrementan la susceptibilidad a la hipoglucemia requieren una especial vigilancia y pueden requerir ajuste de la dosis. Entre ellos se incluyen:
- el cambio del área de inyección,
- el incremento de la sensibilidad a la insulina (p.ej. al eliminar factores de estrés),
- el ejercicio físico desacostumbrado, aumentado o prolongado,
- una enfermedad intercurrente (p.ej. vómitos, diarrea),
- ingesta inadecuada de alimentos,
- omisión de comidas,
- consumo de alcohol,
- ciertos trastornos de descompensación del sistema endocrino, (p.ej. hipotiroidismo e insuficiencia adrenocortical o de la pituitaria anterior),
- el tratamiento concomitante con ciertos medicamentos (ver sección Interacción con otros medicamentos y otras formas de interacción).
Enfermedades intercurrentes:
Las enfermedades intercurrentes exigen una intensificación del control metabólico. En muchos casos está indicada la realización de análisis de orina para detectar la presencia de cuerpos cetónicos, y a menudo hay que ajustar la dosis de insulina, siendo frecuente que aumente la necesidad de la misma. Los pacientes con diabetes del tipo 1 deben continuar consumiendo al menos una pequeña cantidad de carbohidratos de forma periódica, aun cuando sean incapaces de comer o coman sólo un poco, o padezcan vómitos, etc., y nunca deben interrumpir completamente la administración de insulina.
Anticuerpos antiinsulina:
La administración de insulina puede dar lugar a la formación de anticuerpos antiinsulina. En raras ocasiones, la presencia de estos anticuerpos antiinsulina puede precisar un ajuste de la dosis de insulina para corregir una tendencia a la hiper o a la hipoglucemia (ver sección Propiedades farmacodinámicas).
Plumas a utilizar con LANTUS 100 unidades/ml en cartuchos:
LANTUS 100 unidades/ml en cartuchos sólo está indicado para inyecciones subcutáneas administradas con una pluma reutilizable. Si es necesaria la administración con jeringa, se debe utilizar un vial. Los cartuchos de LANTUS se deben utilizar únicamente con las siguientes plumas:
- JuniorSTAR que libera LANTUS en incrementos de 0,5 unidades de dosis.
- ClikSTAR, Tactipen, Autopen 24, AllStar y AllStar PRO que liberan LANTUS en incrementos de 1 unidad de dosis.
Estos cartuchos no se deben utilizar con ninguna otra pluma reutilizable, ya que la exactitud de la dosis está únicamente establecida con las plumas citadas.
En su país, puede que solamente estén comercializadas algunas de estas plumas (ver secciones Posología y forma de administración y Precauciones especiales de eliminación y otras manipulaciones).
Manejo de la pluma precargada SoloStar:
LANTUS SoloStar 100 unidades/ml en pluma precargada sólo está indicado para inyecciones subcutáneas. Si es necesaria la administración con jeringa, se debe utilizar un vial (ver sección Posología y forma de administración).
Antes de usar LANTUS SoloStar, se deben leer las instrucciones de uso incluidas en el prospecto cuidadosamente. LANTUS SoloStar se tiene que utilizar, tal y como recomiendan estas instrucciones de uso (ver sección Precauciones especiales de eliminación y otras manipulaciones).
Errores de medicación:
Se han notificado errores de medicación, en los cuales se han administrado de forma accidental otras insulinas, en particular insulinas de acción corta, en lugar de insulina glargina. Se debe comprobar siempre la etiqueta de insulina antes de cada inyección para evitar errores de medicación entre insulina glargina y otras insulinas.
Combinación de LANTUS con pioglitazona:
Se han notificado casos de insuficiencia cardíaca cuando se utiliza pioglitazona en combinación con insulina, sobre todo en pacientes con factores de riesgo para el desarrollo de insuficiencia cardíaca.
Esto deberá tenerse en cuenta si se considera el tratamiento con la combinación de pioglitazona y LANTUS. Si se usa esta combinación, se deben observar a los pacientes por si aparecen signos y síntomas de la insuficiencia cardíaca, aumento de peso y edema. Se debe interrumpir el tratamiento con pioglitazona si se produce cualquier deterioro de los síntomas cardíacos.
Excipientes:
Este medicamento contiene menos de 1mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Fertilidad, embarazo y lactancia:
Embarazo:
No se dispone de datos clínicos sobre la exposición a la insulina glargina durante el embarazo en estudios clínicos controlados. Existe un elevado número de datos sobre mujeres embarazadas (datos en más de 1000 embarazos) que indican que insulina glargina no produce efectos adversos específicos sobre el embarazo, ni malformaciones específicas ni toxicidad fetal/neonatal.
Los estudios realizados en animales no han mostrado toxicidad para la reproducción.
El uso de LANTUS se puede considerar durante el embarazo, en aquellos casos en los que esté clínicamente indicado.
Es esencial que las pacientes con diabetes preexistente o gravídica mantengan un buen control metabólico durante el embarazo para prevenir los resultados adversos asociados a hiperglucemia. Las necesidades de insulina pueden disminuir durante el primer trimestre y generalmente aumentan durante el segundo y tercer trimestre. Inmediatamente después del parto, las necesidades de insulina disminuyen de forma rápida (aumento del riesgo de hipoglucemia), siendo esencial un control cuidadoso de la glucosa.
Lactancia:
Se desconoce si la insulina glargina se excreta en la leche materna. No se prevén efectos metabólicos de la insulina glargina ingerida en niños/recién nacidos lactantes puesto que la insulina glargina como péptido es digerida en aminoácidos en el tracto gastrointestinal humano.
Las mujeres en periodo de lactancia pueden necesitar ajustes en la dosis de insulina y en la dieta.
Fertilidad:
Los estudios en animales no indican efectos perjudiciales directos en términos de fertilidad.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCCIÓN Y EL USO DE MAQUINARIA:
Efectos sobre la capacidad para conducir y utilizar máquinas:
La capacidad de concentración y de reacción del paciente puede verse afectada como consecuencia de una hipoglucemia o una hiperglucemia o, por ejemplo, como consecuencia de un trastorno visual. Esto puede ser causa de riesgo en situaciones en que estas capacidades sean de especial importancia (p.ej.conducir un automóvil o utilizar máquinas).
Debe advertirse a los pacientes que adopten precauciones para evitar una hipoglucemia mientras conducen. Esto es particularmente importante en aquellos pacientes con ausencia o reducción de la capacidad para percibir los síntomas de aviso de hipoglucemia, o que padecen episodios frecuentes de hipoglucemia. Deberá considerarse la conveniencia de conducir o utilizar máquinas en estas circunstancias.
REACCIONES ADVERSAS:
Resumen del perfil de seguridad:
La hipoglucemia (muy frecuente) que es por lo general, la reacción adversa más frecuente de la terapia con insulina, puede producirse si la dosis de insulina es muy elevada en relación con las necesidades de la misma (ver sección Advertencias y precauciones especiales de empleo).
Tabla de reacciones adversas:
A continuación, se enumeran según el sistema órgano-clase y en orden decreciente de incidencia, las siguientes reacciones adversas relacionadas, procedentes de ensayos clínicos (muy frecuentes: ≥ 1/10; frecuentes: ≥ 1/100 a < 1/10; poco frecuentes: ≥ 1/1.000 a < 1/100; raras: ≥ 1/10.000 a < 1/1.000; muy raras: < 1/10.000; no conocida: no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Base de datos de clasificación de órganos del sistema MedDRA |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Muy raras |
No conocida |
|
Trastornos del sistema inmunológico |
Reacciones alérgicas |
|||||
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia |
|||||
|
Trastornos del sistema nervioso |
Disgeusia |
|||||
|
Trastornos oculares |
Trastorno visual Retinopatía |
|||||
|
Trastornos de la piel y del tejido subcutáneo |
Lipohipertrofia |
Lipoatrofia |
Amiloidosis cutánea |
|||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Mialgia |
|||||
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones en el punto de inyección |
Edema |
Descripción de las reacciones adversas seleccionadas:
Trastornos del metabolismo y de la nutrición:
Las crisis hipoglucémicas graves, especialmente si muestran un patrón recurrente, pueden producir lesiones neurológicas. Los episodios hipoglucémicos prolongados o graves pueden ser potencialmente mortales.
En muchos pacientes, los signos y síntomas de neuroglucopenia están precedidos por signos de contrarregulación adrenérgica. En general, cuanto mayor y más rápido es el descenso de la glucemia, más marcado es el fenómeno de contrarregulación y sus síntomas (ver sección Advertencias y precauciones especiales de empleo).
Trastornos del sistema inmunológico:
Las reacciones alérgicas de tipo inmediato a la insulina son raras. Estas reacciones a la insulina (incluyendo la insulina glargina) o a los excipientes, pueden acompañarse, por ejemplo, de reacciones cutáneas generalizadas, angioedema, broncoespasmo, hipotensión y shock, pudiendo ser potencialmente mortales.
Trastornos oculares:
Un cambio importante en el control de la glucemia puede provocar un trastorno visual temporal, debido a la alteración temporal de la turgencia y del índice de refracción del cristalino.
La mejora a largo plazo del control de la glucemia reduce el riesgo de progresión de la retinopatía diabética. Sin embargo, la intensificación de la terapia con insulina, con una mejora brusca del control de la glucemia, puede estar asociado a un deterioro temporal de la retinopatía diabética. En pacientes con retinopatía proliferativa, especialmente si no se ha tratado con fotocoagulación, los episodios hipoglucémicos graves pueden ocasionar una amaurosis transitoria.
Trastornos de la piel y del tejido subcutáneo:
Se puede producir una lipodistrofia y amiloidosis cutánea en el punto de inyección que retrase la absorción local de la insulina. La rotación continua del punto de inyección dentro de una misma área de inyección puede ser útil para reducir o evitar estas reacciones.
Trastornos generales y alteraciones en el lugar de administración:
Reacciones en el punto de inyección que incluyen enrojecimiento, dolor, prurito, urticaria, hinchazón o inflamación. La mayor parte de las reacciones leves a la insulina, en el punto de inyección, se resuelven habitualmente en unos días o en pocas semanas.
Raras veces, la insulina puede ocasionar retención de sodio y edema, especialmente si se mejora un control metabólico previo deficiente, con un tratamiento insulínico intensificado.
Población pediátrica:
En general, el perfil de seguridad en niños y adolescentes (≤ 18 años) es similar al perfil de seguridad en adultos.
Las notificaciones de reacciones adversas recibidas en la postcomercialización incluyeron relativamente más frecuentemente reacciones en el lugar de inyección (dolor en el lugar de inyección, reacción en el lugar de inyección) y reacciones en la piel (rash, urticaria) en niños y adolescentes (≤ 18 años) que en adultos.
No se dispone de datos de seguridad en estudios clínicos en niños menores de 2 años.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación de su país.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacción con otros medicamentos y otras formas de interacción:
Diversas sustancias afectan al metabolismo de la glucosa y pueden requerir el ajuste de la dosis de insulina glargina.
Entre las sustancias que pueden aumentar el efecto hipoglucemiante e incrementar la susceptibilidad a la hipoglucemia se cuentan los medicamentos antidiabéticos orales, los inhibidores de la enzima convertidora de la angiotensina (ECA), la disopiramida, los fibratos, la fluoxetina, los inhibidores de la mono amino-oxidasa (MAO), la pentoxifilina, el propoxifeno, los salicilatos y los antibióticos del tipo de las sulfamidas.
Entre las sustancias que pueden reducir el efecto hipoglucemiante se incluyen los corticosteroides, el danazol, el diazóxido, los diuréticos, el glucagón, la isoniazida, los estrógenos y los progestágenos, los derivados de fenotiazina, la somatotropina, los medicamentos simpaticomiméticos (p.ej. epinefrina [adrenalina], salbutamol, terbutalina) las hormonas tiroideas, medicamentos antipsicóticos atípicos (p. ej. clozapina y olanzapina) e inhibidores de la proteasa.
Los betabloqueantes, la clonidina, las sales de litio o el alcohol pueden potenciar o debilitar el efecto hipoglucemiante de la insulina. La pentamidina puede provocar hipoglucemia, que algunas veces puede ir seguida de una hiperglucemia.
Además, bajo la influencia de medicamentos simpaticolíticos como los betabloqueantes, la clonidina, la guanetidina o la reserpina, los signos de contrarregulación adrenérgica pueden atenuarse o desaparecer.
INCOMPATIBILIDADES:
Este medicamento no debe mezclarse con otros medicamentos.
LANTUS 100 unidades/ml solución inyectable en un vial:
Es importante asegurar que las jeringas no contengan vestigios de ningún otro material.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Datos preclínicos sobre seguridad:
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción.
REFERENCIA:
Agencia Europea de Medicamentos (EMA) – Resumen de las Características del Producto. LANTUS. Fecha de última actualización 3 de septiembre 2020.
Disponible en: https://www.ema.europa.eu/en/documents/product-information/LANTUS-epar-product-information_es.pdf
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y forma de administración:
Posología:
LANTUS contiene insulina glargina, un análogo de la insulina, y presenta una duración de acción prolongada.
LANTUS debe administrarse una vez al día a cualquier hora, pero todos los días a la misma hora.
La pauta posológica (dosis y horario) se debe ajustar de manera individual. En pacientes con diabetes tipo 2, LANTUS también se puede administrar junto con antidiabéticos orales. La potencia de este medicamento se establece en unidades. Estas unidades son exclusivas de LANTUS y no son las mismas que las UI o las unidades utilizadas para expresar la potencia de otros análogos de insulina (ver sección Propiedades farmacodinámicas).
Poblaciones especiales:
Pacientes de edad avanzada (≥ 65 años):
En pacientes de edad avanzada, el deterioro progresivo de la función renal puede producir una disminución constante de las necesidades de insulina.
Insuficiencia renal:
En pacientes con insuficiencia renal, las necesidades de insulina pueden reducirse a causa de la disminución de su metabolismo.
Insuficiencia hepática:
En pacientes con insuficiencia hepática, las necesidades de insulina pueden disminuir a causa de la reducción de la capacidad de gluconeogénesis y la disminución del metabolismo de la insulina.
Población pediátrica:
Adolescentes y niños a partir de los 2 años de edad:
La seguridad y eficacia de LANTUS ha sido establecida en adolescentes y niños a partir de 2 años de edad (ver sección Propiedades farmacodinámicas). La pauta posológica (dosis y horario) se debe ajustar de manera individual.
Niños menores de 2 años:
La seguridad y eficacia de LANTUS no ha sido establecida. No se dispone de datos.
Cambio de otras insulinas a LANTUS:
Al cambiar de una pauta de tratamiento con una insulina de acción intermedia o larga a una pauta con LANTUS, se puede requerir un cambio de la dosis de la insulina basal y el tratamiento antidiabético concomitante puede requerir un ajuste (dosis e intervalos de las insulinas regulares o de los análogos de la insulina de acción rápida adicionales, o la dosis de los medicamentos antidiabéticos orales).
Cambio de insulina NPH dos veces al día a LANTUS:
Los pacientes que vayan a modificar su pauta de insulina basal de insulina NPH dos veces al día a una única dosis diaria con LANTUS, deben reducir su dosis diaria de insulina basal entre un 20 y un 30 % durante las primeras semanas de tratamiento, con el fin de minimizar el riesgo de hipoglucemia nocturna y matutina.
Cambio de insulina glargina 300 unidades/ml a LANTUS:
LANTUS y Toujeo (insulina glargina 300 unidades/ml) no son bioequivalentes ni son directamente intercambiables. Los pacientes que vayan a cambiar su pauta de insulina basal de insulina glargina 300 unidades/ml una vez al día a LANTUS una vez al día, deben reducir su dosis aproximadamente un 20%, para reducir el riesgo de hipoglucemia.
Durante las primeras semanas, esta disminución debe compensarse, al menos en parte, con un incremento de la insulina en las horas de las comidas, debiendo ajustar esta pauta posteriormente de forma individual.
Durante el cambio de la insulina y en las semanas siguientes se recomienda establecer un estrecho control metabólico.
Con la mejora del control metabólico y el incremento resultante de la sensibilidad a la insulina puede ser necesario un nuevo ajuste de la dosis pautada. También puede requerirse un ajuste de la dosis, por ejemplo, si cambia el peso, el estilo de vida del paciente, el horario de administración de la dosis de insulina o si surgen otras circunstancias que puedan inducir una mayor sensibilidad a la hipo o hiperglucemia (ver sección Advertencias y precauciones especiales de empleo).
Los pacientes con dosis elevadas de insulina a causa de la presencia de anticuerpos antiinsulina humana pueden experimentar una respuesta mejorada a la insulina con LANTUS.
Forma de administración:
LANTUS se administra por vía subcutánea.
LANTUS no se debe administrar por vía intravenosa. La prolongada duración de la acción de LANTUS depende de su inyección en el tejido subcutáneo. La administración intravenosa de la dosis subcutánea habitual puede provocar una hipoglucemia grave.
No existen diferencias clínicamente relevantes en los niveles séricos de insulina o de glucosa tras la administración de LANTUS en el abdomen, en el muslo o en el deltoides. Hay que cambiar los puntos de inyección, dentro de un área de aplicación determinada, de una inyección a otra para reducir el riesgo de lipodistrofia y amiloidosis cutánea (ver secciones Advertencias y precauciones especiales de empleo y Reacciones adversas).
LANTUS no debe mezclarse con ninguna otra insulina ni debe diluirse. Su mezcla o dilución pueden modificar su perfil de acción/tiempo y la mezcla puede provocar su precipitación.
LANTUS 100 unidades/ml solución inyectable en un vial:
Para más información acerca de la manipulación, ver sección Advertencias y precauciones especiales de empleo.
LANTUS 100 unidades/ml solución inyectable en un cartucho:
LANTUS 100 unidades/ml en cartuchos sólo está indicado para inyecciones subcutáneas administradas con una pluma reutilizable. Si es necesaria la administración con jeringa, se debe utilizar un vial (ver sección Advertencias y precauciones especiales de empleo).
Para más información acerca de la manipulación, ver sección Precauciones especiales de eliminación y otras manipulaciones.
LANTUS SoloStar 100 unidades/ml solución inyectable en pluma precargada:
LANTUS SoloStar 100 unidades/ml en pluma precargada sólo está indicado para inyecciones subcutáneas. Si es necesaria la administración con jeringa, se debe utilizar un vial (ver sección Advertencias y precauciones especiales de empleo).
Antes de usar LANTUS SoloStar, las instrucciones de uso incluidas en el prospecto se deben leer cuidadosamente (ver sección Precauciones especiales de eliminación y otras manipulaciones).
PROPIEDADES FARMACÉUTICAS:
Propiedades farmacológicas:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Fármacos usados en diabetes, insulinas y análogos para inyección, de acción prolongada. Código ATC: A10AE04.
Mecanismo de acción:
La insulina glargina es un análogo de la insulina humana diseñado para que tenga baja solubilidad a un pH neutro. Es completamente soluble al pH ácido de la solución de inyección de LANTUS (pH 4).
Tras su inyección en el tejido subcutáneo, la solución ácida es neutralizada, dando lugar a la formación de microprecipitados a partir de los cuales se liberan continuamente pequeñas cantidades de insulina glargina, proporcionando un suave y predecible perfil de concentración/tiempo sin pico, con una duración de acción prolongada.
La insulina glargina se metaboliza en 2 metabolitos activos M1 y M2 (ver sección 5.2).
Unión al receptor de la insulina: estudios in vitro indican que la afinidad de la insulina glargina y sus metabolitos M1 y M2 por el receptor de la insulina humana, es similar a la de la insulina humana.
Unión al receptor de IGF-1: la afinidad de la insulina glargina por el receptor de IGF-1 humano es aproximadamente de 5 a 8 veces mayor que la afinidad por dicho receptor de la insulina humana (pero aproximadamente de 70 a 80 veces menor que la afinidad del IGF- 1 por el receptor de IGF-1), mientras que M1 y M2 se unen al receptor de IGF-1 con una afinidad ligeramente inferior en comparación con la insulina humana.
La concentración terapéutica total de insulina (insulina glargina y sus metabolitos) encontrada en pacientes diabéticos tipo 1 fue marcadamente menor que la que sería necesaria para una ocupación semimáxima del receptor de IGF-1 y consecuentemente la activación de la vía mitogénicaproliferativa iniciada por el receptor de IGF-1. Las concentraciones fisiológicas de IGF-1 endógeno puede activar la vía mitogénica- proliferativa; sin embargo, las concentraciones terapéuticas encontradas en la terapia con insulina, incluida la terapia con LANTUS, son considerablemente menores que las concentraciones farmacológicas necesarias para activar la vía del IGF-1.
La actividad principal de la insulina, incluida la insulina glargina, es la regulación del metabolismo de la glucosa. La insulina y sus análogos reducen los niveles de glucemia mediante la estimulación de la captación periférica de glucosa, especialmente por parte del músculo esquelético y del tejido adiposo, y la inhibición de la producción hepática de glucosa. La insulina inhibe la lipólisis en el adipocito, inhibe la proteólisis y estimula la síntesis de proteínas.
En ciertos estudios clínicos farmacológicos, la insulina glargina y la insulina humana por vía intravenosa han demostrado ser equipotentes cuando se administran a las mismas dosis. Como ocurre con todas las insulinas, el curso temporal de acción de la insulina glargina puede verse afectado por el ejercicio físico y otras variables.
En estudios de clamp euglucémico en sujetos sanos y en pacientes con diabetes tipo 1, el inicio de la acción de la insulina glargina subcutánea fue más lento que el de la insulina NPH humana, su perfil de acción fue suave y sin pico, y la duración de su efecto fue prolongada.
El siguiente gráfico muestra los resultados de un estudio en pacientes:
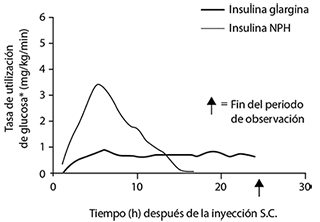
* Determinada como la cantidad de glucosa perfundida para mantener niveles plasmáticos de glucosa constantes (valores medios horarios).
La duración de acción más prolongada de la insulina glargina subcutánea está relacionada directamente con su menor tasa de absorción y respalda su administración una vez al día. El curso temporal de acción de la insulina y de los análogos de la insulina tales como la insulina glargina pueden variar considerablemente en diferentes personas o dentro de la misma persona.
En un estudio clínico, los síntomas de hipoglucemia o las respuestas de contrarregulación hormonal fueron similares tras la administración intravenosa de insulina glargina e insulina humana, tanto en voluntarios sanos como en pacientes con diabetes tipo 1.
En estudios clínicos se observaron anticuerpos que presentaban reacción cruzada con la insulina humana y la insulina glargina, con la misma frecuencia tanto en los grupos de tratamiento con insulina-NPH como con insulina glargina.
Los efectos de insulina glargina (administrado una vez al día) sobre la retinopatía diabética se evaluaron en un ensayo de 5 años de duración, abierto, controlado frente a insulina NPH (administrada 2 veces al día), en 1.024 pacientes con diabetes tipo 2, en los que se evaluó la progresión de retinopatía en tres o más grados en la escala del Estudio para el Tratamiento Precoz de la Retinopatía Diabética (ETDRS) mediante fotografía de fondo de ojo. No se han observado diferencias significativas en la progresión de la retinopatía diabética al comparar insulina glargina frente a insulina NPH.
El estudio ORIGIN (Outcome Reduction with Initial Glargine Intervention) fue un estudio de diseño factorial 2x2, aleatorizado, multicéntrico realizado en 12.537 participantes con alto riesgo cardiovascular (CV) con alteración de la glucosa en ayunas (IFG) o alteración de la tolerancia a la glucosa (IGT) (12% de los participantes) o diabetes mellitus tipo 2 tratados con ≤ 1 antidiabético oral (88% de los participantes). Los participantes fueron aleatorizados (1:1) para recibir insulina glargina (n = 6.264), titulada (ajustada) hasta alcanzar unos valores de Glucemia en ayunas (FPG) ≤ 95 mg/dl (5,3 mM), o tratamiento estándar (n = 6.273). La primera de las dos variables principales de eficacia fue el tiempo transcurrido hasta la primera aparición de muerte CV, infarto de miocardio (IM) no mortal, o ictus no mortal y la segunda variable principal de eficacia fue el tiempo hasta la aparición de cualquiera de los primeros acontecimientos de la primera variable principal, o procedimientos de revascularización (coronaria, carótida o periférica) u hospitalización por insuficiencia cardiaca.
Las variables secundarias incluyen todas las causas de mortalidad y una variable compuesta microvascular.
Insulina glargina no alteró el riesgo relativo de enfermedad CV y mortalidad CV cuando se comparó con el tratamiento estándar. No existieron diferencias entre insulina glargina y el tratamiento estándar para las dos variables principales; ni para cualquier componente de la variable compuesta; para la mortalidad por cualquier causa; o para el resultado microvascular.
La dosis media de insulina glargina al final del estudio fue 0,42 U/kg. Al inicio los participantes tuvieron un valor medio de HbA1c de 6,4% y medianas de HBA1c durante el tratamiento que van del 5,9 al 6,4% en el grupo de insulina glargina, y 6,2% a 6,6% en el grupo de tratamiento estándar durante la duración del seguimiento.
Las tasas de hipoglucemia grave (casos por 100 participantes/año de exposición) fueron 1,05 para insulina glargina y 0,30 para el grupo de tratamiento estándar y las tasas de hipoglucemia no grave fueron 7,71 para insulina glargina y 2,44 para el grupo de tratamiento estándar. Durante el transcurso de los 6 años del estudio, el 42% del grupo de insulina glargina no experimento ninguna hipoglucemia.
En la última visita del tratamiento, hubo un incremento medio del peso corporal desde el valor basal de 1,4 kg en el grupo de insulina glargina y un decrecimiento medio de 0,8 kg en el grupo de tratamiento estándar.
Población pediátrica:
En un ensayo clínico controlado, aleatorizado, en pacientes pediátricos (de edades comprendidas entre 6 y 15 años) con diabetes tipo 1 (n = 349) en tratamiento durante 28 semanas con un régimen de insulina basal en bolus donde se utilizó insulina regular humana antes de cada comida. Se administró insulina glargina una vez al día a la hora de acostarse e insulina humana NPH una o dos veces al día.
En ambos grupos de tratamiento se observaron efectos similares sobre HbA1c (Hemoglobina Glicosilada) y la incidencia de hipoglucemia sintomática, sin embargo la glucosa plasmática en ayunas disminuyó más con respecto a los valores basales en el grupo de insulina glargina que en el grupo de NPH. También apareció menos hipoglucemia grave en el grupo de insulina glargina. Ciento cuarenta y tres pacientes tratados con insulina glargina en este estudio continuaron en tratamiento con insulina glargina en una extensión del estudio sin controlar, con una duración media de seguimiento de 2 años. No se observaron nuevas señales de seguridad durante esta extensión de tratamiento con insulina glargina.
Un estudio cruzado que compara insulina glargina más insulina lispro con insulina humana regular más NPH (cada tratamiento se administró durante 16 semanas en orden aleatorio) se realizó también en 26 adolescentes de 12 a 18 años, con diabetes tipo 1. Como en el estudio pediátrico descrito anteriormente, la reducción de la glucosa plasmática en ayunas con respecto a los valores basales fue mayor en el grupo de insulina glargina que en el grupo de NPH. Los cambios de HbA1c con respecto a los valores basales fueron similares en ambos grupos de tratamiento; sin embargo, los niveles de glucosa en sangre registrados durante la noche fueron significativamente más altos en el grupo de insulina glargina/lispro que en el grupo NPH/regular, con un nadir medio de 5,4 mM versus 4,1mM. Consecuentemente las incidencias de hipoglucemia nocturnas fueron del 32 % en el grupo insulina glargina/lispro versus 52 % en el grupo NPH/regular.
Un estudio de grupos paralelos se realizó en 125 niños con diabetes mellitus tipo 1 de edades comprendidas entre 2 y 6 años durante 24 semanas, comparando insulina glargina administrada una vez al día por la mañana con insulina NPH administrada una o dos veces al día como insulina basal.
Ambos grupos recibieron insulina en bolos antes de las comidas.
El objetivo primario de demostrar la no inferioridad de la insulina glargina frente a NPH en todas las hipoglucemias no se alcanzó y hubo una tendencia al incremento de las hipoglucemias con insulina glargina [ratio tasa insulina glargina: NPH (95% CI) = 1,18 (0,97 – 1,44)].
La HbA1c (Hemoglobina Glicosilada) y variabilidades de glucosa fueron comparables en ambos grupos de tratamiento.
No se observaron nuevos signos de seguridad en este estudio.
Propiedades farmacocinéticas:
En sujetos sanos y en pacientes diabéticos, las concentraciones séricas de insulina indicaron una absorción más lenta y mucho más prolongada y mostraron la ausencia de pico tras la inyección subcutánea de insulina glargina en comparación con la insulina NPH humana. Las concentraciones fueron así consistentes con el perfil temporal de la actividad farmacodinámica de la insulina glargina.
El gráfico anterior mostraba los perfiles de actividad en función del tiempo de la insulina glargina y de la insulina NPH.
La inyección de insulina glargina una vez al día alcanza niveles de estado estacionario 2-4 días después de la primera dosis.
Cuando se administraron por vía intravenosa la semivida de eliminación de la insulina glargina y de la insulina humana eran comparables.
Después de la inyección subcutánea de LANTUS en pacientes diabéticos, la insulina glargina es metabolizada rápidamente en la terminación carboxil de la cadena Beta con la formación de dos metabolitos activos, M1 (21A-Gly-insulina) y M2 (21A-Gly-des-30B-Thr insulina). El principal compuesto circulante en plasma es el metabolito M1. La exposición a M1 incrementa con la dosis administrada de LANTUS. Los hallazgos farmacocinéticos y farmacodinámicos indican que el efecto de la inyección subcutánea de LANTUS se basa principalmente en la exposición a M1. En la mayoría de los sujetos no se detectaron insulina glargina y su metabolito M2 y cuando fueron detectados, sus concentraciones fueron independientes de la dosis administrada de LANTUS.
En ciertos estudios clínicos, los análisis de subgrupos basados en la edad y el sexo no indicaron diferencia alguna en la seguridad ni en la eficacia en pacientes tratados con insulina glargina en comparación con toda la población del estudio.
Población pediátrica:
La farmacocinética se evaluó en un estudio clínico en niños de 2 años a menores de 6 años con diabetes mellitus tipo 1 (ver sección Propiedades farmacodinámicas). Los niveles en plasma de insulina glargina y sus principales metabolitos M1 y M2 se midieron en niños tratados con insulina glargina, mostrando patrones de concentración plasmática similares a los encontrados en adultos y sin mostrar evidencia de acumulación de insulina glargina o sus metabolitos con dosificación crónica.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis:
Síntomas:
La sobredosis de insulina puede dar lugar a hipoglucemia grave y, en ocasiones, de larga duración que puede ser potencialmente mortal.
Medidas:
Los episodios leves de hipoglucemia se pueden tratar normalmente con carbohidratos por vía oral, pudiéndose requerir ajustes de la dosis del medicamento, de las pautas dietéticas o del ejercicio físico.
Los episodios más graves con coma, convulsiones o trastornos neurológicos se pueden tratar con glucagón intramuscular/subcutáneo o con solución glucosada concentrada por vía intravenosa. Puede ser necesaria una ingesta mantenida de carbohidratos y someter al paciente a observación porque la hipoglucemia puede recurrir tras una aparente recuperación clínica.
DEFINICIÓN:
NOMBRE DEL MEDICAMENTO:
LANTUS® 100 U/mL Solución Inyectable en Vial de 10mL. LANTUS® 100 U/mL Solución Inyectable en Cartucho de 3mL
LANTUS® 100 U/mL Solución Inyectable en SoloStar® - Cartucho de 3mL incorporado a la pluma/ dispositivo prellenado desechable para dispensar insulina
INFORMACIÓN COMPLEMENTARIA:
Período de validez:
LANTUS 100 unidades/ml solución inyectable:
VIAL, CARTUCHO Y CARTUCHO INCORPORADO AL DISPOSITIVO SOLOSTAR® ABIERTOS/ EN USO:
Una vez realizada la primera aplicación del vial o cartucho, estén refrigerados o no, deben ser desechados después de 28 días (4 semanas). Si la refrigeración no es posible, el Vial de 10 ml o cartucho de LANTUS® iniciado, puede mantenerse sin refrigerar hasta por 28 días (4 semanas), lejos del calor y la luz directa, siempre y cuando la temperatura no sea mayor de 30 °C (86 °F).
Los viales de 10 ml y cartuchos de 3 ml sin refrigeración estén en uso o no, deben ser desechados después de un periodo de 28 días (4 semanas).
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Precauciones especiales de conservación:
VIAL, CARTUCHO Y CARTUCHO INCORPORADO AL DISPOSITIVO SOLOSTAR® NO ABIERTO/ SIN USAR:
LANTUS® debe ser almacenado entre +2 °C y + 8 °C (esto es, en el refrigerador) y protegido de la luz. No permita que la insulina se congele. Debe desecharse en caso de congelación.
No almacene LANTUS® al lado del compartimento del congelador o de un paquete refrigerante.
ABIERTOS/ EN USO:
No permita que la insulina se congele. Debe desecharse en caso de congelación:
Una vez realizada la primera aplicación del vial o cartucho, estén refrigerados o no, deben ser desechados después de 28 días (4 semanas). Si la refrigeración no es posible, el Vial de 10 ml o cartucho de LANTUS® iniciado, puede mantenerse sin refrigerar hasta por 28 días (4 semanas), lejos del calor y la luz directa, siempre y cuando la temperatura no sea mayor de 30 °C (86 °F).
Los viales de 10 ml y cartuchos de 3 ml sin refrigeración estén en uso o no, deben ser desechados después de un periodo de 28 días (4 semanas).
Si un cartucho se coloca en una pluma/dispositivo, y se realiza la primera aplicación, éste no debe ser colocado nuevamente en el refrigerador.
Inspeccione el vial o cartucho antes de usar. Sólo debe usarse si la solución es transparente, incolora, sin partículas sólidas visibles y si tiene consistencia similar a la del agua. Como LANTUS® es una solución, no requiere resuspensión antes del uso.
Antes del primer uso, el cartucho incorporado al dispositivo SoloStar® (Pluma/dispositivo) debe conservarse a temperatura ambiente durante 1 o 2 horas.
Se recomienda que la fecha del primer uso del vial se anote en la etiqueta.
Las plumas/dispositivos vacíos nunca deben reutilizarse y deben desecharse de forma segura.
Para prevenir la posible transmisión de enfermedades, cada pluma/dispositivo debe ser utilizado exclusivamente por un solo paciente.
Naturaleza y contenido del envase:
LANTUS® 100 U/mL Solución Inyectable en Vial de 10mL. Caja por 1, 2, 5 y/o 10 Viales.
LANTUS® 100 U/mL Solución Inyectable en Cartucho de 3mL incorporado a la pluma/dispositivo SoloStar®.
No todas las presentaciones están disponibles en todos los países.
Precauciones especiales de eliminación y otras manipulaciones:
Hay que inspeccionar LANTUS antes de usarlo. Sólo se debe usar si la solución es transparente, incolora, carece de partículas sólidas visibles, y si presenta una consistencia acuosa. Dado que LANTUS es una solución, no necesita disolución antes de su uso.
LANTUS no debe mezclarse con otra insulina o diluirse. La mezcla o dilución puede cambiar su tiempo/perfil de acción y la mezcla puede formar precipitados.
Se debe comprobar siempre la etiqueta de insulina antes de cada inyección para evitar errores de medicación entre insulina glargina y otras insulinas (ver sección Advertencias y precauciones especiales de empleo).
LANTUS 100 unidades/ml solución inyectable en un cartucho:
Pluma de insulina:
LANTUS 100 unidades/ml en cartuchos sólo está indicado para inyecciones subcutáneas administradas con una pluma reutilizable. Si es necesaria la administración con jeringa, se debe utilizar un vial.
Los cartuchos de LANTUS se deben utilizar únicamente con las plumas: ClikSTAR, Autopen 24, Tactipen, AllStar, AllStar PRO o JuniorSTAR (ver secciones Posología y forma de administración y Advertencias y precauciones especiales de empleo). En su país, puede que solamente estén comercializadas algunas de estas plumas.
La pluma debe utilizarse tal y como se recomienda en la información facilitada por el fabricante del dispositivo.
Las instrucciones del fabricante para el uso de la pluma se deben seguir cuidadosamente al cargar el cartucho, insertar la aguja y administrar la inyección de insulina.
Si la pluma de insulina está dañada, o no funciona correctamente (debido a defectos mecánicos), se debe desechar y utilizar una pluma de insulina nueva.
Cartucho:
Antes de su inserción en la pluma, el cartucho se debe mantener a temperatura ambiente durante 1 o 2 horas.
Antes de la inyección se deben eliminar del cartucho las burbujas de aire que se formen (véanse las instrucciones de uso de la pluma). Los cartuchos vacíos no se deben rellenar.
LANTUS SoloStar 100 unidades/ml solución inyectable en pluma precargada:
LANTUS SoloStar 100 unidades/ml en pluma precargada sólo está indicado para inyecciones subcutáneas. Si es necesaria la administración con jeringa, se debe utilizar un vial (ver secciones Posología y forma de administración y Advertencias y precauciones especiales de empleo). Antes del primer uso, la pluma se debe conservar a temperatura ambiente durante 1 o 2 horas.
Las plumas vacías nunca se deben reutilizar y se deben desechar de forma segura.
Para prevenir la posible transmisión de enfermedades, cada pluma se debe utilizar exclusivamente por un solo paciente.
Antes de utilizar la pluma precargada, se deben leer cuidadosamente las instrucciones de uso incluidas en el prospecto.
Mantener en su envase original, no debe utilizarse despues de la fecha de caducidad indicada en el envase.
Todo medicamento debe conservarse fuera del alcance de los niños.
Fabricado por:
Sanofi-Aventis Deutschland GmbH
Industriepark Höchst, Brüningstraße 50, D-65926 Frankfurt am Main, Alemania.
Imp./Dist.:
Sanofi-aventis de Colombia S.A.
Bogotá. Reg. San.: INVIMA 2016M-0000384-R2 e INVIMA 2016-0000394-R2.
Venta bajo fórmula médica.
Sanofi-aventis del Ecuador S.A.
Quito-Ecuador. Venta con receta médica. Medicamento Innovador. Medicamento Biotecnológico. Código CUM:
A10AE04SLYB5712
TODO MEDICAMENTO DEBE CONSERVARSE FUERA DEL ALCANCE DE LOS NIÑOS
Bolivia: Importado y Distribuido por Quimiza Ltda.
Venta bajo receta médica.
Representante exclusivo en Paraguay:
Sanofi-aventis Paraguay S.A.
Edificio SkyPark, Aviadores del Chaco N° 2581, Torre 2, Piso 13, Asunción – Paraguay Venta autorizada por la Dirección Nacional de Vigilancia Sanitaria.
Reg. MSP y BS N °08092-04-MB
D. Técnica:Q.F. Jefferson L. Garbin - Reg. Prof. N° 4372 Venta bajo receta
En caso de sobredosis, favor concurrir al Centro de Toxicología-Emergencias Médicas Gral. Santos y Teodoro
S. Mongelós. Tel 204 800
En caso de reporte de evento adverso o reclamorelacionado al producto,
comunicarse al (021) 288 1000
Imp./Dist.:
Sanofi-aventis de Colombia S.A.
Bogotá. Reg. San.: INVIMA 2011M-0000384-R1 e INVIMA 2011M-0000394-R1. Venta bajo fórmula médica.
Sanofi-aventis del Ecuador S.A.
Quito-Ecuador. Venta con receta médica. Medicamento Innovador. Medicamento Biotecnológico.
Código CUM: A10AE04SLYB5712
SmPC EMA: 03 de septiembre de 2020
Fecha de revisión local: Diciembre-2020