
JARDIANZ DUO COSTA RICA
CLORHIDRATO DE METFORMINA, EMPAGLIFLOZINA
Tabletas recubiertas
Caja, 7 Tabletas recubiertas,
Caja, 60 Tabletas recubiertas,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA RECUBIERTA contiene:
Empagliflozina 5 mg, 12.5 mg
Clorhidrato de Metformina 850 mg, 1000 mg
Excipiente cbp 1 tableta recubierta
Código ATC: A10BD20
INDICACIONES TERAPÉUTICAS:
Indicaciones y uso:
JARDIANZ® DUO es una combinación de empagliflozina y clorhidrato de metformina (HCl) indicada como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos y pacientes pediátricos de 10 años y mayores con diabetes mellitus tipo 2.
Empagliflozina: La empagliflozina, cuando se usa como un componente de JARDIANZ® DUO, está indicada en adultos con diabetes mellitus tipo 2 para reducir el riesgo de:
• Muerte cardiovascular en adultos con enfermedad cardiovascular establecida.
• Muerte cardiovascular y hospitalización por insuficiencia cardíaca en adultos con insuficiencia cardíaca.
Limitaciones de uso:
• No se recomienda el uso de JARDIANZ® DUO para mejorar el control glucémico en pacientes con diabetes mellitus tipo 1. Puede aumentar el riesgo de cetoacidosis diabética en estos pacientes [consulte Advertencias y precauciones (Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis)].
• Debido al componente de metformina, el uso de JARDIANZ® DUO está limitado a pacientes con diabetes mellitus tipo 2 para todas las indicaciones.
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacología clínica:
Mecanismo de acción:
JARDIANZ® DUO contiene: Empagliflozina, un inhibidor del SGLT2, y metformina, una biguanida.
Empagliflozina: La empagliflozina es un inhibidor del SGLT2, el transportador predominante responsable de la reabsorción de glucosa desde el filtrado glomerular hacia la circulación. Al inhibir el SGLT2, la empagliflozina reduce la reabsorción renal de la glucosa filtrada y reduce el umbral renal para la glucosa y, por lo tanto, aumenta la excreción urinaria de glucosa.
La empagliflozina también reduce la reabsorción de sodio y aumenta el suministro de sodio al túbulo distal. Esto puede influir en varias funciones fisiológicas, como la reducción de la carga previa y posterior del corazón y la regulación negativa de la actividad simpática.
Metformina HCl: La metformina es un agente hipoglucemiante que mejora la tolerancia a la glucosa en pacientes con diabetes mellitus tipo 2, reduciendo la glucosa plasmática tanto basal como posprandial. No está química ni farmacológicamente relacionada con ninguna otra clase de agentes hipoglucemiantes orales. La metformina disminuye la producción de glucosa hepática, disminuye la absorción intestinal de glucosa y mejora la sensibilidad a la insulina al aumentar la captación y utilización de glucosa periférica. A diferencia de las SU, la metformina no produce hipoglucemia ni en pacientes con diabetes mellitus tipo 2 ni en sujetos normales (excepto en circunstancias especiales) [consulte Advertencias y precauciones (Hipoglucemia)] y no provoca hiperinsulinemia. Con la terapia con metformina, la secreción de insulina permanece sin cambio, mientras que los niveles de insulina en ayunas y la respuesta de insulina plasmática durante todo el día pueden disminuir.
Farmacodinámica:
Empagliflozina:
Excreción de glucosa en orina: En pacientes con diabetes mellitus tipo 2, la excreción urinaria de glucosa aumentó inmediatamente después de una dosis de empagliflozina y se mantuvo hasta el final de un período de tratamiento de 4 semanas con un promedio de aproximadamente 64 gramos por día con 10 mg de empagliflozina y 78 gramos por día con 25 mg de empagliflozina una vez al día [consulte Estudios clínicos]. Los datos de dosis orales únicas de empagliflozina en sujetos sanos indican que, en promedio, la elevación de la excreción urinaria de glucosa se aproxima al valor inicial en aproximadamente 3 días para las dosis de 10 mg y 25 mg.
Volumen urinario: En un estudio de 5 días, el aumento promedio del volumen de orina en 24 horas desde el inicio fue de 341 ml el día 1 y de 135 ml el día 5 del tratamiento con 25 mg de empagliflozina una vez al día.
Electrofisiología cardíaca: En un estudio cruzado aleatorizado, controlado con placebo, con comparador activo, a 30 sujetos sanos se les administró una dosis oral única de 25 mg de empagliflozina, 200 mg de empagliflozina (8 veces la dosis máxima), moxifloxacino y placebo. No se observó ningún aumento en el intervalo QTc con 25 mg o 200 mg de empagliflozina.
Farmacocinética:
JARDIANZ® DUO:
La administración de 12.5 mg de empagliflozina/1,000 mg de metformina HCI en condiciones de alimentación resultó en una disminución del 9 % en el ABC y una disminución del 28 % en la Cmáx para la empagliflozina, en comparación con las condiciones en ayunas. Para la metformina, el ABC disminuyó un 12 % y la Cmáx disminuyó un 26 % en comparación con las condiciones de ayuno. El efecto observado de los alimentos sobre la empagliflozina y la metformina no se considera clínicamente relevante.
Empagliflozina: La farmacocinética de la empagliflozina se ha caracterizado en voluntarios sanos y en pacientes con diabetes mellitus tipo 2, y no se observaron diferencias clínicamente relevantes entre las dos poblaciones. Los valores promedio del ABC y de la Cmáx plasmática en el estado estacionario fueron 1,870 nmol• h/L y 259 nmol/L, respectivamente, con 10 mg de empagliflozina una vez al día, y 4,740 nmol• h/L y 687 nmol/L, respectivamente, con 25 mg de empagliflozina una vez al día. La exposición sistémica a la empagliflozina aumentó de manera proporcional a la dosis en el intervalo de dosis terapéuticas. No parece que la empagliflozina tenga características farmacocinéticas dependientes del tiempo. Después de la administración una vez al día, se observó una acumulación de hasta el 22 %, con respecto al ABC plasmático en el estado estacionario.
Absorción: Después de la administración oral, las concentraciones plasmáticas máximas de empagliflozina se alcanzaron 1,5 horas después de la dosis. La administración de 25 mg de empagliflozina después de la ingesta de una comida rica en grasas y calorías resultó en una exposición ligeramente menor; el ABC disminuyó aproximadamente un 16 % y la Cmáx disminuyó aproximadamente un 37 %, en comparación con la condición en ayunas. El efecto observado de los alimentos sobre la farmacocinética de la empagliflozina no se consideró clínicamente relevante y la empagliflozina se puede administrar con o sin alimentos.
Distribución: El volumen de distribución aparente en el estado estacionario se estimó en 73.8 L, con base en un análisis farmacocinético poblacional. Después de la administración de una solución oral de [14C]-empagliflozina a sujetos sanos, la distribución en los eritrocitos fue de aproximadamente 36.8 % y la unión a las proteínas plasmáticas fue de 86.2 %.
Eliminación: La vida media de eliminación terminal aparente de la empagliflozina se estimó en 12.4 h y la depuración oral aparente fue de 10.6 L/h, con base en el análisis farmacocinético poblacional.
Metabolismo: No se detectaron metabolitos principales de la empagliflozina en plasma humano y los metabolitos más abundantes fueron tres conjugados con glucurónidos(2-O-, 3-O- y 6-O-glucurónido). La exposición sistémica de cada metabolito fue inferior al 10 % del material total relacionado con el fármaco.
Los estudios in vitro sugirieron que la principal ruta de metabolismo de la empagliflozina en humanos es la glucuronidación por las uridina 5’-difosfo-glucuronosiltransferasas UGT2B7, UGT1A3, UGT1A8 y UGT1A9.
Excreción: Tras la administración de una solución oral de [14C]-empagliflozina a sujetos sanos, aproximadamente el 95.6 % de la radiactividad relacionada con el fármaco se eliminó en heces (41.2 %) u orina (54.4 %). La mayor parte de la radiactividad relacionada con el fármaco recuperada en las heces era el fármaco original inalterado y aproximadamente la mitad de la radiactividad relacionada con el fármaco excretada en la orina era el fármaco original inalterado.
Metformina:
Absorción: La biodisponibilidad absoluta de una tableta de 500 mg de metformina HC1 administrada en ayunas es de aproximadamente 50 % a 60 %. Estudios que utilizaron dosis orales únicas de tabletas de 500 mg a 1,500 mg y de 850 mg a 2,550 mg de metformina HC1, indican que existe una falta de proporcionalidad de la dosis con dosis crecientes, lo que se debe a una absorción disminuida más que a una alteración en la eliminación.
Los alimentos disminuyen la extensión y retrasan ligeramente la absorción de la metformina, como lo demuestra una Cmáx aproximadamente un 40 % más baja, un ABC 25 % más baja y una prolongación de 35 minutos del tiempo hasta la concentración plasmática máxima (Tmax) después de la administración de una sola tableta de 850 mg de metformina con los alimentos, en comparación con la misma tableta de 850 mg administrada en ayunas. Se desconoce la relevancia clínica de estas disminuciones.
Distribución: El volumen aparente de distribución (V/F) de la metformina luego de dosis orales únicas de tabletas de liberación inmediata de 850 mg de metformina HCI1 promedió 654 ± 358 L. La metformina se une insignificantemente a las proteínas plasmáticas. La metformina entra en los eritrocitos, probablemente en función del tiempo.
Eliminación: La metformina tiene una vida media de eliminación plasmática de aproximadamente 6.2 horas. En sangre, la vida media de eliminación es de aproximadamente 17.6 horas, lo que sugiere que la masa de eritrocitos puede ser un compartimento de distribución.
Metabolismo: Los estudios de dosis únicas intravenosas en sujetos normales demuestran que la metformina no experimenta metabolismo hepático (no se han identificado metabolitos en humanos) ni excreción biliar.
Excreción: Tras la administración oral, aproximadamente el 90 % del fármaco absorbido se excreta por vía renal en las primeras 24 horas.
La depuración renal es aproximadamente 3.5 veces mayor que la depuración de creatinina, lo que indica que la secreción tubular es la principal vía de eliminación de la metformina.
Poblaciones específicas:
Pacientes geriátricos:
JARDIANZ® DUO: No se han realizado estudios que caractericen la farmacocinético de la empagliflozina y la metformina después de la administración de JARDIANZ® DUO en pacientes geriátricos [consulte Advertencias y precauciones (Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis) y Uso en poblaciones específicas (Uso geriátrico)].
Empagliflozina: La edad no tuvo ningún efecto clínicamente significativo en la farmacocinética de la empagliflozina con base en un análisis farmacocinético poblacional [consulte Uso en poblaciones específicas (Uso geriátrico)].
Metformina HCl: Los datos limitados de los estudios farmacocinéticos controlados de metformina HCl en sujetos sanos de edad avanzada sugieren que la depuración plasmática total de metformina disminuye, la vida media aumenta y la Cmáx aumenta en comparación con los sujetos sanos jóvenes. A partir de estos datos parece que el cambio en la farmacocinética de la metformina con el envejecimiento se debe principalmente al cambio en la función renal.
Pacientes pediátricos:
Empagliflozina: La farmacocinética y la farmacodinamia de la empagliflozina se investigaron en pacientes pediátricos con edad de 10 a 17 años con diabetes mellitus tipo 2. La administración oral de 10 mg y 25 mg resultó en una exposición dentro del intervalo observado en pacientes adultos.
Metformina: Tras la administración de una sola tableta oral de liberación inmediata de 500 mg de metformina HCl con alimentos, la media geométrica de la Cmáx y del ABC difirieron en menos del 5 % entre los pacientes pediátricos con diabetes tipo 2 (12 a 16 años de edad) y los pacientes adultos sanos emparejados por sexo y peso (20 a 45 años de edad), todos ellos con función renal normal.
Efectos de la edad, el índice de masa corporal, el género y la raza:
Empagliflozina: La edad, el índice de masa corporal (IMC), el género y la raza (asiáticos frente a blancos principalmente) no tienen ningún efecto clínicamente significativo sobre la farmacocinética de la empagliflozina.
Metformina HCl: No se han realizado estudios de los parámetros farmacocinéticos de la metformina en función de la raza. En estudios clínicos controlados de metformina HCl en pacientes con diabetes mellitus tipo 2, el efecto antihiperglucémico fue similar en los pacientes blancos (n=249), negros o afroamericanos (n=51) e hispanos o latinos (n=24).
Pacientes con insuficiencia renal:
JARDIANZ® DUO: No se han realizado estudios que caractericen la farmacocinética de la empagliflozina y la metformina después de la administración de JARDIANZ® DUO en pacientes con insuficiencia renal.
Empagliflozina: En pacientes adultos con diabetes mellitus tipo 2 con insuficiencia renal leve (TFGe: de 60 a menos de 90 mL/min/1.73 m2), moderada (TFGe: de 30 a menos de 60 mL/min/1.73 m2) y grave (TFGe: menos de 30 mL/min/1.73 m2) y en pacientes en diálisis por falla renal, el ABC de la empagliflozina aumentó aproximadamente 18 %, 20 %, 66 % y 48 %, respectivamente, en comparación con los sujetos con función renal normal. Los niveles plasmáticos máximos de empagliflozina fueron similares en los pacientes con insuficiencia renal moderada y en los pacientes en diálisis por falla renal, en comparación con los sujetos con función renal normal. Los niveles plasmáticos máximos de empagliflozina fueron aproximadamente 20 % más altos en los pacientes con insuficiencia renal leve y grave, en comparación con los sujetos con función renal normal. El análisis farmacocinético poblacional mostró que la depuración oral aparente de empagliflozina disminuyó con una disminución de la TFGe, lo que provocó un aumento en la exposición al fármaco. Sin embargo, la fracción de empagliflozina que se excretó sin cambio en la orina y la excreción urinaria de glucosa, disminuyeron con la disminución de la TFGe.
Metformina: En pacientes con función renal disminuida, la vida media plasmática y sanguínea de la metformina se prolonga y la depuración renal se reduce [consulte Contraindicaciones y Advertencias y precauciones (Acidosis láctica)].
Pacientes con deterioro hepático:
JARDIANZ® DUO: No se han realizado estudios que caractericen la farmacocinética de la empagliflozina y la metformina después de la administración de JARDIANZ® DUO en pacientes con insuficiencia hepática [consulte Advertencias y precauciones (Acidosis láctica)].
Empagliflozina: En pacientes adultos con insuficiencia hepática leve, moderada y grave según la clasificación de Child-Pugh, el ABC de la empagliflozina aumentó aproximadamente 23 %, 47 % y 75 %, y la Cmáx aumentó aproximadamente 4 %, 23 % y 48 %, respectivamente, en comparación con los sujetos con función hepática normal.
Metformina HCl: No se han realizado estudios farmacocinéticos de metformina en pacientes con insuficiencia hepática.
Estudios de interacciones medicamentosas: No se han realizado estudios de interacción farmacocinética de medicamentos con JARDIANZ® DUO; sin embargo, tales estudios se han realizado con los componentes individuales empagliflozina y metformina HC1.
Empagliflozina:
Evaluación in vitro de interacciones con otros fármacos: La empagliflozina no inhibe, inactiva ni induce las isoformas CYP450. Los datos in vitro sugieren que la principal ruta de metabolismo de la empagliflozina en humanos es la glucuronidación por las uridina 5’-difosfo-glucuronosiltransferasas UGT1A3, UGT1A8, UGT1A9 y UGT2B7. La empagliflozina no inhibe UGT1A1, UGT1A3, UGT1A8, UGT1A9 o UGT2B7. Por lo tanto, no se anticipa ningún efecto de la empagliflozina con medicamentos administrados de manera concomitante que son sustratos de las principales isoformas de CYP450 o UGT1A1, UGT1A3, UGT1A8, UGT1A9 o UGT2B7. No se ha evaluado el efecto de la inducción de UGT (p. ej., inducción por rifampicina o cualquier otro inductor de la enzima UGT) sobre la exposición a la empagliflozina.
La empagliflozina es un sustrato para la glicoproteína P (P-gp) y para la proteína de resistencia del cáncer de mama (BCRP), pero no inhibe estos transportadores de salida a dosis terapéuticas. Con base en estudios in vitro, se considera poco probable que la empagliflozina cause interacciones con fármacos que son sustratos de la P-gp. La empagliflozina es un sustrato de los transportadores de captación humanos OAT3, OATP1B1 y OATP1B3, pero no de OAT1 y OCT2. La empagliflozina no inhibe ninguno de estos transportadores de captación humanos a concentraciones plasmáticas clínicamente relevantes y, por lo tanto, no se prevé ningún efecto de la empagliflozina con los fármacos administrados de forma concomitante que son sustratos de estos transportadores de captación.
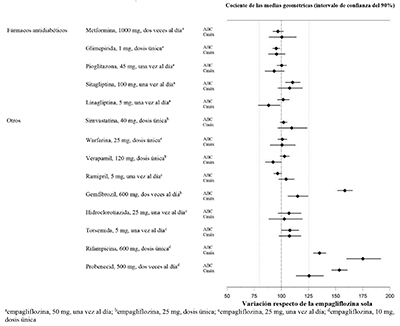
Evaluación in vivo de las interacciones medicamentosas: La farmacocinética de empagliflozina fue similar con y sin la coadministración de metformina HC1, glimepirida, pioglitazona, sitagliptina, linagliptina, warfarina, verapamilo, ramipril y simvastatina en voluntarios sanos y con o sin la coadministración de hidroclorotiazida y torsemida en pacientes con diabetes mellitus tipo 2 (consulte la Figura 1). En sujetos con función renal normal, la coadministración de empagliflozina con probenecid resultó en una disminución del 30 % en la fracción de empagliflozina excretada en la orina sin ningún efecto sobre la excreción de glucosa en orina de 24 horas. Se desconoce la relevancia de esta observación para los pacientes con insuficiencia renal.
Figura 1. Efecto de diversos medicamentos sobre la farmacocinética de la empagliflozina según se muestra como un intervalo de confianza del 90 % de la media geométrica del AUC y relaciones Cmax [las líneas de referencia indican 100 % (80 %-125 %)]
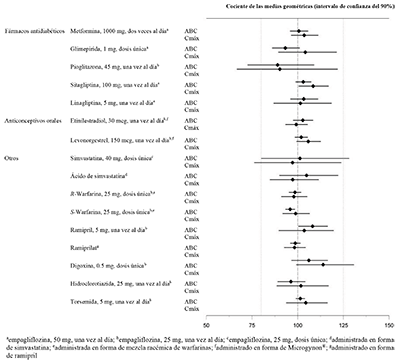
La empagliflozina no tuvo un efecto clínicamente relevante sobre la farmacocinética de la metformina, la glimepirida, la pioglitazona, la sitagliptina, la linagliptina, la warfarina, la digoxina, el ramipril, la simvastatina, la hidroclorotiazida, la torsemida y los anticonceptivos orales cuando se administraron junto con la empagliflozina en voluntarios sanos (consulte la Figura 2).
Figura 2. Efecto de la empagliflozina sobre la farmacocinética de varios medicamentos, como se muestra como un intervalo de confianza del 90 % de la media geométrica del AUC y relaciones Cmax [las líneas de referencia indican 100 % (80 %-125 %)]
Metformina HCl:
Tabla 5. Efecto del fármaco coadministrado sobre la exposición sistémica a la metformina plasmática
|
Fármaco coadministrado |
Dosis del fármaco coadministrado* |
Dosis de metformina HC1* |
Cociente de las medias geométricas (cociente con/sin fármaco coadministrado) Sin efecto = 1.0 |
||
|
ABC† |
Cmáx |
||||
|
Gliburida |
5 mg |
500 mg≠ |
metformina |
0.98‡ |
0.99‡ |
|
Furosemida |
40 mg |
850 mg |
metformina |
1.09‡ |
1.22‡ |
|
Nifedipino |
10 mg |
850 mg |
metformina |
1.16 |
1.21 |
|
Propranolol |
40 mg |
850 mg |
metformina |
0.90 |
0.94 |
|
Ibuprofeno |
400 mg |
850 mg |
metformina |
1.05‡ |
1.07‡ |
|
Los fármacos catiónicos eliminados por secreción tubular renal pueden reducir la eliminación de la metformina [consulte Interacciones farmacológicas]. |
|||||
|
Cimetidina |
400 mg |
850 mg |
metformina |
1.40 |
1.61 |
|
Los inhibidores de la anhidrasa carbónica pueden causar acidosis metabólica [consulte Interacciones farmacológicas]. |
|||||
|
Topiramato** |
100 mg |
500 mg |
metformina |
1.25 |
1.17 |
* Toda la metformina y los fármacos coadministrados se administraron en dosis únicas
† ABC = ABC(INF)
≠ Tabletas de metformina HCl de liberación prolongada de 500 mg
‡ Cociente de las medias aritméticas
** En el estado estacionario con topiramato 100 mg cada 12 horas y metformina 500 mg cada 12 horas; ABC = ABC (0-12 horas)
Tabla 6. Efecto de la metformina sobre la exposición sistémica al fármaco coadministrado
|
Fármaco coadministrado |
Dosis del fármaco coadministrado* |
Dosis de metformina HCl* |
Conciente de las medias geométricas (conciente con/sin metformina) Sin efecto = 1.0 |
||
|
ABC† |
Cmáx |
||||
|
Gliburida |
5 mg |
500 mg§ |
gliburida |
0.78‡ |
0.63‡ |
|
Furosemida |
40 mg |
850 mg |
furosemida |
0.87‡ |
0.69‡ |
|
Nifedipino |
10 mg |
850 mg |
nifedipino |
1.10§ |
1.08 |
|
Propranolol |
40 mg |
850 mg |
propranolol |
1.01§ |
0.94 |
|
Ibuprofeno |
400 mg |
850 mg |
ibuprofeno |
0.97¶ |
1.01¶ |
|
Cimetidina |
400 mg |
850 mg |
cimetidina |
0.95§ |
1.01 |
* Toda la metformina y los fármacos se coadministrados se administran en dosis únicas.
† ABC = ABC(INF) a menos que se indique lo contrario.
‡ Conciente de medias aritméticas, valor p de diferencia < 0.05
§ ABC (0-24 horas) informado.
¶ Cociente de medias aritméticas.
CONTRAINDICACIONES:
JARDIANZ® DUO está contraindicado en pacientes con:
• Insuficiencia renal grave (TFGe inferior a 30 mL/min/1.73 m2), enfermedad renal en etapa terminal o diálisis [consulte Advertencias y precauciones (Acidosis láctica) y Uso en poblaciones específicas (Insuficiencia renal)].
• Acidosis metabólica aguda o crónica, incluida la cetoacidosis diabética [consulte Advertencias y precauciones (Acidosis láctica)].
• Hipersensibilidad a la empagliflozina, metformina o cualquiera de los excipientes de JARDIANZ® DUO, se han producido reacciones como angioedema [consulte Advertencias y precauciones (Reacciones de hipersensibilidad)].
PRECAUCIONES Y ADVERTENCIAS:
Advertencias y precauciones:
Acidosis láctica:
Ha habido casos, posteriores a la comercialización, de acidosis láctica asociada a metformina, incluidos casos mortales. Estos casos tuvieron un inicio sutil y se acompañaron de síntomas inespecíficos como malestar general, mialgias, dolor abdominal, dificultad respiratoria o aumento de la somnolencia; sin embargo, se ha presentado hipotermia, hipotensión y bradiarritmias resistentes con acidosis grave. La acidosis láctica asociada a la metformina se caracterizó por concentraciones elevadas de lactato en sangre (> 5 mmol/litro), acidosis con brecha aniónica (sin evidencia de cetonuria o cetonemia) y una relación lactato: piruvato aumentada; niveles plasmáticos de metformina generalmente > 5 mcg/mL. La metformina disminuye la captación hepática de lactato aumentando los niveles de lactato en sangre, lo que puede aumentar el riesgo de acidosis láctica, especialmente en los pacientes en riesgo.
Si se sospecha acidosis láctica asociada a metformina, se deben instituir medidas de apoyo generales de inmediato en un entorno hospitalario, junto con la suspensión inmediata de JARDIANZ® DUO. En pacientes tratados con JARDIANZ® DUO con diagnóstico o fuerte sospecha de acidosis láctica, se recomienda hemodiálisis inmediata para corregir la acidosis y eliminar la metformina acumulada (la metformina es dializable, con una depuración de hasta 170 mL/minuto en buenas condiciones hemodinámicas). La hemodiálisis a menudo ha resultado en la reversión de los síntomas y la recuperación.
Instruya a los pacientes y sus familias sobre los síntomas de la acidosis láctica y, si estos síntomas ocurren indíqueles que descontinúen JARDIANZ® DUO e informen estos síntomas a su proveedor de atención médica.
Para cada uno de los factores de riesgo conocidos y posibles de acidosis láctica asociada a metformina, a continuación, se proporcionan recomendaciones para reducir el riesgo y controlar la acidosis láctica asociada a metformina:
Insuficiencia renal: Los casos de acidosis láctica asociada a metformina posteriores a la comercialización ocurrieron principalmente en pacientes con insuficiencia renal significativa. El riesgo de acumulación de metformina y acidosis láctica asociada a metformina aumenta con la gravedad de la insuficiencia renal porque la metformina se excreta sustancialmente por vía renal. Las recomendaciones clínicas basadas en la función renal del paciente incluyen [consulte Dosificación y administración (Recomendaciones de dosificación en pacientes con insuficiencia renal) y Farmacología clínica (Farmacocinética)].
• Antes de iniciar el tratamiento con JARDIANZ® DUO, obtenga una tasa de filtración glomerular estimada (TFGe).
• JARDIANZ® DUO está contraindicado en pacientes con una TFGe inferior a 30 mL/min/1.73 m2 [consulte Contraindicaciones].
• Obtenga una TFGe al menos una vez al año en todos los pacientes que toman JARDIANZ® DUO. En pacientes con mayor riesgo de desarrollar insuficiencia renal (p. ej., adultos mayores), se debe evaluar la función renal con mayor frecuencia.
Interacciones medicamentosas: El uso concomitante de JARDIANZ® DUO con medicamentos específicos puede aumentar el riesgo de acidosis láctica asociada con metformina: los medicamentos que alteran la función renal provocan cambios hemodinámicos significativos, interfieren con el equilibrio ácido-base o aumentan la acumulación de metformina [consulte Interacciones medicamentosas]. Por lo tanto, considere un monitoreo más frecuente de los pacientes.
65 años o más: El riesgo de acidosis láctica asociada a metformina aumenta con la edad del paciente porque los pacientes de edad avanzada tienen una mayor probabilidad de tener insuficiencia hepática, renal o cardíaca que los pacientes más jóvenes. Evalúe la función renal con mayor frecuencia en pacientes de edad avanzada [consulte Uso en poblaciones específicas (Uso geriátrico)].
Estudios radiológicos con contraste: La administración de agentes de contraste yodados intravasculares en pacientes tratados con metformina ha provocado una disminución aguda de la función renal y la aparición de acidosis láctica. Suspenda JARDIANZ® DUO en el momento o antes de un procedimiento de obtención de imágenes con contraste yodado en pacientes con una TFGe inferior a 60 mL/min/1.73 m2; en pacientes con antecedentes de insuficiencia hepática, alcoholismo o insuficiencia cardíaca; o en pacientes a los que se les administrará contraste yodado intraarterial. Vuelva a evaluar la TFGe 48 horas después del procedimiento de imagen y reinicie JARDIANZ® DUO si la función renal es estable.
Cirugía y otros procedimientos: La privación de alimentos y líquidos durante procedimientos quirúrgicos u otros puede aumentar el riesgo de hipovolemia, hipotensión e insuficiencia renal. JARDIANZ® DUO debe suspenderse temporalmente mientras los pacientes tengan una ingesta restringida de alimentos y líquidos.
Estados hipóxicos: Varios de los casos posteriores a la comercialización de acidosis láctica asociada con metformina ocurrieron en el contexto de insuficiencia cardíaca congestiva aguda (particularmente cuando se acompaña de hipoperfusión e hipoxemia). El colapso cardiovascular (choque), el infarto agudo de miocardio, la sepsis y otras condiciones asociadas con la hipoxemia se han asociado con acidosis láctica y también pueden causar azotemia prerrenal. Cuando ocurran tales eventos, suspenda JARDIANZ® DUO.
Consumo excesivo de alcohol: El alcohol potencia el efecto de la metformina sobre el metabolismo del lactato y esto puede aumentar el riesgo de acidosis láctica asociada a la metformina. Advierta a los pacientes sobre el consumo excesivo de alcohol mientras reciben JARDIANZ® DUO.
Insuficiencia hepática: Los pacientes con insuficiencia hepática han desarrollado casos de acidosis láctica asociada a metformina. Esto puede deberse a una depuración de lactato alterado que da como resultado niveles sanguíneos de lactato más altos. Por lo tanto, evite el uso de JARDIANZ® DUO en pacientes con evidencia clínica o de laboratorio de enfermedad hepática.
Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis:
En pacientes con diabetes mellitus tipo 1, la empagliflozina, un componente de JARDIANZ® DUO, aumenta significativamente el riesgo de cetoacidosis diabética, un evento que pone en peligro la vida, por arriba de la tasa base. En ensayos clínicos controlados con placebo en pacientes con diabetes mellitus de tipo 1, el riesgo de cetoacidosis aumentó notablemente en los pacientes que recibían inhibidores del cotransportador de sodio y glucosa 2 (SGLT2) en comparación con los pacientes que recibían placebo, y la cetoacidosis mortal se ha producido con la empagliflozina. JARDIANZ® DUO no está indicado para el control glucémico en pacientes con diabetes mellitus tipo 1.
La diabetes mellitus de tipo 2 y los trastornos pancreáticos (por ejemplo, antecedentes de pancreatitis o cirugía pancreática) también son factores de riesgo de cetoacidosis. Después de la comercialización se han reportado casos mortales de cetoacidosis en pacientes con diabetes mellitus tipo 2 que utilizaban inhibidores del SGLT2, incluido JARDIANZ® DUO.
Las condiciones precipitantes de la cetoacidosis diabética u otras cetoacidosis incluyen infrainsulinización debida a reducción de la dosis de insulina u omisión de dosis de insulina, enfermedad febril aguda, ingesta calórica reducida, dieta cetogénica, cirugía, hipovolemia y abuso de alcohol.
Los signos y síntomas son congruentes con la deshidratación y acidosis metabólica grave e incluyen náuseas, vómitos, dolor abdominal, malestar generalizado y dificultad para respirar. Los niveles de glucosa en sangre en el cuadro clínico inicial pueden estar por debajo de los típicamente esperados para la cetoacidosis diabética (p. ej., menos de 250 mg/dL). La cetoacidosis y la glucosuria pueden persistir más tiempo de lo esperado. La excreción de la glucosa en orina persiste durante 3 días después de suspender JARDIANZ® DUO [consulte Farmacología clínica (Farmacodinámica)]; sin embargo, ha habido reportes posteriores a la comercialización de cetoacidosis y/o glucosuria que han durado más de 6 días y algunos hasta 2 semanas después de suspender los inhibidores del SGLT2.
Considere el monitoreo de las cetonas en pacientes con riesgo de cetoacidosis si lo indica la situación clínica. Evalúe si existe una cetoacidosis independientemente de los niveles de glucosa que presenten los pacientes que acudan con signos y síntomas congruentes con acidosis metabólica grave. Si se sospecha la acidosis, suspenda la administración de JARDIANZ® DUO, evalúe rápidamente y en caso de confirmarse, trate la cetoacidosis. Monitoree a los pacientes en cuanto a la resolución de la cetoacidosis antes de reiniciar el tratamiento con JARDIANZ® DUO.
Si es posible, suspenda el uso de JARDIANZ® DUO en situaciones clínicas temporales que puedan predisponer a los pacientes a la cetoacidosis. Reanude el tratamiento con JARDIANZ® DUO cuando el paciente esté clínicamente estable y haya reanudado la ingesta oral [consulte Dosis y administración (Interrupción temporal para una cirugía)].
Instruya a todos los pacientes sobre los signos y síntomas de la cetoacidosis e indíqueles que suspendan JARDIANZ® DUO y busquen atención médica de inmediato si se presentan signos y síntomas.
Hipovolemia: La empagliflozina puede causar hipovolemia intravascular que a veces puede manifestarse como hipotensión sintomática o cambios transitorios agudos en la creatinina [consulte Reacciones adversas (Experiencia en ensayos clínicos)]. Ha habido informes posteriores a la comercialización de insuficiencia renal aguda, algunos que requirieron hospitalización y diálisis, en pacientes con diabetes mellitus tipo 2 que recibieron inhibidores de SGLT2, incluida la empagliflozina. Los pacientes con función renal alterada (TFGe inferior a 60 mL/min/1.73 m2), los pacientes de edad avanzada o los pacientes que toman diuréticos del asa pueden tener un mayor riesgo de hipovolemia o hipotensión. Antes de iniciar JARDIANZ® DUO en pacientes con una o más de estas características, evalúe el estado del volumen y la función renal. En pacientes con hipovolemia, corrija esta condición antes de iniciar JARDIANZ® DUO. Monitoree los signos y síntomas de hipovolemia y la función renal después de iniciar el tratamiento.
Urosepsis y pielonefritis:
Ha habido reportes de infecciones graves del tracto urinario, incluidas urosepsis y pielonefritis, que requirieron hospitalización en pacientes que recibieron empagliflozina. El tratamiento con inhibidores de SGLT2 aumenta el riesgo de infecciones del tracto urinario. Evalúe a los pacientes en busca de signos y síntomas de infecciones del tracto urinario y trátelos de inmediato, si está indicado [consulte Reacciones adversas].
Hipoglucemia:
Se sabe que la insulina y los secretagogos de insulina causan hipoglucemia. En pacientes adultos, el riesgo de hipoglucemia puede aumentar cuando JARDIANZ® DUO se usa en combinación con secretagogos de insulina (p. ej., sulfonilurea) o insulina. En pacientes pediátricos de 10 años y mayores, el riesgo de hipoglucemia fue mayor con la empagliflozina independientemente del uso de insulina [consulte Reacciones adversas (Experiencia en ensayos clínicos)].
El riesgo de hipoglucemia se puede disminuir con una reducción en la dosis de sulfonilurea (u otro secretagogo de insulina administrado concomitantemente) o de insulina. Informe a los pacientes que utilizan estos medicamentos concomitantes y a los pacientes pediátricos sobre el riesgo de hipoglucemia e instrúyales sobre los signos y síntomas de la hipoglucemia.
Fascitis necrotizante perineal (gangrena de Fournier):
Se han identificado informes de fascitis necrosante perineal (gangrena de Fournier), una infección necrotizante poco frecuente pero grave y potencialmente mortal que requiere intervención quirúrgica urgente, en pacientes con diabetes mellitus que reciben inhibidores de SGLT2, incluida empagliflozina. Se han notificado casos tanto en mujeres como en hombres. Los resultados graves han incluido hospitalización, múltiples cirugías y muerte.
Los pacientes tratados con JARDIANZ® DUO que presenten dolor o sensibilidad, eritema o hinchazón en el área genital o perineal, junto con fiebre o malestar general, deben ser evaluados para detectar fascitis necrotizante. Ante la sospecha, iniciar tratamiento inmediatamente con antibióticos de amplio espectro y, si es necesario, desbridamiento quirúrgico. Suspenda JARDIANZ® DUO, monitoree cuidadosamente los niveles de glucosa en sangre y proporcione una terapia alternativa adecuada para el control de la glucemia.
Infecciones micóticas genitales:
La empagliflozina aumenta el riesgo de infecciones micóticas genitales [consulte Reacciones adversas (Experiencia en ensayos clínicos)]. Los pacientes con antecedentes de infecciones micóticas genitales crónicas o recurrentes tenían más probabilidades de desarrollar infecciones micóticas genitales. Monitorear y tratar según corresponda.
Amputación de extremidades inferiores:
En algunos estudios clínicos con inhibidores del SGLT2 se ha observado un desequilibrio en la incidencia de amputación de extremidades inferiores. En cuatro ensayos clínicos con empagliflozina, las tasas de amputaciones de extremidades inferiores fueron de 4.3 y 5.0 eventos por 1,000 años-paciente en el grupo con placebo y en el grupo de dosis de 10 mg o 25 mg de empagliflozina, respectivamente, con un CRI del 1.05 (I95 % CI) (0.81, 1.36).
En un ensayo de resultados cardiorrenales a largo plazo, en pacientes con enfermedad renal crónica, se reportó la ocurrencia de amputaciones de extremidades inferiores con tasas de 2.9 y 4.3 eventos por 1,000 años-paciente en el grupo con placebo, y con los grupos de tratamiento con 10 mg de empagliflozina, respectivamente. La amputación del dedo del pie y de la parte media del pie fueron las más frecuentes (21 de 28 pacientes tratados con 10 mg de empagliflozina con amputación de extremidades inferiores), y algunos casos en los que se afectó por arriba y por debajo de la rodilla. Algunos pacientes presentaron múltiples amputaciones. JARDIANZ® DUO no está indicado para el tratamiento de la enfermedad renal crónica.
La arteriopatía periférica y la infección del pie diabético (incluida la osteomielitis) fueron los eventos médicos precipitantes más frecuentes que condujeron a la necesidad de una amputación. El riesgo de amputación fue mayor en los pacientes con antecedentes de pie diabético, arteriopatía periférica (incluida una amputación previa) o la diabetes.
Aconseje a los pacientes acerca de la importancia del cuidado preventivo rutinario de los pies. Monitoree a los pacientes que reciben JARDIANZ® DUO para detectar signos y síntomas de la infección del pie diabético (incluida la osteomielitis), dolor o sensibilidad nuevos, llagas o úlceras que afecten a las extremidades inferiores, e inicie el tratamiento apropiado.
Reacciones de hipersensibilidad:
Ha habido informes posteriores a la comercialización de reacciones de hipersensibilidad graves (p. ej., angioedema) en pacientes tratados con empagliflozina. Si ocurre una reacción de hipersensibilidad, suspenda JARDIANZ® DUO; trate de inmediato según el estándar de atención y monitoree hasta que desaparezcan los signos y síntomas. JARDIANZ® DUO está contraindicado en pacientes con hipersensibilidad a la empagliflozina o a cualquiera de los excipientes de JARDIANZ® DUO [consulte Contraindicaciones].
Deficiencia de vitamina B12:
En ensayos clínicos de metformina de 29 semanas de duración, se observó una disminución a niveles inferiores a los normales de los niveles séricos de vitamina B12 previamente normales en aproximadamente el 7 % de los pacientes tratados con metformina. Tal disminución, posiblemente debida a la interferencia del complejo B12-factor intrínseco en la absorción de B12, puede estar asociada con anemia, pero parece ser rápidamente reversible con la interrupción de la metformina o la suplementación con vitamina B12. Ciertas personas (aquellas con una ingesta o absorción inadecuada de vitamina B12 o calcio) parecen estar predispuestas a desarrollar niveles de vitamina B12 por debajo de lo normal. Mida los parámetros hematológicos anualmente y la vitamina B12 a intervalos de 2 a 3 años en pacientes tratados con JARDIANZ® DUO y trate cualquier anomalía [consulte Reacciones adversas (Experiencia en ensayos clínicos)]
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Toxicología preclínica:
Carcinogénesis, mutagénesis, alteración de la fertilidad:
JARDIANZ® DUO:
No se han realizado estudios de carcinogenicidad, mutagenicidad o deterioro de la fertilidad con la combinación de empagliflozina y clorhidrato de metformina.
Se realizaron estudios generales de toxicidad en ratas de hasta 13 semanas con los componentes combinados. Estos estudios indicaron que la combinación de empagliflozina y metformina no causa toxicidad aditiva.
Empagliflozina: La carcinogénesis se evaluó en estudios de 2 años realizados en ratones CD-1 y ratas Wistar. La empagliflozina no aumentó la incidencia de tumores en ratas hembra que recibieron dosis de 100, 300 o 700 mg/kg/día (hasta 72 veces la exposición con la dosis clínica máxima de 25 mg). En ratas macho, los hemangiomas de ganglios linfáticos mesentéricos aumentaron significativamente con 700 mg/kg/día o aproximadamente 42 veces la exposición de una dosis clínica de 25 mg. La empagliflozina no aumentó la incidencia de tumores en ratones hembra que recibieron dosis de 100, 300 o 1,000 mg/kg/día (hasta 62 veces la exposición de una dosis clínica de 25 mg). Se observaron adenomas y carcinomas en los túbulos renales en ratones macho tratados con a 1,000 mg/kg/día, que es aproximadamente 45 veces la exposición con la dosis clínica máxima de 25 mg. Estos tumores pueden estar asociados a una vía metabólica presente predominante en el riñón de ratones macho.
La empagliflozina no fue mutagénica ni clastogénica con o sin activación metabólica en el ensayo in vitro de mutagenicidad bacteriana Ames, en el ensayo in vitro de células de linfoma de ratón L5178Y tk ± y en un ensayo in vivo de micronúcleos en ratas.
La empagliflozina no tuvo efectos sobre el apareamiento, la fertilidad o el desarrollo embrionario temprano en ratas macho o hembra tratadas hasta con la dosis alta de 700 mg/kg/día (aproximadamente 155 veces la dosis clínica de 25 mg en machos y hembras, respectivamente).
Metformina HC1: Se han realizado estudios de carcinogenicidad a largo plazo en ratas (duración de la dosificación de 104 semanas) y ratones (duración de la dosificación de 91 semanas) a dosis de hasta 900 mg/kg/día y 1,500 mg/kg/día, respectivamente. Ambas dosis son aproximadamente 4 veces la dosis diaria máxima recomendada en humanos de 2,000 mg/kg/día con base en las comparaciones del área de superficie corporal. No se encontró evidencia de carcinogenicidad con metformina en ratones macho o hembra. De manera similar, no se observó potencial tumorigénico con metformina en ratas macho. Sin embargo, hubo una mayor incidencia de pólipos uterinos estromales benignos en ratas hembra tratadas con 900 mg/kg/día.
No hubo evidencia de un potencial mutagénico de la metformina en las siguientes pruebas in vitro: Prueba de Ames (Salmonella typhimurium), prueba de mutación genética (células de linfoma de ratón) o prueba de aberraciones cromosómicas (linfocitos humanos). Los resultados de la prueba de micronúcleos de ratón in vivo también fueron negativos.
La fertilidad de ratas macho o hembra no se vio afectada por la metformina cuando se administró en dosis de hasta 600 mg/kg/día, que es aproximadamente 2 veces la MRHD con base en las comparaciones del área de superficie corporal.
REACCIONES ADVERSAS:
Las siguientes reacciones adversas importantes se describen a continuación y en otras partes de la etiqueta:
• Acidosis láctica [consulte el Recuadro de advertencia y Advertencias y precauciones (Acidosis láctica)].
• Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis [consulte Advertencias y precauciones (Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis)].
• Hipovolemia [consulte Advertencias y precauciones (Hipovolemia)].
• Urosepsis y pielonefritis [consulte Advertencias y precauciones (Urosepsis y pielonefritis)].
• Hipoglucemia [consulte Advertencias y precauciones (Hipoglucemia)].
• Fascitis necrotizante perineal (gangrena de Fournier) [consulte Advertencias y precauciones (Fascitis necrotizante perineal (gangrena de Fournier)].
• Infecciones micóticas genitales [consulte Advertencias y precauciones (Infecciones micóticas genitales)].
• Amputación de extremidades inferiores [consulte Advertencias y precauciones (Amputación de extremidades inferiores)].
• Reacciones de hipersensibilidad [consulte Advertencias y precauciones (Reacciones de hipersensibilidad)].
• Deficiencia de vitamina B12 [consulte Advertencias y precauciones (Deficiencia de vitamina B12)].
Experiencia en ensayos clínicos:
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas de los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
La seguridad de la administración concomitante de empagliflozina (dosis diaria de 10 mg o 25 mg) y metformina HCl (dosificación diaria promedio de aproximadamente 1,800 mg) ha sido evaluada en 3,456 pacientes adultos con diabetes mellitus tipo 2 tratados durante 16 a 24 semanas, de los cuales 926 pacientes recibieron placebo, 1,271 pacientes recibieron una dosis diaria de 10 mg de empagliflozina y 1,259 pacientes recibieron una dosis diaria de 25 mg de empagliflozina. La interrupción del tratamiento debido a eventos adversos en los grupos de tratamiento fue del 3.0 %, 2.8 % y 2.9 % para el placebo, 10 mg de empagliflozina y 25 mg de empagliflozina, respectivamente.
Reacciones adversas en un ensayo clínico con empagliflozina (Terapia de combinación adicional con metformina y sulfonilurea) para el control glucémico en adultos con diabetes mellitus tipo 2:
En un ensayo controlado con placebo de 24 semanas de empagliflozina 10 mg o 25 mg administrados una vez al día junto con metformina y sulfonilurea, se informaron reacciones adversas en ≥5 % de los pacientes tratados con empagliflozina, y con mayor frecuencia que en los pacientes que recibieron placebo, como se muestra en la Tabla 1 (consulte también la Tabla 4).
Tabla 1. Reacciones adversas informadas en ≥ 5 % de los adultos con diabetes mellitus tipo 2 tratados con empagliflozina añadida a metformina más sulfonilurea, y mayores que con el placebo en un ensayo clínico controlado con placebo de 24 semanas
|
Reacciones adversas |
Placebo ( %) n = 225 |
Empagliflozina 10 mg (%) n = 224 |
Empagliflozina 25 mg (%) n = 217 |
|
Hipoglucemia |
9.8 |
15.6 |
12.9 |
|
Infección de vías urinarias |
6.7 |
9.4 |
6.9 |
|
Nasofaringitis |
4.9 |
8.0 |
6.0 |
Empagliflozina:
Ensayos clínicos en adultos con diabetes mellitus tipo 2: Los datos de la Tabla 2 se derivan de un conjunto de cuatro ensayos controlados con placebo de 24 semanas y datos de 18 semanas de un ensayo controlado con placebo con insulina basal en pacientes adultos con diabetes mellitus tipo 2. La empagliflozina se usó como monoterapia en un ensayo y como terapia complementaria en cuatro ensayos [consulte Estudios clínicos (Ensayos de control glucémico en adultos con diabetes mellitus tipo 2)].
Estos datos reflejan la exposición de 1,976 pacientes adultos a la empagliflozina con una duración media de la exposición de aproximadamente 23 semanas. Los pacientes recibieron placebo (N = 995), empagliflozina 10 mg (N = 999) o empagliflozina 25 mg (N = 977) una vez al día.
La edad promedio de la población fue de 56 años y el 3 % tenía más de 75 años. Más de la mitad (55 %) de la población eran hombres; el 46 % eran blancos, el 50 % eran asiáticos y el 3 % eran negros o afroamericanos. Al inicio del ensayo, el 57 % de la población tenía diabetes mellitus durante más de 5 años y tenía una media de hemoglobina A1c (HbA1c) del 8 %. Las complicaciones microvasculares establecidas de la diabetes mellitus al inicio del ensayo incluyeron nefropatía diabética (7 %), retinopatía (8 %) o neuropatía (16 %). La función renal inicial era normal o levemente alterada en el 91 % de los pacientes y moderadamente alterada en el 9 % de los pacientes (TFGe promedio de 86.8 mL/min/1.73 m2).
La tabla 2 muestra las reacciones adversas (excluyendo la hipoglucemia) que no estaban presentes al inicio del ensayo, que ocurrieron con mayor frecuencia en los pacientes tratados con empagliflozina que con placebo y que ocurrieron en el 2 % o más de los pacientes tratados con empagliflozina.
Tabla 2. Reacciones adversas informadas en ≥ 2 % de los adultos con diabetes mellitus tipo 2 tratados con empagliflozina y mayor que con el placebo en ensayos clínicos combinados controlados con placebo de monoterapia con empagliflozina o terapia combinada
|
Reacciones adversas |
Placebo (%) N = 995 |
Empagliflozina 10 mg (%) N = 999 |
Empagliflozina 25 mg (%) N = 977 |
|
Infección del tracto urinarioa |
7.6 |
9.3 |
7.6 |
|
Infecciones micóticas genitales femeninasb |
1.5 |
5.4 |
6.4 |
|
Infección del tracto respiratorio superior |
3.8 |
3.1 |
4.0 |
|
Aumento de micciónc |
1.0 |
3.4 |
3.2 |
|
Dislipidemia |
3.4 |
3.9 |
2.9 |
|
Artralgia |
2.2 |
2.4 |
2.3 |
|
Infecciones micóticas genitales masculinasd |
0.4 |
3.1 |
1.6 |
|
Náusea |
1.4 |
2.3 |
1.1 |
a Agrupación predefinida de eventos adversos, que incluye, entre otros, infección del tracto urinario, bacteriuria asintomática, cistitis
b Las infecciones micóticas genitales femeninas incluyen las siguientes reacciones adversas: infección micótica vulvovaginal, infección vaginal, vulvitis, candidiasis vulvovaginal, infección genital, candidiasis genital, infección genital fúngica, infección del tracto genitourinario, vulvovaginitis, cervicitis, infección urogenital fúngica, vaginitis bacteriana. Porcentajes calculados con el número de mujeres en cada grupo como denominador: placebo (N = 481), empagliflozina 10 mg (N = 443), empagliflozina 25 mg (N = 420).
c Agrupación predefinida de eventos adversos, incluidos, entre otros, poliuria, polaquiuria y nicturia.
d Las infecciones micóticas genitales masculinas incluyen las siguientes reacciones adversas: balanopostitis, balanitis, infecciones micóticas genitales, infección del tracto genitourinario, balanitis Candida, absceso escrotal, infección del pene. Porcentajes calculados con el número de sujetos masculinos en cada grupo como denominador: placebo (N = 514), empagliflozina 10 mg (N = 556), empagliflozina 25 mg (N = 557).
La sed (incluida la polidipsia) se notificó en el 0 %, el 1.7 % y el 1.5 % con placebo, empagliflozina de 10 mg y empagliflozina de 25 mg, respectivamente.
Hipovolemia: La empagliflozina causa una diuresis osmótica, que puede provocar una contracción del volumen intravascular y reacciones adversas relacionadas con la hipovolemia.
En el conjunto de cinco ensayos clínicos controlados con placebo en adultos, las reacciones adversas relacionadas con hipovolemia (p. ej., disminución de la presión arterial (ambulatoria), disminución de la presión arterial sistólica, deshidratación, hipotensión, hipovolemia, hipotensión ortostática y síncope) se informaron en 0.3 %, 0.5 % y 0.3 % de los pacientes tratados con placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente. La empagliflozina puede aumentar el riesgo de hipotensión en pacientes con riesgo de contracción del volumen [consulte Uso en poblaciones específicas (Uso geriátrico, Insuficiencia renal)].
Aumento de la micción: En el conjunto de cinco ensayos clínicos controlados con placebo en adultos, las reacciones adversas de aumento de la micción (p. ej., poliuria, polaquiuria y nicturia) ocurrieron con más frecuencia con empagliflozina que con el placebo (consulte la Tabla 2). Específicamente, el 0.4 %, 0.3 % y 0.8 % de los pacientes tratados con placebo, empagliflozina 10 mg y empagliflozina 25 mg, informaron nocturia, respectivamente.
Hipoglucemia en ensayos clínicos con empagliflozina para el control glucémico en adultos con diabetes mellitus tipo 2:
La incidencia de hipoglucemia en adultos por ensayo se muestra en la Tabla 3. La incidencia de hipoglucemia aumentó cuando se administró empagliflozina con insulina o sulfonilurea.
Tabla 3. Incidencia de eventos hipoglucémicos generalesa y gravesb en ensayos clínicos controlados con placeboc para el control glucémico en adultos con diabetes mellitus tipo 2
|
Monoterapia (24 semanas) |
Placebo (n = 229) |
Empagliflozina 10 mg (n = 224) |
Empagliflozina 25 mg (n = 223) |
|
General (%) |
0.4 |
0.4 |
0.4 |
|
Grave (%) |
0 |
0 |
0 |
|
En combinación con metformina (24 semanas) |
Placebo + Metformina (n = 206) |
Empagliflozina 10 mg + Metformina (n=217) |
Empagliflozina 25 mg + Metformina (n = 214) |
|
General (%) |
0.5 |
1.8 |
1.4 |
|
Grave (%) |
0 |
0 |
0 |
|
En combinación con Metformina + Sulfonilurea (24 semanas) |
Placebo (n = 225) |
Empagliflozina 10 mg + Metformina + Sulfonilurea (n=224) |
Empagliflozina 25 mg + Metformina + Mulfonilurea (n = 217) |
|
General (%) |
8.4 |
16.1 |
11.5 |
|
Grave (%) |
0 |
0 |
0 |
|
En combinación con Pioglitazona ± Metformina (24 semanas) |
Placebo (n = 165) |
Empagliflozina 10 mg + Pioglitazona ± Metformina (n = 165) |
Empagliflozina 25 mg + Pioglitazona ± Metformina (n = 168) |
|
General (%) |
1.8 |
1.2 |
2.4 |
|
Grave (%) |
0 |
0 |
0 |
|
En combinación con Insulina basal ± Metformina (18 semanasd) |
Placebo (n = 170) |
Empagliflozina 10 mg (n = 169) |
Empagliflozina 25 mg (n = 155) |
|
General (%) |
20.6 |
19.5 |
28.4 |
|
Grave (%) |
0 |
0 |
1.3 |
|
En combinación con Insulina MDI ± Metformina (18 semanasd) |
Placebo (n = 188) |
Empagliflozina 10 mg (n = 186) |
Empagliflozina 25 mg (n = 189) |
|
General (%) |
37.2 |
39.8 |
41.3 |
|
Grave (%) |
0.5 |
0.5 |
0.5 |
a Eventos hipoglucémicos generales: glucosa plasmática o capilar menor o igual a 70 mg/dL.
b Eventos hipoglucémicos graves: que requieren asistencia independientemente de la glucosa en sangre.
c Conjunto tratado (pacientes que habían recibido al menos una dosis del fármaco del ensayo).
d La dosis de insulina no se pudo ajustar durante el período de tratamiento inicial de 18 semanas.
Otras reacciones adversas en ensayos clínicos con empagliflozina en adultos:
Infecciones micóticas genitales: En el conjunto de cinco ensayos clínicos controlados con placebo, la incidencia de infecciones micóticas genitales (p. ej., infección micótica vaginal, infección vaginal, infección genital fúngica, candidiasis vulvovaginal y vulvitis) aumentó en las pacientes tratadas con empagliflozina en comparación con placebo, y se produjo en 0.9 %, 4.1 % y 3.7 % de los pacientes aleatorizados al placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente. La interrupción del ensayo debido a una infección genital se produjo en el 0 % de los pacientes tratados con placebo y en el 0.2 % de los pacientes tratados con 10 mg o 25 mg de empagliflozina.
Las infecciones micóticas genitales ocurrieron con mayor frecuencia en mujeres que en hombres (consulte la Tabla 2).
La fimosis ocurrió con mayor frecuencia en pacientes masculinos tratados con empagliflozina 10 mg (menos del 0,1 %) y empagliflozina 25 mg (0.1 %) que con placebo (0 %).
Infecciones de vías urinarias: En el grupo de cinco ensayos clínicos controlados con placebo, la incidencia de infecciones del tracto urinario (p. ej., infección del tracto urinario, bacteriuria asintomática y cistitis) aumentó en los pacientes tratados con empagliflozina en comparación con el placebo (consulte la Tabla 2). Los pacientes con antecedentes de infecciones crónicas o recurrentes del tracto urinario tenían más probabilidades de experimentar una infección del tracto urinario. La tasa de interrupción del tratamiento debido a infecciones del tracto urinario fue del 0.1 %, 0.2 % y 0.1 % para placebo, 10 mg de empagliflozina y 25 mg de empagliflozina, respectivamente.
Las infecciones de vías urinarias ocurrieron con mayor frecuencia en pacientes de sexo femenino. La incidencia de infecciones del tracto urinario en pacientes aleatorizadas a placebo, empagliflozina 10 mg y empagliflozina 25 mg fue del 16.6 %, 18.4 % y 17.0 %, respectivamente. La incidencia de infecciones del tracto urinario en pacientes varones asignados aleatorizados a placebo, empagliflozina de 10 mg y empagliflozina 25 mg fue del 3.2 %, 3.6 % y 4.1 %, respectivamente [consulte Uso en poblaciones específicas (Uso geriátrico)].
Amputaciones de extremidades inferiores: En cuatro ensayos de empagliflozina, las tasas de amputación de extremidades inferiores fueron de 4.3 y 5.0 eventos por 1,000 años-paciente en el grupo con placebo y en el grupo con 10 mg y 25 mg de empagliflozina, respectivamente, con un CRI de 1.05 (IC del 95 %: 0.81, 1.36). En un ensayo de resultados cardiorrenales a largo plazo, en los pacientes con enfermedad renal crónica, se reportó la ocurrencia de amputaciones de extremidades inferiores con tasas de 2.9 y 4.3 eventos por 1,000 años-paciente en los grupos con placebo, y con 10 mg y 25 mg de empagliflozina, respectivamente. JARDIANZ® DUO no está indicado para el tratamiento de enfermedad renal crónica.
Ensayo clínico de empagliflozina en pacientes pediátricos de 10 a 17 años con diabetes mellitus tipo 2:
La empagliflozina se administró a 52 pacientes en un ensayo de 157 pacientes pediátricos de 10 a 17 años con diabetes mellitus tipo 2, con una exposición media a empagliflozina de 23.8 semanas [consulte Estudios clínicos (Ensayos del control glucémico en pacientes pediátricos con diabetes mellitus tipo 2)]. Los tratamientos de base como complemento de la dieta y el ejercicio incluían metformina (51 %), una combinación de metformina e insulina (40.1 %), insulina (3.2 %) o ninguna (5.7 %). La HbA1c media al inicio del ensayo era de 8.0 % y la duración media de la diabetes mellitus tipo 2 era de 2.1 años.
La media de la edad era de 14.5 años (intervalo: 10-17 años) y el 51.6 % tenía 15 años o más. Aproximadamente, el 50 % eran blancos, el 6 % asiáticos, el 31 % negros o afroamericanos y el 38 % hispanos o latinos. El IMC medio fue de 36.0 kg/m2 y la media de la puntuación Z del IMC fue de 3.0. Cerca del 25 % de la población del ensayo presentaba microalbuminuria o macroalbuminuria.
El riesgo de hipoglucemia fue mayor en los pacientes pediátricos tratados con empagliflozina independientemente del uso concomitante de insulina. La hipoglucemia, definida como una glucosa sanguínea < 54 mg/dL, se produjo en 10 (19.2 %) pacientes y en 4 (7.5 %) pacientes tratados con empagliflozina y placebo, respectivamente. No se produjeron eventos hipoglucémicos graves (la hipoglucemia grave se definió como un evento que requirió la ayuda de otra persona para administrar activamente carbohidratos, glucagón o tomar otras medidas correctivas).
Reacciones adversas en ensayos clínicos de metformina:
Las reacciones adversas establecidas más comunes (>5 %) debidas al inicio de la terapia con metformina son diarrea, náuseas/vómitos, flatulencia, malestar abdominal, indigestión, astenia y dolor de cabeza.
En un ensayo clínico de 24 semanas en el que se añadió metformina de liberación prolongada o placebo al tratamiento con gliburida, las reacciones adversas más frecuentes (> 5 % y mayores que las del placebo) en el grupo de tratamiento combinado fueron hipoglucemia (13.7 % vs. 4.9 %), diarrea (12.5 % vs. 5.6 %) y náuseas (6.7 % vs. 4.2 %).
Pacientes pediátricos: En ensayos clínicos con tabletas de liberación inmediata de metformina HCl en pacientes pediátricos con diabetes mellitus tipo 2, el perfil de reacciones adversas fue similar al observado en adultos.
Anomalías en las pruebas de laboratorio en ensayos clínicos de empagliflozina o metformina:
Empagliflozina:
Aumentos en la creatinina sérica y disminuciones en TFGe: El inicio de la empagliflozina provoca un aumento de la creatinina sérica y una disminución de la TFGe a las pocas semanas de iniciar el tratamiento y luego estos cambios se estabilizan. En un ensayo de adultos con insuficiencia renal moderada, se observaron cambios promedio mayores. En un ensayo de resultados cardiovasculares a largo plazo, el aumento de la creatinina sérica y la disminución de la TFGe generalmente no superaron los 0.1 mg/dL y -9.0 mL/min/1.73 m2, respectivamente, en la semana 4, y se revirtió después de la interrupción del tratamiento, lo que sugiere que los cambios hemodinámicos agudos pueden desempeñar un papel en los cambios de la función renal observados con empagliflozina.
Aumento del colesterol de lipoproteínas de baja densidad (LDL-C): Se observaron aumentos relacionados con la dosis en el colesterol de lipoproteínas de baja densidad (LDL-C) en adultos tratados con empagliflozina. El LDL-C aumentó un 2.3 %, 4.6 % y 6.5 % en pacientes tratados con placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente. El intervalo de los niveles basales promedio de LDL-C fue de 90.3 a 90.6 mg/dL en todos los grupos de tratamiento.
Aumento del hematocrito: En un conjunto de cuatro ensayos controlados con placebo en adultos, la mediana del hematocrito disminuyó un 1.3 % en el grupo placebo y aumentó un 2.8 % en los pacientes tratados con 10 mg de empagliflozina y un 2.8 % en los pacientes tratados con 25 mg de empagliflozina. Al final del tratamiento, el 0.6 %, el 2.7 % y el 3.5 % de los pacientes con hematocritos inicialmente dentro del intervalo de referencia tenían valores por encima del límite superior del intervalo de referencia con placebo, empagliflozina 10 mg y empagliflozina 25 mg, respectivamente.
Metformina:
Disminución de la vitamina B12: En ensayos clínicos de metformina de 29 semanas de duración, se observó una disminución a niveles por debajo de lo normal de los niveles séricos de vitamina B12 previamente normales en aproximadamente el 7 % de los pacientes.
Experiencia posterior a la comercialización:
Se han identificado reacciones adversas adicionales durante el uso posterior a la aprobación. Debido a que estas reacciones son informadas voluntariamente por una población de tamaño incierto, generalmente no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Empagliflozina:
Trastornos gastrointestinales: Estreñimiento.
Infecciones: Fascitis necrotizante del perineo (gangrena de Fournier), urosepsis y pielonefritis.
Trastornos del metabolismo y la nutrición: Cetoacidosis.
Trastornos renales y urinarios: Daño renal agudo.
Trastornos de la piel y del tejido subcutáneo: Angioedema, reacciones cutáneas (por ejemplo, erupción, urticaria).
Metformina HCl:
Trastornos hepatobiliares: Daño hepático colestásico, hepatocelular y hepatocelular mixto.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones medicamentosas:
Consulte en la Tabla 4 las interacciones clínicamente relevantes con JARDIANZ® DUO.
Tabla 4. Interacciones clínicamente relevantes con JARDIANZ® DUO
|
Inhibidores de la anhidrasa carbónica |
|
|
Impacto Clínico |
El topiramato u otros inhibidores de la anhidrasa carbónica (p. ej., zonisamida, acetazolamida o diclorfenamida) provocan con frecuencia una disminución del bicarbonato sérico e inducen acidosis metabólica hiperclorémica sin brecha aniónica. El uso concomitante de estos fármacos con JARDIANZ® DUO puede aumentar el riesgo de acidosis láctica. |
|
Intervención |
Considere un monitoreo más frecuente de estos pacientes. |
|
Fármacos que reducen la depuración de metformina |
|
|
Impacto clínico |
El uso concomitante de fármacos que interfieren con los sistemas comunes de transporte tubular renal implicados en la eliminación renal de metformina (p. ej., transportador catiónico orgánico-2 [OCT2]/inhibidores de la extrusión de múltiples fármacos y toxinas [MATE] como ranolazina, vandetanib, dolutegravir y cimetidina) podría aumentar la exposición sistémica a la metformina y puede aumentar el riesgo de acidosis láctica [consulte Farmacología clínica (Farmacocinética)]. |
|
Intervención |
Considere los beneficios y riesgos del uso concomitante. |
|
Alcohol |
|
|
Impacto Clínico |
Se sabe que el alcohol potencia el efecto de la metformina sobre el metabolismo del lactato. |
|
Intervención |
Advierta a los pacientes sobre el consumo excesivo de alcohol mientras reciben JARDIANZ® DUO. |
|
Diuréticos |
|
|
Impacto Clínico |
La coadministración de empagliflozina con diuréticos resultó en un aumento del volumen de orina y de la frecuencia de las micciones, lo que podría aumentar el potencial de hipovolemia. |
|
Intervención |
Antes de iniciar JARDIANZ® DUO, evalúe el estado del volumen y la función renal. En pacientes con hipovolemia, corrija esta condición antes de iniciar JARDIANZ® DUO. Monitoree los signos y síntomas de hipovolemia y la función renal después de iniciar el tratamiento. |
|
Insulina o Secretagogos de Insulina |
|
|
Impacto Clínico |
El riesgo de hipoglucemia aumenta cuando JARDIANZ® DUO se usa en combinación con secretagogos de insulina (p. ej., sulfonilurea) o insulina. |
|
Intervención |
La coadministración de JARDIANZ® DUO con un secretagogo de insulina (p. ej., sulfonilurea) o insulina puede requerir dosis más bajas del secretagogo de insulina o de insulina para reducir el riesgo de hipoglucemia. |
|
Medicamentos que afectan el control glucémico |
|
|
Impacto Clínico |
Ciertos fármacos tienden a producir hiperglucemia y pueden conducir a la pérdida del control glucémico. Estos fármacos incluyen las tiazidas y otros diuréticos, corticosteroides, fenotiazinas, productos tiroideos, estrógenos, anticonceptivos orales, fenitoína, ácido nicotínico, simpaticomiméticos, bloqueadores de los canales de calcio e isoniazida. |
|
Intervención |
Cuando dichos fármacos se administran a un paciente que recibe JARDIANZ® DUO, se debe observar de cerca al paciente para mantener un control glucémico adecuado. Cuando dichos fármacos se retiran de un paciente que recibe JARDIANZ® DUO, se debe vigilar de cerca al paciente en busca de hipoglucemia. |
|
Litio |
|
|
Impacto Clínico |
El uso concomitante de un inhibidor de SGLT2 con litio puede disminuir las concentraciones séricas de litio. |
|
Intervención |
Monitoree la concentración sérica de litio con mayor frecuencia durante el inicio de JARDIANZ® DUO y cuando se realicen cambios de dosis |
|
Prueba de glucosa en orina positiva |
|
|
Impacto Clínico |
Los inhibidores de SGLT2 aumentan la excreción de glucosa en orina y darán lugar a pruebas de glucosa en orina positivas. |
|
Intervención |
No se recomienda monitorear el control glucémico con pruebas de glucosa en orina en pacientes que toman inhibidores SGLT2. Use métodos alternativos para monitorear el control glucémico. |
|
Interferencia con el ensayo de 1,5-anhidroglucitol (1,5-AG) |
|
|
Impacto Clínico |
Las mediciones de 1,5-AG no son confiables para evaluar el control glucémico en pacientes que toman inhibidores de SGLT2. |
|
Intervención |
No se recomienda monitorear el control glucémico con el ensayo 1,5-AG. Use métodos alternativos para monitorear el control glucémico. |
HALLAZGOS DE LABORATORIO CLÍNICO:
Uso en poblaciones específicas:
Embarazo:
Resumen de riesgos: Según los datos en animales que muestran efectos renales adversos de la empagliflozina, JARDIANZ® DUO no se recomienda durante el segundo y tercer trimestre del embarazo.
Los datos limitados disponibles con JARDIANZ® DUO o empagliflozina en mujeres embarazadas no son suficientes para determinar un riesgo de anomalías congénitas graves y abortos espontáneos asociados con el fármaco. Los ensayos publicados con el uso de metformina durante el embarazo no informaron una asociación clara entre la metformina y el riesgo de malformaciones congénitas importantes o aborto espontáneo (consulte Datos). Existen riesgos para la madre y el feto asociados con la diabetes mal controlada durante el embarazo (consulte Consideraciones clínicas).
En ensayos con animales, la empagliflozina, un componente de JARDIANZ® DUO, provocó cambios renales adversos en ratas cuando se administró durante un período de desarrollo renal correspondiente a finales del segundo y tercer trimestre del embarazo humano. Dosis de aproximadamente 13 veces la dosis clínica máxima causó dilataciones de la pelvis renal y de los túbulos que fueron reversibles. No se observaron efectos adversos en el desarrollo cuando se administró metformina a ratas o conejas preñadas (consulte Datos).
El riesgo poblacional estimado de defectos congénitos importantes es del 6 % al 10 % en mujeres con diabetes pregestacional con HbA1c > 7 y se ha informado que es tan alto como del 20 % al 25 % en mujeres con HbA1c > 10. Se desconoce el riesgo poblacional estimado de aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo poblacional estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 % al 4 % y del 15 % al 20 %, respectivamente.
Consideraciones clínicas:
Riesgo materno y/o embrionario/fetal asociado a la enfermedad: La diabetes mal controlada en el embarazo aumenta el riesgo materno de cetoacidosis diabética, preeclampsia, abortos espontáneos, parto prematuro y complicaciones en el parto. La diabetes mal controlada aumenta el riesgo fetal de defectos congénitos importantes, muerte fetal y morbilidad relacionada con la macrosomía.
Datos:
Datos en humanos: Los datos publicados de los ensayos posteriores a la comercialización no informaron una asociación clara entre la metformina y los defectos de nacimiento importantes, abortos espontáneos o resultados maternos o fetales adversos cuando se usó metformina durante el embarazo. Sin embargo, estos ensayos no pueden establecer definitivamente la ausencia de algún riesgo asociado con la metformina, debido a las limitaciones metodológicas, incluido el tamaño pequeño de la muestra y los grupos de comparación inconsistentes.
Datos en animales:
Empagliflozina: La empagliflozina administrada directamente a ratas jóvenes desde el día posnatal (DPN) 21 hasta el DPN 90 en dosis de 1, 10, 30 y 100 mg/kg/día provocó un aumento del peso de los riñones y dilatación pélvica renal y tubular a 100 mg/kg/día, que se aproxima a 13 veces la dosis clínica máxima de 25 mg, con base en el ABC. Estos hallazgos no se observaron después de un período de recuperación de 13 semanas sin fármaco. Estos resultados ocurrieron con la exposición al fármaco durante períodos de desarrollo renal en ratas, que corresponden a finales del segundo y tercer trimestre del desarrollo renal humano.
En ensayos de desarrollo embriofetal en ratas y conejos, la empagliflozina se administró a intervalos que coincidían con el período del primer trimestre de la organogénesis en humanos. Las dosis de hasta 300 mg/kg/día, que se aproximan a 48 veces (ratas) y 128 veces (conejos) la dosis clínica máxima de 25 mg (basada en el ABC), no produjeron efectos adversos en el desarrollo. En ratas, a dosis más altas de empagliflozina que causaron toxicidad materna, las malformaciones de los huesos de las extremidades aumentaron en los fetos de las ratas que recibieron 700 mg/kg/día o 154 veces la dosis clínica máxima de 25 mg. La empagliflozina atraviesa la placenta y llega a los tejidos fetales en las ratas. En el conejo, las dosis más altas de empagliflozina produjeron toxicidad materna y fetal a dosis de 700 mg/kg/día, o 139 veces la dosis clínica máxima de 25 mg.
En ensayos de desarrollo prenatal y posnatal en ratas preñadas, se administró empagliflozina desde el día 6 de gestación hasta el día 20 de lactancia (destete) a una dosis de hasta 100 mg/kg/día (aproximadamente 16 veces la dosis clínica máxima de 25 mg) sin toxicidad materna. Se observó una reducción del peso corporal en las crías con una dosis mayor o igual a 30 mg/kg/día (aproximadamente 4 veces la dosis clínica máxima de 25 mg).
Metformina HCl: La metformina HCl no causó efectos adversos en el desarrollo cuando se administró a ratas Sprague Dawley y conejas preñadas en dosis de hasta 600 mg/kg/día durante el período de organogénesis. Esto representa una exposición de aproximadamente 2 y 6 veces la dosis clínica de 2,000 mg, con base en el área de superficie corporal (mg/m2) para ratas y conejos, respectivamente.
Empagliflozina y metformina HCl: No se observaron efectos adversos en el desarrollo cuando la empagliflozina y la metformina HCl se coadministraron a ratas preñadas durante el período de organogénesis a exposiciones de aproximadamente 35 y 14 veces la exposición clínica en ABC de empagliflozina asociada con las dosis de 10 mg y 25 mg, respectivamente, y 4 veces la exposición clínica en ABC de metformina asociada con la dosis de 2,000 mg.
Lactancia:
Resumen de los riesgos: Existe información limitada sobre la presencia de JARDIANZ® DUO o sus componentes (empagliflozina o metformina) en la leche humana, los efectos en el lactante o los efectos en la producción de leche. Los ensayos publicados limitados informan que la metformina está presente en la leche humana (consulte Datos). La empagliflozina está presente en la leche de ratas lactantes (consulte Datos).
Dado que la maduración del riñón humano ocurre en el útero y durante los primeros 2 años de vida, cuando puede ocurrir la exposición durante la lactancia, puede haber riesgo para el riñón humano en desarrollo.
Debido al potencial de reacciones adversas graves en un lactante amamantado, incluido el potencial de empagliflozina para afectar el desarrollo renal posnatal, advierta a los pacientes que no se recomienda el uso de JARDIANZ® DUO durante la lactancia.
Datos: Ensayos clínicos de lactancia publicados notifican que la metformina está presente en la leche humana, lo que resultó en dosis para lactantes de aproximadamente 0.11 % a 1 % de la dosis materna ajustada al peso y una relación leche/plasma que oscila entre 0.13 y 1. Sin embargo, los ensayos no fueron diseñados para establecer definitivamente el riesgo del uso de metformina durante la lactancia, debido al pequeño tamaño de la muestra y a los datos limitados de eventos adversos recopilados en lactantes.
La empagliflozina estuvo presente en un nivel bajo en tejidos fetales de rata después de una dosis oral única a las madres en el día 18 de gestación. En la leche de rata, la relación promedio de leche/plasma varió de 0.634 a 5, y fue mayor que uno entre 2 y 24 horas después de la dosis. La relación leche/plasma promedio máxima de 5 se produjo 8 horas después de la dosis, lo que sugiere una acumulación de empagliflozina en la leche. Las ratas jóvenes expuestas directamente a la empagliflozina mostraron un riesgo para el riñón en desarrollo (dilatación pélvica renal y tubular) durante la maduración.
Mujeres y hombres con capacidad de procrear: Analice la posibilidad de un embarazo no deseado con mujeres premenopáusicas, ya que la terapia con metformina puede provocar la ovulación en algunas mujeres anovulatorias.
Uso pediátrico:
JARDIANZ® DUO: La seguridad y la eficacia de JARDIANZ® DUO como complemento de la dieta y el ejercicio para mejorar el control glucémico en la diabetes mellitus tipo 2 se ha establecido en pacientes pediátricos con edad de 10 años y mayores. El uso de JARDIANZ® DUO para esta indicación está respaldada por los datos de un ensayo clínico doble ciego, controlado con placebo, de 26 semanas de duración con empagliflozina, con un periodo de extensión de la seguridad con tratamiento con activo doble ciego, de hasta 52 semanas en 157 pacientes pediátricos con edad de 10 a 17 años con diabetes mellitus tipo 2 y un ensayo farmacocinético pediátrico [consulte Farmacología clínica (Farmacocinética) y Estudios clínicos (Ensayos del control glucémico en pacientes pediátricos con diabetes mellitus tipo 2)].
El perfil de seguridad de los pacientes pediátricos tratados con empagliflozina fue similar al observado en adultos con diabetes mellitus tipo 2, con excepción del riesgo de hipoglucemia, que fue mayor en los pacientes pediátricos tratados con empagliflozina independientemente del uso concomitante de insulina [consulte Advertencias y precauciones (Hipoglucemia) y Reacciones adversas (Experiencia en ensayos clínicos)].
El uso de JARDIANZ® DUO para esta indicación también está respaldado por los datos de ensayos adecuados y bien controlados de tabletas de liberación inmediata de metformina HCl en adultos, con datos adicionales de un ensayo clínico controlado con tabletas de liberación inmediata de metformina HCl en pacientes pediátricos de 10 a 16 años con diabetes mellitus tipo 2 [consulte Estudios clínicos]. En este ensayo, las reacciones adversas fueron similares a las descritas en adultos.
No se ha establecido la seguridad y eficacia de JARDIANZ® DUO en pacientes pediátricos menores de 10 años.
Uso geriátrico: Evalúe la función renal con mayor frecuencia en pacientes geriátricos tratados con JARDIANZ® DUO porque existe un mayor riesgo de contracción del volumen intravascular e hipotensión sintomática asociadas con la empagliflozina en pacientes geriátricos, y existe un mayor riesgo de acidosis láctica asociada con metformina en pacientes geriátricos [consulte Advertencias y precauciones (Acidosis láctica, Hipovolemia)].
La dosis recomendada para el componente metformina de JARDIANZ® DUO en pacientes geriátricos generalmente debe comenzar en el extremo inferior del intervalo de dosis.
Empagliflozina: En ensayos de diabetes mellitus tipo 2 con empagliflozina, 2,721 pacientes tratados con empagliflozina tenían 65 años o más, y 491 pacientes tenían 75 años o más. En estos ensayos, se produjeron reacciones adversas relacionadas con la hipovolemia en el 2.1 %, 2.3 % y 4.4 % de los pacientes de 75 años de edad y mayores en los grupos del placebo, empagliflozina 10 mg y empagliflozina 25 mg una vez al día, respectivamente; y se produjeron infecciones del tracto urinario en el 10.5 %, 15.7 % y 15.1 % de los pacientes de 75 años de edad y mayores en los grupos del placebo, empagliflozina 10 mg y empagliflozina 25 mg una vez al día, respectivamente.
En los ensayos de insuficiencia cardíaca, EMPEROR-Reduced incluyó 1,188 (64 %) pacientes tratados con empagliflozina de 65 años de edad y mayores, y 503 (27 %) pacientes de 75 años de edad y mayores. EMPEROR-Preserved incluyó 2,402 (80 %) pacientes tratados con empagliflozina de 65 años o más, y 1,281 (43 %) pacientes de 75 años y mayores. No se han observado diferencias generales en la seguridad y la eficacia entre los pacientes de 65 años y los pacientes adultos mayores y más jóvenes.
Metformina: Los ensayos clínicos de metformina no incluyeron un número suficiente de pacientes de 65 años y más para determinar si responden de manera diferente a los pacientes adultos más jóvenes.
Insuficiencia renal:
JARDIANZ® DUO no debe iniciarse en pacientes con una TFGe inferior a 45 mL/min/1.73 m2 debido al componente metformina, y está contraindicado en pacientes con insuficiencia renal grave (TFGe inferior a 30 mL/min/1.73 m2), enfermedad renal en etapa terminal, o diálisis.
Empagliflozina: El beneficio hipoglucemiante de 25 mg de empagliflozina disminuyó en pacientes adultos con empeoramiento de la función renal. Los riesgos de insuficiencia renal, reacciones adversas de hipovolemia y reacciones adversas relacionadas con infecciones de vías urinarias aumentaron con el empeoramiento de la función renal [consulte Advertencias y precauciones (Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis)].
En el ensayo de pacientes pediátricos con edad de 10 a 17 años con diabetes mellitus tipo 2, no se inscribió a los pacientes con una TFGe menor de 60 mL/min/1.73 m2.
Metformina: La metformina se excreta sustancialmente por vía renal, y el riesgo de acumulación de metformina y acidosis láctica aumenta con el grado de insuficiencia renal [consulte Advertencias y precauciones (Acidosis láctica)].
Insuficiencia hepática: El uso de metformina HCl en pacientes con insuficiencia hepática se ha asociado con algunos casos de acidosis láctica. JARDIANZ® DUO no se recomienda en pacientes con insuficiencia hepática [consulte Advertencias y precauciones (Acidosis láctica)].
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Estudios clínicos:
Ensayos de control glucémico en adultos con diabetes mellitus tipo 2: En pacientes adultos con diabetes mellitus tipo 2, el tratamiento con empagliflozina y metformina produjo mejoras clínica y estadísticamente significativas en la HbA1c en comparación con el placebo y con metformina. Se observaron reducciones en la HbA1c en todos los subgrupos, incluidos la edad, el sexo, la raza y el índice de masa corporal (IMC) inicial.
Terapia de combinación adicional de empagliflozina con metformina en pacientes adultos con diabetes mellitus tipo 2:
Un total de 637 pacientes con diabetes mellitus tipo 2 participaron en un ensayo doble ciego, controlado con placebo, para evaluar la eficacia de empagliflozina en combinación con metformina.
Pacientes con diabetes mellitus tipo 2 sin un control adecuado con al menos 1,500 mg de metformina HCl por día entraron a un período abierto de preinclusión de 2 semanas con placebo. Al final del periodo de preinclusión, los pacientes que permanecieron sin un control adecuado y que tenían un nivel de HbA1c entre 7 % y 10 % fueron aleatorizados para recibir placebo, empagliflozina 10 mg o empagliflozina 25 mg.
En la semana 24, el tratamiento con empagliflozina 10 mg o 25 mg por día causó reducciones estadísticamente significativas en HbA1c (valor de p < 0.0001), en la GPA y en el peso corporal, en comparación con el placebo (consulte la Tabla 7).
Tabla 7. Resultados en la semana 24 de un ensayo controlado con placebo para Empagliflozina utilizada en combinación con metformina
|
Empagliflozina a 10 mg N = 217 |
Empagliflozina N = 213 |
Placebo N = 207 |
|
|---|---|---|---|
|
HbA1c ( %)ª |
|||
|
Inicial (media) |
7.9 |
7.9 |
7.9 |
|
Cambio desde el inicio (media ajustada) |
-0.7 |
-0.8 |
-0.1 |
|
Diferencia respecto al placebo + metformina (media ajustada) (IC 95 %) |
-0.6b (-0.7,-0.4) |
-0.6b (-0.8, -0.5) |
-- |
|
Pacientes [n ( %)] que lograron HbA1c <7 % |
75 (38 %) |
74 (39 %) |
23 (13 %) |
|
GPA (mg/dL)C |
|||
|
Inicial (media) |
155 |
149 |
156 |
|
Cambio desde el inicio (media ajustada) |
-20 |
-22 |
6 |
|
Diferencia respecto al placebo + metformina (media ajustada) |
-26 |
-29 |
-- |
|
Peso corporal |
|||
|
Media inicial en kg |
82 |
82 |
80 |
|
% de cambio desde el inicio (media ajustada) |
-2.5 |
-2.9 |
-0.5 |
|
Diferencia respecto al placebo (media ajustada) (IC 95 %) |
-2.0b (-2.6,-1.4) |
-2.5b (-3.1, -1.9) |
-- |
a Población por intención de tratar modificada. Se utilizó la última observación del ensayo (LOCF) para imputar los datos faltantes en la semana 24. En la semana 24, se imputó el 9.7 %, el 14.1 % y el 24.6 % para los pacientes aleatorizados a empagliflozina 10 mg, empagliflozina 25 mg y placebo, respectivamente.
b Valor de p de ANCOVA <0.0001 (HbA1c: el modelo ANCOVA incluye la HbA1c inicial, el tratamiento, la función renal y la región. Peso corporal y GPA: se usa el mismo modelo que para la HbA1c, pero además incluye el peso corporal inicial/GPA inicial, respectivamente).
c GPA (mg/dL); para empagliflozina 10 mg, n = 216, para empagliflozina 25 mg, n = 213 y para placebo, n = 207.
En la semana 24, la presión arterial sistólica se redujo de manera estadísticamente significativa en comparación con el placebo en -4.1 mmHg (corregida para el placebo, valor de p < 0.0001) para empagliflozina 10 mg y -4.8 mmHg (corregida para el placebo, valor de p < 0.0001) para empagliflozina 25 mg.
Tratamiento combinado inicial de empagliflozina con metformina: Un total de 1,364 pacientes con diabetes mellitus tipo 2 participaron en un ensayo doble ciego, aleatorizado y con control activo para evaluar la eficacia de la empagliflozina en combinación con metformina como terapia inicial en comparación con los componentes individuales correspondientes.
Los pacientes sin tratamiento previo con diabetes mellitus tipo 2 no controlada de manera adecuada ingresaron a un período abierto de preinclusión con placebo durante 2 semanas. Al final del periodo de preinclusión, los pacientes que seguían sin un control adecuado y tenían un nivel de HbA1c entre 7 y 10.5 % fueron aleatorizados a uno de los 8 grupos de tratamiento activo: empagliflozina 10 mg o 25 mg; metformina HCl 1,000 mg o 2,000 mg; empagliflozina 10 mg en combinación con 1,000 mg o 2,000 mg de metformina HCl; o empagliflozina 25 mg en combinación con 1,000 mg o 2,000 mg de metformina HCl.).
En la semana 24, la terapia inicial con empagliflozina en combinación con metformina produjo reducciones estadísticamente significativas en la HbA1c (valor de p < 0.01) en comparación con los componentes individuales (consulte la Tabla 8).
Tabla 8. Parámetros glucémicos a las 24 semanas en un ensayo que compara la empagliflozina y la metformina con los componentes individuales como terapia inicial
|
Empagliflozina 10 mg + metformina 1,000 mgª N=161 |
Empagliflozina 10 mg + metformina 2,000 mga N = 167 |
Empagliflozina 25 mg + metformina 1,000 mgª N = 165 |
Empagliflozina 25 mg + metformina 2,000 mgª N=169 |
Empagliflozina 10 mg N=169 |
Empagliflozina 25 mg N=163 |
Metformina 1,000 mg N=167 |
Metformina 2,000 mgª N=162 |
|
|---|---|---|---|---|---|---|---|---|
|
HbA1c ( %) |
||||||||
|
Inicial (media) |
8.7 |
8.7 |
8.8 |
8.7 |
8.6 |
8.9 |
8.7 |
8.6 |
|
Cambio desde el inicio (media ajustada) |
-2.0 |
-2.1 |
-1.9 |
-2.1 |
-1.4 |
-1.4 |
-1.2 |
-1.8 |
|
Comparación vs. empagliflozina (media ajustada) (IC 95 %) |
-0.6b (-0.9,-0.4) |
-0.7b (-1.0, -0.5) |
-0.6c (-0.8, -0.3) |
-0.7c (-1.0,-0.5) |
-- |
-- |
-- |
-- |
|
Comparación vs metformina (media ajustada) (IC 95 %) |
-0.8b (-1.0,-0.6) |
-0.3b (-0.6, -0.1) |
-0.8c (-1.0,-0.5) |
-0.3c (-0.6,-0.1) |
-- |
-- |
-- |
-- |
|
Pacientes [n ( %)] que lograron HbA1c <7 % |
96 (63 %) |
112 (70 %) |
91 (57 %) |
111 (68 %) |
69 (43 %) |
51 (32 %) |
63 (38 %) |
92 (58 %) |
a Dosis diaria total de metformina HC1, administrada en dos dosis iguales por día.
b Valor de p ≤0.0062 (población por intención de tratar modificada [caso observado]. El modelo MMRM incluyó tratamiento, función renal, región, visita, interacción visita por tratamiento y HbA1c inicial).
c Valor de p ≤0.0056 (población por intención de tratar modificada [caso observado] El modelo MMRM incluyó tratamiento, función renal, región, visita, interacción visita por tratamiento y HbA1c inicial).
Terapia de combinación adicional de empagliflozina con metformina y sulfonilurea: Un total de 666 pacientes con diabetes mellitus tipo 2 participaron en un ensayo doble ciego controlado con placebo para evaluar la eficacia de empagliflozina en combinación con metformina más una sulfonilurea.
Pacientes con diabetes mellitus tipo 2 no controlada adecuadamente con al menos 1,500 mg por día de clorhidrato de metformina y con una sulfonilurea, ingresaron a un período de preinclusión abierto de dos semanas con placebo. Al final del período de preinclusión, los pacientes que seguían sin un control adecuado y tenían una HbA1c entre el 7 % y 10 % fueron aleatorizados para recibir placebo, 10 mg de empagliflozina o 25 mg de empagliflozina.
El tratamiento con empagliflozina 10 mg o 25 mg diarios produjo reducciones estadísticamente significativas en HbA1c (valor de p < 0.0001), FPG y peso corporal en comparación con el placebo (consulte la Tabla 9).
Tabla 9. Resultados en la semana 24 de un ensayo controlado con placebo para empagliflozina en combinación con metformina y sulfonilurea
|
Empagliflozina 10 mg N = 225 |
Empagliflozina N = 216 |
Placebo N = 225 |
|
|
HbA1c ( %)a |
|||
|
Inicial (media) |
8.1 |
8.1 |
8.2 |
|
Cambio desde el inicio (media ajustada) |
-0.8 |
-0.8 |
-0.2 |
|
Diferencia con el placebo (media ajustada) (IC 95 %) |
-0.6b (-0.8,-0.5) |
-0.6b (-0.7,-0.4) |
-- |
|
Pacientes [n (%)] que lograron HbA1c <7 % |
55 (26 %) |
65 (32 %) |
20 (9 %) |
|
GPA (mg/dL)c |
|||
|
Inicial (media) |
151 |
156 |
152 |
|
Cambio desde el inicio (media ajustada) |
-23 |
-23 |
6 |
|
Diferencia respecto al placebo (media ajustada) |
-29 |
-29 |
-- |
|
Peso corporal |
|||
|
Media basal en kg |
77 |
78 |
76 |
|
% de cambio desde el inicio (media ajustada) |
-2.9 |
-3.2 |
-0.5 |
|
Diferencia con el placebo (media ajustada) (IC 95 %) |
-2.4b (-3.0,-1.8) |
-2.7b (-3.3,-2.1) |
-- |
a Población por intención de tratar modificada. Se utilizó la última observación del ensayo (LOCF) para imputar los datos faltantes en la semana 24. En la semana 24 se imputó el 17.8 %, el 16.7 % y el 25.3 % de los pacientes aleatorizados a empagliflozina 10 mg, empagliflozina 25 mg y placebo, respectivamente.
b Valor de p de ANCOVA <0.0001 (HbA1c: el modelo ANCOVA incluye la HbA1c inicial, el tratamiento, la función renal y la región. Peso corporal y GPA: se usa el mismo modelo que para la HbA1c, pero además incluye el peso corporal inicial/GPA inicial, respectivamente).
c GPA (mg/dL); para empagliflozina 10 mg, n = 225, para empagliflozina 25 mg, n = 215, para placebo, n = 224.
Ensayo con control activo frente a glimepirida en combinación con metformina: La eficacia de la empagliflozina se evaluó en un ensayo doble ciego controlado con glimepirida en 1,545 pacientes con diabetes mellitus tipo 2 con control glucémico insuficiente a pesar del tratamiento con metformina.
Los pacientes con un control glucémico inadecuado y una HbA1c entre 7 % y 10 % después de un período de preinclusión de 2 semanas fueron aleatorizados para recibir glimepirida o empagliflozina 25 mg .
En la semana 52, 25 mg de empagliflozina y glimepirida redujeron la HbA1c y la FPG (consulte Tabla 10, Figura 3). La diferencia en el tamaño del efecto observado entre 25 mg de empagliflozina y la glimepirida excluyó el margen de no inferioridad preespecificado de 0.3 %. La dosis diaria promedio de glimepirida fue de 2.7 mg y la dosis máxima aprobada en los Estados Unidos es de 8 mg por día.
Tabla 10. Resultados en la semana 52 de un ensayo controlado con un activo que comparó la empagliflozina con la glimepirida como terapia complementaria en pacientes no controlados adecuadamente con metformina
|
Empagliflozina 25 mg N = 765 |
Glimepirida N = 780 |
|
|
HbA1c( %)ª |
||
|
Inicial (media) |
7.9 |
7.9 |
|
Cambio desde el inicio (media ajustada) |
-0.7 |
-0.7 |
|
Diferencia respecto a la glimepirida (media ajustada) (IC 97,5 %) |
-0.07b (-0.15, -0.01) |
-- |
|
GPA (mg/dL)d |
||
|
Inicial (media) |
150 |
150 |
|
Cambio desde el inicio (media ajustada) |
-19 |
-9 |
|
Diferencia respcto a la glimepirida (media ajustada) |
-11 |
-- |
|
Peso corporal |
||
|
Media basal en kg |
82.5 |
83 |
|
% de cambio desde el inicio (media ajustada) |
-3.9 |
-2.0 |
|
Diferencia respecto a la glimepirida (media ajustada) (IC 95 %) |
-5.9c (-6.3,-5.5) |
-- |
a Población por intención de tratar modificada. Se utilizó la última observación del ensayo (LOCF) para imputar los datos que faltaban en la semana 52. En la semana 52 se imputaron los datos del 15.3 % y el 21.9 % de los pacientes aleatorizados a empagliflozina 25 mg y glimepirida, respectivamente.
b No inferior, valor de p del modelo ANCOVA <0,0001 (HbA1c: el modelo ANCOVA incluye la HbA1c inicial, el tratamiento, la función renal y la región)
c Valor de p de ANCOVA <0.0001 (Peso corporal y GPA: se usa el mismo modelo que para HbA1c, pero además incluye el peso corporal inicial/GPA inicial, respectivamente).
d GPA (mg/dL); para empagliflozina 25 mg, n = 764, para glimepirida, n = 779.
Figura 3. Cambio promedio ajustado de HbA1c en cada tiempo (sujetos que completaron el estudio) y en la semana 52 (población mITT)-LOCF
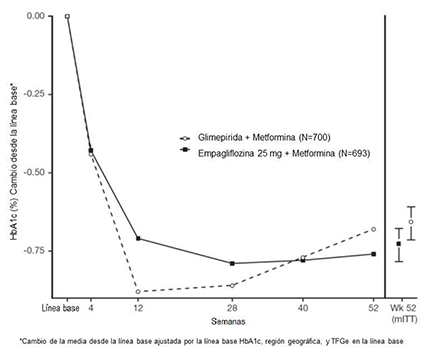
En la semana 52, el cambio promedio ajustado desde el inicio en la presión arterial sistólica fue de -3.6 mmHg, en comparación con 2.2 mmHg para glimepirida. Las diferencias entre los grupos de tratamiento para la presión arterial sistólica fueron estadísticamente significativas (valor de p <0.0001).
En la semana 104, el cambio promedio ajustado desde el inicio en HbA1c fue -0.75 % para empagliflozina 25 mg y -0.66 % para glimepirida. La diferencia media ajustada del tratamiento fue de -0.09 % con un intervalo de confianza al 97.5 % de (-0.32 %, 0.15 %), excluyendo el margen de no inferioridad preespecificado de 0.3 %. La dosis diaria promedio de glimepirida fue de 2.7 mg y la dosis máxima aprobada en los Estados Unidos es de 8 mg por día. El análisis de la semana 104 incluyó datos con y sin medicación de rescate glucémico concomitante, así como datos sin tratamiento. Los datos que faltaban para los pacientes que no proporcionaron ninguna información en la visita se imputaron en función de los datos observados sin tratamiento. En este análisis de imputación múltiple, el 13.9 % de los datos se imputaron para empagliflozina 25 mg y el 12.9 % para glimepirida.
En la semana 104, 25 mg diarios de empagliflozina dieron como resultado una diferencia estadísticamente significativa en el cambio desde el inicio para el peso corporal en comparación con glimepirida (-3.1 kg para 25 mg de empagliflozina frente a +1.3 kg para glimepirida; ANCOVA-LOCF, valor de p <0.0001).
Ensayos del control glucémico en pacientes pediátricos con diabetes mellitus tipo 2:
Ensayo de control glucémico con empagliflozina en pacientes pediátricos de 10 a 17 años con diabetes mellitus tipo 2: DINAMO (NCT03429543) fue un ensayo doble ciego, aleatorizado, controlado con placebo, de grupos paralelos, de 26 semanas de duración, con un periodo de extensión de la seguridad del tratamiento activo doble ciego de 52 semanas para evaluar la eficacia de la empagliflozina. En el ensayo participaron pacientes pediátricos con edad de 10 a 17 años con diabetes mellitus tipo 2 controlada inadecuadamente (HbA1c de 6.5 a 10.5 %). Se inscribió a pacientes tratados con metformina (al menos 1,000 mg diarios o la dosis máxima tolerada), con o sin tratamiento con insulina, y aquellos con antecedentes de intolerancia al tratamiento con metformina. Los pacientes fueron asignados aleatoriamente a 3 grupos de tratamiento (empagliflozina 10 mg, un inhibidor de la dipeptidil peptidase-4 (DPP-4) o placebo) durante 26 semanas. Los pacientes en el grupo de 10 mg de empagliflozina que no alcanzaron una HbA1c < 7.0 % en la semana 12 fueron sometidos a una segunda aleatorización en la semana 14 para permanecer con la dosis de 10 mg o aumentarla a 25 mg. Los pacientes que recibieron placebo fueron aleatorizados nuevamente en la semana 26 a una de las dosis de empagliflozina (10 mg o 25 mg) o al inhibidor de la DPP-4.
Se trató a un total de 157 pacientes ya sea con empagliflozina (10 mg o 25 mg; N = 52), un inhibidor de la DPP-4 (N = 52), o placebo (N = 53). Los tratamientos base como complemento a la dieta y el ejercicio incluyeron metformina (51 %), una combinación de metformina e insulina (40.1 %), insulina (3.2 %) o ninguna (5.7 %). La media de la HbA1c al inicio del estudio fue de 8.0 % y la media de la duración de la diabetes mellitus tipo 2 fue de 2.1 años. La media de la edad fue de 14.5 años (intervalo: 10-17 años) y 51.6 % tenían una edad de 15 años y mayores. Aproximadamente, 50 % eran blancos, 6 % eran asiáticos, 31 % eran negros o afroamericanos y 38 % eran hispanos o latinos. La media del IMC fue de 36.0 kg/m2 y la media de la puntuación Z del IMC fue de 3.0. Los pacientes con una TFGe menor que 60 mL/min/1.73 m2 no participaron en el ensayo. Cerca del 25 % de la población del ensayo tenía microalbuminuria o macroalbuminuria.
En la semana 26, el tratamiento con empagliflozina fue superior en la reducción de la HbA1c desde el valor inicial frente al placebo (consultar la tabla 11).
Tabla 11. Resultados en la semana 26 de un ensayo controlado con placebo para la empagliflozina en combinación con metformina y/o insulina o como monoterapia en pacientes pediátricos con edad de 10 a 17 años con diabetes mellitus tipo 2ª
|
Empagliflozina 10 mg y 25 mg |
Placebo |
|
|
HbA1c(%)b |
||
|
Número de pacientes |
n=52 |
n=53 |
|
Valor inicial (media) |
8.0 |
8.1 |
|
Cambio desde el inicio |
-0.2 |
0.7 |
|
Diferencia respecto al placeboc (IC 95 %) |
-0.8e (-1.5, -0.2) |
-- |
|
GPA (mg/dL)b,c |
||
|
Número de pacientes |
n=48 |
n=52 |
|
Valor inicial (media) |
154 |
159 |
|
Cambio desde el inicio |
-19 |
17 |
|
Diferencia respecto al placeboc (IC 95 %) |
-36 (-60.7, -10.7) |
-- |
a Conjunto modificado de intención de tratar (todos los pacientes aleatorizados y tratados con medición al inicio del ensayo).
b Imputaciones múltiples utilizando el enfoque de reposo farmacológico de placebo con 500 iteraciones para los datos faltantes. Imputados para la HbA1c (empagliflozina N=5 (9.6 %), placebo N=3 (5.7 %)), para la GPA (empagliflozina N=4 [8.3 %], placebo N=2 (3.8 %)).
c Media de mínimos cuadrados del análisis de covarianza (ANCOVA) ajustado por el valor inicial y estrato de edad al inicio del ensayo (<15 años vs. 15 a <18 años).
d No se evaluó en cuanto a la significancia estadística, no forma parte del procedimiento de pruebas secuenciales.
e Valor de p = 0.0116 (bilateral).
Ensayo de control glucémico de metformina HCl de liberación inmediata en pacientes pediátricos con edad de 10 a 16 años con diabetes mellitus tipo 2: Se realizó un ensayo doble ciego y controlado con placebo en pacientes pediátricos con edad de 10 a 16 años con diabetes mellitus tipo 2 (media de la GPA 182.2 mg/dL), en el que los pacientes fueron tratados con tabletas de liberación inmediata de metformina HCl (hasta 2,000 mg/día) durante un máximo de 16 semanas (11 meses de duración media del tratamiento). Los resultados se presentan en la tabla 12.
Tabla 12. Promedio del cambio de la glucosa plasmática en ayunas en la semana 16 comparando la metformina HCl contra al placebo en pacientes pediátricos con diabetes mellitus tipo 2
|
Metformina HCl |
Placebo |
Valor de p |
|
|
GPA (mg/dL) |
n = 37 |
(n = 36) |
|
|
Inicial |
162.4 |
192.3 |
|
|
Cambio en la VISITA FINAL |
-42.9 |
21.4 |
< 0.001 |
a Media de edad de los pacientes pediátricos: 13.8 años (intervalo 10-16 años)
La media del peso corporal al inicio del ensayo fue de 93 kg (205 lb) y 86 kg (189 lb) en los grupos de metformina HCl de liberación inmediata y de placebo, respectivamente. La media del cambio en el peso corporal desde el inicio hasta la semana 16 fue de -1.5 kg (-3.3 lb) y -0.9 kg (-2.0 lb) en los grupos de metformina HCl y placebo, respectivamente.
Ensayo de resultados cardiovasculares de empagliflozina en pacientes adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular aterosclerótica:
El estudio EMPA-REG OUTCOME, fue un ensayo de grupos paralelos, multicéntrico, multinacional, aleatorizado, doble ciego, que comparó el riesgo de experimentar un evento cardiovascular adverso mayor (MACE) entre empagliflozina y un placebo cuando éstos se agregaron y se usaron concomitantemente con tratamientos estándar de atención para diabetes mellitus y enfermedad cardiovascular (CV) aterosclerótica. Los medicamentos antidiabéticos concomitantes debían mantenerse estables durante las primeras 12 semanas del ensayo. Posteriormente, las terapias antidiabéticas y ateroscleróticas podrían ajustarse, a criterio de los investigadores, para garantizar que los participantes fueran tratados de acuerdo con la atención estándar para estas enfermedades.
Se trató un total de 7,020 pacientes (empagliflozina 10 mg = 2,345; empagliflozina 25 mg = 2,342; placebo = 2,333) y el seguimiento de estos pacientes se llevó a cabo durante un tiempo mediano de 3.1 años. Aproximadamente, el 72 % de la población del ensayo era blanca, el 22 % era asiática y el 5 % era negra o afroamericana. La edad promedio fue de 63 años y aproximadamente el 72 % eran hombres.
Al inicio del ensayo, todos los pacientes tenían diabetes mellitus tipo 2 no controlada adecuadamente (HbA1c mayor o igual al 7 %). La HbA1c promedio al inicio del estudio fue del 8.1 %, y el 57 % de los participantes tenían diabetes mellitus durante más de 10 años. Aproximadamente el 31 %, el 22 % y el 20 % informaron a los investigadores antecedentes de neuropatía, retinopatía y nefropatía, respectivamente, y la TFGe promedio fue de 74 mL/min/1.73 m2. Al inicio del estudio, los pacientes fueron tratados con uno (~30 %) o más (~70 %) medicamentos antidiabéticos, incluidos metformina (74 %), insulina (48 %) y sulfonilurea (43 %).
Al inicio del estudio todos, los pacientes tenían enfermedad CV aterosclerótica establecida, incluido uno (82 %) o más (18 %) de los siguientes: antecedentes documentados de enfermedad arterial coronaria (76 %), accidente cerebrovascular (23 %) o enfermedad arterial periférica (21 %). Al inicio del estudio, la presión arterial sistólica media fue de 136 mmHg, la presión arterial diastólica media fue de 76 mmHg, la LDL media fue de 86 mg/dL, la HDL media fue de 44 mg/dL y el cociente promedio de albúmina/creatinina en orina (UACR) fue de 175 mg/g. Al inicio del estudio, aproximadamente 81 % de los pacientes fueron tratados con inhibidores del sistema renina angiotensina, 65 % con bloqueadores beta, 43 % con diuréticos, 77 % con estatinas y 86 % con agentes antiplaquetarios (principalmente aspirina).
El criterio de valoración principal en EMPA-REG OUTCOME fue el tiempo transcurrido hasta la primera aparición de un evento cardíaco adverso mayor (MACE). Un evento cardíaco adverso mayor se definió como la ocurrencia de una muerte CV o un infarto de miocardio (IM) no mortal o un accidente cerebrovascular no mortal. El plan de análisis estadístico había especificado previamente que las dosis de 10 y 25 mg se combinarían. Se utilizó un modelo de riesgos proporcionales de Cox para evaluar la no inferioridad frente al margen de riesgo preespecificado de 1.3 para el cociente de riesgos instantáneos (hazard ratio, HR) de MACE y la superioridad sobre MACE si se demostraba la no inferioridad. El error de tipo 1 se controló en múltiples pruebas utilizando una estrategia de pruebas jerárquicas.
La empagliflozina redujo significativamente el riesgo de la primera aparición del criterio principal de valoración compuesto de muerte CV, infarto de miocardio no mortal o accidente cerebrovascular no mortal (HR: 0.86; IC 95 %: 0.74, 0.99). El efecto del tratamiento se debió a una reducción significativa del riesgo de muerte CV en sujetos aleatorizados a empagliflozina (HR: 0.62; IC 95 %: 0.49, 0.77), sin cambio en el riesgo de infarto de miocardio no mortal o accidente cerebrovascular no mortal (consulte la Tabla 13 y las Figuras 4 y 5). Los resultados de las dosis de 10 mg y 25 mg de empagliflozina fueron consistentes con los resultados de los grupos de dosis combinadas.
Tabla 13. Efecto del tratamiento para el criterio principal de valoración compuesto y sus componentesa
|
Placebo N=2,333 |
Empagliflozina N=4,687 |
Cociente de riesgos instantáneos vs. placebo (95 % IC) |
|
|
Compuesto de muerte CV, infarto de miocardio no mortal, accidente cerebrovascular no mortal (tiempo hasta la primera aparición)b |
282 (12.1 %) |
490 (10.5 %) |
0.86 (0.74, 0.99) |
|
Infarto de miocardio no mortalc |
121 (5.2 %) |
213 (4.5 %) |
0.87 (0.70, 1.09) |
|
Accidente cerebrovascular no mortalc |
60 (2.6 %) |
150 (3.2 %) |
1.24 (0.92, 1.67) |
|
Muerte CVc |
137 (5.9 %) |
172 (3.7 %) |
0.62 (0.49, 0.77) |
a Conjunto tratado (pacientes que habían recibido al menos una dosis del fármaco del estudio).
b Valor de p para la superioridad (bilateral) 0.04.
c Número total de eventos.
Figura 4. Incidencia acumulada estimada del primer MACE
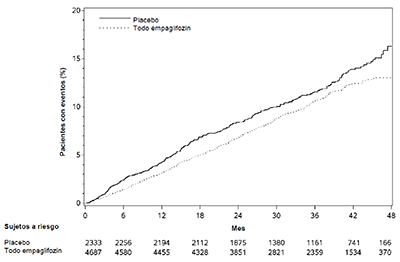
Figura 5. Incidencia acumulada estimada de muerte CV
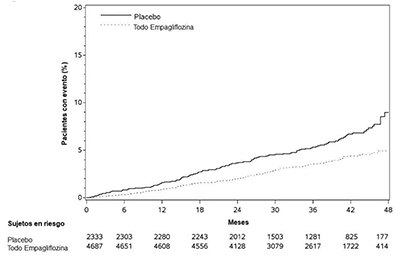
La eficacia de la empagliflozina sobre la muerte CV generalmente fue consistente en los principales subgrupos demográficos y de enfermedades.
El estado vital se obtuvo para el 99.2 % de los sujetos en el ensayo. Se registraron un total de 463 muertes durante el ensayo EMPA-REG OUTCOME. La mayoría de estas muertes se clasificaron como muertes CV. Las muertes no CV fueron solo una pequeña proporción de las muertes y se equilibraron entre los grupos de tratamiento (2.1 % de los pacientes tratados con empagliflozina y 2.4 % de los pacientes tratados con placebo).
Ensayos de insuficiencia cardíaca con empagliflozina, incluidos pacientes adultos con diabetes mellitus tipo 2:
Ensayo EMPEROR-Reduced (insuficiencia cardíaca crónica con fracción de eyección del ventrículo izquierdo ≤40 %): EMPEROR-Reduced (NCT03057977) fue un ensayo doble ciego realizado en adultos con insuficiencia cardíaca crónica (clase funcional II-IV de la New York Heart Association [NYHA]) con fracción de eyección del ventrículo izquierdo (FEVI) ≤ 40 % para evaluar la eficacia de la empagliflozina como complemento de la terapia de atención estándar para la insuficiencia cardíaca. De 3,730 pacientes, 1,863 fueron aleatorizados para recibir 10 mg de empagliflozina una vez al día, y 1,867 fueron aleatorizados para recibir un placebo una vez al día, y fueron seguidos durante una mediana de 16 meses.
Características de la enfermedad y datos demográficos al inicio del estudio: EMPEROR-Reduced incluyó pacientes con diabetes mellitus tipo 2 (n = 1,856) y pacientes sin diabetes mellitus tipo 2 (n = 1,874). La media de la edad de la población del ensayo fue de 67 años (intervalo: 25 a 94 años) y el 76 % eran hombres, el 24 % eran mujeres y el 27 % tenían 75 años o más. Aproximadamente el 71 % de la población del ensayo eran blancos, el 18 % asiáticos y el 7 % negros o afroamericanos. En el momento de la aleatorización, el 75 % de los pacientes estaban clasificados en la clase II de la NYHA, el 24 % en la clase III y el 0.5 % en la clase IV. La FEVI promedio fue del 28 %. Al inicio del estudio, la TFGe promedio fue de 62 mL/min/1.73 m2 y el cociente mediano de albúmina/creatinina en orina (UACR) fue de 22 mg/g. Aproximadamente la mitad de los pacientes (52 %) tenía una TFGe igual o superior a 60 mL/min/1.73 m2, el 24 % tenía una TFGe de 45 a menos de 60 mL/min/1.73 m2 y el 19 % tenía una TFGe de 30 a menos de 45 mL/min/1.73 m2. Al inicio del estudio, 88 % de los pacientes fueron tratados con inhibidores de la enzima convertidora de angiotensina (ECA), bloqueadores de los receptores de angiotensina (ARB) o inhibidores de los receptores de neprilisina y angiotensina (ARNI), 95 % con beta bloqueadores, 71 % con antagonistas de los receptores de mineralocorticoides (MRA), y 95 % con diuréticos.
En EMPEROR-Reduced, el historial de diabetes mellitus tipo 2 estuvo presente en 50 % de los pacientes, y 46 % de estos pacientes fueron tratados con metformina (444 pacientes en el grupo de empagliflozina y 418 en el grupo del placebo), y 25 % fueron tratados con insulina. En la subpoblación de diabetes mellitus tipo 2, la edad promedio fue de 67 años; el 77 % eran hombres; 69 % blancos, 19 % asiáticos y 7 % negros o afroamericanos; 32 % eran hispanos/latinos. En la subpoblación de diabetes mellitus tipo 2, al inicio del estudio, 71 % de los pacientes fueron clasificados como clase II de la NYHA, 28 % como clase III y 0.7 % como clase IV; la FEVI promedio fue del 27 %; la TFGe promedio al inicio del estudio fue de 61 mL/min/1.73 m2. En esta subpoblación, al inicio del estudio 88 % de los pacientes fueron tratados con inhibidores de la ECA, ARB o ARNI, 95 % con bloqueadores beta, 70 % con MRA y 96 % con diuréticos.
Resultados: En EMPEROR-Reduced, 10 mg de empagliflozina, en comparación con el placebo, redujeron el riesgo del criterio principal de valoración compuesto de muerte CV u hospitalización por insuficiencia cardíaca (HIC), principalmente a través de una reducción de la HIC (HR 0.75 [IC 95 %: 0.65, 0.86]). La empagliflozina redujo el riesgo de HIC inicial y recurrente, un criterio de valoración secundario clave. Debido al componente metformina, JARDIANZ® DUO no está indicado para su uso en pacientes con insuficiencia cardíaca sin diabetes mellitus tipo 2 [consulte Indicaciones y uso].
El efecto de la empagliflozina en la reducción del riesgo del criterio principal de valoración compuesto fue consistente en los pacientes con diabetes mellitus tipo 2 (HR 0.73 [IC 95 %: 0.60, 0.87]) y en los pacientes con diabetes mellitus tipo 2 y metformina como tratamiento de base (HR 0.65 [IC 95 %: 0.49; 0.86]).
Ensayo EMPEROR-Preserved (insuficiencia cardíaca crónica con fracción de eyección del ventrículo izquierdo >40 %):
EMPEROR-Preserved (NCT03057951) fue un ensayo doble ciego realizado en pacientes con insuficiencia cardíaca crónica Clase II-IV de la NYHA con FEVI > 40 % para evaluar la eficacia de la empagliflozina como complemento del tratamiento estándar. De 5,988 pacientes, 2,997 pacientes fueron aleatorizados para recibir 10 mg de empagliflozina una vez al día. Y 2,991 pacientes fueron aleatorizados para recibir un placebo una vez al día, y fueron seguidos durante una mediana de 26 meses.
Características de la enfermedad y datos demográficos al inicio de estudio: EMPEROR-Preserved incluyó pacientes con diabetes mellitus tipo 2 (n = 2,928) y pacientes sin diabetes mellitus tipo 2 (n = 3,060). La media de la edad de la población del ensayo fue de 72 años (intervalo: 22 a 100 años) y el 55 % eran hombres, el 45 % eran mujeres y el 43 % tenían 75 años o más. Aproximadamente el 76 % de la población del estudio eran blancos, el 14 % asiáticos y el 4 % negros o afroamericanos. En el momento de la aleatorización, el 82 % de los pacientes eran de la clase II de la NYHA, el 18 % de la clase III y el 0.3 % de la clase IV. Este ensayo incluyó pacientes con una FEVI < 50 % (33.1 %), con una FEVI de 50 a < 60 % (34.4 %) y una FEVI ≥ 60 % (32.5 %). Al inicio del estudio, la TFGe promedio fue de 61 mL/min/1.73 m2 y el cociente mediano de albúmina/creatinina en orina (UACR) fue de 21 mg/g. Aproximadamente la mitad de los pacientes (50 %) tenía una TFGe igual o superior a 60 mL/min/1.73 m2, el 26 % tenía una TFGe de 45 a menos de 60 mL/min/1.73 m2 y el 19 % tenía una TFGe de 30 a menos de 45 mL/min/1.73 m2. Al inicio del estudio, el 81 % de los pacientes fueron tratados con inhibidores de la ECA, ARB o ARNI, el 86 % con bloqueadores beta, el 38 % con ARM y el 86 % con diuréticos.
En EMPEROR-Preserved, el historial de diabetes mellitus tipo 2 estuvo presente en el 49 % de los pacientes, y el 54 % de estos pacientes fueron tratados con metformina (773 pacientes en el grupo de empagliflozina y 803 en el grupo del placebo) y el 29 % fueron tratados con insulina. En la subpoblación de diabetes mellitus tipo 2, la edad promedio fue de 71 años, el 57 % eran hombres, el 75 % blancos, el 13 % asiáticos y el 5 % negros o afroamericanos.
En la subpoblación de diabetes mellitus tipo 2, al inicio del estudio, el 79 % de los pacientes se clasificaron como clase II de la NYHA, el 20 % como clase III y el 0.2 % como clase IV; el ensayo también incluyó pacientes con diabetes mellitus tipo 2 con FEVI < 50 % (35 %), con FEVI de 50 a < 60 % (34 %) y con FEVI ≥ 60 % (31 %). Para esta subpoblación, la TFGe promedio al inicio del estudio fue de 60 mL/min/1.73 m2; y al inicio del estudio, el 83 % de los pacientes fueron tratados con inhibidores de la ECA, ARB o ARNI, el 88 % con bloqueadores beta, el 39 % con MRA y el 89 % con diuréticos.
Resultados: En EMPEROR-Preserved, 10 mg de empagliflozina, en comparación con el placebo, redujeron el riesgo del criterio principal de valoración compuesto (tiempo hasta el primer evento de muerte CV o HIC) principalmente a través de una reducción de la hospitalización por insuficiencia cardíaca (HR 0.79 [IC 95 %: 0.69, 0.90]). La empagliflozina redujo el riesgo de HIC por primera vez y recurrente, un criterio de valoración secundario clave. Debido al componente metformina, JARDIANZ® DUO no está indicado para su uso en pacientes con insuficiencia cardíaca sin diabetes mellitus tipo 2 [consulte Indicaciones y uso].
El efecto de la empagliflozina en la reducción del riesgo del criterio principal de valoración compuesto fue consistente en los pacientes con diabetes mellitus tipo 2 (HR 0.80 [IC 95 %: 0.67, 0.95]) y en los pacientes con diabetes mellitus tipo 2 y metformina como tratamiento de base (HR 0.79 [IC 95 %: 0.61, 1.02]).
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dosificación y administración:
Análisis antes del inicio del tratamiento con JARDIANZ® DUO:
• Evalúe la función renal antes de iniciar el tratamiento con JARDIANZ® DUO y según esté clínicamente indicado [consulte Advertencias y precauciones (Acidosis láctica, Hipovolemia)].
• En pacientes con hipovolemia, evalúe el estatus del volumen y corrija esta afección antes de iniciar el tratamiento con JARDIANZ® DUO [consulte Advertencias y precauciones (Hipovolemia) y Uso en poblaciones específicas (Uso geriátrico, Insuficiencia renal)].
Dosificación y administración de JARDIANZ® DUO recomendada en adultos:
• Cuando se cambia a JARDIANZ® DUO de:
- Metformina HCl: Inicie JARDIANZ® DUO a una dosis diaria total similar de Metformina HCl y una dosis diaria total de 10 mg de empagliflozina.
- Empagliflozina: Inicie JARDIANZ® DUO a la misma dosis diaria total de empagliflozina y una dosis diaria total de 1,000 mg de Metformina HCl.
- Empagliflozina y Metformina HCl: Inicie JARDIANZ® DUO a las mismas dosis diarias totales de cada componente.
• Dosificación recomendada de JARDIANZ® DUO:
- La dosis diaria total recomendada de empagliflozina es de 10 mg.
- Para un control glucémico adicional, la empagliflozina se puede aumentar hasta una dosis diaria total máxima de 25 mg en pacientes que toleren 10 mg diarios, y la metformina se puede aumentar hasta una dosis diaria total máxima de 2,000 mg, con un aumento gradual para reducir las reacciones adversas gastrointestinales con metformina [consulte Reacciones adversas (Experiencia en ensayos clínicos)].
• Tome JARDIANZ® DUO por vía oral dos veces al día con las comidas.
Dosificación y administración de JARDIANZ® DUO recomendada en pacientes pediátricos de 10 años y mayores:
• Individualice la dosificación de JARDIANZ® DUO con base en el régimen actual del paciente.
• Monitoree la eficacia y la tolerabilidad, y ajuste la dosificación según sea apropiado, sin exceder la dosificación diaria total máxima de 25 mg de empagliflozina y 2,000 mg de metformina HCl.
• Tome JARDIANZ® DUO por vía oral dos veces al día con las comidas, con un aumento gradual de la dosis para reducir las reacciones adversas gastrointestinales con la metformina [consulte Reacciones adversas (Experiencia en ensayos clínicos)].
Recomendaciones de dosificación en pacientes con insuficiencia renal:
• No se recomienda iniciar el tratamiento con JARDIANZ® DUO en pacientes con una TFGe inferior a 45 mL/min/1.73 m2, debido al componente metformina.
• JARDIANZ® DUO está contraindicado en pacientes con una TFGe inferior a 30 mL/min/1.73 m2 o en pacientes en diálisis [consulte Contraindicaciones, Advertencias y precauciones (Acidosis láctica) y Uso en poblaciones específicas (Insuficiencia renal)].
Interrupción por procedimientos de imágenes de contraste yodado:
Suspenda el tratamiento con JARDIANZ® DUO en el momento o antes de un procedimiento de obtención de imágenes con contraste yodado en pacientes con una TFGe menor a 60 mL/min/1.73 m2; en pacientes con antecedentes de enfermedad hepática, alcoholismo o insuficiencia cardíaca; o en pacientes a los que se les administrará contraste yodado intraarterial. Vuelva a evaluar la TFGe 48 horas después del procedimiento de imagen; reinicie el tratamiento con JARDIANZ® DUO si la función renal es estable [consulte Advertencias y precauciones (Acidosis láctica)].
Interrupción temporal para una cirugía: Suspenda la administración de JARDIANZ® DUO al menos 3 días, si es posible, antes de una cirugía mayor o procedimientos asociados con el ayuno prolongado. Reinicie la administración de JARDIANZ® DUO cuando el paciente esté clínicamente estable y haya reiniciado la ingesta oral [consulte Advertencias y precauciones (Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis) y Farmacología clínica (Farmacodinámica)].
Recomendaciones sobre una dosis olvidada:
• Si se olvida tomar una dosis, indíquele al paciente que la tome lo antes posible.
• No duplique la dosis en la siguiente toma.
Formas de dosificación y concentraciones:
JARDIANZ® DUO Tabletas:
|
Concentración de empagliflozina |
Concentración de metformina HCI |
Color/Forma |
Marcas en las tabletas |
|
5 mg |
850 mg |
Tableta recubierta, de color amarillo pálido, ovalada, biconvexa |
Símbolo de la empresa Boehringer Ingelheim y “S5” grabado en un lado; el otro lado está grabado con “850” |
|
12.5 mg |
850 mg |
Tableta recubierta, de color rosa pálido, ovalada, biconvexa |
Símbolo de la empresa Boehringer Ingelheim y “S12” grabado en un lado; el otro lado está grabado con “850” |
|
12.5 mg |
1,000 mg |
Tableta recubierta, de color púrpura parduzco oscuro, ovalada, biconvexa |
Símbolo de la empresa Boehringer Ingelheim y “S12” grabado en un lado; el otro lado está grabado con “1000” |
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis: En caso de sobredosis con JARDIANZ® DUO, comuníquese con las autoridades locales.
Han ocurrido sobredosis de metformina HC1, incluyendo la ingestión de cantidades superiores a 50 gramos. Se ha informado acidosis láctica en aproximadamente el 32 % de los casos de sobredosis de metformina [consulte Advertencias y precauciones (Acidosis láctica)]. La metformina es dializable con una depuración de hasta 170 mL/min en buenas condiciones hemodinámicas. Por lo tanto, la hemodiálisis puede ser útil para eliminar el fármaco acumulado en pacientes en quienes se sospecha una sobredosis de metformina.
No se ha estudiado la eliminación de empagliflozina por hemodiálisis.
DESCRIPCIÓN:
Las tabletas de JARDIANZ® DUO para uso oral contienen: Empagliflozina y metformina HC1.
Empagliflozina: La empagliflozina es un inhibidor del (SGLT2).
El nombre químico de la empagliflozina es D-Glucitol,1,5-anhidro-1-C-[4-cloro-3-[[4-[[(3S)-tetrahidro-3-furanil]oxi]fenil]metil]fenilo]-, (1S).
Su fórmula molecular es C23H27ClO7 y el peso molecular es 450.91. La fórmula estructural es:

La empagliflozina es un polvo no higroscópico de color blanco a amarillento. Es muy poco soluble en agua, escasamente soluble en metanol, ligeramente soluble en etanol y acetonitrilo; soluble en 50 % acetonitrilo/agua y prácticamente insoluble en tolueno.
Metformina HC1: La metformina HC1 (N, N-dimetilimidodicarbonimidica diamida HCI) es una biguanida. La metformina HCI es un compuesto cristalino de color blanco a blanquecino con una fórmula molecular de C4H11N5• HCl y un peso molecular de 165,63. La metformina HCI es fácilmente soluble en agua y casi insoluble en acetona, éter y cloroformo. El pKa de la metformina es 12,4. El pH de una solución acuosa al 1 % de la metformina HCI es 6.68. La fórmula estructural es:

JARDIANZ® DUO:
Las tabletas de JARDIANZ® DUO para administración oral están disponibles en cuatro dosis que contienen:
• 5 mg de empagliflozina y 850 mg metformina HCl (equivalentes a 662.88 mg de metformina),
• 5 mg de empagliflozina y 1,000 mg de metformina HCl (equivalentes a 779.86 mg de metformina),
• 12.5 mg de empagliflozina y 850 mg de metformina HCl (equivalentes a 662.88 mg de metformina),
• 12.5 mg de empagliflozina y 1,000 mg de metformina HCl (equivalentes a 779.86 mg de metformina).
Cada tableta recubierta de JARDIANZ® DUO contiene los siguientes ingredientes inactivos: dióxido de silicio coloidal, copovidona, almidón de maíz y estearato de magnesio. Recubrimiento pelicular: óxido ferroso férrico negro y óxido férrico rojo (12.5 mg/850 mg, 12.5 mg/1,000 mg) u óxido férrico amarillo (5 mg/850 mg, 5 mg/1,000 mg), hipromelosa, polietilenglicol 400, talco y dióxido de titanio.
PRESENTACIÓN:
La disponibilidad de las presentaciones depende de cada país.
Caja con 60 tabletas recubiertas de 5 mg/850 mg, 12.5 mg/850 mg o 12.5 mg/1000mg en blíster e instructivo anexo.
Caja con 7 tabletas recubiertas de 12.5 mg/850 mg o 12.5 mg/1000 mg en blíster e instructivo anexo (muestra médica).
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Recomendaciones para el almacenamiento:
Consérvese a no más de 30 °C.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. No se use en el embarazo, en la lactancia ni en niños menores de 10 años.
Hecho en México por:
BOEHRINGER INGELHEIM PROMECO, S.A. de C.V.
Calle del Maíz No. 49,
Col. Barrio Xaltocan, C.P. 16090,
Xochimilco, Ciudad de México, México
Fecha de revisión de la monografía: Octubre-23
®Marca registrada