
INVEGA
PALIPERIDONA
Comprimidos de liberación prolongada
Frasco de polietileno de alta densidad, Comprimidos de liberación prolongada, 3 Miligramos
Frasco de polietileno de alta densidad, Comprimidos de liberación prolongada, 6 Miligramos
Frasco de polietileno de alta densidad, Comprimidos de liberación prolongada, 9 Miligramos
Frasco de polietileno de alta densidad, Comprimidos de liberación prolongada, 12 Miligramos
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Cada COMPRIMIDO de liberación prolongada contiene 3, 6, 9 o 12 mg de paliperidona.
Los excipientes figuran en la Lista de excipientes.
FORMA FARMACÉUTICA:
3 mg: Comprimido blanco en forma de cápsula con el texto “PAL 3” impreso.
6 mg: Comprimido beige en forma de cápsula con el texto “PAL 6” impreso.
9 mg: Comprimido rosa en forma de cápsula con el texto “PAL 9” impreso.
12 mg: Comprimido amarillo oscuro en forma de cápsula con el texto “PAL 12” impreso.
En INVEGA® se utiliza una tecnología de liberación de fármacos por ósmosis, según la cual la presión osmótica hace que se libere paliperidona de la forma posológica a una velocidad controlada. El sistema, que tiene el aspecto de un comprimido en forma de cápsula, está compuesto de un núcleo de tres capas osmóticamente activo rodeado por una subcubierta y una membrana semipermeable. El núcleo está compuesto de dos capas que contienen el fármaco y los excipientes y de una capa de empuje que contiene componentes osmóticamente activos. En la cúpula de la capa de fármaco del comprimido hay dos orificios horadados con un láser de precisión. El color de la cubierta externa y el texto impreso son distintos para cada dosis. En un medio acuoso, como el tracto gastrointestinal, la cubierta externa de color, dispersable en agua, desaparece rápidamente. Luego el agua pasa a través de la membrana semipermeable, que controla la velocidad a la que el agua entra en el núcleo del comprimido, la cual, a su vez, controla la liberación del fármaco. Los polímeros hidrófilos del núcleo se hidratan y se hinchan, creando un gel que contiene paliperidona, el cual es empujado fuera a través de los orificios del comprimido. Los componentes biológicamente inertes del comprimido, es decir, la cubierta y los componentes insolubles del núcleo, permanecen intactos durante el tránsito por el tracto gastrointestinal y se eliminan por las heces.
INDICACIONES TERAPÉUTICAS: INVEGA® está indicado para el tratamiento de la esquizofrenia en adultos, incluido el tratamiento agudo y la prevención de recurrencias.
INVEGA® está indicado para el tratamiento de esquizofrenia en adolescentes entre 12 -17 años.
INVEGA® está indicado para el tratamiento del trastorno esquizoafectivo como monoterapia y en combinación con antidepresivos y/o estabilizantes del estado de ánimo en adultos.
PROPIEDADES FARMACOLÓGICAS: Paliperidona, el ingrediente activo de INVEGA®, es un agente psicotrópico que pertenece al grupo farmacoterapéutico de los derivados del benzisoxazol (antipsicóticos neurolépticos atípicos, código ATC: N05AX13). INVEGA™ contiene una mezcla racémica de (+)paliperidona y (-)paliperidona.
DATOS FARMACÉUTICOS:
Lista de excipientes: Los ingredientes inactivos de INVEGA® son los siguientes: cera de carnauba, acetato de celulosa, hidroxietil celulosa, propilenglicol, óxidos de polietileno, polietilenglicol, povidona, cloruro sódico, ácido esteárico, hidroxitolueno butilado, hipromelosa, dióxido de titanio y óxidos de hierro. Los comprimidos de 3 mg también contienen monohidrato de lactosa y triacetato de glicerol.
Incompatibilidades: Ninguna.
Período de validez: Vigile la fecha de caducidad señalada en el envase externo.
Precauciones especiales de conservación: No conservar a una temperatura superior a 30 ºC. Proteger de la humedad.
Manténgase fuera del alcance de los niños.
PROPIEDADES FARMACODINÁMICAS:
— Mecanismo de acción: La paliperidona es un antagonista de la dopamina D2 de acción central, con actividad principalmente antagonista de 5-HT2A serotinérgico. La paliperidona también actúa como antagonista en los receptores adrenérgicos a1 y a2, y los receptores histaminérgicos H1. La paliperidona carece de afinidad con los receptores muscarínicos colinérgicos o con los receptores adrenérgicos ß1 y ß2. La actividad farmacológica de los enantiómeros de la paliperidona (+) y (-) es parecida cualitativa y cuantitativamente.
Se desconoce el mecanismo de acción de la paliperidona, al igual que ocurre con otros fármacos eficaces contra la esquizofrenia. No obstante, se ha propuesto que la actividad terapéutica del fármaco en la esquizofrenia se debe a la combinación de su actividad como antagonista de los receptores tipo 2 de la dopamina (D2) y de los receptores tipo 2 de la serotonina (5HT2A). El antagonismo en otros receptores distintos de D2 y 5HT2A podría deberse a alguno de los efectos de la paliperidona.
— Polisomnografía: Los medicamentos que actúan a nivel central pueden afectar al sueño, dependiendo de su mecanismo de acción, del perfil de liberación del fármaco y/o del momento de la administración. Para evaluar los efectos de la administración matutina de INVEGA® sobre la estructura y la continuidad del sueño, se llevó a cabo un estudio controlado con placebo en 36 sujetos con esquizofrenia, en el cual se administró INVEGA® 9 mg o placebo una vez al día durante 14 días. Se registraron los siguientes resultados con INVEGA® (valores medios en comparación con placebo): el tiempo trascurrido desde el período de latencia hasta el sueño persistente disminuyó en 41,0 (EE 18,70) minutos; el tiempo transcurrido desde el período de latencia hasta el inicio del sueño disminuyó en 35,2 (EE 14,99) minutos; el número de despertares tras el inicio del sueño disminuyó en 7,0 (EE 3,88) despertares; el tiempo total de sueño aumentó en 52,8 (EE 24,01) minutos; el tiempo de los períodos de sueño aumentó en 41,7 (EE 18,75) minutos, y el índice de eficiencia del sueño aumentó en un 11,0% (EE 5,00). También hubo una disminución estadísticamente significativa (en comparación con placebo) de 11,9 (EE 4,44) minutos del tiempo del sueño en estadio 1 y un aumento de 50,7 (EE 17,67) minutos del tiempo del sueño en estadio 2. No se observó un efecto clínicamente relevante sobre el sueño en fase REM.
— Electrofisiología: Los efectos de paliperidona sobre el intervalo QT se evaluaron en dos estudios en fase 1 aleatorizados, doble ciego, y multicéntricos, en adultos con esquizofrenia y trastorno esquizoafectivo, y en tres ensayos de eficacia controlados con placebo y con control activo, de 6 semanas de duración y de dosis fija, en adultos con esquizofrenia.
En el primer estudio de fase 1 (n = 141), se dividió a los pacientes en grupos aleatorios y se les administró paliperidona oral de liberación inmediata a diario durante 7 días (ajustada de 4 a 8 mg) o una única dosis de moxifloxacino (400 mg).
Con la dosis de 8 mg una vez al día de paliperidona oral de liberación inmediata (n = 44) se alcanzó un pico de concentración plasmática estacionaria media más de dos veces superior al observado con la dosis máxima recomendada de INVEGA™, de 12 mg (Cmáx ss = 113 y 45 ng/ml, respectivamente). En la corrección del QT derivada en línea del modelo ajustado según el promedio diario (QTcLD), se produjo un aumento medio de 5,5 ms (IC del 90%: 3,66; 7,25) en el grupo tratado con INVEGA™ (n = 44).
En el segundo estudio en fase 1 (n = 109), los sujetos fueron aleatorizados a recibir un placebo, la dosis máxima recomendada de INVEGA™ (12 mg una vez al día), posteriormente titulados a una dosis superior al rango recomendado (18 mg una vez al día), o un control activo perteneciente a la misma clase farmacológica (400 mg de quetiapina dos veces al día). La comparación primaria en este estudio de no inferioridad de 10 días se realizó entre INVEGA™ 12 mg y quetiapina. El cambio medio en los mínimos cuadrados con respecto al QTcLD basal para el tmáx observado de cada individuo resultó ser 5,1 ms menor para INVEGA™ 12 mg (Cmáx media 34 ng/ml), en comparación con 400 mg de quetiapina dos veces al día (Cmáx media 1183 ng/ml) (IC 90%: -9,2; -0,9), cumpliendo el criterio de no inferioridad predefinido de 10 ms. El cambio medio con respecto al QTcLD basal para el tmáx observado de cada individuo resultó ser 2,3 ms menor para 18 mg de INVEGA™ (Cmáx media 53 ng/ml), en comparación con 400 mg de quetiapina dos veces al día (Cmáx media 1.183 ng/ml) (IC 90%: -6,8; 2,3).
Resultó ser 1,5 ms mayor (IC 90%: -3,3; 6,2) para INVEGA™ 12 mg y 8,0 ms mayor (IC 90%: 3,1; 12,9) para quetiapina 400 mg dos veces al día, en comparación con el cambio medio con respecto al QTcLD basal para la mediana del tmáx observado (del fármaco activo en la comparación) en el grupo placebo concurrente. Resultó ser 4,9 ms mayor (IC 90%: -0,5; 10,3) para paliperidona de liberación prolongada 18 mg y 7,5 ms mayor (IC 90%: 2,5; 12,5) para quetiapina 400 mg dos veces al día, en comparación con el cambio medio con respecto al QTcLD basal para la mediana del tmáx observado (del fármaco activo en la comparación) en el grupo placebo concurrente.
Ninguno de los sujetos presentó un cambio con respecto al punto basal de más de 60 ms ni un QTcLD de más de 600 ms en ningún momento durante estos estudios.
En los tres estudios de eficacia con dosis fija se realizaron determinaciones electrocardiográficas (ECG) exhaustivas en 15 ocasiones en días especificados (incluidas las horas en las que se preveía que se había alcanzado la Cmáx), utilizando una metodología normalizada. El aumento medio del QTcLD no superó en ningún momento los 5 ms en ninguno de los grupos de tratamiento, según se desprende del análisis de los datos combinados de 836 sujetos tratados con INVEGA™, 357 tratados con olanzapina y 350 tratados con placebo. Un sujeto del grupo de 12 mg de INVEGA® y un sujeto del grupo de olanzapina presentaron un cambio de más de 60 ms en un punto de evaluación durante estos estudios (aumentos de 62 y 110 ms, respectivamente).
Eficacia clínica:
— Esquizofrenia- adultos: La eficacia de INVEGA® se estableció en 3 ensayos controlados con placebo, doble ciego y de 6 semanas de duración, realizados en sujetos con esquizofrenia según los criterios del DSM-IV. Se incluyó un control activo (olanzapina) para analizar la sensibilidad. Las dosis de INVEGA® fueron de entre 3 y 15 mg una vez al día y diferentes en los tres estudios. La eficacia se evaluó utilizando la escala de los síndromes positivo y negativo (PANSS); el criterio de valoración principal fue la disminución de la puntuación total de la PANSS. Un examen de los subgrupos de la población reveló que no había diferencias en la capacidad de respuesta en función de la edad, la raza o el sexo. Los criterios de valoración secundarios fueron la escala de rendimiento personal y social (PSP) y la escala de impresión clínica global – gravedad (CGI-S). La PSP es una escala validada, valorada por el médico, con la que se determinan cuatro áreas de la función personal y social (las actividades sociales útiles incluyen el trabajo y el estudio, las relaciones personales y sociales, cuidarse así mismo y los comportamientos inquietantes y agresivos). La CGI-S es una evaluación independiente, realizada por el investigador, de la gravedad global de la enfermedad. Según un análisis agrupado de estos tres estudios, todas las dosis de INVEGA® fueron superiores a la de placebo según la PSP y la CGI-S. Además, el efecto sobre la PSP fue distinto de la mejoría de los síntomas según el criterio de valoración principal, la puntuación total de la PANSS. Una evaluación adicional de las extensiones abiertas de estos tres estudios mostró que la administración de INVEGA® en dosis flexibles (de 3 a 15 mg una vez al día) durante un máximo de 52 semanas se asoció a una mejora continua de la PSP.
En un ensayo a largo plazo cuyo objetivo era investigar el mantenimiento del efecto, INVEGA® fue significativamente más eficaz que placebo para mantener el control de los síntomas y retrasar la recurrencia de la esquizofrenia. En este estudio, adultos con esquizofrenia según los criterios de DSM-IV y que permanecieron clínicamente estables con la administración de una dosis establecida de INVEGA® durante un período de 8 semanas de tratamiento abierto (dosis de 3 a 15 mg una vez al día) después de haber sido tratados por un episodio agudo durante las 6 semanas anteriores con INVEGA® (dosis de 3 a 15 mg una vez al día), fueron asignados aleatoriamente, siguiendo un criterio doble ciego para seguir recibiendo INVEGA® en la dosis con la que habían alcanzado la estabilidad o placebo, hasta que presentaran una recurrencia de los síntomas de la esquizofrenia. El ensayo se interrumpió prematuramente por motivos de eficacia, ya que un análisis intermedio demostró que se habían cumplido los criterios predefinidos para la interrupción: el tiempo transcurrido hasta la recurrencia fue significativamente más largo en los pacientes tratados con INVEGA™ que en los tratados con placebo (p = 0,0053).
Según el análisis final (que incluía también a los pacientes incluidos después del punto de corte del análisis intermedio), las tasas de episodios de recurrencias fueron del 22,1% en el grupo de INVEGA® y del 51,5% en el grupo de placebo. Al final de la fase de estabilización abierta, los síntomas de los pacientes habían mejorado significativamente (disminución de la puntuación total de la PANSS de 38 [DE ± 16,03] puntos), pero después de la asignación aleatoria al tratamiento doble ciego, el estado de los pacientes que recibieron placebo se deterioró significativamente más que el de los tratados con INVEGA® (p < 0,001). INVEGA® también fue significativamente más eficaz que placebo para mantener el rendimiento personal y social. Durante la fase doble ciego de este estudio, y según la escala CGI-S, la gravedad global de la psicosis en los pacientes del grupo de placebo aumentó, mientras que los pacientes tratados con INVEGA® permanecieron clínicamente estables.
— Esquizofrenia - adolescentes: La eficacia de INVEGA® en adolescentes con esquizofrenia fue establecido en un estudio randomizado, doble ciego, grupo paralelo, placebo controlado, 6-semanas, usando una dosis fija basada en peso, del grupo de diseño sobre un rango de dosis de 1.5 a 12 mg/día. Los sujetos fueron 12-17 años de edad y cumplen el criterio DSM-IV para esquizofrenia, con confirmación de dosis usando Horario Kiddie para Trastornos Afectivos y Esquizofrenia presente y Versión Lifetime (K-SADS-PL).
Los sujetos elegibles fueron asignados al azar de 1 a 4 grupos tratados: un grupo placebo de o INVEGA® en grupos de dosis baja, media o alta. Las dosis fueron administradas basadas en peso corporal para minimizar el riesgo de exponer a los adolescentes con menor peso a dosis altas de INVEGA®. Los sujetos que pesaron entre 29 kg y menos de 51 kg en la visita inicial fueron asignados al azar para recibir placebo o 1.5 Mg (baja dosis), 3 mg (dosis media) o 12 mg (dosis alta) de INVEGA® diario. La dosificación fue en la mañana a pesar de las comidas.
La eficacia fue evaluada usando PANSS. Este estudio demostró la eficacia de INVEGA® en sujetos adolescentes con esquizofrenia cuando se dan dosis diarias de 3, 6 y 12 mg en grupos de tratamiento basados en peso. La dosis efectiva mínima de INVEGA® en esta población fue de 3 mg/día.
— Trastorno esquizoafectivo: La eficacia de INVEGA® (de 3 a 12 mg una vez al día) en el tratamiento del trastorno esquizoafectivo se estableció en dos ensayos controlado con placebo, de 6 semanas de duración, realizado en adultos (no ancianos) que cumplían los criterios de trastorno esquizoafectivo recogidos en el DSM-IV, con confirmación durante la entrevista clínica estructurada para trastornos DSM-IV. En uno de estos ensayos, se evaluó la eficacia en 203 pacientes asignados a uno de los dos niveles de posología de INVEGA™: 6 mg con opción de reducirlos a 3 mg (n = 105) o 12 mg con opción de reducirlos a 9 mg (n = 98), en ambos casos administrados una vez al día. En el otro estudio, se evaluó la eficacia en 211 sujetos a los que se administraron dosis flexibles de INVEGA™ (3-12 mg una vez al día). En ambos estudios participaron sujetos a los que se administró INVEGA™ como monoterapia o en combinación con antidepresivos y/o estabilizantes del estado de ánimo. Las dosis se administraron por la mañana, con independencia de las comidas. Los estudios se realizaron en los Estados Unidos, en la Europa del Este, en Rusia y en Asia.
La eficacia se evaluó mediante la escala de síntomas positivos y negativos (PANSS), un inventario validado compuesto por diversos elementos y por cinco factores para evaluar los síntomas positivos, los síntomas negativos, los pensamientos desorganizados, la pérdida de control sobre la hostilidad/la excitación, y la ansiedad/depresión.
El grupo con dosis altas de INVEGA™ en el estudio con 2 niveles de posología (12 mg/día con opción de reducirlos a 9 mg/día) y el grupo tratado con INVEGA™ en el estudio con dosis flexibles (entre 3 y 12 mg/día, dosis media de ejemplo de 8,6 mg/día) superaron la puntuación PANSS del grupo tratado con placebo. En el grupo con dosis bajas en el estudio con 2 niveles de posología (6 mg/día con opción de reducirlos a 3 mg/día), no se observaron diferencias significativas en la puntuación PANSS entre el grupo tratado con INVEGA™ y el grupo tratado con placebo.
Según el conjunto de los resultados obtenidos en ambos estudios, INVEGA™ mejoró los síntomas del trastorno esquizoafectivo en el criterio de valoración respecto al placebo cuando se administró como monoterapia o combinado con antidepresivos y/o estabilizantes del estado de ánimo. Un examen de los subgrupos de la población reveló que no había diferencias en la capacidad de respuesta en función del sexo, la edad o el área geográfica. Los datos obtenidos no fueron suficientes para evaluar la diferencia en los efectos según la etnia.
PROPIEDADES FARMACOCINÉTICAS: A menos que se declare de otra manera, la información de farmacocinética presentada en esta sección se basó en la información de estudios en adultos.
La farmacocinética de paliperidona tras la administración de INVEGA® es proporcional a la dosis dentro del rango de dosis clínicas recomendadas (de 3 a 12 mg).
Absorción: Tras la administración de una dosis única de INVEGA®, las concentraciones plasmáticas de paliperidona aumentan de forma continua hasta alcanzar la concentración plasmática máxima (Cmáx) aproximadamente 24 horas después de la administración de la dosis. Con la administración de una vez al día de INVEGA®, las concentraciones de paliperidona en el estado de equilibrio se alcanzan en 4-5 días en la mayoría de los sujetos.
Debido al perfil de liberación de INVEGA®, las fluctuaciones entre la concentración máxima y la mínima son muy pequeñas en comparación con las observadas con risperidona de liberación inmediata. En un estudio en el que se comparó la farmacocinética en el estado de equilibrio tras la administración una vez al día de 12 mg de paliperidona (en comprimidos de liberación prolongada) y de 4 mg de risperidona de liberación inmediata en sujetos con esquizofrenia, los índices de fluctuaciones fueron del 38% con paliperidona de liberación prolongada y del 125% con risperidona de liberación inmediata (véase la Figura 1).
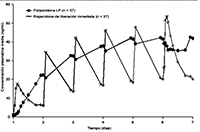
Figura 1. Perfil de las concentraciones en el estado de equilibrio tras la administración de 12 mg de paliperidona en forma de 6 comprimidos de liberación prolongada de 2 mg una vez al día durante 6 días (se muestran las concentraciones de paliperidona) y tras la administración de risperidona de liberación inmediata en dosis de 2 mg una vez al día el día 1 y de 4 mg una vez al día los días 2 al 6 (se muestran las concentraciones de paliperidona + risperidona).
Tras la administración de INVEGA®, los enantiómeros (+) y (-) de paliperidona se convierten el uno en el otro, y el cociente entre AUC (+) y AUC (-) es de aproximadamente 1,6 en el estado de equilibrio. La biodisponibilidad oral absoluta de paliperidona tras la administración de INVEGA® es del 28%.
Tras la administración de un único comprimido de liberación prolongada de 15 mg de paliperidona a sujetos sanos encamados durante 36 horas que recibieron una comida estándar rica en grasas y en calorías, los valores de la Cmáx y el AUC fueron un 42% y un 46% mayores, respectivamente, que los observados con la administración en condiciones de ayuno. En otro estudio realizado en sujetos ambulatorios sanos, los valores de la Cmáx y el AUC de paliperidona tras la administración de un único comprimido de liberación prolongada de 12 mg de paliperidona con una comida estándar rica en grasas y en calorías fueron un 60% y un 54% mayores, respectivamente, que los observados con la administración en condiciones de ayuno.
Aunque la presencia o ausencia de alimentos en el momento de la administración de INVEGA® puede incrementar o reducir la exposición a paliperidona, estos cambios no se consideran relevantes a nivel clínico. En los ensayos clínicos en los que se establecieron la seguridad y la eficacia de INVEGA® no se tuvieron en cuenta las horas de las comidas. (Véase Posología y forma de administración).
Distribución: Paliperidona se distribuye rápidamente. El volumen aparente de la distribución es 487 L. La unión a las proteínas plasmáticas de la paliperidona es del 74%. Se une principalmente a la glucoproteína a1-ácida y a la albúmina. In vitro, concentraciones terapéuticas altas de diazepam (3 µg/ml), sulfametacina (100 µg/ml), warfarina (10 µg/ml) y carbamazepina (10 µg/ml) causaron un ligero aumento de la fracción libre de paliperidona en una concentración de 50 ng/ml. No cabe esperar que estos cambios sean relevantes a nivel clínico.
Metabolismo y eliminación: Una semana después de la administración de una única dosis oral de 1 mg de 14C paliperidona de liberación inmediata, el 59 % de la dosis se excretó inalterada en la orina, lo que indica que la paliperidona no se metaboliza en gran medida en el hígado.
Aproximadamente el 80% de la radiactividad administrada se recuperó en la orina, y el 11 % en las heces. Se han identificado cuatro vías metabólicas in vivo, ninguna de las cuales supuso más del 6,5 % de la dosis: Desalquilación, hidroxilación, deshidrogenación y escisión del benzisoxazol. A pesar de que los estudios in vitro indican que CYP2D6 y CYP3A4 podrían tener una implicación en el metabolismo de la paliperidona, no hay indicios in vivo de que estas isoenzimas desempeñen un papel significativo en el metabolismo de la paliperidona. A pesar de las grandes variaciones en la población general en la capacidad para metabolizar los sustratos de la CYP2D6, análisis farmacocinéticos realizados en diversas poblaciones indicaron que no había una diferencia apreciable en el aclaramiento aparente de paliperidona tras la administración de INVEGA® entre personas que metabolizan mucho y poco los sustratos de la CYP2D6. Estudios in vitro realizados en preparaciones microsomales de sistemas heterólogos indican que las isoenzimas CYP1A2, CYP2A6, CYP2C9, CYP2C19 y CYP3A5 no participan en el metabolismo de paliperidona. La semivida de eliminación terminal de paliperidona es de aproximadamente 23 horas.
Poblaciones especiales:
— Insuficiencia hepática: La paliperidona no se metaboliza en su totalidad en el hígado. En un estudio realizado en sujetos con insuficiencia hepática moderada (clase B de Child-Pugh), las concentraciones plasmáticas de paliperidona libre fueron similares a las observadas en sujetos sanos. No se ha estudiado la paliperidona en pacientes con insuficiencia hepática grave.
— Insuficiencia renal: Debe reducirse la dosis en los pacientes con insuficiencia renal moderada o grave (véase Posología y forma de administración). La eliminación de paliperidona se estudió en sujetos con diversos grados de función renal. La eliminación de paliperidona fue menor cuanto menor era el aclaramiento de creatinina (CrCl). El aclaramiento total de paliperidona disminuyó en un 32% en los sujetos con insuficiencia renal leve (CrCl de 50 a < 80 ml/min), en un 64% en los sujetos con insuficiencia renal moderada (CrCl de 30 a < 50 ml/min) y en un 71% en los sujetos con insuficiencia renal grave (CrCl = 10 a < 30 ml/min). Las semividas de eliminación terminal medias de paliperidona fueron de 24, 40 y 51 horas en los sujetos con insuficiencia renal leve, moderada y grave, respectivamente, frente a 23 horas en los sujetos con función renal normal (CrCl ≥ 80 ml/min).
— Adolescentes: La exposición sistémica de paliperidona en sujetos adolescentes fue comparable a la de los adultos. En adolescentes pesando < 51 kg (< 112 lb), un 23% de mayor exposición fue observada que en los adolescentes pesando ≥ 51 kg (≥ 112 lb); esto es considerado no se clínicamente significativo. Sólo la edad no influenció la exposición de paliperidona.
— Ancianos: Los datos de un estudio farmacocinético realizado en sujetos ancianos (≥ 65 años de edad, n = 26) indicaron que el aclaramiento aparente en el estado de equilibrio de paliperidona tras la administración de INVEGA® fue un 20% menor que el observado en sujetos adultos (de 18-45 años de edad, n = 28). Sin embargo, en los análisis farmacocinéticos de diversas poblaciones de sujetos con esquizofrenia no se observó un efecto apreciable de la edad tras corregir las disminuciones del CrCl relacionadas con la edad.
— Etnia: No se recomienda ajustar la dosis según la etnia. Los análisis farmacocinéticos de la población indican que no hay diferencias étnicas en la farmacocinética de la paliperidona después de administrar INVEGA™. No se observaron diferencias farmacocinéticas en un estudio farmacocinético en el que participaron pacientes japoneses y caucásicos.
— Sexo: El aclaramiento aparente de paliperidona tras la administración de INVEGA® es aproximadamente un 19% menor en las mujeres que en los varones. Esta diferencia se debe principalmente a las diferencias existentes en la masa corporal magra y en el aclaramiento de creatinina entre los varones y las mujeres, ya que en una evaluación farmacocinética de diversas poblaciones no se observaron diferencias clínicamente significativas relacionadas con el sexo en la farmacocinética de paliperidona tras la administración de INVEGA® después de hacer una corrección en función de la masa corporal magra y el aclaramiento de creatinina. Fumadores y no fumadores. De acuerdo con los estudios in vitro con enzimas hepáticas humanas, la paliperidona no es un sustrato de CYP1A2; en consecuencia, el hecho de fumar no debería repercutir en la farmacocinética de la paliperidona. Según estos resultados in vitro, no se observaron diferencias entre fumadores y no fumadores en la evaluación farmacocinética de la población.
CONTRAINDICACIONES: INVEGA® está contraindicado en pacientes con hipersensibilidad conocida a paliperidona o a alguno de los excipientes de la formulación. Como paliperidona es un metabolito activo de risperidona, INVEGA® está contraindicado en pacientes con hipersensibilidad conocida a risperidona.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO:
Síndrome maligno por neurolépticos: El síndrome maligno por neurolépticos (SMN), caracterizado por hipertermia, rigidez muscular, inestabilidad autónoma, trastorno de la conciencia y aumento de los niveles de creatina-cinasa, se ha asociado a la administración de antipsicóticos, incluida la paliperidona. Otros signos clínicos pueden ser mioglobinuria (rabdomiolisis) e insuficiencia renal aguda. Si un paciente presenta signos o síntomas indicativos de SNM, deben suspenderse todos los fármacos antipsicóticos, incluido INVEGA®.
Discinesia tardía: Los fármacos con propiedades antagonistas de los receptores de la dopamina se han asociado a la inducción de discinesia tardía, caracterizada por movimientos rítmicos involuntarios, sobre todo de la lengua y/o la cara. Si un paciente presenta signos o síntomas indicativos de discinesia tardía, deberá considerarse la suspensión de todos los fármacos antipsicóticos, incluido INVEGA®.
Intervalo QT: Al igual que ocurre con otros antipsicóticos, se debe proceder con precaución cuando se prescriba INVEGA® a pacientes con antecedentes de arritmias cardíacas, pacientes con síndrome de QT largo congénito y cuando se utilice de forma concomitante con fármacos que prolonguen el intervalo QT.
Hiperglucemia y diabetes mellitus: Hiperglicemia, diabetes mellitus y exacerbación de diabetes pre existente se ha reportado durante el tratamiento con INVEGA®. La evaluación de la relación entre el uso antipsicóticos atípicos y anormalidades en la glucosa, es complicado por la posibilidad de un aumento del riesgo de antecedentes de diabetes mellitus en pacientes con esquizofrenia y el aumento de incidencia de diabetes mellitus en la población general. Dados estos datos, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con hiperglicemia no están completamente comprendidos. Cualquier paciente tratado con antipsicóticos atípicos incluyendo INVEGA® debería ser monitoreado por síntomas de hipreglicemia y diabetes mellitus. (Ver Eventos no deseados).
Aumento de peso: Se ha observado aumento de peso con el uso de antipsicóticos atípicos. Se recomienda monitoreo clínico del peso.
Hipotensión ortostática: La paliperidona podría inducir hipotensión ortostática en algunos pacientes por su actividad alfa bloqueante. INVEGA® debe utilizarse con precaución en los pacientes con enfermedades cardiovasculares (p. ej., insuficiencia cardíaca, infarto de miocardio, isquemia miocárdica, anomalías de la conducción cardíaca), enfermedades cerebrovasculares o estados que predispongan al paciente a presentar hipotensión (p. ej., deshidratación, hipovolemia y tratamiento con fármacos antihipertensivos).
Crisis: Al igual que los otros fármacos antipsicóticos, INVEGA® debe utilizarse con precaución en los pacientes con antecedentes de convulsiones u otras enfermedades que puedan reducir el umbral para que se produzcan convulsiones.
Potencial de producir obstrucción gastrointestinal: Como el comprimido de INVEGA® es indeformable y su forma no cambia apreciablemente en el tracto gastrointestinal, INVEGA® no debe administrarse, por lo general, a pacientes con estrechamiento gastrointestinal grave preexistente (patológico o iatrogénico) ni a pacientes con disfagia o grandes dificultades para tragar comprimidos. Se han descrito casos aislados de síntomas obstructivos de enfermos con estenosis conocida, asociados a la ingestión de fármacos en formulaciones indeformables y de liberación controlada. Debido a que la forma posológica de INVEGA® es de liberación controlada, INVEGA® sólo debe administrarse a pacientes que puedan tragar el comprimido completo (véase también Posología y forma de administración).
Pacientes ancianos con demencia: INVEGA® no se ha estudiado en pacientes ancianos con demencia.
Mortalidad global: En un meta-análisis de 17 ensayos clínicos controlados por placebo, se observó que los pacientes ancianos con demencia tratados con otros antipsicóticos atípicos, incluidos risperidona, aripiprazol, olanzapina y quetiapina, tenían un mayor riesgo de mortalidad que los que recibieron un placebo.
Dentro tratados con risperidona, la mortalidad fue 4% comparada con 3.1% para el placebo.
Complicaciones cerebrovasculares: Durante los ensayos controlados por placebo, en el caso de los pacientes de edad avanzada con demencia y tratados con antipsicóticos atípicos como risperidona, aripiprazol y olanzapina, la incidencia de complicaciones cerebrovasculares (accidentes cerebrovasculares y ataques isquémicos transitorios), incluidas las muertes, fue mayor que en los pacientes que recibieron un placebo.
Leucopenia, neutropenia y agranulocitosis: Los eventos de leucopenia, neutropenia y agranulocitosis ha sido reportado con agentes anti psicóticos, incluyendo INVEGA®. La agranulocitosis se ha reportado muy raro (<1/10000 pacientes) durante la vigilancia post mercadeo. Los pacientes con historial de conteo de glóbulos blancos significativamente bajo (WBC) o leucopenia/neutropenia inducida por medicamentos, deberían ser monitoreados durante los primeros meses de terapia y se debería descontinuar la terapia con INVEGA® con el primer signo de disminución clínicamente significativa de WBC, en la ausencia de otros factores causantes.
Los pacientes con neutropenia clínicamente significativa deberían ser monitoreados por fiebre u otro síntoma o signo de infección y ser tratados prontamente si estos síntomas o signos ocurren. Los pacientes con neutropenia severa (conteo de neutrófilos absolutos < 1 x 109/L) deberían descontinuar INVEGA® y tener seguimiento de WBC hasta la recuperación.
Tromboembolismo venoso: Casos de tromboemolismo venoso (VTE, por sus siglas en inglés) se ha reportado con medicamentos antipsicóticos. Como los pacientes tratados con antipsicóticos usualmente presentan factores de riesgos adquiridos para VTE, todos los factores de riesgo posibles para VTE deberían ser identificados antes y durante el tratamiento con INVEGA® y se deberían tomar medidas preventivas.
Enfermedad de Parkinson y demencia con cuerpos de Lewy: Los médicos deben sopesar los riesgos y los beneficios a la hora de prescribir fármacos antipsicóticos, incluido INVEGA®, a pacientes con enfermedad de Parkinson o demencia con cuerpos de Lewy (DCL), ya que ambos tipos de pacientes tienen un mayor riesgo de presentar síndrome neuroléptico maligno y de tener una sensibilidad elevada a las medicaciones antipsicóticas. Las manifestaciones de esta mayor sensibilidad pueden incluir desorientación, obnubilación, inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
Priapismo: Se ha documentado que los fármacos que provocan un bloqueo alfa-adrenérgico inducen priapismo. Se han notificado casos de priapismo con paliperidona durante la fase de control posterior a su comercialización (consulte Reacciones adversas).
Regulación de la temperatura corporal: Se ha atribuido a agentes antipsicóticos la posibilidad de provocar trastornos que afecten a la capacidad del organismo de reducir la temperatura corporal general. Se aconseja tener cuidado cuando se prescriba INVEGA® a pacientes que vayan a experimentar situaciones que pueden incrementar la temperatura corporal central, como ejercicios extenuantes, exposición a calor extremo, toma de medicaciones concomitantes con actividad anticolinérgica, o bien que puedan sufrir deshidratación.
Efecto antiemético: Se ha observado un efecto antiemético en los estudios preclínicos con paliperidona. Si este efecto se da en humanos, podría enmascarar los signos y los síntomas de una sobredosis con determinados fármacos, o trastornos como la obstrucción intestinal, el síndrome de Reye o un tumor cerebral.
EMBARAZO Y LACTANCIA:
Embarazo: La seguridad del uso de paliperidona durante el embarazo humano no se ha establecido. No se han observado efectos teratógenos en ninguno de los estudios realizados con animales. Se observó un ligero aumento de las muertes fetales en animales de laboratorio tratados con una dosis alta de paliperidona. Esta dosis alta fue tóxica para las madres. Exposiciones al fármaco de 20 a 34 veces superiores a la exposición máxima en seres humanos no afectaron a las crías.
Los neonatos que han estado expuestos a fármacos antipsicóticos (incluida la paliperidona) durante el tercer trimestre de embarazo, corren el riesgo de sufrir síntomas extrapiramidales y/o síntomas de abstinencia de intensidad variada, después del parto. Estos síntomas, en los neonatos, pueden incluir agitación, hipertonía, hipotonía, temblores, somnolencia, distrés respiratorio y trastornos alimentarios.
INVEGA® sólo debe usarse durante el embarazo si los beneficios compensan los riesgos. Se desconoce el efecto de INVEGA® sobre el parto en los seres humanos.
Lactancia: En los estudios de paliperidona en animales y de risperidona en humanos, se ha observado la excreción de paliperidona en la leche. Por tanto, las mujeres que reciben INVEGA® no deben amamantar a sus hijos.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: INVEGA® puede interferir con actividades que requieran concentración y puede tener efectos sobre la visión (véase Reacciones adversas). Por lo tanto, se recomendará a los pacientes que no conduzcan ni utilicen máquinas hasta que se conozca su sensibilidad.
REACCIONES ADVERSAS:
Datos de ensayos clínicos: La seguridad de INVEGA™ para el tratamiento de la esquizofrenia se evaluó en 1.205 adultos con esquizofrenia que participaron en 3 ensayos doble ciego y controlados con placebo, de 6 semanas de duración, a 850 de los cuales se les administró una dosis fija de INVEGA™ de entre 3 mg y 12 mg una vez al día.
La seguridad de INVEGA® fue evaluada en 314 sujetos adolescentes 12-17 de años con esquizofrenia que recibieron INVEGA® en un rango de 1,5 mg a 12 mg/día en estudios Fase 3, incluyendo 201 sujetos en un estudio de 6 semanas, doble ciego, placebo controlado y sujetos tratados por 2 años en un estudio de seguridad abierto, de un grupo.
La seguridad de INVEGA™ se evaluó también en 622 sujetos adultos con trastorno esquizoafectivo que participaron en 2 ensayos doble ciego y controlados con placebo, de 6 semanas de duración. En uno de estos ensayos se asignaron 206 sujetos a uno de los dos niveles posológicos de INVEGA™: 6 mg con opción de reducirlos a 3 mg (n = 108) o 12 mg con opción de reducirlos a 9 mg (n = 98), en ambos casos administrados una vez al día. En el otro estudio, a 214 sujetos se les administraron dosis flexibles de INVEGA™ (3-12 mg una vez al día). En ambos estudios participaron sujetos a los que se administró INVEGA™ como monoterapia o en combinación con antidepresivos y/o estabilizantes del estado de ánimo.
La información en esta sección se obtuvo a partir de datos combinados.
La mayoría de las reacciones adversas fueron de intensidad leve a moderada.
Datos de ensayos doble ciego, controlados con placebo - Esquizofrenia-adultos: Las reacciones adversas (RA) a la medicación comunicadas por ≥ 2% de los pacientes con esquizofrenia tratados con INVEGA™ en los tres ensayos doble ciego, de dosis fija y controlados con placebo, de 6 semanas de duración, en adultos, se muestran en la Tabla 1.
|
Tabla 1. Reacciones adversas (RA) a la medicación comunicadas por ≥ 2% de los pacientes adultos con esquizofrenia tratados con INVEGA™ en los tres ensayos doble ciego, de dosis fija y controlados con placebo, de 6 semanas de duración |
|||||
|
Porcentaje de pacientes |
|||||
|
Grupo sistémico Reacción adversa |
INVEGA® 3 mg una vez al día (N = 127) % |
INVEGA® 6 mg una vez al día (N = 235) % |
INVEGA® 9 mg una vez al día (N = 246) % |
INVEGA® 12 mg una vez al día (N = 242) % |
Placebo (N = 355) % |
|
Trastornos del sistema nervioso |
|||||
|
Cefalea Mareos Síndrome extrapiramidal Somnolencia Acatisia Temblor Hipertonía Distonía Sedación Parkinsonismo Trastorno ocular Crisis oculogírica |
11 6 5 5 4 3 2 1 1 0 0 |
12 5 2 3 3 3 1 1 5 <1 0 |
14 4 7 7 8 4 4 4 3 2 2 |
14 5 7 5 10 3 3 4 6 1 0 |
12 4 2 3 4 3 1 1 4 0 0 |
|
Trastornos cardíacos |
|||||
|
Taquicardia sinusal Taquicardia Bloqueo de rama Arritmia sinusal Bloqueo atrioventricular de primer grado Trastornos vasculares Hipotensión ortostática |
9 2 3 2 2 2 |
4 7 1 1 0 1 |
4 7 3 1 2 2 |
7 7 <1 <1 1 4 |
4 3 2 0 1 1 |
|
Trastornos gastrointestinales |
|||||
|
Vómitos Sequedad bucal Dolor abdominal alto Hipersalivación Trastornos generales Astenia Fatiga |
2 2 1 0 2 2 |
3 3 3 <1 <1 1 |
4 1 2 1 2 2 |
5 3 2 4 2 2 |
5 1 1 <1 1 1 |
Datos de ensayos doble ciego, placebo controlados-en adolescentes con esquizofrenia: Las RA reportadas por ≥ 2% of INVEGA® en sujetos adolescentes de 12-17 años con esquizofrenia tratados en un estudio de dosis fija, placebo controlado se muestran en la tabla 2.
|
Table 2. Reacciones adversas reportadas ≥ 2% of INVEGA® sujetos con esquizofrenia tratados en un estudio clínico a dosis fija, placebo controlado en adolescentes |
|||||
|
Porcentaje de pacientes |
|||||
|
Sistema corporal/Clase orgánica Reacción adversa |
INVEGA® 1.5 mg diario (N = 54) |
INVEGA® 3 mg diario (N = 16) |
INVEGA® 6 mg diario (N = 45) |
INVEGA® 12 mg diario (N = 35) |
Placebo (N = 51) |
|
Infecciones e infestaciones |
|||||
|
Nasofaringitis |
4 |
0 |
4 |
0 |
2 |
|
Trastornos psiquiátricos |
|||||
|
Insomnio |
9 |
6 |
7 |
14 |
22 |
|
Ansiedad |
0 |
0 |
2 |
9 |
4 |
|
Trastornos del sistema nervioso |
|||||
|
Somnolencia |
6 |
13 |
13 |
26 |
2 |
|
Acatisia |
4 |
6 |
11 |
17 |
0 |
|
Dolor de cabeza |
9 |
6 |
4 |
14 |
4 |
|
Tremor |
2 |
6 |
7 |
11 |
0 |
|
Distonía |
2 |
0 |
4 |
9 |
0 |
|
Rigidez de mandíbula |
0 |
0 |
0 |
11 |
0 |
|
Mareo |
2 |
6 |
2 |
3 |
0 |
|
Disquinesia |
2 |
6 |
2 |
3 |
0 |
|
Sedación |
4 |
0 |
2 |
0 |
2 |
|
Hipersomnia |
0 |
0 |
4 |
0 |
0 |
|
Trastorno extrapiamidal |
0 |
6 |
0 |
0 |
0 |
|
Letargo |
0 |
0 |
0 |
3 |
0 |
|
Contracciones musculares involuntarios |
0 |
0 |
0 |
3 |
0 |
|
Parálisis de lengua |
0 |
0 |
0 |
3 |
0 |
|
Trastornos oculares |
|||||
|
Crisis oculogíricas |
0 |
0 |
4 |
3 |
0 |
|
Visión borrosa |
0 |
0 |
0 |
3 |
0 |
|
Trastornos cardiacos |
|||||
|
Taquicardia |
0 |
6 |
7 |
6 |
0 |
|
Taquicardia sinusal |
0 |
0 |
2 |
0 |
0 |
|
Trastornos respiratorios, torácicos y mediastinales |
|||||
|
Epistaxis |
0 |
0 |
2 |
0 |
0 |
|
Trastornos gastrointestinales |
|||||
|
Vómito |
0 |
6 |
11 |
3 |
10 |
|
Nausea |
0 |
0 |
2 |
9 |
12 |
|
Hipersecreción salival |
2 |
6 |
2 |
0 |
0 |
|
Dolor abdominal superior |
2 |
0 |
2 |
0 |
2 |
|
Boca seca |
0 |
0 |
0 |
3 |
2 |
|
Lengua inflamada |
0 |
0 |
0 |
3 |
0 |
|
Trastornos musculoesqueléticos y en tejido conectivo |
|||||
|
Rigidez muscular |
0 |
0 |
2 |
3 |
0 |
|
Contractura muscular |
0 |
0 |
0 |
3 |
0 |
|
Tortículis |
0 |
0 |
2 |
0 |
0 |
|
Trastornos de sistema reproductor y mamas |
|||||
|
Galactorrea |
0 |
0 |
4 |
0 |
0 |
|
Amenorrea |
0 |
6 |
0 |
0 |
0 |
|
Inflamación de pecho |
0 |
0 |
0 |
3 |
0 |
|
Trastornos generales |
|||||
|
Fatiga |
4 |
0 |
2 |
3 |
0 |
|
Astenia |
0 |
0 |
2 |
3 |
0 |
|
Investigaciones |
|||||
|
Aumento de peso |
7 |
6 |
2 |
3 |
0 |
Datos de ensayos doble ciego, controlados con placebo - Trastorno esquizoafectivo: Las RA a la medicación comunicadas por ≥ 2% de los pacientes tratados con INVEGA™ en los dos ensayos controlados con placebo sobre el trastorno esquizoafectivo se muestran en la Tabla 2.
|
Tabla 3. Reacciones adversas a la medicación comunicadas por ≥ 2% de los pacientes con trastorno esquizoafectivo tratados con INVEGA® en dos ensayos clínicos doble ciego y controlados con placebo |
||
|
Porcentaje de pacientes |
||
|
Grupo sistémico Reacción adversa |
INVEGA® 3-12 mg una vez al día (N=420) % |
Placebo (N=202) % |
|
Infecciones e infestaciones |
||
|
Nasofaringitis |
3 |
1 |
|
Trastornos del metabolismo y de la nutrición |
||
|
Aumento del apetito |
2 |
<1 |
|
Trastornos del sistema nervioso |
||
|
Temblor Acatisia Sedación Somnolencia Hipertonía Babeo Disartria |
8 5 5 5 5 2 2 |
3 4 3 2 2 0 0 |
|
Trastornos gastrointestinales |
||
|
Náuseas Dispepsia Estreñimiento |
6 5 4 |
6 2 2 |
|
Trastornos musculoesqueléticos y del tejido conectivo |
||
|
Mialgia |
2 |
<1 |
|
Analíticas |
||
|
Aumento de peso |
4 |
1 |
|
* De los 420 sujetos tratados con INVEGA™, a 230 (55%) se les administró INVEGA™ como monoterapia y a 190 (45%) se les administró INVEGA™ en combinación con antidepresivos y/o estabilizantes del estado de ánimo. |
||
Comparación de la monoterapia y la politerapia: El diseño de los dos ensayos doble ciego y controlados con placebo, de 6 semanas de duración, en los que participaron pacientes con trastorno esquizoafectivo, contemplaban la posibilidad de que los pacientes tomaran además antidepresivos (salvo inhibidores de la monoaminooxidasa) y/o estabilizantes del estado de ánimo (litio, valproato o lamotrigina). Dentro del grupo de pacientes en los que se evaluó la seguridad, a 230 (55%) sujetos se les administró INVEGA™ como monoterapia y a 190 (45%) se les administró INVEGA™ en combinación con antidepresivos y/o estabilizantes del estado de ánimo. Al comparar los 2 subgrupos sólo se observó una mayor frecuencia de las náuseas (diferencia ≥ 3%) en el grupo de los pacientes tratados con INVEGA™ como monoterapia.
Reacciones adversas relacionadas con la dosis: En el estudio en el que participaron pacientes con trastorno esquizoafectivo, controlado con placebo, de 6 semanas de duración y de dosis altas y bajas, la frecuencia de distonía, disartria y nasofaringitis fue mayor (la diferencia fue como mínimo del 3%) en los sujetos a los que se administraron dosis más altas de INVEGA™ que en los sujetos a los que se administraron dosis más bajas. La hipertonía fue más frecuente en pacientes a los que se administraron dosis más bajas de INVEGA™ que en los pacientes a los que se administraron dosis más altas.
Otros datos de ensayos clínicos: Paliperidona es el metabolito activo de risperidona, por lo tanto los perfiles de reacciones adversas de estos compuestos (incluyendo las formulaciones oral e inyectable) son relevantes. Esta sub sección incluye reportes de RA adicionales reportadas con paliperidona y/o risperidona en estudios clínicos.
Los RA reportados con paliperidona y/o risperidona por ≥2% de los pacientes tratados con INVEGA™ en la base de datos de un estudio doble ciego, placebo controlado, sobre la esquizofrenia, el trastorno bipolar y el trastorno esquizoafectivo (en 8 adultos y 1 adolescente)antes mencionados se muestran en la Tabla 3. También se incluyen en la Tabla 3 las RA a la medicación comunicadas en otros ensayos clínicos, con independencia de la frecuencia.
|
Tabla 4a. Los ra reportados con paliperidona y/o risperidona por ≥2% de INVEGA®- Sujetos tratados en una base de datos de los 9 estudios doble-ciego, placebo controlado, esquizofrenia, trastorno bipolar y trastorno esquizoafectivo (8 en adultos y 1 en sujetos adolescentes). Los términos de cada sistema orgánico se almacenan alfabeticamente. |
|
Sistema/Clase orgánica Reacción adversa |
|
Infecciones e Infestaciones Infecciones del tracto respiratorio superior |
|
Trastornos psiquiátricos Insomnio* |
|
Trastornos del sistema nervioso Acatisia*, Distonía*, Parkinsonismo* |
|
Trastornos gastrointestinales Molestia abdominal, diarrea |
|
Trastornos del tejido conectivo y musculoesquelético Dolor musculoesquelético |
|
* Insomnio incluye: Insomnio inicial, insomnio medio; Acatisia incluye: hiperquinesia, síndrome de piernas inquietas; Distonía incluye: blefarosmasmo, espasmo cervical, emprostotono, espasmo facial, hipertonía, laringoespasmo, contracción muscular involuntaria,miotonía,oculogiración, opistotono, espasmo orofaríngeo, pleurotono, risa sardónico, tétano, parálisis de legnua, espasmo de lengua, tortículis, trismus; Parkinsonismo icluye: aquinesia, bradiquinesia, rigidez de mandíbula, babeo, síntomas extrapiramidales, reflejo gableral anormal, rigidez muscular, muscle tightness, musculoskeletal stiffness. |
Las RA reportadas con paliperidona y/o risperidona por <2% de INVEGA® - en sujetos tratados en un base de datos de los 9 estudios doble-ciego, placebo controlado, esquizofrenia, trastorno bipolar y trastorno esquizoafectivo (8 en adultos y 1 en sujetos adolescentes) se muestran en la Tabla 4b.
|
Tabla 4b. Otras reacciones adversas a la medicación comunicadas por < 2% de los pacientes tratados con INVEGA™ según los datos obtenidos en 3 ensayos doble ciego y controlados con placebo sobre la esquizofrenia, 3 ensayos doble ciego y controlados con placebo sobre el trastorno bipolar, 2 ensayos controlados con placebo sobre el trastorno esquizoafectivo, y otros ensayos clínicos, con independencia de la frecuencia. |
|
Grupo sistémico Reacción adversa |
|
Infecciones e infestaciones Acarodermatitis, bronquitis, celulitis, cistitis, infección de oído, influenza, onicomicosis, neumonía, infección de tracto respiratorio, sinusitis, toncilitis, infección del tracto urinario |
|
Trastornos sanguíneo y de sistema linfático Anemia, disminución del hematocrito, neutropenia, disminución del conteo de glóbulos blancos |
|
Trastornos del sistema inmunitario Reacción anafiláctica, hipersensibilidad |
|
Trastornos del sistema endocrino Hiperprolactinemia |
|
Trastornos metabólicos y nutricionales Anorexia, aumento del colesterol en sangre, aumento de triglicéridos en sangre, pérdida de apetito, hiperglicemia, pérdida de peso |
|
Trastornos psiquiátricos Anorgasmia, depresión, disminución de libido, pesadillas, trastornos del sueño |
|
Trastornos del sistema nervioso Accidente cerebrovascular, convulsiones*, convulsión, mareo postural, hipoestasia, pérdida de la conciencia, parestesia, hiperactividad psicomotora, síncope, disquinesia tardía |
|
Trastornos oculares Conjuntivitis, ojo seco, aumento de lagrimación, fotofobia |
|
Trastornos de oído y laberinto Dolor de oído, tinitus, vértigo |
|
Trastornos cardíacos Bloqueo atrioventricular, bradicardia, trastorno de conducción, electrocardiograma anormal, QT prolongado en electrocardiograma, palpitaciones |
|
Trastornos vasculares Enrojecimiento, hipertensión, hipotensión, isquemia |
|
Trastornos respiratorios, torácicos y mediastínicos Tos, disnea, hiperventilación, congestión nasal, dolor faringolaríngeo, sibilancias |
|
Trastornos gastrointestinales Quelitis, disfagia, incontinencia fecal, flatulencia, gastroenteritis, obstrucción intestinal, lengua inflamada, dolor dental |
|
Trastornos de la piel y del tejido subcutáneo Acné, piel seca, eczema, eritema, prurito, rash, dermatitis seborreica, decoloración de piel |
|
Trastornos musculoesqueléticos y del tejido conectivo Artralgia, dolor de espalda, aumento de creatinina fosfoquinasa en sangre, rigidez de articulaciones, inflamación de articulaciones, debilidad muscular, dolor de cuello |
|
Trastornos renales y urinarios Disuria, polakiuria, incontinencia urinaria |
|
Trastornos del sistema reproductor y de las glándulas mamarias Trastornos de carácter general Aumento de temperatura corporal, molestia en pecho, escalofríos, edema facial, paso anormal, edema*, pirexia, sed |
|
Herida, envenenamiento y complicaciones de procedimiento Caída |
|
* Convulsiones incluye: Convulsión grand mal; Disquinesia incluye: Atetosis, corea, coreatetosis, trastornos del movimiento, espasmo muscular, mioclonía; Trastorno menstrual incluye: Menstruación irregular, oligomenorrea; Edema incluye: Edema generalizado, edema periférico, picaduras con edema. |
Las RA reportadas con paliperidona y/o risperidona en otros estudios clínicos pero no reportados por INVEGA® -(3-12 mg)- en sujetos tratados en un base de datos de los 9 estudios doble-ciego, placebo controlado, esquizofrenia, trastorno bipolar y trastorno esquizoafectivo (8 en adultos y 1 en sujetos adolescentes) se muestran en la Tabla 4c.
|
Tabla 4c. Las RA reportadas con paliperidona y/o risperidona en otros estudios clínicos pero no reportados por INVEGA® -(3-12 mg)- Sujetos tratados en una base de datos de los 9 estudios doble-ciego, placebo controlado, esquizofrenia, trastorno bipolar y trastorno esquizoafectivo (8 en adultos y 1 en sujetos adolescentes). Los términos de cada Sistema orgánico se almacenan alfabéticamente |
|
Sistema/Clase orgánica Reacción adversa |
|
Infecciones e infestaciones Infección ocular |
|
Trastornos en sangre y sistema linfático Aumento en conteo de eosinófilos |
|
Trastornos endocrinos Presencia de glucosa en sangre |
|
Trastornos metabólicos y de nutrición Hiperinsulinemia, polidipsia |
|
Trastornos psiquiátricos Afección, estado de confusión |
|
Trastorno del sistema nervioso Trastorno del balance, trastorno cerebrovascular, coordinación anormal, disminución del estado de consciencia, coma diabético, titubeo de cabeza, síndrome neuroléptico maligno, no respuesta a estímulo. |
|
Trastornos oculares Trastorno de movimiento ocular, laminación de ojo, glaucoma, hiperemia ocular. |
|
Trastorno cardiaco Síndrome de taquicardia ortostática postural |
|
Trastorno respiratorio, torácico, y mediastinal Disfonía, neumonía por aspiración, congestión pulmonar, estertores, congestión del tracto respiratorio |
|
Trastorno gastrointestinal Fecaloma |
|
Trastorno de piel y tejido conectivo Erupción por medicamento, hiperqueratosis, urticaria |
|
Trastornos del tejido musculoesquelético y subcutáneo Postura anormal, rabdomiólisis |
|
Trastorno del sistema reproductivo y mamario Agrandamiento mamario, retraso en la menstruación |
|
Trastornos generales Disminución de la temperatura corporal, síndrome de abstinencia, induración, malestar |
Ancianos: La seguridad de INVEGA® se evaluó en 81 sujetos ancianos con esquizofrenia (de ™ 65 años de edad) que recibieron INVEGA® en dosis flexibles (n = 76) o en dosis fijas (n = 5), en un rango posológico de 3 a 12 mg una vez al día durante un máximo de 6 semanas en ensayos doble ciego y controlados con placebo. Aunque esta serie de datos no permite realizar una comparación sistemática directa entre los sujetos ancianos y los sujetos no ancianos, el perfil de seguridad de INVEGA® fue similar en las dos poblaciones. No obstante, según estos datos limitados y según lo observado en la práctica clínica general, no se puede descartar la posibilidad de que los sujetos ancianos sean más proclives a presentar RAF.
Acontecimientos de especial interés en relación con la clase: Síntomas extrapiramidales (SEP). Según los datos agrupados de los 3 estudios controlados con placebo, de 6 semanas de duración, doble ciego y de dosis fija (véase Propiedades farmacodinámicas: Eficacia clínica), no hubo diferencias en las incidencias de SEP ocurridos durante el tratamiento entre placebo (11%) e INVEGA® en dosis de 3 y 6 mg (13% y 10%, respectivamente). Se observó una relación entre los SEP y la dosis con las dos dosis más altas de INVEGA® (incidencias del 25% y del 26% con las dosis de 9 y 12 mg, respectivamente). La evaluación de los SEP comprendió un análisis agrupado de los siguientes términos: discinesia, distonía, hipercinesia, parkinsonismo y temblores. Según los datos obtenidos en los dos ensayos doble ciego, controlados con placebo, de 6 semanas de duración, en los que participaron pacientes con trastorno esquizoafectivo (véase Propiedades farmacodinámicas: Eficacia clínica), se obtuvieron resultados similares.
Aumento de peso: En el análisis de los datos agrupados de los 3 estudios controlados con placebo, de 6 semanas de duración y de dosis fija en esquizofrenia en adultos (véase Propiedades farmacodinámicas) se compararon los porcentajes de pacientes que cumplieron el criterio de aumento de peso de ≥ 7%; se observó que la incidencia de aumento de peso fue similar en los sujetos tratados con 3 y 6 mg de INVEGA® (7% y 6%, respectivamente) y en los que recibieron placebo (5%), y que fue mayor en los sujetos tratados con 9 y 12 mg de INVEGA® (9% y 9%, respectivamente).
El aumento de peso en adolescentes con esquizofrenia fue evaluada en un estudio de 6 semanas, doble ciego, placebo controlado y extensión abierta con una duración media de exposición de INVEGA® de 182 días. En un estudio doble ciego, placebo controlado, un mayor porcentaje de INVEGA® a dosis baja (6%), dosis media (13%) en sujetos tratados [ver Sección 5.1] tiene un aumento en el peso corporal de ≥ 7% del inicial comparado con placebo (2%). En el estudio abierto a largo plazo la proporción de los sujetos tratado con INVEGA® con un aumento de peso ≥ 7% del inicial fue de 33%. Cuando los adolescentes fueron tratados con INVEGA® , el aumento de peso debió ser evaluado contra el esperado con el crecimiento normal. Al tomar en consideración la duración media de la exposición de INVEGA® en estudio abierto (182 días) con el crecimiento normal esperado en esta población, una evaluación de las puntuaciones de estandarización relativas a la información de normativa brinda una medida más relevante clínicamente de cambios en el peso. El cambio medio de la inicial al punto final en puntuaciones de estandarización para el peso fue de 0.1 (4% por encima de la información de normativa media). Basado en la comparación de la información de normativa, estos cambios no son considerados ser clínicamente significativos.
Según los datos obtenidos en los dos ensayos controlados con placebo, de 6 semanas de duración, en los que participaron pacientes adultos con trastorno esquizoafectivo (véase: Propiedades farmacocinéticas: Eficacia clínica), un mayor porcentaje de pacientes tratados con INVEGA™ (5%) aumentaron de peso en 7% en comparación con los pacientes tratados con el placebo (1%). En el ensayo en el que se estudiaron grupos con dosis altas y con dosis bajas, el aumento de peso del ≥ 7% fue del 3% en el grupo con dosis bajas, del 7% en el grupo con dosis altas y del 1% en el grupo tratado con placebo.
Pruebas de laboratorio: Prolactina sérica. Según los datos agrupados de los 3 estudios controlados con placebo, de 6 semanas de duración, doble ciego y de dosis fija (véase Propiedades farmacodinámicas: Eficacia clínica), se observaron aumentos de las medianas de las concentraciones de prolactina sérica en sujetos de ambos sexos que recibieron INVEGA®. Los aumentos medios máximos de las concentraciones de prolactina sérica se registraron generalmente el día 15 de tratamiento, pero los valores siguieron siendo superiores a los basales en la evaluación final del estudio.
Ensayos clínicos: RAF en un estudio a largo plazo controlado con placebo: La seguridad de INVEGA® también se evaluó en un ensayo a largo plazo cuyo objetivo era investigar el mantenimiento del efecto de INVEGA® en adultos con esquizofrenia (véase Propiedades farmacodinámicas: Eficacia clínica). En general, los tipos, las frecuencias y las intensidades de las RAF comunicadas durante la fase abierta inicial de 14 semanas de este estudio fueron similares a los observados en los estudios de 6 semanas de duración, controlados con placebo y de dosis fija. Los tipos y las intensidades de las RAF comunicadas durante la fase a largo plazo y doble ciego de este estudio fueron similares a los observados en la fase abierta inicial de 14 semanas, pero sus frecuencias fueron generalmente menores.
Datos posteriores a la comercialización: Las reacciones adversas identificadas en primer lugar como RA durante la experiencia posterior a la comercialización con paliperidona y/o risperidona se muestran en la Tabla 5. En la tabla se indican las frecuencias de acuerdo con la siguiente convención:
— Muy frecuente ≥1/10
— Frecuente ≥1/100 a <1/10
— Poco frecuente ≥1/1.000 a <1/100
— Raro ≥1/10.000 a <1/1.000
— Muy raro < 1/10.000, incluyendo informes aislados.
En la Tabla 5, las RA a la medicación se presentan categorizadas por frecuencia, de acuerdo con las tasas de comunicación espontánea.
|
Table 5. Reacciones adversas a fármacos identificadas durante la experiencia posterior a la comercialización con INVEGA® y/o risperidona por categoría de frecuencia estimada de porcentajes de observación espontánea con paliperidona |
|
|
Trastorno en sangre o sistema linfático |
|
|
Muy raro |
Agranulocitosis, trombocitopenia |
|
Trastornos endocrinos |
|
|
No conocido |
Secreción inapropiada de la hormona antidiurética. |
|
Trastornos metabólicos y nutricionales |
|
|
Muy raro |
Diabetes mellitus, cetoacidosis diabética, hipoglicemia |
|
No conocido |
Intoxicación con agua |
|
Trastornos psiquiátricos |
|
|
Muy raro |
Manía |
|
Trastornos del sistema nervioso |
|
|
Muy raro |
Disguesia |
|
Trastorno cardiaco |
|
|
Muy raro |
Fibrilación atrial |
|
Trastorno vascular |
|
|
Muy raro |
Trombosis venosa profunda, embolismo pulmonar |
|
Trastorno respiratorio, torácico y mediastinal |
|
|
Muy raro |
Síndrome de apnea del sueño |
|
Trastorno gastrointestinal |
|
|
Muy raro |
Pancreatitis |
|
Trastorno hepatobiliar |
|
|
No se muestra |
Ictericia |
|
Trastorno de piel y tejido conectivo |
|
|
Raro |
Angioedema |
|
Muy raro |
Alopecia |
|
Trastorno renal y urinario |
|
|
Muy raro |
Retención urinaria |
|
Embarazo, puerperio y condiciones perinatales |
|
|
Muy raro |
Síndrome de abstinencia neonatal |
|
Trastorno del sistema reproductivo y mamas |
|
|
Muy raro |
Priapismo |
|
Trastorno general |
|
|
Muy raro |
Hipotermia |
SOBREDOSIS:
Síntomas: En general, los signos y síntomas esperados son los debidos a una exageración de los efectos farmacológicos conocidos de la paliperidona, es decir, somnolencia y sedación, taquicardia e hipotensión, prolongación del segmento QT y síntomas extrapiramidales. Se ha comunicado la aparición de torsade de pointes y fibrilación ventricular en un paciente en relación con una sobredosis con paliperidona oral. En caso de sobredosis aguda, se contemplará la posibilidad de que el paciente haya tomado varios fármacos.
Tratamiento: A la hora de evaluar el tratamiento que hay que administrar y lo que es necesario hacer para que el paciente se recupere, hay que tener en cuenta que el producto se administra en una formulación de liberación prolongada. No existe ningún antídoto específico contra la paliperidona. En consecuencia, se deberán adoptar medidas de apoyo generales. Mantener la vía respiratoria permeable, asegurándose de que la oxigenación y la ventilación son suficientes. Se establecerá de inmediato monitorización cardiovascular, con registro electrocardiográfico continuo para detectar posibles arritmias. La hipotensión y la insuficiencia circulatoria se tratarán con las medidas idóneas, como la administración intravenosa de líquidos y/o simpaticomiméticos. Hay que considerar la posibilidad de hacer un lavado gástrico (después de la intubación si el paciente está inconsciente) y de administrar carbón activado junto con un laxante. En caso de que el paciente presente síntomas extrapiramidales graves, deben administrarse agentes anticolinérgicos. Se vigilará estrechamente al paciente hasta que se recupere.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: Se recomienda precaución cuando se prescriba INVEGA® junto con otros fármacos que prolonguen el intervalo QT.
Potencial de INVEGA® para afectar a otros fármacos: No se espera que la paliperidona provoque interacciones farmacocinéticas importantes a nivel clínico con fármacos metabolizados por isoenzimas del citocromo P-450. En los estudios in vitro realizados en microsomas hepáticos humanos se ha observado que la paliperidona no inhibe sustancialmente el metabolismo de los fármacos metabolizados por las isoenzimas del citocromo P450, incluidas CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5. Por tanto, no se espera que la paliperidona inhiba el aclaramiento de fármacos metabolizados por estas vías metabólicas de forma clínicamente relevante. Los estudios in vitro indicaron que la paliperidona no induce la actividad de CYP1A2, 2C19 o 3A4.
Además, la paliperidona es un inhibidor débil de la glicoproteína P (P-gp) en concentraciones elevadas. No existen datos in vivo y se desconoce la relevancia clínica. Dado que los principales efectos de la paliperidona se producen en el SNC (véase Reacciones adversas), se debe actuar con precaución en cuanto al consumo de INVEGA® junto con alcohol o con otros fármacos que actúan en el SNC. La paliperidona puede contrarrestar el efecto de la levodopa y otros agonistas de la dopamina.
Debido a su potencial de producir hipotensión ortostática (véase Advertencias y precauciones especiales de empleo), puede observarse un efecto aditivo cuando INVEGA® se administra junto con otros agentes terapéuticos que tienen este potencial.
Es poco probable que se dé una interacción farmacocinética entre INVEGA™ y el litio.
La administración concomitante de INVEGA™ en estado estacionario (12 mg una vez al día) con comprimidos de valproato semisódico de liberación prolongada (de 500 mg a 2.000 mg una vez al día) no influyó en la farmacocinética del valproato en estado estacionario.
Potencial de otros fármacos para afectar a INVEGA®: La paliperidona no es un sustrato de CYP1A2, CYP2A6, CYP2C9, CYP2C19 ni CYP3A5. Esto hace pensar que es poco probable que se dé una interacción con inhibidores o inductores de estas isoenzimas. Mientras que los estudios in vitro indican que CYP2D6 y CYP3A4 podrían tener una implicación mínima en el metabolismo de la paliperidona, no hay indicios in vitro ni in vivo de que estas isoenzimas desempeñen un papel importante en el metabolismo de la paliperidona.
En los estudios in vitro se ha observado que la paliperidona es un sustrato de la P-gp.
La paliperidona es metabolizada hasta cierto punto por CYP2D6 (véase Propiedades farmacológicas: Propiedades farmacocinéticas: Metabolismo y eliminación). En un estudio de interacción realizado en sujetos sanos, en el que se administró INVEGA™ de forma concomitante con paroxetina, un inhibidor potente de CYP2D6, no se observaron efectos clínicamente relevantes sobre la farmacocinética de paliperidona.
La administración concomitante de INVEGA™ una vez al día junto con carbamazepina 200 mg dos veces al día ocasionó una disminución de aproximadamente el 37% del estado estacionario medio de la Cmáx y el AUC de paliperidona. Esta reducción se debe, en gran parte, a un incremento del 35 % en el aclaramiento renal de la paliperidona, probablemente consecuencia de la inducción de la P-gp renal por parte de la carbamazepina. Una reducción menor de la cantidad de fármaco excretado inalterado en la orina hace pensar que el efecto sobre el metabolismo de la CYP o la biodisponibilidad de la paliperidona durante la administración conjunta con carbamazepina es poco relevante. Al iniciar el tratamiento con carbamazepina, la dosis de INVEGA™ debe ser revisada y aumentada si fuera necesario. De la misma manera, al finalizar el tratamiento con carbamazepina, la dosis de INVEGA™ debe ser revisada y reducida si fuera necesario.
La paliperidona, un catión por debajo del pH fisiológico, se excreta principalmente inalterada por los riñones, aproximadamente la mitad por filtración y la otra mitad por secreción activa. La administración concomitante de la trimetoprima, un fármaco del que se tiene constancia que inhibe el transporte de fármacos con cationes renales activos, no influyó en la farmacocinética de la paliperidona.
La administración concomitante de una única dosis de 12 mg de INVEGA™ con comprimidos de valproato semisódico de liberación prolongada (dos comprimidos de 500 mg una vez al día) provocó un aumento de aproximadamente el 50% en el AUC y la Cmáx de la paliperidona. Se debe plantear una reducción de la dosis de INVEGA™ en caso de administración concomitante con valproato después de la evaluación clínica.
Es poco probable que se dé una interacción farmacocinética entre el litio e INVEGA™.
Uso concomitante de INVEGA® y risperidona: No se ha estudiado la administración concomitante de INVEGA™ y risperidona.
Como paliperidona es un metabolito activo de risperidona, hay que tener en cuenta la exposición adicional a paliperidona cuando se coadministre risperidona junto con INVEGA®.
DATOS PRECLÍNICOS SOBRE SEGURIDAD:
Toxicología: Al igual que otros fármacos antagonistas de los receptores D2 de la dopamina, paliperidona incrementó las concentraciones séricas de prolactina en estudios de toxicidad de dosis múltiples.
En un estudio de toxicidad juvenil de 7 semanas con dosis oral de paliperidona de 0,16, 0,63 y 2,5 mg/kg/día, el cual fue 0,12, 0,5 y 1,8 veces la dosis máxima recomendada para humanos de 12 mg/día para adolescentes en una base mg/m2, no afecta el crecimiento, maduración sexual y el rendimiento reproductivo fue observado. Dosis de hasta 2,5 mg/kg/día no perjudicó el desarrollo neuroconductual en machos y hembras, excepto por un efecto en la conducta y aprendizaje en ratas hembras tratadas con 2,5 mg/kg/día. Este efecto no fue observado después de descontinuar el tratamiento.
En un estudio de 40 semanas en perros jóvenes tratados con una dosis oral de risperidona (el cual es extensamente convertido a paliperidona) a dosis de 0,31, 1,25 y 5 mg/kg/día, la maduración sexual no fue afectada adversamente a 0,31 y 1,25 mg/kg/día. El crecimiento de hueso largo no fue afectado a 0,31 mg/kg/día; se observaron efectos a 1,25 y 5 mg/kg/día.
Carcinogenicidad: El potencial carcinógeno de paliperidona, un metabolito activo de risperidona, se evaluó basándose en estudios realizados con risperidona en ratones y ratas. Se administró risperidona en dosis de hasta 10 mg/kg/día a ratones durante 18 meses, y a ratas durante 25 meses. Se observaron aumentos estadísticamente significativos de adenomas de la glándula pituitaria, adenomas endocrinos del páncreas y adenocarcinomas de la glándula mamaria. Se ha observado un aumento de tumores mamarios, pituitarios y endocrinos del páncreas en roedores después de la administración crónica de otros antipsicóticos, y se considera que se deben al antagonismo prolongado de la dopamina D2. Se desconoce la relevancia de estos datos tumorales en roedores como posible riesgo para los humanos.
Mutagenicidad: No se ha detectado ningún signo de potencial mutagénico en el caso de la paliperidona de acuerdo con la prueba de mutación inversa Ames, el ensayo sobre linfomas en ratones, ni la prueba de micronúcleos en ratas.
Deterioro de la fertilidad: Aunque el tratamiento con paliperidona produjo efectos mediados por la prolactina y el SNC, la fertilidad de las ratas macho y hembra no se vio afectada. Con un nivel tóxico de la dosis para la madre, las ratas hembra tuvieron un número ligeramente inferior de embriones.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN: INVEGA® se administra por vía oral, con o sin alimentos.
Los comprimidos INVEGA® deben tragarse enteros, con la ayuda de líquidos y no deben masticarse, dividirse o triturarse. El medicamento está contenido en una cápsula no absorbible diseñada para liberar el fármaco de forma controlada. El organismo elimina la cápsula que contiene el comprimido junto con los componentes insolubles del núcleo; los pacientes no deben preocuparse si observan ocasionalmente algo parecido a un comprimido en las heces.
Esquizofrenia:
— Adultos (≥ 18 años de edad): La dosis recomendada de INVEGA® para el tratamiento de la esquizofrenia en adultos es de 6 mg una vez al día, administrados por la mañana. No es necesario aumentar gradualmente la dosis inicial. Determinados pacientes pueden beneficiarse de dosis más bajas o más altas comprendidas dentro del rango recomendado de 3 a 12 mg una vez al día. El ajuste de la dosis, si está indicado, sólo debe realizarse tras hacer una reevaluación clínica. Cuando esté indicado aumentar la dosis, se recomienda realizar incrementos de 3 mg/día y generalmente deben realizarse a intervalos de más de cinco días.
— Adolescentes (12-17 años de edad): La dosis recomendada de INVEGA® para el tratamiento de esquizofrenia en adolescente entre 12-17 años de edad es de 3 mg una vez al día, administrado en la mañana. La titulación de la dosis inicial no se requiere. Algunos pacientes se pueden beneficiar de las dosis más altas de 6 mg a 12 mg/día. El aumento de dosis debería realizarse sólo después de la reevaluación clínica y debería ocurrir en aumentos de 3 mg/día en intervalos de más de 5 días.
Trastorno esquizoafectivo:
— Adultos (≥ 18 años de edad): La dosis recomendada de INVEGA® para el tratamiento del trastorno esquizoafectivo en adultos es de 6 mg una vez al día, administrados por la mañana. No es necesario aumentar gradualmente la dosis inicial. Determinados pacientes pueden beneficiarse de dosis más bajas o más altas comprendidas dentro del rango recomendado de dosis, que es de 3 a 12 mg una vez al día. Se ha observado una tendencia general hacia efectos mayores con dosis más altas. El ajuste de la dosis, si está indicado, sólo debe realizarse tras hacer una reevaluación clínica. Cuando esté indicado aumentar la dosis, se recomienda realizar incrementos de 3 mg/día y generalmente deben realizarse a intervalos de más de 4 días.
Pacientes con insuficiencia hepática: No se requiere ajuste de la dosis en pacientes con insuficiencia hepática de leve a moderada. No se han realizado estudios con INVEGA® en pacientes con insuficiencia hepática grave.
Pacientes con insuficiencia renal: Para los pacientes con insuficiencia renal leve (aclaramiento de creatinina de ≥ 50 a < 80 ml/min), la dosis inicial recomendada es de 3 mg una vez al día. La dosis puede incrementarse hasta 6 mg una vez al día, basándose en la respuesta clínica y en la tolerabilidad.
Para los pacientes con insuficiencia renal de moderada a grave (aclaramiento de creatinina ≥ 10 a < 50 ml/min), la dosis recomendada de INVEGA® es de 3 mg una vez al día. Dado que no se han realizado estudios con INVEGA® en pacientes con aclaramiento de creatinina < 10 ml/min, no se recomienda su utilización en estos pacientes.
Ancianos: Las recomendaciones posológicas para los pacientes ancianos con función renal normal (≥ 80 ml/min) son las mismas que para los adultos con función renal normal (véase el primer párrafo del apartado anterior, Posología y forma de administración).
No obstante, como puede que los pacientes ancianos tengan una función renal menor de la normal, la dosis debe ajustarse dependiendo del estado de la función renal (véase el apartado anterior, Pacientes con insuficiencia renal).
Adolescentes y niños: La seguridad y la eficacia de INVEGA® para el tratamiento de esquizofrenia en pacientes < 12 años de edad no se ha establecido. La seguridad y eficacia de INVEGA® para el tratamiento de trastornos de esquizofrenia en pacientes < 18 años no se ha estudiado.
Otras poblaciones especiales: No se recomienda ajustar la dosis de INVEGA® en función del sexo, de la raza o de si el paciente es fumador o no. (Respecto a las pacientes embarazadas o en período de lactancia, véase Embarazo y lactancia).
INSTRUCCIONES DE USO Y MANIPULACIÓN <Y ELIMINACIÓN>: No hay requisitos especiales.
Fabricado por: Ver embalaje exterior.
Fecha de revisión del texto: Octubre del 2011
JANSSEN PHARMACEUTICAL COMPANIES
NATURALEZA Y CONTENIDO DEL ENVASE:
Frascos: Frasco de polietileno de alta densidad (HDPE) de color blanco con sellado de inducción y cierre de polipropileno a prueba de niños. Cada frasco contiene una bolsita de desecante. Frasco de 75 cc de 30 comprimidos, frasco de 160 cc de 350 comprimidos.
Blísteres:
— Cloruro de polivinilo (PVC) laminado con una capa de policloro-trifluoroetileno (PCTFE)/aluminio que se rompe haciendo presión sobre ella.
— Capa de poliamida orientada (OPA)-aluminio-cloruro de polivinilo (PVC)/aluminio que se rompe haciendo presión sobre ella.