
HALDOL- DECANOAS
HALOPERIDOL
Solución inyectable
Ampolletas de vidrio color ámbar, 1 ml Solución inyectable, 50 mg/ml
Ampolletas de vidrio color ámbar, 3ml Solución inyectable, 50 mg/ml
Ampolletas de vidrio color ámbar, 1 ml Solución inyectable, 100 mg/ml
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Cada ml de HALDOL® DECANOAS 50 mg/ml se expresa en términos del contenido de haloperidol y es equivalente a 70,52 mg de haloperidol decanoato.
Cada ml de HALDOL® DECANOAS 100 mg/ml se expresa en términos del contenido de haloperidol y es equivalente a 141,04 mg de haloperidol decanoato.
Los excipientes figuran en la Lista de excipientes.
FORMA FARMACÉUTICA: Solución inyectable.
Aspecto:
— Soluciones inyectables de 50 mg/ml y 100 mg/ml.
— Solución ligeramente ámbar, ligeramente viscosa. Sin materiales extraños visibles.
INDICACIONES TERAPÉUTICAS: HALDOL® DECANOAS está indicado para el tratamiento de mantenimiento de la esquizofrenia crónica y otras psicosis. También está indicado en el tratamiento de otros trastornos mentales y del comportamiento, en los casos en que la agitación psicomotora requiera un tratamiento de mantenimiento.
PROPIEDADES FARMACOLÓGICAS:
Propiedades farmacodinámicas: Código ATC N05AD01.
Haloperidol decanoato es un éster de haloperidol y del ácido decanoico y, como tal, un neuroléptico depositivo perteneciente al grupo de las butirofenonas. Tras la inyección intramuscular, el tejido muscular va liberando progresivamente haloperidol decanoato, que se hidroliza lentamente en haloperidol libre, penetrando éste en el sistema circulatorio general.
Haloperidol decanoato es un potente antagonista de la dopamina y, por consiguiente, un neuroléptico muy eficaz.
En el cerebro, haloperidol decanoato ejerce una acción eficaz contra los delirios y las alucinaciones (probablemente a través de una interacción con los receptores de la dopamina en los tejidos mesocortical y límbico) y tiene efectos inhibidores debido a su acción en los ganglios basales, es decir, el haz nigroestriado, en el que radican igualmente los efectos secundarios motores extrapiramidales (a saber, distonía, acatisia y parkinsonismo).
Haloperidol produce una eficaz sedación psicomotriz, lo que explica su beneficioso efecto en manías y otros síndromes de agitación.
Se ha observado un efecto de resocialización en pacientes introvertidos.
Los efectos antidopaminérgicos más periféricos explican la acción antiemética (a través de la zona desencadenante de los quimioreceptores), la relajación de los esfínteres gastrointestinales y la mayor liberación de prolactina (por la inhibición de la acción del factor inhibidor de la prolactina, PIF, al nivel de la adenohipófisis).
Propiedades farmacocinéticas:
— Absorción: La administración de haloperidol decanoato mediante una inyección intramuscular depositiva tiene como resultado la liberación lenta y sostenida de haloperidol libre.
Las concentraciones plasmáticas aumentan progresivamente, alcanzando por lo general su valor máximo a los 3-9 días de la inyección. La farmacocinética de haloperidol decanoato administrado mediante inyecciones intramusculares depende de la dosis administrada. La relación entre la dosis y la concentración plasmática de haloperidol es más o menos lineal tratándose de dosis inferiores a 450 mg.
— Distribución: Haloperidol cruza fácilmente la barrera hematocefálica. La fijación en las proteínas plasmáticas alcanza el 92%.
— Metabolización: El haloperidol se metaboliza por distintas rutas, como el sistema enzimático del citocromo P450 (en particular las isoenzimas CYP 3A4 o CYP 2D6) y la glucuronidación.
— Eliminación: Tras alcanzar las concentraciones plasmáticas máximas, los niveles descienden con una vida media aparente de unas 3 semanas. El haloperidol se excreta en la orina (40%) y las heces (60%). El 1% de la dosis, aproximadamente, se excreta en la orina sin sufrir cambio alguno.
— Farmacocinética de la administración continuada: Las concentraciones plasmáticas en estado estable se alcanzan al cabo de entre 2 y 4 meses en pacientes que reciben inyecciones mensuales.
— Concentraciones terapéuticas: Se ha sugerido la necesidad de un intervalo de concentraciones plasmáticas de haloperidol que iría desde 4 µg/l hasta un límite superior de 20 a 25 µg/l para obtener una respuesta terapéutica.
DATOS FARMACÉUTICOS:
Lista de excipientes: Alcohol bencílico, aceite de sésamo refinado.
Incompatibilidades: Esta solución inyectable no debe administrarse en infusión debido a su base oleosa.
Período de validez: 3 años.
Precauciones especiales de conservación: Consérvese entre 15 y 30 ºC. Protéjase de la luz.
Manténgase fuera del alcance de los niños.
CONTRAINDICACIONES: Estado comatoso; depresión del SNC debida a la ingestión de alcohol u otros fármacos depresivos; enfermedad de Parkinson; hipersensibilidad conocida a HALDOL® DECANOAS o a sus excipientes (contiene aceite de sésamo); lesión de los ganglios basales.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO: Se han descrito casos raros de muerte súbita en enfermos psiquiátricos tratados con fármacos antipsicóticos, entre ellos HALDOL® DECANOAS.
Los pacientes ancianos con psicosis relacionada con demencia tratada con fármacos antipsicóticos presentan un mayor riesgo de muerte. Los análisis de diecisiete ensayos controlados mediante placebo (duración modal de 10 semanas), principalmente en pacientes que tomaban fármacos antipsicóticos atípicos, revelaron un riesgo de muerte en pacientes tratados con el medicamento de 1,6 a 1,7 veces superior al riesgo de muerte en pacientes tratados con placebo. Durante el transcurso de un ensayo típico controlado de 10 semanas de duración, la incidencia de mortalidad en pacientes tratados con el medicamento fue de un 4,5% frente al 2,6% en el grupo placebo. Aunque los pacientes fallecieron debido a diferentes causas, la mayoría de las muertes resultaron ser de naturaleza cardiovascular (por ejemplo, insuficiencia cardiaca, muerte súbita) o infecciosa (por ejemplo, neumonía). Estudios observacionales sugieren que, al igual que sucede con los fármacos antipsicóticos atípicos, el tratamiento con fármacos antipsicóticos convencionales puede aumentar la incidencia de mortalidad. El grado en que se puede atribuir a los fármacos antipsicóticos el aumento de mortalidad concluido en los estudios observacionales en contraposición con algunas características de los pacientes, no está claro.
Efectos cardiovasculares: Se han registrado algunos casos aislados de prolongación del intervalo QT y/o arritmias ventriculares con haloperidol, así como algunos casos raros de muerte súbita. Pueden darse con mayor frecuencia cuando la dosis es elevada y en pacientes propensos.
Al observarse una prolongación del intervalo QT durante el tratamiento con haloperidol, se recomienda prudencia en pacientes con estados asociados a una prolongación del intervalo QT (síndrome del intervalo QT, hipocalemia, alteración del equilibrio de electrolitos, fármacos que prolongan el intervalo QT (consulte Interacciones con otros medicamentos y otras formas de interacción), enfermedades cardiovasculares, antecedentes familiares de prolongación del intervalo QT), especialmente si el haloperidol se administra por vía parenteral. Las dosis elevadas o la administración parenteral, en particular por vía intravenosa, pueden aumentar el riesgo de aparición de prolongación del QT y/o arritmias ventriculares.
HALDOL® DECANOAS no debe administrarse por vía intravenosa.
También se han registrado casos de taquicardia e hipotensión en pacientes ocasionales.
Síndrome neuroléptico maligno: Al igual que ocurre con otros antipsicóticos, HALDOL® DECANOAS se ha relacionado con el síndrome neuroléptico maligno: una respuesta idiosincrásica rara caracterizada por hipertermia, rigidez muscular generalizada, inestabilidad autónoma y alteración de la consciencia. La hipertermia constituye a menudo el signo inicial de este síndrome. Se suspenderá inmediatamente el tratamiento antipsicótico y se establecerá una terapia de apoyo apropiada y una cuidadosa observación.
Discinesia tardía: Como ocurre con todos los antipsicóticos, se puede presentar una discinesia tardía en algunos pacientes sometidos a un tratamiento prolongado o después de interrumpirlo. El síndrome se caracteriza principalmente por movimientos rítmicos involuntarios de la lengua, el rostro, la boca o las mandíbulas. En algunos pacientes, estas manifestaciones pueden ser de carácter permanente. El síndrome podría enmascararse al reanudar el tratamiento, al aumentar la dosis o al administrar un antipsicótico diferente. El tratamiento debe interrumpirse lo antes posible.
Síntomas extrapiramidales: Como sucede con todos los neurolépticos, pueden aparecer síntomas extrapiramidales de tipo temblor, rigidez, hipersalivación, bradicinesia, acatisia y distonía aguda.
En estos casos, se pueden prescribir fármacos antiparkinsonianos con actividad anticolinérgica, según sea necesario, pero nunca de modo preventivo. Si se requiere simultáneamente medicación antiparkinsoniana, puede que sea necesario prolongarla una vez retirado HALDOL® DECANOAS si su excreción fuera más rápida que la de haloperidol, con el fin de evitar la aparición o la agravación de síntomas extrapiramidales. El médico deberá tener presente el posible aumento de la presión intraocular cuando administre anticolinérgicos, incluyendo agentes antiparkinsonianos, en combinación con HALDOL® DECANOAS.
Crisis/convulsiones: Se ha señalado que HALDOL® DECANOAS puede desencadenar ataques. Asimismo, se recomienda cautela en los pacientes con epilepsia u otras enfermedades que predisponen a las crisis convulsivas (por ejemplo, abstinencia de alcohol y lesiones cerebrales).
Problemas hepatobiliares: Como HALDOL® DECANOAS se metaboliza en el hígado, se recomienda precaución en pacientes con hepatopatías. Se conocen casos aislados de anomalías de la función hepática o hepatitis, habitualmente colestásica.
Problemas del sistema endocrino: La tiroxina puede potenciar la toxicidad de HALDOL® DECANOAS. El tratamiento antipsicótico debe usarse con el máximo cuidado en pacientes con hipertiroidismo y siempre deberá ir acompañado de un tratamiento para mantener una adecuada función tiroidea.
Los efectos hormonales de los fármacos neurolépticos antipsicóticos incluyen la hiperprolactinemia, que a su vez puede producir galactorrea, ginecomastia y oligorrea o amenorrea. Se han registrado casos aislados de hipoglucemia y del síndrome de secreción inapropiada de ADH.
Tromboembolismo venoso: Casos de tromboembolismo venoso (TEV) han sido reportados con fármacos antipsicóticos. Debido a que los pacientes tratados con antipsicóticos presentan frecuentemente factores de riesgo adquiridos para (TEV), todos los factores de riesgo para (TEV) deben ser identificados antes y durante el tratamiento con HALDOL® y acciones preventivas deben ser tomadas.
Consideraciones adicionales: Al igual que con todos los agentes antipsicóticos, cuando predomina la depresión no debe usarse únicamente HALDOL® DECANOAS. Se puede combinar con antidepresivos para tratar los casos en que coexistan la depresión y la psicosis.
EMBARAZO Y LACTANCIA: Los estudios en animales han demostrado un efecto teratogénico del haloperidol (véase sección 5.3).
Los neonatos expuestos a fármacos antipsicóticos (incluido el haloperidol) durante el tercer trimestre de embarazo, corren el riesgo de sufrir síntomas extrapiramidales y/o síntomas de abstinencia de intensidad variada, después del parto. Estos síntomas, en los neonatos, pueden incluir agitación, hipertonía, hipotonía, temblores, somnolencia, distrés respiratorio y trastornos alimentarios.
No apareció ningún aumento significativo de anomalías fetales como consecuencia de HALDOL® DECANOAS en estudios de grandes poblaciones. Se han detectado casos aislados de malformación congénita tras la exposición fetal a HALDOL® DECANOAS en combinación con otros fármacos. No se utilizará HALDOL® DECANOAS durante el embarazo, salvo que el beneficio esperado justifique el riesgo potencial para el feto.
HALDOL® DECANOAS se excreta en la leche materna. Si el uso de HALDOL® DECANOAS se considera imprescindible, deberán sopesarse los beneficios de la lactancia materna frente a sus riesgos potenciales.
Asimismo, se han comunicado síntomas extrapiramidales en lactantes cuyas madres recibían tratamiento con HALDOL® DECANOAS.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: Sobre todo en dosis elevadas y en la fase inicial del tratamiento, puede darse un cierto grado de sedación o una disminución de la agudeza mental, efectos que pueden acentuarse bajo la influencia del alcohol. Se le recomendará al paciente que no conduzca ni maneje máquinas hasta que se conozca su sensibilidad al fármaco.
REACCIONES ADVERSAS:
Datos del ensayo clínico:
— Datos del ensayo abierto y comparativo-Reacciones adversas a fármacos presentadas con una incidencia ≥1%: La seguridad de HALDOL® DECANOAS (de 15 a 500 mg/mes) se evaluó en 410 pacientes que participaron en 13 ensayos clínicos en el tratamiento de la esquizofrenia o un trastorno esquizoafectivo.
En la tabla 1 se muestran las reacciones adversas a fármacos (ADR) presentadas por ≥1% de pacientes tratados con HALDOL® DECANOAS.
|
Tabla 1. Reacciones adversas a fármacos presentadas por ≥1% de los pacientes tratados con HALDOL® DECANOAS en los ensayos clínicos abiertos y comparativos de HALDOL® DECANOAS |
|
|
Clasificación de órganos del sistema Reacción adversa |
HALOPERIDOL® DECANOAS (n=410) % |
|
Trastornos del sistema nervioso |
|
|
Trastorno extrapiramidal |
13,6 |
|
Temblor |
8,0 |
|
Parkinsonismo |
7,3 |
|
Somnolencia |
4,9 |
|
Fascies parkinsoniana |
4,1 |
|
Acatisia |
3,4 |
|
Sedación |
2,7 |
|
Trastornos gastrointestinales |
|
|
Boca seca |
3,4 |
|
Estreñimiento |
2,0 |
|
Hipersecreción salival |
1,2 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|
|
Rigidez muscular |
6,1 |
|
Trastornos del aparato reproductor y de la mama |
|
|
Disfunción sexual |
1,5 |
|
Trastornos generales y alteraciones en el lugar de administración |
|
|
Reacción en la zona de inyección |
1,2 |
|
Investigaciones |
|
|
Aumento de peso |
2,9 |
— Datos del ensayo abierto y comparativo – Reacciones adversas a fármacos presentadas con una incidencia <1%: En la tabla 2 se muestran las reacciones adversas a fármacos presentadas por <1% de pacientes tratados con HALDOL® DECANOAS en alguno de los datos del ensayo anterior.
|
Tabla 2. Reacciones adversas a fármacos presentadas por <1% de los pacientes tratados con HALDOL® DECANOAS en los ensayos clínicos abiertos y comparativos de HALDOL® DECANOAS. |
|
Trastornos del sistema nervioso |
|
Acinesia Discinesia Hipertonía Distonía Rigidez en rueda dentada |
|
Trastornos oculares |
|
Visión borrosa Alteraciones visuales Crisis oculogírica |
|
Trastornos cardíacos |
|
Taquicardia |
A continuación se enumeran las reacciones adversas a fármacos adicionales que se han identificado en ensayos clínicos con otras formulaciones de haloperidol (no decanoas):
Trastornos endocrinos: Hiperprolactinemia.
Trastornos psiquiátricos: Disminución o pérdida de la libido; agitación.
Trastornos del sistema nervioso: Síndrome neuroléptico maligno; discinesia tardía; bradicinesia; vértigo; hipercinesia: hipocinesia; disfunción motora; contracción muscular involuntaria; nistagmo.
Trastornos vasculares: Hipotensión; hipotensión ortostática.
Trastornos musculoesqueléticos y del tejido conectivo: Trismo; tortícolis; espasmos musculares; rigidez musculoesquelética; fasciculación muscular.
Trastornos del aparato reproductor y de la mama: Amenorrea; galactorrea; trastorno menstrual; disfunción eréctil; molestias en las mamas; dolor en las mamas; disminorrea; menorragia.
Trastornos generales y alteraciones en el lugar de administración: Alteraciones de la marcha.
Datos tras la comercialización: En la Tabla 3 se incluyen los primeros acontecimientos adversos identificados como ADR durante la experiencia tras la comercialización con haloperidol. La revisión tras la comercialización se realizó en base a todos los casos incluidos los productos que contienen haloperidol y haloperidol decanoas. En la tabla se proporcionan las frecuencias según la siguiente convención:
— Muy frecuentes ≥1/10
— Frecuentes ≥1/100 a <1/10
— Poco frecuentes ≥1/1000 a <1/100
— Raras ≥1/10000 a <1/1000
— Muy raras <1/10000, incluidos casos aislados.
En la tabla 3 se presentan las reacciones adversas a fármacos por categoría de frecuencia basada en porcentajes de observación espontánea.
|
Tabla 3: Reacciones adversas a fármacos identificadas durante la experiencia tras la comercialización con haloperidol (oral, solución o Decanoas) por categoría de frecuencia estimada de porcentajes de observación espontánea. |
|
|
Trastornos de la sangre y del sistema linfático |
|
|
Muy raro |
Agranulocitosis, pancitopenia, trombocitopenia, leucopenia, neutropenia |
|
Trastornos del sistema inmunológico |
|
|
Muy raro |
Reacción anafiláctica, hipersensibilidad |
|
Trastornos endocrinos |
|
|
Muy raro |
Secreción inadecuada de hormona antidiurética |
|
Trastornos nutricionales y metabólicos |
|
|
Muy raro |
Hipoglucemia |
|
Trastornos psiquiátricos |
|
|
Muy raro |
Trastorno psicótico, agitación, estado confusional, depresión, insomnio |
|
Trastornos del sistema nervioso |
|
|
Muy raro |
Convulsión, cefalea |
|
Trastornos cardíacos |
|
|
Muy raro |
Torsade de pointes, fibrilación ventricular, taquicardia ventricular, extrasístoles |
|
Trastornos respiratorios, torácicos y mediastínicos |
|
|
Muy raro |
Broncoespasmo, laringoespasmo, edema laringeo, disnea |
|
Trastornos gastrointestinales |
|
|
Muy raro |
Vómitos, nauseas |
|
Trastornos hepatobiliares |
|
|
Muy raro |
Insuficiencia hepática aguda, hepatitis, colestasis, ictericia, pruebas de función hepática anormales |
|
Trastornos de la piel y del tejido subcutáneo |
|
|
Muy raro |
Vasculitis Leucocitoclástica, dermatitis exfoliativa, urticaria, reacción de fotosensibilidad, erupción, prurito, hiperhidrosis |
|
Trastornos renales y urinarios |
|
|
Muy raro |
Retención urinaria |
|
Embarazo, puerperio y enfermedades perinatales |
|
|
Muy raro |
Síndrome de abstinencia neonatal |
|
Trastornos del aparato reproductor y de la mama |
|
|
Muy raro |
Priapismo, ginecomastia |
|
Trastornos generales y alteraciones en el lugar de administración |
|
|
Muy raro |
Muerte súbita, edema de cara, edema, hipotermia, hipertermia, absceso en el lugar de la inyección |
|
Investigaciones |
|
|
Muy raro |
Intervalo QT del electrocardiograma prolongado, disminución de peso |
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN: Al igual que con otros antipsicóticos, se recomienda precaución a la hora de prescribir haloperidol junto con medicamentos que prolongan el intervalo QT.
El haloperidol se metaboliza por distintas rutas, como la glucuronidación y el sistema enzimático del citocromo P450 (en particular las isoenzimas CYP 3A4 o CYP 2D6).
La inhibición de estas rutas metabólicas por efecto de otro fármaco o una disminución en la actividad de la isoenzima CYP 2D6 pueden causar un aumento de las concentraciones de haloperidol y un mayor riesgo de acontecimientos adversos, como la prolongación del intervalo QT. En estudios farmacocinéticos se ha observado un aumento leve o moderado de las concentraciones de haloperidol cuando éste se administra conjuntamente con otros fármacos caracterizados como sustratos o inhibidores de las isoenzimas CYP 3A4 o CYP 2D6, como itraconazol, nefazodona, buspirona, venlafaxina, alprazolam, fluvoxamina, quinidina, fluoxetina, sertralina, clorpromazina y prometazina. Una disminución en la actividad de la isoenzima CYP2D6 puede aumentar las concentraciones de haloperidol. Se han observado incrementos de QTc cuando haloperidol se administra en combinación con los inhibidores metabólicos ketoconazol (400 mg/día) o paroxetina (20 mg/día).
Puede que sea necesario reducir la dosis de haloperidol.
Se recomienda cautela cuando se utilice en combinación con medicamentos que alteran el equilibrio de electrolitos.
Efecto de otros medicamentos en haloperidol: Si se añaden al tratamiento con HALDOL® DECANOAS fármacos inductores de enzimas, como carbamazepina, fenobarbital o rifampicina, de forma prolongada, los niveles plasmáticos de haloperidol disminuyen de forma significativa. Por consiguiente, se debe ajustar la dosis de HALDOL® DECANOAS o el intervalo de dosis durante un tratamiento combinado, cuando sea necesario. Una vez suspendidos estos fármacos, puede que sea necesario reducir la dosis de HALDOL® DECANOAS.
El valproato sódico, un medicamento que inhibe la glucuronidación, no afecta a las concentraciones plasmáticas de haloperidol.
Efecto de haloperidol en otros medicamentos: Al igual que todos los neurolépticos, HALDOL® DECANOAS puede aumentar la depresión del sistema nervioso central provocada por otros fármacos depresores del SNC, como alcohol, hipnóticos, sedativos o analgésicos fuertes. Asimismo, se ha descrito una intensificación de su efecto sobre el SNC cuando se combina con metildopa.
HALDOL® DECANOAS puede antagonizar la acción de la adrenalina y otros agentes simpatomiméticos y contrarrestar el efecto hipotensor de los agentes bloqueantes adrenérgicos como la guanetidina.
HALDOL® DECANOAS puede alterar los efectos antiparkinsonianos de la levodopa.
El haloperidol es un inhibidor de la isoenzima CYP 2D6. Además, HALDOL® DECANOAS inhibe la metabolización de los antidepresivos tricíclicos, aumentando así las concentraciones plasmáticas de estos fármacos.
Otras formas de interacción: En raras ocasiones se han observado los síntomas siguientes durante el tratamiento concomitante con litio y haloperidol decanoato: Encefalopatía, síntomas extrapiramidales, discinesia tardía, síndrome neuroléptico maligno, lesiones del tronco cerebral, síndrome cerebral agudo y coma. La mayoría de estos síntomas son reversibles, pero se desconoce si se trata de una entidad clínica aparte.
Sea como fuere, se recomienda suspender inmediatamente el tratamiento simultáneo con litio y HALDOL® DECANOAS si el paciente presenta estos síntomas.
Se ha descrito efecto antagónico con el anticoagulante fenindiona.
DATOS PRECLÍNICOS SOBRE SEGURIDAD: Los datos preclínicos no indican riesgos especiales para el ser humano, según estudios convencionales de tolerabilidad local, toxicidad por administración continuada, genotoxicidad y carcinogenicidad. En roedores, la administración de haloperidol causó una disminución de la fertilidad, una teratogenicidad limitada y efectos embriotóxicos.
Se ha demostrado que haloperidol bloquea los canales hERG cardíacos en varios estudios in vitro publicados. En ciertos estudios in vivo, la administración intravenosa de haloperidol en algunos modelos animales causó una importante prolongación del intervalo QTc, en dosis de aproximadamente 0,3 mg/kg por vía intravenosa, con unos niveles de Cmáx plasmática entre 3 y 7 veces mayores que las concentraciones plasmáticas humanas eficaces, de 4 a 20 ng/ml. Estas dosis intravenosas que prolongaron el intervalo QTc no causaron arritmias. En algunos estudios, dosis intravenosas más elevadas, de 1 a 5 mg/kg de haloperidol por vía intravenosa, causaron la prolongación del intervalo QTc y/o arritmias ventriculares a niveles de Cmáx plasmática entre 19 y 68 veces mayores que las concentraciones plasmáticas humanas eficaces.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN: HALDOL® DECANOAS, administrado mediante inyección, está destinado al tratamiento de pacientes psicóticos crónicos que precisan una terapia antipsicótica parenteral prolongada. Antes de administrar HALDOL® DECANOAS a estos pacientes, es preciso estabilizarlos con una medicación antipsicótica.
HALDOL® DECANOAS está destinado exclusivamente a los adultos y ha sido formulado para proporcionar a la mayor parte de los pacientes una terapia de un mes de duración mediante una sola inyección intramuscular profunda en la región glútea.
HALDOL® DECANOAS no debe administrarse por vía intravenosa. En la medida en que la administración de dosis superiores a 3 ml sea molesta para el paciente, se recomienda no inyectar volúmenes tan grandes.
Debido a que la respuesta de cada paciente a las medicaciones neurolépticas es variable, es preciso determinar la posología de este fármaco en cada caso particular, y resulta recomendable administrarlo inicialmente y ajustar la dosis bajo estrecha vigilancia clínica. La dosis inicial individual depende tanto de la gravedad de los síntomas como de la cantidad de la medicación oral requerida para el tratamiento de mantenimiento previo al tratamiento depositivo.
Se recomienda que la dosis inicial de HALDOL® DECANOAS sea 10-15 veces la dosis diaria anterior de haloperidol oral. Para la mayoría de los pacientes, esto representa una dosis inicial comprendida entre 25 y 75 mg de HALDOL® DECANOAS. La dosis inicial máxima no debe exceder de 100 mg.
Según la respuesta del paciente a la medicación, puede ir aumentándose progresivamente la dosis en incrementos de 50 mg hasta conseguir el efecto terapéutico óptimo. La dosis mensual más apropiada de HALDOL® DECANOAS equivale a menudo a 20 veces, aproximadamente, la dosis diaria de haloperidol oral.
Durante el período de ajuste de la dosis o en episodios de exacerbación de los síntomas psicóticos, la terapia a base de HALDOL® DECANOAS puede completarse con haloperidol normal.
El intervalo de tiempo entre las inyecciones suele ser de cuatro semanas. No obstante, la variabilidad de la respuesta entre distintos pacientes puede imponer la necesidad de un ajuste del intervalo entre las dosis.
Utilización del fármaco en pacientes ancianos o debilitados: Se recomienda iniciar el tratamiento con dosis bajas, por ejemplo de 12,5 mg a 25 mg cada 4 semanas, incrementando la dosis de acuerdo con la respuesta del paciente.
SOBREDOSIS: Aunque la probabilidad de una sobredosificación es menor con una medicación parenteral que con una medicación oral, proporcionamos información relativa a halperidol oral, modificada al efecto exclusivo de evidenciar la larga duración de la acción producida por HALDOL® DECANOAS.
Síntomas: Los síntomas consisten en una intensificación de los efectos farmacológicos conocidos y de los efectos secundarios. Los síntomas más destacados son: Reacciones extrapiramidales graves, hipotensión y sedación. La reacción extrapiramidal se manifiesta por rigidez muscular y un temblor generalizado o localizado. También puede producirse hipertensión en lugar de hipotensión. En casos extremos, el paciente puede presentar un estado comatoso, con depresión respiratoria e hipotensión, que puede ser tan grave como para producir un estado parecido al de shock. Se tendrá en cuenta el riesgo de arritmias ventriculares, posiblemente asociadas a una prolongación del intervalo QT.
Tratamiento: Debido a que no existe antídoto específico alguno, el tratamiento es esencialmente paliativo. En los pacientes en estado comatoso se establecerá una vía respiratoria abierta utilizando una vía orofaríngea o un tubo endotraqueal. La depresión respiratoria puede requerir respiración artificial. La hipotensión y el colapso respiratorio se pueden contrarrestar usando fluidos intravenosos, plasma o albúmina concentrada, así como agentes vasoconstrictores como la dopamina o la noradrenalina. No se usará adrenalina.
En el caso de reacciones severas de tipo extrapiramidal, se administrará medicación antiparkinsoniana con acción anticolinérgica que se mantendrá durante varias semanas.
Dicha medicación se retirará con sumo cuidado, ya que pueden aparecer síntomas extrapiramidales.
El ECG y las constantes vitales se monitorizarán permanentemente hasta que el ECG sea normal. Las arritmias severas se tratarán con medidas antiarrítmicas adecuadas.
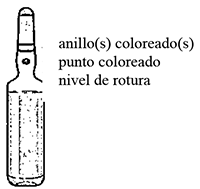
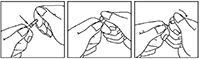
INSTRUCCIONES DE USO Y MANIPULACIÓN <Y ELIMINACIÓN>: Antes de utilizarla, haga rodar la ampolla entre las palmas de las manos unos instantes para calentarla.
1. Sujete la ampolla entre el dedo pulgar y el índice, dejando libre la punta.
2. Sostenga con la otra mano la punta de la ampolla, colocando el dedo índice sobre el cuello de ésta y el pulgar sobre el punto coloreado, paralelo al (a los) anillo(s) identificador(es) de color.
3. Manteniendo el pulgar sobre el lugar indicado, rompa bruscamente la punta de la ampolla, quedándose con la otra parte de la misma en la otra mano.
Fecha de revisión del texto: 29 de agosto del 2011
JANSSEN PHARMACEUTICAL COMPANIES
NATURALEZA Y CONTENIDO DEL ENVASE:
HALDOL® DECANOAS 50 mg/ml se suministra en ampollas de 1 ml y 3 ml de vidrio ámbar tipo I.
HALDOL® DECANOAS 100 mg/ml se suministra en ampollas de 1 ml de vidrio ámbar tipo I.