
GARDASIL
PAPILOMA HUMANO, VIRUS DEL
Jeringas prellenadas
1 Caja, 1 Jeringa(s) prellenada(s), única Dosis, 0.5 Mililitros
INDICACIONES: GARDASIL® es una vacuna indicada en niñas y mujeres de 9 a 45 años de edad para la prevención del cáncer cervicouterino, vulvar, vaginal y anal; de las lesiones precancerosas o displásicas; de las verrugas genitales; y de la infección, causados por el virus del papiloma humano (VPH).
GARDASIL® está indicada para prevenir las siguientes enfermedades:
— Cáncer cervicouterino, vulvar, vaginal y anal causados por el VPH tipos 16 y 18.
— Verrugas genitales (condilomas acuminados) causados por el VPH tipos 6 y 11.
Y para las infecciones y las siguientes lesiones precancerosas o displásicas causadas por el VPH tipos 6, 11, 16, y 18:
— Neoplasia intraepitelial cervical (NIC) grado 2/3 y adenocarcinoma cervicouterino in situ (AIS, por sus siglas en inglés).
— Neoplasia intraepitelial cervical (NIC) de grado 1.
— Neoplasia intraepitelial vulvar (NIV) de grados 2 y 3.
— Neoplasia intraepitelial vaginal (NIVa) de grados 2 y 3.
— NIV grado 1 y NIVa grado 1.
— Displasia anal intraepitelial (AIN) grado 1, 2 y 3.
GARDASIL® también proporciona protección en niñas y mujeres de 9 a 26 años de edad en contra de la NIC (grados 1, 2, 3) o AIS relacionados con el VPH 31, 33, 52 y 58.
GARDASIL® está indicado en niños y hombres de 9 a 26 años de edad para la prevención de lesiones genitales externas e infecciones y las siguientes enfermedades causadas por los tipos de VPH incluidos en la vacuna:
— Cáncer anal causado por el VPH tipos 16 y 18.
— Verrugas genitales (Condiloma acuminata) causadas por el VPH tipos 6 y 11.
Y las siguientes lesiones precancerosas o displásicas causadas por el VPH tipos 6, 11,16 y 18:
— Neoplasia anal intraepitelial (AIN) grados 1, 2 y 3.
FARMACOCINÉTICA Y FARMACODINAMIA EN HUMANOS:
Carga de la enfermedad:
En todo el mundo, cada año se diagnostican más de 490,000 casos de cáncer cervicouterino. La prevención del cáncer cervicouterino se centra en el tamizaje repetido (a saber, frotis de Papanicolaou, pruebas de virus del papiloma humano o ambas) y la intervención temprana. Tal estrategia ha reducido las tasas de cáncer aproximadamente 75% en el mundo desarrollado, pero ha desviado la carga, pasando del manejo del cáncer cervicouterino a la detección y el tratamiento de un gran número de lesiones premalignas.
El cáncer cervicouterino es causado por una infección por el virus del papiloma humano (VPH). Es necesaria la infección por VPH para que aparezcan el cáncer cervicouterino de células escamosas (y su lesión precursora, la neoplasia intraepitelial cervical o NIC de grados 1 y 2/3) y el adenocarcinoma cervicouterino (y su lesión precursora, el adenocarcinoma in situ [AIS]). El VPH también causa un subgrupo de cánceres vulvares y vaginales, así como sus lesiones precursoras, la neoplasia intraepitelial vulvar (NIV) y la neoplasia intraepitelial vaginal (NIVa).
La infección por el VPH es muy común. La mayoría de las infecciones por VPH desaparecen sin secuelas, pero algunas avanzan hasta desembocar en cáncer cervicouterino y/u otras enfermedades relacionadas con VPH. A falta de vacunación, más de 50% de los individuos sexualmente activos se infectarán con el VPH a lo largo de la vida. Los hombres juegan un importante papel en la transmisión de VPH a sus parejas sexuales. Varios estudios prospectivos han demostrado un alto nivel de concordancia de VPH entre parejas que recientemente fueron infectadas, indicando transmisión de VPH entre parejas (hombre a mujer, y mujer a hombre). Los datos consistentemente soportan la naturaleza de la transmisión sexual de VPH y el papel del hombre en las mujeres infectadas, quienes subsecuentemente pueden desarrollar cáncer ano genital y verrugas relacionadas con VPH. Con base a estas líneas de evidencia es de esperar que la disminución de riesgo de VPH en los hombres a través de la vacunación debe disminuir el riesgo de infección de sus parejas sexuales, proporcionando un beneficio adicional en la salud pública.
La infección por el VPH de los tipos 6, 11, 16 y 18 puede ocasionar resultados anormales en la citología de Papanicolaou y lesiones displásicas de grado leve (NIC 1, NIV 1 y NIVa 1). Las lesiones por el VPH de los tipos 6 y 11 tienen pocas probabilidades de progresar hasta el cáncer, pero son clínicamente indistinguibles de las lesiones premalignas causadas por el VPH de los tipos 16 y 18.
La infección por el VPH de los tipos 6 y 11 también causa verrugas genitales (condilomas acuminados), excrecencias que aparecen en la mucosa cervicovaginal, vulvar, perianal e intra anal y en los genitales externos, que rara vez progresan hasta el cáncer. Se ha calculado que el riesgo de por vida de contraer verrugas genitales es superior al 10%. La incidencia de estas lesiones por lo general es comparable entre hombres y mujeres.
El VPH de los tipos 6 y 11 también causa la papilomatosis respiratoria recurrente (PRR), una enfermedad de los lactantes y los adultos. La papilomatosis respiratoria recurrente se caracteriza por la aparición repetida de verrugas en las vías respiratorias. En Estados Unidos, cada año se diagnostican 5,900 casos. El tratamiento requiere intervenciones quirúrgicas repetidas.
La infección por VPH se asocia fuertemente con cáncer anal. La gran mayoría de cáncer anal es cáncer cervicouterino de células escamosas (CCE). Los CCE anales son positivos en el 80 a 90% de hombres y mujeres. El VPH tipo (73%) y el VPH 18 (5%) son los tipos más comunes asociados. Aproximadamente 100,000 nuevos casos de cáncer anal se estima ocurran anualmente alrededor del mundo y la tasa de casos de cáncer anal va en aumento. No hay pruebas de detección de rutina para este tipo de cáncer en personas sanas.
El VPH es la causa aceptada de cáncer de células escamosas de cabeza y cuello (CCECC), y data emergente demuestra un aumento en las décadas pasadas en la proporción de cáncer de cabeza y cuello causados por el VPM. La mayoría de CCEOC relacionados al VPH ocurren en la orofaringe, específicamente en el área de las amígdalas del anillo de Waldeyer. Del cáncer orofaríngeo, de un 60 - 70% es causado por el VPM, y de estos aproximadamente un 90% esta asociado al VPM tipo 16. En general, aproximadamente 2/3 de estos casos ocurren en hombres. La infección oral y seropositiva para VPH 16 ha sido asociada con un riesgo significativamente elevado para el desarrollo de CCECC.
GARDASIL® es una vacuna recombinante con proteínas L1 parecidas a los tipos de VPH 6, 11, 16 y 18.
Los tipos 16 y 18 causan aproximadamente:
— 70% de los casos de cáncer cervicouterino, adenocarcinoma in situ, y NIC 3.
— 50% de los casos de NIC 2.
— 70% de los casos de cáncer vulvar y vaginal relacionados con el VPH, casos de NIV 2/3, y NIVa.
— 90% de los casos de cáncer anal y sus lesiones precursoras relacionados con el VPH.
— 60% de los casos de cáncer de pene relacionados con VPH.
Los tipos de VPH 6, 11, 16 y 18 causan aproximadamente:
— 35 a 50% de los casos de NIC 1, NIV 1 y NIVa.
Los tipos de VPH 6 y 11 causan aproximadamente:
— 90% de los casos de verrugas genitales y PRR.
— 9 a 12% de los casos de NIC 1.
El tipo de VPH 16 causa aproximadamente:
— 90% de cáncer de células escamosas orofaríngeo.
Los efectos de GARDASIL® también han sido estudiados en el VPH tipos 31, 33, 52, 56, 58 y 59.
Estos tipos causan aproximadamente:
— 11.6% de los casos de cáncer cervicouterino.
— 32.2% de los casos de NIC 1.
— 39.3% de los casos de NIC 2.
— 24.3% de los casos de NIC y AIS.
Mecanismo de acción: GARDASIL® contiene PPV, las cuales son proteínas parecidas a viriones naturales. Debido a que las partículas parecidas a los virus no contienen DNA viral, no pueden infectar células o reproducirse.
En estudios preclínicos, la inducción de anticuerpos anti papilomavirus de la vacuna con PPV resultó en protección contra la infección. La administración de suero de animales vacunados a los no vacunados resulta en la transferencia de protección contra VPH a los animales no vacunados. Estos datos sugieren que la eficacia de la vacuna con PPV es mediada por el desarrollo de las respuestas inmunes humorales.
Estudios clínicos: En las participantes femeninas la neoplasia intraepitelial cervical 2/3 y el adenocarcinoma in situ son los precursores inmediatos del carcinoma de células escamosas invasor y del adenocarcinoma cervicouterino invasor, respectivamente. Se ha demostrado que su detección y extirpación previene el cáncer invasor (prevención secundaria); así pues, su prevención primaria mediante la vacunación también prevendrá el cáncer invasor.
No puede emplearse el cáncer cervicouterino invasor como un punto final en los estudios de eficacia de las vacunas contra el VPH, debido a la importancia de emplear medidas de prevención secundaria. Así pues, los precursores inmediatos, tales como la NIC 2 (displasia cervicouterina de grado moderado), la NIC 3 (displasia cervicouterina de grado alto, que incluye el carcinoma in situ), y el adenocarcinoma in situ son los puntos finales más apropiados para demostrar la prevención del cáncer cervicouterino mediante las vacunas contra el VPH.
La neoplasia intraepitelial cervical 3 y el adenocarcinoma in situ se clasifican como cánceres cervicouterinos de grado 0, según la FIGO (Federación Internacional de Ginecología y Obstetricia). La neoplasia intraepitelial vulvar y la neoplasia intraepitelial vaginal de grados 2 y 3 son, respectivamente, las precursoras de los cánceres vulvares y vaginales relacionados con el VPH.
En los hombres, arriba del 84% de la neoplasia (NIP) 1 (bajo grado) intraepitelial penial/perineal/perianal y cerca del 90% de NIP 3 (alto grado) ha sido asociado con VPH. El VPH 16 es el tipo más común detectado. Eritroplasia de Queyrat (EQ), Enfermedad de Bowen (EB), y Papulosis Bowenoide (PB) son las manifestaciones clínicas de alto grado de NIP. Tan alto como un 33% de EB y EQ han sido asociadas con cáncer invasivo. La PB raramente progresa a malignidad.
La eficacia de GARDASIL® se evaluó en 6 estudios clínicos de Fase II y III, doble ciego, con distribución al azar, controlados con placebo. El primer estudio de Fase II evaluó el componente de VPH 16 de GARDASIL® (Protocolo 005, N=2,391 niñas y mujeres), y el segundo evaluó todos los componentes de GARDASIL® (Protocolo 007, N=551). Tres estudios de Fase III, denominados FUTURE (siglas en inglés de Mujeres Unidas para Reducir Unilateralmente las Enfermedades Ecto- y Endocervicales), evaluaron GARDASIL® en 5,442 (FUTURE I), 12,157 (FUTURE II), y 3,817 (FUTURE III) niñas y mujeres. Un cuarto estudio fase III, Protocolo 020, evaluó GARDASIL® en 4055 niños y hombres incluyendo un subconjunto de 598 (GARDASIL®= 299; PLACEBO= 299) hombres que se autoidentificaron como hombres que tienen sexo con hombres (población HSH) . En conjunto, dichos estudios evaluaron a 24,358 niñas y mujeres que tenían entre 16 a 45 años de edad y 4055 niños y hombres de 16 a 26 años al ingreso. La mediana de duración del seguimiento fue de 4.0, 3.0, 3.0, 3.0, 4.0, y 2.9 años para el Protocolo 005, el Protocolo 007, FUTURE I, FUTURE II, y FUTURE III, y el Protocolo 20, respectivamente. Los participantes recibieron la vacuna o placebo el día de su ingreso y 2 y 6 meses después. Se analizó la eficacia por separado en cada estudio y en todos los estudios conducidos en niñas y mujeres combinados.
Los estudios no tuvieron una fase de detección. Así pues, en los estudios se incluyó a personas que habían estado expuestas a alguno de los tipos del VPH de la vacuna antes del ingreso. En términos generales, 73% de 16 a 26 años de edad de las niñas y mujeres y 67% de 16 a 45 años de edad de las mujeres nunca habían estado expuestas a ninguno de los 4 tipos de VPH al ingreso. En promedio, el 83% de los niños y hombres de 16 a 26 años nunca habían estado expuestos a ninguno de los 4 tipos de VPH al ingreso. Los participantes que no tuvieron exposición previa continuaron en riesgo de contraer infecciones y enfermedades causadas por los cuatro tipos de VPH presentes en la vacuna. De las mujeres de 24 a 45 años de edad, sólo el 0.4% estuvieron expuestas a los 4 tipos de VPH presentes en la vacuna. De los niños y hombres de 16 a 26 años de edad, sólo 0.2% estuvieron expuestos a los cuatro tipos de VPH presentes en la vacuna.
Eficacia profiláctica – VPH tipos 6, 11, 16 y 18 en niñas y mujeres de 16 a 26 años de edad: GARDASIL® fue sumamente eficaz para reducir la incidencia de cánceres cervicouterino, vulvar y vaginal; neoplasia intraepitelial cervical (de cualquier grado); de adenocarcinoma in situ; de cáncer cervicouterino no invasor (NIC 3 y adenocarcinoma in situ); y de lesiones genitales externas, incluidos los condilomas acuminados y las neoplasias intraepiteliales vulvares y vaginales (de cualquier grado) causadas por el VPH tipos 6, 11, 16 y 18. Con base en un análisis preespecificado de las lesiones evidentes a partir de 30 días después de la primera dosis, se demostró que la vacuna ya era eficaz durante el curso del esquema de vacunación, de tres dosis.
Los análisis primarios de eficacia, con relación al VPH tipos 6, 11, 16 y 18, se realizaron en la población de eficacia con apego al protocolo (EAP), conformada por participantes que recibieron las 3 dosis de vacuna en el curso de 1 año después del ingreso, no presentaron desviaciones importantes con respecto al protocolo del estudio y no habían estado expuestas (eran inmunológicamente “vírgenes”) al tipo o tipos relevantes de VPH antes de la primera dosis y hasta un mes después de la tercera dosis (mes 7). La eficacia se midió a partir de la consulta del 7° mes.
La eficacia de GARDASIL® en contra de la NIC 2/3 o AIS relacionadas con el VPH 16 o 18 fue de 98.2% (IC de 95%: 93.5%, 99.8%) al combinar los protocolos. Los análisis de cada uno de los protocolos demostraron los siguientes resultados: 100% (IC de 95%: 65.1%, 100.0%) en el Protocolo 005, 100% (IC de 95%: <0.0%, 100.0%) en el Protocolo 007, 100% (IC de 95%: 89.2%, 100.0%) en el FUTURE I y 96.9% (IC de 95%: 88.2%, 99.6%) en el FUTURE II. Se presentaron dos casos de NIC 3 que ocurrieron en el grupo que recibió GARDASIL®. En el primer caso se detectaron el VPH 16 y el VPH 52. Este paciente fue infectado de manera crónica con el VPH 52 (infección en el día 1, y meses 32.5 y 33.6) en 8 de 11 especímenes, incluyendo tejido que fue extirpado durante una escisión electroquirúrgica con asa (EEA). Se encontró VPH 16 en 1 de 11 especímenes en el Mes 32.5. El VPH 16 no fue detectado en el tejido que fue extirpado durante la EEA. En el segundo caso, se detectaron VPH 16, VPH 51, y VPH 56. Este paciente fue infectado con HPV 51 (infección detectada por PCR en el día 1) en 2 de 9 especímenes. VPH 56 fue detectado (en tejido extirpado durante una EEA) en 3 de 9 especímenes en el Mes 52. VPH fue detectado en 1 de 9 especímenes por biopsia en el Mes 51. Dado que estos casos ocurrieron en el contexto de una infección mixta, con el tipo dominante no presente en la vacuna de VPH, parece ser que el tipo relacionado con la vacuna de VPH no fue la causa del tipo de VPH. Con base a esta evaluación, puede deducirse que la eficacia de la vacuna contra la NIC 2/3 o AIS relacionada con el VPH 16/18 fue de 100%.
La eficacia de GARDASIL® contra NIC 2/3 o AIS relacionada con el VPH 16 fue de 97.9% (I C de 95%: 92.3%, 99.8%) al combinar los protocolos. La eficacia de GARDASIL® contra NIC 2/3 o AIS relacionada con el VPH 18 fue de 100% (IC de 95%: 86.6%, 100%) al combinar los protocolos.
La eficacia de GARDASIL® contra la NIV 2/3 relacionada con el VPH 16 o 18 fue de 100% (IC de 95%: 55.5%, 100.0%) al combinar los protocolos. El análisis de cada uno de los protocolos demostró los siguientes resultados: 100% (IC de 95%:14.4%, 100.0%) en el FUTURE I y 100% (IC de 95%: <0.0%, 100.0%) en el FUTURE II.
La eficacia de GARDASIL® contra la NIVa 2/3 relacionada con el VPH 16 o 18 fue de 100% (IC de 95%: 49.5%, 100.0%) al combinar los protocolos. El análisis de cada uno de los protocolos demostró los siguientes resultados: 100% (IC de 95%:<0.0%, 100.0%) en el FUTURE I y 100% (IC de 95%: <0.0%, 100.0%) en el FUTURE II.
La eficacia de GARDASIL® contra la NIC (NIC 1, NIC 2/3) o AIS relacionados con el VPH 6, 11, 16 o 18 fue de 96.0% (IC de 95%: 92.3%, 98.2%) al combinar los protocolos. El análisis de cada uno de los protocolos demostró los siguientes resultados: 100% (IC de 95%:<0.0%, 100.0%) en el Protocolo 007, 100% (IC de 95%: 95.1%, 100.0%) en el FUTURE I y 93.8% (IC de 95%: 88.0%, 97.2%) en el FUTURE II.
La eficacia de GARDASIL® contra las lesiones genitales (verrugas genitales, NIV, NIVa, cáncer vulvar y cáncer vaginal) relacionadas con el VPH 6, 11, 16 o 18 fue de 99.1% (IC de 95%: 96.8%, 99.9%) al combinar los protocolos. El análisis de cada uno de los protocolos demostró los siguientes resultados:
100% (IC de 95%:<0.0%, 100.0%) en el Protocolo 007, 100% (IC de 95%: 94.9%, 100.0%) en el FUTURE I y 98.7% (IC de 95%: 95.2%, 99.8%) en el FUTURE II.
La eficacia de GARDASIL® contra las verrugas genitales relacionadas con el VPH 6 y 11 fue de 99.0% (IC de 95%: 96.2%, 99.9%) al combinar los protocolos.
Análisis complementario de eficacia para los puntos finales del cáncer en niñas y mujeres de 16 a 26 años de edad
En un análisis complementario, la eficacia de GARDASIL® fue evaluada contra el cáncer cervicouterino (NIC 2/3 y AIS) Etapa 0 de acuerdo con la FIGO relacionado con el VPH 16/18 y para los precursores inmediatos del cáncer vulvar y vaginal (NIV 2/3 o NIVa 2/3 en la población de eficacia por protocolo (PEPP) y en la población modificada por intención de tratar-2 (PMIT-2). La PMIT-2 consistió en pacientes que no habían sido expuestos al tipo o tipos relevantes de VPH (tipos 6, 11, 16 y 18) antes de la dosis 1, que recibieron por lo menos una dosis de la vacuna o placebo, y que tuvieron por lo menos una visita de seguimiento después del Día 30. La población PMIT-2 fue diferente a la PEPP en que la primera incluye individuos con violaciones importantes al protocolo y que se infectaron con un tipo incluido en la vacuna durante el periodo de vacunación. La eficacia se midió comenzando 30 días Post dosis 1 para la población PMIT-2.
La eficacia de GARDASIL® contra enfermedad relacionada con el VPH 16/18 fue de 96.9% (IC de 95%: 88.4%, 99.6%), 100% (IC de 95%: 30.6%, 100.0%), y 100% (IC de 95%: 78.6%, 100.0%) para NIC 3, AIS, y NIV 2/3 o NIVa 2/3, respectivamente, en la población por protocolo. La eficacia de GARDASIL® en contra de enfermedad relacionada con el VPH 16/18 fue de 96.7% (IC de 95%: 90.2%, 99.3%), 100% (IC de 95%: 60.0%, 100.0%), y 97.0% (IC de 95%: 82.4%, 99.9%) para NIC 3, AIS, y NIV 2/3 o NIVa 2/3, respectivamente, en la PMIT-2.
La eficacia profiláctica en contra de la infección persistente general o enfermedad en una fase de extensión del Protocolo 007, que incluyó datos desde el Mes 60, fue 95.8% (IC de 95%: 83.8%, 99.5%). En el grupo que recibió GARDASIL®, no se observaron casos a pesar de la inmunidad decreciente.
GARDASIL® fue igualmente eficaz contra las enfermedades por el VPH causadas por los tipos de VPH 6, 11, 16 y 18.
Eficacia en niñas y mujeres de 16 a 26 años de edad con infección actual o previa con el VPH Tipos 6, 11, 16 y 18
Los individuos que ya estaban infectados con uno o más tipos de VPH relacionados con la vacuna antes de la vacunación fueron protegidos de la enfermedad clínica causada por los tipos de VPH remanentes.
Los individuos con evidencia de una infección previa que decidieron vacunarse al comienzo de la enfermedad fueron protegidos de una readquisición o recurrencia de la infección que los llevara a enfermedad clínica.
Los individuos que recibieron GARDASIL®, pero que tenían infección en curso por el VPH al momento de la vacunación, tuvieron un 21.6% (IC de 95%: <0.0%, 42.1%) menos incidencia de NIC (NIC 1 o NIC 2/3) o AIS como resultado de esta infección al compararse con placebo. La infección en curso se definió como una infección de un tipo de VPH contenido en la vacuna al momento de la inclusión, pero sin evidencia de respuesta inmune a la misma.
Eficacia profiláctica en una población generalmente no expuesta al VPH y la población general del estudio – VPH tipos 31, 33, 45, 52, 56, 58 y 59 en niñas y mujeres de 16 a 26 años de edad:
La eficacia en protección cruzada de GARDASIL® fue evaluada en las bases de datos combinadas de los estudios FUTURE I y FUTURE II (N=17,599). El punto final primario de este análisis fue la incidencia combinada de NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 31 y 45. El punto final secundario de este análisis fue la incidencia combinada de NIC (grados 1, 2, 3) y AIS relacionadas con el VPH 31, 33, 45, 52 y 58. Los análisis también se realizaron para evaluar la eficacia con relación a la NIC (grados 1, 2, 3) o AIS causados por tipos de VPH de manera individual no incluidos en la vacuna. En participantes que nunca habían sido expuestos a los tipos de VPH relevantes de la vacuna en el Día 1 (PMIT-2, n=16,895 para el punto final compuesto de 31/45 y n = 16,969 para el punto final compuesto de 31/33/45/52/58), se observó una tendencia hacia la reducción de la incidencia de NIC grados 1, 2, 3) o AIS relacionada con VPH 31–, y 45- y VPH 31-,33-, 45-, 52-, y 58-. La administración de GARDASIL® redujo la incidencia de NIC (grados 1, 2, 3) o AIS en 37.3% (IC de 95%: 17.0%, 52.8%), comparado con placebo. La administración de GARDASIL® redujo la incidencia de la NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 31, 33, 45, 52 y 58 en 26.4% (IC de 95%: 12.9%, 37.8%), comparado con placebo. La eficacia fue impulsada por reducciones en los puntos finales relacionados con el VPH 31, 33, 52 y 58. No hubo una evidencia clara de eficacia para el VPH 45. En un análisis post hoc, la administración profiláctica de GARDASIL® también redujo la incidencia de NIC (grados 1, 2, 3) o AIS relacionados con el VPH 56 y 59, comparado con placebo en esta población.
Análisis post hoc posteriores consideraron la eficacia en 2 poblaciones clínicamente relevantes: (1) una población nunca antes expuesta al VPH (con resultado negativo a 14 tipos comunes de VPH y que tuvo una prueba de Papanicolaou con resultado negativo para LICE [lesiones intraepiteliales de células escamosas] en el Día 1), la cual asemejaba una población de participantes sin experiencia sexual previa más participantes poco después de su debut sexual; y (2) la población general del estudio de participantes sin importar su estado de VPH inicial, algunas de ellas con enfermedad relacionada con el VPH al comienzo de la vacunación. La administración de GARDASIL® a participantes sin exposición previa al VPH, redujo las incidencias de NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 31, 33, 52 y 58, de NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 56 y de NIC (grados 1, 2, 3) o AIS relacionadas con el VPH 59. Las reducciones en las tasas de estas enfermedades también fue observada en la población general del estudio (la cual incluyó participantes sin exposición previa al VPH y participantes infectadas con el VPH).
En la población sin exposición previa al VPH (n=9,296), GARDASIL® redujo la incidencia de NIC (cualquier grado) o AIS en 43.6% (IC de 95%: 12.9%, 64.1%) para el VPH tipos 31/45; 29.2% (IC de 95%: 8.3%, 45.5%) para el VPH tipos 31/33/45/52/58; 33.8% (IC de 95%: 13.4%, 49.6%) para el VPH tipos 31/33/52/58; 27.6% (IC de 95%: <0.0%, 49.3%) para el VPH tipo 56; y 22.3% (IC de 95%:<0.0%, 58.9%) para el VPH tipo 59.
En la población general del estudio (n = 17,151), GARDASIL® redujo la incidencia de NIC (cualquier grado) o AIS en 23.2% (IC de 95%: 5.6%, 37.7%) para el VPH tipos 31/45; 19.6% (IC de 95%: 8.2%, 29.6%) para el VPH tipos 31/33/45/52/58; 21.2% (IC de 95%: 9.6%, 31.3%) para el VPH tipos 31/33/52/58; 16.8% (IC de 95%: <0.0%, 32.8%) para el VPH tipo 56; y 39.2% (IC de 95%: 8.1%, 60.3%) para el VPH tipo 59.
Los análisis de eficacia cruzada demostraron que la administración profiláctica de GARDASIL® a los participantes reduce el riesgo de que adquieran NIC 1, NIC 2/3 y AIS causadas por los tipos de VPH 31, 33, 52, 56, 58 y 59.
Protección en contra de la carga general de enfermedad cervical, vulvar y vaginal por HPV en niñas y mujeres de 16 a 26 años de edad:
El impacto de GARDASIL® en contra del riesgo general de enfermedad cervical, vulvar y vaginal causado por el VPH (p. ej., enfermedad causada por cualquier tipo de VPH) fue evaluado en un análisis preespecificado en 17,599 participantes incluidos en el FUTURE I y FUTURE II. Entre estos participantes que no tuvieron exposición previa por lo menos a uno de los 14 tipos comunes de VPH y/o tuvieron una prueba de Papanicolaou negativa para LICE [lesión intraepitelial de células escamosas] en el Día 1 (población PMIT-2), la administración de GARDASIL® redujo la incidencia de NIC 2/3 o AIS causados por tipos de VPH contenidos o no en la vacuna en 33.8% (IC de 95%: 20.7%, 44.8%).
Se realizaron análisis posteriores de eficacia en 2 poblaciones clínicas relevantes: (1) una población nunca antes expuesta al VPH (con resultado negativo a 14 tipos comunes de VPH y que tuvo una prueba de Papanicolaou con resultado negativo para LICE [lesiones intraepiteliales de células escamosas] en el Día 1), la cual asemejaba una población de participantes sin experiencia sexual previa más participantes poco después de su debut sexual; y (2) la población general del estudio de participantes sin importar su estado de VPH inicial, algunas de ellas con enfermedad relacionada con el VPH al comienzo de la vacunación.
Entre las participantes sin exposición previa al VPH y entre la población general del estudio (incluyendo participantes con infección por VPH al comienzo de la vacunación), GARDASIL® redujo la incidencia general de NIC 2/3 o AIS; de NIV 2/3 o NIVa 2/3; o NIC (de cualquier grado) o AIS; y de verrugas genitales. Estas reducciones se debieron principalmente a reducciones en las lesiones causadas por el VPH tipos 6, 11, 16 y 18. Entre los participantes sin exposición previa y la población general del estudio, el beneficio de la vacuna con respecto a la incidencia general de NIC 2/3 o AIS (causados por cualquier tipo de VPH) fue más aparente conforme transcurrió el tiempo. Lo anterior debido a que GARDASIL® no tiene un impacto sobre la evolución de las infecciones que estén presentes al comienzo de la vacunación. Dichas participantes infectadas pueden tener NIC 2/3 o AIS al comienzo de la vacunación y algunas desarrollarán NIC 2/3 o AIS durante el seguimiento. GARDASIL® reduce la incidencia de NIC 2/3 o AIS causadas por infecciones por el VPH tipos 6, 11, 16, 18, 31, 33, 52, 56, 58 y 59 que ocurran después del comienzo de la vacunación.
GARDASIL® no ha demostrado proteger contra enfermedades causadas por cada tipo de VPH, y no tratará la enfermedad preexistente. La eficacia general de GARDASIL® variará con la prevalencia inicial de la infección y enfermedad por VPH, la incidencia de la infección en contra de las cuales GARDASIL® ha demostrado protección, y en aquellas infecciones en contra de las cuales GARDASIL® no ha demostrado proteger.
Impacto en las tasas de anormalidades de la prueba de Papanicolaou y en procedimientos cervicales, vulvares y vaginales en niñas y mujeres de 16 a 26 años de edad:
El impacto de GARDASIL® en las tasas de pruebas de Papanicolaou y procedimientos cervicales (biopsia colposcópica, terapia definitiva) independientemente de los tipos de VPH causantes fue evaluada en 18,150 participantes incluidos en el Protocolo 007, el FUTURE I y FUTURE II. El impacto de GARDASIL® en las tasas de procedimientos de extirpación quirúrgica para tratar las lesiones causadas por cualquier tipo de VPH fue evaluado en 5,455 participantes incluidos en el FUTURE I. Se consideraron dos poblaciones: (1) una población sin exposición previa al VPH (con resultado negativo a 14 tipos comunes de VPH y que tuvieron una prueba de Papanicolaou que fue negativa a LICE [lesión intraepitelial de células escamosas] en el Día 1), la cual asemejaba una población de participantes sin experiencia sexual previa más participantes poco después de su debut sexual; y (2) la población general del estudio de participantes sin importar su estado de VPH inicial, algunas de ellas con enfermedad relacionada con el VPH al comienzo de la vacunación.
En ambas poblaciones, GARDASIL® redujo las proporciones de participantes que experimentaron una anormalidad en la prueba de Papanicolaou sugerente de NIC, una biopsia colposcópica, un procedimiento de tratamiento cervicouterino definitivo (escisión electroquirúrgica con asa o conización por criocirugía), una biopsia vulvar o vaginal, o un procedimiento de extirpación definitivo en la vagina o vulva.
En resumen, la administración de GARDASIL® a la población general de participantes de 16 a 26 años de edad expuesta a VPH redujo la incidencia de anormalidades en la prueba de Papanicolaou (ASCUS positivas, LICE de bajo grado, o peores) relacionadas con el VPH 16 y 18 en 92.4% (IC de 95%: 83.7, 97.0) y 96.9% (IC de 95%: 81.6, 99.9%) en el estudio FUTURE I.
Eficacia profiláctica - VPH tipos 6, 11, 16, y 18 - en mujeres de 24 a 45 años de edad:
No ha sido definido un nivel mínimo de anticuerpos antiVPH que proporcione protección contra VPH. Asimismo, las respuestas inmunes a las vacunas en personas mayores de edad son comúnmente más bajas comparadas con las de los jóvenes. Por lo tanto, para confirmar la utilidad de GARDASIL® para prevenir cánceres cervical, vulvar, y vaginal y enfermedades relacionadas causadas por los tipos objetivo de la vacuna en participantes de hasta 45 años de edad, se realizó un estudio de eficacia (FUTURE III).
GARDASIL® fue muy eficaz en reducir la incidencia de infección persistente; NIC (cualquier grado); lesiones genitales externas (LGE) causadas por los tipos de VPH 6, 11, 16, y 18. GARDASIL® fue también muy eficaz en reducir la incidencia de VPH 16/18 relacionada con el diagnóstico por prueba de Papanicolaou de ASCUS (células escamosas atípicas de significado indeterminado) positivas para alto riesgo de VPH. Los análisis primarios de eficacia, con respecto a los tipos de VPH 6, 11, 16, y 18, fueron conducidos en una población de eficacia por protocolo (PEPP). La eficacia fue medida al inicio después de la visita 7 del mes.
La eficacia de GARDASIL® contra VPH 6-, 11-, 16- o 18- relacionados con infección persistente, NIC (cualquier grado) o LGE fue de 88.7% (IC de 95%: 78.1%, 94.8%).
La eficacia de GARDASIL® contra VPH 16- o 18- relacionados con infección persistente, NIC (cualquier grado), o LGE fue de 84.7% (IC de 95%: 67.5%, 93.7%).
Hubo un caso de NIC 2 (VPH 16 y VPH 51 identificados) en el grupo de PEPP. El caso NIC 2 fue positivo para VPH tipos 16 y 51 mediante biopsia en el Mes 18. Los restantes 9 casos en el grupo PPE fueron infecciones de punto final persistentes.
La eficacia de GARDASIL® contra infección persistente relacionada con VPH 6-, u 11-, NIC (cualquier grado) o LGE fue de 94.8% (IC de 95%: 79.9%, 99.4%).
La eficacia de GARDASIL® contra diagnóstico por Papanicolaou de ASCUS positivas relacionadas con VPH 16/18 fue de 96.3% (IC de 95%: 77.7%, 99.9%).
Con base en la eficacia de estos hallazgos, puede deducirse la eficacia de GARDASIL® con respecto a la prevención de cáncer cervical, vulvar, y vaginal y enfermedades relacionadas en participantes de hasta 45 años de edad.
Eficacia profiláctica – VPH Tipos 6, 11, 16, y 18 en niños y hombres de 16 a 26 años de edad:
En estudios clínicos en niños y hombres, la eficacia fue evaluada utilizando los siguientes puntos finales: Verrugas genitales externas; neoplasia penial/perineal/perianal (NIP) grados 1/2/3 o cáncer penial/perineal/perianal; e infección persistente. Un alto grado de NIP se asocia con ciertos tipos de cáncer penial/perineal/perianal. La infección persistente es un pronóstico de enfermedad clínica.
El análisis primario de eficacia fue conducido en una población de eficacia por protocolo (PEPP). Esta población consistió en participantes quienes recibieron las 3 dosis de vacunación dentro del 1er. año del reclutamiento, y no tenían desviaciones importantes del protocolo en estudio, y fueron sin exposición previa (PCR negativo y seronegativo) a el/los tipo(s) relevantes de VPH (Tipos 6, 11, 16, y 18) antes de la 1a dosis y durante 1 mes después de la 3a dosis (mes 7). La eficacia se midió al comienzo después de la visita en el mes 7.
GARDASIL® fue eficaz en reducir la incidencia de lesiones genitales externas (condiloma y NIP grados 1/2/3) e infección persistente relacionada a la vacuna de VPH tipos 6, 11, 16, o 18 en aquellos quienes fueron PCR negativo y seronegativo al inicio.
La eficacia de GARDASIL® contra VPH 6-, 11-, 16-, o 18-relacionado con lesiones genitales externas (Condiloma y NIP grados 1/2/3) fue de 90.6% (95% IC: 70.1%, 98.2%). Los análisis de los componentes individuales del punto final demostraron los siguientes resultados: 89.3% (95% IC: 65.3%, 97.9%) para condiloma y 100.0% (95% IC: <0.0%, 100.0%) para NIP grados 1/2/3.
La eficacia de GARDASIL® contra VPH 6-, 11-, 16-, o 18-relacionado con infección persistente fue de 85.5% (95% IC: 77.0%, 91.3%). Los análisis de participantes VPH serotipo-relacionado con infección persistente demostraron los siguientes resultados: 90.1% (95% IC: 75.3%, 96.9%), 94.4% (95% IC: 64.7%, 99.9%), 79.3% (95% IC: 61.9%, 89.6%), y 93.9% (95% IC: 76.3%, 99.3%), para VPH 6-, 11-, 16- y 18-relacionado con infección persistente, respectivamente.
Eficacia profiláctica- Enfermedad anal causada por el VPM tipos 6, 11, 16 y 18 en niños y hombres de 16 a 26 años de edad en el sub-estudio HSH: Un sub-estudio del protocolo 020 evalúo la eficacia de GARDASIL® contra enfermedad anal (neoplasia anal intraepitelial o cáncer anal) en una población de 598 HSH. En este sub-estudio, casos de AIN 2/3 fueron los puntos de eficacia utilizados para evaluar la prevención de cáncer anal relacionado al VPH. Los primeros análisis de eficacia fueron realizados en la población de Eficacia por Protocolo (PPE) del protocolo 020.
GARDASIL® fue eficaz en reducir la incidencia de Neoplasia Anal intraepitelial (AIN) grado 1 (tanto condiloma como no-acuminate), 2 y 3 relacionados con los serotipos de la vacuna 6, 11, 16 y 18 en aquellos niños y hombres PCR fue negativos y serotiponegativos al inicio del estudio.
La eficacia de GARDASIL® contra AIN 1/2/3 relacionada con el VPH 6-, 11-, 16-, o 18 fue 77.5% (95% IC: 39.6%, 93.3%). Análisis de los componentes individuales de la variable final demostraron los siguientes resultados: 74,9% (IC 95%: 8,8%, 95,4%) para AIN grados 2 / 3 y 73,0% (IC 95%: 16,3%, 93,4%) para AIN grado 1 (condiloma y no- acuminado).
Inmunogenicidad:
Análisis para medir la respuesta inmune: Análisis específicos de tipo con estándares específicos de tipo fueron utilizados para evaluar la inmunogenicidad contra cada tipo de VPH de la vacuna. Estos análisis midieron anticuerpos contra epítopos neutralizantes para cada tipo de VPH, en lugar de los anticuerpos totales dirigidos contra las partículas parecidas al virus de la vacuna. Las escalas para los análisis son únicas para cada tipo de VPH; por lo tanto, las comparaciones entre tipos y con otros análisis carecen de significado. Se demostró que los análisis empleados para medir la respuesta inmune a GARDASIL® se correlacionaron con la capacidad para neutralizar los viriones vivos de VPH.
Debido a la gran eficacia de GARDASIL® en los estudios clínicos, no ha sido posible establecer los niveles mínimos de anticuerpos anti-VPH 6, anti- VPH 11, anti-VPH 16 y anti-VPH 18 que protegen contra la enfermedad manifiesta por VPH.
La inmunogenicidad de GARDASIL® se evaluó en 23,951 de mujeres y niñas de 9 a 45 años de edad (GARDASIL®, N = 12,634; placebo, N = 11,317) y en 5,417 niños y hombres de 9 a 26 años de edad (GARDASIL®, N = 3,109; placebo, N = 2,308).
Los análisis primarios de inmunogenicidad se llevaron a cabo en una población de inmunogenicidad con apego al protocolo (IAP). Esta población consistió en individuos que eran seronegativos y tenían una reacción en cadena de la polimerasa (RCP) negativa para el tipo o tipos relevantes de VPH a su ingreso, que mantuvieron una RCP negativa para el tipo o tipos relevantes de VPH hasta un mes después de la tercera dosis (Mes 7), que recibieron las tres dosis de vacuna y que no se desviaron del protocolo del estudio de alguna manera que pudiera interferir con los efectos de la vacuna.
La inmunogenicidad fue medida por (1) el porcentaje de participantes que fueron seropositivos para anticuerpos contra los tipos relevantes de la vacuna de VPH, y (2) los Títulos Geométricos Promedio (TGP).
La respuesta inmune a GARDASIL® en el mes 7 en niñas y mujeres de 9 a 45 años de edad (punto en el tiempo aproximado al pico máximo de inmunogenicidad):
En la población de inmunogenicidad por protocolo de 9 a 45 años de edad, la seropositividad en el Mes 7 fluctuó de 96.4% a 99% a través de los 4 tipos de la vacuna y a través de las poblaciones definidas por rango de edad. Los TGPs de los niveles de anticuerpos antiVPH para todos los tipos disminuyeron con la edad. Este hallazgo era de esperarse, ya que las respuestas inmunes a las vacunas generalmente disminuyen con la edad de la vacunación. La eficacia de GARDASIL® permaneció alta a pesar de la disminución observada en los TGPs antiVPH relacionados con la edad.
La respuesta inmune a GARDASIL® en el mes 7 en niños y hombres de 9 a 26 años de edad (punto en el tiempo aproximado al pico máximo de inmunogenicidad):
En la población de inmunogenicidad por protocolo de 9 a 26 años de edad, la seropositividad en el Mes 7 fluctuó de 97.4% a 99.9% a través de los 4 tipos de la vacuna y a través de las poblaciones definidas por rango de edad. Los TGPs de los niveles de anticuerpos para todos los tipos disminuyeron con la edad. Este hallazgo era de esperarse, ya que las respuestas inmunes a las vacunas generalmente disminuyen con la edad de la vacunación. La eficacia de GARDASIL® permaneció alta a pesar de la disminución observada en los TGPs antiVPH relacionados con la edad.
Comparación de la eficacia de GARDASIL® en los adultos y en los adolescentes:
Un estudio clínico comparó las respuestas contra el VPH-6, el VPH-11, el VPH-16 y el VPH-18 en adolescentes de 10 a 15 años de edad con las respuestas en niñas y mujeres de 16 a 23 años de edad. Entre las niñas y mujeres que recibieron GARDASIL®, 99.1% a 100% se volvieron seropositivas contra el VPH-6, el VPH-11, el VPH-16 y el VPH-18, respectivamente, al término de un mes después de la tercera dosis. Las respuestas anti-VPH, tanto en adolescentes de 10 a 15 años de edad, fueron significativamente superiores a las observadas en las niñas y mujeres de 16 a 23 años de edad.
Se observaron resultados similares en una comparación de las respuestas anti-VPH un mes después de la tercera dosis en adolescentes de 9 a 15 años de edad con las respuestas anti-VPH en niñas y mujeres de 16 a 26 años de edad, en la base de datos combinada de los estudios de inmunogenicidad de GARDASIL®.
Las respuestas (TGPs) contra el VPH 6, VPH 11, VPH 16, y VPH 18 fueron comparadas entre adolescentes de 9 a 15 años de edad y niños y hombres de 16 a 26 años de edad. Entre los participantes que recibieron GARDASIL®, 97.4% a 99.9% se volvieron seropositivos contra el VPH 6, VPH 11, VPH 16, y VPH 18 al término de un mes después de la tercera dosis. Las respuestas anti VPH en adolescentes de 9 a 15 años de edad fueron significativamente superiores a aquellas observadas en los niños y hombres de 16 a 26 años de edad.
Con base en estas comparaciones de la inmunogenicidad, la eficacia de GARDASIL® en adolescentes de 9 a 15 años de edad es equiparable a la eficacia de GARDASIL® observada en los estudios de Fase III en niñas y mujeres de 16 a 26 años de edad. Adicionalmente la eficacia de GARDASIL® en adolescentes de 9 a 15 años de edad es comparable a la eficacia de GARDASIL® observada en los estudios en niños y hombres de 16 a 26 años de edad.
Persistencia de la respuesta inmune a GARDASIL®:
La duración de la inmunidad siguiendo un esquema completo de inmunización con GARDASIL® no ha sido establecida. Después de alcanzar el pico máximo en el Mes 7, los anti TGPs para todos los tipos de VPH disminuyeron en el Mes 24 y entonces los niveles se estabilizaron como al inicio.
En el Protocolo 007, se observaron picos de los Títulos Geométricos Promedio (TGP) antiVPH 6, antiVPH 11, antiVPH 16 y antiVPH 18 al Mes 7. Los TGP disminuyeron hasta el mes 24 y posteriormente se estabilizaron hasta por lo menos el mes 60 (véase la Figura 1).
Figura 1.
Persistencia de las respuestas Anti-HPV después de aplicar un esquema de 3-dosis de GARDASIL®
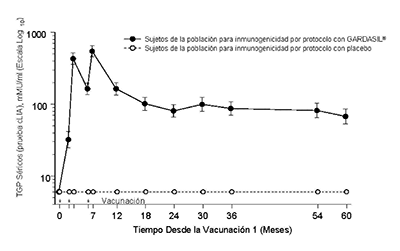
Persistencia de las Respuestas AntiHPV 6
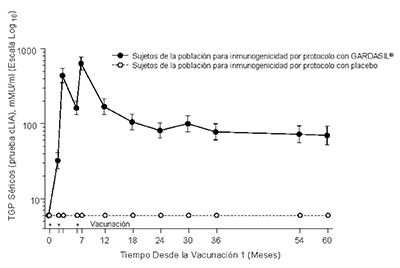
Persistencia de las Respuestas AntiHPV 11
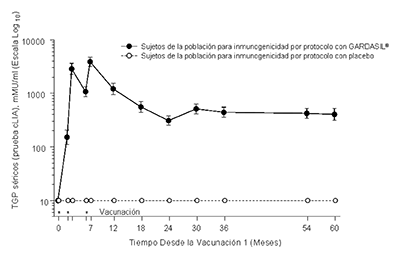
Persistencia de las Respuestas AntiHPV 16
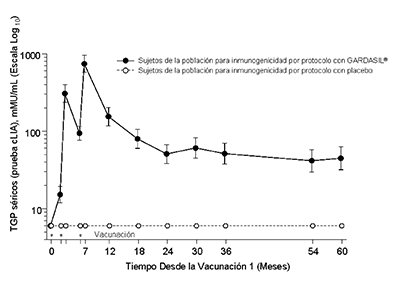
Persistencia de las Respuestas AntiHPV 18
Evidencia de respuesta anamnésica (memoria inmune):
La evidencia de respuesta inmune se observó en individuos vacunados que eran seropositivos al (los) tipo(s) de VPH relevantes antes de la vacunación.
En un estudio realizado para evaluar la capacidad de inducir memoria inmune, los individuos que recibieron 3 dosis en una primera serie de la vacuna recibieron una dosis de desafío de GARDASIL® 5 años después del comienzo de la vacunación. Estos participantes mostraron una respuesta rápida y potente que excedió los TGP antiVPH observados 1 mes Postdosis 3 (Mes 7). Los TGP 1 semana después de la dosis postdesafío fueron 0.9, 2.2, 1.2 y 1.4 veces más altos que los TGP de la Postdosis 3 para los tipos 6, 11, 16 y 18, respectivamente. Los TGP 1 mes después de la dosis postdesafío fueron 1.3, 4.2, 1.5 y 1.7 veces más altos que los TGP de la Postdosis 3 para los tipos 6, 11, 16 y 18, respectivamente. En la semana 1 después de la dosis de desafío, 87.2%, 94.9%, 86.4% y 95.2% de los individuos tuvieron TGP antiVPH 6, antiVPH 11, antiVPH 16 y antiVPH 18 más altos que aquellos detectados en el Mes 60.
Adicionalmente, un subgrupo de individuos que recibieron 3 dosis en una primera serie de la vacuna se convirtieron nominalmente en antiVPH 18 seronegativos en el Mes 60. Aunque estos individuos eran nominalmente antiVPH 18 seronegativos, no se detectaron casos de enfermedad relacionada con el VPH tipo 18 entre estos individuos. También mostraron memoria inmune; cuando a estos sujetos se les dio una dosis de desafío de GARDASIL® (al Mes 60), 93% y 97% se volvieron antiVPH 18 seropositivos a la semana 1 y en el Mes 1 post desafío, respectivamente; 73% tuvieron niveles de antiVPH18 al Mes 1 post desafío que fueron más elevados que los niveles antiVPH 18 al Mes 7 (1 mes Postdosis 3).
Persistencia de la respuesta inmune en los estudios Fase III de GARDASIL® en niñas y mujeres de 9 a 45 años de edad: La seropositividad de antiVPH 6, antiVPH 11, antiVPH 16, y antiVPH 18 fue más alta en el Mes 7, y después disminuyó persistentemente en los puntos de corte en el tiempo. En el Mes 48, la seropositividad del antiVPH fue más alta de los 9 a 15 años de edad y más baja de 35 a 45 años de edad.
La disminución en el porcentaje de seropositividad de respuestas para antiVPH fue más grande que la disminución de respuestas para antiVPH 6, antiVPH 11, y antiVPH 16. A pesar de esta disminución, la eficacia de la vacuna permaneció alta, a través de todos los grupos de edad. En la PEPP de los estudios FUTURE I y FUTURE II (mujeres entre 16 a 26 años de edad), la eficacia contra NIC 2/3 o AIS relacionadas con VPH 18 fue del 100% IC de 95%: 86.6%, 100.0%) y la eficacia contra NIC (cualquier grado) o AIS relacionadas con VPH 18 fue de 98.4% (IC de 95%: 90.6%, 100%). En la PEPP de el estudio FUTURE III, la eficacia contra la infección persistente o cervical, vulvar, y enfermedad vaginal relacionadas con VPH 18 fue de 100.0% (IC de 95%: 67.4%, 100.0%).
Persistencia de la respuesta inmune en los estudios Fase III de GARDASIL® en niños y hombres de 9 a 26 años de edad:
La seropositividad antiVPH 6, antiVPH 11, antiVPH 16 y antiVPH 18 fue más alta en el Mes 7, y después generalmente disminuyó persistentemente en los puntos de corte en el tiempo. En el Mes 36, la seropositividad contra VPH fue más alta de los 9 a 15 años de edad y más baja de 16 a 26 años de edad. Las respuestas en la disminución en el porcentaje de seropositividad para antiVPH 18 fueron mayores que las disminuciones en el porcentaje de seropositividad para antiVPH 6, antiVPH 11, y anti-VPH 16. A pesar de esta disminución, la eficacia de la vacuna permaneció alta, a través de todos los grupos de edad.
Flexibilidad del esquema: Todos los participantes evaluados en las poblaciones EAP de los estudios de Fase II y III recibieron el esquema de tres dosis de GARDASIL® en el transcurso de un año, independientemente del intervalo entre las dosis. Un análisis de los datos sobre la respuesta inmune sugiere que la flexibilidad de ±1 mes para la segunda dosis (es decir, del mes 1 al mes 3 en el esquema de vacunación) y la flexibilidad de ±2 meses para la tercera dosis (es decir, del Mes 4 al Mes 8 en el esquema de vacunación) no influye sustancialmente en las respuestas inmunes a GARDASIL® (véase Dosis y administración).
Estudios con otras vacunas
Vacuna de hepatitis B (recombinante): La seguridad y la inmunogenicidad de la administración simultánea de GARDASIL® con la vacuna contra la hepatitis B (recombinante) (en la misma fecha, pero inyectada en distintos sitios) se evaluaron en un estudio con distribución al azar de 1,871 mujeres que tenían entre 16 a 24 años al ingreso. La respuesta inmune y el perfil de seguridad, tanto de la vacuna contra la hepatitis B (recombinante) como de GARDASIL®, fueron similares cuando se les administró en la misma fecha o en fechas distintas.
Vacuna de la difteria, tétanos, tosferina (componente acelular) y poliomielitis (inactivada), (contenido de antígeno(s) adsorbido, reducido]: Se evaluó la seguridad e inmunogenicidad de la administración conjunta de GARDASIL® con la vacuna de la difteria, tétanos, tosferina (componente acelular) y poliomielitis (inactivado), (contenido de antígeno(s) adsorbido, reducido)] (misma visita, inyecciones en sitios separados) en un estudio aleatorio de 843 niños y niñas de 11 a 17 años de edad en el reclutamiento. La administración concomitante de GARDASIL® con la vacuna de la difteria, tétanos, tosferina (componente acelular) y poliomielitis (inactivada), (contenido de antígeno(s) no interfiere con la respuesta del anticuerpo a ninguno de los componentes de cualquiera de las vacunas. Además, el perfil de seguridad fue generalmente similar (ver Efectos colaterales, Administración concomitante con otras vacunas).
Vacuna meningocócica (grupos A, C, Y y W-135), vacuna polisacárida conjugada de toxoide diftérico y toxoide tetánico, toxoide diftérico reducido y vacuna adsorbida de tosferina acelular:
Se evaluó la seguridad e inmunogenicidad de la administración conjunta de GARDASIL® con la vacuna meningocócica (Grupos A, C, Y y W-135), vacuna polisacárida conjugada de toxoide diftérico y toxoide tetánico, toxoide diftérico reducido y vacuna adsorbida de tosferina acelular (misma visita, inyecciones en sitios separados) en un estudio aleatorio de 1040 niños y niñas de 11 a 17 años de edad al ser reclutados. La administración concomitante de GARDASIL® con la vacuna meningocócica (grupos A, C, Y y W-135), vacuna polisacárida conjugada de toxoide diftérico y toxoide tetánico, toxoide diftérico reducido y vacuna adsorbida de tosferina acelular no interfiere con la respuesta del anticuerpo con ninguno de los componentes de cualquiera de las vacunas. Además, el perfil de seguridad fue generalmente similar (ver Efectos colaterales, Administración concomitante con otras vacunas).
CONTRAINDICACIONES: Hipersensibilidad a las sustancias activas o a cualquiera de los excipientes de la vacuna.
Los individuos que presenten síntomas indicativos de hipersensibilidad después de recibir una dosis de GARDASIL® no deben recibir más dosis de GARDASIL®.
PRECAUCIONES: Al igual que con cualquier vacuna, la aplicación de GARDASIL® puede no brindar protección en todos los individuos vacunados con ella.
Esta vacuna no está indicada para el tratamiento de lesiones genitales externas activas; del cáncer cervicouterino, vulvar, vaginal o anal; ni del carcinoma intraepitelial cervical, vulvar o vaginal o la neoplasia anal intraepitelial.
Esta vacuna no protege contra enfermedades que no sean causadas por el VPH.
Al igual que con todas las vacunas inyectables, siempre debe tenerse disponible el tratamiento médico adecuado, en caso de que se presenten reacciones anafilácticas raras después de administrar la vacuna.
Puede suceder síncope (pérdida súbita del estado de conciencia) en cualquier momento de la vacunación, especialmente en adolescentes y adultos jóvenes. Síncope, algunas veces asociado con caídas, ha ocurrido después de la vacunación con GARDASIL®. Por lo tanto, los vacunados deben permanecer en observación por aproximadamente 15 minutos después de la administración de GARDASIL® (véase Reacciones secundarias. Reportes post comercialización).
La decisión de administrar la vacuna o posponerla debido a una enfermedad febril presente o reciente depende en gran medida de la gravedad de los síntomas y de su origen. La febrícula en sí y las infecciones leves de las vías respiratorias altas no suelen ser contraindicaciones para la vacunación.
Las personas con una respuesta inmune deficiente, ya sea por el empleo de tratamiento inmunosupresor, un defecto genético, infección por el virus de la inmunodeficiencia humana (VIH) u otras causas, pueden tener una menor respuesta de anticuerpos a la inmunización activa (véase Interacciones medicamentosas).
Esta vacuna debe administrarse con cautela a las personas que padezcan trombocitopenia o cualquier trastorno de la coagulación, ya que en ellas puede haber una hemorragia después de la inyección intramuscular.
Debe evitarse el embarazo durante el esquema de vacunación con GARDASIL® (véase Precauciones o restricciones de uso durante el embarazo o la lactancia, Embarazo).
EMPLEO EN ADULTOS MAYORES: No se han evaluado la seguridad y eficacia de GARDASIL® en adultos mayores de 45 años de edad.
EMPLEO EN POBLACIONES ESPECIALES: No se han evaluado a fondo la seguridad, la inmunogenicidad y la eficacia de GARDASIL® en personas con infección por el VIH.
USO DURANTE EL EMBARAZO:
Estudios en ratas hembras: Estudios en animales no indican un efecto nocivo directo o indirecto con respecto al embarazo, desarrollo embriónico/fetal, parto o desarrollo postnatal. GARDASIL® induce una respuesta de anticuerpos específicos con el VPH tipos 6, 11,16 y 18 en ratas embarazadas seguido de una o múltiples inyecciones intramusculares. Los anticuerpos de todos los tipos de HPV fueron transferidos a la cría durante la gestación y posiblemente durante la lactancia.
Estudios clínicos en humanos: Sin embargo, no hay estudios adecuados y bien controlados en mujeres embarazadas. Dado que los estudios de reproducción en animales no siempre pueden predecir la respuesta en los seres humanos, debe evitarse el embarazo durante el periodo de vacunación con GARDASIL®.
En los estudios clínicos, las participantes se sometieron a una prueba de embarazo en orina antes de administrarles cada dosis de GARDASIL®. A las mujeres en quienes se diagnosticó un embarazo antes completar el esquema de tres dosis de GARDASIL® se les indicó que pospusieran la conclusión del esquema de vacunación hasta después del embarazo. Tales esquemas no convencionales generaron una respuesta de anticuerpos contra el VPH de los tipos 6, 11, 16 y 18, después de la tercera dosis, comparable con las observadas en mujeres que recibieron un esquema de vacunación convencional a los 0, 2 y 6 meses (véase Dosis y administración).
Durante los estudios clínicos, 3,819 mujeres (N = 1,894 con vacuna vs. N = 1,925 con placebo) reportaron cuando menos un embarazo. Las proporciones generales de embarazos con desenlace desfavorable definido como el número combinado de casos de aborto espontáneo, muerte fetal tardía y anomalías congénitas fuera del número total de desenlaces de embarazos para los cuales un desenlace fue conocido (y excluyendo las terminaciones electivas), fueron 22.6% (446/1,973) en las participantes que recibieron GARDASIL® y 23.1% (460/1,994) en las participantes que recibieron placebo.
Se realizaron subanálisis ulteriores para evaluar los embarazos cuyo inicio se calculó en los 30 días siguientes o más de 30 días después de la administración de una dosis de GARDASIL® o placebo. Entre los embarazos cuyo inicio se calculó en los 30 días siguientes a la vacunación, se observaron cinco casos de anomalías congénitas en el grupo que recibió GARDASIL®, en comparación con 1 caso de anomalía congénita en el grupo que recibió placebo. A la inversa, entre los embarazos cuyo inicio se calculó más de 30 días después de la vacunación, se observaron 40 casos de anomalías congénitas en el grupo que recibió GARDASIL®, en comparación con 33 casos de anomalías congénitas en el grupo que recibió placebo. El tipo de anomalías observadas concordó con las que se observan por lo general en los embarazos de mujeres entre16 a 45 años de edad, independientemente de la fecha de inicio del embarazo con respecto a la vacunación.
Por lo tanto, no hay evidencia que sugiera que la administración de GARDASIL® influye negativamente sobre la fertilidad o el desenlace del embarazo o de los recién nacidos.
USO DURANTE LA LACTANCIA: Se desconoce si los antígenos de la vacuna o los anticuerpos que induce se excretan en la leche materna.
GARDASIL® puede ser administrado a mujeres lactando.
GARDASIL® o placebo fueron administrados a un total de 1,133 mujeres que amamantaron en cualquier momento durante los estudios clínicos fase III. En dichos estudios, la frecuencia de reacciones adversas en las madres y los lactantes fue comparable entre los distintos grupos de vacunación. Además, la inmunogenicidad de la vacuna fue comparable entre las madres lactantes y las mujeres que no amamantaron durante la administración de la vacuna.
REACCIONES SECUNDARIAS Y ADVERSAS:
Estudios clínicos: En 7 estudios clínicos (6 de ellos controlados con placebo), se administró a los participantes GARDASIL® o placebo el día de su ingreso y aproximadamente 2 y 6 meses después. GARDASIL® demostró un perfil de seguridad favorable cuando se le comparó con el placebo (ya fuese que este contuviera aluminio o no). Pocos participantes (0.2%) abandonaron los estudios por reacciones adversas. En todos los estudios clínicos salvo uno, la seguridad se evaluó mediante monitoreo apoyado en una bitácora o “libreta de calificaciones” durante 14 días después de cada inyección de GARDASIL® o placebo. Los participantes a quienes se monitoreó con el uso de la bitácora fueron 10,088 que recibieron GARDASIL® (6,995 niñas y mujeres de 9 a 45 años de edad y 3,093 niños y hombres de 9 a 26 años de edad al momento del ingreso) y 7,995 que recibieron placebo.
En quienes recibieron GARDASIL®, se observaron las siguientes reacciones adversas relacionadas con la vacuna, con una frecuencia de cuando menos 1.0% y también con una frecuencia mayor que en quienes recibieron placebo y se encuentran enlistadas de acuerdo a la frecuencia y órgano o sistema relacionado.
Las clasificaciones de frecuencia son las siguientes:
Muy comunes (≥1/10); comunes (≥1/100, <1/10); poco comunes (≥1/1,000, <1/100); raras (≥1/10,000, <1/1,000); muy raras (<1/10,000)
Reacciones adversas relacionadas con la vacunación en niñas y mujeres de 9 a 45 años de edad:
— Trastornos del sistema nervioso
• Muy comunes: Cefalea.
• Comunes: Mareo.
— Trastornos gastrointestinales
• Comunes: Náusea.
— Trastornos musculoesqueléticos y del tejido conectivo
• Comunes: Dolor en la extremidad.
— Trastornos generales y del sitio de administración
• Muy comunes: Pirexia.
Las siguientes reacciones en el sitio de inyección se presentaron con una incidencia mayor en el grupo que recibió GARDASIL® comparado con adyuvante de sulfato hidroxifosfato de aluminio amorfo o con el grupo que recibió solución salina como placebo:
— Muy comunes: Eritema, dolor, e hinchazón.
— Comunes: Prurito y hematoma.
La mayoría de las reacciones en el sitio de inyección fueron de intensidad leve a moderada.
Además, se reportó broncospasmo muy rara vez, como una reacción adversa grave.
Reacciones adversas relacionadas con la vacunación en niños y hombres de 9 a 26 años de edad
— Trastornos del sistema nervioso
• Comunes: Cefalea.
— Trastornos generales y del sitio de administración
• Comunes: Pirexia.
Las siguientes reacciones en el sitio de la inyección ocurrieron con mayor incidencia en el grupo que recibió GARDASIL® comparado con aquellos del grupo que contenía adyuvante de sulfato hidroxifosfato de aluminio amorfo o placebo de solución salina:
— Muy comunes: Eritema, dolor e hinchazón.
Las siguientes reacciones en el sitio de inyección ocurrieron con una incidencia mayor en el grupo que recibió GARDASIL® comparado con el grupo que recibió placebo conteniendo adyuvante de sulfato hidroxifosfato de aluminio amorfo:
— Comunes: Hematoma.
La mayoría de las reacciones en el sitio de inyección fueron de leves a moderadas.
Administración concomitante con otras vacunas: La seguridad de GARDASIL® administrado simultáneamente con otras vacunas fue evaluada en estudios clínicos. La frecuencia de las reacciones adversas observadas con la administración simultánea con la vacuna de hepatitis B (recombinante) fue similar a la frecuencia observada cuando GARDASIL® se administró solo.
Hubo un aumento de cefalea e inflamación en el sitio de inyección, cuando se administró GARDASIL® simultáneamente con la vacuna de difteria, tétanos, tosferina (componente acelular) y poliomielitis (inactivada) (contenido de antígeno(s) adsorbido, reducido).
Hubo un incremento en la inflamación en el sitio de inyección, cuando se administró GARDASIL® simultáneamente con la vacuna meningocócica (grupos A, C, Y y W-135), vacuna polisacárida conjugada con toxoide diftérico y toxoide tetánico, toxoide diftérico reducido y vacuna adsorbida de tosferina acelular.
La mayoría de estas experiencias adversas observadas con la administración concomitante con otras vacunas se reportaron en intensidad de leves a moderadas.
Reportes postcomercialización: Las siguientes reacciones adversas se han reportado de manera espontánea después de la aprobación de uso de GARDASIL®. Debido a que estas reacciones fueron reportadas de manera voluntaria por una población de tamaño desconocido, no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a la vacuna.
— Desórdenes de la sangre y sistema linfático: Púrpura trombocitopénica idiopática, linfadenopatía.
— Desórdenes del sistema nervioso: Encefalomielitis aguda diseminada, mareo, síndrome Guillian-Barré, cefalea, síncope algunas veces acompañado por movimientos tónico clónicos.
— Desórdenes gastrointestinales: Náusea, vómito.
— Desórdenes musculoesqueléticos y del tejido conectivo: Artralgia, mialgia.
— Trastornos generales y del sitio de administración: Astenia, escalofrío, fatiga, malestar.
— Desórdenes del sistema inmunitario: Reacciones de hipersensibilidad incluyendo reacciones anafilácticas/anafilactoides, broncoespasmo y urticaria.
INTERACCIONES MEDICAMENTOSAS:
Uso concomitante con otras vacunas: Los resultados de los estudios clínicos indican que GARDASIL® puede administrarse de manera simultánea (en un sitio de inyección distinto) con la vacuna contra la hepatitis B (recombinante), vacuna meningocócica (grupos A, C, Y y W-135), vacuna polisacárida conjugada con toxoide diftérico, toxoide tetánico, toxoide tetánico reducido y vacuna adsorbida de tosferina acelular, difteria, tétanos, tosferina (componente acelular,) y vacuna contra la poliomielitis (inactivada), (contenido de antígeno(s) adsorbido, reducido).
Uso concomitante con medicamentos comunes: En los estudios clínicos en niñas y mujeres (9 a 26 años de edad), 11.9%, 9.5%, 6.9% y 4.3% de los participantes usaron analgésicos, antiinflamatorios, antibióticos y preparados de vitaminas, respectivamente. En un estudio clínico en mujeres (24 a 45 años de edad), 30.6%, 20.2%, 11.6%, y 7.5% de las participantes utilizaron analgésicos, fármacos antiinflamatorios, antibióticos, y vitaminas, respectivamente. Recíprocamente en un estudio clínico en niños y hombres (16 a 26 años de edad), 10.3%, 7.8%, 6.8%, 3.4% y 2.6% de los participantes utilizaron analgésicos, fármacos antiinflamatorios, antibióticos, antihistamínicos y vitaminas, respectivamente. El empleo de tales medicamentos no influyó en la eficacia, inmunogenicidad y seguridad de la vacuna.
Uso concomitante con anticonceptivos hormonales: En los estudios clínicos, 50.2% de las mujeres (entre 16 y 45 años de edad) que recibieron GARDASIL® empleaban anticonceptivos hormonales. El empleo de anticonceptivos hormonales no pareció afectar la respuesta inmune a GARDASIL®.
Uso concomitante con esteroides: En los estudios clínicos en niñas y mujeres (16 a 26 años de edad), 1.7% (n = 158), 0.6% (n = 56) y 1.0% (n = 89) de los participantes usaron inmunosupresores inhalados, tópicos y parenterales, respectivamente. En un estudio clínico en mujeres (24 a 45 años de edad), 1.4% (n = 27) utilizaron corticosteroides para uso sistémico. En un estudio clínico en niños y hombres (16 a 26 años de edad), 1.0% (n = 21) utilizaron corticosteroides para uso sistémico. Los corticosteroides para todos los participantes fueron administrados cerca del momento de administración de una dosis de GARDASIL®. Estos medicamentos no parecieron afectar la respuesta inmune a GARDASIL®. Muy pocos participantes de los estudios clínicos tomaban esteroides, y se piensa que el grado de inmunosupresión causado por estos fue leve.
Uso concomitante con inmunosupresores sistémicos: No hay información sobre el uso concomitante de inmunosupresores potentes y GARDASIL®. Las personas que reciben tratamiento con agentes inmunosupresores (dosis sistémicas de corticosteroides, antimetabolitos, agentes alquilantes o citotóxicos) pueden no responder de manera óptima a la inmunización activa (véase Precauciones generales).
DOSIS Y VÍA DE ADMINISTRACIÓN:
Dosis:
GARDASIL® debe administrarse por vía intramuscular, en forma de tres dosis individuales de 0.5 ml, con el siguiente esquema:
Primera dosis: En la fecha elegida.
Segunda dosis: Dos meses después de la primera dosis.
Tercera dosis: Seis meses después de la primera dosis.
Debe alentarse a los pacientes para que se apeguen al esquema de vacunación de los 0, 2 y 6 meses. Sin embargo, en los estudios clínicos se ha demostrado su eficacia en individuos que recibieron las tres dosis en el transcurso de un año. Si es necesario otro esquema de vacunación, la segunda dosis debe administrarse cuando menos un mes después de la primera, y la tercera dosis debe administrarse cuando menos tres meses después de la segunda.
Método de administración: GARDASIL® debe administrarse por vía intramuscular, en la región deltoidea del brazo o en la zona antero lateral y superior del muslo.
GARDASIL® no debe inyectarse intravascular. No se han estudiado ni la administración subcutánea ni la intradérmica, y por consiguiente estos métodos de administración no se recomiendan.
La jeringa prellenada es para un solo uso, y no debe usarse para más de una persona. En el caso de los frascos ámpula, deben usarse una jeringa y una aguja estéril distinta para cada persona.
La vacuna debe administrarse tal como se presenta; no es necesario diluirla ni reconstituirla. Debe usarse la dosis completa recomendada de la vacuna.
Agítese bien antes de usarse: Es necesario agitar la vacuna con energía, inmediatamente antes de administrarla, para mantener el estado de suspensión.
Después de agitarlo vigorosamente, GARDASIL® es un líquido blanco turbio. Los medicamentos de uso parenteral deben inspeccionarse visualmente antes de su administración, en busca de partículas suspendidas y alteraciones de color. Debe desecharse el producto si contiene partículas o si presenta cambios de color.
Modo de empleo de la jeringa prellenada: Inyecte el contenido completo contenido en la jeringa prellenada.
SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL (ANTÍDOTOS): Se ha reportado la administración de dosis de GARDASIL® superiores a las recomendadas.
En general, el perfil de reacciones adversas reportadas con la sobredosis fue comparable al de las dosis únicas recomendadas de GARDASIL®.
EMPLEO EN NIÑOS Y NIÑAS: No se han evaluado la seguridad y eficacia de GARDASIL® en niños y niñas menores de 9 años de edad.
CLASE TERAPÉUTICA: GARDASIL®* es una vacuna recombinante, tetravalente contra el virus del papiloma humano (tipos 6, 11, 16, 18).
PRESENTACIÓN: GARDASIL® se suministra en una caja de cartón con una jeringa prellenada de dosis única de 0.5 mL.
Si requiere mayor información solicítela a la Dirección Médica al Teléfono: (507) 282-7200


RECOMENDACIONES PARA EL ALMACENAMIENTO: Consérvese en refrigeración entre 2 y 8 °C. No se congele. Protéjase de la luz. GARDASIL® debe administrarse tan pronto como sea posible después de sacarse de refrigeración. GARDASIL® puede estar sin refrigeración (a temperaturas de o bajo 25 °C) durante no más de 72 horas.