
ELIGARD
LEUPROLIDA
Ampollas
1 Juego, 2 Jeringa(s) prellenada(s), 1 Dosis, 7.5 Miligramos
1 Juego, 2 Jeringa(s) prellenada(s), 1 Dosis, 22.5 Miligramos
FÓRMULA CUALICUANTITATIVA: Cada jeringa reconstituida dispensa:
|
Leuprolide acetato |
7,5 mg |
|
50:50 Poli (DL-láctido-co-glicólido) |
82,5 mg |
|
N-metil-2-pirrolidona |
160,00 mg |
Cada jeringa prellenada A (AtrigelR sistema de liberación) contiene:
|
(50:50) Poli (DL-lactido-co-glicólido) |
112 mg |
|
N-metil-2-pirrolidona |
218 mg |
Cada jeringa prellenada B: liofilizado de leuprolide acetato contiene:
|
Leuprolide acetato |
10,2 mg * |
* Contiene sobredosis debido a la posible retención de producto en la jeringa y aguja luego de la reconstitución.
ELIGARD® 7,5 mg se presenta con dos jeringas prellenadas separadas, estériles, cuyos contenidos son mezclados de inmediato previo a la administración. Ambas jeringas son unidas y el producto de dosis única es mezclado hasta homogeneización. Leuprolide acetato 7,5 mg es administrado por vía subcutánea donde forma un depósito sólido de liberación de droga.
La jeringa A contiene el sistema de liberación ATRIGEL y la jeringa B contiene leuprolide acetato. ATRIGEL es un sistema de liberación polimérico (sin contenido de gelatina) que consiste de una formulación polímera poli-(DL-lactido-co-glicólido) (PLGH) biodegradable disuelto en un solvente biocompatible, N-metil-2-pirrolidona (NMP). PLGH es un co-polímero con una ratio molar 50:50 de DL-lactido conteniendo grupos terminales de carboxilo. La segunda jeringa contiene leuprolide acetato y el producto constituido libera 7,5 mg de leuprolide acetato en el momento de la inyección subcutánea, (equivalente a 7 mg de leuprolide base libre) disuelto en 160 mg de N-metil-2-pyrrolidona y 82,5 mg poli (DL-lactido-co-glicólido). El peso aproximado de la formulación administrada es de 250 mg.
ACCIÓN TERAPÉUTICA: Agonista de la hormona liberadora de gonadotrofina.
Código ATC: LO2A EO2.
INDICACIONES Y USO:
Cáncer prostático: Leuprolide acetato inyectable liofilizado 7,5 mg está indicado para el tratamiento paliativo del cáncer prostático avanzado.
Pubertad precoz: Leuprolide acetato 7,5 mg está indicado en el tratamiento de niños con pubertad precoz central. Los pacientes serán seleccionados utilizando los siguientes criterios:
Diagnóstico clínico de pubertad precoz central (idopática o neurogénica) con comienzo de los caracteres sexuales secundarios antes de los 8 años en mujeres y de los 9 años en varones.
El diagnóstico clínico será confirmado antes de la iniciación del tratamiento.
Confirmación del diagnóstico mediante una respuesta puberal al test de estimulación GnRH. Debe conocerse la sensibilidad y metodología de este ensayo. Edad ósea, un año mayor de la edad cronológica.
La evaluación basal también incluirá:
Medición de peso y altura.
Niveles de esteroides sexuales.
Niveles de esteroides adrenales para excluir la hierplasia suprarrenal congénita.
Nivel de gonadotrofina coriónica beta humana para descartar un tumor secretante de gonadotrofina coriónica.
Ecografía pelvia/adrenal, y testicular para descartar un tumor secretante de esteroides.
Tomografía computada de cabeza para descartar un tumor intracraneal.
FARMACOCINÉTICA:
Absorción: La farmacocinética/fármacodinamia observada durante tres inyecciones una vez al mes en veinte pacientes con carcinoma de próstata es presentado en la figura uno.
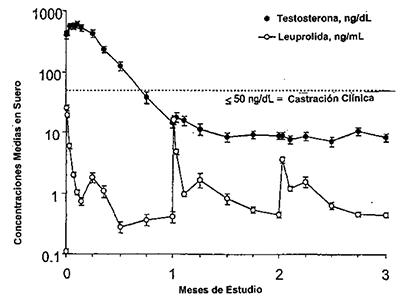
Figura 1: Respuesta farmacocinética/farmacodinámica (N=20) leuprolide 7,5 mg. Pacientes dosificados inicialmente y a los meses 1 y 2.
Las concentraciones medias de leuprolide en suero después de una inyección inicial se elevaron a 25,3 ng/mL a las 4-8 horas (Cmáx.) post-inyección. Después del aumento inicial posterior a cada inyección, las concentraciones en suero continuaron relativamente constantes (0.28 - 1.67 ng/mL) no hubo evidencia de acumulación significativa durante el dosaje repetido.
Después de la primera dosis de leuprolide 7,5 mg las concentraciones medias de testosterona en suero aumentaron en forma transitoria después se redujeron por debajo del umbral de castración (£ 50 mg/dL) en el plazo de tres semanas. El tratamiento mensual continuo mantuvo la supresión de testosterona a nivel de castración durante todo el estudio. No hubo concentraciones de testosterona por encima del umbral de castración (> 50 mg/dL) durante el estudio una vez lograda la supresión.
Distribución: El volumen de distribución medio de estado constante de leuprolide después de la administración intravenosa de bolo a voluntarios sanos de sexo masculino fue de 27 L. La combinación in vitro con proteínas plasmáticas humanas oscilo desde 43% a 49%.
Metabolismo: En voluntarios sanos de sexo masculino, un bolo de 1 mg de leuprolide en administración I.V. reveló que la excreción sistémica media fue de 8.34 L/h, con una vida media de eliminación terminal de aproximadamente 3 horas basado en un modelo de dos compartimentos.
Excreción: No se realizó ningún estudio de excreción de leuprolide una vez al mes 7,5 mg.
Poblaciones especiales:
Geriatría: La mayoría (70%) de los 128 pacientes estudiados en estos ensayos clínicos fueron mayores a 70 años.
Pediatría: No se ha establecido la seguridad y efectividad de ELIGARD® 7,5 mg, una vez al mes en pacientes pediátricos.
Raza: En los pacientes estudiados (26 blancos, 2 hispánicos) las concentraciones medias de leuprolide en suero fueron similares.
Insuficiencia renal y hepática: No se ha determinado la farmacocinética de leuprolide 7,5 mg en pacientes con insuficiencia hepática y renal.
Interacciones droga-droga: No se han realizado estudios de interacción farmacocinética con leuprolide 7,5 mg.
CONTRAINDICACIONES:
1. Leuprolide acetato 7,5 mg está contraindicado en pacientes con hipersensibilidad a GnRH, los análogos agonistas de GnRH o cualquier de los componentes de leuprolide acetato. Han sido informadas las reacciones anafilácticas con GnRH sintético o análogos agonistas de GnRN.
2. Contraindicado en mujeres embarazadas. El acetato de leuprolide puede causar daño fetal cuando es administrado a una mujer embarazada. Se observaron anormalidades fetales mayores en conejos pero no en ratas después de la administración de acetato de leuprolide durante la gestación. Hubo una mortalidad fetal aumentada y pesos fetales menores en ratas y conejos. Los efectos sobre la mortalidad fetal son consecuencias esperadas de las alteraciones de los niveles hormonales aportados por esta droga. Existe la posibilidad de que puedan producirse abortos espontáneos.
ADVERTENCIAS: Leuprolide acetato 7,5 mg como otros agonistas LH-RH puede producir un incremento transitorio de las concentraciones de testosterona durante la primera semana de tratamiento. Los pacientes pueden experimentar empeoramiento sintomático o comienzo de nuevos síntomas, incluyendo dolor óseo, neuropatía, hematuria o obstrucción ureteral o de la vejiga (ver Precauciones).
Casos de obstrucción ureteral y compresión de la médula espinal, que puede contribuir a parálisis con complicaciones fatales o sin ellas, han sido informados con agonistas LH-RH.
Si se desarrolla compresión de la médula espinal o insuficiencia renal, se debe instituir el tratamiento estándar de estas complicaciones.
El incumplimiento del régimen de la droga o una dosificación inadecuada para un paciente pediátrico puede provocar un control inadecuado del proceso puberal. Las consecuencias incluyen el retorno de signos puberales, tales como: menstruación, desarrollo mamario y crecimiento testicular. Las consecuencias a largo plazo del control inadecuado de la secreción de esteroides gonadales son desconocidas, pero pueden incluir un compromiso posterior de la estatura a edad adulta.
PRECAUCIONES:
Generales: Los pacientes con lesiones vertebrales metastásicas y/o con obstrucción del tracto urinario deben ser observados cuidadosamente durante las primeras pocas semanas de terapia (ver Advertencias).
Pruebas de laboratorio: La respuesta a leuprolide acetato 7,5 mg puede ser controlada periódicamente mediante la medición de las concentraciones séricas de testosterona y antígeno prostático específico.
En la mayoría de los pacientes los niveles de testosterona aumentaron por encima de la línea base durante la primera semana, declinando después a niveles de línea base o por debajo al final en la segunda semana. Los niveles de castración fueron alcanzados por lo general en el plazo de dos a cuatro semanas y una vez alcanzado fueron mantenidos durante toda la duración del tratamiento. En ninguno de los pacientes se produjeron incrementos por encima del nivel de castración.
Los resultados de las determinaciones de testosterona dependen de la metodología de valoración. Es aconsejable de tener conciencia del tipo y la precisión de la metodología de valoración para tomar decisiones clínicas y terapéuticas apropiadas.
Pacientes pediátricos: La respuesta al acetato de leuprolide deberá controlarse 1-2 meses después del comienzo del tratamiento con un test de estimulación de GnRH y niveles de esteroides sexuales. La medición de la edad ósea para evaluar el progreso debe ser realizada cada 6-12 meses.
Si la dosis es inadecuada los esteroides sexuales pueden aumentarse o exceder los niveles prepuberales. Una vez que la dosis terapéutica ha sido establecida, los niveles de esteroides sexuales y de gonadotrofinas declinarán a niveles prepuberales.
Pueden ocurrir cambios en la densidad mineral ósea durante cualquier estado hipoestrogénico. La pérdida de la densidad mineral ósea puede ser reversible luego de suspender el acetato de leuprolide.
Interacciones de la droga: Ver Farmacocinética.
REACCIONES ADVERSAS: La seguridad de ELIGARD® es evaluada en ocho hombres quirúrgicamente castrados y ciento veinte pacientes con cáncer prostático avanzado en dos ensayos clínicos. ELIGARD® 7,5 mg como otro análogos LH-RH produjeron un incremento transitorio de las concentraciones séricas de testosterona durante las primeras dos semanas de tratamiento.
Por lo tanto las potenciales exacerbaciones de signos y síntomas de la enfermedad durante las primeras semanas de tratamiento son de preocupación en pacientes con metástasis vertebrales y/o obstrucción urinaria y/o hematuria. Si estas condiciones se agravan puede conducir a problemas neurológicos tales como debilidad y/o parestesia de los miembros inferiores o empeoramiento de los síntomas urinarios (ver Advertencias y precauciones). En el ensayo sobre eficacia clínica arriba descrito, el incremento transitorio en las concentraciones de testosterona sérica no estaba asociado con una exacerbación de los síntomas de la enfermedad.
Los hechos locales adversos informados después de la inyección de leuprolide 7,5 mg fueron típicos de aquellos frecuentemente asociados con productos similares inyectados subcutáneamente. En total se administraron 716 inyecciones de leuprolide 7,5 mg y se informo sobre sensación uriente transitoria después de 248 (34,6%) siendo informados las mayoría de estos hechos (84%) como leves se reportó dolor en el 4,3% de los pacientes con la inyección (18.3% de los pacientes) y que fue de naturaleza leve y de duración mediana. El eritema fue reportado en (2,6%) de inyecciones (12,5% de los pacientes) como leve. Estos eventos fueron reportados como medianos y resueltos unos dos días después de la inyección. Prurito, induración, y ulceraciones fueron demostradas en el 1,4%, 0,4% y el 0,1% de las inyecciones estudiadas respectivamente. Estos efectos adversos localizados no fueron recurrentes a lo largo del tiempo. Ningún paciente discontinuó la terapia debido a un efecto adverso en el sitio de la inyección.
Los siguientes efectos adversos sistémicos posible o probablemente relacionados con hechos adversos ocurrieron durante un ensayo clínico de hasta 6 meses de tratamiento, y fueron informados en ³ 2% de los pacientes (Tabla 1 y 2).
Tabla 1. Incidencia (%) de hechos adversos sistémicos posible o probablemente relacionados, informados por > 2% de los pacientes (n = 120) tratados con leuprolide acetato 7,5 mg durante hasta seis meses en el estudio AGL9904.
|
Sistema corporal |
Hechos adversos |
Número |
Porcentaje |
|
Cuerpo en su totalidad |
Malestar y fatiga Aturdimiento |
21 4 |
17,5% 3,3% |
|
Cardiovascular |
Rubores/sudoración * |
68 |
56,7% |
|
Génito-urinario |
Atrofia testicular * |
6 |
5,0% |
|
Digestivo |
Gastroenteritis/colitis |
3 |
2,5% |
Tabla 2. Incidencia (%) de hechos adversos sistémicos posibles o probablemente relacionados, informados por ³ 2% de los pacientes quirúrgicamente castrados (n = 8) tratados con una dosis única de leuprolide acetato 7,5 mg en el estudio AGL 9802.
|
Sistema corporal |
Hechos adversos |
Número |
Porcentaje |
|
Cardiovascular |
Rubores/sudoración |
2 |
25,0% |
Además los siguientes hechos adversos sistémicos, posible o probablemente relacionados fueron informados por < 2% de los pacientes que usaron leuprolide acetato 7,5 mg, en estudios.
General: Sudoración, insomnio, síncope.
Gastrointestinal: Flatulencia, constipación.
Hematológica: Disminución del recuento celular de hematíes, hematocrito y hemoglobina.
Metabólico: Aumento ponderal.
Músculo-esquelético: Temblor, dolor dorsal, dolor articular.
Nervioso: Trastornos del olfato y del gusto, depresión, vértigo.
Piel: Alopecia.
Urogenital: Dolor testicular, impotencia*, libido disminuida*, ginecomastía, sensibilidad de las mamas.
* Consecuencias farmacológicas esperadas de la supresión de testosterona. En las poblaciones de pacientes estudiados, se informó sobre un total de 86 pacientes con rubor/sudoración como hechos adversos en 70 casos. De estos, 71 hechos (83%) fueron leves; 14 (16%) fueron moderados, 1 (1%) fue severo.
Cambios de la densidad ósea: Se ha informado sobre densidad ósea reducida en la literatura médica en hombres sometidos a orquiectomía o los que habían sido tratados con un análogo agonista de LH-RH. Se puede anticipar que los periodos prolongados de castración médica en hombres tendrán efectos sobre la densidad ósea.
CARCINOGÉNESIS, MUTAGÉNESIS, ALTERACIONES EN LA FERTILIDAD: Dos años de estudio sobre carcinogenicidad fueron realizados en ratas y ratones. En ratas un incremento relacionado con la dosis de la hiperplasia pituitaria benigna y adenomas pituitarios benignos fueron vistos a los 24 meses cuando la droga fue administrada por vía subcutánea con altas dosis diarias (0.6 a 4 mg/kg). Hubo un incremento significativo pero no relacionado con la dosis de adenomas de células de islotes pancreáticos en hembras y adenomas celulares intersticiales testiculares en machos (máxima incidencia en el grupo de dosis baja). En ratones no se observaron tumores o anormalidades de la pituitaria inducidos con dosis tan alta como 60 mg/kg durante 2 años.
Los pacientes han sido tratados con acetato de leuprolide durante hasta 3 años con dosis tan alta como 10 mg/d y durante 2 años con dosis tan altas como 20 mg/d sin anormalidades demostrables de la pituitaria.
Mutagenicidad: Se han realizado estudios de mutagenicidad con acetato de leuprolide usando sistemas citogénicos y sistemas de mamíferos y con ELIGARD® en un mes en sistemas bacterianos. Estos estudios no proporcionaron evidencia de un potencial mutagénico.
Embarazo, efectos teratogénicos: Embarazo categoría X (ver Contraindicaciones).
Uso pediátrico: Leuprolide 7,5 mg esta contraindicada en pacientes pediátricos y no fue estudiada en niños (ver Contraindicaciones).
INTERACCIONES DE DROGA/TEST DE LABORATORIO: La terapia con leuprolide acetato resulta en supresión del sistema pituitario-gonadal. Los resultados de las pruebas diagnósticas de las gonadotróficas y de la función gonadal conducidas durante y después de la terapia de leuprolide pueden estar afectadas.
FARMACOLOGÍA CLÍNICA: ELIGARD® 7,5 mg es una formulación polimérica estéril de leuprolide acetato para inyección subcutánea. Está diseñada para liberar 7,5 mg de leuprolide una proporción controlada durante un periodo terapéutico de un mes.
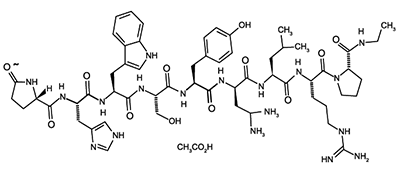
Leuprolide acetato es un nonapéptido sintético análogo de la hormona liberadora de gonadotropina natural (GnRH o LH-RH) que en administración continua, inhibe la secreción de gonadotropina pituitaria y suprime la esteroido-génesis testicular y ovárica. El análogo posee mayor potencia que la hormona natural. El nombre químico es 5-oxo-L-proplyl-L-histidyl-L-triptofyl-L-seryl-L-tyrosyl-D-leucyl-L-leucyl-L-arginyl-N-etyl-L-prolinamida acetato. Presenta la siguiente estructura:
Leuprolide acetato, es un agonista LH-RH que actúa como un potente inhibidor de la secreción de gonadotropina cuando es administrada continuamente en dosis terapéuticas. Estudios en animales y en humanos indican que después de un estímulo inicial, la administración crónica de leuprolide acetato resulta en una supresión de la esteroideogénesis ovárica y testicular. Este efecto es reversible al discontinuarse la terapia con la droga.
En humanos la administración de leuprolide acetato resulta en un aumento inicial de los niveles circulantes de hormona luteinizante (LH) y hormona folículo - estimulante (FSH), conducente a un aumento transitorio de los niveles de los esteroides gonadales (testosterona y dihidro testosterona en hombres y de estrona y estradiol en mujeres pre-menopáusicas); sin embargo la administración continua de leuprolide acetato produce niveles disminuidos de LH y FSH. En hombres la testosterona esta reducida por debajo del umbral de castración (£ 50 ng/dL). Estas reducciones ocurren en el término de dos a cuatro semanas post-iniciación del tratamiento. Los estudios a largo plazo demuestran que la continuación de la terapia mantiene la testosterona por debajo del nivel de castración durante hasta siete años y presumiblemente en forma indefinida.
Leuprolide acetato no es activo cuando es dado por vía oral.
POSOLOGÍA, DOSIFICACIÓN, MODO DE ADMINISTRACIÓN: Una vez mezclado leuprolide acetato 7,5 mg debe ser descartado si no es usado en el plazo de 30 minutos. Al igual que con otras drogas administradas por inyección subcutánea, el sitio de inyección debe variar periódicamente.
Cáncer de próstata: Leuprolide acetato 7,5 mg. La dosis recomendada es de una inyección por mes. La inyección contiene 7,5 mg de acetato de leuprolide incorporado en una formulación de polímero. Es administrado por vía subcutánea y proporciona liberación continua de leuprolide durante un mes.
Pubertad precoz: La dosis de leuprolide acetato debe ser individualizada para cada caso. La dosis debe estar basada en un índice de mg/kg de peso corporal. Los niños más pequeños requieren dosis más altas sobre un índice mg/kg.
Para cada forma de dosificación, después de 1-2 meses del tratamiento inicial o del cambio de dosis, el niño debe ser monitoreado con un test de estimulación de GnRH, esteroides sexuales y una estadificación de Tanner para confirmar la respuesta. La medición de la edad ósea será monitoreada cada 6 a 12 meses. La dosis será titulada en forma creciente hasta que no se note progresión de la condición clínica o mediante parámetros de laboratorio.
La primera dosis que logre una adecuada supresión probablemente puede ser mantenida durante la duración del tratamiento en la mayoría de los pacientes. Sin embargo, no hay suficientes datos para guiar el ajuste de la dosificación dado que los pacientes aumentan de peso después de la terapéutica inicial a edades muy tempranas y a dosis bajas. Se recomienda que una adecuada “down regulation” sea verificada en aquellos pacientes que aumentaron de peso significativamente durante el tratamiento.
Como con otras drogas inyectables se deberá variar periódicamente el sitio de inyección.
La discontinuación de leuprolide acetato deberá ser considerada antes de los 11 años para las mujeres y de 12 años para los varones.
La dosis inicial recomendada es 0,3 mg/kg/ 4 semanas (mínimo 7,5 mg) administrados como una sola inyección subcutánea. La dosis inicial será dictaminada por el peso del paciente.
|
Peso (Kg) |
Dosis (mg) |
|
£ 25 ³ 25.0 - 37.5 ³ 37.5 |
7.50 11.25 15 |
Estudios clínicos: En un estudio abierto, multicéntrico, 120 pacientes con cáncer de próstata avanzado fueron tratados con seis inyecciones mensuales de leuprolide acetato 7,5 mg. Ochenta y nueve pacientes estaban en estado C de la enfermedad y 31 pacientes presentaron enfermedad en estado D. Este estudio evaluó el logro y el mantenimiento de la supresión de testosterona sérica durante seis meses de terapia.
La concentración media de testosterona aumentó de 361.3 ng/dL inicial a 574.6 ng/dL al día 3, después de la inyección subcutánea inicial. Las concentraciones de testosterona en suero se redujeron entonces hasta por debajo de la línea inicial el día 10.
La testosterona sérica fue suprimida por debajo del umbral de castración (£ 50 ng/dL) a la semana 4 en todos salvo siete pacientes (94.1%) que continuaron en el estudio. Estos pacientes alcanzaron todos el umbral de castración para el día 42. Una vez alcanzada la supresión de testosterona en, o por debajo de las concentraciones séricas de 50 ng/dL, ningún paciente (0%) evidenció interrupción (concentración superior a 50 ng/dL) en cualquier momento del estudio. A la conclusión del estudio (mes 6), las concentraciones medias de testosterona fueron de 6.1 ng/dL. El total de 117 pacientes evaluables en el estudio en el estudio al mes 6 presentaron concentraciones de testosterona de £ 50 ng/dL.
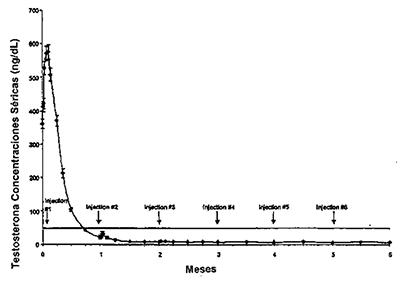
Figura 2: Leuprolide acetato 7,5 mg; concentración media de testosterona en suero (n = 117).
El antígeno específico medio para próstata en suero (PSA) estaba muy por encima del límite normal al inicio (>800%). PSA en suero se redujo en todos los pacientes cuyos valores iniciales estaban elevados por encima del límite normal. Los valores medios estaban reducidos un 94% desde el inicio hasta el mes 6. Al mes 6, los niveles PSA se habían reducido a límites normales en el 94% de los pacientes que presentaban elevados niveles iniciales.
Los síntomas secundarios de eficacia evaluados incluyeron el estado de performance, dolor óseo, dolor urinario y signos y síntomas urinarios. La evaluación de estos síntomas comparando los puntajes de línea base y del mes 6 indican buen control de los mismos durante todo el estudio con mejorías estables o modestas de varios parámetros durante los 6 meses de estudio. Estos resultados demuestran que no hubo respuesta rápida en la población en estudio. Además, hubo una reducción en pacientes con anormalidades de próstata detectadas durante el examen físico de 102 (85%) en la proyección a 77 (64%) al mes 6. Mejoras similares de las anormalidades rectales durante el examen físico también fueron observadas. Estos cambios reflejan mejorías relacionadas con el tratamiento en estudio.
PROCEDIMIENTOS DE MEZCLADO:
Importante: Dejar que el producto alcance la temperatura ambiente antes de su uso una vez mezclado el producto debe ser administrado en el plazo de 30 minutos.
Seguir las instrucciones como se indica para asegurar la correcta preparación del leuprolide acetato 7,5 mg previo a su administración.
ELIGARD® 7,5 mg se encuentra en un empaque que puede ser de bandejas termoformadas o en sobres. Cada unidad contiene:
Una jeringa A estéril pre-llenada con el sistema de liberación ATRIGEL.
Una jeringa B pre-llenada con polvo de acetato de leuprolide.
Un émbolo blanco largo de repuesto para utilizar con la jeringa B.
Una aguja de media pulgada calibre 20.
Sobres desecantes.
1. En un campo limpio, abrir todos los envases y sacar el contenido. Descartar el desecante.
Figura 3.

Figura 4.
2. Saque el émbolo corto con punta azul y el tapón adjunto de la jeringa B y descártela (Figura 3). Insertar suavemente la varilla larga, blanca de reemplazo del émbolo dentro del tapón primario gris remanente en la jeringa B, girándola para que ocupe su lugar (Figura 4).
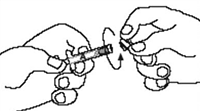
Figura 5.
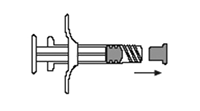
Figura 6.
3. Desenrosque la tapa clara de la jeringa A (Figura 5). Eliminar el tapón de goma color gris de la jeringa B (Figura 6).
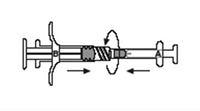
Figura 7.
4. Una las dos jeringas empujándolas hacia adentro y girándolas hasta que estén seguras (Figura 7).


Figura 8.
5. Mezclar perfectamente el producto impeliendo el contenido de ambas jeringas hacia adentro y hacia fuera entre las jeringas (aproximadamente 45 segundos) para obtener una suspensión uniforme (Figura 8). Cuando están perfectamente mezcladas, la suspensión tendrá un color tostado suave a tostado. Favor observe: el producto debe ser mezclado conforme a la descripción: la agitación no proporcionará un mezclado adecuado del producto.
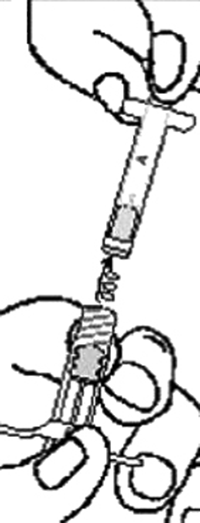
Figura 9.
6. Sostener las jeringas en sentido vertical, debiendo estar la jeringa B en la parte inferior. Las jeringas deben estar perfectamente acopladas. Llevar todo el producto mezclado en la jeringa B (jeringa B, corta, ancha) mediante depresión del émbolo de la jeringa A y retirarlo ligeramente el émbolo de la jeringa B. Desacople la jeringa A mientras se continúa empujando hacia abajo el émbolo de la jeringa A (Figura 9). Favor observar: pequeñas burbujas de aire seguirán estando en la fórmula - esto es aceptable.
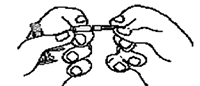
Figura 10.
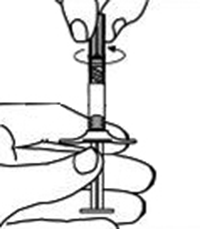
Figura 11.
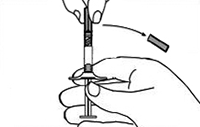
Figura 12.
7. Mantener la jeringa B dirigida hacia arriba. Eliminar el tapón rosa en la parte inferior del cartucho estéril para la aguja mediante giro (Figura 10). Agregar el cartucho de la aguja a la parte final de la jeringa B (Figura 11) empujándolo hasta que esté perfectamente asentado. No girar la aguja en la jeringa hasta que esté fija. Eliminar la cubierta del cartucho previo a la administración (Figura 12). Después de la administración descartar todos los componentes en forma segura en un recipiente apropiado de bio-riesgo.
SOBREDOSIFICACIÓN: En ensayos clínicos usando a diario leuprolide acetato subcutáneo en pacientes con cáncer de próstata, dosis tan altas como 20 mg/día durante hasta 2 años, no produjeron efectos adversos que difieren de los observados con la dosis de 1 mg/día.
Ante la eventualidad de una sobredosificación, concurrir al hospital más cercano.
PRESENTACIÓN: Leuprolide acetato 7,5 se presenta en un juego de implementos, de un solo uso. El juego consiste en un sistema para mezclado de 2 jeringas, una aguja de media pulgada, calibre 20, un sobre de silicona con material desecante para el control de la humedad, un folleto en el envase para la constitución y los procedimientos de administración. Cada jeringa es envasada en forma individual. Una contiene el Sistema ATRIGEL y la otra contiene leuprolide acetato. Cuando han sido reconstituidas. Jeringas prellenadas de 7.5 mg (dosis mensual) y 22.5 mg (dosis trimestral).

® Marca registrada
CONSERVACIÓN: En su envase original de 2º a 8 ºC. Proteger de la luz.