
CERVARIX
PAPILOMA HUMANO, VIRUS DEL
Suspensión inyectable
1 Jeringa(s) prellenada(s), 0.5 ml Suspensión,
1 Vial (vidrio de tipo I) con tapón (caucho bromobutilo) y un sello (aluminio) con cápsula levadiza, 0.5 ml Suspensión,
1 Vial (vidrio de tipo I) con tapón (caucho bromobutilo) y un sello (aluminio) con cápsula levadiza, 1 ml Suspensión, 2 Dosis
CARACTERÍSTICAS FARMACÉUTICAS:
Lista de excipientes: Cloruro de sodio, fosfato de sodio dihidrogenado dihidratado, agua para inyectables.
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Una dosis (0.5 ml) contiene:
|
Proteína L1 virus del papiloma humano tipo 161 |
20 microgramos |
|
Proteína L1 virus del papiloma humano tipo 181 |
20 microgramos |
|
3-O-desacil-4’- monofosforil lípido A (MPL)2 |
50 microgramos |
|
Hidróxido de aluminio hidratado2 |
0.5 miligramos Al3+ |
1Proteína L1 en la forma de partículas no infecciosas semejantes al virus (VLP) producida mediante tecnología de ADN recombinante usando un sistema de expresión del baculovirus.
2El sistema adyuvante AS04, patentado por GlaxoSmithKline, está compuesto de hidróxido de aluminio y 3-O-desacil-4’- monofosforil lípido A (MPL) (ver Farmacodinamia).
FORMA FARMACÉUTICA: Suspensión inyectable.
INDICACIONES: CERVARIXTM está indicada desde los 9 años de edad en adelante para la prevención de infección persistente, lesiones anogenitales premalignas (de cérvix, vulvares, vaginales y anales), y casos de cáncer de cérvix, vulvar, vaginal y anal (carcinoma de células escamosas y adenocarcinoma) causados por Virus del Papiloma Humano (VPH) oncogénicos (ver Advertencias y Precauciones y Farmacodinamia).
FARMACODINAMIA:
Grupo farmacoterapéutico: Vacunas contra el virus del papiloma, código ATC: J07BM02.
Mecanismo de acción: Se ha demostrado que la infección persistente con tipos oncogénicos de VPH es responsable de casi todos los casos de cáncer cervicouterino en el mundo.
CERVARIXTM es una vacuna recombinante no infecciosa preparada usando las partículas similares al virus (VLP) altamente purificadas de la proteína principal L1 de la cápside de los VPH oncogénicos tipos 16 y 18. Ya que las VLP no contienen ADN viral, no pueden infectar las células, reproducirse u ocasionar enfermedades. En estudios animales se ha demostrado que la eficacia de las vacunas basadas en VLP de L1 está mediada principalmente por el desarrollo de una respuesta inmune humoral y memoria inmune mediada por células.
CERVARIXTM tiene un adyuvante AS04, el que en estudios clínicos ha demostrado que induce una respuesta inmune superior y de mayor duración que la inducida por los mismos antígenos conteniendo sólo sal de aluminio [Al(OH)3] como adyuvante.
El cáncer de cérvix invasivo incluye al carcinoma cervical escamoso (84%) y al adenocarcinoma (16%, hasta 20% en los países desarrollados con programas de tamizaje).
El VPH-16 y el VPH-18 son responsables de aproximadamente el 70% de los casos de cáncer de cérvix, el 80% de los casos de cáncer vulvar y vaginal, el 90% de los casos de cáncer anal, el 70% de los casos de neoplasia intraepitelial vulvar (NIV 2/3) y vaginal (NIVa 2/3) y del 78% de los casos de neoplasia intraepitelial (NIA 2/3) anal de grado alto relacionados con el VPH en todas las regiones del mundo. Otros tipos oncogénicos del VPH (VPH-31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, -68) pueden también causar cánceres anogenitales.
Los 4 tipos más comunes de VPH identificados en el carcinoma cervical escamoso (aproxi-madamente 76%) y en el adenocarcinoma (aproximadamente 91%) son los VPH-16, -18, -45 y -31.
Evidencia de respuesta anamnésica (memoria inmune): La administración de una dosis adicional de la vacuna tras una media de 6.8 años después de la primera vacunación provocó una respuesta inmune anamnésica frente a VPH-16 y VPH-18 (por ELISA y el ensayo de neutralización basado en seudovirión) en el día 7. Un mes después de esta dosis de exposición, los títulos medios geométricos (GMT, por su sigla en inglés) excedieron los observados un mes después del esquema de vacunación primaria.
Con ELISA, también se observó una respuesta anamnésica para los tipos relacionados- VPH-31 y VPH-45.
Eficacia profiláctica:
Eficacia clínica en mujeres de 15 a 25 años: La eficacia de CERVARIXTM se evaluó en 2 estudios clínicos aleatorizados, doble ciego, con grupo de control (HPV-001/007 y HPV-008) que incluyeron a un total de 19.778 mujeres de edades entre 15 y 25 años al momento de la inclusión.
El ensayo clínico HPV-001/007 se realizó en Norteamérica y Latinoamérica. En el estudio HPV-023, se realizó un seguimiento de los sujetos de la cohorte brasilera del estudio 001/007. Los criterios de inclusión al estudio fueron: Negativos para ADN de VPH oncogénico (VPH-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66 y -68) en muestras cervicales, seronegativas para anticuerpos contra VPH-16 y VPH-18, y citología normal. Estas características son representativas de una población que se supone no había sido expuesta a infección previa por los tipos oncogénicos del VPH antes de la vacunación.
El ensayo clínico HPV-008 se realizó en Norteamérica, Latinoamérica, Europa, Asia del Pacífico y Australia. Se obtuvieron muestras prevacunación para pruebas de ADN de VPH oncogénico (VPH-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66 y -68) y para pruebas de anticuerpos séricos contra VPH-16 y al VPH-18. Las mujeres fueron vacunadas independientemente de la citología inicial, del estatus del VPH serológico y del ADN viral. Estas características son representativas de una población que incluye mujeres con evidencia de infección previa y/o actual por el VPH.
Al igual que con cualquier ensayo de eficacia profiláctica, las mujeres inicialmente infectadas por un tipo de VPH en particular no fueron elegibles para la valoración de eficacia correspondiente a ese tipo.
La neoplasia intraepitelial cervical (NIC) grados 2 y 3 (NIC2+), se usó como un marcador subrogado de cáncer de cérvix en los ensayos clínicos.
Se demostró también que la infección persistente que duraba al menos 6 meses, era un marcador subrogado relevante para el cáncer de cérvix. Aunque la NIC grado 1 no es un marcador subrogado para cáncer de cérvix, estas lesiones requieren seguimiento médico.
Eficacia de la vacuna contra VPH-16/18 en mujeres sin exposición previa a los tipos oncogénicos del VPH (estudios HPV-001/007/023): En la Tabla 1 se presentan los resultados de eficacia para criterios de valoración histológica asociados con el VPH-16 y/o VPH-18 (VPH-16/18) que se observaron en el estudio HPV-001/007 (Cohorte Total, es decir, mujeres que recibieron al menos una dosis de la vacuna).
|
Tabla 1: Eficacia de la vacuna contra las lesiones NIC2+ y NIC1+ asociadas con el VPH-16/18 |
|||
|
Criterio de valoración de VPH-16/18 |
CervarixTM N = 481 |
Control (Sal de aluminio) N = 470 |
% Eficacia (IC 95%) |
|
Número de casos |
|||
|
NIC2+(1) |
0 |
9 |
100% (51.3;100) |
|
NIC1+(2) |
0 |
15 |
100% (73.4;100) |
|
(1) Neoplasia intraepitelial cervical de grado 2 y lesiones de grado superior. (2) Neoplasia intraepitelial cervical de grado 1 y lesiones de grado superior. |
|||
La eficacia contra anomalías citológicas por el VPH-16/18 fue de 96.7% (IC 95%: 87.3;99.6).
La eficacia contra la infección persistente por el VPH-16/18 fue de 98.2% (IC 95%: 89.5;100) y de 96.9% (IC 95%: 81.4;99.9) en base a una definición de 6 meses y de 12 meses, respectivamente.
En el estudio HPV-023, se realizó un seguimiento de los sujetos (N=437) hasta 9.4 años (aproximadamente 113 meses) después de la dosis uno. No se presentaron nuevos casos de infección ni lesiones histopatológicas asociadas con el VPH-16/18 en el grupo de la vacuna. En el grupo que recibió placebo, se observaron 4 casos de infección persistente de 6 meses, 1 caso de infección persistente de 12 meses y 1 caso de NIC1+ asociada con el VPH-16/18.
En el análisis combinado descriptivo de los estudios HPV-001/007/023, la eficacia contra la incidencia del VPH-16/18 y la infección persistente de 6 meses fue del 91.0% (IC 95%: 80.3; 96.5) y del 96.8% (IC 95%: 80.4;99.9), respectivamente. A pesar de evidencia de una exposición continua a infecciones por el VPH como se observa en el grupo de control, no hay signos de disminución de la protección en las mujeres vacunadas.
Eficacia de la vacuna en mujeres con evidencia de infección previa y/o actual por el VPH (estudio HPV-008):
Eficacia profiláctica contra VPH-16/18 en mujeres sin exposición previa al VPH-16 y/o VPH-18: En el estudio HPV-008, los análisis primarios de eficacia se efectuaron en la cohorte de Acuerdo al Protocolo (cohorte According to Protocol (ATP)): Que incluyó a las mujeres que recibieron 3 dosis de la vacuna y que no habían sido expuestas al tipo relevante de VPH en el punto de tiempo del mes 0 y al mes 6) y en la Cohorte Total Vacunada 1 (Total Vaccinated Cohort-1 (TVC-1)): Que incluyó a las mujeres que recibieron al menos una dosis de la vacuna y que no habían sido expuestas al tipo relevante del VPH al mes 0. Ambas cohortes incluyeron mujeres con citología normal o de bajo grado al inicio y sólo se excluyeron a mujeres con citología de alto grado (0.5%).
Además, se efectuaron análisis de eficacia en la Cohorte Total Vacunada (TVC) más amplia y en el grupo sin infección previa de la TVC.
En el estudio HPV-008, aproximadamente un 26% de las mujeres tuvieron evidencia de in-fección actual y/o previa por el VPH-16/18 y menos del 1% de las mujeres, al inicio, eran ADN positivas para ambos tipos de VPH 16 y 18.
El análisis final del estudio HPV-008 fue realizado en función de los eventos, es decir que se realizó cuando se acumularon al menos 36 casos de NIC2+ asociados con el VPH-16/18 en la cohorte ATP. La media de duración del seguimiento fue de aproximadamente 39 meses des-pués de la dosis uno.
El análisis de conclusión del estudio se realizó al final del período de seguimiento de 4-años (es decir, 48 meses después de la dosis uno) e incluyó a todos los sujetos de la Cohorte Total Vacunada (TVC).
En el análisis especificado por el protocolo, la eficacia de la vacuna contra las NIC1+ y NIC2+ asociadas con el VPH-16/18 fue estadísticamente significativa en las cohortes ATP y TVC-1.
Investigaciones posteriores identificaron que varios casos de NIC1+, NIC2+ y de NIC3+ in-cluían varios tipos oncogénicos del VPH en la lesión. Con el objeto de distinguir el (los) tipo(s) de VPH que más probablemente eran responsables de una lesión, del (de los) tipo(s) sólo temporalmente asociado(s) a la lesión, se aplicó una asignación del tipo de VPH (análisis exploratorio). La asignación del tipo de VPH consideró los tipos de VPH detectados por la técnica de Reacción en Cadena de la Polimerasa (PCR) en al menos una de las dos muestras citológicas precedentes, en adición a los tipos detectados en la lesión. En base a esta asignación del tipo de VPH, el análisis excluyó los casos (en el grupo de la vacuna y en el grupo de control) que no fueron considerados que estuviesen causalmente asociados con las infecciones por el VPH-16 o VPH-18 adquiridas durante el estudio.
En la Tabla 2 se presentan los resultados observados en ambos análisis (es decir, el análisis especificado por el protocolo y el de asignación del tipo de VPH).
|
Tabla 2: Eficacia de la vacuna contra las NIC1+, NIC2+ y NIC3+ asociadas con los VPH-16/18 |
|||||||||||
|
Criterio de valoración de VPH-16/18 |
Análisis final del estudio |
Análisis de conclusión del estudio |
|||||||||
|
CERVARIXTM |
Control |
% Eficacia (IC 96.1%) |
CERVARIXTM |
Control |
% Eficacia (IC 95%) |
||||||
|
N |
n |
N |
n |
N |
n |
N |
n |
||||
|
Análisis especificado por el protocolo (ATP y TVC-1) |
|||||||||||
|
NIC3+ |
ATP(1) |
7344 |
2 |
7312 |
10 |
80.0% (0.3;98.1) |
7338 |
2 |
7305 |
24 |
91.7% (66.6;99.1) |
|
TVC-1(2) |
8040 |
2 |
8080 |
22 |
90.9% (60.8;99.1) |
8068 |
2 |
8103 |
40 |
95.0% (80.7;99.4) |
|
|
NIC2+ |
ATP(1) |
7344 |
4 |
7312 |
56 |
92.9% (79.9;98.3) |
7338 |
5 |
7305 |
97 |
94.9% (87.7;98.4) |
|
TVC-1(2) |
8040 |
5 |
8080 |
91 |
94.5% (86.2;98.4) |
8068 |
6 |
8103 |
135 |
95.6% (90.1;98.4) |
|
|
NIC1+ |
ATP(1) |
7344 |
8 |
7312 |
96 |
91.7% (82.4;96.7) |
7338 |
12 |
7305 |
165 |
92.8% (87.1;96.4) |
|
TVC-1(2) |
8040 |
11 |
8080 |
135 |
91.8% (84.5;96.2) |
8068 |
15 |
8103 |
210 |
92.9% (88.0;96.1) |
|
|
Asignación del tipo de VPH (análisis exploratorio) (ATP y TVC-1) |
|||||||||||
|
NIC3+ |
ATP(1) |
7344 |
0 |
7312 |
8 |
100% (36.4;100) |
7338 |
0 |
7305 |
22 |
100% (81.8;100) |
|
TVC-1(2) |
8040 |
0 |
8080 |
20 |
100% (78.1;100) |
8068 |
0 |
8103 |
38 |
100% (89.8;100) |
|
|
NIC2+ |
ATP(1) |
7344 |
1 |
7312 |
53 |
98.1% (88.4;100) |
7338 |
1 |
7305 |
92 |
98.9% (93.8;100) |
|
TVC-1(2) |
8040 |
2 |
8080 |
87 |
97.7% (91.0;99.8) |
8068 |
2 |
8103 |
128 |
98.4% (94.3;99.8) |
|
|
NIC1+ |
ATP(1) |
7344 |
2 |
7312 |
90 |
97.8% (91.4;99.8) |
7338 |
3 |
7305 |
154 |
98.1% (94.3;99.6) |
|
TVC-1(2) |
8040 |
5 |
8080 |
128 |
96.1% (90.3;98.8) |
8068 |
6 |
8103 |
196 |
97.0% (93.3;98.9) |
|
|
N = número de sujetos incluidos en cada grupo. n = número de casos. (1)3 dosis de la vacuna, ADN negativas y seronegativas en el mes 0 y ADN negativa en el mes 6, para el tipo relevante de VPH (VPH-16 o VPH-18). (2) al menos una dosis de la vacuna, ADN negativas y seronegativas para el tipo relevante de VPH (VPH-16 o VPH-18) en el mes 0. |
|||||||||||
Además, en el momento del análisis final del estudio, se demostró que la eficacia de la vacuna es estadísticamente significativa contra las NIC2+ asociadas con el VPH-16 y VPH-18, para cada tipo individual, en ambas cohortes correspondientes a cada análisis.
Asimismo se valoró la eficacia de la vacuna contra la infección persistente de 6 meses y de 12 meses, y las anomalías citológicas (≥ASCUS) asociadas con el VPH-16/18. La eficacia ob-servada de la vacuna frente a cada criterio de valoración fue estadísticamente significativa en ambas cohortes:
En el momento del análisis final del estudio:
— Infección persistente de 6 meses: 94.3% (91.5;96.3) en la cohorte ATP y 90.2% (87.3;92.6) en la cohorte TVC-1,
— Infección persistente de 12 meses: 91.4% (86.1;95.0) en la cohorte ATP y 85.3% (79.9;89.4) en la cohorte TVC-1,
— Anomalías citológicas (≥ASCUS): 89.0% (84.9;92.1) en la cohorte ATP y 86.7% (82.8; 89.8) en la cohorte TVC-1.
En análisis de conclusión del estudio:
— Infección persistente de 6 meses: 94.3% (92.0;96.1) en la cohorte ATP y 91.0% (88.5;93.0) en la cohorte TVC-1,
— Infección persistente de 12 meses: 92.9% (89.4;95.4) en la cohorte ATP y 88.2% (84.5%; 91.2%) en la cohorte TVC-1,
— Anomalías citológicas (≥ASCUS): 90.7% (87.8;93.1) en la cohorte ATP y 88.6% (85.6;91.0) en la cohorte TVC-1.
En el momento del análisis final del estudio, se observó igualmente que la eficacia de la vacuna es estadísticamente significativa contra las lesiones NIV1+ (neoplasia intraepitelial vulvar de grado 1 y lesiones de grado superior) o las NIVa1+ (neoplasia intraepitelial vaginal de grado 1 y lesiones de grado superior) asociadas con el VPH-16/18 en ambas cohortes: 80.0% (IC 96.1%: 0.3;98.1) en la cohorte ATP y 83.2% (IC 96.1%: 20.2;98.4) en la cohorte TVC-1. En el análisis de conclusión del estudio, la eficacia de la vacuna contra las NIV1+ o NIVa1+ asociadas con el VPH-16/18 fue del 75.1% (IC 95%: 22.9; 94.0) en la cohorte ATP y del 77.7% (IC 95%: 32.4;94.5) en la cohorte TVC-1. Hubo 2 casos de NIV2+ o NIVa2+ asociados con VPH-16 o VPH-18 en el grupo de la vacuna y 7 casos en el grupo de control en la cohorte ATP. El estudio no se diseñó con la potencia suficiente como para demostrar una diferencia entre la vacuna y el grupo de control para estos criterios de valoración.
No se observó evidencia de protección frente a la enfermedad causada por los tipos de VPH para los que los sujetos eran ADN positivos al inicio del estudio. Sin embargo, los individuos ya infectados antes de la vacunación por uno de los tipos de VPH relacionados con la vacuna se vieron protegidos contra la enfermedad clínica causada por el otro tipo de VPH de la vacuna.
Impacto global de la vacuna en la carga de la enfermedad por el VPH: En el estudio HPV-008 se evaluó la eficacia global de la vacuna independientemente del tipo de ADN de VPH en la lesión y estratificada por el estatus de ADN de VPH y sérico iniciales.
En las cohortes TVC y sin infección previa de la cohorte TVC, que incluyeron a todas las mujeres vacunadas, se demostró la eficacia de la vacuna contra las NIC3+, NIC2+ y NIC1+ (Tabla 3). Se demostró asimismo el impacto de CERVARIXTM en la reducción de la terapia cervical local (Procedimiento de Electroexcisión con Asa, Conización, Cuchillo o Láser) en las mismas cohortes (Tabla 3).
El grupo sin infección previa de la cohorte TVC es un subconjunto de la TVC que incluye mujeres con citología normal, y que eran ADN de VPH negativas para 14 tipos oncogénicos del VPH (VPH-16, -18, -31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, -68) y seronegativas para el VPH-16 y VPH-18 al inicio del estudio.
|
Tabla 3: Eficacia de la vacuna independientemente del tipo de |
|||||||||||
|
Análisis final del estudio |
Análisis de conclusión del estudio |
||||||||||
|
CERVARIXTM |
Control |
% Eficacia (IC 96.1%) |
CERVARIXTM |
Control |
% Eficacia (IC 95%) |
||||||
|
N |
n |
N |
n |
N |
n |
N |
n |
||||
|
NIC3+ |
TVC sin infección previa (1) |
5449 |
3 |
5436 |
23 |
87.0% (54.9;97.7) |
5466 |
3 |
5452 |
44 |
93.2% (78.9;98.7) |
|
TVC (2) |
8667 |
77 |
8682 |
116 |
33.4% (9.1;51.5) |
8694 |
86 |
8708 |
158 |
45.6% (28.8;58.7) |
|
|
NIC2+ |
TVC sin infección previa(1) |
5449 |
33 |
5436 |
110 |
70.2% (54.7;80.9) |
5466 |
61 |
5452 |
172 |
64.9% (52.7;74.2) |
|
TVC (2) |
8667 |
224 |
8682 |
322 |
30.4% (16.4;42.1) |
8694 |
287 |
8708 |
428 |
33.1% (22.2;42.6) |
|
|
NIC1+ |
TVC sin infección previa (1) |
5449 |
106 |
5436 |
211 |
50.1% (35.9;61.4) |
5466 |
174 |
5452 |
346 |
50.3% (40.2;58.8) |
|
TVC (2) |
8667 |
451 |
8682 |
577 |
21.7% (10.7;31.4) |
8694 |
579 |
8708 |
798 |
27.7% (19.5;35.2) |
|
|
Terapia cervical local |
TVC sin infección previa (1) |
5449 |
26 |
5436 |
83 |
68.8% (50.0;81.2) |
5466 |
43 |
5452 |
143 |
70.2% (57.8;79.3) |
|
TVC (2) |
8667 |
180 |
8682 |
240 |
24.7% (7.4;38.9) |
8694 |
230 |
8708 |
344 |
33.2% (20.8;43.7) |
|
|
N = número de sujetos incluidos en cada grupo n = número de casos (1) TVC- sin infección previa: Incluye todos los sujetos vacunados (que recibieron al menos una dosis de la vacuna) con citología normal, y que eran ADN de VPH negativos para 14 tipos oncogénicos del VPH y seronegativos para el VPH-16 y VPH-18 al inicio (2) TVC: Incluye todos los sujetos vacunados (que recibieron al menos una dosis de la vacuna). |
|||||||||||
Eficacia profiláctica frente a la infección por otros tipos oncogénicos del VPH aparte del VPH-16 y del VPH-18: En el estudio HPV-008, se evaluó la eficacia de la vacuna frente a 12 tipos oncogénicos del VPH no vacunales (VPH-31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, -68) en las cohortes ATP y TVC-1.
En el momento del análisis final del estudio, la eficacia estadísticamente significativa de la vacuna contra las lesiones NIC2+ para todos los tipos combinados del VPH (VPH-31, -33, -35, -39, -45, -51, -52, -56, -58, -59, -66, -68), sin incluir los tipos 16 y 18 del VPH, fue de 54.0% (IC 96.1%: 34.0;68.4) en la cohorte ATP y de 46.0% (IC 96.1%: 27.0;60.3) en la co-horte TVC-1. En el análisis de conclusión del estudio, la eficacia de la vacuna contra las NIC2+ para todos los tipos de VPH combinados, excluidos los tipos 16 y 18 de VPH, fue del 46.8% (IC 95%: 30.7;59.4) en la cohorte ATP y del 40.8% (IC 95%: 25.5;53.1) en la cohorte TVC-1.
En el momento del análisis final del estudio, se ha observado una eficacia estadísticamente significativa de la vacuna frente a la infección persistente de seis meses y frente a las lesiones NIC2+ para los siguientes tipos de VPH individuales:
— Infección persistente de 6 meses: Tipos 31, 33, 45 en la cohorte ATP; tipos 31, 33, 45, 51 en la cohorte TVC-1.
— NIC2+: Tipos 31, 51, 58 en la cohorte ATP; tipos 31, 33, 35, 51 en la cohorte TVC-1.
En el análisis de conclusión del estudio, se acumularon más casos y se observó un límite inferior del IC 95% por encima de cero para los tipos 31, 33, 45 y 51 de VPH, tanto para la infección persistente de 6 meses como para las NIC2+ en las cohortes ATP y TVC-1. Para las NIC2+, también se observó un límite inferior del IC 95% por encima de cero para el tipo 39 de VPH en la cohorte ATP y para el tipo 66 de VPH en la cohorte TVC-1.
Eficacia clínica en mujeres de 26 años o más: La eficacia de CERVARIXTM se evaluó en un ensayo clínico doble ciego, aleatorizado, de fase III (HPV-015), que incluyó un total de 5777 mujeres de 26 años o más. El estudio se llevó a cabo en América del Norte, América Latina, Asia del Pacífico y Europa, y permitió la inscripción de mujeres con antecedentes de enfermedad/infección por el VPH. Se efectuó un análisis intermedio cuando todos los sujetos habían completado la visita del mes 48 del estudio.
Los análisis primarios de eficacia se efectuaron en la cohorte ATP para la eficacia y en la co-horte TVC.
En la siguiente tabla, se resume la eficacia de la vacuna contra el criterio de valoración prima-rio combinado (infección persistente de 6 meses y/o NIC1+) asociado con el VPH 16/18.
|
Tabla 4. Eficacia de la vacuna contra la 6M PI y/o la NIC1+ asociadas con el VPH 16/18 en las cohortes ATP y TVC |
||||||
|
Criterio de valoración de VPH-16/18 |
ATP(1) |
TVC(2) |
||||
|
CERVARIXTM |
Control |
% eficacia (IC 97.7%) |
CERVARIXTM |
Control |
% eficacia (IC 97.7%) |
|
|
N=1898 |
N=1854 |
N=2772 |
N=2779 |
|||
|
n |
n |
n |
n |
|||
|
6M PI y/o NIC1+ |
7 |
36 |
81.1% (52.1; 94.0) |
90 |
158 |
43.9% (23.9; 59.0) |
|
6M PI y/o NIC1+ (TAA de VPH) |
7 |
36 |
81.1% (52.1; 94.0) |
89 |
155 |
43.5% (23.1; 58.7) |
|
N = cantidad de sujetos en cada grupo. n = cantidad de sujetos que informaron al menos un evento en cada grupo. TAA de VPH = algoritmo para la asignación del tipo de VPH. 6M PI = infección persistente de 6 meses. NIC1+ = NIC1, NIC2, NIC3, adenocarcinoma in situ o cáncer de cérvix invasivo. IC = intervalo de confianza. (1) 3 dosis de la vacuna, ADN negativas y seronegativas en el mes 0, y ADN negativas en el mes 6 para el tipo relevante de VPH (VPH-16 y/o VPH-18). (2) Al menos una dosis de la vacuna, independientemente del ADN de VPH y el estatus sérico en el mes 0. Incluye el 15% de los sujetos con antecedentes de enfermedad/infección por el VPH. |
||||||
La eficacia de la vacuna contra la infección persistente de 6 meses fue del 79.1% (IC 97.7% [27.6; 95.9]) para el VPH-31 y del 76.9% (IC 97.7% [18.5; 95.6]) para el VPH-45 en la co-horte ATP.
Eficacia clínica contra infecciones anales prevalentes en mujeres de 18-25 años de edad: El estudio VPH-009 evaluó la eficacia de la vacuna contra infecciones anales prevalentes en la visita del estudio de 4 años. La eficacia de la vacuna contra el VPH-16/18 y contra los tipos de VPH-31/33/45 no vacunales se presenta en la Tabla 5. Se evaluó la infección cervical en las mismas mujeres durante la misma visita para fines de comparación.
|
Tabla 5: Eficacia contra infecciones prevalentes anales y cervicales relacionadas con el VPH-16/18 y el VPH-31/33/45 en el estudio VPH-009 |
||||||||
|
Número de mujeres |
Número de infecciones VPH-16/18 |
Eficacia de vacuna VPH 16/18 (IC 95%) |
Número de mujeres |
Número de infecciones VPH-31/33/45 |
Eficacia de vacuna VPH-31/33/45 (IC 95%) |
|||
|
Cohorte completa* |
Ano |
|||||||
|
Grupo de VPH |
2103 |
47 |
62.0% (47.1; 73.1) |
Grupo de VPH |
2103 |
55 |
49.4% (30.3; 63.6) |
|
|
Grupo de control |
2107 |
124 |
Grupo de control |
2107 |
109 |
|||
|
Cérvix |
||||||||
|
Grupo de VPH |
2103 |
40 |
76.4% (67.0; 83.5) |
Grupo de VPH |
2103 |
76 |
45.2% (27.7; 58.7) |
|
|
Grupo de control |
2107 |
170 |
Grupo de control |
2107 |
139 |
|||
|
Cohorte restringida** |
Ano |
|||||||
|
Grupo de VPH |
1003 |
8 |
83.6% (66.7; 92.8) |
Grupo de VPH |
1629 |
31 |
61.8% (42.8; 75.0) |
|
|
Grupo de control |
986 |
48 |
Grupo de control |
1684 |
84 |
|||
|
Cohorte restringida** |
Cérvix |
|||||||
|
Grupo de VPH |
1003 |
10 |
87.9% (77.4; 94.0) |
Grupo de VPH |
1629 |
49 |
51.3% (31.9; 65.5) |
|
|
Grupo de control |
986 |
81 |
Grupo de control |
1684 |
104 |
|||
|
Grupo de VPH: Grupo de tratamiento vacunado con vacuna CERVARIXTM. Grupo de control: Grupo de tratamiento vacunado con vacuna HavrixTM modificada (vacuna contra la Hepatitis A). *Cohorte completa incluyó a todas las mujeres con especímenes anales disponibles. **Cohorte restringida para comprobar la eficacia contra la infección VPH16/18 incluyó a participantes de la cohorte completa sin evidencia de infección de VPH 16 y VPH 18 cervical prevalente o de anticuerpos de VPH 16 y VPH 18 antes de la vacunación, que recibieron tres dosis de vacunas contra el VPH o de las vacunas de control. La cohorte restringida para comprobar la eficacia contra la infección de VPH-31/33/45 incluyó a mujeres de la cohorte completa sin evidencia de infecciones por VPH 31, 33 o 45 cervicales prevalentes antes de la vacunación, y que recibieron tres dosis de vacuna contra el VPH o de la vacuna de control. |
||||||||
Inmunogenicidad inducida por la vacuna: La respuesta de anticuerpos a VPH-16 y VPH-18 se determinó usando un ELISA de tipo específico que se ha demostrado está correlacionado estrechamente con los análisis de neutralización (incluyendo el ensayo de neutralización basado en seudovirión desarrollado por el Instituto Nacional de Cáncer de los EE.UU.). En estudios clínicos se ha demostrado la transudación de anticuerpos del suero a la mucosa del cérvix del útero.
Se ha evaluado la inmunogenicidad inducida por las tres dosis de CERVARIXTM en más de 5000 mujeres entre los 9 y 55 años y de más de 800 varones entre los 10 y 18 años.
En estudios clínicos, más del 99% de las participantes inicialmente seronegativas habían seroconvertido a los VPH tipo 16 y 18 un mes después de la tercera dosis. Los títulos medios geométricos de IgG inducidos por la vacuna (GMT) están muy por encima de los títulos observados en mujeres infectadas previamente, pero que habían depurado la infección con VPH (infección natural). Las mujeres que eran inicialmente seropositivas y las seronegativas alcanzaron títulos similares después de la vacunación.
Inmunogenicidad en mujeres entre 15 y 25 años: En el estudio HPV-001/007, se evaluó la respuesta inmune contra VPH-16 y VPH-18 hasta 76 meses después de la primera dosis en mujeres de 15 a 25 años al momento de ser vacunadas. En el estudio HPV-023, esta respuesta inmune continuó siendo evaluada hasta 9.4 años después de la dosis uno, en un subconjunto de la población del estudio HPV-001/007. En el estudio HPV-023, 100% de las mujeres vacunadas fueron seropositivas tanto para VPH-16 como VPH-18 por el método de ELISA o por el ensayo neutralización basado en seudovirión (PBNA, por su sigla en inglés) hasta 9.4 años después de la primera dosis de la vacuna.
Los títulos medios geométricos (GMT, por su sigla en inglés) de IgG inducidos por la vacuna para VPH-16 y VPH-18 llegaron al máximo al mes 7 y entonces disminuyeron hasta llegar a un nivel estable a partir del mes 18, sin observarse ninguna disminución sustancial adicional hasta el final del período de seguimiento (mes 113). En el mes 113, los GMT para VPH-16 y VPH-18 continúan siendo al menos 10 veces más altos que los títulos observados en mujeres infectadas previamente, pero que habían depurado la infección con VPH (infección natural) y el 100% de las mujeres resultaron seropositivas para ambos antígenos.
En el estudio HPV-008, la inmunogenicidad hasta el mes 48 fue similar a la respuesta observada en el estudio HPV-001/007. Se observó un perfil cinético similar con los anticuerpos neutralizantes.
Se extiende la demostración de la eficacia de CERVARIXTM en mujeres de 15 a 25 años a otros grupos de edad: En un análisis combinado (HPV-029, -030 y -048), el 99.7% y el 100% de las niñas de 9 años de edad presentaron seroconversión a los tipos 16 y 18 del VPH, respectivamente, después de la tercera dosis (al mes 7) con GMT al menos 1.4 veces y 2.4 veces más altos que los de las mujeres entre los 10 y 14 años y entre los 15 y 25 años, respectivamente.
En dos estudios clínicos (HPV-012 y -013) hechos con niñas de entre 10 y 14 años, todas las participantes se seroconvirtieron a VPH tipos 16 y 18 después de la tercera dosis (al mes 7) con GMT al menos 2 veces más altos que los de mujeres entre los 15 y 25 años.
En un estudio clínico en curso (HPV-070) que se lleva a cabo en niñas de 9 a 14 años que reciben un programa de vacunación de 2 dosis (0, 6 meses o 0, 12 meses), todas las participantes se seroconvirtieron a ambos tipos de VPH 16 y 18 un mes después de la segunda dosis. Se demostró que la respuesta inmunitaria después de 2 dosis en mujeres de 9 a 14 años no era inferior a la respuesta inmunitaria después de 3 dosis en mujeres de 15 a 25 años.
La eficacia de CERVARIXTM se infiere sobre la base de los datos de inmunogenicidad observados en las niñas de 9 a 14 años de edad que fueron vacunadas.
Inmunogenicidad en mujeres de 26 años o más: En el estudio de fase III (VPH-015) realizado en mujeres de 26 años o más, en el momento de evaluación a los 48 meses, es decir, 42 meses después de completar todo el ciclo de vacunación, el 100% y el 99.4% de las mujeres inicialmente seronegativas continuaron siendo seropositivas para los anticuerpos anti-VPH-16 y anti-VPH-18, respectivamente. Los títulos de anticuerpos tuvieron su valor máximo en el mes 7, disminuyeron gradualmente hasta el mes 18 y se estabilizaron hasta alcanzar una meseta al mes 48.
En otro estudio clínico (HPV-014) realizado en mujeres de entre 26 y 55 años (N = 362), todas las participantes fueron seropositivas para los tipos de VPH 16 y 18 después de la tercera dosis (en el mes 7). Las GMT fueron menores en esta población, en comparación con las mujeres de 15 a 25 años. Sin embargo, todas las participantes permanecieron seropositivas para el VPH-16 y todas, excepto una, permanecieron seropositivas para el VPH-18 a lo largo de la fase de seguimiento (hasta el mes 48) y mantuvieron niveles de anticuerpos en un orden de magnitud por encima de los que se encuentran después de la infección natural.
Comparación de la inmunogenicidad de CERVARIXTM y Gardasil:
En niñas de 9 a 14 años de edad: En un estudio de comparación con Gardasil (estudio VPH-071) realizado en niñas de 9 a 14 años, la superioridad de la respuesta inmunitaria inducida por CERVARIXTM administrada según el programa de vacunación de 2 dosis, 0, 6 meses comparado con el de Gardasil, que se administró según los programas de 2 dosis, 0, 6 meses y el estándar de 3 dosis, 0, 2, 6 meses, quedó demostrado para el VPH-16 y el VPH-18 por ELISA (Tabla 6).
|
Tabla 6: Evaluación de la superioridad de la respuesta inmunitaria del anti-VPH-16 y anti-VPH-18 para CERVARIXTM (programa de 2 dosis, 0, 6 meses) sobre Gardasil (programa de 2 dosis, 0, 6 meses u programa de 3 dosis, 0, 2, 6 meses) un mes y seis meses después de la última dosis (Cohorte Total Vacunada) |
||||||
|
Anticuerpo |
N |
GMT |
N |
GMT |
Tasa GMT (CERVARIXTM /Gardasil) IC 95% (LL; UL) |
|
|
Mes 7 |
CERVARIXTM 0,6 meses |
Gardasil 0,6 meses |
||||
|
Anti-VPH-16 |
357 |
8256 |
353 |
4886 |
1.7 (1.5; 1.9) |
|
|
Anti-VPH-18 |
357 |
5268 |
353 |
1166 |
4.5 (4.0; 5.1) |
|
|
CERVARIXTM 0,6 meses |
Gardasil 0,2,6 meses |
|||||
|
Anti-VPH-16 |
357 |
8256 |
351 |
4789 |
1.7 (1.5; 1.9) |
|
|
Anti-VPH-18 |
357 |
5268 |
351 |
1636 |
3.2 (2.8; 3.7) |
|
|
Mes 12 |
CERVARIXTM 0,6 meses |
Gardasil 0,6 meses |
||||
|
Anti-VPH-16 |
355 |
2217 |
347 |
1260 |
1.8 (1.5; 2.0) |
|
|
Anti-VPH-18 |
355 |
1296 |
347 |
261 |
5.0 (4.3; 5.7) |
|
|
CERVARIXTM 0,6 meses |
Gardasil 0,2,6 meses |
|||||
|
Anti-VPH-16 |
355 |
2217 |
348 |
1567 |
1.4 (1.2; 1.6) |
|
|
Anti-VPH-18 |
355 |
1296 |
348 |
469 |
2.8 (2.4; 3.2) |
|
|
GMT = título medio geométrico de anticuerpos por ELISA. N = cantidad de sujetos con resultado disponible posterior a la vacunación. IC 95% = Intervalo de confianza del 95% para la tasa GMT (modelo Anova - variación combinada); LL = límite inferior, UL = límite superior; valor p = 0.0001. La relación entre los niveles de anticuerpo y la eficacia clínica no se entiende completamente. |
||||||
En mujeres de 18 a 45 años de edad: En un estudio comparativo de no inferioridad con Gardasil (estudio HPV-010) en mujeres de 18-45 años se demostró la no inferioridad de la respuesta inmunitaria provocada por CERVARIXTM para los anticuerpos neutralizantes contra el VPH-16 y el VPH-18 en todas las cohortes etarias hasta tres años después de la primera vacunación (Tabla 7).
|
Tabla 7: Evaluación de no inferioridad* en términos de los títulos de anticuerpos neutrali-zantes entre CERVARIXTM y Gardasil para el VPH-16 y el VPH-18 en el mes 7 y en el mes 60 (ATP) en el estudio HPV-010 |
|||||||
|
CERVARIXTM |
Gardasil |
Tasa GMT CERVARIXTM/ Gardasil IC 97,6% en el mes 7 IC 95% en el mes 60 |
|||||
|
Edad (años) |
N |
GMT (ED50) |
N |
GMT (ED50) |
|||
|
Mes 7 |
VPH-16 |
18-26 |
104 |
36792 |
103 |
10053 |
3.7 (2.6; 5.2) |
|
27-35 |
90 |
23908 |
85 |
4958 |
4.8 (3.3; 7.1) |
||
|
36-45 |
96 |
17301 |
83 |
7634 |
2.3 (1.5; 3.4) |
||
|
VPH-18 |
18-26 |
118 |
16487 |
131 |
2258 |
7.30 (5.1; 10.4) |
|
|
27-35 |
102 |
9502 |
101 |
1043 |
9.1 (6.0; 13.9) |
||
|
36-45 |
110 |
9845 |
91 |
1439 |
6.8 (4.6; 10.2) |
||
|
Mes 60 |
VPH-16 |
18-26 |
35 |
4118 |
40 |
530 |
7.8 (4.3; 14.0) |
|
27-35 |
43 |
1925 |
29 |
346 |
5.6 (3.0; 10.2) |
||
|
36-45 |
46 |
1784 |
47 |
765 |
2.3 (1.3; 4.3) |
||
|
VPH-18 |
18-26 |
39 |
1523 |
52 |
126 |
12.1 (6.6; 22.1) |
|
|
27-35 |
54 |
967 |
36 |
74 |
13.0 (7.6; 22.2) |
||
|
36-45 |
55 |
817 |
51 |
105 |
7.8 (4.5; 13.3) |
||
|
ED50 = dosis estimada = dilución sérica que da una reducción del 50% de la señal en comparación con un control sin GMT sérica = media geométrica del título de anticuerpos N = cantidad de sujetos con resultado disponible posterior a la vacunación Se demostró no inferioridad cuando el límite inferior del IC del 97,6% o del IC del 95% era mayor que 0,5 *También se demostró la superioridad de la respuesta inmunitaria inducida por CERVARIXTM hasta el mes 60 para los anticuerpos neutralizantes contra el VPH-16 y el VPH-18 en todas las cohortes etarias. La relación entre los niveles de anticuerpo y la eficacia clínica no se entiende completamente. |
|||||||
Inmunogenicidad en mujeres infectadas por el VIH: En un estudio clínico realizado en 120 sujetos asintomáticos con VIH positivo de 18 a 25 años de edad (60 sujetos recibieron CERVARIXTM), todas las participantes fueron seropositivas para el VPH tipo 16 y para el VPH tipo 18 después de la tercera dosis (en el mes 7), y la seropositividad para el VPH tipo 16 y 18 se mantuvo hasta el mes 12. Los GMT son más bajos en esta población que los valores observados en los sujetos VIH negativos, pero la respuesta fue más de quince veces mayor que la respuesta a la infección por el VPH natural, y los niveles de GMT fueron equivalentes o superiores a los niveles con los que se ha demostrado una eficacia sostenida.
Se observó que, en general, CERVARIXTM es bien tolerado en las mujeres de 18 a 25 años infectadas por el VIH durante un máximo de seis meses después de la última dosis de la vacuna y, durante el período de 12 meses del ensayo, la vacuna no afectó el recuento de linfocitos CD4+, la carga viral de VIH ni el estadio clínico de la infección por el VIH.
Inmunogenicidad en participantes masculinos de 10 a 18 años de edad: La inmunogenicidad en participantes masculinos se evaluó en dos ensayos clínicos, VPH-011 (N=173) y VPH-040 (N=556). Los datos mostraron inmunogenicidad comparable en mujeres y varones. En el estudio VPH-011, todos los sujetos habían seroconvertido a VPH-16 y 18, y los niveles de GMT no fueron inferiores a los observados en los participantes femeninos de 15 a 25 años de edad del estudio VPH-012.
FARMACOCINÉTICAS: No se requiere la evaluación de las propiedades farmacocinéticas de las vacunas.
CONTRAINDICACIONES: CERVARIXTM no deberá ser administrada a personas con hipersensibilidad conocida a cualquier componente de la vacuna (véanse Composición cualitativa y cuantitativa y Lista de excipientes).
ADVERTENCIAS Y PRECAUCIONES: Es buena práctica clínica que la vacunación sea precedida por una revisión del historial médico (especialmente en cuanto a la vacunación previa y la ocurrencia posible de eventos adversos) y un examen clínico.
Como con todas las vacunas inyectables, deberá contarse con el tratamiento médico y supervisión apropiados, en el raro caso de que ocurra una reacción anafiláctica después de administrarse la vacuna.
Puede presentarse síncope (desmayos) después, o incluso antes, de cualquier vacunación como una respuesta psicogénica a la inyección con aguja. Es importante que se tengan disponibles los debidos procedimientos debidos para evitar lesiones por desmayos.
Como ocurre con otras vacunas, la administración de CERVARIXTM deberá posponerse en las niñas y mujeres que padecen enfermedad febril grave aguda. Sin embargo, la presencia de una infección menor, por ejemplo un resfriado, no debería ser motivo para aplazar la aplicación de la vacuna.
En ningún caso deberá administrarse CERVARIXTM por vía intravascular o intradérmica. No se tienen datos sobre la administración subcutánea de CERVARIXTM.
Como ocurre con otras vacunas administradas por vía intramuscular, CERVARIXTM deberá administrarse con precaución a personas con trombocitopenia o cualquier trastorno de la coagulación, puesto que en estos pacientes puede producirse una hemorragia después de la administración intramuscular.
Como con cualquier vacuna, es posible que no se induzca una respuesta inmunoprotectora en todas las personas vacunadas.
CERVARIXTM es una vacuna profiláctica. No busca prevenir la progresión de las lesiones debidas al VPH presentes al momento de la vacunación. CERVARIXTM no ofrece protección frente a todos los tipos oncogénicos del VPH (ver Farmacodinamia).
La vacunación es una prevención primaria y no es un substituto de los programas de detección temprana de anormalidades del cuello del útero, (prevención secundaria) o de la adopción de precauciones contra la exposición al VPH y las enfermedades de transmisión sexual.
Excepto por los sujetos con infección asintomática por el virus de inmunodeficiencia humana (VIH) de quienes se disponen datos limitados (ver Farmacodinamia), no hay información sobre el uso de CERVARIXTM en sujetos con respuesta inmune reducida, como los pacientes que reciben tratamiento inmunosupresor. Es posible que en estos pacientes no se obtenga la respuesta inmune adecuada.
No se ha establecido totalmente la duración de la protección. Se ha observado una eficacia protectora sostenida durante al menos 9.4 años después de la primera dosis. Se están realizando estudios a largo plazo para establecer la duración de la protección (ver Farmacodinamia).
PRECAUCIONES ESPECIALES DE CONSERVACIÓN: Conservar en refrigeración (de 2 °C a 8 ºC). No congelar.
Conservar en el envase original a fin de proteger el producto de la luz.
CERVARIXTM deberá administrarse tan pronto como sea posible una vez retirado del refrigerador.
Sin embargo, los datos de estabilidad generados indican que CERVARIXTM presentado en envases monodosis se mantiene estable y puede administrarse, en caso de que se haya almacenado fuera del refrigerador, hasta tres días entre 8 °C y 25 °C o hasta un día a temperaturas entre 25 °C y 37 °C.
Una vez abierto el vial multidosis, se recomienda su uso inmediato. Si no se usa inmediatamente, la vacuna debe almacenarse en un refrigerador (entre +2 °C y +8 °C). Si no se usa en el plazo de 6 horas, debe desecharse.
EMBARAZO Y LACTANCIA:
Embarazo: Se ha evaluado en ratas el efecto de CERVARIXTM en la supervivencia y en el desarrollo del embrión - feto, en efectos perinatales y posnatales. Dichos estudios en animales no indican ningún efecto perjudicial directo o indirecto con respecto a la fertilidad, el embarazo, el desarrollo embrionario o fetal, el parto o el desarrollo posnatal.
Los datos de mujeres embarazadas recopilados en ensayos clínicos, registros de embarazos y estudios epidemiológicos no sugieren que la vacunación con CERVARIXTM altera el riesgo de resultados anómalos en recién nacidos, tales como defectos de nacimiento. Los datos son insuficientes para concluir si la vacunación con CERVARIXTM afecta o no el riesgo de aborto espontáneo.
Se les recomienda a las mujeres embarazadas o que estén intentando quedar embarazadas posponer la vacunación hasta después del término del embarazo.
Lactancia: No se ha evaluado, en estudios clínicos, el efecto en los lactantes cuyas madres recibieron CERVARIXTM durante el período de lactancia.
CERVARIXTM podrá emplearse durante el período de lactancia únicamente cuando las posibles ventajas superen a los posibles riesgos.
Los datos serológicos sugieren la transferencia de anticuerpos anti-VPH16 y anti-VPH18 a través de la leche durante el período de lactancia en ratas. Sin embargo, se desconoce si los anticuerpos inducidos por la vacuna se excretan en la leche materna humana.
REACCIONES ADVERSAS:
Datos de estudios clínicos: En estudios clínicos, se administró un total de aproximadamente 45,000 dosis de CERVARIXTM a aproximadamente 16,000 participantes femeninos de 9-72 años de edad; y se administraron aproximadamente 7,800 dosis a aproximadamente 2,600 participantes masculinos de 10-18 años de edad. Se realizó un seguimiento de estas participantes para evaluar la seguridad de la vacuna.
La reacción observada con mayor frecuencia después de la administración de la vacuna fue dolor en el sitio de la inyección, que se produjo después del 78% de todas las dosis. La mayoría de estas reacciones fueron de leves a moderadas en severidad, y no fueron de larga duración.
Las reacciones adversas que se consideraron por lo menos posiblemente relacionadas con la vacunación se han clasificado por su frecuencia.
Las frecuencias notificadas son las siguientes:
Muy frecuentes (≥ 1/10)
Frecuentes (≥ 1/100 a < 1/10)
Infrecuentes (≥ 1/1,000 a < 1/100)
Muy infrecuentes (≥ 1/10,000 a < 1/1,000)
Infecciones e infestaciones:
Infrecuentes: Infección de las vías respiratorias altas.
Trastornos del sistema sanguíneo y linfático:
Infrecuente: Linfadenopatía.
Trastornos del sistema nervioso:
Muy frecuentes: Cefalea.
Infrecuentes: Mareos.
Trastornos digestivos:
Frecuentes: Gastrointestinales, incluidas las náuseas, vómitos, diarrea y dolor abdominal.
Trastornos de la piel y de los tejidos blandos:
Frecuentes: Comezón/prurito, erupción, urticaria.
Trastornos musculoesqueléticos y del tejido conjuntivo, y óseos:
Muy frecuentes: Mialgia.
Frecuentes: Artralgia.
Trastornos generales y alteraciones en el lugar de administración:
Muy frecuentes: Reacciones en el sitio de la inyección, incluyendo dolor, rubor e inflamación, fatiga.
Frecuentes: Fiebre (≥ 38 °C).
Infrecuentes: Otras reacciones en el sitio de la inyección, como induración, parestesia local.
Datos poscomercialización:
Alteraciones en el sistema inmune:
Muy infrecuentes: Reacciones alérgicas (incluyendo reacciones anafilácticas y anafilactoides), angioedema.
Alteraciones en el sistema nervioso:
Muy infrecuentes: Síncope o respuestas vasovagales a la inyección, algunas veces acompaña-dos de movimientos tónico-clónicos.
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: No se han estudiado los efectos sobre la capacidad para conducir y utilizar máquinas.
INCOMPATIBILIDADES: A falta de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos.
Período de caducidad: La fecha de caducidad de la vacuna está indicada en la etiqueta y en el envase.
INTERACCIONES:
Uso con otras vacunas: CERVARIXTM puede administrarse de manera concomitante con cualquiera de las siguientes vacunas: Vacuna antigénica reducida antidiftérica-antitetánica-antipertussis acelular (dTpa), vacuna de poliovirus inactivado (VPI) y la vacuna combinada dTpa-VPI; vacuna contra la hepatitis A (inactivada) (HepA), vacuna contra la hepatitis B recombinante (ADNr) (HepB) y la vacuna HepA-HepB combinada.
La administración de CERVARIXTM al mismo tiempo que TwinrixTM (vacuna HepA HepB combinada) no ha mostrado ninguna interferencia clínicamente relevante en la respuesta de anticuerpos frente a los antígenos de VPH y de hepatitis A. Los títulos medios geométricos de anticuerpos anti-HBs fueron más bajos en el caso de la coadministración, pero la importancia clínica de esta observación se desconoce debido a que los índices de seroprotección no se ven afectados. La proporción de sujetos que alcanzaron niveles de anticuerpos anti-HBs ≥10 mIU/ml fue de 98.3% para la vacunación concomitante y de 100% para TwinrixTM solo.
Si se va administrar CERVARIXTM al mismo tiempo que otras vacunas inyectables, las vacunas deberán administrarse siempre en sitios distintos de inyección.
Uso con anticonceptivos hormonales: En estudios de eficacia clínica, aproximadamente 60% de las mujeres vacunadas con CERVARIXTM usaban anticonceptivos hormonales. No se tiene evidencia de que el uso de anticonceptivos hormonales afecte la eficacia de CERVARIXTM.
Uso con medicamentos inmunosupresores sistémicos: Como ocurre con otras vacunas, puede esperarse que, en los pacientes que reciben tratamiento inmunosupresor, no se obtenga una respuesta inmune adecuada.
ESTUDIOS CLÍNICOS: Ver Farmacodinamia.
DATOS DE SEGURIDAD PRECLÍNICA: Los datos no clínicos revelan la ausencia de peligros especiales para los seres humanos, basados en estudios convencionales de farmacología de seguridad, toxicidad con dosis agudas y repetidas, tolerabilidad local, fertilidad, toxicidad embrio-fetal y posnatal (hasta el final del período de lactancia).
POSOLOGÍA Y ADMINISTRACIÓN: El programa de vacunación dependerá de la edad del sujeto.
|
Edad al momento de la primera inyección |
Inmunización y programa |
|
9 hasta 14 años inclusive |
Dos dosis de 0,5 ml cada una. La segunda dosis administrada entre 5 y 13 meses después de la pri-mera dosis* o Tres dosis de 0,5 ml cada una a los 0, 1 y 6 meses** |
|
A partir de los 15 años |
Tres dosis de 0,5 ml cada una a los 0, 1 y 6 meses** |
|
*Si la segunda dosis de la vacuna se administra antes del 5to mes posterior a la primera dosis, siempre se debe administrar una tercera dosis. **Si fuese necesario tener flexibilidad en el programa de vacunación, la segunda dosis podría administrarse entre 1 mes y 2,5 meses después de la primera dosis y la tercera dosis entre 5 y 12 meses después de la primera dosis. |
|
Aunque no se ha establecido la necesidad de una dosis de refuerzo, se ha observado que se produce una respuesta anamnésica después de la administración de una dosis adicional (ver Farmacodinamia).
CERVARIXTM se aplica como inyección intramuscular, en la región deltoidea (véanse Advertencias y precauciones e Interacciones).
SOBREDOSIS: Los datos disponibles son insuficientes.
INSTRUCCIONES PARA EL EMPLEO/MANEJO: Con el almacenamiento de la jeringa o vial, puede observarse un depósito blanco y fino, con un sobrenadante claro e incoloro. Esto no constituye un signo de deterioro.
El contenido de la jeringa o vial deberá inspeccionarse visualmente, tanto antes como después de agitarse, para comprobar si existe presencia de material particulado externo o un aspecto físico anormal antes de la administración.
En caso de observar alguno de éstos, elimínese la vacuna.
La vacuna deberá agitarse bien antes de su uso.
Cuando se use un vial multidosis, se debe extraer cada 0.5 ml dosis usando una aguja y una jeringa estériles; se debe tomar precauciones para evitar la contaminación del contenido.
Instrucciones para la administración de la vacuna presentada en jeringa prellenada:
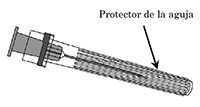
Aguja:
Jeringa:
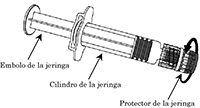
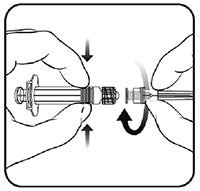
1 Sujetando el cilindro de la jeringa con una mano (evite sujetar el émbolo de la jeringa), desenrosque el protector de la jeringa girándolo en sentido contrario de las manecillas del reloj.
2 Para acoplar la aguja a la jeringa, gire la aguja en el sentido de las manecillas del reloj en la jeringa hasta que la sienta bloqueada (véase la ilustración).
3 Retire el protector de la aguja, que en ocasiones puede estar un poco apretado.
4 Administre la vacuna.
Todo producto no utilizado o los materiales de desecho deberán eliminarse de acuerdo a los requerimientos locales.
No todas las presentaciones están disponibles en todos los países.
Version number: GDS024/IPI019/ Date of issue: 02/Mar/2015.
©2015 GSK group of companies
Manufacturer: GlaxoSmithKline Biologicals s.a.
89, rue de l’Institut - 1330 Rixensart, Belgium
Tel: (32) 2 656 81 11 Fax: (32) 2 656 80 00
*año de creación/actualización del arte.
CERVARIX, TWINRIX y HAVRIX son marcas comerciales del Grupo de Compañías GSK.
GSK Pharmaceuticals CR S.A.
NATURALEZA Y CONTENIDO DEL ENVASE: 0.5 ml de suspensión en una jeringa prellenada (vidrio tipo 1), con un tope de émbolo (goma de butilo), con o sin agujas.
0.5 ml de suspensión en vial (vidrio tipo 1), con un tope (goma de butilo).
1 ml de suspensión en vial (vidrio tipo 1), con un tope (goma de butilo) para 2 dosis. CERVARIXTM se presenta como una suspensión blanca turbia que al estar almacenada, se puede obser-var un depósito blanco y fino, con un sobrenadante claro e incoloro.