
CARDURA XL
DOXAZOSINA
Tabletas
Tabletas, 4 Miligramos
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
Ingrediente activo: Doxazosina.
Las TABLETAS contienen mesilato de doxazosina equivalente a 4 mg de doxazosina.
INDICACIONES TERAPÉUTICAS:
Hiperplasia prostática benigna: La doxazosina XL está indicada para el tratamiento de síntomas clínicos en la Hiperplasia Prostática Benigna (HPB) y para el flujo urinario reducido asociado con la HPB. La doxazosina XL puede usarse en pacientes con HPB que son hipertensos o normotensos. Aunque los cambios en la presión sanguínea de los pacientes normotensos con HPB son clínicamente insignificantes, los pacientes con hipertensión e HPB han sido tratados efectivamente para ambas condiciones con la terapia de doxazosina XL.
PARTICULARIDADES FARMACÉUTICAS:
Condiciones de almacenamiento: Almacenar a una temperatura inferior a 30 °C. Manténgase fuera del alcance de los niños.
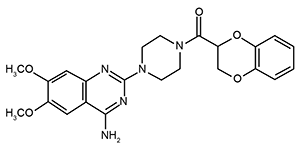
Estructura y nombre químico del principio activo: 4-amino-2-[4-(1,4-benzodioxan-2-carbonyl)piperazin-1-yl]-6,7-dimethoxyquinazoline
Documento de producto referencia No.: 191
Fecha: 18 de noviembre, 2008
Reemplaza: 25 de abril, 2006
PFIZER
® Marca registrada
PROPIEDADES FARMACODINÁMICAS:
Hiperplasia prostática benigna: La administración de doxazosina XL a pacientes con HPB sintomática da como resultado una mejora significativa en la dinámica y los síntomas urinarios. Se cree que el efecto sobre la HPB es el resultado de un bloqueo selectivo de los adrenorreceptores alfa localizados en el estroma muscular y la cápsula de la próstata y en el cuello de la vejiga.
Se ha demostrado que doxazosina es un bloqueador efectivo del subtipo 1A del adrenorreceptor alfa-1, el cual corresponde a más del 70% de los subtipos presentes en la próstata. Esto explica su acción en los pacientes con HPB.
Doxazosina XL ha demostrado eficacia y seguridad sostenidas en el tratamiento a largo plazo de la HPB.
Doxazosina XL administrada en el régimen de dosis recomendado posee poco o ningún efecto sobre la presión arterial en pacientes normotensos.
En un estudio clínico controlado sobre HPB, el tratamiento con doxazosina en pacientes con disfunción sexual estuvo asociado con una mejora en la función sexual.
PROPIEDADES FARMACOCINÉTICAS:
Absorción: Después de administrar dosis terapéuticas por la vía oral, doxazosina XL es bien absorbida, alcanzándose gradualmente los niveles sanguíneos máximos (pico) entre 8 a 9 horas después de tomar la medicación. Los niveles plasmáticos máximos (pico) son aproximadamente una tercera parte de los obtenidos con la misma dosis de las tabletas estándar de doxazosina. Sin embargo, los niveles mínimos (valle) a 24 horas son similares.
Las características farmacocinéticas de doxazosina XL llevarán a tener un perfil plasmático más tenue.
La relación pico/valle de doxazosina XL es menos de la mitad de la observada con doxazosina estándar en tabletas.
En el estado de equilibrio, la biodisponibilidad relativa de doxazosina a partir de la administración de doxazosina XL en comparación con la forma estándar fue de 54% con la dosis de 4 mg y 59% con la dosis de 8 mg.
Los estudios farmacocinéticos con doxazosina XL en ancianos no han mostrado alteraciones significativas en comparación con los pacientes más jóvenes.
Biotransformación/eliminación: La eliminación de la droga del plasma es bifásica, siendo la vida media terminal de eliminación de 22 horas. Ello ofrece la base para su administración una vez al día. La doxazosina es metabolizada extensamente, excretándose <5% como droga inalterada.
Los estudios farmacocinéticos con doxazosina estándar en pacientes con deterioro de la función renal no han mostrado alteraciones significativas en comparación con los pacientes con una función renal normal.
Existe solo información limitada en los pacientes con deterioro de la función hepática y sobre los efectos de las drogas que se sabe influyen en el metabolismo hepático (p. ej., cimetidina). En un estudio clínico efectuado en 12 sujetos con un deterioro moderado de la función hepática, la administración de una dosis única de doxazosina dio como resultado un aumento en el área bajo la curva (AUC, area under the curve) de 43% y una reducción en la depuración oral aparente de 40%. Al igual que con cualquier droga metabolizada íntegramente por el hígado, debe tenerse precaución con el empleo de doxazosina en pacientes con alteraciones en la función hepática (ver Precauciones y advertencias especiales en el uso).
Aproximadamente un 98% de la doxazosina está unida a las proteínas en el plasma.
Doxazosina es metabolizada primariamente mediante O-demetilación e hidroxilación.
CONTRAINDICACIONES: La doxazosina XL está contraindicada en pacientes con una hipersensibilidad conocida a quinazolinas, doxazosina o a cualquier otro ingrediente inerte.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES PARA SU USO:
Hipotensión postural/síncope: Como con todos los alfa-bloqueadores, un porcentaje muy pequeño de pacientes han experimentado hipotensión postural manifestada por mareo y debilidad, o rara vez pérdida de la conciencia (síncope), sobre todo al inicio de la terapia (ver Posología y método de administración). Cuando se instaura la terapia con un alfa-bloqueador efectivo, el paciente debe ser asesorado acerca de cómo evitar los síntomas resultantes de la hipotensión postural y qué medidas tomar si se desarrolla. El paciente debe ser advertido de evitar situaciones en donde podrían resultar lesiones si ocurre mareo o debilidad durante el inicio de la terapia con doxazosina XL. El episodio sincopal puede controlarse limitando la dosis inicial y administrando con prudencia cualquier otro hipotensor.
Si se produce síncope hay que acostar al paciente y administrarle el tratamiento adecuado.
Uso con inhibidores PDE-5: La administración concomitante de doxazosina con un inhibidor PDE-5 debe usarse con precaución ya que podría conducir a hipotensión sintomática en algunos pacientes. No se han realizado estudios con doxazosina XL.
Deterioro de la función hepática: Al igual que con cualquier droga metabolizada totalmente por el hígado, doxazosina debe administrarse con precaución a los pacientes con evidencia de deterioro de la función hepática (ver Propiedades farmacocinéticas).
Desórdenes gastrointestinales: Los tiempos marcadamente reducidos de retención gastrointestinal de doxazosina XL podrían influir en el perfil farmacocinético; y, por tanto, en la eficacia clínica de la droga. Al igual que con cualquier otro material no deformable, debe tenerse precaución al administrar doxazosina XL en pacientes con un estrechamiento gastrointestinal severo preexistente (patológico o iatrogénico).
Han aparecido reportes raros sobre síntomas obstructivos en pacientes con estrecheces documentadas en asociación con la ingestión de otra droga en la citada formulación no deformable de liberación prolongada.
Síndrome de iris flácido intraoperatorio: El Síndrome de Iris Flácido Intraoperatorio (el SIFI, es una variante del síndrome de la pupila pequeña) se ha observado durante la cirugía de catarata en algunos pacientes o en los que previamente han recibido tratamiento con alfa 1 bloqueadores. Como el SIFI puede conducir a un incremento en las complicaciones de procedimientos durante la operación, el cirujano oftalmólogo debe estar enterado, con anticipación a la cirugía, respecto al uso actual o previo de alfa bloqueadores.
Información para los pacientes: Debe informarse a los pacientes que las tabletas de doxazosina XL deben deglutirse enteras. Los pacientes no deben morder, dividir ni triturar las tabletas. Los pacientes no deben preocuparse si ocasionalmente observan en sus heces algo que tenga la forma de una tableta. En doxazosina XL, la medicación está contenida dentro de una cubierta no absorbible, la cual ha sido diseñada especialmente para liberar la droga de manera tal que el organismo pueda absorberla. Cuando se completa dicho proceso, la tableta vacía es eliminada del organismo.
EMBARAZO Y LACTANCIA: Aunque no se observaron efectos teratogénicos en las pruebas en animales con doxazosina, se observó una supervivencia fetal reducida en animales a dosis demasiado altas. Estas dosis fueron aproximadamente 300 veces la dosis máxima recomendada en humanos. Los estudios en animales han demostrado que la doxazosina se acumula en la leche materna.
Como no hay estudios adecuados y bien controlados en mujeres embarazadas o amamantando, la seguridad de la doxazosina XL durante el embarazo y la lactancia no se ha establecido. Por consiguiente, la doxazosina XL durante el embarazo y la lactancia, solo debe usarse cuando a juicio del médico el beneficio potencial sobrepase al riesgo potencial.
EFECTOS INDESEABLES: Se enumeran a continuación los eventos adversos comunes (>1%) reportados en los estudios clínicos controlados con placebo previos al mercadeo efectuados con doxazosina XL. Es importante enfatizar que los eventos reportados durante la terapia pueden no necesariamente ser causados por la misma.
Hiperplasia prostática benigna:
— Cuerpo como un todo: Astenia, dolor de espalda, síntomas que semejan influenza.
— Cardiovascular, general: Hipotensión, edema periférico, hipotensión postural.
— Sistema nervioso central y periférico: Mareos, cefalea, vértigo.
— Gastrointestinal: Dolor abdominal, dispepsia, náuseas.
— Músculo esquelético: Mialgias.
— Psiquiátricos: Somnolencia.
— Respiratorio: Bronquitis, disnea, infecciones del tracto respiratorio, rinitis.
— Sistema urinario: Infección del tracto urinario.
La incidencia de eventos adversos después del tratamiento con doxazosina XL (41%) en los estudios clínicos efectuados en pacientes con HPB fue ampliamente similar a la registrada después de administrar placebo (39%) y menor que la observada después de administrar doxazosina estándar (54%).
El perfil de eventos adversos en los pacientes ancianos (>65 años) con HPB no mostró diferencias con respecto al perfil observado en la población más joven.
En la experiencia posterior al mercadeo, se han reportado los siguientes eventos adversos adicionales:
Trastornos sanguíneos y linfáticos: Leucopenia, trombocitopenia.
Trastornos del oído y del laberinto: Tinitus.
Trastornos oculares: Visión borrosa, IFIS (Síndrome de Iris Flácido Intraoperatorio) (ver Advertencias y precauciones especiales para su uso).
Trastornos gastrointestinales: Estreñimiento, diarrea, dispepsia, flatulencia, boca seca, vómito.
Trastornos generales y condiciones en el sitio de la administración: Fatiga, malestar, dolor.
Trastornos hepatobiliares: Colestasis, hepatitis, ictericia.
Trastornos del sistema inmune: Reacción alérgica.
Investigaciones: Pruebas de función hepática anormales, aumento de peso.
Metabolismo y nutrición: Anorexia.
Trastornos músculo-esqueléticos y del tejido conectivo: Artralgia, calambres musculares, debilidad muscular.
Trastornos del sistema nervioso: Mareo postural, hipoestesia, parestesia, síncope, temblor.
Trastornos psiquiátricos: Agitación, ansiedad, depresión, insomnio, nerviosismo.
Trastornos renales y urinarios: Disuria, hematuria, trastorno de la micción, frecuencia de la micción, nicturia, poliuria, incontinencia urinaria.
Trastornos del sistema reproductivo y de las mamas: Ginecomastia, impotencia, priapismo, eyaculación retrógrada.
Trastornos respiratorios, toráxicos y mediastinales: Broncoespasmo agravado, tos, disnea, epistaxis.
Trastornos cutáneos y subcutáneos: Alopecia, prurito, púrpura, rash cutáneo, urticaria.
Trastornos vasculares: Bochornos, hipotensión.
Los siguientes eventos adversos adicionales han sido reportados en la experiencia de mercadeo en pacientes tratados por hipertensión; pero, en general, no son distinguibles de los síntomas que pudieran haber ocurrido en la ausencia de exposición a doxazosina: Bradicardia, taquicardia, palpitaciones, dolor torácico, angina pectoris, infarto de miocardio, accidentes cerebrovasculares y arritmias cardiacas.
EFECTOS EN LA CAPACIDAD DE CONDUCIR Y USAR MÁQUINAS: La capacidad de comprometerse en actividades tales como operar maquinaria u operar vehículos motorizados puede deteriorarse, sobre todo al inicio de la terapia con doxazosina XL.
INTERACCIÓN CON OTROS PRODUCTOS MEDICINALES Y OTRAS FORMAS DE INTERACCIÓN:
Uso con inhibidores PDE-5: (Ver Advertencias y precauciones especiales para su uso: Uso con inhibidores PDE-5).
Otros: La mayor parte (98%) de doxazosina plasmática está ligada a las proteínas. La información in vitro obtenida en plasma humano indica que doxazosina no posee efectos sobre la unión a proteínas de la digoxina, warfarina, fenitoína o indometacina. Se ha administrado doxazosina XL sin ninguna interacción medicamentosa adversa en la experiencia clínica con diuréticos tiazídicos, furosemida, beta-bloqueadores, antiinflamatorios no esteroideos, antibióticos, drogas hipoglicemiantes orales, agentes uricosúricos, o anticoagulantes.
DATOS PRECLÍNICOS DE SEGURIDAD: Los resultados preclínicos no revelan un riesgo especial para los seres humanos sobre la base de los estudios convencionales efectuados en animales con respecto a la seguridad, farmacología, toxicidad con dosis repetidas, genotoxicidad, carcinogenicidad y tolerancia gastrointestinal (ver Embarazo y lactancia).
Carcinogénesis: La administración crónica en la dieta (hasta por 24 meses) de doxazosina a las dosis máximas toleradas de 40 mg/kg/día en ratas y 120 mg/kg/día en ratones no reveló evidencia de potencial carcinogénico. Las dosis más altas evaluadas en estudios en ratas y ratones se asocian con AUCs (una medida de exposición sistémica) que son 8 veces y 4 veces, respectivamente, el AUC en humanos a una dosis de 16 mg/día.
Mutagénesis: Los estudios de mutagenicidad no revelaron efectos relacionados con el fármaco o los metabolitos a cualquiera de los niveles cromosómicos o sub-cromosómicos.
Deterioro de la fertilidad: Los estudios en ratas demostraron una fertilidad reducida en machos tratados con doxazosina a dosis orales de 20 (pero no 5 o 10) mg/kg/día, cerca de 4 veces las exposiciones AUC obtenidas con una dosis en humanos de 12 mg/día. Este efecto fue reversible en un plazo de dos semanas de haber retirado el fármaco. No ha habido reportes de algún efecto de la doxazosina en la fertilidad masculina en humanos.
POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN: La doxazosina puede administrarse con o sin alimentos.
Las tabletas de doxazosina XL deben deglutirse enteras con una cantidad suficiente de líquido. Los pacientes no deben masticar, dividir o triturar las tabletas (ver Advertencias y precauciones especiales para su uso: Información para los pacientes).
Un número significativo de pacientes se controlará con una dosis de 4 mg una vez por día. Podría tomar hasta 4 semanas para que se observe el efecto óptimo de doxazosina XL. De ser necesario, después de dicho periodo podría aumentarse la dosis a 8 mg una vez por día, de acuerdo con la respuesta de los pacientes.
La dosis máxima recomendada es de 8 mg una vez al día.
Uso en pacientes geriátricos: Se recomienda la dosis normal para adultos.
Uso en pacientes con deterioro renal: Como los efectos farmacocinéticos de la doxazosina XL no cambian en pacientes con insuficiencia renal y no hay evidencia de que la doxazosina empeore la disfunción renal existente, pueden usarse las dosis normales en estos pacientes.
Uso en pacientes con deterioro hepático: Ver Advertencias y precauciones especiales para su uso.
Uso en niños: No se ha establecido la seguridad y la eficacia de la doxazosina XL en niños.
SOBREDOSIS: Si la sobredosis conduce a la hipotensión, el paciente debe ser colocado inmediatamente en una posición supina, con la cabeza hacia abajo. Otras medidas de apoyo deben realizarse si se consideran adecuadas en casos individuales. Debido a que la doxazosina XL está altamente unida a las proteínas, no está indicada la diálisis.