
BENICAR TRIPLE
AMLODIPINO, HIDROCLOROTIAZIDA, OLMESARTÁN MEDOXOMILO
Tabletas recubiertas
Estuche, Blíster de aluminio, 14 Tabletas recubiertas,
Estuche, Blíster de aluminio, 28 Tabletas recubiertas,
COMPOSICIÓN:
Composición cualitativa y cuantitativa:
Cada TABLETA recubierta de BENICAR TRIPLE® 20 mg/12,5 mg/5 mg contiene:
Olmesartán medoxomilo 20 mg
Hidroclorotiazida 12,5 mg
Amlodipino (equivalente a 6.944 mg de amlodipino base) 5 mg
Excipientes, c.s
Cada TABLETA recubierta de BENICAR TRIPLE® 40 mg/12,5 mg/5 mg contiene:
Olmesartán medoxomilo 40 mg
Hidroclorotiazida 12,5 mg
Amlodipino (equivalente a 6.944 mg de amlodipino base) 5 mg
Excipientes, c.s
Cada TABLETA recubierta de BENICAR TRIPLE® 40 mg/25 mg/10 mg contiene:
Olmesartán medoxomilo 40 mg
Hidroclorotiazida 25 mg
Amlodipino (equivalente a 13.888 mg de amlodipino base) 10 mg
Excipientes, c.s
Nombre químico:
Olmesartán medoxomilo: (5-Metil-2-oxo-1,3-dioxolen-4-il)metil 4-(1- hidroxi-1-metiletil)-2-propil-1-[[2’-(1 H- tetrazol-5-il)-1,1’-bifenil-4-il]metil]-1H- imidazol-5-carboxilato o (5-Metil-2-oxo-1,3-dioxolen-4-il)metil 4-(1- hidroxi-1-metiletil)-2-propil-1-[[2’-(1 H- tetrazol-5-il)bifenil-4-il]metil]imidazol-5-carboxilato.
Besilato de amlodipino: 3-Ethyl 5-methyl (4RS)-2-[(2-aminoethoxy)methyl]-4-(2-chlorophenyl)-6-methyl-1,4- dihydropyridine-3,5-dicarboxylate benzenesulphonate.
Hidroclorotiazida: 6-chloro-3,4-dihydro-7-sulfamoyl-2H-1,2,4-benzothiadiazine 1,1-dioxide; o 6-chloro-7-sulfamyl- 3,4-dihydro-1,2,4-benzothiadiazine 1,1-dioxide.
Estructura molecular:
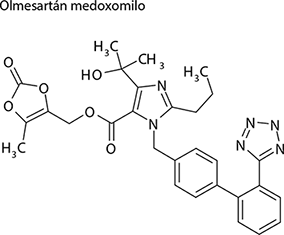


Fórmula molecular:
Olmesartán medoxomilo: C29H30N6O6
Besilato de amlodipino: C20H25ClN2O5. C6H5SO3H
Hidroclorotiazida: C7H8ClN3O4S
Masa molar:
Olmesartán medoxomilo: 558,59 g.mol-1
Besilato de amlodipino: 567,05 g.mol-1
Hidroclorotiazida: 297,74 g.mol-1
Forma farmacéutica:
Tabletas recubiertas.
BENICAR TRIPLE® 20 mg/12,5 mg/5 mg tabletas recubiertas de 8 mm son de color blanco-anaranjada, redondas con C51 grabado en un lado.
BENICAR TRIPLE® 40 mg/12,5 mg/5 mg tabletas recubiertas de 9,5 mm son de color amarillo claro, redondas con C53 grabado en un lado.
BENICAR TRIPLE® 40 mg/25 mg/10 mg tabletas recubiertas con aproximadamente 15 y 7 mm, son de color rojo grisácea, ovales con C57 grabado en un lado.
INDICACIONES TERAPÉUTICAS:
Tratamiento de la hipertensión esencial.
Terapia complementaria:
BENICAR TRIPLE® está indicado en pacientes adultos cuya presión arterial no se controla adecuadamente con la combinación de olmesartán medoxomilo y amlodipino administrados como una formulación de dos componentes.
Terapia de sustitución:
BENICAR TRIPLE® está indicado como terapia de sustitución en pacientes adultos cuya presión arterial se controla adecuadamente con la combinación de olmesartán medoxomilo, amlodipino e hidroclorotiazida, administrados como un componente dual (olmesartán medoxomilo y amlodipino u olmesartán medoxomilo e hidroclorotiazida) y una formulación de un solo componente (hidroclorotiazida o amlodipino).
PROPIEDADES:
Datos farmacéuticos:
Lista de excipientes:
Núcleo de la tableta:
• Almidón pregelatinizado
• Celulosa microcristalina silicificada (celulosa microcristalina y dióxido de silicio)
• Croscarmelosa sódica
• Estearato de magnesio
Recubrimiento:
• Alcohol de polivinilo
• Macrogol
• Talco
• Dióxido de titanio
• Óxido de hierro amarillo (solo tabletas recubiertas de 20 mg/12,5 mg/5 mg, 40 mg/12,5 mg/5 mg y 40 mg/25 mg/10 mg)
• Óxido de hierro rojo (solo tabletas recubiertas de 20 mg/5 mg/12,5 mg y 40 mg/25 mg/10 mg)
• Óxido de hierro negro (solo tabletas recubiertas de 20 mg/5 mg/12,5 mg)
Incompatibilidades:
No aplica.
Vida útil:
24 meses.
CONTRAINDICACIONES:
Hipersensibilidad a los principios activos, a los derivados de la dihidropiridina o a los derivados de las sulfonamidas (ya que la hidroclorotiazida es un fármaco derivado de las sulfonamidas) o a alguno de los excipientes incluidos en la sección 6.1.
Insuficiencia renal grave (véase las secciones Advertencias y Precauciones especiales de uso y Propiedades farmacocinéticas).
Hipopotasemia refractaria, hipercalcemia, hiponatremia e hiperuricemia sintomática.
Insuficiencia hepática grave, colestasis y trastornos biliares obstructivos (véase la sección Propiedades farmacocinéticas).
Segundo y tercer trimestre del embarazo (véase las secciones Advertencias y Precauciones especiales de uso y Fertilidad, embarazo y lactancia).
El uso concomitante de BENICAR TRIPLE® con productos que contienen aliskiren está contraindicado en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 mL/min/1,73 m2) (véase las secciones Interacción con otros medicamentos y otras formas de interacción y Propiedades farmacodinámicas).
Debido al componente amlodipino, BENICAR TRIPLE® está contraindicado en pacientes con:
- Choque (incluido choque cardiogénico).
- Hipotensión severa
- Obstrucción del tracto de salida del ventrículo izquierdo (p. ej., estenosis aórtica de alto grado).
- Insuficiencia cardíaca hemodinámicamente inestable tras un infarto agudo de miocardio.
PRECAUCIONES:
Advertencias y precauciones especiales de uso:
Pacientes con hipovolemia o depleción de sodio:
Puede producirse hipotensión sintomática en pacientes con depleción de volumen y/o sodio como resultado de una terapia diurética vigorosa, restricción de sal en la dieta, diarrea o vómitos, especialmente después de la primera dosis. Se recomienda la corrección de esta afección antes de la administración de BENICAR TRIPLE® o una estrecha supervisión médica al inicio del tratamiento.
Otras condiciones con estimulación del sistema renina-angiotensina-aldosterona:
En pacientes cuyo tono vascular y función renal dependen predominantemente de la actividad del sistema renina- angiotensina-aldosterona (p. ej., pacientes con insuficiencia cardíaca congestiva grave o enfermedad renal subyacente, incluida la estenosis de la arteria renal), se ha asociado el tratamiento con medicamentos que afectan a este sistema con hipotensión aguda, azotemia, oliguria o, raramente, insuficiencia renal aguda.
Hipertensión renovascular:
Existe un mayor riesgo de hipotensión grave e insuficiencia renal cuando los pacientes con estenosis bilateral de la arteria renal o estenosis de la arteria de un solo riñón funcional son tratados con medicamentos que afectan al sistema renina-angiotensina-aldosterona.
Insuficiencia renal y trasplante de riñón:
Cuando se utiliza BENICAR TRIPLE® en pacientes con insuficiencia renal, se recomienda el monitoreo periódico de las concentraciones séricas de potasio y creatinina.
No se recomienda el uso de BENICAR TRIPLE® en pacientes con insuficiencia renal grave (aclaramiento de creatinina <30mL/min) (véase las secciones Posología y Modo de administración, Contraindicaciones y Propiedades farmacocinéticas).
Puede producirse azotemia asociada a diuréticos tiazídicos en pacientes con insuficiencia renal.
Si se hace evidente una insuficiencia renal progresiva, es necesaria una reevaluación cuidadosa del tratamiento, teniendo en cuenta la interrupción del tratamiento con diuréticos.
No hay experiencia en la administración de BENICAR TRIPLE® en pacientes con un trasplante de riñón reciente o en pacientes con insuficiencia renal en etapa terminal (es decir, aclaramiento de creatinina < 12 mL/min).
Doble bloqueo del sistema renina-angiotensina-aldosterona (SRAA):
Existe evidencia de que el uso concomitante de inhibidores de la ECA, bloqueadores de los receptores de la angiotensina II o aliskiren, aumenta el riesgo de hipotensión, hiperpotasemia y disminución de la función renal (incluyendo insuficiencia renal aguda). Por lo tanto, no se recomienda el doble bloqueo del SRAA mediante el uso combinado de inhibidores de la ECA, bloqueadores de los receptores de la angiotensina II o aliskiren (véase las secciones Interacción con otros medicamentos y otras formas de interacción y Propiedades farmacodinámicas).
Si la terapia de doble bloqueo se considera absolutamente necesaria, esto solo debe ocurrir bajo la supervisión de un especialista y sujeto a un estrecho monitoreo frecuente de la función renal, los electrolitos y la presión arterial.
Los inhibidores de la ECA y los bloqueadores de los receptores de la angiotensina II no deben usarse concomitantemente en pacientes con nefropatía diabética.
Insuficiencia hepática:
La exposición a amlodipino y olmesartán medoxomilo aumenta en pacientes con insuficiencia hepática (véase la sección Propiedades farmacocinéticas).
Además, las alteraciones menores del equilibrio de fluidos y electrolitos durante el tratamiento con tiazidas pueden precipitar un coma hepático en pacientes con insuficiencia hepática o enfermedad hepática progresiva.
Se debe tener cuidado cuando se administra BENICAR TRIPLE® a pacientes con insuficiencia hepática leve a moderada.
En pacientes con insuficiencia hepática moderada, la dosis de olmesartán medoxomilo no debe exceder los 20 mg (véase la sección Posología y Modo de administración).
En pacientes con insuficiencia hepática, se debe iniciar amlodipino en el extremo inferior del rango de dosificación y se debe tener precaución, tanto en el tratamiento inicial como al aumentar la dosis.
El uso de BENICAR TRIPLE® está contraindicado en pacientes con insuficiencia hepática grave, colestasis u obstrucción biliar (véase la sección Contraindicaciones).
Estenosis de la válvula aórtica y mitral, miocardiopatía hipertrófica obstructiva:
Debido al componente amlodipino de BENICAR TRIPLE®, al igual que con otros vasodilatadores, se indica especial precaución en pacientes que sufren de estenosis aórtica o mitral, o miocardiopatía hipertrófica obstructiva.
Aldosteronismo primario:
Los pacientes con aldosteronismo primario generalmente no responderán a los medicamentos antihipertensivos que actúan inhibiendo el sistema renina-angiotensina. Por lo tanto, no se recomienda el uso de BENICAR TRIPLE® en estos pacientes.
Efectos metabólicos y endocrinos:
La terapia con tiazidas puede alterar la tolerancia a la glucosa. En pacientes diabéticos, puede ser necesario ajustar la dosis de insulina o de hipoglucemiantes orales (véase la sección Interacción con otros medicamentos y otras formas de interacción). La diabetes mellitus latente puede manifestarse durante el tratamiento con tiazidas.
Los aumentos en los niveles de colesterol y triglicéridos son efectos indeseables que se sabe que están asociados con la terapia con diuréticos tiazídicos.
Puede producirse hiperuricemia o puede precipitarse gota manifiesta en algunos pacientes que reciben tratamiento con tiazidas.
Desequilibrio electrolítico:
Al igual que para cualquier paciente que reciba tratamiento con diuréticos, se deben realizar determinaciones periódicas de los electrolitos séricos a intervalos apropiados.
Las tiazidas, incluida la hidroclorotiazida, pueden provocar un desequilibrio de líquidos o electrolitos (incluidas hipopotasemia, hiponatremia y alcalosis hipoclorémica). Los signos de advertencia de desequilibrio de líquidos o electrolitos son sequedad de boca, sed, debilidad, letargo, somnolencia, inquietud, dolor o calambres musculares, fatiga muscular, hipotensión, oliguria, taquicardia y alteraciones gastrointestinales como náuseas o vómitos (véase sección Efectos indeseables).
El riesgo de hipopotasemia es mayor en pacientes con cirrosis hepática, en pacientes que experimentan diuresis intensa, en pacientes que reciben una ingesta oral inadecuada de electrolitos y en pacientes que reciben tratamiento concomitante con corticosteroides o ACTH (véase la sección Interacción con otros medicamentos y otras formas de interacción).
Por el contrario, debido al antagonismo de los receptores de la angiotensina-II (AT1) a través del componente olmesartán medoxomilo de BENICAR TRIPLE®, puede producirse hiperpotasemia, especialmente en presencia de insuficiencia renal y/o insuficiencia cardíaca y diabetes mellitus. Se recomienda un estrecho monitoreo del potasio sérico en pacientes de riesgo. Los diuréticos ahorradores de potasio, los suplementos de potasio o los sustitutos de la sal que contienen potasio y otros medicamentos que pueden aumentar los niveles séricos de potasio (p. ej., heparina) deben administrarse con precaución con BENICAR TRIPLE® (véase la sección Interacción con otros medicamentos y otras formas de interacción) y con un control frecuente de los niveles de potasio.
No hay evidencia de que olmesartán medoxomilo reduzca o prevenga la hiponatremia inducida por diuréticos. El déficit de cloruro es generalmente leve y normalmente no requiere tratamiento.
Las tiazidas pueden disminuir la excreción urinaria de calcio y causar una elevación leve e intermitente del calcio sérico en ausencia de trastornos conocidos del metabolismo del calcio.
La hipercalcemia puede ser evidencia de hiperparatiroidismo oculto. Se deben suspender las tiazidas antes de realizar pruebas de función paratiroidea.
Se ha demostrado que las tiazidas aumentan la excreción urinaria de magnesio, lo que puede provocar hipomagnesemia.
Puede producirse hiponatremia dilucional en pacientes edematosos en climas cálidos.
Litio:
Al igual que con otros antagonistas de los receptores de la angiotensina II, no se recomienda la coadministración de BENICAR TRIPLE® y litio (véase la sección Interacción con otros medicamentos y otras formas de interacción).
Insuficiencia cardíaca:
Como consecuencia de la inhibición del sistema renina-angiotensina-aldosterona, pueden anticiparse cambios en la función renal en individuos susceptibles.
En pacientes con insuficiencia cardíaca grave cuya función renal puede depender de la actividad del sistema renina- angiotensina-aldosterona, el tratamiento con inhibidores de la enzima convertidora de angiotensina (ECA) y antagonistas de los receptores de la angiotensina se ha asociado con oliguria y/o azotemia progresiva y (raramente) con insuficiencia renal aguda y/o muerte.
Los pacientes con insuficiencia cardíaca deben tratarse con precaución. En un estudio a largo plazo controlado con placebo de amlodipino en pacientes con insuficiencia cardíaca grave (NYHA III y IV), la incidencia notificada de edema pulmonar fue mayor en el grupo de amlodipino que en el grupo de placebo (véase la sección Propiedades farmacodinámicas). Los bloqueadores de los canales de calcio, incluido el amlodipino, deben usarse con precaución en pacientes con insuficiencia cardíaca congestiva, ya que pueden aumentar el riesgo de eventos cardiovasculares futuros y mortalidad.
Enteropatía tipo Sprue:
En casos muy raros, se ha notificado diarrea crónica grave con pérdida de peso sustancial en pacientes que toman olmesartán unos pocos meses o años después del inicio del fármaco, posiblemente causada por una reacción de hipersensibilidad retardada localizada. Las biopsias intestinales de los pacientes a menudo demostraron atrofia de las vellosidades. Si un paciente desarrolla estos síntomas durante el tratamiento con olmesartán, y en ausencia de otras etiologías aparentes, el tratamiento con olmesartán debe suspenderse inmediatamente y no debe reiniciarse. Si la diarrea no mejora durante la semana posterior a la interrupción, se debe considerar el asesoramiento de un especialista (p. ej., un gastroenterólogo).
Derrame coroideo, miopía aguda y glaucoma secundario de ángulo cerrado:
La hidroclorotiazida, una sulfonamida, puede causar una reacción idiosincrásica, lo que resulta en un derrame coroideo con defecto del campo visual, miopía transitoria aguda y glaucoma agudo de ángulo cerrado. Los síntomas incluyen el inicio agudo de disminución de la agudeza visual o dolor ocular y típicamente ocurren dentro de horas a semanas después del inicio del fármaco. El glaucoma agudo de ángulo cerrado no tratado puede provocar una pérdida permanente de la visión. El tratamiento principal consiste en suspender la hidroclorotiazida lo más rápido posible. Es posible que se deban considerar tratamientos médicos o quirúrgicos inmediatos si la presión intraocular permanece incontrolada. Los factores de riesgo para desarrollar glaucoma agudo de ángulo cerrado pueden incluir antecedentes de alergia a la sulfonamida o la penicilina (véase la sección Efectos indeseables).
Embarazo:
Los antagonistas de los receptores de la angiotensina II no deben iniciarse durante el embarazo. A menos que se considere esencial continuar el tratamiento con antagonistas del receptor de la angiotensina II, las pacientes que estén planeando quedarse embarazadas deben cambiar a un tratamiento antihipertensivo alternativo que tenga un perfil de seguridad establecido para su uso durante el embarazo. Cuando se diagnostica un embarazo, se debe interrumpir inmediatamente el tratamiento con antagonistas de los receptores de la angiotensina II y, si procede, se debe iniciar un tratamiento alternativo (véase las secciones Contraindicaciones y Fertilidad, embarazo y lactancia).
Población pediátrica:
BENICAR TRIPLE® no está indicado en niños y adolescentes menores de 18 años.
Ancianos:
En pacientes de edad avanzada, el aumento de la dosis debe realizarse con precaución (véase la sección Propiedades farmacocinéticas).
Fotosensibilidad:
Se han notificado casos de reacciones de fotosensibilidad con diuréticos tiazídicos (véase la sección Efectos indeseables). Si se produce una reacción de fotosensibilidad durante el tratamiento con BENICAR TRIPLE®, se recomienda interrumpir el tratamiento. Si se considera necesario volver a administrar el diurético, se recomienda proteger las zonas expuestas al sol o a los rayos UVA artificiales.
Cáncer de piel no melanoma:
En dos estudios epidemiológicos basados en el Registro Nacional Danés de Cáncer, se ha observado un mayor riesgo de cáncer de piel no melanoma (CPNM) [carcinoma de células basales (CCB) y carcinoma de células escamosas (CCE)] con una dosis acumulativa creciente de exposición a hidroclorotiazida (HCT). Las acciones fotosensibilizantes de HCT podrían actuar como un posible mecanismo para CPNM.
Se debe informar a los pacientes que toman HCT sobre el riesgo de CPNM y se les debe aconsejar que revisen periódicamente su piel en busca de lesiones nuevas y que informen de inmediato sobre cualquier lesión cutánea sospechosa. Posibles medidas preventivas como la exposición limitada a la luz solar y los rayos ultravioleta y, en caso de exposición, se debe aconsejar a los pacientes una protección adecuada para minimizar el riesgo de cáncer de piel. Las lesiones cutáneas sospechosas deben examinarse con prontitud, lo que podría incluir exámenes histológicos de biopsias. También puede ser necesario reconsiderar el uso de HCT en pacientes que hayan experimentado un CPNM anterior (véase también la sección Efectos indeseables).
Toxicidad respiratoria aguda:
Se han notificado casos muy raros de toxicidad respiratoria aguda, incluido el síndrome de dificultad respiratoria aguda (SDRA), después de tomar hidroclorotiazida. El edema pulmonar generalmente se desarrolla en minutos u horas después de la ingesta de hidroclorotiazida. Al inicio, los síntomas incluyen disnea, fiebre, deterioro pulmonar e hipotensión. Si se sospecha un diagnóstico de ARDS, se debe retirar BENICAR TRIPLE® y administrar el tratamiento adecuado. La hidroclorotiazida no debe administrarse a pacientes que previamente experimentaron SDRA después de la ingesta de hidroclorotiazida.
Otro:
Al igual que con cualquier agente antihipertensivo, la reducción excesiva de la presión arterial en pacientes con cardiopatía isquémica o enfermedad cerebrovascular isquémica podría resultar en un infarto de miocardio o un accidente cerebrovascular.
Las reacciones de hipersensibilidad a la hidroclorotiazida pueden ocurrir en pacientes con o sin antecedentes de alergia o asma bronquial, pero son más probables en pacientes con tales antecedentes.
Se ha informado la exacerbación o activación del lupus eritematoso sistémico con el uso de diuréticos tiazídicos.
Al igual que con todos los demás antagonistas de los receptores de la angiotensina II, el efecto hipotensor de olmesartán es algo menor en pacientes negros que en pacientes de otra raza; sin embargo, este efecto no se observó en uno de los tres ensayos clínicos con BENICAR TRIPLE® que incluyeron pacientes negros (30%), véase también la sección Propiedades farmacodinámicas.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por tableta recubierta, es decir, prácticamente “exento de sodio”.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Fertilidad, embarazo y lactancia:
Embarazo:
El uso de BENICAR TRIPLE® está contraindicado durante el segundo y tercer trimestre del embarazo (véase las secciones Contraindicaciones y Advertencias y Precauciones especiales de uso). Dados los efectos de los componentes individuales de este producto combinado sobre el embarazo, no se recomienda el uso de BENICAR TRIPLE® durante el primer trimestre del embarazo (véase la sección Advertencias y Precauciones especiales de uso).
Olmesartán medoxomilo:
No se recomienda el uso de antagonistas de los receptores de la angiotensina II durante el primer trimestre del embarazo (véase la sección Advertencias y Precauciones especiales de uso). El uso de antagonistas de los receptores de la angiotensina II está contraindicado durante el segundo y tercer trimestre del embarazo (véase las secciones Contraindicaciones y Advertencias y Precauciones especiales de uso).
La evidencia epidemiológica con respecto al riesgo de teratogenicidad después de la exposición a inhibidores de la ECA durante el primer trimestre del embarazo no ha sido concluyente; sin embargo, no se puede excluir un pequeño aumento del riesgo. Si bien no existen datos epidemiológicos controlados sobre el riesgo con los antagonistas de los receptores de la angiotensina II, pueden existir riesgos similares para esta clase de fármacos. A menos que se considere esencial continuar el tratamiento con bloqueadores de los receptores de la angiotensina, las pacientes que estén planificando un embarazo deben cambiar a tratamientos antihipertensivos alternativos, que tengan un perfil de seguridad establecido para su uso durante el embarazo. Cuando se diagnostica un embarazo, se debe interrumpir inmediatamente el tratamiento con antagonistas de los receptores de la angiotensina II y, si procede, iniciar un tratamiento alternativo.
Se sabe que la exposición al tratamiento con antagonistas de los receptores de la angiotensina II durante el segundo y tercer trimestre induce fetotoxicidad humana (disminución de la función renal, oligohidramnios, retraso de la osificación del cráneo) y toxicidad neonatal (insuficiencia renal, hipotensión, hiperpotasemia) (véase también la sección Datos preclínicos de seguridad).
Si se ha producido una exposición a los antagonistas de los receptores de la angiotensina II a partir del segundo trimestre del embarazo, se recomienda una ecografía de la función renal y del cráneo.
Los lactantes cuyas madres hayan tomado antagonistas de los receptores de la angiotensina II deben ser vigilados de cerca para detectar hipotensión (véase también las secciones Contraindicaciones y Advertencias y Precauciones especiales de uso).
Hidroclorotiazida:
Existe una experiencia limitada con hidroclorotiazida durante el embarazo, especialmente durante el primer trimestre. Los estudios con animales son insuficientes.
La hidroclorotiazida atraviesa la placenta. Basado en el mecanismo de acción farmacológico de la hidroclorotiazida, su uso durante el segundo y tercer trimestre puede comprometer la perfusión fetoplacentaria y puede causar efectos fetales y neonatales como ictericia, alteración del equilibrio electrolítico y trombocitopenia.
La hidroclorotiazida no debe usarse para el edema gestacional, la hipertensión gestacional o la preeclampsia debido al riesgo de disminución del volumen plasmático e hipoperfusión placentaria, sin un efecto beneficioso sobre el curso de la enfermedad.
La hidroclorotiazida no debe usarse para la hipertensión esencial en mujeres embarazadas, excepto en situaciones raras en las que no se puede usar ningún otro tratamiento.
Amlodipino:
Los datos sobre un número limitado de embarazos expuestos no indican que el amlodipino u otros antagonistas de los receptores de calcio tengan un efecto nocivo sobre la salud del feto. Sin embargo, puede haber riesgo de parto prolongado.
Lactancia:
Durante la lactancia, no se recomienda BENICAR TRIPLE® y son preferibles tratamientos alternativos con perfiles de seguridad mejor establecidos durante la lactancia, especialmente durante la lactancia de un recién nacido o un lactante prematuro.
El olmesartán se excreta en la leche de ratas lactantes. Sin embargo, no se sabe si el olmesartán pasa a la leche humana.
Amlodipino se excreta en la leche materna. La proporción de la dosis materna recibida por el lactante se ha estimado con un rango intercuartílico del 3 al 7%, con un máximo del 15%. Se desconoce el efecto de amlodipino en los lactantes.
La hidroclorotiazida se excreta en la leche materna en pequeñas cantidades. Las tiazidas en dosis altas que causan diuresis intensa pueden inhibir la producción de leche.
No se recomienda el uso de BENICAR TRIPLE® durante la lactancia. Si se usa BENICAR TRIPLE® durante la lactancia, las dosis deben mantenerse las más bajas posible.
Fertilidad:
Se han notificado cambios bioquímicos reversibles en la cabeza de los espermatozoides en algunos pacientes tratados con bloqueadores de los canales de calcio.
Los datos clínicos son insuficientes con respecto al efecto potencial de amlodipino sobre la fertilidad. En un estudio en ratas, se encontraron efectos adversos sobre la fertilidad masculina (véase la sección Datos preclínicos de seguridad).
REACCIONES ADVERSAS:
Efectos indeseables:
La seguridad de BENICAR TRIPLE® ha sido investigada en ensayos clínicos en 7826 pacientes que recibieron olmesartán medoxomilo en combinación con amlodipino e hidroclorotiazida.
Las reacciones adversas de los ensayos clínicos, los estudios de seguridad posteriores a la autorización y las notificaciones espontáneas se resumen en la tabla 1 para BENICAR TRIPLE®, así como para los componentes individuales olmesartán medoxomilo, amlodipino e hidroclorotiazida, según el perfil de seguridad conocido de los componentes individuales.
Las reacciones adversas notificadas con más frecuencia durante el tratamiento con BENICAR TRIPLE® son edema periférico, dolor de cabeza y mareos.
Se han utilizado las siguientes terminologías para clasificar la aparición de efectos indeseables:
Muy común (≥1/10)
Común (≥1/100 a <1/10)
Poco común (≥1/1.000 a <1/100)
Raro (≥1/10.000 a <1/1.000)
Muy raro (<1/10.000)
Desconocido (no puede estimarse a partir de los datos disponibles)
Tabla 1: Resumen de reacciones adversas con BENICAR TRIPLE® y los componentes individuales
|
Clasificación por sistema de órganos del MedDRA |
Reacciones adversas |
Frecuencia |
|||
|---|---|---|---|---|---|
|
BENICAR TRIPLE® |
Olmesartán |
Amlodipino |
HCT |
||
|
Infecciones e infestaciones |
Infección del tracto respiratorio superior |
Común |
|||
|
Nasofaringitis |
Común |
||||
|
Infección del tracto urinario |
Común |
Común |
|||
|
Sialadenitis |
Raro |
||||
|
Neoplasias benignas, malignas y no especificadas (incluidos quistes y pólipos) |
Cáncer de piel no melanoma (carcinoma de células basales y carcinoma de células escamosas) |
Desconocido |
|||
|
Trastornos de la sangre y del sistema linfático |
Leucopenia |
Muy raro |
Raro |
||
|
Trombocitopenia |
Poco común |
Muy raro |
Raro |
||
|
Depresión de médula ósea |
Raro |
||||
|
Neutropenia/Agranulocitosis |
Raro |
||||
|
Anemia hemolítica |
Raro |
||||
|
Anemia aplásica |
Raro |
||||
|
Trastornos del sistema inmunológico |
Reacción anafiláctica |
Poco común |
|||
|
Hipersensibilidad al medicamento |
Muy raro |
||||
|
Trastornos del metabolismo y nutrición |
Hiperpotasemia |
Poco común |
Raro |
||
|
Hipopotasemia |
Poco común |
Común |
|||
|
Anorexia |
Poco común |
||||
|
Glucosuria |
Común |
||||
|
Hipercalcemia |
Común |
||||
|
Hiperglucemia |
Muy raro |
Común |
|||
|
Hipomagnesemia |
Común |
||||
|
Hiponatremia |
Común |
||||
|
Hipocloremia |
Común |
||||
|
Hipertrigliceridemia |
Común |
Muy común |
|||
|
Hipercolesterolemia |
Muy común |
||||
|
Hiperuricemia |
Común |
Muy común |
|||
|
Alcalosis hipoclorémica |
Muy raro |
||||
|
Hipermilasemia |
Común |
||||
|
Trastornos psiquiátricos |
Estado de confusión |
Raro |
Común |
||
|
Depresión |
Poco común |
Raro |
|||
|
Apatía |
Raro |
||||
|
Irritabilidad |
Poco común |
||||
|
Inquietud |
Raro |
||||
|
Cambios de humor (incluida la ansiedad) |
Poco común |
||||
|
Trastornos del sueño (incluido el insomnio) |
Poco común |
Raro |
|||
|
Trastornos del sistema nervioso |
Mareo |
Común |
Común |
Común |
Común |
|
Dolor de cabeza |
Común |
Común |
Común |
Raro |
|
|
Mareos posturales |
Poco común |
||||
|
Presíncope |
Poco común |
||||
|
Disgeusia |
Poco común |
||||
|
Hipertonía |
Muy raro |
||||
|
Hipoestesia |
Poco común |
||||
|
Parestesia |
Poco común |
Raro |
|||
|
Neuropatía periférica |
Muy raro |
||||
|
Somnolencia |
Común |
||||
|
Síncope |
Poco común |
||||
|
Convulsiones |
Raro |
||||
|
Pérdida de apetito |
Poco común |
||||
|
Temblor |
Poco común |
||||
|
Trastorno extrapiramidal |
Desconocido |
||||
|
Trastornos del ojo |
Alteración visual (incluida diplopía, visión borrosa) |
Común |
Raro |
||
|
Disminución del lagrimeo |
Raro |
||||
|
Empeoramiento de la miopía |
Poco común |
||||
|
Xantopsia |
Raro |
||||
|
Miopía aguda, glaucoma agudo de ángulo cerrado (véase la sección Advertencias y Precauciones especiales de uso) |
Desconocido |
||||
|
Derrame coroideo |
Desconocido |
||||
|
Trastornos del oído y del laberinto |
Vértigo |
Poco común |
Poco común |
Raro |
|
|
Tinnitus |
Poco común |
||||
|
Trastornos cardiacos |
Palpitaciones |
Común |
Común |
||
|
Taquicardia |
Poco común |
||||
|
Infarto de miocardio |
Muy raro |
||||
|
Arritmia (incluida bradicardia, taquicardia ventricular y fibrilación auricular) |
Poco común |
Raro |
|||
|
Angina de pecho |
Poco común |
Poco común (incluida la agravación de angina de pecho) |
|||
|
Trastornos vasculares |
Hipotensión |
Común |
Raro |
Poco común |
|
|
Enrojecimiento |
Poco común |
Común |
|||
|
Hipotensión ortostática |
Poco común |
||||
|
Vasculitis (incluida angiitis necrotizante) |
Muy raro |
Raro |
|||
|
Trombosis |
Raro |
||||
|
Embolia |
Raro |
||||
|
Trastornos respiratorios, torácicos y mediastinales |
Tos |
Poco común |
Común |
Poco común |
|
|
Bronquitis |
Común |
||||
|
Disnea |
Común |
Raro |
|||
|
Faringitis |
Común |
||||
|
Rinitis |
Común |
Poco común |
|||
|
Neumonía intersticial aguda |
Raro |
||||
|
Dificultad respiratoria |
Poco común |
||||
|
Edema pulmonar |
Raro |
||||
|
Síndrome de dificultad respiratoria aguda (SDRA) (ver sección Advertencias y Precauciones especiales de uso.) |
Muy raro |
||||
|
Trastornos gastrointestinales |
Diarrea |
Común |
Común |
Común |
|
|
Náusea |
Común |
Común |
Común |
Común |
|
|
Estreñimiento |
Común |
Común |
|||
|
Boca seca |
Poco común |
Poco común |
|||
|
Dolor abdominal |
Común |
Común |
Común |
||
|
Hábitos intestinales alterados (incluida diarrea y estreñimiento) |
Común |
||||
|
Meteorismo |
Común |
||||
|
Dispepsia |
Común |
Común |
|||
|
Gastritis |
Muy raro |
||||
|
Irritación gástrica |
Común |
||||
|
Gastroenteritis |
Común |
||||
|
Hiperplasia gingival |
Muy raro |
||||
|
Íleo paralítico |
Muy raro |
||||
|
Pancreatitis |
Muy raro |
Raro |
|||
|
Vómitos |
Poco común |
Poco común |
Común |
||
|
Enteropatía tipo Sprue (véase la sección Advertencias y Precauciones especiales de uso) |
Muy raro |
||||
|
Trastornos hepatobiliares |
Hepatitis |
Muy raro |
|||
|
Ictericia (ictericia colestática intrahepática) |
Muy raro |
Raro |
|||
|
Colecistitis aguda |
Raro |
||||
|
Hepatitis autoinmune * |
No conocida |
||||
|
Trastornos de la piel y de los tejidos subcutáneos |
Alopecia |
Poco común |
|||
|
Angioedema |
Raro |
Muy raro |
|||
|
Dermatitis alérgica |
Poco común |
||||
|
Eritema multiforme |
Muy raro |
||||
|
Eritema |
Poco común |
||||
|
Reacciones tipo lupus eritematoso cutáneo |
Raro |
||||
|
Exantema |
Poco común |
Poco común |
|||
|
Dermatitis exfoliativa |
Muy raro |
||||
|
Hiperhidrosis |
Poco común |
||||
|
Reacciones de fotosensibilidad |
Muy raro |
Poco común |
|||
|
Prurito |
Poco común |
Poco común |
Poco común |
||
|
Síndrome purpúrico |
Poco común |
Poco común |
|||
|
Edema de Quincke |
Muy raro |
||||
|
Erupción |
Poco común |
Poco común |
Poco común |
||
|
Reactivación de lupus eritematoso cutáneo |
Raro |
||||
|
Necrólisis epidérmica tóxica |
Desconocido |
Raro |
|||
|
Decoloración de la piel |
Poco común |
||||
|
Síndrome de Stevens- Johnson |
Muy raro |
||||
|
Urticaria |
Poco común |
Poco común |
Poco común |
||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Espasmo muscular |
Común |
Raro |
Común |
|
|
Inflamación de articulaciones |
Común |
||||
|
Debilidad muscular |
Poco común |
Raro |
|||
|
Hinchazón de tobillos |
Común |
||||
|
Artralgia |
Poco común |
||||
|
Artritis |
Común |
||||
|
Dolor de espalda |
Común |
Poco común |
|||
|
Paresia |
Raro |
||||
|
Mialgia |
Poco común |
Poco común |
|||
|
Dolor esquelético |
Común |
||||
|
Trastornos renales y urinarios |
Polaquiuria |
Común |
|||
|
Aumento de la frecuencia urinaria |
Poco común |
||||
|
Insuficiencia renal aguda |
Raro |
||||
|
Hematuria |
Común |
||||
|
Trastorno de la micción |
Poco común |
||||
|
Nocturia |
Poco común |
||||
|
Nefritis intersticial |
Raro |
||||
|
Insuficiencia renal |
Raro |
Raro |
|||
|
Trastornos del sistema reproductor y de la mama |
Disfunción eréctil |
Poco común |
Poco común |
Poco común |
|
|
Ginecomastia |
Poco común |
||||
|
Trastornos generales y condiciones del sitio de administración |
Astenia |
Común |
Poco común |
Común |
|
|
Edema periférico |
Común |
Común |
|||
|
Fatiga |
Común |
Común |
Común |
||
|
Dolor de pecho |
Común |
Poco común |
|||
|
Fiebre |
Raro |
||||
|
Síntomas similares a los de la influenza |
Común |
||||
|
Letargo |
Raro |
||||
|
Malestar |
Poco común |
Poco común |
|||
|
Edema |
Muy común |
||||
|
Dolor |
Común |
Poco común |
|||
|
Edema facial |
Poco común |
||||
|
Investigaciones |
Aumento de creatinina en la sangre |
Común |
Raro |
Común |
|
|
Aumento de urea en la sangre |
Común |
Común |
Común |
||
|
Aumento de ácido úrico en la sangre |
Común |
||||
|
Disminución de Potasio en la sangre |
Poco común |
||||
|
Aumento de gamma glutamil transferasa |
Poco común |
||||
|
Aumento de alanina aminotransferasa |
Poco común |
||||
|
Aumento de aspartato aminotransferasa |
Poco común |
||||
|
Aumento de enzimas hepáticas |
Común |
Muy raro (sobre todo consistente con colestasis) |
|||
|
Aumento de creatina fosfoquinasa en la sangre |
Común |
||||
|
Disminución de peso |
Poco común |
||||
|
Aumento de peso |
Poco común |
||||
* Se han notificado casos de hepatitis autoinmune con una latencia de pocos meses a años después de la comercialización, que fueron reversibles tras la retirada de olmesartán.
Se han notificado casos únicos de rabdomiólisis en asociación temporal con la ingesta de bloqueadores del receptor de la angiotensina II. Se han notificado casos únicos de síndrome extrapiramidal en pacientes tratados con amlodipino.
Cáncer de piel no melanoma: basado en los datos disponibles de estudios epidemiológicos, se ha observado una asociación acumulativa dependiente de la dosis entre HCT y CPNM (véase también las secciones Advertencias y Precauciones especiales de uso y Propiedades farmacodinámicas).
Otras reacciones adversas notificadas en ensayos clínicos o en la experiencia posterior a la comercialización con una combinación de dosis fija de olmesartán medoxomilo y amlodipino y todavía no notificadas para BENICAR TRIPLE®, olmesartán medoxomilo en monoterapia o amlodipino en monoterapia o notificadas con mayor frecuencia para la combinación doble (Tabla 2):
Tabla 2: Combinación de olmesartán medoxomilo y amlodipino
|
Clasificación por órganos y sistemas |
Frecuencia |
Reacciones adversas |
|
Trastornos del sistema inmunológico |
Raro |
Hipersensibilidad al medicamento |
|
Trastornos gastrointestinales |
Poco común |
Dolor abdominal superior |
|
Trastornos del sistema reproductor y de la mama |
Poco común |
Libido disminuida |
|
Trastornos generales y condiciones del sitio de administración |
Común |
Edema de fóvea |
|
Poco común |
Letargo |
|
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco común |
Dolor en las extremidades |
Otras reacciones adversas notificadas en ensayos clínicos o en la experiencia posterior a la comercialización con una combinación de dosis fija de olmesartán medoxomilo e hidroclorotiazida y todavía no notificadas para BENICAR TRIPLE®, olmesartán medoxomilo en monoterapia o hidroclorotiazida en monoterapia o notificadas con mayor frecuencia para la combinación doble (Tabla 3):
Tabla 3: Combinación de olmesartán medoxomilo e hidroclorotiazida
|
Clasificación por órganos y sistemas |
Frecuencia |
Reacciones adversas |
|---|---|---|
|
Trastornos del sistema nervioso |
Raro |
Alteraciones de la conciencia (como pérdida de la conciencia) |
|
Trastornos de la piel y del tejido subcutáneo |
Poco común |
Eczema |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco común |
Dolor en las extremidades |
|
Investigaciones |
Raro |
Disminuciones menores de la hemoglobina media y de los valores de hematocrito |
Notificación de reacciones adversas sospechosas:
Es importante notificar las reacciones adversas sospechosas después de la autorización del medicamento. Eso permite un seguimiento continuo de la relación beneficio/riesgo del medicamento. Se solicita a los profesionales de salud que notifiquen cualesquier reacciones adversas sospechosas.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCCIÓN Y EL USO DE MAQUINARIA:
Efectos sobre la capacidad para conducir y utilizar máquinas:
No se han realizado estudios acerca de los efectos sobre la capacidad para conducir y utilizar máquinas.
Sin embargo, debe tenerse en cuenta que ocasionalmente pueden ocurrir mareos, dolor de cabeza, náuseas o fatiga en pacientes que toman terapia antihipertensiva y que estos síntomas pueden afectar la capacidad de reaccionar. Se recomienda precaución especialmente al inicio del tratamiento.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacción con otros medicamentos y otras formas de interacción:
Posibles interacciones relacionadas con la combinación de BENICAR TRIPLE:
No se recomienda el uso concomitante:
Litio:
Se han notificado aumentos reversibles de las concentraciones séricas de litio y toxicidad durante la administración concomitante de litio con inhibidores de la enzima convertidora de angiotensina y, en raras ocasiones, con antagonistas de los receptores de la angiotensina II. Además, las tiazidas reducen el aclaramiento renal de litio y, en consecuencia, el riesgo de toxicidad por litio puede aumentar. Por lo tanto, no se recomienda el uso de BENICAR TRIPLE® y litio en combinación (véase la sección Advertencias y Precauciones especiales de uso). Si el uso de la combinación resulta necesario, se recomienda un monitoreo cuidadoso de los niveles séricos de litio.
Uso concomitante que requiere precaución:
Baclofeno:
Puede producirse una potenciación del efecto antihipertensivo.
Medicamentos antiinflamatorios no esteroideos:
Los AINEs (es decir, ácido acetilsalicílico (> 3 g/día), inhibidores de la COX-2 y AINEs no selectivos) pueden reducir el efecto antihipertensivo de los diuréticos tiazídicos y los antagonistas de los receptores de la angiotensina II.
En algunos pacientes con función renal comprometida (p. ej., pacientes deshidratados o ancianos con función renal comprometida), la coadministración de antagonistas del receptor de angiotensina II y agentes que inhiben la ciclooxigenasa puede provocar un mayor deterioro de la función renal, incluida una posible insuficiencia renal aguda, que generalmente es reversible. Por lo tanto, la combinación debe administrarse con precaución, especialmente en pacientes ancianos. Los pacientes deben estar adecuadamente hidratados y se debe considerar el monitoreo de la función renal después del inicio de la terapia concomitante y periódicamente a partir de entonces.
Se debe tener en cuenta el uso concomitante:
Amifostina:
Puede producirse una potenciación del efecto antihipertensivo.
Otros agentes antihipertensivos:
El efecto hipotensor de BENICAR TRIPLE® puede aumentar con el uso concomitante de otros medicamentos antihipertensivos.
Alcohol, barbitúricos, narcóticos o antidepresivos:
Puede producirse una potenciación de la hipotensión ortostática.
Posibles interacciones relacionadas con olmesartán medoxomilo:
No se recomienda el uso concomitante:
Inhibidores de la ECA, bloqueadores de los receptores de la angiotensina II o aliskiren:
Los datos de ensayos clínicos han demostrado que el bloqueo doble del sistema renina-angiotensina-aldosterona (SRAA) mediante el uso combinado de inhibidores de la ECA, bloqueadores de los receptores de la angiotensina II o aliskiren se asocia con una mayor frecuencia de reacciones adversas como hipotensión, hiperpotasemia y disminución de la función renal (incluida la insuficiencia renal aguda) en comparación con el uso de un único agente que actúa como SRAA (véase las secciones Contraindicaciones, Advertencias y Precauciones especiales de uso y Propiedades farmacodinámicas).
Medicamentos que afectan los niveles de potasio:
El uso concomitante de diuréticos ahorradores de potasio, suplementos de potasio, sustitutos de la sal que contengan potasio u otros medicamentos que puedan aumentar los niveles séricos de potasio (p. ej., heparina, inhibidores de la ECA) puede producir aumentos del potasio sérico (véase la sección Advertencias y Precauciones especiales de uso). Si se van a prescribir medicamentos que afectan al potasio en combinación con BENICAR TRIPLE®, se recomienda el monitoreo del potasio sérico.
Información Adicional:
Agente secuestrante de ácidos biliares colesevelam:
La administración simultánea del agente secuestrante de ácidos biliares colesevelam hidrocloruro reduce la exposición sistémica y la concentración plasmática máxima de olmesartán y reduce t1/2. La administración de olmesartán medoxomilo al menos 4 horas antes del colesevelam hidrocloruro disminuyó el efecto de interacción farmacológica.
Se debe considerar la administración de olmesartán medoxomilo al menos 4 horas antes de la dosis de colesevelam hidrocloruro (véase la sección Propiedades farmacocinéticas).
Después del tratamiento con antiácido (hidróxido de aluminio y magnesio), se observó una pequeña reducción en la biodisponibilidad de olmesartán.
Olmesartán medoxomilo no tuvo un efecto significativo sobre la farmacocinética o farmacodinamia de warfarina o la farmacocinética de digoxina.
La coadministración de olmesartán medoxomilo con pravastatina no tuvo efectos clínicamente relevantes sobre la farmacocinética de ninguno de los componentes en participantes de la investigación sanos.
Olmesartán no tuvo efectos inhibidores clínicamente relevantes sobre las enzimas 1A1/2, 2A6, 2C8/9, 2C19, 2D6, 2E1 y 3A4 del citocromo P450 humano in vitro, y presentó efectos inductores mínimos o nulos sobre las actividades del citocromo P450 en ratas. No se esperan interacciones clínicamente relevantes entre olmesartán y medicamentos metabolizados por las enzimas del citocromo P450 anteriores.
Posibles interacciones relacionadas con amlodipino:
Uso concomitante que requiere precaución:
Efectos de otros medicamentos sobre amlodipino:
Inhibidores de CYP3A4:
El uso concomitante de amlodipino con inhibidores potentes o moderados del CYP3A4 (inhibidores de la proteasa, antifúngicos azoles, macrólidos como eritromicina o claritromicina, verapamilo o diltiazem) puede dar lugar a un aumento significativo en la exposición de amlodipino. La traducción clínica de estas variaciones farmacocinéticas puede ser más pronunciada en los ancianos. Existe un mayor riesgo de hipotensión. Se recomienda una estrecha observación de los pacientes y, por lo tanto, puede ser necesario un ajuste de la dosis.
Inductores de CYP3A4:
Tras la coadministración de inductores conocidos del CYP3A4, la concentración plasmática de amlodipino puede variar. Por lo tanto, se debe controlar la presión arterial y considerar la regulación de la dosis durante y después de la medicación concomitante, en particular con inductores potentes del CYP3A4 (p. ej., rifampicina, hypericum perforatum).
No se recomienda la administración de amlodipino con toronja o jugo de toronja ya que la biodisponibilidad puede aumentar en algunos pacientes, dando lugar a un aumento de los efectos reductores de la presión arterial.
Dantroleno (infusión): en animales, se han observado fibrilación ventricular letal y colapso cardiovascular en asociación con hiperpotasemia después de la administración de verapamilo y dantroleno intravenoso. Debido al riesgo de hiperpotasemia, se recomienda evitar la coadministración de los bloqueadores de los canales de calcio como amlodipino en pacientes susceptibles a hipertermia maligna y en el tratamiento de la hipertermia maligna.
Efectos de amlodipino sobre otros medicamentos:
El efecto reductor de la presión arterial de amlodipino se suma a los efectos reductores de la presión arterial de otros agentes antihipertensivos.
En los estudios de interacción clínica, amlodipino no afectó la farmacocinética de atorvastatina, digoxina o warfarina.
Simvastatina: la coadministración de múltiples dosis de 10 mg de amlodipino con 80 mg de simvastatina resultó en un aumento del 77% en la exposición a simvastatina en comparación con simvastatina sola. Limite la dosis de simvastatina en pacientes con amlodipino a 20 mg al día.
Tacrolimus: existe el riesgo de un aumento de los niveles sanguíneos de tacrolimus cuando se le coadministra con amlodipino. Para evitar la toxicidad de tacrolimus, la administración de amlodipino a un paciente tratado con tacrolimus requiere monitorear los niveles de tacrolimus en sangre y ajustar la dosis de tacrolimus cuando sea apropiado.
Inhibidores de la diana mecánica de la rapamicina (mTOR): los inhibidores de mTOR como sirolimus, temsirolimus y everolimus son sustratos de CYP3A. Amlodipino es un inhibidor débil de CYP3A. Con el uso concomitante de inhibidores de mTOR, la amlodipina puede aumentar la exposición a los inhibidores de mTOR.Ciclosporina: en un estudio prospectivo en pacientes con trasplante renal, se observó un aumento promedio del 40% en los niveles mínimos de ciclosporina cuando se usó concomitantemente con amlodipino. La coadministración de BENICAR TRIPLE® con ciclosporina puede aumentar la exposición a ciclosporina. Controle los niveles mínimos de ciclosporina durante el uso concomitante, y se deben realizar reducciones de dosis de ciclosporina según sea necesario.
Interacciones potenciales relacionadas con la hidroclorotiazida:
No se recomienda el uso concomitante:
Medicamentos que afectan los niveles de potasio:
El efecto de depleción de potasio de la hidroclorotiazida (véase la sección Advertencias y Precauciones especiales de uso) puede verse potenciado por la coadministración de otros medicamentos asociados con la pérdida de potasio y la hipopotasemia (p. ej., otros diuréticos kaliuréticos, laxantes, corticosteroides, ACTH, anfotericina, carbenoxolona, penicilina G sódica o derivados del ácido salicílico). Por lo tanto, no se recomienda este uso concomitante.
Uso concomitante que requiere precaución:
Sales de calcio:
Los diuréticos tiazídicos pueden aumentar el calcio sérico debido a una menor excreción. Si se deben prescribir suplementos de calcio, se debe monitorear el calcio sérico y ajustar la dosis de calcio en consecuencia.
Resinas de colestiramina y colestipol:
La absorción de hidroclorotiazida se perjudica en la presencia de resinas de intercambio aniónico.
Glucósidos digitálicos:
La hipopotasemia o hipomagnesemia inducida por tiazidas puede favorecer la aparición de arritmias cardíacas inducidas por digitálicos.
Medicamentos afectados por alteraciones del potasio sérico:
Se recomienda el monitoreo periódico del potasio sérico y del ECG cuando BENICAR TRIPLE® se administra con medicamentos afectados por alteraciones del potasio sérico (p. ej., glucósidos digitálicos y antiarrítmicos) y con los siguientes medicamentos inductores de torsades de pointes (taquicardia ventricular) (incluidos algunos antiarrítmicos), siendo hipopotasemia un factor predisponente a torsades de pointes (taquicardia ventricular):
- Antiarrítmicos de clase Ia (p. ej., quinidina, hidroquinidina, disopiramida).
- Antiarrítmicos de clase III (p. ej., amiodarona, sotalol, dofetilida, ibutilida).
- Algunos antipsicóticos (p. ej., tioridazina, clorpromazina, levomepromazina, trifluoperazina, ciamemazina, sulpirida, sultoprida, amisulprida, tiaprida, pimozida, haloperidol, droperidol).
- Otros (p. ej., bepridil, cisaprida, difemanilo, eritromicina IV, halofantrina, mizolastina, pentamidina, esparfloxacina, terfenadina, vincamina IV).
Relajantes del músculo esquelético no despolarizantes (p. ej., tubocurarina):
La hidroclorotiazida puede potenciar el efecto de los relajantes del músculo esquelético no despolarizantes.
Agentes anticolinérgicos (p. ej., atropina, biperideno):
Aumento de la biodisponibilidad de los diuréticos de tipo tiazídico al disminuir la motilidad gastrointestinal y la tasa de vaciado del estómago.
Medicamentos antidiabéticos (agentes orales e insulina):
El tratamiento con una tiazida puede influir en la tolerancia a la glucosa. Puede ser necesario un ajuste de la dosis del medicamento antidiabético (véase la sección Advertencias y Precauciones especiales de uso).
Metformina:
La metformina debe usarse con precaución debido al riesgo de acidosis láctica inducida por una posible insuficiencia renal funcional ligada a la hidroclorotiazida.
Betabloqueadores y diazóxido:
Las tiazidas pueden potenciar el efecto hiperglucémico de los betabloqueadores y el diazóxido.
Aminas presoras (p. ej., noradrenalina):
El efecto de las aminas presoras puede disminuir.
Medicamentos utilizados en el tratamiento de la gota (p. ej., probenecid, sulfinpirazona y alopurinol):
Puede ser necesario un ajuste de la dosis de los medicamentos uricosúricos, ya que la hidroclorotiazida puede elevar el nivel de ácido úrico en suero. Puede ser necesario aumentar la dosis de probenecid o sulfinpirazona. La coadministración de una tiazida puede aumentar la incidencia de reacciones de hipersensibilidad al alopurinol.
Amantadina:
Las tiazidas pueden aumentar el riesgo de efectos adversos causados por la amantadina.
Agentes citotóxicos (p. ej., ciclofosfamida, metotrexato):
Las tiazidas pueden reducir la excreción renal de medicamentos citotóxicos y potenciar sus efectos mielosupresores.
Salicilatos:
En caso de altas dosis de salicilatos, la hidroclorotiazida puede potenciar el efecto tóxico de los salicilatos sobre el sistema nervioso central.
Metildopa:
Se han notificado casos aislados de anemia hemolítica con el uso concomitante de hidroclorotiazida y metildopa.
Ciclosporina:
El tratamiento concomitante con ciclosporina puede aumentar el riesgo de hiperuricemia y complicaciones de tipo gota.
Tetraciclinas:
La administración concomitante de tetraciclinas y tiazidas aumenta el riesgo de aumento de urea inducido por tetraciclina. Esta interacción probablemente no sea aplicable a la doxiciclina.
HALLAZGOS DE LABORATORIO CLÍNICO:
Datos preclínicos de seguridad:
Combinación de Olmesartán medoxomilo/ Amlodipino/ Hidroclorotiazida:
El estudio de toxicidad a dosis repetidas en ratas demostró que la administración combinada de olmesartán medoxomilo, amlodipino e hidroclorotiazida no aumentó ninguna de las toxicidades previamente notificadas y existentes de los agentes individuales, ni indujo ninguna toxicidad nueva, y no se observaron efectos toxicológicamente sinérgicos.
No se han realizado estudios adicionales de mutagenicidad, carcinogenicidad y toxicidad reproductiva para BENICAR TRIPLE® basados en el perfil de seguridad bien conocido de los ingredientes activos individuales.
Olmesartán medoxomilo:
En estudios de toxicidad crónica en ratas y perros, olmesartán medoxomilo mostró efectos similares a otros antagonistas del receptor AT1 e inhibidores de la ECA: aumento de urea en sangre (BUN) y creatinina; reducción del peso del corazón; reducción de los parámetros de los glóbulos rojos (eritrocitos, hemoglobina, hematocrito); indicaciones histológicas de daño renal (lesiones regenerativas del epitelio renal, engrosamiento de la membrana basal, dilatación de los túbulos). Estos efectos adversos causados por la acción farmacológica de olmesartán medoxomilo también se han producido en ensayos preclínicos sobre otros antagonistas del receptor AT1 e inhibidores de la ECA y pueden reducirse mediante la administración oral simultánea de cloruro de sodio.
Al igual que otros antagonistas del receptor AT1, se encontró que olmesartán medoxomilo aumenta la incidencia de roturas cromosómicas en cultivos celulares in vitro, pero no in vivo. Los datos generales de un programa completo de pruebas de genotoxicidad sugieren que es muy poco probable que el olmesartán ejerza efectos genotóxicos en las condiciones de uso clínico.
Olmesartán medoxomilo no fue carcinogénico en ratas ni ratones transgénicos.
En estudios de reproducción en ratas, olmesartán medoxomilo no afectó la fertilidad y no hubo evidencia de efecto teratogénico. Al igual que otros antagonistas de la angiotensina II, la supervivencia de la progenie se redujo y se observó dilatación pélvica del riñón después de la exposición de las madres al final del embarazo y la lactancia. No hubo indicios de efecto fetotóxico en conejos.
Amlodipino:
Toxicología reproductiva:
Los estudios de reproducción en ratas y ratones han mostrado retraso en la fecha de parto, duración prolongada del trabajo de parto y disminución de la supervivencia de la cría en dosis aproximadamente 50 veces mayores que la dosis máxima recomendada para humanos basada en mg/kg.
Deterioro de la fertilidad:
No hubo ningún efecto sobre la fertilidad de las ratas tratadas con amlodipino (machos durante 64 días y hembras 14 días antes del apareamiento) a dosis de hasta 10 mg/kg/día (8 veces* la dosis máxima recomendada en humanos de 10 mg sobre una base mg/m2). En otro estudio en ratas en el que se trató a ratas macho con besilato de amlodipino durante 30 días a una dosis comparable a la dosis humana basada en mg/kg, se encontró una disminución de la hormona estimulante del folículo plasmático y de la testosterona, así como una disminución en la densidad de espermatozoides y en el número de espermátidas maduras y células de Sertoli.
Carcinogénesis, mutagénesis
Las ratas y ratones tratados con amlodipino en la dieta durante dos años, en concentraciones calculadas para proporcionar niveles de dosis diaria de 0,5, 1,25 y 2,5 mg/kg/día, no mostraron evidencia de carcinogenicidad. La dosis más alta (para ratones, similar, y para ratas, el doble* de la dosis clínica máxima recomendada de 10 mg sobre una base de mg/m2) estuvo cerca de la dosis máxima tolerada para ratones, pero no para ratas.
Los estudios de mutagenicidad no revelaron efectos relacionados con el fármaco ni a nivel genético ni cromosómico.
*Basado en un peso de paciente de 50 kg
Hidroclorotiazida:
Los estudios con hidroclorotiazida han mostrado evidencia equívoca de un efecto genotóxico o carcinogénico en algunos modelos experimentales. Sin embargo, la amplia experiencia humana con hidroclorotiazida no ha demostrado una asociación entre su uso y un aumento de neoplasmas.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Posología y modo de administración:
Posología:
Adultos:
La dosis recomendada de BENICAR TRIPLE® es de 1 tableta al día.
Terapia complementaria:
BENICAR TRIPLE® 20 mg/12,5 mg/5 mg puede administrarse en pacientes cuya presión arterial no se controle adecuadamente con olmesartán medoxomilo 20 mg y amlodipino 5 mg tomados como combinación de dos componentes.
BENICAR TRIPLE® 40 mg/12,5 mg/5 mg puede administrarse en pacientes cuya presión arterial no se controle adecuadamente con olmesartán medoxomilo 40 mg y amlodipino 5 mg tomados como combinación de dos componentes o en pacientes cuya presión arterial no se controle adecuadamente con BENICAR TRIPLE® 20 mg/12,5 mg/5 mg.
BENICAR TRIPLE® 40 mg/25 mg/10 mg puede administrarse en pacientes cuya presión arterial no se controla adecuadamente con BENICAR TRIPLE® 20 mg/12,5 mg/5 mg o BENICAR TRIPLE® 40 mg/12,5 mg/5 mg.
Se recomienda una titulación gradual de la dosis de los componentes individuales antes de cambiar a la combinación de tres componentes. Cuando sea clínicamente apropiado, se puede considerar el cambio directo de la combinación de dos componentes a la combinación de tres componentes.
Terapia de sustitución:
Los pacientes controlados con dosis estables de olmesartán medoxomilo, amlodipino e hidroclorotiazida tomadas al mismo tiempo que una formulación de dos componentes (olmesartán medoxomilo y amlodipino u olmesartán
medoxomilo e hidroclorotiazida) y una formulación de un solo componente (hidroclorotiazida o amlodipino) pueden cambiar a BENICAR TRIPLE® que contenga las mismas dosis de componentes.
La dosis máxima recomendada de BENICAR TRIPLE® 40 mg/25 mg/10 mg al día.
Ancianos (65 años o más):
Se recomienda precaución, incluido un monitoreo más frecuente de la presión arterial, en personas de edad avanzada, especialmente con la dosis máxima de BENICAR TRIPLE® 40 mg/25 mg/10 mg al día.
Un aumento de la dosis debe realizarse con precaución en personas de edad avanzada (véase las secciones Advertencias y Precauciones especiales de uso y Propiedades farmacocinéticas).
Se dispone de datos muy limitados sobre el uso de BENICAR TRIPLE® en pacientes de 75 años o más. Se recomienda extrema precaución, incluido un control más frecuente de la presión arterial.
Insuficiencia renal:
La dosis máxima en pacientes con insuficiencia renal leve a moderada (aclaramiento de creatinina de 30-60 mL/min) es BENICAR TRIPLE® 20 mg/12,5 mg/5 mg, debido a la experiencia limitada de la dosis de 40 mg de olmesartán medoxomilo en este grupo de pacientes.
Se recomienda el monitoreo de las concentraciones séricas de potasio y creatinina en pacientes con insuficiencia renal moderada.
El uso de BENICAR TRIPLE® en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 mL/min) está contraindicado (véase las secciones Contraindicaciones, Advertencias y Precauciones especiales de uso y Propiedades farmacocinéticas).
Insuficiencia hepática:
BENICAR TRIPLE® debe utilizarse con precaución en pacientes con insuficiencia hepática leve (véase las secciones Advertencias y Precauciones especiales de uso y Propiedades farmacocinéticas).
En pacientes con insuficiencia hepática moderada, la dosis máxima no debe exceder BENICAR TRIPLE® 20 mg/12,5 mg/5 mg una vez al día. Se recomienda un estrecho monitoreo de la presión arterial y la función renal en pacientes con insuficiencia hepática.
Al igual que con todos los antagonistas del calcio, la vida media de amlodipino se prolonga en pacientes con insuficiencia hepática y no se han establecido recomendaciones posológicas. Por lo tanto, BENICAR TRIPLE® debe administrarse con precaución en estos pacientes. No se ha estudiado la farmacocinética de amlodipino en insuficiencia hepática grave. Amlodipino debe iniciarse a la dosis más baja y titularse lentamente en pacientes con insuficiencia hepática.
El uso de BENICAR TRIPLE® está contraindicado en pacientes con insuficiencia hepática grave (véase las secciones Contraindicaciones y Propiedades farmacocinéticas), colestasis u obstrucción biliar (véase la sección Contraindicaciones).
Población pediátrica:
No se recomienda el uso de BENICAR TRIPLE® en pacientes menores de 18 años debido a la falta de datos sobre seguridad y eficacia.
Modo de administración:
La tableta debe tragarse con una cantidad suficiente de líquido (por ejemplo, un vaso de agua). La tableta no debe masticarse y debe tomarse a la misma hora todos los días.
BENICAR TRIPLE® puede tomarse con o sin alimentos.
PROPIEDADES FARMACÉUTICAS:
Propiedades farmacológicas:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: antagonistas de la angiotensina II, bloqueadores de los canales de calcio y diuréticos. Código ATC: C09DX03.
BENICAR TRIPLE® es una combinación de un antagonista del receptor de la angiotensina II, olmesartán medoxomilo, un bloqueador de los canales de calcio, besilato de amlodipino y un diurético tiazídico, hidroclorotiazida. La combinación de estos ingredientes tiene un efecto antihipertensivo aditivo, reduciendo la presión arterial en mayor grado que cada componente solo.
Olmesartán medoxomilo es un antagonista selectivo del receptor de la angiotensina II (tipo AT1), activo por vía oral. La angiotensina II es la principal hormona vasoactiva del sistema renina-angiotensina-aldosterona y tiene un papel importante en la fisiopatología de la hipertensión. Los efectos de la angiotensina II incluyen vasoconstricción, estimulación de la síntesis y liberación de aldosterona, estimulación cardíaca y reabsorción renal de sodio. Olmesartán bloquea los efectos secretores de aldosterona y vasoconstrictores de la angiotensina II al bloquear su unión al receptor AT1 en tejidos que incluyen el músculo liso vascular y la glándula suprarrenal. La acción de olmesartán es independiente de la fuente o vía de síntesis de la angiotensina II. El antagonismo selectivo de los receptores de angiotensina II (AT1) por olmesartán resulta en aumentos en los niveles de renina plasmática y concentraciones de angiotensina I y II, y cierta disminución de las concentraciones plasmáticas de aldosterona.
En la hipertensión, olmesartán medoxomilo produce una reducción prolongada y dependiente de la dosis de la presión arterial. No ha habido indicios de hipotensión con la primera dosis, de taquifilaxia durante el tratamiento a largo plazo o de hipertensión de rebote después de una interrupción brusca del tratamiento.
La dosificación de olmesartán medoxomilo una vez al día proporciona una reducción eficaz y suave de la presión arterial durante el intervalo de dosis de 24 horas. La dosificación una vez al día produjo disminuciones similares en la presión arterial que la dosificación dos veces al día con la misma dosis diaria total.
Con el tratamiento continuo, las reducciones máximas de la presión arterial se alcanzan a las 8 semanas después del inicio de la terapia, aunque ya se observa una proporción sustancial del efecto reductor de la presión arterial después de 2 semanas de tratamiento.
Aún no se conoce el efecto de olmesartán medoxomilo sobre la mortalidad y la morbilidad.
El estudio Olmesartán Aleatorizado y la Prevención de Microalbuminuria por Diabetes [Randomized Olmesartan and Diabetes Microalbuminuria Prevention] (ROADMAP) en 4447 pacientes con diabetes tipo 2, normoalbuminuria y al menos un factor de riesgo cardiovascular adicional, investigó si el tratamiento con olmesartán podría retrasar la aparición de microalbuminuria. Durante la mediana de seguimiento de 3,2 años, los pacientes recibieron olmesartán o placebo además de otros agentes antihipertensivos, excepto inhibidores de la ECA o bloqueadores del receptor de la angiotensina.
Para el criterio de valoración principal, el estudio demostró una reducción significativa del riesgo en el tiempo hasta el inicio de la microalbuminuria, a favor del olmesartán. Después del ajuste por diferencias de PA, esta reducción del riesgo dejó de ser estadísticamente significativa. El 8,2% (178 de 2160) de los pacientes del grupo olmesartán y el 9,8% (210 de 2139) del grupo placebo desarrollaron microalbuminuria.
Para los criterios de valoración secundarios, se produjeron eventos cardiovasculares en 96 pacientes (4,3%) con olmesartán y en 94 pacientes (4,2%) con placebo. La incidencia de mortalidad cardiovascular fue mayor con olmesartán en comparación con el tratamiento con placebo (15 pacientes (0,7%) frente a 3 pacientes (0,1%)), a pesar de tasas similares de accidente cerebrovascular no fatal (14 pacientes (0,6%) frente a 8 pacientes (0,4%)), infarto de miocardio no fatal (17 pacientes (0,8%) frente a 26 pacientes (1,2%)) y mortalidad no cardiovascular (11 pacientes (0,5%) frente a 12 pacientes (0,5%)). La mortalidad general con olmesartán aumentó numéricamente (26 pacientes (1,2%) frente a 15 pacientes (0,7%)), lo que se debió principalmente a un mayor número de eventos cardiovasculares mortales.
El Ensayo de Olmesartán en la Reducción de Incidencia de Enfermedad Renal Terminal en Nefropatía Diabética [Olmesartan Reducing Incidence of End-stage Renal Disease in Diabetic Nephropathy Trial] (ORIENT) investigó los efectos del olmesartán en los resultados renales y cardiovasculares en 577 pacientes diabéticos tipo 2, japoneses y chinos, aleatorizados con nefropatía manifiesta. Durante una mediana de seguimiento de 3,1 años, los pacientes recibieron olmesartán o placebo además de otros agentes antihipertensivos, incluidos los inhibidores de la ECA.
El criterio de valoración principal compuesto (tiempo hasta el primer evento de duplicación de la creatinina sérica, enfermedad renal en etapa terminal, muerte por cualquier causa) ocurrió en 116 pacientes en el grupo olmesartán (41,1%) y 129 pacientes en el grupo placebo (45,4%) (HR 0,97 (IC del 95%: 0,75 a 1,24); p = 0,791). El criterio de valoración cardiovascular secundario compuesto se produjo en 40 pacientes tratados con olmesartán (14,2%) y 53 pacientes tratados con placebo (18,7%). Este criterio de valoración cardiovascular compuesto incluyó muerte cardiovascular en 10 (3,5%) pacientes que recibieron olmesartán frente a 3 (1,1%) que recibieron placebo, mortalidad general 19 (6,7%) frente a 20 (7,0%), accidente cerebrovascular no fatal 8 (2,8%) frente a 11 (3,9%) e infarto de miocardio no fatal 3 (1,1%) frente a 7 (2,5%), respectivamente.
El componente amlodipino de BENICAR TRIPLE® es un bloqueador de los canales de calcio que inhibe la entrada transmembrana de iones de calcio a través de los canales de tipo L dependientes del potencial hacia el corazón y el músculo liso. Los datos experimentales indican que el amlodipino se une a sitios de unión tanto de dihidropiridina como de no dihidropiridina. Amlodipino es relativamente selectivo a los vasos, con un efecto mayor sobre las células del músculo liso vascular que sobre las células del músculo cardiaco. El efecto antihipertensivo de amlodipino se deriva de un efecto relajante directo sobre el músculo liso arterial, que conduce a una disminución de la resistencia periférica y, por consiguiente, de la presión arterial.
En pacientes hipertensos, amlodipino provoca una reducción de la presión arterial de larga duración dependiente de la dosis. No ha habido evidencia de hipotensión con la primera dosis, de taquifilaxia durante el tratamiento a largo plazo o de hipertensión de rebote después de la interrupción abrupta del tratamiento.
Tras la administración de dosis terapéuticas a pacientes con hipertensión, amlodipino produce una reducción eficaz de la presión arterial en las posiciones supina, sentada y de pie. El uso crónico de amlodipino no se asocia con cambios significativos en la frecuencia cardíaca o los niveles plasmáticos de catecolaminas. En pacientes hipertensos con función renal normal, las dosis terapéuticas de amlodipino reducen la resistencia vascular renal y aumentan la tasa de filtración glomerular y el flujo plasmático renal efectivo, sin alterar la fracción de filtración ni la proteinuria.
En estudios hemodinámicos en pacientes con insuficiencia cardíaca y en estudios clínicos basados en pruebas de esfuerzo en pacientes con insuficiencia cardíaca de clase II-IV de la NYHA, se encontró que amlodipino no causaba ningún deterioro clínico, medido por la tolerancia al ejercicio, la fracción de eyección del ventrículo izquierdo y los signos y síntomas clínicos.
Un estudio controlado con placebo (PRAISE) diseñado para evaluar a pacientes con insuficiencia cardíaca de clase III-IV de la NYHA que reciben digitálicos, diuréticos e inhibidores de la ECA, ha demostrado que amlodipino no conducía a un aumento del riesgo de mortalidad y morbilidad en pacientes con insuficiencia cardíaca.
En un estudio de seguimiento a largo plazo controlado con placebo (PRAISE-2) de amlodipino en pacientes con insuficiencia cardíaca de clase III y IV de la NYHA sin síntomas clínicos o hallazgos objetivos sugestivos de enfermedad isquémica subyacente, con dosis estables de inhibidores de la ECA, digitálicos y diuréticos, amlodipino no tuvo ningún efecto sobre la mortalidad total o cardiovascular. En esta misma población, amlodipino se asoció con un aumento de informes de edema pulmonar a pesar de que no hubo diferencias significativas en la incidencia de empeoramiento de la insuficiencia cardíaca en comparación con el placebo.
Se realizó un estudio aleatorizado doble ciego de morbilidad y mortalidad llamado Ensayo de Tratamiento Antihipertensivo y Reductor de Lípidos para Prevenir un Ataque Cardiaco [Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial] (ALLHAT) para comparar las terapias farmacológicas más nuevas: amlodipino 2,5-10 mg/d (bloqueador de los canales de calcio) o lisinopril 10-40 mg/d (inhibidor de la ECA) como terapias de primera línea frente al diurético tiazídico clortalidona 12,5-25 mg/d en la hipertensión leve a moderada.
Un total de 33.357 pacientes hipertensos de 55 años o más fueron aleatorizados y seguidos durante una media de 4,9 años. Los pacientes tenían al menos un factor de riesgo adicional de cardiopatía coronaria, que incluía: infarto de miocardio o accidente cerebrovascular previo (> 6 meses antes de la inclusión) o documentación de otra enfermedad cardiovascular aterosclerótica (en general 51,5%), diabetes tipo 2 (36,1%), HDL-C < 35 mg/dL (11,6%), hipertrofia ventricular izquierda diagnosticada por electrocardiograma o ecocardiografía (20,9%), tabaquismo actual (21,9%).
El criterio de valoración principal fue una combinación de cardiopatía coronaria fatal o infarto de miocardio no fatal. No hubo diferencias significativas en el criterio de valoración principal entre la terapia basada en amlodipino y la terapia basada en clortalidona: RR 0,98, IC del 95% (0,90-1,07), p = 0,65. Entre los criterios de valoración secundarios, la incidencia de insuficiencia cardíaca (componente de un criterio de valoración cardiovascular combinado compuesto) fue significativamente mayor en el grupo de amlodipino en comparación con el grupo de clortalidona (10,2% frente a 7,7%, RR 1,38, IC del 95% [1,25-1,52], p <0,001). Sin embargo, no hubo diferencias significativas en la mortalidad por cualquier causa entre la terapia basada en amlodipino y la terapia basada en clortalidona. RR 0,96, IC del 95% [0,89-1,02], p = 0,20.
La hidroclorotiazida es un diurético tiazídico. El mecanismo del efecto antihipertensivo de los diuréticos tiazídicos no se conoce por completo. Las tiazidas afectan los mecanismos tubulares renales de reabsorción de electrolitos, aumentando directamente la excreción de sodio y cloruro en cantidades aproximadamente equivalentes. La acción diurética de la hidroclorotiazida reduce el volumen plasmático, aumenta la actividad de la renina plasmática y aumenta la secreción de aldosterona, con los consiguientes aumentos de la pérdida urinaria de potasio y bicarbonato y disminución del potasio sérico. El enlace renina-aldosterona está mediado por la angiotensina II y, por lo tanto, la coadministración de un antagonista del receptor de la angiotensina II tiende a revertir la pérdida de potasio asociada con los diuréticos tiazídicos. Con hidroclorotiazida, el inicio de la diuresis se produce aproximadamente a las 2 horas y el efecto máximo se produce aproximadamente 4 horas después de la dosis, mientras que la acción persiste durante aproximadamente 6 a 12 horas.
Los estudios epidemiológicos han demostrado que el tratamiento a largo plazo con hidroclorotiazida en monoterapia reduce el riesgo de morbilidad y mortalidad cardiovascular.
Resultados de Estudios Clínicos:
En un estudio de 12 semanas, doble ciego, aleatorizado, de grupos paralelos en 2492 pacientes (67% pacientes caucásicos), el tratamiento con BENICAR TRIPLE® 40 mg/25 mg/10 mg resultó en reducciones significativamente mayores en la presión arterial diastólica y sistólica que el tratamiento con cualquiera de las combinaciones dobles correspondientes, olmesartán medoxomilo 40 mg más amlodipino 10 mg, olmesartán medoxomilo 40 mg más hidroclorotiazida 25 mg y amlodipino 10 mg más hidroclorotiazida 25 mg, respectivamente.
El efecto de disminución de la presión arterial adicional de BENICAR TRIPLE® 40 mg/25 mg/10 mg en comparación con las combinaciones dobles análogas fue de entre -3,8 y -6,7 mmHg para la presión diastólica en posición sentada y entre -7,1 y -9,6 mmHg para la presión arterial sistólica en posición sentada y se produjo dentro de las primeras 2 semanas.
Las proporciones de pacientes que alcanzaron el objetivo de presión arterial (< 140/90 mmHg para pacientes no diabéticos y < 130/80 mmHg para pacientes diabéticos) en la semana 12 variaron del 34,9% al 46,6% para los grupos de tratamiento de combinación doble en comparación con el 64,3% para BENICAR TRIPLE® 40 mg/25 mg/10 mg. En un segundo estudio doble ciego, aleatorizado, de grupos paralelos en 2690 pacientes (99,9% pacientes caucásicos), el tratamiento con BENICAR TRIPLE® resultó en reducciones significativamente mayores en la presión arterial diastólica y sistólica en comparación con las correspondientes combinaciones dobles, olmesartán medoxomilo 20 mg más amlodipino 5 mg, olmesartán medoxomilo 40 mg más amlodipino 5 mg y olmesartán medoxomilo 40 mg más amlodipino 10 mg, respectivamente, después de 10 semanas de tratamiento.
El efecto de disminución de la presión arterial adicional de BENICAR TRIPLE® en comparación con las combinaciones duales correspondientes fue entre -1,3 y -1,9 mmHg para la presión diastólica en posición sentada y entre -2,7 y -4,9 mmHg para la presión arterial sistólica en posición sentada.
Las proporciones de pacientes que alcanzaron el objetivo de presión arterial (< 140/90 mmHg para pacientes no diabéticos y < 130/80 mmHg para pacientes diabéticos) en la semana 10 variaron del 42,7% al 49,6% para los grupos de tratamiento de combinación doble en comparación con el 52,4% al 58,8% para BENICAR TRIPLE®.
En un estudio complementario, aleatorizado, doble ciego, en 808 pacientes (99,9% pacientes caucásicos) no controlados adecuadamente después de terapia de 8 semanas con olmesartán medoxomilo 40 mg más amlodipino 10 mg, el tratamiento de combinación doble con BENICAR TRIPLE® resultó en una reducción numéricamente adicional de la presión arterial sentada de -1,8 / -1,0 mmHg cuando tratados con BENICAR TRIPLE® 40 mg/12,5 mg/10 mg y una reducción adicional estadísticamente significativa de la presión arterial sentada de -3,6 / -2,8 mmHg cuando tratados con BENICAR TRIPLE® 40 mg/25 mg/10 mg en comparación con la combinación doble olmesartán medoxomilo 40 mg más amlodipino 10 mg.
El tratamiento con BENICAR TRIPLE® 40 mg/25 mg/10 mg en terapia de combinación triple resultó en un porcentaje estadísticamente significativamente mayor de participantes de la investigación que alcanzaron su objetivo de presión arterial en comparación con olmesartán medoxomilo 40 mg más amlodipino 10 mg en terapia de combinación doble (41,3% frente a 24,2%); mientras que el tratamiento con BENICAR TRIPLE® 40 mg/12,5 mg/10 mg en terapia de combinación triple resultó en un porcentaje numéricamente mayor de participantes de la investigación que alcanzaron su objetivo de presión arterial en comparación con olmesartán medoxomilo 40 mg más amlodipino 10 mg en terapia de combinación doble (29,5% frente a 24,2%) en participantes de la investigación no controlados adecuadamente con la terapia de combinación doble.
El efecto antihipertensivo de BENICAR TRIPLE® fue similar independientemente de la edad y el sexo, y fue similar en pacientes con y sin diabetes.
Otra información:
Dos grandes ensayos controlados aleatorizados (ONTARGET (Ensayo de criterios de valoración global de Telmisartán solo y en combinación con Ramipril en curso) [ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial] y VA NEPHRON-D (The Veterans Affairs Nephropathy in Diabetes)) han examinado el uso de la combinación de un inhibidor de la ECA con un bloqueador del receptor de la angiotensina II.
ONTARGET fue un estudio realizado en pacientes con antecedentes de enfermedad cardiovascular o cerebrovascular, o diabetes mellitus tipo 2 acompañada de evidencia de daño en los órganos diana. VA NEPHRON-D fue un estudio en pacientes con diabetes mellitus tipo 2 y nefropatía diabética.
Estos estudios no han mostrado ningún efecto beneficioso significativo sobre los resultados renales y/o cardiovasculares y la mortalidad, mientras que se observó un mayor riesgo de hiperpotasemia, daño renal agudo y/o hipotensión en comparación con la monoterapia. Dadas sus propiedades farmacodinámicas similares, estos resultados también son relevantes para otros inhibidores de la ECA y bloqueadores de los receptores de la angiotensina II.
Por lo tanto, los inhibidores de la ECA y los bloqueadores de los receptores de la angiotensina II no deben utilizarse de forma concomitante en pacientes con nefropatía diabética.
ALTITUDE (Ensayo de aliskiren en la diabetes tipo 2 utilizando criterios de valoración de la enfermedad cardiovascular y renal [Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints]) fue un estudio diseñado para probar el beneficio de agregar aliskiren a una terapia estándar de un inhibidor de la ECA o un bloqueador del receptor de la angiotensina II en pacientes con diabetes mellitus tipo 2 y enfermedad renal crónica, enfermedad cardiovascular o ambas. El estudio se terminó temprano debido a un mayor riesgo de resultados adversos. La muerte cardiovascular y el accidente cerebrovascular fueron numéricamente más frecuentes en el grupo de aliskiren que en el grupo de placebo y los eventos adversos y los eventos adversos graves de interés (hiperpotasemia, hipotensión y disfunción renal) se notificaron con más frecuencia en el grupo de aliskiren que en el grupo de placebo.
Cáncer de piel no melanoma:
Según los datos disponibles de estudios epidemiológicos, se ha observado una asociación dependiente de la dosis acumulada entre HCT y CPNM. Un estudio incluyó una población compuesta por 71.533 casos de carcinoma de células basales y 8.629 casos de carcinoma de células escamosas emparejados con 1.430.833 y 172.462 controles de población, respectivamente. El uso elevado de HCT (≥ 50.000 mg acumulados) se asoció con un OR [odds ratio] ajustado de 1,29 (IC del 95%: 1,23-1,35) para carcinoma de células basales y 3,98 (IC del 95%: 3,68-4,31) para carcinoma de células escamosas. Se observó una clara relación dosis-respuesta acumulativa tanto para carcinoma de células basales como para carcinoma de células escamosas. Otro estudio mostró una posible asociación entre el cáncer de labio y la exposición a HCT: 633 casos de cáncer de labio se emparejaron con 63.067 controles de población, utilizando una estrategia de muestreo de conjunto de riesgos. Se demostró una relación dosis-respuesta acumulada con un OR ajustado 2,1 (IC del 95%: 1,7-2,6) aumentando a OR 3,9 (3,0-4,9) para uso elevado (~ 25.000 mg) y OR 7,7 (5,7-10,5) para la dosis acumulada más alta (~ 100.000 mg) (véase también la sección Advertencias y Precauciones especiales de uso).
Propiedades farmacocinéticas:
La administración concomitante de olmesartán medoxomilo, amlodipino e hidroclorotiazida no presentó efectos clínicamente relevantes en la farmacocinética de ninguno de los componentes en sujetos sanos.
Tras la administración oral de BENICAR TRIPLE® en adultos sanos normales, las concentraciones plasmáticas máximas de olmesartán, amlodipino e hidroclorotiazida se alcanzan en aproximadamente 1,5 a 3 horas, 6 a 8 horas y 1,5 a 2 horas, respectivamente. El rango y el grado de absorción de olmesartán medoxomilo, amlodipino e hidroclorotiazida de BENICAR TRIPLE® son los mismos que cuando se administran como una combinación doble fija de olmesartán medoxomilo y amlodipino junto con una tableta de un solo componente de hidroclorotiazida o cuando se administra como una combinación doble fija de olmesartán medoxomilo e hidroclorotiazida junto con una tableta de un solo componente de amlodipino con las mismas dosis. Los alimentos no afectan la biodisponibilidad de BENICAR TRIPLE®.
Olmesartán medoxomilo:
Absorción y distribución:
Olmesartán medoxomilo es un profármaco. Se convierte rápidamente en el metabolito farmacológicamente activo, olmesartán, a través de esterasas en la mucosa intestinal y en la sangre portal durante la absorción en el tracto gastrointestinal. No se ha detectado olmesartán medoxomilo intacto ni fracción intacta de medoxomilo de cadena lateral en plasma o excrementos. La biodisponibilidad absoluta media de olmesartán a partir de una formulación en tabletas fue del 25,6%.
La concentración plasmática máxima media (Cmáx) de olmesartán se alcanza aproximadamente 2 horas después de la administración oral de olmesartán medoxomilo, y las concentraciones plasmáticas de olmesartán aumentan de forma aproximadamente lineal al aumentar las dosis orales únicas hasta aproximadamente 80 mg.
Los alimentos tuvieron un efecto mínimo sobre la biodisponibilidad de olmesartán y, por lo tanto, olmesartán medoxomilo se puede administrar con o sin alimentos.
No se han observado diferencias clínicamente relevantes relacionadas con el sexo en la farmacocinética de olmesartán.
Olmesartán se une en gran medida a las proteínas plasmáticas (99,7%), pero el potencial de interacciones clínicamente significativas de desplazamiento de la unión a proteínas entre olmesartán y otros principios activos coadministrados con un alto grado de unión es bajo (confirmado por la ausencia de una interacción clínicamente significativa entre olmesartán medoxomilo y warfarina). La unión de olmesartán a las células sanguíneas es insignificante. El volumen medio de distribución después de la administración intravenosa es bajo (16 – 29 L).
Biotransformación y eliminación:
El aclaramiento plasmático total de olmesartán fue típicamente de 1,3 L/h (CV 19%) y fue relativamente lento en comparación con el flujo sanguíneo hepático (aproximadamente 90 L/h). Después de una dosis oral única de olmesartán medoxomilo marcado con 14C, el 10-16% de la radioactividad administrada se excretó en la orina (la gran mayoría en las 24 horas posteriores a la administración de la dosis) y el resto de la radioactividad recuperada se excretó en las heces. Con base en la disponibilidad sistémica del 25,6%, se puede calcular que el olmesartán absorbido se aclara tanto por excreción renal (aproximadamente 40%) como por excreción hepatobiliar (aproximadamente 60%). Toda la radioactividad recuperada se identificó como olmesartán. No se detectó ningún otro metabolito significativo. El reciclaje enterohepático de olmesartán es mínimo. Dado que una gran proporción de olmesartán se excreta por vía biliar, el uso en pacientes con obstrucción biliar está contraindicado (véase la sección Contraindicaciones).
La vida media de eliminación terminal de olmesartán varió entre 10 y 15 horas después de múltiples dosis orales. El estado estable se alcanzó después de 2-5 días de dosificación y ninguna acumulación adicional fue evidente después de 14 días de dosis repetidas. El aclaramiento renal fue de aproximadamente 0,5 - 0,7 L/h y fue independiente de la dosis.
Interacciones farmacológicas:
Agente secuestrante de ácidos biliares colesevelam:
La administración concomitante de 40 mg de olmesartán medoxomilo y 3750 mg de colesevelam hidrocloruro en participantes de la investigación sanos resultó en una reducción del 28% en la Cmáx y del 39% en el AUC de olmesartán. Se observaron efectos menores, una reducción del 4% y del 15% en la Cmáx y el AUC, respectivamente, cuando se administró olmesartán medoxomilo 4 horas antes del colesevelam hidrocloruro. La vida media de eliminación de olmesartán se redujo en un 50 – 52% independientemente de si se administró concomitantemente o 4 horas antes de colesevelam hidrocloruro (véase la sección Interacción con otros medicamentos y otras formas de interacción).
Amlodipino:
Absorción y distribución:
Tras la administración oral de dosis terapéuticas, amlodipino se absorbe bien con niveles máximos en la sangre entre 6-12 horas después de la dosis. Se ha estimado que la biodisponibilidad absoluta está entre el 64 y el 80%. El volumen de distribución es de aproximadamente 21 L/kg. Los estudios in vitro han demostrado que aproximadamente el 97,5% del amlodipino circulante se une a las proteínas plasmáticas.
La absorción de amlodipino no se ve afectada por la ingesta concomitante de alimentos.
Biotransformación y eliminación:
La vida media de eliminación plasmática terminal es de aproximadamente 35 a 50 horas y es consistente con la dosificación una vez al día.
Amlodipino se metaboliza extensamente en el hígado a metabolitos inactivos con un 10% del compuesto original y un 60% de los metabolitos excretados en la orina.
Hidroclorotiazida:
Absorción y distribución:
Tras de la administración oral de olmesartán medoxomilo e hidroclorotiazida en combinación, el tiempo medio hasta las concentraciones máximas de hidroclorotiazida fue de 1,5 a 2 horas después de la dosificación. La hidroclorotiazida se une en un 68% a las proteínas plasmáticas y su volumen aparente de distribución es de 0,83 - 1,14 L/kg.
Biotransformación y eliminación:
La hidroclorotiazida no se metaboliza en el hombre y se excreta casi en su totalidad como principio activo inalterado en la orina. Aproximadamente el 60% de la dosis oral se elimina como principio activo inalterado en 48 horas. El aclaramiento renal es de aproximadamente 250 a 300 mL/min. La vida media de eliminación terminal de la hidroclorotiazida es de 10 a 15 horas.
Farmacocinética en poblaciones especiales:
Población pediátrica:
La Agencia Europea de Medicamentos ha renunciado a la obligación de presentar los resultados de los estudios con BENICAR TRIPLE® en todos los subgrupos de población pediátrica en hipertensión esencial.
Ancianos (65 años o más):
En pacientes hipertensos, el AUC de olmesartán en estado estable aumentó aproximadamente un 35% en personas de edad avanzada (65-75 años) y aproximadamente un 44% en personas de edad muy avanzada (≥ 75 años) en comparación con el grupo de edad más joven (véase la sección Posología y Modo de administración).
Esto puede estar relacionado, al menos en parte, con una disminución media de la función renal en este grupo de pacientes. Sin embargo, el régimen de dosificación recomendado para los ancianos es el mismo, aunque se debe tener precaución al aumentar la dosis.
El tiempo para alcanzar las concentraciones plasmáticas máximas de amlodipino es similar en participantes de la investigación ancianos y jóvenes. El aclaramiento de amlodipino tiende a disminuir con el consiguiente aumento en el AUC y la vida media de eliminación en ancianos. Los aumentos del AUC y la vida media de eliminación en pacientes con insuficiencia cardíaca congestiva fueron según lo esperado para el grupo de edad de los pacientes en este estudio (véase la sección Advertencias y Precauciones especiales de uso).
Los datos limitados sugieren que el aclaramiento sistémico de la hidroclorotiazida se reduce tanto en personas de edad avanzada sanas como hipertensas en comparación con voluntarios jóvenes sanos.
Insuficiencia renal:
En pacientes con insuficiencia renal, el AUC de olmesartán en estado estable aumentó en un 62%, 82% y 179% en pacientes con insuficiencia renal leve, moderada y grave, respectivamente, en comparación con controles sanos (véase las secciones Posología y Modo de administración y Advertencias y Precauciones especiales de uso). No se ha estudiado la farmacocinética de olmesartán medoxomilo en pacientes sometidos a hemodiálisis.
Amlodipino se metaboliza ampliamente a metabolitos inactivos. El diez por ciento de la sustancia se excreta sin cambios en la orina. Los cambios en la concentración plasmática de amlodipino no se correlacionan con el grado de insuficiencia renal. En estos pacientes, amlodipino puede administrarse a la dosis normal. Amlodipino no es susceptible a la diálisis.
La vida media de hidroclorotiazida se prolonga en pacientes con insuficiencia renal.
Insuficiencia hepática:
Después de la administración oral única, los valores del AUC de olmesartán son un 6% y un 65% más altos en pacientes con insuficiencia hepática leve y moderada, respectivamente, que en sus correspondientes controles sanos emparejados. La fracción libre de olmesartán 2 horas después de la dosis en participantes sanos, en pacientes con insuficiencia hepática leve y en pacientes con insuficiencia hepática moderada es del 0,26%, 0,34% y 0,41%, respectivamente.
Tras la administración repetida de dosis en pacientes con insuficiencia hepática moderada, el AUC medio de olmesartán es nuevamente aproximadamente un 65% más alto que en los controles sanos emparejados. Los valores medios de Cmáx de olmesartán son similares en sujetos con insuficiencia hepática y en sujetos sanos. No se ha evaluado olmesartán medoxomilo en pacientes con insuficiencia hepática grave (véase las secciones Posología y Modo de administración y Advertencias y Precauciones especiales de uso).
Se dispone de datos clínicos muy limitados sobre la administración de amlodipino en pacientes con insuficiencia hepática. El aclaramiento de amlodipino disminuye y la vida media se prolonga en pacientes con insuficiencia hepática, lo que da lugar a un aumento del AUC de aproximadamente un 40% - 60% (véase las secciones Posología y Modo de administración y Advertencias y Precauciones especiales de uso).
La insuficiencia hepática no influye significativamente en la farmacocinética de la hidroclorotiazida.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sobredosis:
Síntomas:
La dosis máxima de BENICAR TRIPLE® es 40 mg/25 mg/10mg una vez al día. No hay información sobre la sobredosis con BENICAR TRIPLE® en humanos. El efecto más probable de la sobredosis de BENICAR TRIPLE® es la hipotensión.
Los efectos más probables de la sobredosis de olmesartán medoxomilo son hipotensión y taquicardia; la bradicardia podría suceder si se produjera una estimulación parasimpática (vagal).
Se puede esperar que la sobredosis de amlodipino dé lugar a una vasodilatación periférica excesiva con hipotensión marcada y posiblemente una taquicardia refleja. Se ha informado hipotensión sistémica marcada y potencialmente prolongada, hasta e incluyendo choque con resultado fatal.
La sobredosis con hidroclorotiazida se asocia con una depleción de electrolitos (hipopotasemia, hipocloremia) y deshidratación como resultado de una diuresis excesiva.
Los signos y síntomas más comunes de sobredosis son náuseas y somnolencia. La hipopotasemia puede resultar en espasmo muscular y/o acentuar las arritmias cardíacas asociadas con el uso concomitante de glucósidos digitálicos o ciertos medicamentos antiarrítmicos.
Tratamiento:
En caso de sobredosis con BENICAR TRIPLE®, el tratamiento debe ser sintomático y de apoyo. El manejo depende del tiempo transcurrido desde la ingestión y de la gravedad de los síntomas.
Si la ingesta es reciente, se puede considerar el lavado gástrico. En participantes de la investigación sanos, se ha demostrado que la administración de carbón activado inmediatamente o hasta 2 horas después de la ingestión de amlodipino reduce sustancialmente la absorción de amlodipino.
La hipotensión clínicamente significativa debida a una sobredosis de BENICAR TRIPLE® requiere un apoyo activo del sistema cardiovascular, incluido un estrecho monitoreo de la función cardíaca y pulmonar, la elevación de las extremidades y la atención al volumen de líquido circulante y la producción de orina. Un vasoconstrictor puede ser útil para restaurar el tono vascular y la presión arterial, siempre que no exista contraindicación para su uso. El gluconato de calcio intravenoso puede ser beneficioso para revertir los efectos del bloqueo de los canales de calcio.
Los electrolitos séricos y la creatinina deben controlarse con frecuencia. Si se produce hipotensión, el paciente debe colocarse en decúbito supino, con reemplazos de sal y volumen administrados rápidamente.
Dado que el amlodipino se une en gran medida a las proteínas, no es probable que la diálisis sea beneficiosa. Se desconoce la capacidad de diálisis de olmesartán o hidroclorotiazida.
No se ha establecido el grado en que olmesartán e hidroclorotiazida se eliminan por hemodiálisis.
PRESENTACIÓN:
Presentaciones:
Naturaleza y contenido del recipiente:
Blíster de aluminio/aluminio en estuche de cartón con 14 y 28 tabletas recubiertas.
Titular y Fabricante
Daiichi Sankyo Brasil FarmacêuticA LTDA.
Brasil Alameda Xingu, 766
Alphaville, Barueri - SP
Brasil
Comercializado por:
LATIN FARMA, S.A.
Guatemala
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Precauciones especiales de conservación:
Conserve este medicamento a temperatura inferior a 30ºC. Mantener fuera de la vista y del alcance de los niños.
REFERENCIAS:
- Summary of Product Characteristics (SmPC) – Inserto del Profesional de Salud revisado enMarzo/2022– link: https:// www.medicines.org.uk/emc/product/4596/smpc/print
VENTA BAJO RECETA MÉDICA
Fecha de revisión: julio de 2022.