
APO- OLANZAPINA
OLANZAPINA
Tabletas recubiertas
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada TABLETA Recubierta contiene: 10 mg
INDICACIONES TERAPÉUTICAS:
Esquizofrenia y trastornos relacionados: APO®-OLANZAPINA está indicado para el tratamiento agudo y de mantenimiento de la esquizofrenia y trastornos psicóticos relacionados. En ensayos clínicos controlados, se descubrió que la olanzapina mejora los síntomas tanto positivos como negativos.
Se ha demostrado que la olanzapina es eficaz para mantener la mejoría clínica durante un año de terapia de continuación en pacientes que habían mostrado una respuesta de tratamiento inicial.
Desorden bipolar: APO®-OLANZAPINA (olanzapina) está indicada para el tratamiento agudo de episodios maníacos o mixtos en el trastorno bipolar I. La olanzapina se puede usar como monoterapia o co-terapia con agentes comúnmente usados en el tratamiento del trastorno bipolar agudo.
La eficacia de la olanzapina como tratamiento de mantenimiento en monoterapia en pacientes bipolares con episodios maníacos o mixtos que respondieron al tratamiento agudo con olanzapina se demostró en dos ensayos de 1 año de “tiempo de recaída”.
El médico que elige usar APO®-OLANZAPINA durante períodos prolongados debe volver a evaluar periódicamente la utilidad a largo plazo del medicamento para el paciente individual.
Geriatría (≥ 65 años): APO®-OLANZAPINA no está indicado en pacientes ancianos con demencia.
Pediatría (<18 años de edad): La seguridad y eficacia de la olanzapina no se han establecido en poblaciones pediátricas y no se recomienda su uso.
PROPIEDADES FARMACOLOGICAS
• Propiedades Farmacodinamicas:
La olanzapina, una tienobenzodiazepina, es un agente antipsicótico que demuestra un amplio perfil farmacológico en varios sistemas de receptores. Olanzapina muestra alta afinidad de receptor in vitro en dopamina D2, D3, D4 (Ki = 11-31 nM), 5-HT2A / C (Ki = 4 y 11 nM, respectivamente), 5-HT3, 5-HT6, muscarínico M1 -M5 (Ki = 1.9-2.5 nM), adrenérgico α1 (Ki = 9 nM), y histamina H1 (Ki = 7 nM) subtipos de receptores, mientras que muestra una menor afinidad en los subtipos de receptor de dopamina D1 y D5 (Ki = 51 - 119nM ) En un paradigma conductual predictivo de actividad antipsicótica, la olanzapina redujo la respuesta de evitación condicionada en ratas a dosis inferiores a 4 veces las requeridas para producir catalepsia. En un estudio de dosis única (10 mg) de PET en sujetos sanos, la olanzapina produjo una mayor ocupación del receptor 5-HT2A que de la dopamina D2. El porcentaje de ocupación de D2 fue menor que el valor de umbral predictivo de eventos extrapiramidales.
En animales, se ha observado que la olanzapina produce una reducción significativa en el disparo de células dopaminérgicas A10. El número de neuronas A9 espontáneamente activas permaneció constante o aumentó. Esto puede explicar la baja incidencia de efectos secundarios extrapiramidales con olanzapina generalmente asociados con los antipsicóticos típicos.
La olanzapina también aumenta los niveles extracelulares de dopamina de una manera regionalmente específica en la corteza prefrontal, similar a los estabilizadores del estado de ánimo, el litio y el valproato.
• Propiedades Farmacocinéticas:
Absorción: La olanzapina se absorbe bien después de la administración oral, alcanzando concentraciones plasmáticas máximas en 5 a 8 horas. La absorción no se ve afectada por los alimentos.
Distribución: Las concentraciones plasmáticas de olanzapina administradas por vía oral fueron lineales y proporcionales a la dosis en ensayos que estudiaron dosis de 1 a 20 mg. Las concentraciones plasmáticas máximas (Cmáx) de olanzapina después de dosis orales únicas de 5, 10 y 15 mg promediaron 7, 14 y 21 ng / ml, respectivamente (20 ng / ml = 0.064 mcM). En voluntarios sanos jóvenes, después de una dosis repetida una vez al día, la Cmáx en estado estacionario fue aproximadamente el doble de la alcanzada después de una dosis única (por ejemplo, 23 ng / ml frente a 12 ng / ml para una dosis de 10 mg).
En los ancianos, la concentración plasmática en estado de equilibrio fue aproximadamente 3 veces mayor que la alcanzada después de una dosis única (por ejemplo, 16 ng / ml versus 5 ng / ml para una dosis de 5 mg). En ambos, jóvenes y ancianos, se obtuvieron concentraciones estables de olanzapina después de siete días de administración una vez al día.
Con el tiempo y el rango de dosificación, los parámetros farmacocinéticos dentro de un individuo son muy consistentes. Sin embargo, las concentraciones plasmáticas, la vida media y el aclaramiento de la olanzapina pueden variar según el estado del fumador, el sexo y la edad (ver Poblaciones especiales). Los datos de los estudios farmacocinéticos combinados de dosis única mostraron que la vida media de la olanzapina oscilaba entre 21 y 54 horas (percentil 5 a 95) y el aclaramiento plasmático aparente oscilaba entre 12 y 47 l / h (percentil 5 a 95).
La unión a la proteína plasmática de la olanzapina fue aproximadamente del 93% en el intervalo de concentración de aproximadamente 7 a aproximadamente 1000 ng / ml. La olanzapina se une predominantemente a la albúmina y la glicoproteína ácida α1.
Metabolismo: La olanzapina se metaboliza en el hígado por vía conjugativa y oxidativa. El principal metabolito circulante es el 10-N-glucurónido, que es farmacológicamente inactivo y no pasa la barrera hematoencefálica. Las isoformas del citocromo P450 CYP1A2 y CYP2D6 contribuyen a la formación de los metabolitos N-desmetilo y 2-hidroximetilo.
Ambos metabolitos mostraron significativamente menos actividad farmacológica in vivo que la olanzapina en estudios con animales. La actividad farmacológica predominante proviene del padre olanzapina.
Los estudios microsómicos in vitro muestran que la olanzapina es un inhibidor débil de CYP1A2 (Ki = 36 mcM), CYP2D6 (Ki = 89 mcM) y CYP3A4 (Ki = 490 mcM). En base a estos valores de Ki, se espera una pequeña inhibición de estas enzimas del citocromo P-450 in vivo a concentraciones por debajo de 5 µM (aproximadamente 1500 ng / ml) porque la concentración de olanzapina será inferior al 10% de su valor Ki. En estudios clínicos, las concentraciones plasmáticas de olanzapina en estado estacionario observadas rara vez son> 150 ng / ml (aproximadamente 0,5 mcM). Por lo tanto, es poco probable que la olanzapina cause interacciones fármaco-farmacológicas farmacológicas clínicamente importantes mediadas a través de las rutas metabólicas descritas anteriormente.
Eliminación: Después de la administración oral a sujetos sanos, la vida media de eliminación terminal fue de 33 horas (21 a 54 horas para el percentil 5 al 95) y el aclaramiento plasmático de olanzapina medio fue de 26 l / h (12 a 47 l / h para el Del percentil 5 al 95). La farmacocinética de la olanzapina varía en función del tabaquismo, el sexo y la edad.
|
La Tabla 13 resume estos efectos: |
||
|
Caracteristicas del paciente |
Vida Media (hrs) |
Aclaramiento Plasmatico (L/hr) |
|
No Fumador |
38.6 |
18.6 |
|
Fumador |
30.4 |
27.7 |
|
Mujeres |
36.7 |
18.9 |
|
Hombre |
32.3 |
27.3 |
|
Viejos mayores de 65 años |
51.8 |
17.5 |
|
No viejos |
33.8 |
18.2 |
Aunque el tabaquismo, el sexo y, en menor medida, la edad pueden afectar el aclaramiento y la vida media de la olanzapina, la magnitud del impacto de estos factores individuales es pequeña en comparación con la variabilidad general entre los individuos.
Los estudios farmacocinéticos demuestran que los comprimidos de olanzapina y las formas de dosificación de olanzapina que se disuelven por vía oral son bioequivalentes. Las tabletas de desintegración oral de olanzapina se pueden usar como una alternativa a las tabletas de olanzapina.
Geriatría: En un estudio en el que participaron 24 sujetos sanos, la vida media de eliminación de la olanzapina fue aproximadamente 1,5 veces mayor en ancianos (> 65 años) que en sujetos no ancianos (≤ 65 años). Se debe tener precaución en la dosificación de los ancianos, especialmente si existen otros factores que podrían influir aditivamente en el metabolismo del medicamento y / o la sensibilidad farmacodinámica.
Género: La eliminación de olanzapina es aproximadamente un 30% menor en las mujeres que en los hombres. Sin embargo, no hubo diferencias aparentes entre hombres y mujeres en efectividad o efectos adversos. Las modificaciones de dosis basadas en el género no deberían ser necesarias.
Raza: En un estudio de sujetos caucásicos, japoneses y chinos, no hubo diferencias en la farmacocinética de olanzapina entre las tres poblaciones. El estado de la isoforma CYP2D6 del citocromo P450 no afecta el metabolismo de la olanzapina.
Insuficiencia hepática: No se observaron diferencias en la farmacocinética de una sola dosis de la olanzapina en sujetos con cirrosis clínicamente significativa (que eran en su mayoría fumadores) en comparación con sujetos sanos (todos los no fumadores). Sin embargo, no se han realizado estudios de dosis múltiples en pacientes con insuficiencia hepática.
Insuficiencia renal: No hubo diferencias significativas en la eliminación media de la vida media o la eliminación plasmática de olanzapina entre los sujetos con insuficiencia renal grave en comparación con los individuos con función renal normal. Aproximadamente el 57% de la olanzapina radiomarcada se excreta en la orina, principalmente como metabolitos.
FARMACOLOGÍA:
• Farmacodinámica:
Afinidades vinculantes del receptor in vitro: Las afinidades de unión de olanzapina versus clozapina y haloperidol se resumen en la Tabla 16. El perfil de unión de olanzapina tiene similitudes con el producido por clozapina, aunque la afinidad de olanzapina es algo mayor para los receptores de dopamina D1 y D2 y menor para 2 receptores. Con respecto a los subtipos del receptor 5-HT, ambos agentes muestran la mayor afinidad por los receptores 5-HT2A y 5-HT2C. La relación de actividad entre los receptores 5-HT2A y D2 es ligeramente menor para la olanzapina que para la clozapina, aunque la olanzapina es todavía aproximadamente el doble de activa en los receptores 5-HT2A en comparación con los receptores D2. Ambos compuestos también tienen una alta afinidad por los subtipos de receptores muscarínicos, particularmente el sitio m1. Las constantes de afinidad (Ki, nM) para olanzapina, clozapina y haloperidol se muestran a continuación:
|
Tabla 16: Constantes de afinidad para olanzapina, clozapina y haloperidol |
||||||||||
|
Compuesto |
Dopamina D1 |
Dopamine D2 |
α1 |
α2 |
Histamine H1 |
|||||
|
Olanzapina |
31 ± 0.7 |
11 ± 2 |
19 ± 1 |
230 ± 40 |
7 ± 0.3 |
|||||
|
Clozapina |
85 ± 0.7 |
125 ± 20 |
7 ± 4 |
8 ± 3 |
6 ± 2 |
|||||
|
Haloperidol |
25 ± 7 |
1 ± 0.04 |
46 ± 6 |
360 ± 100 |
3630 ± 85 |
|||||
|
Compuesto |
5-HT1A |
5-HT1B |
5-HT1D |
5-HT2A |
5-HT2C |
5-HT3 |
||||
|
Olanzapina |
>10,000 |
1355 ± 380 |
800 ± 190 |
4 ± 0.4 |
11 ± 1 |
57 |
||||
|
Clozapina |
770 ± 220 |
1200 ± 170 |
980 ± 115 |
12 ± 3 |
8 ± 0.8 |
69 |
||||
|
Haloperidol |
7930 ± 500 |
>10,000 |
6950 ± 950 |
78 ± 22 |
3085 |
>1000 |
||||
|
Compuesto |
m1 |
m2 |
m3 |
m4 |
m5 |
|||||
|
Olanzapina |
1.9 ± 0.1 |
18 ± 5 |
25 ± 2 |
13 ± 2 |
6 ± 0.8 |
|||||
|
Clozapina |
1.9 ± 0.4 |
10 ± 1 |
14 ± 1 |
18 ± 5 |
5 ± 1.2 |
|||||
|
Haloperidol |
1475 ± 300 |
1200 ± 180 |
1600 ± 305 |
>10,000 |
No probada |
|||||
Olanzapina no tiene actividad significativa en GABAA, benzodiazepina o receptores β. La olanzapina también interactúa con los receptores de dopamina D4 (Ki 27 nM).
Se realizaron estudios bioquímicos in vivo para confirmar los datos de unión e investigar las consecuencias funcionales de la interacción con estos sitios receptores de neurotransmisores.
Estudios neuroendocrinos in vivo: Se ha demostrado que las concentraciones de corticosterona en ratas pueden ser elevadas por mecanismos mediados por 5-HT o mediados por dopamina. La olanzapina antagoniza los aumentos de corticosterona inducidos por 5-HT (inducida por quipazina) (ED50 0,57 mg / kg) y mediada por receptor de dopamina D2 (inducida por pergolida) (ED50 3 mg / kg). Estos resultados muestran que la olanzapina tiene una mayor actividad en 5-HT en comparación con los receptores de dopamina D2 in vivo. Estos resultados complementan los estudios de comportamiento que muestran que la olanzapina antagoniza preferentemente una respuesta inducida por 5-HT.
Farmacología conductual in vivo: En los estudios de comportamiento, la olanzapina exhibe un amplio perfil farmacológico, según lo predicho a partir de los datos bioquímicos.
La olanzapina bloquea el comportamiento de escalada inducido por apomorfina con una DE50 de aproximadamente 5 mg / kg. La respuesta de escalada ha demostrado previamente que requiere la activación del receptor D1 y D2. Por lo tanto, estos resultados indican que la olanzapina posee actividad antagonista de la dopamina in vivo.
Un segundo estudio en ratones analizó la capacidad de la olanzapina para bloquear las sacudidas de la cabeza inducidas por 5-hidroxitriptófano (5-HTP), una prueba probablemente mediada por los receptores 5-HT2. La olanzapina produjo reducciones relacionadas con la dosis en la respuesta de la contracción de la cabeza con valores ED50 aproximados de 2 mg / kg. La olanzapina bloquea preferentemente la contracción de la cabeza, en comparación con la respuesta de escalada, lo que demuestra que este agente exhibe una mayor actividad en el receptor 5-HT en comparación con los receptores de dopamina in vivo. Estos resultados concuerdan con los informados en ratas, que muestran que la olanzapina antagoniza preferentemente las elevaciones de corticosterona mediadas por 5-HT en lugar de por dopamina (Moore et al., 1993).
Dosis de olanzapina de 2.5 a 10 mg / kg produjeron una reducción significativa en el temblor inducido por oxotremorina en ratones, con una DE50 de 3 mg / kg. Estos resultados demuestran que la olanzapina posee actividad anticolinérgica in vivo a dosis que también antagonizan los efectos mediados por dopamina.
La inhibición de una respuesta de evitación condicionada se ha utilizado ampliamente como una prueba para predecir el potencial antipsicótico de un compuesto, mientras que la inducción de la catalepsia en ratas se asocia con la aparición de síntomas extrapiramidales en la clínica. Las ED50 para los diversos compuestos en el bloqueo de una respuesta de evitación condicionada o la inducción de catalepsia en ratas se dan en la Tabla 17.
|
Tabla 17: Efecto de la olanzapina y el haloperidol en la respuesta de evitación condicionada (CAR) y la inducción de la catalepsia (CAT) en ratas Lister Hooded |
|||
|
Compuesto |
CAR |
CAT |
Ratio |
|
Olanzapina |
5.6 (4.6-6.8) |
23 (18.7-29) |
4.1 |
|
Haloperidol |
0.28 (0.24-0.33) |
0.74 (0.6-0.9) |
2.6 |
|
Nota: Los resultados se expresan como valores ED50 (mg / kg p.o.) con intervalos de confianza del 95% indicados entre paréntesis. La relación es el ED50 CAT / ED50 CAR. Aunque la olanzapina induce la catalepsia, esto solo ocurre a dosis superiores a las requeridas para bloquear la respuesta de evitación condicionada. |
|||
Varios informes han demostrado que el agente “atípico”, la clozapina, difiere de los antipsicóticos “típicos” en sus efectos sobre el comportamiento controlado por programa.
En una prueba de conflicto de ratas o palomas, la olanzapina, la clozapina y el clordiazepóxido produjeron los cambios característicos en las tasas de respuesta asociadas con ansiolíticos, aunque el efecto de la olanzapina y la clozapina fue menor que el observado con el clordiazepóxido. Los tres compuestos disminuyeron o no tuvieron efecto sobre las altas tasas de respuesta producidas en el componente de recompensa, mientras que las tasas en el tiempo de espera y particularmente el período de conflicto aumentaron. Este tipo de perfil no se observó con el antipsicótico “típico”, haloperidol, que solo disminuyó las tasas en todos los componentes. Estos datos enfatizan aún más el perfil “atípico” de la olanzapina.
Electrofisiología in vivo: Los agentes antipsicóticos “típicos”, como el haloperidol, reducen la activación espontánea de las neuronas dopaminérgicas A9 y A10 en el SNC después de la administración crónica. Se cree que el A9 (sistema nigroestriatal) media las alteraciones motoras extrapiramidales, mientras que el Al0 (sistema mesolímbico) se ha asociado con la actividad antipsicótica de los compuestos. La olanzapina (10 y 20 mg / kg por vía subcutánea durante 21 días) produjo una reducción significativa en el disparo de las células dopaminérgicas A10. El número de neuronas A9 espontáneamente activas permaneció constante o aumentó. Estos resultados son muy similares a los reportados previamente para la clozapina y enfatizan aún más el perfil farmacológico “atípico” de la olanzapina.
Humano contra el metabolismo animal: En especies animales (ratones, ratas y perros) utilizadas para la evaluación toxicológica, la olanzapina se metabolizó mediante hidroxilación aromática (formando metabolitos fenólicos y / o sus conjugados glucurónidos), oxidación alílica (alquilo), N-desalquilación y reacciones de N-oxidación.
Aunque las similitudes en el destino metabólico de la olanzapina en animales (ratones, ratas y perros) y humanos incluyen las vías de 2-alquil hidroxilación, N-desalquilación y N-oxidación, se pueden observar dos diferencias significativas. En primer lugar, la glucuronidación directa, que produce principalmente 10-N-glucurónido y, en menor medida, 4’-N-glucurónido, fue una vía metabólica significativa en los seres humanos. Estos N-glucurónidos estaban ausentes en especies animales excepto por una cantidad traza de 10-N-glucurónido en orina de perro. En segundo lugar, los metabolitos resultantes de la oxidación aromática no se encontraron en ningún fluido biológico humano.
El mono tampoco parecía formar 10-N-glucurónido, pero era similar a los humanos que aparentemente no formaban metabolitos como resultado del ataque oxidativo del anillo bencénico de la olanzapina.
CONTRAINDICACIONES: APO®-OLANZAPINA (olanzapina) está contraindicada en aquellos pacientes con hipersensibilidad conocida al medicamento o a los excipientes del producto.
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO
Advertencias y precauciones graves: “Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de LAPP o malabsorción de glucosa o galactosa no deben tomar este medicamento. Tener en cuenta en el tratamiento de los pacientes con diabetes mellitus”
Aumento de la mortalidad en pacientes ancianos con demencia: Los pacientes ancianos con demencia tratados con fármacos antipsicóticos atípicos tienen un mayor riesgo de muerte en comparación con el placebo. Los análisis de trece ensayos controlados con placebo con diversos antipsicóticos atípicos (duración modal de 10 semanas) en estos pacientes mostraron un aumento medio de 1,6 veces en la tasa de mortalidad en los pacientes tratados con medicamentos. Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecían ser de naturaleza cardiovascular (p. Ej., Insuficiencia cardíaca, muerte súbita) o infecciosa (p. Ej., Neumonía).
• General:
Síndrome neuroléptico maligno: El síndrome neuroléptico maligno (SNM) es un complejo sintomático potencialmente fatal que se ha notificado en asociación con fármacos antipsicóticos, incluida la olanzapina.
Las manifestaciones clínicas de NMS son hiperpirexia, rigidez muscular, alteración del estado mental y evidencia de inestabilidad autonómica (pulso o presión sanguínea irregular, taquicardia, diaforesis y disritmia cardíaca). Los signos adicionales pueden incluir creatinfosfoquinasa elevada, mioglobinuria (rabdomiólisis) e insuficiencia renal aguda.
Al llegar a un diagnóstico, es importante identificar los casos en los que la presentación clínica incluye enfermedades médicas graves (por ejemplo, neumonía, infección sistémica, etc.) y signos y síntomas extrapiramidales (EPS) no tratados o tratados inadecuadamente. Otras consideraciones importantes en el diagnóstico diferencial incluyen la toxicidad anticolinérgica central, el golpe de calor, la fiebre del fármaco y la patología primaria del sistema nervioso central.
El tratamiento de los SNM debe incluir 1) la interrupción inmediata de todos los fármacos antipsicóticos, incluida la olanzapina y otros medicamentos no esenciales para el tratamiento; 2) tratamiento sintomático intensivo y control médico; y 3) tratamiento de cualquier problema médico grave concomitante para el que haya tratamientos específicos disponibles. No existe un acuerdo general sobre el tratamiento farmacológico específico para los SNM no complicados.
Si un paciente requiere tratamiento con medicamentos antipsicóticos después de la recuperación del SNM, se debe considerar muy cuidadosamente la posible reintroducción del tratamiento. El paciente debe ser monitoreado cuidadosamente ya que se han reportado recurrencias de NMS.
Aumento de peso: La olanzapina se asoció con un aumento de peso durante los ensayos clínicos. Se observó un aumento de peso clínicamente significativo en todas las categorías basales del índice de masa corporal (IMC), otros eventos adversos observados durante los ensayos clínicos con olanzapina en todas las indicaciones, cambios de peso). El uso de datos combinados de pacientes tratados con olanzapina en el rango de dosificación de 5 mg a 20 mg por día fue de 5.4 kg de ganancia promedio.
El cambio medio en el peso fue comparable para los pacientes con esquizofrenia y manía bipolar. Un análisis retrospectivo de 573 pacientes que recibieron olanzapina durante hasta 3 años encontró que la dosis no era un predictor significativo de mayores cambios a largo plazo en el peso.
En los estudios a largo plazo (al menos 48 semanas), tanto la magnitud del aumento de peso como la proporción de pacientes tratados con olanzapina que tuvieron ganancia de peso clínicamente significativa fueron mayores que en los estudios a corto plazo. El porcentaje de pacientes que ganaron ≥25% de su peso corporal basal con exposición a largo plazo fue muy común (≥10%).
Regulación de temperatura corporal: La interrupción de la capacidad del cuerpo para reducir la temperatura corporal central se ha atribuido a los agentes antipsicóticos. Se recomienda una atención adecuada cuando se prescriba olanzapina para pacientes que experimentarán condiciones que pueden contribuir a una elevación de la temperatura central, por ejemplo, hacer ejercicio enérgico, exposición a calor extremo, recibir medicación concomitante con actividad anticolinérgica o estar sujetos a la deshidratación.
Efecto potencial en el rendimiento cognitivo y motor: Debido a que la olanzapina puede causar somnolencia, se debe advertir a los pacientes sobre la operación de maquinaria peligrosa, incluidos los vehículos de motor, hasta que estén razonablemente seguros de que la terapia con olanzapina no los afecta adversamente.
ABUSO Y ADICCIÓN: No aplica.
EMBARAZO Y LACTANCIA: No hay estudios adecuados y bien controlados en mujeres embarazadas. Se debe advertir a las pacientes que notifiquen a su médico si quedan embarazadas o si pretenden quedar embarazadas durante el tratamiento con olanzapina. Debido a que la experiencia humana en mujeres embarazadas es limitada, este medicamento debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Efectos no teratogénicos: Los neonatos expuestos a medicamentos antipsicóticos (incluida la olanzapina) durante el tercer trimestre del embarazo corren el riesgo de presentar síntomas extrapiramidales y / o de abstinencia después del parto. Ha habido informes de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria y trastorno de la alimentación en estos neonatos. Estas complicaciones han variado en severidad; mientras que en algunos casos los síntomas han sido autolimitados, en otros casos los neonatos han requerido el apoyo de la unidad de cuidados intensivos y la hospitalización prolongada.
Olanzapina no debe usarse durante el embarazo a menos que los beneficios esperados para la madre superen marcadamente los riesgos potenciales para el feto.
Labor de parto y Parto: El parto en ratas no se vio afectado por la olanzapina. El efecto de la olanzapina sobre el trabajo de parto y el parto en humanos no se conoce.
• Mujeres en lactancia:
Lactancia: En un estudio en mujeres sanas y lactantes, la olanzapina se excretó en la leche materna. La exposición media al lactante (mg / kg) en estado estacionario se estimó en el 1,8% de la dosis materna de olanzapina (mg / kg). Se debe advertir a los pacientes que no deben amamantar a un bebé si están tomando olanzapina.
REACCIONES ADVERSAS: Las frecuencias indicadas de eventos adversos representan la proporción de individuos que experimentaron al menos una vez, un evento adverso emergente del tratamiento del tipo mencionado. Un evento se consideró emergente del tratamiento si se produjo por primera vez o empeoró mientras recibía la terapia después de la evaluación inicial. Es importante enfatizar que aunque los eventos fueron reportados durante la terapia, no fueron necesariamente causados por la terapia.
Ensayo clínico Reacciones adversas a medicamentos: El prescriptor debe ser consciente de que las cifras en las tablas y tabulaciones no se pueden usar para predecir la incidencia de efectos secundarios en el curso de la práctica médica habitual donde las características del paciente y otros factores difieren de los que prevalecieron en los ensayos clínicos. Del mismo modo, las frecuencias citadas no se pueden comparar con las cifras obtenidas de otras investigaciones clínicas que implican diferentes tratamientos, usos e investigadores. Sin embargo, las cifras citadas brindan al médico que receta algunas bases para estimar la contribución relativa de los factores farmacológicos y no farmacológicos a la incidencia del efecto secundario en las poblaciones estudiadas.
• Incidencia de eventos adversos asociados con la interrupción:
Esquizofrenia y Trastornos Relacionados: En ensayos a corto plazo, controlados con placebo, no hubo diferencias estadísticamente significativas en las tasas de interrupción de la olanzapina o el placebo atribuidas a eventos adversos.
En general, el 5% de los pacientes tratados con olanzapina discontinuaron el tratamiento por eventos adversos en comparación con el 6% de los pacientes tratados con placebo. Sin embargo, las interrupciones debidas a elevaciones de ALT (SGPT) se consideraron relacionadas con el fármaco (2% para olanzapina versus 0% para placebo).
• Desorden bipolar:
Manía bipolar: En ensayos clínicos controlados con placebo a corto plazo, no hubo diferencias generales en la incidencia de interrupción debido a eventos adversos (2% para olanzapina versus 2% para placebo).
Mantenimiento Bipolar: En el ensayo clínico a largo plazo (1 año), controlado con placebo, de los 225 pacientes tratados con olanzapina, el 16% (n = 35) suspendió debido a un evento adverso, en comparación con el 9% (n = 12) de 136 pacientes tratados con placebo.
En el ensayo clínico controlado a largo plazo (1 año), de los 217 pacientes tratados con olanzapina, el 19% (n = 41) suspendió debido a un evento adverso, en comparación con el 26% (n = 55) de 214 pacientes tratados con litio.
Todos los ensayos a corto plazo: esquizofrenia y ensayos de manía bipolar: En ensayos clínicos controlados activos a corto plazo, de 1796 pacientes orales tratados con olanzapina en ensayos clínicos comparativos con haloperidol, 98 (5%) interrumpieron el tratamiento para eventos adversos en comparación con 66 de 810 (8%) pacientes tratados con haloperidol.
Todos los ensayos a corto plazo - Base de datos integrada de seguridad integral: En una base de datos de ensayos clínicos previa a la comercialización de 2.500 pacientes tratados con olanzapina, el 14,9% (372/2500) suspendió debido a un evento adverso. Alrededor de la mitad (183/372) de estas interrupciones se asociaron con la psicopatología subyacente. Otros eventos adversos más comunes (incidencia de 0.5% - 0.6%) informados como el motivo de interrupción entre los pacientes tratados con olanzapina fueron: aumento de la ALT (SGPT), embarazo no deseado, aumento de la creatina fosfocinasa y convulsiones.
• Incidencia de eventos adversos comúnmente observados:
Esquizofrenia y Trastornos Relacionados: En los ensayos controlados con placebo de esquizofrenia, los eventos adversos observados con mayor frecuencia asociados con el uso de olanzapina (incidencia de ≥ 5% y al menos dos veces placebo) fueron: mareos (11% para olanzapina versus 4% para placebo), estreñimiento (9 % frente a 3%), ALT (SGPT) aumentó (8% frente a 3%), trastorno de personalidad (8% frente a 4%), ganancia de peso (6% frente a 1%), acatisia (5% frente a 1%) y postural hipotensión (5% vs 2%).
• Desorden bipolar:
Manía bipolar: En los ensayos controlados con placebo de monoterapia con manía bipolar, los eventos adversos observados con mayor frecuencia asociados con el uso de olanzapina (incidencia de ≥ 5% y al menos dos veces placebo) fueron: somnolencia (35% frente a 13%), sequedad de boca (22% vs 7%), mareo (18% vs 6%), astenia (15% vs 6%), estreñimiento (11% vs 5%), dispepsia (11% vs 5%), aumento del apetito (6% vs 3%) y temblor (6% vs 3%).
En la combinación de manía bipolar controlada con placebo, los eventos adversos más comúnmente asociados con la combinación de olanzapina y litio o valproato (incidencia de ≥ 5% y al menos dos veces placebo) fueron: sequedad de boca (32% para combinación de olanzapina versus 9% para placebo), aumento de peso (26% vs 7%), aumento del apetito (24% vs 8%), mareo (14% vs 7%), dolor de espalda (8% vs 4%), estreñimiento (8% vs 4% ), trastorno del habla (7% frente a 1%), aumento de la salivación (6% frente a 2%), amnesia (5% frente a 2%) y parestesia (5% frente a 2%). Además de la última lista de eventos adversos identificados durante la combinación de manía bipolar, también se han identificado temblores de ensayos clínicos (≥ 10%).
Mantenimiento Bipolar: En el ensayo clínico controlado con placebo de un año de duración para recaída en el trastorno bipolar, los eventos adversos observados con mayor frecuencia asociados con olanzapina (incidencia de ≥ 5% y al menos dos veces placebo) fueron: aumento de peso (8% para olanzapina vs. 1.5% para el placebo), cefalea NOS (6.7% vs 2.9%), fatiga (6.2% vs 1.5%), depresión (5.8% vs 2.9%).
Otros ensayos de indicación: La marcha anormal y las caídas se han observado con mucha frecuencia (≥ 10%) en ensayos clínicos con pacientes ancianos con psicosis relacionada con la demencia. Además, la incontinencia urinaria y la neumonía se informaron comúnmente (≥ 1% y <10%) en estos pacientes.
En ensayos clínicos en pacientes con psicosis inducida por fármacos (agonista de la dopamina) asociada con la enfermedad de Parkinson, se informó un empeoramiento de la sintomatología parkinsoniana y alucinaciones con mucha frecuencia y con mayor frecuencia que con el placebo.
Eventos adversos que ocurren con una incidencia del 1% o más entre los pacientes tratados con olanzapina por vía oral: Ciertas partes de la discusión a continuación relacionadas con los parámetros de seguridad objetivos o numéricos se derivan de estudios en pacientes con esquizofrenia y no se han duplicado para los ensayos de trastorno bipolar. Sin embargo, esta información también es generalmente aplicable al trastorno bipolar.
La Tabla 1 enumera la incidencia de eventos adversos emergentes del tratamiento, redondeados al porcentaje más cercano, que ocurrieron durante la terapia aguda (hasta 6 semanas) de esquizofrenia en 1% o más de los pacientes tratados con olanzapina oral (dosis ≥ 2,5 mg / día) donde la incidencia en pacientes tratados con olanzapina fue mayor que la incidencia en pacientes tratados con placebo.
|
Tabla 1: Ensayos de esquizofrenia: incidencia de eventos adversos emergentes del tratamiento en ensayos clínicos controlados con placebo con olanzapina oral - fase aguda. |
||
|
Porcentaje de pacientes que informan el evento |
||
|
Sistema del cuerpo / Evento adverso |
Olanzapina (N=248) |
Placebo (N=118) |
|
Cuerpo como un todo |
||
|
Dolor de Cabeza |
17% |
15% |
|
Dolor |
10% |
9% |
|
Fiebre |
5% |
3% |
|
Dolor abdominal |
4% |
2% |
|
Dolor de espalda |
4% |
3% |
|
Dolor precordial |
4% |
2% |
|
Rigidez de cuello |
2% |
1% |
|
Daño Intencional |
1% |
0% |
|
Sistema Cardiovascular |
||
|
Hipotensión Postural |
5% |
2% |
|
Taquicardia |
4% |
1% |
|
Hipotensión |
2% |
1% |
|
Sistema Digestivo |
||
|
Estreñimiento |
9% |
3% |
|
Resequedad de labios |
7% |
4% |
|
Aumentó de Gamma glutamil transpeptidasa |
2% |
1% |
|
Aumento del apetito |
2% |
1% |
|
Hemático y Linfático |
||
|
Leucopenia |
1% |
0% |
|
Trastornos Metabólicos y nutricionales |
||
|
Aumento de SGPT |
8% |
3% |
|
Ganancia de peso2 |
6% |
1% |
|
Edema |
2% |
0% |
|
Edema Periférico |
2% |
0% |
|
Incremento de SGOT |
2% |
0% |
|
Aumento de la Creatinina Fosfoquinasa |
1% |
0% |
|
Sistema Musculoesquelético |
||
|
Artralgia |
3% |
2% |
|
Trastorno de Articulación |
2% |
1% |
|
Espasmos |
2% |
1% |
|
Sistema Nervioso |
||
|
Somnolencia2 |
26% |
15% |
|
Agitación |
23% |
17% |
|
Insomnio |
20% |
19% |
|
Nerviosismo |
16% |
14% |
|
Hostilidad |
15% |
14% |
|
Mareo2 |
11% |
4% |
|
Ansiedad |
9% |
8% |
|
Trastorno de Personalidad |
8% |
4% |
|
Acatisia2 |
5% |
1% |
|
Hipertonía |
4% |
3% |
|
Trastorno del habla |
4% |
1% |
|
Tremor |
4% |
3% |
|
Amnesia |
2% |
0% |
|
Dependencia de drogas |
2% |
0% |
|
Euforia |
2% |
0% |
|
Neurosis |
1% |
0% |
|
Sistema Respiratorio |
||
|
Rinitis |
10% |
6% |
|
Aumento de Tos |
5% |
3% |
|
Faringitis |
5% |
3% |
|
Piel y anexos |
||
|
Dermatitis Micotica |
2% |
0% |
|
Erupción vesicular |
2% |
1% |
|
Sentidos Especiales |
||
|
Ambliopía |
5% |
4% |
|
Blefaritis |
2% |
1% |
|
Trastorno Ocular |
2% |
1% |
|
Lesión corneal |
1% |
0% |
|
Sistema Urogenital |
||
|
Desordenes menstruales3 |
2% |
0% |
|
1. Los siguientes eventos tuvieron una incidencia igual o menor que el placebo: sueños anormales, lesión accidental, anorexia, apatía, astenia, rigidez de las ruedas dentadas, confusión, conjuntivitis, depresión, diarrea, dismenorrea3, dispepsia, equimosis, labilidad emocional, alucinaciones, hipercinesia. , hipertensión, hipocinesia, aumento de la libido, mialgia, náuseas, reacción paranoide, parestesia, prurito, erupción cutánea, reacción esquizofrénica, sudoración, pensamiento anormal, caries en los dientes, vaginitis3, vómitos. 2. Estadísticamente significativamente más frecuente en pacientes tratados con olanzapina que en pacientes tratados con placebo. 3. El denominador utilizado fue solo para mujeres (N = 4 l de Olanzapina, N = 23 de Placebo). |
||
Otros eventos adversos de los ensayos de esquizofrenia: Ciertas partes de la discusión a continuación relacionadas con parámetros de seguridad numéricos o objetivos, a saber, cambios en el signo vital, aumento de peso, cambios de laboratorio y cambios en el ECG se derivan de estudios en pacientes con esquizofrenia y no se han duplicado para la manía bipolar. Sin embargo, esta información también se aplica generalmente a la manía bipolar.
Cambios de peso: Durante la terapia aguda (hasta 6 semanas) en ensayos clínicos controlados que comparaban olanzapina con placebo en el tratamiento de la esquizofrenia, los porcentajes de pacientes con aumento de peso ≥ 7% del peso corporal inicial en cualquier momento fueron 29% para olanzapina y 3% para placebo , que fue una diferencia estadísticamente significativa. El aumento de peso promedio durante la terapia aguda en pacientes tratados con olanzapina fue de 2,8 kg. Se observó un aumento de peso clínicamente significativo en todas las categorías del índice basal de masa corporal (IMC). En los ensayos de esquizofrenia de extensión a largo plazo, hubo una ganancia promedio de 5,4 kg, y el 56% de los pacientes tratados con olanzapina con un aumento de peso> 7% del peso corporal basal. En los ensayos de mantenimiento bipolar de extensión a largo plazo, hubo un aumento de peso medio de 3,8 kg y un 31% de pacientes tratados con olanzapina con un aumento de peso> 7% del peso corporal basal.
Cambios de signos vitales: En ensayos clínicos controlados con placebo, se produjo hipotensión ortostática (disminución de más de 30 mm en la presión arterial sistólica) con una incidencia del 5% en pacientes tratados con olanzapina por vía oral en comparación con el 2% en pacientes tratados con placebo (las mediciones de signos vitales 7 días de tratamiento con olanzapina). La olanzapina oral se asoció con un valor inicial medio hasta el aumento del punto final en la frecuencia cardíaca de 2.4 latidos por minuto en comparación con ningún cambio entre los pacientes tratados con placebo.
Cambios de laboratorio: La olanzapina se asocia con aumentos asintomáticos en SGPT, SGOT y GGT.
La olanzapina también se asocia con aumentos generalmente leves en la prolactina sérica, que generalmente disminuye con el tratamiento farmacológico continuo. La olanzapina también se asocia con elevaciones asintomáticas de eosinófilos y ácido y con descensos en el bicarbonato sérico.
Cambios de ECG: Las comparaciones entre grupos para los ensayos controlados con placebo agrupados revelaron diferencias no estadísticamente significativas de olanzapina / placebo en las proporciones de pacientes que experimentaron cambios potencialmente importantes en los parámetros de ECG, incluidos los intervalos QT, QTc y PR.
Otros eventos adversos observados durante los ensayos clínicos con olanzapina en todas las indicaciones La siguiente discusión se relaciona principalmente con el aumento de peso, los lípidos y los cambios de glucosa observados durante los ensayos clínicos en todas las indicaciones.
Cambios de peso: El aumento de peso se ha observado con mucha frecuencia en pacientes tratados con olanzapina durante los ensayos clínicos. En 13 estudios de monoterapia con olanzapina controlados con placebo, el 22.2% de los pacientes tratados con olanzapina ganaron ≥ 7% de su peso corporal basal versus el 3% de los pacientes tratados con placebo, con una mediana de exposición al evento de 8 semanas; El 4,2% de los pacientes tratados con olanzapina ganaron ≥ 15% de su peso basal versus el 0,3% de los pacientes tratados con placebo, con una mediana de exposición al evento de 12 semanas. Se observó un aumento de peso clínicamente significativo en todas las categorías del índice basal de masa corporal (IMC).
En los estudios a largo plazo (al menos 48 semanas), tanto la magnitud del aumento de peso como la proporción de pacientes tratados con olanzapina que tuvieron ganancia de peso clínicamente significativa fueron mayores que en los estudios a corto plazo.
El porcentaje de pacientes que ganaron ≥ 25% de su peso corporal basal con exposición a largo plazo fue muy común (≥ 10%).
Lípidos: En ensayos clínicos controlados con placebo de hasta 12 semanas de duración, los pacientes tratados con olanzapina tuvieron un mayor aumento medio en el colesterol total en ayunas, el colesterol LDL y los triglicéridos en comparación con los pacientes tratados con placebo.
Los aumentos medios en los valores de lípidos en ayunas (colesterol total, colesterol LDL y triglicéridos) fueron mayores en pacientes sin evidencia de desregulación lipídica al inicio del estudio. Sin embargo, para los cambios medios en los triglicéridos en ayunas, la diferencia entre la olanzapina y el placebo fue mayor en los pacientes con evidencia de desregulación de los lípidos al inicio del estudio. Las elevaciones en los niveles de triglicéridos en ayunas ≥ 11.3 mmol / L se observaron de forma poco común con el uso de olanzapina (duración mediana de exposición de 8 semanas).
|
Tabla 3: Cambios en los valores de lípidos en ayunas de estudios de monoterapia con olanzapina controlada con placebo en adultos con duración del tratamiento de hasta 12 semanas |
||
|
Análisis de Laboratorio |
Olanzapina* |
Placebo |
|
Triglicéridos: ayuno normal a alto (<1.70 mmol / L a ≥ 2.26 mmol / L) |
9.2% (N = 457) |
4.4% (N = 251) |
|
Triglicéridos: límite de ayuno a alto (≥ 1.70 mmol / L y <2.26 mmol / L a ≥ 2.26 mmol / L) |
39.3% (N = 135) |
20.0% (N = 65) |
|
Colesterol-Total: ayuno normal a alto (<5.18 mmol / L a ≥ 6.22 mmol / L) |
2.8% (N = 392) |
2.4% (N = 207) |
|
Colesterol-Total: límite de ayuno a alto (≥ 5,18 mmol / L y <6,22 mmol / L a ≥ 6,22 mmol / L) |
23.0% (N = 222) |
12.5% (N = 112) |
|
Colesterol LDL: ayuno normal a alto (<2.59 mmol / l a ≥ 4.14 mmol / l) |
0% (N = 154) |
1.2% (N = 82) |
|
Colesterol LDL: límite de ayuno a alto (≥2.59 mmol / L y <4.14 mmol / L a ≥ 4.14 mmol / L) |
10.6% (N = 302) |
8.1% (N = 173) |
|
* Duración mediana de exposición 8 semanas. |
||
Para el colesterol HDL en ayunas, no se observaron diferencias estadísticamente significativas entre los pacientes tratados con olanzapina y los pacientes tratados con placebo.
La proporción de pacientes que presentaron cambios en el colesterol total, colesterol LDL o triglicéridos de normal o límite a alto, o cambios en el colesterol HDL de normal o borderline a bajo, fue mayor en los estudios a largo plazo (al menos 48 semanas) en comparación con estudios a corto plazo. Se observaron cambios clínicamente significativos emergentes del tratamiento en los lípidos en ayunas en pacientes con o sin evidencia de dislipidemia al inicio del estudio.
Cambios de glucosa: En ensayos clínicos (hasta 52 semanas), la olanzapina se asoció con un cambio medio mayor en la glucosa con respecto al placebo.
La diferencia en los cambios medios entre olanzapina y placebo fue mayor en pacientes con evidencia de desregulación de glucosa al inicio (incluidos aquellos pacientes diagnosticados con diabetes mellitus o que cumplían criterios sugestivos de hiperglucemia), y estos pacientes tuvieron un mayor aumento de HbA1c en comparación con placebo.
En pacientes con niveles basales normales de glucosa en ayunas (<5.5 mmol / L), 2.2% (N = 543) de aquellos tratados con olanzapina (duración mediana de exposición de 8 semanas) tenían niveles altos de glucosa (≥ 6.99 mmol / L) durante el tratamiento con olanzapina versus el 3,4% (N = 293) de los tratados con placebo. En pacientes con niveles basales de glucosa en ayunas límite (≥ 5,5 mmol / L y <6,99 mmol / L), el 17,4% (N = 178) de los tratados con olanzapina (duración media de exposición de 5 semanas) tenían niveles altos de glucosa ( ≥ 6.99 mmol / L) durante el tratamiento con olanzapina versus el 11.5% (N = 96) de aquellos tratados con placebo.
La proporción de pacientes que tuvieron un cambio en el nivel de glucosa de normal o límite al inicio del estudio a alto aumentó con el tiempo. Se observaron cambios clínicamente significativos emergentes del tratamiento en la glucosa en ayunas en pacientes con o sin evidencia de desregulación de la glucosa al inicio del estudio.
La glucosuria se informó comúnmente en pacientes tratados con olanzapina durante los ensayos clínicos.
Prolactina: En ensayos clínicos controlados (hasta 12 semanas), se observaron elevaciones de la prolactina en el 30% de los pacientes tratados con olanzapina en comparación con el 10,5% de los pacientes tratados con placebo. En la mayoría de estos pacientes, las elevaciones fueron leves. En pacientes con esquizofrenia, los eventos adversos relacionados con la menstruación potencialmente asociados con las elevaciones de prolactina1 fueron comunes (<10% a ≥ 1%), mientras que los eventos adversos relacionados con la función sexual y la mama fueron poco frecuentes (<1% a ≥ 0.1%).
En pacientes tratados por otras enfermedades mentales2, los eventos adversos relacionados con la función sexual (disfunción eréctil, disminución de la libido, pérdida de la libido, orgasmo anormal) potencialmente asociados con elevaciones de prolactina fueron comunes (<10% a ≥ 1%), mientras que los relacionados con la mama y los eventos adversos relacionados con la menstruación fueron infrecuentes (<1% a ≥ 0.1%).
(1) Análisis de TEAEs hasta 52 semanas de tratamiento
(2) Depresión bipolar, depresión psicótica, trastorno límite de la personalidad y manía bipolar
Cambios de signos vitales: La bradicardia se observó de forma poco común en los ensayos clínicos.
Reacciones de fotosensibilidad: Las reacciones de fotosensibilidad se observaron poco en los ensayos clínicos.
La Tabla 4 resume los términos de la reacción adversa al fármaco central y sus frecuencias identificadas a partir de una base de datos integrada de 42 estudios clínicos de olanzapina completa en adultos, que consiste en 7787 pacientes expuestos a olanzapina en estudios clínicos controlados con placebo o comparador.
|
Tabla 4: Reacciones adversas centrales a medicamentos de ensayos clínicos de olanzapina |
|||||
|
Parte del cuerpo / evento adverso |
Frecuencia |
||||
|
≥ 10% |
< 10% y ≥ 1% |
<1% y ≥0.1% |
<0.1% y ≥ 0.01% |
<0.01% |
|
|
Cuerpo como un todo |
|||||
|
Pirexia |
x |
||||
|
Cardiovascular |
|||||
|
Hipotensión ortostatica |
x |
||||
|
Sistema Digestivo |
|||||
|
Distension Abdominal |
x |
||||
|
Sistema Musculoesqueletico |
|||||
|
Artralgia |
x |
||||
|
Sistema Nervioso |
|||||
|
Amnesia |
x |
||||
|
Trastornos Respiratorios |
|||||
|
Epistaxis |
x |
||||
|
Analisis de Laboratorio |
|||||
|
Quimica Clinica |
|||||
|
Aumento Fosfatasa alcalina |
x |
||||
|
Incremento de la Gama- Glutamiltransferasa |
x |
||||
|
Incremento de Acido Urico |
x |
||||
|
Hematología |
|||||
|
Leucopenia, Neutropenia |
x |
||||
|
1 Según lo evaluado por los valores medidos dentro de la base de datos de ensayos clínicos. |
|||||
Eventos adversos dependientes de la dosis: Se evaluó la relación con la dosis de los eventos adversos utilizando datos de un ensayo clínico con un rango de dosis fijo. La Tabla 5 enumera los eventos adversos emergentes del tratamiento en los que hubo una respuesta dosis-dosis estadísticamente significativa en este ensayo clínico.
|
Tabla 5: Ensayos de esquizofrenia: eventos adversos dependientes de la dosis en un rango de dosis fijo, ensayo clínico controlado con placebo1 de olanzapina oral. |
||||
|
Porcentaje de pacientes que informan el evento |
||||
|
Sistema del cuerpo / Evento adversos |
Placebo (N=68) |
Olanzapina 5 ± 2.5 mg/day (N=65) |
Olanzapina 10 ± 2.5 mg/day (N=64) |
Olanzapina 15 ± 2.5 mg/day (N=69) |
|
Sistema Digestivo |
||||
|
Estreñimiento |
0% |
6.2% |
9.4% |
14.5% |
|
Sistema Nervioso |
||||
|
Sueño Anormal |
0% |
0% |
1.6% |
4.3% |
|
Porcentaje de pacientes que informan el evento |
||||
|
Sistema del cuerpo / Evento adversos |
Placebo (N=68) |
Olanzapina 5 ± 2.5 mg/day (N=65) |
Olanzapina 10 ± 2.5 mg/day (N=64) |
Olanzapina 15 ± 2.5 mg/day (N=69) |
|
Mareo |
2.9% |
7.7% |
9.4% |
17.4% |
|
Somnolencia |
16.2% |
20.0% |
29.7% |
39.1% |
|
Sistema Respiratorio |
||||
|
Faringitis |
1.5% |
3.1% |
1.6% |
10.1% |
|
1 La dermatitis fúngica también se notificó con una respuesta a la dosis que aumentaba de forma estadísticamente significativa, pero no se incluye como una causa de fármaco remota. |
||||
La Tabla 6 enumera los eventos adversos emergentes del tratamiento de un ensayo aleatorio, doble ciego, de dosis fija de 8 semanas que comparó 10 (N = 199), 20 (N = 200) y 40 (N = 200) mg / día de olanzapina en pacientes con esquizofrenia o trastorno esquizoafectivo. Se observaron diferencias estadísticamente significativas entre los 3 grupos de dosis para los siguientes resultados de seguridad: fatiga, mareos, elevación de prolactina y ganancia de peso (cambio promedio).
|
Tabla 6: Prueba de esquizofrenia: eventos adversos dependientes de la dosis en una dosis fija, ensayo clínico controlado con placebo de olanzapina oral1 |
|||
|
Evento Adverso |
Olanzapina 10 mg/día (N = 195) |
Olanzapina 20 mg/día (N = 191) |
Olanzapina 40 mg/día (N = 197) |
|
Fatiga2,3 (% evento de informe) |
1.5% |
2.1% |
6.6% |
|
Mareos3 (% de evento de informe) |
2.6% |
1.6% |
6.6% |
|
Elevación de prolactina2,3,4 (% de evento informante) |
31.2% |
42.7% |
61.1% |
|
Elevación de prolactina2,3,4 (% de evento informante) |
-10.5 ng/mL |
-1.7 ng/mL |
4.9 ng/mL |
|
Aumento de peso ≥ 7% en cualquier momento (% de evento de informe) |
14.0% |
18.4% |
20.5% |
|
Weight Gain2 (cambio promedio desde el inicio hasta el punto final) |
1.9 kg |
2.3 kg |
3.0 kg |
|
1. Estudio HGLF: 8 semanas, Fase IV, paralelo, aleatorizado, doble ciego, estudio de dosis fija en pacientes con esquizofrenia y trastorno esquizoafectivo que evalúa la eficacia de dosis-respuesta y la seguridad de la olanzapina 10, 20 y 40 mg / día . Los pacientes fueron titulados hasta su dosis aleatoria durante 2 semanas. 2. diferencia significativa entre 10 vs. 40 mg / día 3. diferencia significativa entre 20 vs. 40 mg / día 4.> 24.2 ng / mL (femenino) o> 18.77 ng / mL (masculino) en cualquier momento durante la prueba. |
|||
Incidencia del tratamiento: síntomas extrapiramidales emergentes: La Tabla 7 enumera el porcentaje de pacientes con síntomas extrapiramidales emergentes del tratamiento evaluados mediante análisis categóricos de escalas de calificación formales durante la terapia aguda en un ensayo clínico controlado que compara la olanzapina oral en 3 rangos de dosis fijos con placebo en el tratamiento de la esquizofrenia.
|
Tabla 7: Prueba de esquizofrenia: síntomas extrapiramidales emergentes del tratamiento evaluados mediante la escala de clasificación Incidencia en un rango de dosis fijo, ensayo clínico controlado con placebo - Fase aguda1 |
|||||||
|
Porcentaje de Pacientes |
|||||||
|
Placebo |
Olanzapina 5 ± 2.5 mg/day |
Olanzapina 10 ± 2.5 mg/day |
Olanzapina 15 ± 2.5 mg/day |
||||
|
Parkinsonism2 |
15% |
14% |
12% |
14% |
|||
|
Akathisia3 |
23% |
16% |
19% |
27% |
|||
|
1. Sin diferencias estadísticamente significativas. 2. Porcentaje de pacientes con una puntuación total de la escala Simpson-Angus ≥ 3. 3. Porcentaje de pacientes con una puntuación global de la Escala de Akathisia de Barnes ≥ 2. |
|||||||
La Tabla 8 enumera el porcentaje de pacientes con síntomas extrapiramidales emergentes del tratamiento evaluados por eventos adversos informados espontáneamente durante la terapia aguda en el mismo ensayo clínico controlado que compara los rangos de dosis fijas de Olanzapinaat oral con placebo en el tratamiento de la esquizofrenia. Se encontraron resultados similares durante el ensayo de mantenimiento bipolar a largo plazo (hasta 1 año) a doble ciego y la comparación con Olanzapina con placebo; hubo una mayor incidencia estadística de acatisia para las dosis combinadas de Olanzapinaversus placebo.
|
Tabla 8: Ensayos de esquizofrenia: síntomas extrapiramidales emergentes del tratamiento evaluados por incidencia de eventos adversos en un rango de dosis fija oral, ensayo clínico controlado con placebo - fase aguda1 |
||||
|
Síntomas extrapiramidales |
Porcentaje de paciente que reportaron un evento |
|||
|
Placebo (N = 68) |
Olanzapina 5 ± 2.5 mg/day (N = 65) |
Olanzapina 10 ± 2.5 mg/day (N = 64) |
Olanzapina 15 ± 2.5 mg/day (N = 69) |
|
|
Eventos diatónicos 2 |
1% |
3% |
2% |
3% |
|
Eventos de Parkinson3 |
10% |
8% |
14% |
20% |
|
Eventos de acatisia4 |
1% |
5% |
11%1 |
10%1 |
|
Eventos diskinesicos5 |
4% |
0% |
2% |
1% |
|
Eventos residuales6 |
1% |
2% |
5% |
1% |
|
Cualquier evento extrapiramidal |
16% |
15% |
25% |
32%1 |
|
1. Estadísticamente significativamente diferente del placebo. 2. Los pacientes con los siguientes términos COSTART se contaron en esta categoría: distonía, espasmo generalizado, rigidez del cuello, crisis oculógira, opistótonos, tortícolis. 3. Los pacientes con los siguientes términos COSTART se contaron en esta categoría: acinesia, rigidez de las ruedas dentadas, síndrome extrapiramidal, hipertonía, hipocinesia, facies enmascarada, temblor. 4. Los pacientes con los siguientes términos de COSTART se contaron en esta categoría: acatisia, hipercinesia. 5. Los pacientes con los siguientes términos COSTART se contaron en esta categoría: síndrome buccogloso, coreoatetosis, discinesia, discinesia tardía. 6. Los pacientes con los siguientes términos COSTART se contaron en esta categoría: trastorno del movimiento, mioclono, espasmos. |
||||
Otros ensayos de investigación:
Eventos adversos cerebrovasculares (ACV) en pacientes ancianos con demencia: Los datos de 5 ensayos controlados con placebo en pacientes ancianos con psicosis relacionada con la demencia (Alzheimer, vascular y mixto; olanzapina n = 1178 y placebo n = 478) sugieren que hubo una mayor incidencia de CVAE en pacientes tratados con olanzapina en comparación con pacientes tratados con placebo (1.3% vs. 0.4%, respectivamente). Aunque la incidencia de CVAE no fue significativamente diferente cuando se analizó con la prueba exacta de Fisher (p = 0.177), la diferencia fue significativa al controlar simultáneamente la edad, el sexo y el tipo de demencia mediante la regresión de Poisson (p = 0.0428).
Cuatro pacientes murieron en el grupo de olanzapina versus 1 paciente en el grupo de placebo. En los ensayos de seguridad abiertos que se estudiaron durante hasta 59 semanas en pacientes con demencia (N = 231), se informaron 7 casos de CVAE, incluidas 2 muertes.
Los datos de estos ensayos sugieren que los pacientes con un diagnóstico de demencia de tipo vascular o mixto tenían una probabilidad 5 veces mayor de experimentar CVAE que los pacientes con un diagnóstico de Alzheimer. No hay información suficiente para determinar si los CVAE en pacientes ancianos con demencia están asociados específicamente con olanzapina o con todos los agentes antipsicóticos.
La olanzapina no está aprobada para su uso en pacientes ancianos con demencia.
Mortalidad general: Los pacientes de edad avanzada con demencia tratados con fármacos antipsicóticos atípicos mostraron una mayor mortalidad en comparación con el placebo en un metanálisis de 13 ensayos controlados de diversos fármacos antipsicóticos atípicos. En cinco ensayos controlados con placebo con olanzapina oral en esta población, la incidencia de mortalidad fue del 3,5% para los pacientes tratados con olanzapina en comparación con el 1,5% para los pacientes tratados con placebo. Olanzapina no está indicado en pacientes ancianos con demencia.
Cambios de laboratorio: En 5 ensayos clínicos doble ciego controlados con placebo de pacientes ancianos con psicosis relacionada con la demencia (n = 1184 total en los brazos de olanzapina yn = 478 en total en brazos con placebo), los pacientes tratados con olanzapina mostraron tasas de incidencia significativamente mayores en comparación con placebo. pacientes tratados con albúmina baja (10.4% vs 5.5%, respectivamente), baja hemoglobina (4.2% vs 1.8%) y bajo hematocrito (4.6% vs 2.4%). De los pacientes que tenían bajos valores de albúmina, el 3,6% en el grupo tratado con olanzapina frente al 1,4% en los tratados con placebo también experimentaron una infección respiratoria emergente del tratamiento.
No se ha determinado una relación causal entre los dos eventos adversos.
Eventos adversos en pacientes adolescentes (edades de 13 a 17 años): Los tipos de eventos adversos observados en pacientes adolescentes tratados con olanzapina fueron similares a los observados en pacientes adultos. Aunque no se realizaron ensayos clínicos diseñados para comparar adolescentes con adultos, los datos de los ensayos en adolescentes se compararon con los de los ensayos en adultos.
El aumento medio del peso en adolescentes (4,6 kg durante 3 semanas de duración media de la exposición) fue mayor que en adultos (2,6 kg durante 7 semanas de duración media de la exposición).
En estudios a largo plazo (al menos 24 semanas), tanto la magnitud del aumento de peso como la proporción de pacientes adolescentes tratados con olanzapina que tuvieron un aumento de peso clínicamente significativo fueron mayores que en los estudios a corto plazo y fueron mayores que en pacientes adultos con resultados comparables exposiciones.
Con la exposición a largo plazo, aproximadamente la mitad de los pacientes adolescentes ganaron ≥ 15% y casi un tercio ganaron ≥ 25% de su peso corporal inicial. Entre los pacientes adolescentes, el aumento de peso medio fue mayor en los pacientes con sobrepeso u obesidad al inicio del estudio.
Los aumentos medios en la glucosa en ayunas fueron similares en adolescentes y adultos tratados con olanzapina; sin embargo, la diferencia entre los grupos de olanzapina y placebo fue mayor en adolescentes que en adultos.
En estudios a largo plazo (al menos 24 semanas), los cambios en la glucosa desde normal al inicio hasta alto fueron poco frecuentes (<1% y ≥ 0,1%).
Los incrementos promedio en el colesterol total en ayunas, el colesterol LDL y los triglicéridos fueron generalmente mayores en adolescentes que en adultos tratados con olanzapina. Sin embargo, en ensayos a corto plazo, las diferencias entre la olanzapina y el placebo fueron similares para adolescentes y adultos. La proporción de cambios clínicamente significativos emergentes del tratamiento en el colesterol total, el colesterol LDL y los triglicéridos en ayunas normales a altos o en el límite entre altos fue mayor en adolescentes que en adultos, y las diferencias entre olanzapina y placebo en estas categorías de valores de laboratorio también fueron generalmente mayores en adolescentes. En estudios a largo plazo, se observaron cambios clínicos clínicamente significativos en el tratamiento del colesterol total, el colesterol LDL y los triglicéridos en adolescentes con o sin evidencia de dislipidemia al inicio del estudio.
En comparación con los adultos, los adolescentes tratados con olanzapina experimentaron una incidencia significativamente mayor de niveles elevados de prolactina (47% en adolescentes tratados con olanzapina frente a 30% en adultos tratados con olanzapina) y aumentos significativamente mayores en los niveles de prolactina.
Las elevaciones de la aminotransferasa hepática (3 veces el límite superior de la normalidad) son más frecuentes en adolescentes (12.1%) que en adultos (5.4%).
Los eventos relacionados con la sedación son más comunes en adolescentes (44%) que en adultos (29%).
La Tabla 11 resume los términos principales de reacción adversa al fármaco para la olanzapina en comparación con el placebo y sus frecuencias identificadas solo durante los ensayos clínicos en pacientes adolescentes (edades de 13 a 17 años). Olanzapina no está indicado en pacientes adolescentes (edades de 13 a 17 años).
|
Tabla 11: Reacciones adversas principales de fármacos y frecuencias de ensayos clínicos en pacientes adolescentes (edades de 13 a 17 años). |
||||
|
Sistema del cuerpo/evento Adverso |
Olanzapina |
Placebo |
||
|
Frecuencia |
N |
Frecuencia |
N |
|
|
Cuerpo total |
||||
|
Aumento de peso ≥7% del peso corporal basal (kg) 7 |
40.6% |
197 |
9.8% |
112 |
|
Aumento de peso ≥15% del peso corporal basal (kg) 8 |
7.1% |
197 |
2.7% |
112 |
|
Sistema Digestivo |
||||
|
Resequedad Labial |
6.15% |
179 |
0% |
89 |
|
Aumento de Apetito |
24% |
179 |
6% |
89 |
|
Sistema Nervioso |
||||
|
Sedación 1 |
44.1% |
179 |
9% |
89 |
|
Química Clinica |
||||
|
ALT / SGPT> 3X ULN todos los pacientes asignados al azar con ALT basal <= 3X ULN 2 |
12.1% |
174 |
2.3% |
87 |
|
Sistema del cuerpo / Término de reacción adversa |
Olanzapina |
Placebo |
||
|
AST / SGOT: aumento 3 |
27.6% |
163 |
3.8% |
79 |
|
Bilirrubina total -Decreto 4 |
22.1% |
154 |
6.7% |
75 |
|
GGT - Incrementado 5 |
10.1% |
169 |
1.2% |
83 |
|
Prolactina: aumento 6 |
47.4% |
116 |
6.8% |
59 |
|
Colesterol - total, ayuno normal a alto (<4.40 mmol / L a ≥ 5.18 mmol / L) 9 |
6.9% |
87 |
2.3% |
43 |
|
Colesterol total, límite de ayuno a alto (≥ 4,40 mmol / L y <5,18 mmol / L a ≥ 5,18 mmol / L) 9 |
38.9% |
36 |
7.7% |
13 |
|
Colesterol LDL: ayuno normal a alto (<2.85 mmol / L a ≥ 3.37 mmol / L) |
5.1% |
98 |
4.5% |
44 |
|
Colesterol LDL: límite de ayuno a alto (≥ 2,85 mmol / L y <3,37 mmol / L a ≥ 3,37 mmol / L) |
48.3% |
29 |
0% |
9 |
|
Triglicéridos, ayuno normal a alto (<1.02 mmol / L a> 1.47 mmol / L) 9 |
26.9% |
67 |
10.7% |
28 |
|
Triglicéridos, el límite de ayuno a alto (≥ 1,02 mmol / L y ≤ 1,47 mmol / L a> 1,47mmol/L) 9 |
59.5% |
37 |
35.3% |
17 |
|
Glucosa, ayuno normal a alto (<5.55 mmol / L a ≥ 6.99 mmol / L) 9 |
0% |
124 |
1.9% |
53 |
|
Glucosa, el límite de ayuno a alto (≥ 5,55 mmol / L y <6,99 mmol / L a ≥ 6,99 mmol / L) 10 |
14.3% |
14 |
0% |
13 |
|
1 Representó un grupo de términos de MedDRA que incluyen: hipersomnia, letargo, sedación, somnolencia. 2 rangos de referencia de Covance: bajo alto (U / L) Mujer 13 - ≤ 17.999 6 34 (U / L) Masculino 13 - ≤ 17.999 6 43 3 rangos de referencia de Covance: bajo alto (U / L) Mujer 13 - ≤ 17.999 10 40 (U / L) Masculino 13 - ≤ 17.999 10 40 4 rangos de referencia de Covance: bajo alto (mmol / L) Mujer 13 - ≤ 17.999 3 21 (mmol / L) Macho 13 - ≤ 17.999 3 21 5 rangos de referencia de Covance bajo alto (U / L) Mujer 13 - ≤ 17.999 0 33 (U / L) Masculino 13 - ≤ 17.999 0 51 6 Rangos de referencia de Covance para la prolactina publicados por Wiedemann y Jonetz-Mentzel (1993) Femenino: 12 a 14 años: 2.52 - 16.90 ng / ml 14 a 19 años: 4.20 - 39.00 ng / mL Masculino: de 12 a 14 años: 2.84 - 24.00 ng / mL 14 a 19 años: 2.76 - 16.10 ng / ml 7 Duración mediana de la exposición al evento = 4 semanas 8 Duración mediana de la exposición al evento = 19 semanas 9 La duración mediana de la exposición fue de 3 semanas 10 La duración mediana de la exposición fue de 5 semanas |
||||
Reacciones adversas a los medicamentos posteriores al mercado: La Tabla 12 resume los términos centrales de la reacción adversa al medicamento y sus frecuencias identificadas de la vigilancia global posterior a la comercialización, además de lo que se informó en los ensayos clínicos. No se ha establecido una relación causal entre la olanzapina y la aparición de estos eventos.
|
Sistema del cuerpo / Término de reacción adversa |
Frequencia |
|||
|
≥ 10% |
< 10% and ≥ 1% |
< 1% and ≥ 0.1% |
< 0.1% and ≥ 0.01% |
< 0.01% |
|
Cuerpo completo |
||||
|
Reacción alérgica 2 |
X |
|||
|
Reacción de descontinuación 3 |
X |
|||
|
Cardiovascular |
X |
|||
|
Tromboembolismo venoso, que incluye Embolia Pulmonar y Vena Profunda Trombosis |
X |
|||
|
Sistema Digestivo |
||||
|
Pancreatitis |
X |
|||
|
Hematológico |
||||
|
Trombocitopenia 4 |
X |
|||
|
Desordenes Hepatobiliares |
||||
|
Hepatitis |
X |
|||
|
Ictericia |
X |
|||
|
Falla Hepatica |
X |
|||
|
Metabolico |
||||
|
Coma Diabetico |
X |
|||
|
Cetoacidosis diabética 5 |
X |
|||
|
Hipercolesterolemia 7 |
X |
|||
|
Hiperglicemia |
X |
|||
|
Hipertrigliceridemia 6,7 |
X |
|||
|
Exacerbación de diabetes preexistente |
X |
|||
|
Sistema Musculoesqueletico |
||||
|
Rabdomiolisis |
X |
|||
|
Sistema Nervioso |
||||
|
Síndrome de piernas inquietas (RLS)8 |
X |
|||
|
Convulsiones |
X |
|||
|
Piel y apendices |
||||
|
Alopecia |
X |
|||
|
Reacción farmacológica con eosinofilia y síntomas sistémicos (DRESS) |
X |
|||
|
Rash |
X |
|||
|
Sistema Urogenital |
||||
|
Priapismo |
X |
|||
|
Incontinencia Urinaria |
X |
|||
|
Retención Urinaria |
X |
|||
|
Análisis de Laboratorio |
||||
|
Quimica Clinica |
||||
|
Incremento total de Bilirrubina |
X |
|||
|
1. Evento adverso identificado a partir de la vigilancia espontánea posterior a la comercialización. 2. por ejemplo, exantema maculopapular, reacción anafilactoide, angioedema, pruritis o urticaria. 3. es decir, diaforesis, náuseas o vómitos. 4. Incluyendo un caso de púrpura trombocitopénica. 5. El término COSTART es la acidosis diabética. 6. El término COSTART es hiperlipemia. 7. Raramente se informaron niveles de colesterol aleatorio de ≥ 6,22 mmol / L y niveles de triglicéridos aleatorios de ≥11,30 mmol / L. 8. Evento adverso identificado a partir de informes espontáneos posteriores a la comercialización con frecuencia determinada mediante la base de datos de ensayos clínicos de olanzapina |
||||
Al igual que con otros antipsicóticos atípicos, se han publicado informes posteriores a la comercialización con olanzapina de eventos adversos graves relacionados con el sistema cardiovascular, que incluyen muertes.
Se han informado casos de neutropenia, granulocitopenia y agranulocitosis durante el uso de antipsicóticos. Por lo tanto, se recomienda que a los pacientes se les haga un conteo sanguíneo completo (CBC, por sus siglas en inglés) antes de comenzar la olanzapina y luego periódicamente durante el tratamiento.
El tromboembolismo venoso (TEV), incluida la embolia pulmonar mortal, se ha notificado con medicamentos antipsicóticos, incluida la olanzapina. Sin embargo, dado que los pacientes que requieren tratamiento con antipsicóticos a menudo presentan factores de riesgo adquiridos de TEV, se deben identificar todos los factores de riesgo posibles de TEV, por ejemplo, inmovilización, y tomar medidas preventivas.
Se debe advertir a los pacientes sobre el riesgo de estreñimiento severo durante el tratamiento con olanzapina, y que deben informar a su médico si se produce estreñimiento o empeora, ya que pueden necesitar laxantes.
Los fármacos antipsicóticos atípicos, incluida la olanzapina, se han asociado con casos de apnea del sueño, con o sin aumento de peso concomitante. En pacientes que tienen un historial de apnea del sueño o están en riesgo de presentarla, la olanzapina debe prescribirse con precaución.
EFECTOS SOBRE LA CAPACIDAD DE CONDUCIR Y MANEJAR MAQUINARIA Debido a que la olanzapina puede causar somnolencia, se debe advertir a los pacientes sobre la operación de maquinaria peligrosa, incluidos los vehículos de motor, hasta que estén razonablemente seguros de que la terapia con olanzapina no los afecta negativamente.
INTERACCIONES CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
• Interacciones medicamentosas:
Alcohol: Debido a los efectos primarios del sistema nervioso central de la olanzapina, se debe tener precaución cuando se toma en combinación con otros medicamentos de acción central y alcohol, ya que pueden producirse efectos farmacológicos aditivos, como un aumento de la sedación.
Agonistas de levodopa y dopamina: Como muestra antagonismo de dopamina in vitro, la olanzapina puede antagonizar los efectos de la levodopa y los agonistas dopaminérgicos.
Agentes antihipertensivos: Debido a su potencial para inducir hipotensión, la olanzapina puede potenciar los efectos de ciertos agentes antihipertensivos. Se debe tener precaución en pacientes que reciben medicamentos que pueden inducir hipotensión, bradicardia o depresión respiratoria.
Posibilidad de que otras drogas afecten la APO®-OLANZAPINA:
Carbamazepina: La terapia concomitante con carbamazepina puede inducir el metabolismo de la olanzapina.
Carbón activado: La administración concomitante de carbón activado redujo la biodisponibilidad oral de la olanzapina en un 50% a 60%.
Antiácidos: Dosis únicas de antiácido (aluminio, magnesio) o cimetidina no afectaron la biodisponibilidad oral de olanzapina.
Valproato: Estudios in vitro con microsomas hepáticos humanos demostraron que la olanzapina tiene poco potencial para inhibir la glucuronidación del valproato, que es la principal vía metabólica. Además, se encontró que el valproato tiene poco efecto sobre el metabolismo de la olanzapina in vitro. La administración diaria concomitante in vivo de 10 mg de olanzapina durante 2 semanas no afectó las concentraciones plasmáticas en equilibrio del valproato. Por lo tanto, la administración concomitante de olanzapina no requiere un ajuste de dosis de valproato.
Fluoxetina: Fluoxetina (dosis única de 60 mg o 60 mg al día durante 8 días) causa un incremento promedio del 16% en la concentración máxima de olanzapina y una disminución media del 16% en el aclaramiento de olanzapina. La magnitud del impacto de este factor es pequeña en comparación con la variabilidad general entre individuos y, por lo tanto, no se recomienda rutinariamente la modificación de la dosis.
Inductores de CYP1A2: Los agentes que inducen CYP1A2 como el omeprazol pueden aumentar la eliminación de olanzapina.
Inhibidores de CYP1A2: Se ha demostrado que la fluvoxamina, un inhibidor específico de CYP1A2, inhibe significativamente el metabolismo de la olanzapina. El aumento medio en la Cmáx de olanzapina después de la fluvoxamina fue del 54% en mujeres no fumadoras y del 77% en varones fumadores. El aumento medio en el AUC de olanzapina fue del 52% y del 108%, respectivamente. Debe considerarse una dosis inicial más baja de olanzapina en pacientes que estén usando fluvoxamina o cualquier otro inhibidor de CYP1A2, como ciprofloxacina o ketoconazol. Se debe considerar una disminución en la dosis de olanzapina si se inicia el tratamiento con un inhibidor de CYP1A2.
• Potencial de APO®-OLANZAPINA para afectar otros medicamentos:
Teofilina: La farmacocinética de la teofilina, un fármaco metabolizado principalmente por el CYP1A2, no fue alterada por la olanzapina en un ensayo clínico con dosis únicas de teofilina IV.
Imipramina / Desipramina: En ensayos clínicos con dosis únicas de olanzapina, no se observó inhibición del metabolismo de la imipramina / desipramina (P450-CYP2D6).
Warfarina: En ensayos clínicos con dosis únicas de olanzapina, no fue evidente la inhibición del metabolismo de la warfarina (P450 CYP2C9).
Diazepam: En ensayos clínicos con dosis únicas de olanzapina, no se observó inhibición del metabolismo del diazepam (P450 CYP3A4).
Litio o Biperideno: Olanzapina no mostró interacción cuando se coadministra con litio o biperideno.
Fármacos metabolizados a través de P450-CYP1A2, -CYP2C9, -CYP2C19, -CYP2D6 y -CYP3A: en estudios in vitro con microsomas humanos, la olanzapina mostró poco potencial para inhibir los citocromos P450-CYP1A2, -CYP2C9, -CYP2C19, -CYP2D6, y - CYP3A. Por lo tanto, es poco probable que la olanzapina cause interacciones farmacológicas clínicamente importantes mediadas a través de las rutas metabólicas descritas anteriormente. Sin embargo, la posibilidad de que la olanzapina pueda alterar el metabolismo de otras drogas, o que otras drogas puedan alterar el metabolismo de la olanzapina, debe considerarse al prescribir olanzapina.
Lorazepam: No se recomienda la inyección concomitante de olanzapina intramuscular y benzodiazepina parenteral. En un estudio clínico farmacocinético / farmacodinámico, la administración de lorazepam intramuscular (2 mg) una hora después de la administración de olanzapina intramuscular (5 mg) no afectó significativamente la farmacocinética de olanzapina, lorazepam no conjugado o lorazepam total. Sin embargo, la administración de lorazepam intramuscular dos horas después de la inyección de olanzapina intramuscular se sumó a la somnolencia observada con cualquiera de los fármacos solo.
Interacciones entre medicamentos y alimentos: La absorción de la olanzapina no se ve afectada por los alimentos.
Interacciones medicamento-plantas: Las interacciones con productos a base de hierbas no han sido identificadas.
Interacciones fármaco-laboratorio: No se han identificado interacciones con pruebas de laboratorio.
Interacciones fármaco-estilo de vida: Fumar: fumar en forma concomitante puede inducir el metabolismo de la olanzapina.
DATOS PRECLÍNICOS DE SEGURIDAD:
Biodisponibilidad comparativa de APO®-OLANZAPINA: Se realizó un estudio comparativo de biodisponibilidad en voluntarios humanos sanos en ayunas. La velocidad y el grado de absorción de olanzapina se midieron y compararon después de una sola dosis oral de comprimidos de APO®-OLANZAPINA (olanzapina) o ZYPREXA®. Los resultados de los datos medidos se resumen en la Tabla.
|
Tabla resumen de los datos comparativos de biodisponibilidad Olanzapina (Dosis única: 1 x 10 mg) a partir de datos medidos - En condiciones de ayuno basado en Olanzapina |
||||
|
Parámetro |
Significado geométrico Media aritmética (CV%) |
Relación de geométrica (%) ¨** |
90 % de intervalo de confianza ** |
|
|
APO® ONLAZAPINA |
ZYPREXA® |
|||
|
AUC0-72 (ng• h/mL) |
486 496 (19) |
492 502 (18) |
98.6 |
95.8 - 101.5 |
|
AUCI (ng• h/mL) |
690 720 (29) |
704 734 (28) |
98.0 |
93.7 - 102.5 |
|
Cmax (ng• h/mL) |
15.3 15.7 (25) |
15.4 15.8 (25) |
99.3 |
95.4 - 103.4 |
|
Tmax* (h) |
5.25 (57) |
5.31 (47) |
||
|
T1/2* (h) |
44.5 (42) |
45.2 (47) |
||
|
§ Expresado como medio aritmético (CV%) solamente. † Zyprexa® Zydis® es fabricado por Eli Lilly Canada Inc. y fue comprado en |
||||
Biodisponibilidad comparativa de APO®-OLANZAPINA ODT: Se realizó un estudio comparativo de biodisponibilidad en voluntarios humanos sanos en ayunas. La velocidad y el grado de absorción de olanzapina se midieron y compararon después de una dosis oral única de APO®-OLANZAPINA ODT (olanzapina) o Zyprexa® Zydis® tabletas de desintegración oral, administradas sin agua. Los resultados de los datos medidos se resumen en la tabla.
Ensayos de esquizofrenia y trastornos relacionados: La eficacia de la olanzapina oral en la reducción y el mantenimiento de la reducción de las manifestaciones de la esquizofrenia y los trastornos psicóticos relacionados se estableció en 3 ensayos clínicos bien controlados de pacientes hospitalizados psicóticos que cumplían los criterios del DSM-III-R para la esquizofrenia ( la mayoría con un curso al ingreso de “crónica con exacerbación aguda”) y 1 ensayo clínico bien controlado de pacientes hospitalizados y ambulatorios psicóticos que, al ingresar, cumplían con los criterios del DSM-III-R para la esquizofrenia, el trastorno esquizofreniforme o el trastorno esquizoafectivo. Los resultados de los ensayos siguen:
(1) Un ensayo de 6 semanas, controlado con placebo (N = 335) comparó 3 rangos de dosis fijas de olanzapina (5 ± 2.5, 10 ± 2.5 y 15 ± 2.5 mg / día QD), 1 rango de dosis de haloperidol (15 ± 5 mg / día en un programa BID) y placebo.
Los 2 rangos de dosis más altas de olanzapina fueron estadísticamente significativamente superiores al placebo en el total de la Escala breve de evaluación psiquiátrica (BPRS), la escala de Impresiones globales clínicas - Severidad de la enfermedad (CGI - S) y el grupo de psicosis positiva BPRS. El rango de dosis más elevado de olanzapina fue estadísticamente significativamente superior al placebo y al haloperidol en la Escala para la evaluación de los síntomas negativos (SANS). La eficacia de la olanzapina generalmente aumentó con la dosis. El rango de dosificación de 5 ± 2,5 mg / día de olanzapina fue numérica, pero no estadísticamente, significativamente superior al placebo en el total de BPRS y otras evaluaciones de la psicopatología general.
(2) Un ensayo de 6 semanas, controlado con placebo (N = 152) comparó 2 dosis fijas de olanzapina (1 o 10 mg / día QD) y placebo. Olanzapina, 10 mg / día, fue estadísticamente significativamente superior al placebo en el total de BPRS, el grupo de psicosis positiva BPRS, la escala CGI-S, la Escala de Síndrome Positivo y Negativo (PANSS), la subescala positiva PANSS y la PANSS negativa subescala. La olanzapina, 1 mg / día, pareció ser una dosis sin efecto sin diferencia, clínica o estadísticamente, del placebo en cualquier evaluación de psicopatología.
(3) Un ensayo de comparación de dosis de 6 semanas (N = 431) comparó 3 rangos de dosis fijas de olanzapina (5 ± 2.5, 10 ± 2.5 y 15 ± 2.5 mg / día QD), olanzapina (1 mg / día QD), y haloperidol (15 ± 5 mg / día en un programa BID). No hubo diferencias estadísticamente significativas entre los grupos en las medidas de eficacia excepto en el rango de dosis más elevado de olanzapina, que fue estadísticamente significativamente superior a olanzapina, 1 mg, en el grupo de psicosis positivo BPRS, subescala positiva PANSS y escala CGI-S.
(4) Un ensayo controlado por comparador de 6 semanas (N = 1996, aleatorización 2: 1, olanzapina: haloperidol) comparó 1 rango de dosificación de olanzapina (5 a 20 mg / día QD) y 1 rango de dosificación de haloperidol (5 a 20 mg / día QD). Las dosis modales medias agudas (para aquellos pacientes con al menos 3 semanas de tratamiento) fueron 13.2 mg / día para olanzapina y 11.8 mg / día para haloperidol. Olanzapina fue estadísticamente significativamente superior al haloperidol.
En el total de BPRS, el grupo de psicosis negativa BPRS, la subescala negativa PANSS y la escala CGI-S. Olanzapina también fue estadísticamente significativamente superior al haloperidol en la Escala de Depresión de Montgomery-Asberg (MADRS). La validez de esta escala en pacientes con esquizofrenia, sin embargo, no está establecida.
(5) La efectividad de la olanzapina en el tratamiento a largo plazo, es decir,> 6 semanas, se evaluó en 3 ensayos de mantenimiento de extensión controlados, doble ciego (de los ensayos agudos 1, 3 y 4 anteriores). Los pacientes que mostraron una mejoría clínica adecuada después de la terapia aguda doble ciego se les permitió continuar en una fase de mantenimiento de extensión doble ciego, a largo plazo en su régimen de dosificación aguda. El mantenimiento a largo plazo de la respuesta al tratamiento (definido por la reducción continua de signos y síntomas suficientes para no requerir hospitalización por psicosis) se comparó con el tiempo (894 pacientes tratados con olanzapina, la mediana de duración del tratamiento fue de 237 días). Se comparó el porcentaje de pacientes que mantuvieron la respuesta al tratamiento durante un año. Olanzapina fue estadísticamente significativamente superior al placebo en el ensayo controlado con placebo y fue comparable o estadísticamente significativamente superior al comparador activo en 3 de los 3 ensayos comparativos controlados activos.
Resumen de ensayos de esquizofrenia y trastornos relacionados: Si bien la eficacia de la olanzapina a una dosis de 5 mg / día no fue estadísticamente superior al placebo (ver (1 anterior)), algunos pacientes individuales que recibieron esta dosis tuvieron una buena respuesta aguda y se mantuvieron bien durante una fase de extensión de 1 año.
Los ensayos anteriores (incluida la extensión de etiqueta abierta) y un ensayo adicional en pacientes geriátricos con demencia degenerativa primaria de tipo Alzheimer constituyen la base de datos primaria (N = 2500 pacientes tratados con olanzapina, que corresponden a 1122,2 pacientes-año; N = 810 pacientes tratados con haloperidol, que corresponde a 193.0 pacientes-año; N = 236 pacientes tratados con placebo, lo que corresponde a 27.1 pacientes-año).
• Ensayos de trastorno bipolar
Manía bipolar: La eficacia de la olanzapina oral en el tratamiento de la manía bipolar aguda se demostró en 5 estudios controlados, incluidos 2 estudios controlados con placebo, 2 estudios comparadores activos y 1 estudio de cotratamiento. Todos los pacientes incluidos en estos estudios tenían un diagnóstico de trastorno bipolar I y presentaban un episodio agudo maníaco o mixto (con o sin características psicóticas) de acuerdo con los criterios del DSM-IV basados en la evaluación clínica y confirmados por la entrevista clínica estructurada para el diagnóstico y manual estadístico, SCID-P.
• Ensayos controlados con placebo: Los 2 ensayos controlados con placebo evaluaron la eficacia de olanzapina versus placebo en el tratamiento de episodios mixtos bipolares maníacos o bipolares, medidos por el puntaje total Y-MRS. Cambio promedio LOCF desde el inicio hasta el punto final durante 3 semanas (n = 70 yn = 69, respectivamente) y 4 semanas (n = 60 yn = 55, respectivamente). Estos ensayos demostraron superioridad en la eficacia de la olanzapina en comparación con el placebo. Los hallazgos clave fueron los siguientes:
• La olanzapina, en un rango de dosis de 5 a 20 mg / día, fue estadísticamente superior al placebo para mejorar los síntomas maníacos en cada estudio (p = 0,019 yp <0,001, respectivamente).
(1) Ensayos comparativos activos: se llevaron a cabo dos ensayos comparadores activos.
(a) El primer estudio de comparación activo evaluó la eficacia de la olanzapina frente al divalproex en el tratamiento de los episodios mixtos bipolares maníacos y bipolares mediante el uso del puntaje total Y-MRS cambio medio LOCF desde el inicio hasta el punto final. Este estudio fue un estudio doble ciego de 3 semanas con una fase de continuación doble ciego de 11 meses. El objetivo principal del estudio fue demostrar la no inferioridad en la eficacia de la olanzapina en comparación con el divalproex a las 3 semanas. Los pacientes fueron aleatorizados a olanzapina (5 a 20 mg / día, n = 125) o divalproex (500 a 2500 mg / día, n = 126). Los hallazgos clave fueron los siguientes:
• La olanzapina fue estadísticamente superior al divalproex en la mejora de los síntomas maníacos medidos por el puntaje de cambio Y-MRS a las 3 semanas (mejorías medias de 13.4 y 10.4 puntos, respectivamente, p = 0.028).
• La proporción de pacientes que cumplieron los criterios de respuesta no fue estadísticamente significativa entre los grupos de olanzapina y divalproex (54.4% y 42.3%, respectivamente) (p = 0.059).
• La proporción de pacientes que estaba en remisión clínica fue significativamente mayor entre los pacientes con olanzapina (47.2%) en comparación con los pacientes con divalproex (34.1%) (p = 0.039).
(b) El segundo estudio de comparación activo evaluó la eficacia de la olanzapina versus el haloperidol en el tratamiento de los episodios bipolares maníacos o mixtos mediante la evaluación de la proporción de pacientes en la remisión definida por protocolo de los síntomas maníacos y depresivos a las 6 semanas. La remisión se definió como: 1) lograr una mejoría en la sintomatología clínica en los síntomas maníacos y depresivos; 2) haber logrado reducciones específicas en las puntuaciones totales de Y-MRS y HAMD-21; y
3) Continuar tomando la medicación del estudio en la semana 6. Esta prueba consistió en una fase de doble ciego de 6 semanas seguida por un mantenimiento doble ciego de 6 semanas de la fase de respuesta en ausencia de un brazo de placebo. Los pacientes fueron asignados aleatoriamente a tratamiento con olanzapina de 5 a 20 mg / día (n = 234) o haloperidol de 3 a 15 mg / día (n = 219). Los hallazgos clave fueron los siguientes:
• Olanzapina y haloperidol fueron igualmente efectivos para mejorar los síntomas maníacos.
• Una respuesta clínica al tratamiento se definió como una mejora ≥ 50% en la puntuación total de Y-MRS desde el inicio hasta el punto final. En ambos grupos de tratamiento, una gran proporción de pacientes respondieron al tratamiento. Al final de la fase aguda 72.3% y El 74.2% de los pacientes con olanzapina y haloperidol cumplieron los criterios de respuesta, y al final de la fase de continuación casi todos los pacientes fueron clasificados como respondedores (96.3% de 160 pacientes con olanzapina y 94.1% de 136 pacientes con haloperidol).
• La proporción de pacientes en remisión sintomática al final de la fase aguda (6 semanas) fue similar para los pacientes con olanzapina y haloperidol (52.1% versus 46.1%, respectivamente (p = 0.152)). Entre los pacientes que entraron en la fase de continuación y no estaban en remisión sintomática a las 6 semanas, significativamente más pacientes con olanzapina (68.3%) que los pacientes con haloperidol (41.0%) estaban en remisión al final del período de continuación (p = 0.014).
• Los síntomas maníacos continuaron mejorando entre los pacientes con olanzapina en un grado estadísticamente significativo.
• Olanzapina fue estadísticamente significativamente más eficaz que el haloperidol en pacientes sin características psicóticas (las tasas de remisión en fase aguda fueron de 56.7% en 104 pacientes con olanzapina y 41.6% en 89 pacientes con haloperidol, respectivamente) (p = 0.043).
(2) Prueba de Cotherapy: Este ensayo evaluó la eficacia de olanzapina más valproato o litio (coterapia, n = 229) versus valproato o litio solo (monoterapia, n = 115) en el tratamiento de episodios maníacos bipolares o mixtos, medido por Y- Puntaje total MRS LOCF significa cambio desde el inicio hasta el punto final. Este estudio fue un estudio doble ciego de 6 semanas con una fase doble ciego realeatorizada de 18 meses. Los hallazgos clave fueron los siguientes:
• La olanzapina en combinación con valproato o litio fue significativamente más eficaz que la monoterapia (valproato o litio) para mejorar los síntomas maníacos (mejorías medias de 13.1 y 9.1 puntos, respectivamente) (p = 0.003).
• La proporción de pacientes que clínicamente respondieron al tratamiento fue estadísticamente significativamente mayor entre los pacientes que recibieron terapia con olanzapina (67.7%) que con monoterapia con litio o valproato (44.7%, p <0.001).
• El porcentaje de pacientes que se encontraban en remisión clínica fue significativamente mayor en el grupo de cotratamiento de olanzapina (78.6%) comparado con el grupo de monoterapia con litio o valproato (65.8%, p = 0.012).
• La diferencia en el tiempo de remisión también fue estadísticamente significativamente diferente (p = 0.002). La mediana del tiempo de remisión estimado fue de 14 días para los pacientes tratados con cotratamiento con olanzapina y de 22 días para los pacientes tratados con monoterapia.
Mantenimiento bipolar: La eficacia de la olanzapina oral como monoterapia para el tratamiento de mantenimiento del trastorno bipolar en pacientes que respondieron al tratamiento agudo con olanzapina para un episodio maníaco o mixto se demostró en dos ensayos controlados de un año de duración y evento: uno controlado con placebo y otro activo comparador de prueba contra la monoterapia con litio.
Todos los pacientes incluidos en estos estudios tenían un diagnóstico de trastorno bipolar y presentaban un episodio agudo maníaco o mixto (con o sin características psicóticas) según los criterios del DSM-IV.
Para ambos estudios: los pacientes tenían que cumplir los criterios de respuesta definidos por el estudio (puntuación total de YMRS ≤ 12 y una puntuación total de HAMD-21 ≤ 8) durante el tratamiento de etiqueta abierta con olanzapina (u olanzapina más litio en el estudio comparador activo) para ser aleatorizado en el período de mantenimiento doble ciego para la observación de una recaída definida por el estudio. La dosis fue flexible (5 a 20 mg / día para olanzapina, niveles séricos de 0.6 a 1.2 mEq / L para litio).
El criterio de salida fue la recaída sintomática del trastorno bipolar, ya sea manía o depresión. La recaída sintomática de la manía se definió como una puntuación total de YMRS ≥ 15 y la recaída sintomática de la depresión como una puntuación total de HAMD-21 ≥ 15; solo para el estudio controlado con placebo, las definiciones también incluyeron hospitalización por manía o depresión. Por lo tanto, la variable de eficacia primaria fue el tiempo y la incidencia de la recaída sintomática de salida del trastorno bipolar, en base al análisis de las curvas de Kaplan-Meier de tiempo hasta la recaída.
1) Prueba controlada por placebo:
El estudio evaluó la eficacia de la olanzapina versus placebo en el tratamiento de mantenimiento de los episodios bipolares maníacos o mixtos mediante el uso de un análisis de la curva de supervivencia para evaluar el tiempo y la incidencia de la recaída del trastorno bipolar. En este ensayo, 361 pacientes que habían demostrado criterios de respuesta durante un promedio de 16 días se asignaron al azar a la continuación de olanzapina en su misma dosis (n = 225) o a placebo (n = 136), para observar la recaída hasta por uno año.
Los hallazgos clave fueron los siguientes:
• La Figura 1 muestra las curvas de tiempo de recaída de 1 año para las interrupciones totales del estudio en cada brazo a lo largo del tiempo, ya sea que salgan debido a una recaída o que se retiren debido a eventos adversos u otras razones. El porcentaje de pacientes que permanecen en el estudio (es decir, sin recaídas y que no se retiraron por ningún motivo) puede verse en cada uno de los puntos de 3, 6, 9 y 12 meses; al final del estudio, esto es 24% (n = 53) para la olanzapina y 10% (n = 13) para el placebo. El punto de tiempo en el cual el 50% de los pacientes en un brazo específico se había retirado por algún motivo fue el Día 59 para el grupo de olanzapina en comparación con el Día 23 para el grupo de placebo.
• La Figura 2 muestra las curvas de tiempo de recaída de 1 año específicamente para el criterio de salida de la recaída bipolar (es decir, los pacientes que se retiraron por otras razones fueron censurados y excluidos de los numeradores y denominadores calculados). La olanzapina fue superior al placebo, tanto para la incidencia de recaída bipolar (46.7% frente a 80.1%, respectivamente) como para el tiempo medio de recaída (174 días frente a 22 días, respectivamente). Tenga en cuenta que una incidencia alta de recaídas para el brazo de placebo no es inesperada dado el tiempo limitado que los pacientes demostraron los criterios de respuesta antes de la aleatorización.
• Las Figuras 2a y 2b muestran las curvas de tiempo de recaída de eficacia para cada recidiva maníaca y depresiva, respectivamente. La olanzapina mostró una ventaja estadísticamente significativa sobre el placebo en términos de manía y depresión, aunque se observó una mayor ventaja en la manía.
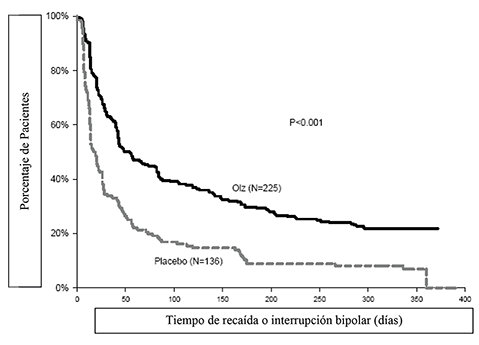
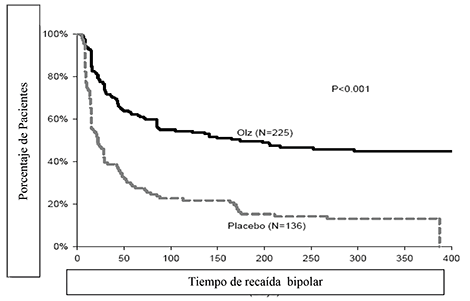
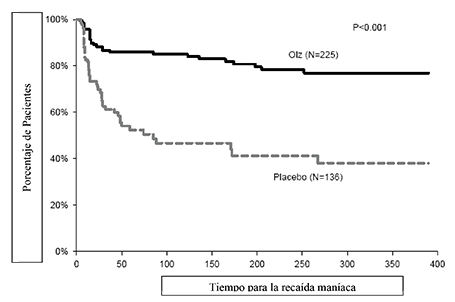
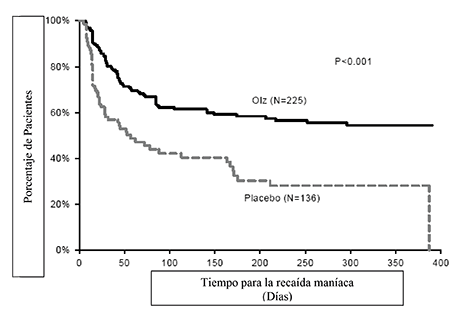
2) Prueba de comparador activo:
El estudio evaluó la eficacia del litio Olanzapinavs en el tratamiento de mantenimiento de episodios bipolares maníacos o mixtos en un diseño de no inferioridad para evaluar la incidencia de recaída del trastorno bipolar y, además, mediante el análisis de la curva de supervivencia para evaluar el tiempo de recaída. En este ensayo, 543 pacientes que habían demostrado criterios de respuesta durante un promedio de 20 días se asignaron al azar a Olanzapinaplus placebo (n = 217) o litio más placebo (n = 214) para la observación de la recaída durante hasta un año. El primer mes del período doble ciego fue un período de reducción gradual para permitir la interrupción no brusca del litio. El margen de no inferioridad utilizado en este estudio fue: ± 20% de la eficacia observada para la población de referencia.
Los hallazgos clave fueron los siguientes:
• La Figura 3 muestra las curvas de tiempo de recaída de 1 año para las interrupciones totales del estudio en cada brazo a lo largo del tiempo, ya sea que salgan debido a una recaída o que se retiren debido a eventos adversos u otras razones. El porcentaje de pacientes que permanecen en el estudio (es decir, sin recaídas, y no se han retirado por alguna razón) se puede ver en cada uno de los puntos de 3, 6, 9 y 12 meses; al final del estudio, esto es 42% (n = 94) para Olanzapina y 28% (n = 61) para litio. El punto de tiempo en el cual el 50% de los pacientes en un brazo específico se había retirado por alguna razón fue el Día 255 para el grupo Olanzapina en comparación con el Día 192 para el grupo de litio.
• La Figura 4 muestra las curvas de tiempo de recaída de 1 año específicamente para el criterio de salida de la recaída bipolar (es decir, los pacientes que se retiraron por otras razones fueron censurados y excluidos de los cálculos de numeradores y denominadores). Olanzapina no fue inferior al litio tanto para la incidencia de recaída bipolar (30.0% vs 38.8%, respectivamente), y el tiempo para el 25% de los pacientes que experimentaron una recaída (122 días frente a 143 días, respectivamente).
• Se puede ver en la Figura 4 que durante aproximadamente los primeros cinco meses de la prueba de 1 año, la tasa de recaída fue más alta en pacientes tratados con olanzapina; a partir de entonces, la tasa de recaída para el litio aumenta, mientras que para Olanzapina se expande.
• Las Figuras 4a y 4b son las curvas de tiempo de recaída de 1 año para cada uno de los criterios de salida de recaída maníaca y depresiva, respectivamente. Olanzapinas mostró una ventaja estadísticamente significativa sobre el litio en la tasa de recaída de la manía, y no fue inferior para la recaída depresiva.
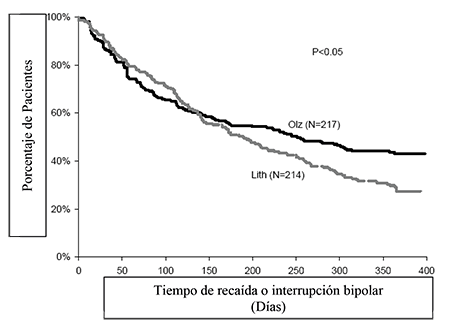
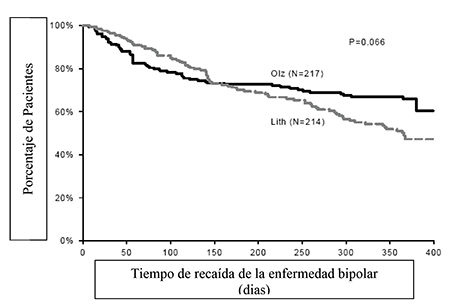
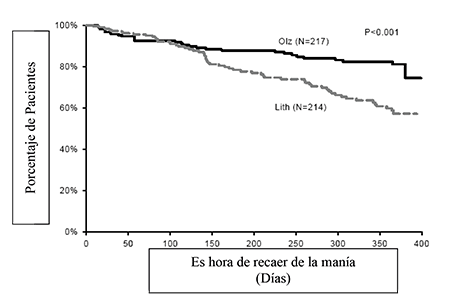
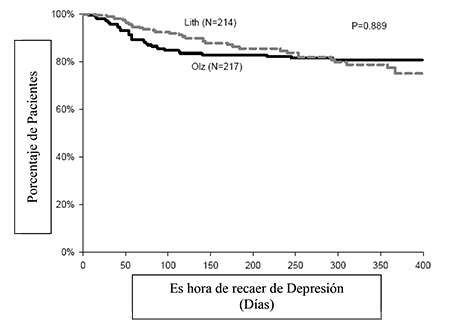
• Resumen de ensayos de trastorno bipolar:
Manía bipolar: La olanzapina fue más eficaz que el placebo y el divalproex y tan eficaz como el haloperidol para mejorar la sintomatología maníaca general en pacientes con trastorno bipolar I agudo, episodio maníaco o mixto, con o sin síntomas psicóticos y con o sin antecedentes de ciclos rápidos. La olanzapina se asocia con un inicio de acción más rápido (basado en el tiempo medio de remisión estimado con el análisis de Kaplan-Meier) en comparación con el divalproex y similar al del haloperidol. La adición de olanzapina también mejoró a los pacientes que no respondieron al litio o al valproato. La olanzapina no se asoció con la inducción o el empeoramiento de los síntomas de la depresión.
Mantenimiento bipolar: Dos estudios controlados de 1 año apoyan el uso de monoterapia con olanzapina en el tratamiento de mantenimiento de pacientes bipolares que respondieron al tratamiento con olanzapina aguda por un episodio maníaco o mixto. Con base en el análisis de las curvas de supervivencia de un año de Kaplan-Meier, la olanzapina fue superior al placebo y no inferior al litio, tanto en el tiempo como en la incidencia de la recaída bipolar durante un año.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
Esquizofrenia y trastornos relacionados: Adultos: APO®-OLANZAPINA (olanzapina) debe administrarse en un programa de una vez al día sin importar las comidas, generalmente comenzando con 5 a 10 mg, con una dosis objetivo de 10 mg/día dentro de varios días. Los ajustes de dosificación adicionales, si están indicados, generalmente deben ocurrir a intervalos de no menos de 1 semana, ya que el estado estacionario para la olanzapina no se lograría durante aproximadamente 1 semana en el paciente típico. Cuando se necesitan ajustes de dosis, se recomiendan incrementos/disminuciones de dosis de 5 mg por día. Un aumento a una dosis mayor que la dosis objetivo de 10 mg/día (es decir, a una dosis de 15 mg/día o mayor) normalmente se recomienda solo después de la evaluación clínica.
Las dosis superiores a 20 mg/día se han evaluado desde una perspectiva de seguridad (consulte la Tabla 6 en Eventos adversos, subsección Sucesos dependientes de la dosis); sin embargo, la eficacia en dosis superiores a 20 mg / día no se ha evaluado sistemáticamente.
Terapia de mantenimiento en esquizofrenia: Se recomienda que los pacientes que responden con esquizofrenia continúen con olanzapina a la dosis más baja necesaria para mantener la remisión. Los pacientes deben volver a evaluarse periódicamente para determinar la necesidad de un tratamiento de mantenimiento. Si bien no existe un cuerpo de evidencia disponible para responder la pregunta de por cuánto tiempo el paciente debe ser tratado con olanzapina, la efectividad del tratamiento de mantenimiento está bien establecida para muchos otros medicamentos antipsicóticos.
• Desorden bipolar:
Manía bipolar:
Adultos: La dosis inicial recomendada para olanzapina es de 15 mg administrados una vez al día en monoterapia y 10 mg diarios en terapia de combinación.
Puede administrarse independientemente de las comidas, ya que su absorción no se ve afectada por los alimentos. El rango de dosificación de olanzapina es de 5 mg a 20 mg por día. La dosis diaria debe ajustarse en respuesta a la evaluación clínica.
Terapia de mantenimiento en el trastorno bipolar: Los pacientes que han estado recibiendo y respondiendo a olanzapina para el tratamiento de episodios maníacos o mixtos agudos de trastorno bipolar deben continuar inicialmente la terapia de mantenimiento con la misma dosis.
La dosis diaria posterior debe ajustarse en función del estado clínico dentro de un rango de 5 a 20 mg por día.
Los pacientes deben volver a evaluarse periódicamente para determinar la necesidad de tratamiento de mantenimiento y la dosis adecuada para dicho tratamiento.
Consideraciones generales para la dosificación oral en poblaciones especiales.
El paciente anciano o debilitado: En ensayos clínicos, 44 pacientes con esquizofrenia o trastornos relacionados que tenían 65 años o más fueron tratados con olanzapina (5 a 20 mg diarios). Dada la experiencia limitada con olanzapina en los ancianos, y la mayor incidencia de enfermedades concomitantes y medicamentos concomitantes en esta población, la olanzapina debe usarse con precaución.
La dosis inicial recomendada es de 5 mg en pacientes ancianos, debilitados, con predisposición a reacciones hipotensoras, que de otra forma exhiben una combinación de factores que pueden dar como resultado un metabolismo más lento de la olanzapina (p. Ej., Pacientes no fumadoras) o quiénes pueden estarlo. farmacodinámicamente más sensible a la olanzapina. Cuando esté indicado, la escalada de dosis se debe realizar con precaución en estos pacientes.
Pacientes con insuficiencia hepática y / o renal: Como falta experiencia clínica en estos pacientes, se debe considerar la dosis de inicio inicial más baja y la titulación más lenta a la dosis objetivo inicial. Escalada de dosis adicional, cuando esté indicado, debe ser.
Dosis perdida: Si un paciente omite una dosis en unas pocas horas, solicite al paciente que tome tan pronto como lo recuerde. Si ha pasado la mayor parte del día, aconseje al paciente que espere hasta la próxima dosis programada. Aconsejar a los pacientes no tomar 2 dosis de olanzapina a la vez.
Vía de administración: Oral.
DATOS FARMACEUTICOS:
Lista de excipientes:
— Lactosa Monohidratada (Spray-dried).
— Estearato de magnesio.
— Celulosa microcristalina NF (PH 102).
— Almidón de maíz (granulo).
Incompatibilidades, por favor anexarlo junto con las interacciones medicamentosas: Ver Sección de Interacciones.
Periodo de validez: 24 meses
Precauciones especiales de conservación: Consérvese a temperatura ambiente a no más de 30 °C y en lugar seco.
Naturaleza y contenido del envase: Caja con Blíster
SOBREDOSIFICACIÓN:
Signos y síntomas: Los síntomas muy comunes reportados en la sobredosis de olanzapina (incidencia ≥ 10%) incluyen taquicardia, agitación / agresividad, disartria, diversos síntomas extrapiramidales y nivel reducido de conciencia que van desde la sedación hasta el coma.
Otras secuelas médicamente significativas de la sobredosis de olanzapina incluyen delirio, convulsiones, posible síndrome neuroléptico maligno, depresión respiratoria, aspiración, hipertensión o hipotensión, arritmias cardíacas (<2% de casos de sobredosis) y paro cardiopulmonar. Se han reportado desenlaces fatales para sobredosis agudas tan bajas como 450 mg de olanzapina oral, pero también se ha informado sobre la supervivencia después de una sobredosis aguda de aproximadamente 2.000 mg de olanzapina oral.
Manejo de sobredosis: No hay un antídoto específico para la olanzapina. No se recomienda la inducción de la emesis. Pueden estar indicados procedimientos estándar para el manejo de una sobredosis (es decir, lavado gástrico, administración de carbón activado). La administración concomitante de carbón activado demostró reducir la biodisponibilidad oral de la olanzapina en un 50 a 60%.
El tratamiento sintomático y la monitorización de la función del órgano vital deben instituirse de acuerdo con la presentación clínica, incluido el tratamiento de la hipotensión y el colapso circulatorio y el soporte de la función respiratoria. No use epinefrina, dopamina u otros agentes simpaticomiméticos con actividad beta-agonista ya que la estimulación beta puede empeorar la hipotensión.
DENOMINACIÓN COMÚN INTERNACIONAL: Olanzapina.
Estructura y nombre químico del principio activo: Olanzapina.
Fármaco:
Nombre común: Olanzapina
Nombre químico: 2-Metil-4-(4-metil-1-piperazinil)-10H-tieno[2,3,-b] [1,5] benzodiazepina
Fórmula molecular y peso molecular: C17H20N4S
Peso molecular: 312.44 mol.
Fórmula estructural:
Propiedades fisicoquímicas:
|
Descripción |
La olanzapina es un agente antipsicótico de la clase de tienobenzodiazepinas. Es un sólido cristalino amarillo, soluble en n-propanol y casi insoluble en agua. |
|
pKa |
5.00 y 7.40 en dimetilformamida/agua (60:40,v/v) |
|
Punto de fusión: |
195 ± 2°C |
Color: Blanco.
Aspecto: Tabletas recubiertas, redondas, biconvexas, de color blanco. Grabadas con “APO” de un lado y “OLA” sobre “10” del otro lado.
CARCINOGÉNESIS Y MUTAGÉNESIS:
Cardiovascular
Hipotensión y síncope: Al igual que con otros medicamentos que tienen alta actividad bloqueadora del receptor adrenérgico alfa-1, la olanzapina puede inducir hipotensión ortostática, taquicardia, mareos y, a veces, síncope, especialmente al inicio del tratamiento.
En una base de datos de ensayos clínicos de 2.500 pacientes tratados con olanzapina oral, se informó síncope en 0.6% (15/2500). El riesgo de hipotensión ortostática y síncope puede minimizarse iniciando la terapia con 5 mg QD. Se debe considerar una titulación más gradual a la dosis objetivo si ocurre hipotensión.
Olanzapina debe usarse con especial precaución en pacientes con enfermedad cardiovascular conocida (antecedentes de infarto de miocardio o isquemia, insuficiencia cardíaca o anomalías de la conducción), enfermedad cerebrovascular y afecciones que predispongan a los pacientes a hipotensión (deshidratación, hipovolemia y tratamiento con medicamentos antihipertensivos).
Tromboembolismo venoso: El tromboembolismo venoso (TEV), incluida la embolia pulmonar mortal, se ha notificado en asociación temporal con fármacos antipsicóticos, incluida la olanzapina, en informes de casos y / o estudios observacionales. Al prescribir olanzapina, se deben identificar todos los posibles factores de riesgo de TEV y tomar medidas preventivas, especialmente porque los pacientes con esquizofrenia a menudo presentan factores de riesgo de TEV. Se han notificado casos muy raros de TEV en pacientes tratados con olanzapina durante el período posterior a la comercialización.
Intervalo QT: En ensayos clínicos, las prolongaciones QTc clínicamente significativas (corrección QQ de Fridericia [QTcF] ≥ 500 milisegundos [mseg] en cualquier momento después de la línea de base en pacientes con QTcF basal <500 mseg) fueron poco frecuentes (0,1% a 1%) en pacientes tratados con olanzapina, sin diferencias significativas en los eventos cardíacos asociados en comparación con el placebo.
Sin embargo, como con otros antipsicóticos, se debe tener precaución cuando se prescriba olanzapina con medicamentos que se sabe aumentan el intervalo QTc, especialmente en los ancianos, en pacientes con síndrome de QT prolongado congénito, insuficiencia cardíaca congestiva, hipertrofia cardíaca, hipocalemia o hipomagnesemia (ver Reacciones adversas , reacciones adversas de medicamentos post-market).
Muerte cardíaca: En un estudio observacional retrospectivo, los pacientes tratados con antipsicóticos atípicos (incluida la olanzapina) o antipsicóticos típicos tuvieron un aumento similar relacionado con la dosis de muerte súbita cardíaca presunta (PCS) en comparación con los no usuarios de antipsicóticos (casi el doble del riesgo que los no usuarios). En los informes posteriores a la comercialización con olanzapina, el evento de SCD ha sido reportado muy raramente.
• Endocrino y Metabolismo:
Hiperglucemia: Al igual que con algunos otros antipsicóticos, rara vez se han notificado exacerbaciones de diabetes preexistente e hiperglucemia, y se han notificado muy raramente cetoacidosis diabética y coma diabético que incluyen algunos casos mortales durante el uso de olanzapina, a veces en pacientes sin antecedentes de hiperglucemia: sección Reacciones adversas a los medicamentos posteriores al mercado). En algunos casos, se ha informado un aumento previo en el peso corporal que puede ser un factor predisponente. Los pacientes deben tener un monitoreo de referencia y periódico de la glucosa en sangre y el peso corporal.
En ensayos clínicos (hasta 52 semanas), la olanzapina se asoció con un cambio medio mayor en la glucosa con respecto al placebo. Se observaron cambios clínicamente significativos emergentes del tratamiento en la glucosa en ayunas en pacientes con o sin evidencia de desregulación de la glucosa al inicio del estudio, Otros eventos adversos observados durante ensayos clínicos con olanzapina en todas las indicaciones, cambios de glucosa).
La evaluación de la relación entre el uso de antipsicóticos atípicos y las anomalías de la glucosa se complica por la posibilidad de un mayor riesgo de fondo de la diabetes mellitus en pacientes con esquizofrenia y la creciente incidencia de diabetes mellitus en la población general. Dados estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia no se comprende completamente. Sin embargo, los estudios epidemiológicos sugieren un mayor riesgo de eventos adversos relacionados con la hiperglucemia emergente del tratamiento en pacientes tratados con antipsicóticos atípicos.
No se dispone de estimaciones de riesgo precisas para los eventos adversos relacionados con la hiperglucemia en pacientes tratados con antipsicóticos atípicos.
Cualquier paciente tratado con antipsicóticos atípicos debe ser monitoreado para detectar síntomas de hiperglucemia que incluyen polidipsia, poliuria, polifagia y debilidad. Los pacientes que desarrollan síntomas de hiperglucemia durante el tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas. En algunos casos, la hiperglucemia se resolvió cuando se suspendió el antipsicótico atípico; sin embargo, algunos pacientes requirieron la continuación del tratamiento antidiabético a pesar de la interrupción del medicamento sospechoso.
Los pacientes con factores de riesgo para diabetes mellitus (por ejemplo, obesidad, antecedentes familiares de diabetes) que están comenzando el tratamiento con antipsicóticos atípicos deben someterse a pruebas de glucosa en sangre en ayunas al comienzo del tratamiento y periódicamente durante el tratamiento. Los pacientes con un diagnóstico establecido de diabetes mellitus que se inician con antipsicóticos atípicos deben controlarse regularmente para detectar un empeoramiento del control de la glucosa.
Hiperprolactinemia: Al igual que con otros medicamentos que bloquean la dopamina D2 y / o los receptores de serotonina 5-HT2, la olanzapina puede elevar los niveles de prolactina. Las elevaciones asociadas con el tratamiento con olanzapina son generalmente leves y pueden disminuir durante la administración continua.
Dado que los experimentos de cultivo de tejidos indican que aproximadamente un tercio de los cánceres de mama humanos son dependientes de prolactina in vitro, la olanzapina solo debe administrarse a pacientes con cáncer de mama detectado previamente si los beneficios superan los riesgos potenciales. También se debe tener precaución cuando se considere el tratamiento con olanzapina en pacientes con tumores hipofisarios. Posibles las manifestaciones asociadas con niveles elevados de prolactina son amenorrea, galactorrea y menorragia.
Como es común con los compuestos que estimulan la liberación de prolactina, la administración de olanzapina dio como resultado un aumento en la incidencia de neoplasmas mamarios tanto en ratas como en ratones. Las diferencias fisiológicas entre las ratas y los humanos con respecto a la prolactina hacen que el significado clínico de estos hallazgos no esté claro. Hasta la fecha, ni los estudios clínicos ni epidemiológicos han demostrado una asociación entre la administración crónica de estos fármacos y la tumorigénesis mamaria.
La hiperprolactinemia de larga data cuando se asocia con hipogonadismo puede conducir a una disminución de la densidad mineral ósea en sujetos femeninos y masculinos.
Lípidos: Se han observado aumentos en los lípidos en pacientes tratados con olanzapina en ensayos clínicos controlados con placebo. Los cambios clínicamente significativos emergentes del tratamiento en los lípidos en ayunas se observaron en pacientes con o sin evidencia de dislipidemia al inicio del estudio (ver Reacciones adversas; Otros eventos adversos observados durante ensayos clínicos con olanzapina en todas las indicaciones, subsección de lípidos). Se recomienda una monitorización clínica adecuada, que incluya evaluaciones de línea de base y de seguimiento de lípidos.
• Gastrointestinal:
Efecto antiemético: En consonancia con sus efectos antagonistas de la dopamina, la olanzapina puede tener un efecto antiemético. Tal efecto puede enmascarar los signos de toxicidad debido a la sobredosis de otras drogas, o puede enmascarar los síntomas de una enfermedad como un tumor cerebral u obstrucción intestinal.
• Genitourinario:
Priapismo: Se han notificado casos raros de priapismo con el uso de antipsicóticos, como la olanzapina. Esta reacción adversa, como con otras drogas psicotrópicas, no pareció depender de la dosis y no se correlacionó con la duración del tratamiento. El mecanismo de acción más probable del priapismo es una disminución relativa del tono simpático.
Retención urinaria: La olanzapina posee propiedades anticolinérgicas, que pueden provocar reacciones adversas a los medicamentos, como la retención urinaria. Ha habido varios informes serios posteriores a la comercialización de la retención urinaria en pacientes tratados con olanzapina y, en algunos casos, se requirió cateterismo. Olanzapina debe prescribirse con precaución en pacientes con diagnóstico actual o antecedentes de retención urinaria y en pacientes con otros factores de riesgo de retención urinaria (por ejemplo, hiperplasia prostática benigna). La olanzapina también debe prescribirse con precaución en pacientes que reciben medicamentos con actividad anticolinérgica que pueden afectar la micción.
• Hematológico:
Índices hematológicos: En ensayos clínicos con olanzapina oral, no hubo datos que sugirieran que la olanzapina afectara negativamente a la función de la médula ósea, incluso en pacientes con antecedentes de neutropenia o leucopenia asociadas a clozapina. La olanzapina se asoció con una incidencia del 5,7% de tratamiento principalmente transitorio elevaciones emergentes de los recuentos de eosinófilos por encima del rango normal. Las elevaciones no se asociaron con ningún síntoma, fenómenos alérgicos identificables o cambios en otros índices hematológicos. Se han notificado casos poco frecuentes de leucopenia con olanzapina. En caso de síntomas de infección, se debe considerar el recuento de glóbulos blancos y el recuento diferencial.
Se han informado casos de neutropenia, granulocitopenia y agranulocitosis durante el uso de antipsicóticos.
Por lo tanto, se recomienda que a los pacientes se les realice un conteo sanguíneo completo (CBC) antes de comenzar la olanzapina y luego periódicamente durante el tratamiento.
• Hepático
Elevaciones de aminotransferasa: Durante los ensayos clínicos previos a la comercialización, el tratamiento con olanzapina oral se asoció con elevación de aminotransferasas hepáticas, principalmente ALT (SGPT). Dentro de una base de datos de ensayos clínicos de 2280 pacientes tratados con olanzapina, con niveles basales de ALT (SGPT) ≤ 60 IU / L, 5,9% (134/2280) tuvieron elevaciones ALT (SGPT) emergentes del tratamiento a> 120 IU / L, 1,9% (44/2280) tenían elevaciones a> 200 IU / L, y 0.2% (5/2280) tenían elevaciones a> 400 IU / L. Ningún paciente tenía valores superiores a 700 IU / L. Ninguno de los pacientes tratados con olanzapina que tenían valores elevados de aminotransferasas manifestó sintomatología clínica asociada con insuficiencia hepática. La mayoría de las elevaciones de aminotransferasas se observaron durante las primeras seis semanas de tratamiento. La mayoría de las elevaciones fueron transitorias (66%) mientras que los pacientes continuaron con la terapia con olanzapina o cayeron (11%) en la última medición disponible. De los 134 pacientes tratados con olanzapina cuyos niveles de enzima aumentaron a> 120 UI / L, 20 interrumpieron el tratamiento (6 para el hígado, 14 por otros motivos) mientras que sus valores de ALT (SGPT) seguían en aumento. En 38 pacientes tratados con olanzapina con ALT basal (SGPT)> 90 IU / L, ninguno experimentó una elevación a> 400 IU / L.
Se han recibido informes raros de post-comercialización de hepatitis. También se han informado casos muy raros de lesión hepática colestática o mixta en el período posterior a la comercialización. La insuficiencia hepática, incluidas las muertes, también se ha informado muy raramente en el período posterior a la comercialización.
Se debe tener precaución cuando se usa olanzapina en pacientes con trastornos hepáticos preexistentes, en pacientes que están siendo tratados con fármacos potencialmente hepatotóxicos, o si aparecen signos o síntomas de insuficiencia hepática emergente del tratamiento.
Para pacientes que tienen una función hepática anormal conocida o sospechada antes de comenzar la olanzapina, se recomienda una evaluación clínica estándar que incluya la medición de los niveles de aminotransferasas. Se recomienda la reevaluación clínica periódica con niveles de aminotransferasas para dichos pacientes, así como para los pacientes que desarrollan signos y síntomas que sugieren un nuevo trastorno hepático de inicio durante el tratamiento con olanzapina.
• Neurológico:
Disquinesia tardía: La discinesia tardía (TD), un síndrome que consiste en movimientos discinéticos involuntarios potencialmente irreversibles, se asocia con el uso de fármacos antipsicóticos. La discinesia tardía ocurre con mayor frecuencia en pacientes de edad avanzada; Sin embargo, los pacientes de cualquier edad pueden verse afectados. Se desconoce si los fármacos antipsicóticos pueden diferir en su potencial para causar TD. Sin embargo, durante los ensayos de mantenimiento a largo plazo con doble ciego de esquizofrenia de extensión (894 pacientes tratados con olanzapina; tratamiento con olanzapina mediana, 237 días), la olanzapina se asoció con una incidencia estadísticamente significativamente más baja de discinesia emergente del tratamiento en comparación con el haloperidol. Durante los ensayos a largo plazo, doble ciego, de mantenimiento bipolar con extensión en monoterapia (567 pacientes tratados con olanzapina, durante hasta 1 año), no hubo casos de DT en los brazos de olanzapina, según lo determinaron los eventos adversos informados o el evento anormal anormal. Escala de movimiento (AIMS). Se ha informado de TD muy raramente (≤ 0,0025%) en la vigilancia posterior al mercado.
Se cree que el riesgo de desarrollar discinesia tardía y la posibilidad de que se vuelva irreversible aumenta a medida que aumenta la duración del tratamiento y la dosis acumulada de fármaco antipsicótico. Sin embargo, el síndrome puede desarrollarse, aunque con menos frecuencia, después de períodos de tratamiento relativamente breves a dosis bajas. No hay tratamiento conocido para casos establecidos de TD.
El síndrome puede remitir, parcial o completamente, si se retira el tratamiento con medicamentos antipsicóticos. Sin embargo, el tratamiento farmacológico antipsicótico en sí mismo puede suprimir los signos y síntomas de la discinesia tardía, ocultando así el proceso subyacente.
Dadas estas consideraciones, la olanzapina se debe prescribir de una manera que sea más probable que minimice el riesgo de discinesia tardía. Al igual que con cualquier medicamento antipsicótico, la olanzapina debe reservarse para los pacientes que parecen estar recibiendo un beneficio sustancial del medicamento. En tales pacientes, se debe buscar la dosis efectiva más baja y la duración más corta del tratamiento. La necesidad de continuar el tratamiento debe ser reevaluada periódicamente.
Si aparecen signos o síntomas de discinesia tardía en un paciente que toma olanzapina, se debe considerar la interrupción del tratamiento. Sin embargo, algunos pacientes pueden beneficiarse del tratamiento continuo con olanzapina a pesar de la presencia del síndrome.
Convulsiones: Los neurolépticos convencionales son conocidos por reducir el umbral convulsivo. En ensayos clínicos, se han producido convulsiones en un pequeño número (0,9%, 22/2500) de pacientes tratados con olanzapina. Hubo factores de confusión que pueden haber contribuido a la ocurrencia de convulsiones en muchos de estos casos. Olanzapina debe usarse con precaución en pacientes que tienen un historial de convulsiones o que tienen condiciones asociadas con las convulsiones o que tienen un umbral de crisis disminuido.
• Psiquiátrico:
Suicidio: La posibilidad de suicidio o intento de suicidio es inherente a la psicosis, por lo que una estrecha supervisión y un tratamiento clínico apropiado de los pacientes de alto riesgo deberían acompañarse de la terapia farmacológica.
• Renal:
Ácido úrico: En la base de datos de ensayos clínicos previos a la comercialización, la olanzapina oral se asoció con elevaciones leves de ácido úrico en algunos pacientes. Sin embargo, solo un paciente tratado con olanzapina experimentó gota emergente del tratamiento, y la concentración de ácido úrico inicial para este paciente fue al menos tan grande como todas las concentraciones observadas mientras el paciente recibía olanzapina.
• Piel:
Reacción farmacológica con eosinofilia y síntomas sistémicos (DRESS): Reacción farmacológica con eosinofilia y síntomas sistémicos (DRESS) se ha informado con exposición a olanzapina. DRESS consiste en una combinación de tres o más de los siguientes: reacción cutánea (como erupción cutánea o dermatitis exfoliativa), eosinofilia, fiebre, linfadenopatía y una o más complicaciones sistémicas como hepatitis, nefritis, neumonitis, miocarditis y pericarditis. Las reacciones adversas cutáneas graves a veces son fatales. Interrumpa la olanzapina si se sospecha DRESS.
• Poblaciones especiales
Mujeres embarazadas: No hay estudios adecuados y bien controlados en mujeres embarazadas. Se debe advertir a las pacientes que notifiquen a su médico si quedan embarazadas o si pretenden quedar embarazadas durante el tratamiento con olanzapina.
Debido a que la experiencia humana en mujeres embarazadas es limitada, este medicamento debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Efectos no teratogénicos: Los neonatos expuestos a medicamentos antipsicóticos (incluida la olanzapina) durante el tercer trimestre del embarazo corren el riesgo de presentar síntomas extrapiramidales y / o de abstinencia después del parto. Ha habido informes de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria y trastorno de la alimentación en estos neonatos. Estas complicaciones han variado en severidad; mientras que en algunos casos los síntomas han sido autolimitados, en otros casos los neonatos han requerido el apoyo de la unidad de cuidados intensivos y la hospitalización prolongada.
Olanzapina no debe usarse durante el embarazo a menos que los beneficios esperados para la madre superen marcadamente los riesgos potenciales para el feto.
Labor de parto y parto: El parto en ratas no se vio afectado por la olanzapina. El efecto de la olanzapina sobre el trabajo de parto y el parto en humanos no se conoce.
• Mujeres en lactancia:
Lactancia: En un estudio en mujeres sanas y lactantes, la olanzapina se excretó en la leche materna. La exposición media al lactante (mg / kg) en estado estacionario se estimó en el 1,8% de la dosis materna de olanzapina (mg / kg). Se debe advertir a los pacientes que no deben amamantar a un bebé si están tomando olanzapina.
• Pediatría (<18 años de edad):
No se ha establecido la seguridad y eficacia de la olanzapina en niños menores de 18 años y no se recomienda su uso.
Se ha observado un aumento de peso con el uso de antipsicóticos atípicos en poblaciones de pacientes pediátricos y adolescentes. Independientemente de cualquier cambio durante el tratamiento con antipsicóticos atípicos, el aumento de peso puede asociarse con cambios adversos en otros parámetros metabólicos (por ejemplo, metabolismo de glucosa y lípidos). El peso anormal de la niñez y el estado metabólico se han asociado con resultados cardiovasculares adversos en la edad adulta. El aumento de peso y los cambios en otros parámetros metabólicos asociados con antipsicóticos atípicos pueden ser más frecuentes o más graves en pacientes pediátricos y adolescentes que en pacientes adultos.
La seguridad a largo plazo de los antipsicóticos atípicos, incluidos los efectos cardiometabólicos potenciales y los efectos sobre el crecimiento, la maduración y el desarrollo del comportamiento en pacientes menores de 18 años de edad, no ha sido evaluado sistemáticamente
Se ha informado una mayor magnitud de aumento de peso y alteraciones lipídicas en adolescentes en comparación con adultos. Los adolescentes tratados con olanzapina experimentaron una incidencia significativamente más alta de niveles elevados de prolactina y aumentos medios significativamente más altos en los niveles de prolactina en comparación con los adultos. Las elevaciones de la aminotransferasa hepática son más frecuentes en adolescentes que en adultos. Los eventos relacionados con la sedación son más comunes en adolescentes que en adultos.
• Pacientes (edades de 13 a 17 años).
• Geriatría (≥ 65 años de edad):
El número de pacientes de 65 años o más con esquizofrenia o trastornos relacionados expuestos a la olanzapina durante los ensayos clínicos fue limitado (N = 44).
Por lo tanto, se debe tener precaución con el uso de olanzapina en el paciente anciano, reconociendo las disfunciones hepáticas, renales, del sistema nervioso central y cardiovascular más frecuentes, y el uso más frecuente de medicación concomitante en esta población.
• Uso en pacientes geriátricos con demencia:
Mortalidad general: Los pacientes de edad avanzada con demencia tratados con fármacos antipsicóticos atípicos mostraron una mayor mortalidad en comparación con el placebo en un metanálisis de 13 ensayos controlados de diversos fármacos antipsicóticos atípicos. En cinco ensayos controlados con placebo con olanzapina oral en esta población, la incidencia de mortalidad fue del 3,5% para los pacientes tratados con olanzapina en comparación con el 1,5% para los pacientes tratados con placebo. Olanzapina no está indicado en pacientes ancianos con demencia.
Disfagia: La dismotilidad esofágica y la aspiración se han asociado con el uso de drogas antipsicóticas.
La neumonía por aspiración es una causa común de morbilidad y mortalidad en pacientes con Enfermedad de Alzheimer. La olanzapina y otros medicamentos antipsicóticos deben usarse con precaución en pacientes con riesgo de neumonía por aspiración.
Eventos adversos cerebrovasculares (CVAE), incluido el accidente cerebrovascular, en pacientes ancianos con demencia:
Se informaron eventos adversos cerebrovasculares (por ejemplo, accidente cerebrovascular, ataque isquémico transitorio), incluyendo muertes, en ensayos de olanzapina en pacientes ancianos con psicosis relacionada con la demencia. En los estudios controlados con placebo, hubo una mayor incidencia de CVAE en pacientes tratados con olanzapina en comparación con los pacientes tratados con placebo (1,3% frente a 0,4%, respectivamente,). Olanzapina no está aprobada para el tratamiento de pacientes ancianos con demencia.
No hay pruebas suficientes para determinar si los CVAE en pacientes ancianos con demencia están asociados específicamente con olanzapina o con todos los agentes antipsicóticos. Los datos de ensayos clínicos parecen sugerir que los pacientes con un diagnóstico de demencia de tipo vascular o mixto tenían una mayor probabilidad de experimentar CVAE que otros tipos de demencia.
Los riesgos y beneficios del uso de olanzapina en pacientes ancianos con demencia deben evaluó teniendo en cuenta los predictores de riesgo de CVAE en el paciente individual.
Se debe recomendar a los pacientes / cuidadores que informen de inmediato los signos y síntomas de los posibles EAVC, como debilidad repentina o entumecimiento en la cara, los brazos o las piernas, y problemas del habla o la visión.
Uso en pacientes con otras enfermedades concomitantes: La experiencia clínica con olanzapina en pacientes con enfermedades concomitantes es limitada. Por lo tanto, se recomienda precaución cuando se usa olanzapina en pacientes con enfermedades o afecciones que podrían afectar el metabolismo o la actividad farmacodinámica de la olanzapina.
Uso en pacientes con trastornos cardíacos: La olanzapina no se ha evaluado en pacientes con antecedentes recientes de infarto de miocardio o enfermedad cardíaca inestable. Los pacientes con estas afecciones se excluyeron de los ensayos clínicos previos a la comercialización.
Uso en pacientes con diabetes y factores de riesgo para el desarrollo de diabetes: Al igual que con algunos otros antipsicóticos, rara vez se han notificado exacerbaciones de diabetes preexistente e hiperglucemia, y se han notificado muy raramente cetoacidosis diabética y coma diabético que incluyen algunos casos mortales durante el uso de olanzapina, a veces en pacientes sin antecedentes de hiperglucemia.
En algunos casos, se ha informado un aumento previo en el peso corporal que puede ser un factor de predisposición.
Se recomienda una monitorización clínica adecuada en pacientes diabéticos y en pacientes con factores de riesgo para el desarrollo de diabetes mellitus.
Uso en pacientes con insuficiencia renal y hepática: Los estudios pequeños de farmacología clínica de dosis única no revelaron ninguna alteración importante en la farmacocinética de olanzapina en sujetos con insuficiencia renal o hepática. Dada la experiencia clínica limitada con olanzapina en pacientes con estas afecciones, se debe tener precaución.
Otras enfermedades concomitantes: Como la olanzapina demostró actividad anticolinérgica in vitro, se recomienda precaución cuando se prescriba a pacientes con agrandamiento prostático sintomático, glaucoma de ángulo estrecho o íleo paralítico y afecciones relacionadas.
En ensayos clínicos, un solo caso de hipertensión intracraneal preexistente se vio exacerbado.
PRESENTACIONES: Caja con blíster con 14 tabletas recubiertas de 10 mg.
Fecha de revision de texto y version del documento: Febrero 2019
REFERENCIAS BIBLIOGRÁFICAS: PRODUCT MONOGRAPH, APO®-OLANZAPINA, Olanzapina Tablets USP, HEALTH CANADA Drug Product Database, Fecha de revisión 8 de Septiembre de 2017, Fecha de Consulta 12 de Febrero de 2019. https://pdf.hres.ca/dpd_pm/00041240.PDF
APOTEX Inc.