
ANORO ELLIPTA
UMECLIDINIO, VILANTEROL
Polvo para inhalación
Blíster, 1 Inhalador,
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada dosis administrada (la dosis que sale por la boquilla del inhalador) contiene 55 microgramos de umeclidinio (equivalente a 65 microgramos de bromuro de umeclidinio) y 22 microgramos de vilanterol (como trifenatato). Esto corresponde a una dosis predispensada de 62.5 microgramos de umeclidinio (equivalente a 74.2 microgramos de bromuro de umeclidinio) y 25 microgramos de vilanterol (como trifenatato).
FORMA FARMACÉUTICA: Polvo para inhalación, predispensado.
Un inhalador gris claro con una tapa para la boquilla roja y un contador de dosis integrado. El inhalador ELLIPTA™ contiene dos tiras blíster, cada una de las cuales contiene un polvo blanco.
INDICACIONES: ANORO™ ELLIPTA™ está indicado en el tratamiento broncodilatador de mantención para aliviar síntomas asociados con enfermedad pulmonar obstructiva crónica (EPOC).
DATOS FARMACÉUTICOS:
Lista de excipientes: Lactosa monohidratada (la cual contiene proteína de la leche) (25 miligramos de lactosa monohidratada por dosis), Estearato de magnesio.
FARMACODINAMIA:
Mecanismo de acción: Umeclidinio/vilanterol es una combinación inhalada de antagonista de receptor muscarínico de acción prolongada/agonista beta2-adrenérgico de acción prolongada (LAMA/LABA). Después de su inhalación, ambos compuestos actúan localmente en las vías respiratorias para producir broncodilatación mediante mecanismos separados.
Umeclidinio: Umeclidinio es un antagonista del receptor muscarínico de acción prolongada (también denominado anticolinérgico). Es un derivado de quinuclidina que constituye un antagonista del receptor muscarínico con actividad entre múltiples subtipos de receptores colinérgicos muscarínicos. Umeclidinio ejerce su actividad broncodilatadora inhibiendo competitivamente la fijación de acetilcolina a receptores muscarínicos de acetilcolina en el músculo liso de las vías respiratorias. Presenta una baja reversibilidad en el subtipo de receptor muscarínico M3 in vitro y una larga duración de la acción in vivo cuando se administra directamente en los pulmones en modelos preclínicos.
Vilanterol: Vilanterol es un agonista selectivo del receptor beta2-adrenérgico (beta2-agonista) de acción prolongada.
Los efectos farmacológicos de los beta2-agonists, incluyendo vilanterol, se atribuyen, por lo menos en parte, a la estimulación de la adenilato ciclasa intracelular, la enzima que cataliza la conversión de adenosina trifosfato (ATP) a 3’,5’-adenosina monofosfato cíclica (AMP cíclico). Los niveles de AMP cíclico elevados ocasionan relajación del músculo liso bronquial e inhibición de la liberación de mediadores de hipersensibilidad inmediata desde las células, especialmente de los mastocitos.
Efectos farmacodinámicos: En un estudio de eficacia clínica controlado con placebo, ANORO™ ELLIPTA™ aumentó el VEF1 después de la primera dosis en el Día 1 con una mejoría comparado con placebo de 0.11 L (p<0.001) a los 15 minutos después de la administración. El cambio desde la basal al VEF1 pico durante 0-6 horas después de la dosis en el Día 1 y en la Semana 24 fue 0.27 L y 0.32 L respectivamente para ANORO™ ELLIPTA™ en comparación con 0.11 L (Día 1) y 0.10 L (Semana 24) para placebo.
Efectos cardiovasculares: El efecto de umeclidinio/vilanterol en el intervalo QT fue evaluado en un estudio QT controlado con placebo y moxifloxacina involucrando la administración una vez al día de umeclidinio/vilanterol 125/25 microgramos ó 500/100 microgramos durante 10 días en 103 voluntarios sanos. La máxima diferencia media en la prolongación del intervalo QT (corregido usando el método Fridericia, QTcF) después de la basal corregida, con placebo fue 4.3 (90% CI=2.2 a 6.4) milisegundos y se observó 10 minutos después de la administración de umeclidinio/vilanterol 125/25 microgramos y 8.2 (90% CI=6.2 a 10.2) milisegundos observada 30 minutos después de la administración de umeclidinio/vilanterol 500/100 microgramos. No se observó un efecto clínicamente relevante en la prolongación del intervalo QT (corregido utilizando el método de Fridericia).
Además, no se observaron efectos clínicamente significativos de umeclidinio/vilanterol en el ritmo cardíaco durante el monitoreo Holter de 24 horas en 281 pacientes tratados con umeclidinio/vilanterol 125/25 microgramos una vez al día hasta por 12 meses.
FARMACOCINÉTICA: Cuando umeclidinio y vilanterol se administraron en una combinación por vía inhalada, la farmacocinética de cada componente fue similar a aquella observada cuando cada principio activo se administró por separado (vea Metabolismo; Interacciones medicamentosas). Por lo tanto, cada componente puede considerarse por separado para fines farmacocinéticos.
Absorción:
Umeclidinio: Después de la inhalación de umeclidinio en voluntarios sanos, la Cmáx ocurrió a los 5 a 15 minutos. La biodisponibilidad absoluta de umeclidinio inhalado fue en promedio 13% de la dosis, con una contribución insignificante de la absorción oral. Después de la administración repetida de umeclidinio inhalado, se alcanzó el estado estable en los siguientes 7 a 10 días, con una acumulación de 1.5 a 2 veces mayor.
Vilanterol: Después de la administración inhalada de vilanterol a voluntarios sanos, la Cmáx ocurrió a los 5 a 15 minutos. La biodisponibilidad absoluta de vilanterol inhalado fue 72%, con una contribución insignificante de la absorción oral. Después de la administración repetida de vilanterol inhalado, se alcanzó el estado estable en los siguientes 6 días, con una acumulación hasta 2.4 veces mayor.
Distribución:
Umeclidinio: Después de la administración intravenosa a sujetos sanos, el volumen medio de distribución fue 86 litros. La fijación a proteínas plasmáticas in vitro en plasma humano fue en promedio 89%.
Vilanterol: Después de la administración intravenosa a voluntarios sanos, el volumen medio de distribución en estado estable fue 165 litros. La fijación a proteínas plasmáticas in vitro en plasma humano fue en promedio 94%.
Metabolismo
Umeclidinio: Estudios in vitro demostraron que umeclidinio es metabolizado principalmente mediante el citocromo P450 2D6 (CYP2D6) y es un substrato para el transportador glucoproteína P (Pgp).
Las principales vías metabólicas para umeclidinio son oxidativas (hidroxilación, O-desalquilación), seguidas de conjugación (glucoronidación, etc.), resultando en un rango de metabolitos con actividad farmacológica disminuida o para los que aún no se ha establecido la actividad farmacológica. La exposición sistémica de los metabolitos es baja.
Vilanterol: Estudios in vitro demostraron que vilanterol se metaboliza principalmente mediante el citocromo P450 3A4 (CYP3A4) y que es un substrato para el transportador Pgp. Las principales vías metabólicas son O-desalquilación a un rango de metabolitos con actividad beta1- y beta2-agonista significativamente disminuida. Los perfiles metabólicos plasmáticos después de la administración oral de vilanterol en un estudio radiomarcado en humanos fueron consistentes con un metabolismo de primer paso elevado. La exposición sistémica a los metabolitos es baja.
CONTRAINDICACIONES: ANORO™ ELLIPTA™ está contraindicado en pacientes con alergia grave a la proteína de la leche.
ADVERTENCIAS Y PRECAUCIONES: El uso de ANORO™ ELLIPTA™ no ha sido estudiado en pacientes con asma y no se recomienda en esta población de pacientes.
ANORO™ ELLIPTA™ está indicado para el tratamiento de mantenimiento de la EPOC. No debe ser utilizado para el alivio de síntomas agudos, esto es como terapia de rescate para el tratamiento de episodios agudos de broncoespasmo. Los síntomas agudos deben ser tratados con un broncodilatador de corta acción inhalado. El aumento del uso de broncodilatadores de acción corta para el alivio de los síntomas indica deterioro del control y los pacientes deben ser examinados por un médico.
Al igual que con otros tratamientos inhalados, la administración de ANORO™ ELLIPTA™ puede producir broncoespasmo paradójico que podría poner en peligro la vida. El tratamiento con ANORO™ ELLIPTA™ debe descontinuarse en caso de ocurrir broncoespasmo paradójico y, de ser necesario, se debe instituir un tratamiento alternativo.
Se pueden observar efectos cardiovasculares tales como arritmias, ej., fibrilación auricular y taquicardia, después de la administración de agentes simpaticomiméticos y antagonistas de receptores muscarínicos, incluyendo ANORO™ ELLIPTA™. Por lo tanto, ANORO™ ELLIPTA™ debe ser utilizado con precaución en pacientes con enfermedad cardiovascular grave.
Consistentemente con su actividad antimuscarínica, ANORO™ ELLIPTA™ debe ser utilizado con precaución en pacientes con glaucoma de ángulo cerrado o retención urinaria.
EMBARAZO Y LACTANCIA:
Fertilidad: No hay datos sobre los efectos de ANORO™ ELLIPTA™ en la fertilidad humana. Estudios en animales no indican efectos de umeclidinio o vilanterol en la fertilidad (vea Datos de seguridad preclínica).
Embarazo: Los datos sobre el uso de ANORO™ ELLIPTA™ en mujeres embarazadas son limitados o inexistentes. Estudios en animales han demostrado toxicidad reproductiva después de la administración inhalada de vilanterol (vea Datos de seguridad preclínica). ANORO™ ELLIPTA™ sólo debe ser utilizado durante el embarazo si el beneficio esperado para la madre justifica el posible riesgo para el feto.
Lactancia: No se sabe si umeclidinio o vilanterol se excretan en leche materna. Sin embargo, otros beta2-agonistas son detectados en leche materna. No se puede excluir un riesgo para neonatos/lactantes amamantados.
Se debe tomar una decisión respecto a descontinuar la lactancia o descontinuar el tratamiento con ANORO™ ELLIPTA™, tomando en consideración el beneficio de la lactancia para el niño y el del tratamiento para la madre.
EFECTOS EN LA CAPACIDAD PARA CONDUCIR Y OPERAR MAQUINARIA: No se han llevado a cabo estudios para investigar el efecto de ANORO™ ELLIPTA™ en la capacidad para llevar a cabo tareas que requieren de juicio o habilidades motoras o cognitivas.
REACCIONES ADVERSAS:
Datos de estudios clínicos: El perfil de seguridad de ANORO™ ELLIPTA™ se basa en aproximadamente 3000 pacientes con EPOC, quienes recibieron dosis de umeclidinio/vilanterol 62.5/ 25 microgramos o mayores hasta por un año durante los estudios clínicos. Esto incluye aproximadamente 1600 pacientes que recibieron 62.5/ 25 microgramos y aproximadamente 1300 pacientes que recibieron 125/ 25 microgramos; ambas una vez al día.
Las reacciones adversas al medicamento (RAM) se presentan por clase de sistemas y órganos MedDRA y por frecuencia. Las frecuencias se definen como: Muy común (≥1/10), común (≥1/100 y <1/10), poco común (≥1/1,000 y <1/100), rara (≥1/10,000 y <1/1,000) y muy rara (<1/10,000).
|
MedDRA Clase de sistemas y órganos |
Reacción(es) adversa(s) |
Frecuencia |
|
Infecciones e infestaciones |
Infecciones de vías urinarias |
Común |
|
Sinusitis |
Común |
|
|
Nasofaringitis |
Común |
|
|
Faringitis |
Común |
|
|
Infecciones de vías respiratorias superiores. |
Común |
|
|
Trastornos cardíacos |
Fibrilación auricular |
Poco común |
|
Taquicardia supraventricular |
Poco común |
|
|
Taquicardia |
Poco común |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
Común |
|
Dolor orofaríngeo |
Común |
|
|
Trastornos gastrointestinales |
Estreñimiento |
Común |
|
Boca seca |
Común |
Datos posteriores a la comercialización:
|
MedDRA Clase de sistemas y órganos |
Reacción(es) adversa(s) |
Frecuencia |
|
Trastornos del sistema inmune |
Reacciones de hipersensibilidad incluyendo: |
|
|
Exantema |
Poco común |
|
|
Anafilaxia, angioedema, y urticaria |
Raro |
|
|
Trastornos psiquiátricos |
Ansiedad |
Poco común |
|
Trastornos del sistema nervioso |
Temblor |
Poco común |
|
Disgeusia |
Poco común |
|
|
Trastornos cardíacos |
Palpitaciones |
Poco común |
|
Trastornos músculoesqueleticos y del tejido conectivo |
Espasmos musculares |
Poco común |
INCOMPATIBILIDADES: No se han identificado incompatibilidades.
Vida útil: La fecha de caducidad se indica en el empaque.
Vida útil durante su uso: Después de ser retirado de la bandeja blíster, el producto puede ser almacenado durante un período máximo de 6 semanas.
INTERACCIONES:
Interacción con beta-bloqueadores: Los bloqueadores beta-adrenérgicos pueden debilitar o antagonizar los efectos de las beta2-agonistas, tales como vilanterol. Se debe evitar el uso concurrente de bloqueadores beta-adrenérgicos no selectivos o selectivos a menos que haya razones imperiosas para su uso.
Interacción con inhibidores CYP3A4: Vilanterol, un componente de ANORO™ ELLIPTA™, es depurado mediante metabolismo extenso de primer paso mediado por CYP3A4 en el tracto gastrointestinal y en el hígado.
Se recomienda tener cuidado al coadministrar con inhibidores CYP3A4 potentes (ej., ketoconazol), ya que existe la posibilidad de una exposición sistémica a vilanterol incrementada, lo que podría llevar a un aumento en la posibilidad de reacciones adversas (vea Farmacocinética).
INTERACCIONES MEDICAMENTOSAS: Los datos farmacocinéticos disponibles en voluntarios sanos y pacientes con EPOC demuestran que la exposición sistémica (Cmáx y AUC) y exposiciones farmacocinéticas poblacionales predichas a umeclidinio y vilanterol no se ven afectadas por la administración de la combinación de umeclidinio/vilanterol en comparación con los componentes administrados por separado. La coadministración con ketoconazol (400 mg), un inhibidor CYP3A4 potente, aumentó el AUC(0-t) y Cmáx de vilanterol en 65% y 22%, respectivamente. El aumento en la exposición de vilanterol no se asoció con un aumento en los efectos sistémicos relacionados con el beta-agonista en la frecuencia cardíaca, potasio sanguíneo o intervalo QT (corregido utilizando el método de Fridericia).
Tanto umeclidinio como vilanterol son substratos de la glucoproteína P (P-gp). El efecto del inhibidor moderado del transportador P-gp verapamilo (240 mg una vez al día) en la farmacocinética en estado estable de umeclidinio y vilanterol fue evaluado en voluntarios sanos. No se observó un efecto de verapamilo en la Cmáx de umeclidinio o vilanterol. Se observó un aumento aproximadamente 1.4 veces mayor en el AUC de umeclidinio sin efectos en el AUC de vilanterol.
Eliminación:
Umeclidinio: La depuración plasmática después de la administración intravenosa fue 151 litros/hora. Después de la administración intravenosa, aproximadamente 58% de la dosis radiomarcada administrada (ó 73% de la radiactividad recuperada) fue excretada en heces a las 192 horas post-dosis. La eliminación urinaria fue responsable de 22% de la dosis radiomarcada administrada a las 168 horas (27% de la radiactividad recuperada). La excreción de material relacionado con el medicamento en heces después de la administración intravenosa indicó la secreción en bilis. Después de la administración oral a sujetos masculinos sanos, la radiactividad total se excretó principalmente en heces (92% de la dosis radiomarcada administrada ó 99% de la radiactividad recuperada) a las 168 horas post-dosis. Menos de 1% de la dosis administrada oralmente (1% de la radiactividad recuperada) fue excretada en orina, lo que sugiere una absorción insignificante después de su administración oral. La vida media de eliminación plasmática de umeclidinio después de la administración inhalada durante 10 días fue, en promedio, 19 horas, con 3% a 4% del medicamento excretado de forma inalterada en orina en estado estable.
Vilanterol: La depuración plasmática de vilanterol después de la administración intravenosa fue 108 litros/hora. Después de la administración oral de vilanterol radiomarcado, el balance de masa mostró 70% del radiomarcaje en orina y 30% en heces. La principal eliminación de vilanterol fue mediante el metabolismo, seguido de excreción de los metabolitos en orina y heces. La vida media de eliminación plasmática de vilanterol después de la administración inhalada durante 10 días fue, en promedio, 11 horas
ESTUDIOS CLÍNICOS: La seguridad y eficacia de ANORO™ ELLIPTA™ administrado una vez al día fueron evaluadas en ocho estudios clínicos de Fase III en pacientes adultos con un diagnóstico clínico de EPOC; cinco fueron estudios de eficacia de 6 meses (DB2113361, DB2113373, DB2113360, DB2113374 y ZEP117115), dos fueron estudios de resistencia al ejercicio de 12 semanas (DB2114417 y DB2114418) y un estudio (DB2113359) evaluó la seguridad de umeclidinio/vilanterol administrado durante un período de tratamiento de 12 meses. Los estudios incluyeron ANORO™ ELLIPTA™ 62.5/25 microgramos y/o umeclidinio/vilanterol 125/25 microgramos, todos una vez al día. Los resultados de eficacia para ANORO™ ELLIPTA™ 62.5/25 microgramos se presentan mas adelante.
Estudios controlados con placebo: En el estudio de 6 meses DB2113373, ANORO™ ELLIPTA™ 62.5/25 microgramos demostró una mejoría estadísticamente significativa en la función pulmonar (definida como el cambio en el VEF1 valle desde la basal a la Semana 24) en comparación con placebo (vea Tabla 1). Los efectos broncodilatadores con ANORO™ ELLIPTA™ en comparación con placebo fueron evidentes después del primer día de tratamiento y se mantuvieron durante el período de tratamiento de 24 semanas.
|
Tabla 1. Variable de eficacia primaria a la Semana 24 (Estudio DB2113373) |
|||
|
VEF1 valle (L) |
|||
|
Diferencia con placebo |
|||
|
Basal (SD) |
Cambio desde la basal (SE) |
Diferencia en el tratamiento Valor p |
|
|
Estudio DB2113373 |
|||
|
ANORO™ ELLIPTA™ (n= 413) |
1.28 (0.56) |
0.17 (0.01) |
0.17 <0.001 |
|
Placebo (n=280) |
1.20 (0.47) |
0.00 (0.02) |
|
|
Abreviaturas: CI= intervalo de confianza; VEF1= volumen espiratorio forzado en 1 segundo; L= litros; mcg= microgramos; n= número de pacientes aleatorizados al tratamiento; OD= una vez al día; SD= desviación estándar; SE= error estándar. |
|||
ANORO™ ELLIPTA™ demostró una mayor mejoría estadísticamente significativa con respecto a la basal en el VEF1 medio ponderado durante 0-6 horas post-dosis a la Semana 24 en comparación con placebo (0.24 L p<0.001).
Se demostró mejoría estadísticamente significativa, con respecto a placebo, en puntaje focal del Índice de Disnea Transicional (TDI) a la Semana 24 para ANORO™ ELLIPTA™ (1.2 unidades; p<0.001). El porcentaje de pacientes que recibió ANORO™ ELLIPTA™ que respondió con una diferencia clínicamente importante mínima (MCID) de ≥1 unidad en la calificación focal TDI a la Semana 24 fue 58% (226/389) en comparación con 41% (106/260) para placebo.
Se demostró mejoría estadísticamente significativa, con respecto a placebo, desde la basal a la Semana 24, en el puntaje total del Cuestionario Respiratorio de St. George (SGRQ), una herramienta de medición del estado de salud específica para la enfermedad, para ANORO™ ELLIPTA™ (-5.51 unidades; p≤0.001). El porcentaje de pacientes tratado con ANORO™ ELLIPTA™ que respondió con una disminución ≥4 unidades (MCID) a partir de la basal en la calificación SGRQ total fue 49% (188/381) en comparación con 34% (86/254) para placebo.
Adicionalmente, los pacientes tratados con ANORO™ ELLIPTA™ requirieron menos tratamiento de rescate, salbutamol, que aquellos tratados con placebo (una disminución estadísticamente significativa promedio de 0.8 disparos por día; p=0.001) Durante el estudio de 24 semanas, los pacientes tratados con ANORO™ ELLIPTA™ tuvieron más días en los que no se necesitó medicamento de rescate (en promedio 36.1%) en comparación con placebo (en promedio, 21.7%; no se llevó a cabo un análisis estadístico formal en esta variable).
El tratamiento con ANORO™ ELLIPTA™ 62.5/25 microgramos resultó en un menor riesgo de exacerbación de EPOC comparado con placebo (análisis del tiempo a la primera exacerbación: Índice de Riesgo (HR por sus siglas en inglés) 0.5, 95% IC 0.3 a 0.8, reducción del riesgo de 50%, p=0.004).
Estudios con tiotropio comparador: En los estudios ZEP117115 y DB2113360 el tratamiento con ANORO™ ELLIPTA™ 62.5/25 microgramos, proporcionó mejoría estadísticamente significativa y cambio clínicamente significativo a partir de la basal en el VEF1 en comparación con tiotropio a la Semana 24 (vea Tabla 2). El Estudio DB2113374 demostró que ANORO™ ELLIPTA™ 62.5/25 microgramos proporcionó mejoría clínicamente significativa a partir de la basal en el VEF1 a la Semana 24 en comparación con tiotropio (vea Tabla 2).
|
Tabla 2. Objetivo primario de eficacia a la Semana 24 (Estudios ZEP117115, DB2113360 y DB2113374) |
|||
|
FEV1 (L) |
|||
|
Diferencia con tiotropio |
|||
|
Basal (SD) |
Cambio a partir de la basal (SE) |
Diferencia debida al Tratamiento valor p |
|
|
Estudio ZEP117115 |
|||
|
ANORO™ ELLIPTA™ 62.5/25 mcg OD (n=454) |
1.25 |
0.21 |
0.11 (0.08,0.14) <0.001 |
|
Tiotropio 18 mcg OD (n=451) |
1.25 |
0.09 |
|
|
Estudio DB2113360 |
|||
|
ANORO™ ELLIPTA™ 62.5/25 mcg OD |
1.32 |
0.21 |
0.09 (0.04,0.14) <0.001 |
|
Tiotropio 18 mcg OD |
1.29 |
0.12 |
|
|
Estudio DB2113374 |
|||
|
ANORO™ ELLIPTA™ |
1.16 (0.48) |
0.21 (0.02) |
0.06 (0.01, 0.11) |
|
Tiotropio 18 mcg OD |
1.16 |
0.15 |
|
|
Abreviaturas: CI= intervalo de confianza; VEF1= volumen espiratorio forzado en 1 segundo; L= litros; mcg= microgramos; n= número de pacientes recibiendo el tratamiento; OD= una vez al día; SD= desviación estándar; SE= error estándar; |
|||
En los estudios ZEP117115 y DB2113360 ANORO™ ELLIPTA™ demostró una mejoría mayor de manera estadísticamente significativa de 0.11 L y 0.07 L respectivamente en el cambio en el VEF1 medio ponderado durante 0-6 horas desde la basal a la Semana 24 en comparación con tiotropio (ambos p≤0.005). En el Estudio DB2113374 ANORO™ ELLIPTA™ demostró una mejoría clínicamente significativa de 0.10 L en el cambio en el VEF1 medio ponderado durante 0-6 horas desde la basal a la Semana 24 en comparación con tiotropio.
En los estudios DB2113360 y DB2113374, ANORO™ ELLIPTA™ y tiotropio mejoraron las mediciones de disnea (puntaje focal TDI) y la calidad de vida relacionada con salud (SGRQ) en comparación con la basal. En el tercer estudio comparador activo (ZEP117115), se demostró una mejoría estadísticamente significativa en comparación con tiotropio en el cambio de la basal en la calificación total SGRO en la semana 24 para ANORO™ ELLIPTA™ (-2.10 unidades; p=0.006). El porcentaje de pacientes que recibieron ANORO™ ELLIPTA™ que respondieron con una reducción de la basal de ≥4 unidades (MCID) en la calificación total SGRO de este estudio fue 53% (237/445) en comparación con 46% (196/430) para tiotropio.
Se observó mejoría estadísticamente significativa en el uso de salbutamol de rescate durante las semanas 1-24 para ANORO™ ELLIPTA™ sobre tiotropio en los estudios ZEP117115 (0.5 disparos al día; p<0.001) and DB2113360 (-0.7 disparos al día p=0.022)
A lo largo de los estudios ZEP117115, DB2113360 y DB2113374, los pacientes tratados con ANORO™ ELLIPTA™ tuvieron, en promedio, una mayor reducción de la basal en la proporción de días en que no se necesitaron medicamentos de rescate (21.5%, 18.6% y 17.6% respectivamente) en comparación con tiotropio (13.3%, 11.7% y 13.4% respectivamente, no se realizó un análisis estadístico normal con este criterio de valoración).
En el estudio ZEP117115, el tratamiento con ANORO™ ELLIPTA™ 62.5/25 microgramos resultó en un menor riesgo de exacerbación de COPD con tiotropio (análisis del tiempo a la primera exacerbación: Razón de riesgos (HR) 0.5, CI de 95% 0.3 a 1.0, reducción de riesgo 50%, p=0.044).
Estudios de apoyo sobre resistencia al ejercicio durante 3 meses: La resistencia al ejercicio se evaluó mediante la prueba de resistencia de lanzadera (ESWT, endurance shuttle walk test) en pacientes adultos con EPOC con hiperinflación (capacidad residual funcional [FRC] >120%) en dos estudios clínicos de 12 semanas replicados.
En un estudio (DB2114418), el tratamiento con ANORO™ ELLIPTA™ 62.5/25 microgramos demostró mejoría estadísticamente significativa sobre placebo en el tiempo de resistencia al ejercicio (EET) obtenido 3 horas después de la administración a la Semana 12 de 69.4 segundos (p=0.003). La mejoría en el EET en comparación con placebo, se observó al Día 2 y se mantuvo hasta la Semana 6 y Semana 12. En el segundo estudio (DB2114417), el tratamiento con ANORO™ ELLIPTA™ 62.5/25 microgramos no demostró mejoría sobre placebo estadísticamente significativa en el EET (21.9 segundos; p>0.05).
En el Estudio DB2114418, ANORO™ ELLIPTA™ demostró mejoría estadísticamente significativa en el VEF1 valle a la Semana 12 (0.24 L p<0.001) y mejorías estadísticamente significativas en comparación con placebo en el cambio en las mediciones de volúmenes pulmonares desde la basal y a las 3 horas post-dosis en la Semana 12 (capacidad inspiratoria: 0.24 y 0.32 L respectivamente, volumen residual: 0.47 y -0.64 L respectivamente y capacidad residual funcional: -0.35 y -0.52 L; todos p<0.001). En el Estudio DB2114417, ANORO™ ELLIPTA™ demostró mejoría clínicamente significativa en comparación con placebo en el cambio en VEF1 desde la basal a la Semana 12 (de 0.21 L), y mejorías en comparación con placebo en el cambio en las mediciones de volúmenes pulmonares desde la basal y a las 3 horas post-dosis en la Semana 12 (capacidad inspiratoria: 0.20 y 0.24 L respectivamente, volumen residual: 0.29 y 0.35 L respectivamente y capacidad residual funcional: 0.24 y 0.30 L respectivamente).
DATOS DE SEGURIDAD PRECLÍNICA: En estudios no clínicos con umeclidinio y vilanterol, los hallazgos fueron aquellos típicamente relacionados con la farmacología primaria de antagonistas del receptor muscarínico o beta2-agonistas, respectivamente, y/o irritación local. La administración de umeclidinio y vilanterol en combinación no resultó en toxicidades nuevas. Los siguientes enunciados reflejan los estudios llevados a cabo en los componentes individuales.
Carcinogénesis/mutagénesis: Umeclidinio no fue genotóxico en una batería estándar de estudios y no fue carcinogénico en estudios de inhalación de por vida en ratones o ratas a exposiciones ≥ 26 ó ≥ 22 veces mayores a la exposición clínica humana de umeclidinio 62.5 microgramos, con base en el AUC, respectivamente.
Estudios de toxicidad genética indican que vilanterol no representa un riesgo genotóxico para humanos. Consistentemente con los hallazgos de otros beta2-agonistas, en estudios de inhalación de por vida, vilanterol ocasionó efectos proliferativos en el tracto reproductivo de ratas y ratones hembra y en la glándula pituitaria de ratas. No hubo un aumento en la incidencia de tumores en ratas o ratones a exposiciones 0.5 ó 13 veces mayores a la exposición clínica humana de vilanterol 25 microgramos con base en el AUC, respectivamente.
Toxicología reproductiva: Ni umeclidinio ni vilanterol tienen efectos adversos en la fertilidad masculina o femenina en ratas.
Umeclidinio no fue teratogénico en ratas o conejos. En un estudio pre- y post-natal, la administración subcutánea de umeclidinio a ratas resultó en menores aumentos de peso corporal materno y consumo de alimentos y aumentos de peso corporal de crías previo al destete discretamente disminuido en hembras tratadas con una dosis de 180 microgramos/kg/día (aproximadamente 80 veces la exposición clínica humana de 62.5 microgramos de umeclidinio, con base en el AUC).
Vilanterol no fue teratogénico en ratas. En estudios de inhalación en conejos, vilanterol ocasionó efectos similares a aquellos observados con otros beta2-agonistas (paladar hendido, párpados abiertos, fusión esternebral y flexión/malrotación de extremidades) a 6 veces la exposición clínica humana con base en el AUC. Cuando se administró subcutáneamente, no se observaron efectos a 36 veces la exposición clínica humana de 25 microgramos de vilanterol, con base en el AUC.
POBLACIONES ESPECIALES DE PACIENTES:
Ancianos: Un análisis farmacocinético poblacional demostró que la farmacocinética de umeclidinio y vilanterol fue similar entre pacientes con EPOC de 65 años de edad y mayores y aquellos menores de 65 años de edad.
Insuficiencia renal: Los sujetos con insuficiencia renal grave no mostraron evidencia de un incremento en la exposición sistémica a umeclidinio o vilanterol (Cmáx y AUC), y no hubo evidencia de una alteración en la fijación a proteínas entre sujetos con insuficiencia renal grave y voluntarios sanos.
Insuficiencia hepática: Los sujetos con insuficiencia hepática moderada no mostraron evidencia de un incremento en la exposición sistémica de umeclidinio o vilanterol (Cmáx y AUC), y no hubo evidencia de una alteración en la fijación a proteínas entre sujetos con insuficiencia moderada hepática y voluntarios sanos. Umeclidinio/vilanterol no ha sido evaluado en sujetos con insuficiencia hepática grave.
Otras características de pacientes: Un análisis farmacocinético poblacional demostró que no se requiere de un ajuste de dosis para umeclidinio o vilanterol con base en el efecto de la edad, raza, género, uso de corticosteroides inhalados o peso. Un estudio en metabolizadores CYP2D6 deficientes no mostró evidencia de un efecto cínicamente significativo del polimorfismo genético de CYP2D6 en la exposición sistémica de umeclidinio.
PRECAUCIONES ESPECIALES PARA SU USO: Almacenar a menos de 30 °C. Si se almacena en el refrigerador, permita que el inhalador recupere la temperatura ambiente por un mínimo de una hora antes de usarse.
DOSIS Y ADMINISTRACIÓN: ANORO™ ELLIPTA™ es únicamente para inhalación oral.
ANORO™ ELLIPTA™ debe ser administrado una vez al día a la misma hora.
Adultos: La dosis recomendada y máxima es una inhalación de ANORO™ ELLIPTA™ 62.5/25 microgramos una vez al día.
Niños: El uso en pacientes menores de 18 años de edad no es relevante debido a la indicación de este producto.
Ancianos: No se requiere ajuste de dosis para pacientes mayores de 65 años de edad (vea Farmacocinética - Poblaciones especiales de pacientes).
Insuficiencia renal: No se requiere ajuste de dosis en pacientes con insuficiencia renal (vea Farmacocinética - Poblaciones especiales de pacientes).
Insuficiencia hepática: No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve o moderada. ANORO™ ELLIPTA™ no ha sido estudiado en pacientes con insuficiencia hepática grave (vea Farmacocinética - Poblaciones especiales de pacientes).
INSTRUCCIONES DE USO: Cuando utilice por primera vez el inhalador ELLIPTA™, no necesita revisar que se encuentre funcionando adecuadamente y no necesita prepararlo para su uso de manera especial. Simplemente siga las instrucciones a continuación.
El inhalador se encuentra empacado en una bandeja blíster que contiene un sobre de desecante para disminuir la humedad. Tire a la basura este sobre - no lo ingiera o inhale.
Al sacar el inhalador de la bandeja blíster, éste se encontrará en posición ‘cerrada’. No lo abra hasta que esté listo para inhalar una dosis del medicamento.
Las instrucciones paso a paso para el inhalador ELLIPTA™ de 30 dosis, a continuación, también aplican para el inhalador ELLIPTA™ de 7 dosis.
Lea esto antes de iniciar: Si usted abre y cierra la tapa sin inhalar el medicamento, perderá la dosis.
La dosis perdida se mantendrá de forma segura dentro del inhalador, pero ya no estará disponible.
No es posible tomar medicamento extra o duplicar la dosis en una inhalación accidentalmente.
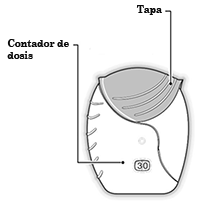
Tapa: Cada vez que abre la tapa, se prepara una dosis del medicamento.
Contador de dosis: Esto muestra cuántas dosis de medicamento quedan en el inhalador.
Antes de que se use el inhalador, muestra exactamente 30 dosis.
El contador disminuye 1 cada vez que se abre la tapa.
Cuando quedan menos de 10 dosis, la mitad del contador de dosis está en rojo.
Después de que haya usado la última dosis, la mitad del contador de dosis está en rojo y se muestra el número 0. El inhalador se encuentra vacío.
Si usted abre la tapa nuevamente, el contador de dosis cambiará de estar sólo la mitad en rojo a todo en rojo.
Prepare una dosis: Espere a abrir la tapa hasta que esté listo para inhalar su dosis.
No agite el inhalador.
Deslice la tapa completamente hasta escuchar un “clic”.
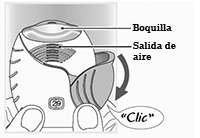
Su medicamento está listo para ser inhalado.
El contador de dosis disminuye en 1 para confirmar.
— Si el contador de dosis no disminuye conforme escucha el “clic”, el inhalador no administrará el medicamento.
— Llévelo a su farmacéutico para recibir orientación.
— No agite el inhalador en ningún momento.
Inhale su medicamento:
— Manteniendo el inhalador lejos de su boca, exhale la mayor cantidad de aire que le resulte cómodo.
— No exhale dentro del inhalador.
— Coloque la boquilla entre sus labios y cierre los labios firmemente alrededor de la misma.
No bloquee la salida de aire con sus dedos.
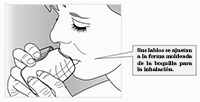
— Tome una inhalación profunda, larga y constante. Retenga el aire lo más que pueda (por lo menos 3 a 4 segundos).
— Retire el inhalador de su boca.
— Respire lenta y suavemente.
Es posible que usted no sienta el medicamento o perciba su sabor, aun cuando esté utilizando el inhalador de forma correcta.
Cierre el inhalador: Si desea limpiar la boquilla, utilice un pañuelo desechable seco antes de cerrar la tapa.
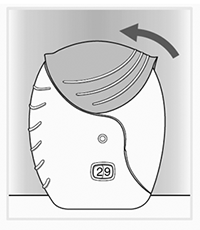
— Para cubrir la boquilla, deslice la tapa hacia arriba hasta donde llegue.
No todas las presentaciones están disponibles en todos los países.
Número de versión: GDS04/IPI05
Fecha de publicación: 30 junio2015
ANORO™ ELLIPTA™ fue desarrollado en colaboración con Theravance, Inc.
ANORO™ y ELLIPTA™ son nombres comerciales del grupo de compañías GlaxoSmithKline.
GSK Pharmaceuticals CR S.A.
SOBREDOSIS:
Síntomas y signos: Una sobredosis de ANORO™ ELLIPTA™ muy probablemente producirá signos y síntomas debido a las acciones de los componentes individuales, de forma consistente con los efectos adversos de antagonistas muscarínicos inhalados conocidos (ej., boca seca, alteraciones de la acomodación visual y taquicardia) y aquellos observados con la sobredosis de otros beta2-agonistas (ej., temblor, cefalea y taquicardia).
Tratamiento: No existe un tratamiento específico para una sobredosis de ANORO™ ELLIPTA™. En caso de una sobredosis, el paciente debe ser tratado con medidas de soporte y monitoreo adecuado, según sea necesario.
El manejo adicional se llevará a cabo según esté clínicamente indicado o tal como lo recomiende el centro nacional de intoxicaciones, en donde se tenga disponible.
NATURALEZA Y CONTENIDO DEL ENVASE: El inhalador de plástico ELLIPTA™ consiste de un cuerpo de color gris claro, una tapa roja para la boquilla y un contador de dosis, empacado en una bandeja blíster de triple laminado con un sobre de desecante. La bandeja blíster está sellada con una hoja de aluminio desprendible.
El inhalador contiene dos tiras ya sea de 7 ó 30 blísteres distribuidos de forma regular, con una tira con 62.5 microgramos de umeclidinio y la otra tira con 25 microgramos de vilanterol.