
ACTILYSE EL SALVADOR-HONDURAS-PANAMA-REPUBLICA DOMINICANA
ALTEPLASA
Solución inyectable
1 Envase(s),2 Frasco(s) ámpula con liofilizado,2 Frasco ámpula,
Caja, 2 Frasco ámpula con diluyente, 2 Frasco ámpula con liofilizado,
COMPOSICIÓN CUALITATIVA Y CUANTITATIVA:
1 vial de polvo contiene:
50 mg de alteplasa (correspondientes a 29,000,000 UI), respectivamente.
La alteplasa es producida mediante la técnica de ADN recombinante, utilizando una línea celular ovárica de hámster chino. La actividad específica de la alteplasa, patrón de referencia interno, es de 580,000 UI/mg. Esto ha sido confirmado por comparación con el segundo patrón internacional de la OMS para t- PA. La especificación para la actividad específica de la alteplasa es de 522,000 a 696,000 UI/mg.
Para consultar la lista completa de excipientes ver sección 6.1.
FORMA FARMACÉUTICA:
Polvo liofilizado para solución inyectable.
El polvo se presenta como una pastilla de liofilizado de incolora a amarilla clara. La preparación reconstituida es una solución límpida y de incolora a amarilla clara.

INDICACIONES TERAPÉUTICAS
Tratamiento trombolítico en el infarto agudo de miocardio:
— Régimen de dosificación de 90 minutos (acelerado) (ver sección 4.2): para pacientes en los cuales el tratamiento puede iniciarse dentro de las 6 h después de la presentación de los síntomas.
— Régimen de dosificación de 3 h (ver sección 4.2): para pacientes en los cuales el tratamiento puede iniciarse entre las 6 y 12 h después de la presentación de los síntomas, siempre que el diagnóstico esté claramente confirmado.
ACTILYSE® ha demostrado reducir la mortalidad al cabo de 30 días en pacientes con infarto de miocardio agudo.
Tratamiento trombolítico en embolia pulmonar masiva aguda con inestabilidad hemodinámica: El diagnóstico deberá ser confirmado, siempre que sea posible, mediante medios objetivos como p.ej. angiografía pulmonar o procedimientos no invasivos como la gammagrafía isotópica pulmonar. No hay evidencia de efectos positivos sobre la mortalidad y morbilidad tardía relacionadas con la embolia pulmonar.
Tratamiento fibrinolítico del ictus isquémico agudo: El tratamiento debe iniciarse tan pronto como sea posible dentro de las 4.5 horas después de la presentación de los síntomas de ictus y después de la exclusión de hemorragia intracraneal mediante técnicas de imagen apropiadas (p. ej. tomografía computarizada craneal u otros métodos de diagnóstico por imagen sensibles a la presencia de hemorragia). El efecto del tratamiento es dependiente del tiempo; por tanto, un tratamiento temprano aumenta la probabilidad de un desenlace favorable.
PROPIEDADES FARMACOLÓGICAS:
• Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Agentes trombolíticos, código ATC: B01AD02
Mecanismo de acción: El componente activo de ACTILYSE® es la alteplasa, un activador recombinante del plasminógeno tisular humano, una glucoproteína que activa directamente el plasminógeno a plasmina. Cuando se administra por vía intravenosa, la alteplasa permanece relativamente inactiva en el sistema circulatorio. Una vez se conjuga con la fibrina, es activada, induciendo la conversión del plasminógeno en plasmina, lo cual produce la disolución del coágulo de fibrina.
Efectos farmacodinámicos: Debido a su especificidad relativa por la fibrina, la alteplasa a dosis de 100 mg produce una modesta disminución de los niveles de fibrinógeno circulante hasta el 60% aproximadamente a las 4 horas, que generalmente revierte a más del 80% después de 24 horas. El plasminógeno y la a-2-antiplasmina disminuyen hasta aproximadamente el 20% y el 35% respectivamente, después de 4 horas y aumentan de nuevo a más del 80% a las 24 horas. Sólo en unos pocos pacientes se observa una disminución marcada y prolongada del nivel de fibrinógeno circulante.
Eficacia clínica y seguridad: En un estudio que incluía más de 40,000 pacientes con infarto de miocardio agudo (GUSTO), la administración de 100 mg de alteplasa durante 90 minutos, con perfusión concomitante de heparina intravenosa, redujo la mortalidad a los 30 días (6.3%), en comparación con la administración de estreptoquinasa, 1.5 millones U durante 60 minutos, con heparina subcutánea o intravenosa (7.3%). Los pacientes tratados con ACTILYSE® mostraron una mayor permeabilidad de los vasos relacionados con el infarto a los 60 y 90 minutos de la trombolisis que los pacientes tratados con estreptoquinasa. No se encontraron diferencias en la permeabilidad a los 180 minutos, ni más tarde.
La mortalidad al cabo de 30 días se reduce, en comparación con pacientes que no reciben terapia trombolítica.
La liberación de a-hidroxibutirato-deshidrogenasa (HBDH) se reduce. La función ventricular global así como la motilidad de la pared regional resulta menos afectada, en comparación con pacientes que no reciben terapia trombolítica.
Infarto agudo de miocardio: Un estudio controlado con placebo realizado con 100 mg de alteplasa durante 3 horas (LATE), demostró una reducción de la mortalidad al cabo de 30 días, en comparación con el placebo, en pacientes tratados dentro de las 6 - 12 horas después de la presentación de los síntomas. El tratamiento puede ser beneficioso en los casos en que todavía se observan signos claros de infarto de miocardio, si el tratamiento se inicia hasta 24 horas después de la presentación de los síntomas.
Embolia pulmonar aguda masiva: En pacientes con embolia pulmonar masiva aguda e inestabilidad hemodinámica, el tratamiento trombolítico con ACTILYSE® conduce a una rápida reducción del tamaño del trombo y a una disminución de la presión arterial pulmonar. No se dispone de datos sobre mortalidad.
Pacientes con Ictus isquémico agudo: En dos estudios de Estados Unidos (NINDS A/B) una proporción de pacientes significativamente mayor presentó un desenlace favorable con alteplasa en comparación con placebo (sin o con mínima discapacidad). Estos hallazgos se confirmaron en el ensayo ECASS III (ver el siguiente parágrafo), después de que entretanto dos estudios europeos y un estudio adicional realizado en EEUU no hubieran proporcionado la correspondiente evidencia según los requisitos de la información de producto europea vigente.
El ensayo ECASS III fue un ensayo de doble ciego controlado con placebo realizado en pacientes con ictus agudo en un intervalo de tiempo de 3 a 4.5 horas en Europa. La administración del tratamiento en el ensayo ECASS III estaba en línea con el Resumen de Características de Producto europeo para ACTILYSE® en la indicación de ictus, excepto el límite superior del intervalo de tiempo de tratamiento, esto es 4.5 horas.
El criterio de valoración principal fue la discapacidad a los 90 días, dividido según desenlace favorable (escala de Rankin modificada [mRS] de 0 a 1) o desfavorable (mRS de 2 a 6). Se aleatorizó un total de 821 pacientes (418 alteplasa/ 403 placebo). Más pacientes alcanzaron un desenlace favorable con alteplasa (52.4%) que con placebo (45.2%; razón de probabilidad [OR], 1.34; 95% IC 1.02-1.76; P=0.038). La incidencia de cualquier HIC//HIC sintomática fue superior con alteplasa que con placebo (cualquier HIC 27.0% versus 17.6%, p=0.0012; HIC sintomática definida en ECASS III 2.4 % versus 0.2 %, p=0.008). La mortalidad fue baja y no fue significativamente diferente entre alteplasa (7.7%) y placebo (8.4%; P=0.681). Los resultados de los subgrupos del ensayo ECASS III confirmaron que un OTT más largo está asociado a un mayor riesgo de mortalidad y de hemorragia intracraneal sintomática. Los resultados del ensayo ECASS III muestran un beneficio clínico neto positivo para ACTILYSE® en el intervalo de tiempo de 3 a 4.5 horas, mientras que los datos combinados demuestran que el beneficio clínico neto ya no es favorable para alteplasa en el intervalo de tiempo por encima de 4.5 horas.
Se ha evaluado la seguridad y la eficacia de ACTILYSE® en el tratamiento del ictus isquémico agudo hasta 4.5 horas de tiempo desde el inicio de la presentación de los síntomas de ictus hasta el tratamiento (OTT) mediante un registro en curso (SITS-ISTR: Registro de la implementación segura de la trombolisis en el ictus). En este estudio observacional, se comparan los datos de los resultados de seguridad de 21,566 pacientes tratados en el intervalo de tiempo de 0 a 3 horas con los datos de 2,376 pacientes tratados entre las 3 y las 4.5 horas después del inicio del ictus isquémico agudo. Se observó que la incidencia de hemorragia intracraneal sintomática (de acuerdo con la definición SITS-MOST) era superior en el intervalo de tiempo de 3 a 4.5 horas (2.2%) en comparación con el intervalo de tiempo de hasta 3 horas (1.7%). Las tasas de mortalidad a los 3 meses fueron similares comparando el intervalo de tiempo de 3 a 4.5 horas (12.0%) con el intervalo de tiempo de 0 a 3 horas (12.3%), con un OR no ajustado de 0.97 (95% IC: 0.84-1.13, p=0.70) y un OR ajustado de 1.26 (95% IC; 1.07-1.49, p=0.005). Los datos observacionales SITS avalan la evidencia del ensayo clínico de que el OTT es un buen indicador del desenlace tras el tratamiento de un ictus agudo con alteplasa.
Pacientes de edad avanzada (> 80 años): Se usaron los meta-análisis con datos ajustados de pacientes individuales de 6.756 pacientes incluyendo los de > de 80 años en nueve ensayos aleatorizados que comparaban alteplasa con placebo o controles abiertos para evaluar el beneficio-riesgo de alteplasa en pacientes de > 80 años. La probabilidad de un buen desenlace del ictus (mRS 0 – 1 en día 90/180) aumentó y se asoció a un beneficio mayor cuando fueron tratados antes para todos los grupos de edad (valor de p de 0.0203 para la interacción) y fue independiente de la edad.
El efecto del tratamiento de alteplasa fue similar para los pacientes de 80 años o más jóvenes (retraso medio del tratamiento 4,1 horas: 990/2512 (39%) tratados con alteplasa frente a 853/2515 (34%) de control consiguieron un buen desenlace del ictus en día 90/180: OR 1.25, 95% IC 1.10-1.42) y para aquellos mayores de 80 años (retraso medio del tratamiento 3.7 horas: 155/879 (18%) tratados con alteplasa frente a 112/850 (13%) de control consiguieron un buen desenlace del ictus: OR 1.56, 95% IC 1.17-2.08).
En pacientes mayores de 80 años tratados con alteplasa en menos o igual a 3 horas, se consiguió un buen desenlace del ictus en 55/302 (18.2%) frente a 30/264 (11.4%) de control (OR 1.86, 95% IC 1.11-3.13) y en aquellos tratados con alteplasa en 3 horas – 4.5 horas 58/342 (17.0%) consiguieron un buen desdenlace del ictus frente a 50/364 (13.7%) de control (OR 1.36, 95% IC 0.87-2.14).
231 (6.8%) de 3.391 pacientes asignados a alteplasa sufrieron hemorragia parenquimal de tipo 2 en 7 días frente a 44 (1.3%) de 3.365 asignados al control (OR 5.55, 95% IC 4.01-7.70).
91 pacientes (2.7%) asignados a alteplasa sufrieron hemorragia parenquimal de tipo 2 fatal en 7 días frente a 13 (0.4%) asignados al control (OR 7.14, 95% IC 3.98-12.79).
En pacientes mayores de 80 años tratados con alteplasa 32/879 (3.6%) sufrieron hemorragia intracraneal fatal en 7 días frente a 4/850 (0.5%) en controles (OR 7.95, 95% IC 2.79-22.60).
De un total de 8.658 pacientes de > 80 años tratados en < 4.5 horas desde el inicio del ictus en el SITS- ISTR, se compararon los datos de los 2.157 pacientes tratados en > 3 a 4.5 horas desde el inicio del ictus con aquellos de los 6.501 pacientes tratados en < 3 horas.
La independencia funcional a los tres meses (puntuación mRS 0 – 2) fue de 36% frente al 37% (OR ajustado 0.79, 95% IC 0.68 – 0.92), la mortalidad fue del 29% frente al 29.6% (OR ajustado 1.10, 95% IC 0.95 – 1.28), y la HIC sintomática (según la definición SITS-MOST) fue de 2.7% frente al 1.6% (OR ajustado 1.62, 95% IC 1.12 – 2.34).
Población pediátrica: Se han obtenido datos observacionales no aleatorizados y no comparativos sobre pacientes con ictus de 16-17 años de edad con tratamiento de alteplasa confirmado de SITS-ISTR (Implementación segura de tratamientos en accidentes cerebrovasculares: Registro Internacional de Trombolisis de Accidente Cerebrovascular, un registro internacional independiente). Entre 2003 y finales de 2017, se recolectó en el registro SITS un total de 25 pacientes pediátricos con uso de alteplasa confirmado dentro del grupo de edad de 16 a 17 años. La dosis media de alteplasa utilizada en este grupo de edad fue de 0.9 mg / kg (rango: 0.83 a 0.99 mg / kg). 23 de 25 pacientes iniciaron el tratamiento dentro de las 4.5 h posteriores al inicio de los síntomas (19 por 3 h, 4 por 3 - 4.5 h, 1 por 5 - 5.5 h, 1 caso no informado). El peso varió de 56 a 90 kg. La mayoría de los pacientes presentaron un ACV moderado o moderado a grave con una NIHSS mediana de 9.0 (rango 1 - 30) al inicio del estudio.
Las puntuaciones del día 90 mRS estaban disponibles en 21/25 pacientes. En el día 90, 14/21 pacientes tenían una puntuación mRS de 0-1 (sin síntomas o sin discapacidad significativa) y 5 pacientes más tenían mRS = 2 (ligera discapacidad). Esto significa que 19/21 (más del 90%) de los pacientes tuvieron un resultado favorable en el día 90 según mRS. Los 2 pacientes restantes tuvieron un resultado informado de discapacidad moderada grave (mRS = 4, n = 1) o muerte (mRS = 6) dentro de los 7 días (n = 1).
Cuatro pacientes no tenían una puntuación de día 90 mRS informada. La última información disponible mostró que 2/4 pacientes tenían una mRS de 2 al día 7 y 2/4 pacientes informaron una mejoría global clara al día 7.
Los datos de seguridad sobre los eventos adversos de hemorragias y edema también estaban disponibles en el registro. De los 25 pacientes de la categoría de edad de 16-17 años, ninguno tenía hemorragia intracerebral sintomática (ICHH, hemorragia hemorrágica de HCH tipo PH2). 5 casos desarrollaron edema cerebral después del tratamiento con alteplasa. 4/5 pacientes con edema cerebral tenían reportado un día 90 mRS entre 0 y 2 o mostraron una mejoría global el día 7 después del tratamiento. Un paciente tenía una mRS = 4 (discapacidad moderada grave) informada el día 90. Ninguno de los casos experimentó un desenlace fatal.
En resumen, hubo 25 informes del Registro SITS de pacientes entre 16 y 17 años de edad con accidente cerebrovascular isquémico agudo que han sido tratados de acuerdo con las recomendaciones de adultos con alteplasa. Aunque el tamaño de muestra pequeño impide un análisis estadístico, los resultados globales muestran una tendencia positiva con la dosis de adultos correspondiente utilizada en estos pacientes. Los datos no parecen mostrar un mayor riesgo de hemorragia intracerebral sintomática o edema en comparación con los adultos.
DATOS FARMACÉUTICOS:
Lista de excipientes:
Polvo:
Arginina
Acido fosfórico (para el ajuste del pH) Polisorbato 80
Disolvente:
Agua para preparaciones inyectables
Incompatibilidades: La solución reconstituida puede diluirse con una solución inyectable estéril de cloruro de sodio 9 mg/mL (0.9%) hasta una concentración mínima de 0.2 mg de alteplasa por mL.
Diluciones adicionales, el uso de agua para preparaciones inyectables para dilución o en general el uso de soluciones de carbohidratos para perfusión, como dextrosa, no se recomiendan, debido al aumento de la turbidez de la solución reconstituida.
ACTILYSE® no debe mezclarse con otros medicamentos ni en el mismo vial de perfusión ni en el mismo catéter (ni siquiera con heparina).
Periodo de validez: Viales sin abrir 3 años.
Solución reconstituida: Hecha la mezcla el producto se conserva en refrigeración entre 2 ºC y 8 ºC por 24 horas, y hasta 8 horas a no más de 30 ºC.
Desde un punto de vista microbiológico, el producto debe ser usado inmediatamente tras su reconstitución. Si no se usa inmediatamente, el período de conservación y las condiciones de uso antes de su utilización será responsabilidad de la persona que lo utilice y no debería ser superior a 24 horas entre 2 y 8 ºC.
Precauciones especiales de conservación: Protéjase de la luz.
Consérvese a no más de 30 °C en el envase original hasta el momento de su preparación.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
PROPIEDADES FARMACOCINÉTICAS: La alteplasa se elimina rápidamente de la sangre circulante y se metaboliza principalmente a través del hígado (aclaramiento plasmático 550 - 680 mL/min). La vida media plasmática relevante, t1/2 alfa es de 4 - 5 minutos. Esto significa que, al cabo de 20 minutos, menos de un 10% del valor inicial está presente en el plasma. Para la cantidad residual que permanece en un compartimento profundo, se determinó una vida media beta de aproximadamente 40 minutos.
CONTRAINDICACIONES:
Por lo general, en todas las indicaciones, ACTILYSE® no se debe administrar a pacientes con hipersensibilidad conocida al principio activo alteplasa, a la gentamicina (una traza residual del proceso de fabricación) o a alguno de los excipientes incluidos en la sección 6.1.
Contraindicaciones adicionales en caso de infarto agudo de miocardio, embolia pulmonar aguda masiva e ictus isquémico agudo:
ACTILYSE® está contraindicado en casos en los que existe un alto riesgo de hemorragia como p.ej.:
— trastorno hemorrágico significativo actual o durante los últimos 6 meses
— diátesis hemorrágica conocida
— pacientes que reciben tratamiento efectivo con anticoagulantes orales, p.ej. warfarina sódica (ver sección 4.4)
— hemorragia grave o peligrosa manifiesta o reciente
— sospecha o historia conocida de hemorragia intracraneal
— sospecha de hemorragia subaracnoidea o trastorno después de una hemorragia subaracnoidea por aneurisma
— cualquier historia de lesión del sistema nervioso central (es decir, neoplasia, aneurisma, cirugía intracraneal o espinal)
— masaje cardíaco externo traumático reciente (menos de 10 días), parto obstétrico reciente, punción reciente de un vaso sanguíneo no comprimible (p.ej. punción de la vena yugular o subclavia)
— hipertensión arterial grave no controlada
— endocarditis bacteriana, pericarditis
— pancreatitis aguda
— enfermedad gastrointestinal ulcerativa documentada durante los últimos 3 meses, varices esofágicas, aneurismas arteriales, malformaciones venosas/arteriales
— neoplasia con riesgo de hemorragia aumentado
— enfermedad hepática grave, incluyendo insuficiencia hepática, cirrosis, hipertensión portal (varices esofágicas) y hepatitis activa
— cirugía mayor o traumatismo importante en los últimos 3 meses Contraindicaciones adicionales en el infarto agudo de miocardio:
— cualquier historia conocida de ictus hemorrágico o ictus de origen desconocido
— historia conocida de ictus isquémico o ataque isquémico transitorio (AIT) en los 6 meses anteriores, excepto ictus isquémico agudo actual durante las 4.5 horas anteriores.
Contraindicaciones adicionales en la embolia pulmonar aguda masiva:
— cualquier historia conocida de ictus hemorrágico o ictus de origen desconocido
— historia conocida de ictus isquémico o ataque isquémico transitorio (AIT) en los 6 meses anteriores, excepto ictus isquémico agudo actual durante las 4.5 horas anteriores.
Contraindicaciones adicionales en el ictus isquémico agudo:
— síntomas de accidente isquémico que empiezan más de 4.5 horas antes del inicio de la perfusión o síntomas para los cuales se desconoce la hora del inicio y ésta puede ser potencialmente superior a las 4.5 horas (ver sección 5.1)
— déficit neurológico leve o síntomas de rápida mejora antes del inicio de la perfusión
— ictus grave evaluado clínicamente (p.ej. NIHSS>25) y/o por técnicas de imagen apropiadas
— convulsiones al inicio del ictus
— evidencia de una hemorragia intracraneal en la TC
— síntomas que sugieran hemorragia subaracnoidea, incluso con TC normal
— administración de heparina dentro de las 48 horas previas y un tiempo de tromboplastina que exceda el límite superior normal
— pacientes con historia previa de ictus y diabetes concomitante
— ictus previo en los últimos 3 meses
— recuento plaquetar inferior a 100,000/mm3
— presión sanguínea sistólica > 185 mm Hg o presión sanguínea diastólica > 110 mmHg, o controles agresivos (farmacoterapia intravenosa) necesarios para reducir la presión sanguínea a estos límites
— niveles de glucosa en sangre < 50 mg/dl ó > 400 mg/dL(< 2.8mM o > 22.2 mM).
Uso en niños y adolescentes: ACTILYSE® no está indicado en el tratamiento del ictus isquémico agudo en niños menores de 16 años (para adolescentes mayores de 16 años, ver sección 4.4).
ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO: La presentación adecuada del producto alteplasa debe escogerse cuidadosamente y de acuerdo con el uso previsto. La presentación de 2 mg de alteplasa no está indicada para utilizarse en infarto agudo de miocardio, embolia pulmonar aguda masiva o ictus isquémico agudo (debido al riesgo de infradosificación masiva). La presentación de 50 mg está indicada para su utilización en estas indicaciones.
El tratamiento trombolítico/fibrinolítico requiere una monitorización adecuada. ACTILYSE® debe ser utilizado sólo bajo la responsabilidad y seguimiento de médicos entrenados y con experiencia en la administración de tratamiento trombolítico y con los medios para monitorizar esta administración. Se recomienda que cuando se administre ACTILYSE® esté disponible en todos los casos un equipo de resucitación estándar y farmacoterapia.
Hipersensibilidad: Las reacciones de hipersensibilidad inmunomediada asociadas a la administración de ACTILYSE® pueden ser provocadas por el principio activo alteplasa, a la gentamicina (una traza residual del proceso de fabricación), alguno de los excipientes o el tapón del vial de vidrio con el polvo de ACTILYSE® que contiene goma natural (un derivado del látex). Tras el tratamiento no se ha observado formación sostenida de anticuerpos para la molécula del activador recombinante de plasminógeno tisular humano. No hay experiencia sistemática con la readministración de ACTILYSE®.
También existe riesgo de reacciones de hipersensibilidad mediadas por un mecanismo no inmunitario.
El angioedema constituye la reacción de hipersensibilidad más frecuente notificada con ACTILYSE®. Este riesgo puede aumentar en la indicación de ictus isquémico agudo y/o por el tratamiento concomitante con inhibidores del ECA (ver sección 4.5). Los pacientes tratados para cualquier indicación autorizada se deben vigilar por si presentan angioedema durante o en las 24 h siguientes a la perfusión.
Si se presenta, una reacción de hipersensibilidad grave (p. ej. angioedema), se debe suspender la perfusión e iniciar de inmediato un tratamiento adecuado. Esto puede incluir intubación.
Hemorragias: Si se produce una hemorragia potencialmente peligrosa, en particular hemorragia cerebral, debe interrumpirse el tratamiento fibrinolítico. Sin embargo, por regla general, no es necesario sustituir los factores de coagulación debido a la corta vida media de la alteplasa y al efecto mínimo sobre los factores de la coagulación sistémicos. La mayoría de los pacientes que presentan hemorragia pueden controlarse mediante interrupción del tratamiento trombolítico y anticoagulantes, sustitutivos del plasma y aplicación de presión manual a un vaso comprimible. Debe considerarse la administración de protamina si se ha administrado heparina dentro de las 4 horas después de la presentación de la hemorragia. Puede indicarse el uso racional de productos de transfusión en pacientes que no respondan a estas medidas conservadoras. Después de cada administración debe realizarse una reevaluación mediante análisis clínicos y de laboratorio, para considerar la necesidad de transfundir crioprecipitado, plasma congelado reciente y plaquetas. Con perfusión de crioprecipitado es deseable alcanzar un nivel de fibrinógeno de 1 g/L. Como última alternativa se dispone de agentes antifibrinolíticos.
El riesgo de hemorragia intracraneal es mayor en pacientes de edad avanzada, por lo tanto en estos pacientes debe valorarse cuidadosamente la relación beneficio/riesgo.
Como con todos los agentes trombolíticos, el beneficio terapéutico esperado debe ponderarse cuidadosamente frente al posible riesgo, especialmente en pacientes con:
— traumatismos menores recientes, como biopsias, punciones de vasos mayores, inyecciones intramusculares, masaje cardíaco para resucitación
— trastornos con un mayor riesgo de hemorragia no mencionados en la sección 4.3. Debe evitarse la utilización de catéteres rígidos.
Pacientes que reciben tratamiento anticoagulante oral: Se puede considerar adecuado el uso de ACTILYSE® cuando las pruebas de actividad anticoagulante apropiadas para los correspondientes medicamentos no muestren actividad clínicamente relevante sobre el sistema de coagulación (p. ej. INR ≤ 1.3 para los antagonistas de la vitamina K u otras pruebas pertinentes para otros anticoagulantes orales que estén dentro del correspondiente límite superior de lo normal).
Población pediátrica: Hasta el momento, sólo se dispone de experiencia limitada sobre el uso de ACTILYSE® en niños y adolescentes.
Cuando se considere el uso de ACTILYSE® para el tratamiento del ictus isquémico agudo en adolescentes mayores de 16 años cuidadosamente seleccionados, se debe sopesar la relación beneficio/riesgo de forma individual y discutirse con el paciente y el padre/tutor, según corresponda. Los adolescentes mayores de 16 años deben ser tratados de acuerdo con las instrucciones de uso del prospecto para la población adulta después de la obtención de imágenes mediante técnicas apropiadas para descartar falsos ictus y confirmar la oclusión arterial correspondiente al déficit neurológico (ver sección 5.1).
Advertencias y precauciones especiales adicionales en el infarto agudo de miocardio y en la embolia pulmonar aguda masiva: No debe administrarse una dosis superior a 100 mg de alteplasa debido a que ha sido asociada con un incremento adicional de hemorragias intracraneales. Debe procederse con especial cuidado, para asegurar que la dosis de alteplasa que se perfunde corresponda a la descrita en la sección 4.2.
El beneficio terapéutico esperado debe ser ponderado cuidadosamente frente al posible riesgo, especialmente en pacientes con la presión sanguínea sistólica > 160 mm Hg (ver la sección 4.3).
Antagonistas GPIIb/IIIa: El uso concomitante de antagonistas GPIIb/IIIa aumenta el riesgo de hemorragia. Advertencias y precauciones especiales adicionales en el ictus isquémico agudo:
Precauciones especiales de empleo: El tratamiento sólo debe ser realizado bajo la responsabilidad y supervisión de un médico entrenado y con experiencia en cuidados neurovasculares. Para verificar la indicación a tratar, las medidas de diagnóstico remoto se pueden considerar adecuadas (ver sección 4.1).
Advertencias especiales/condiciones con una relación beneficio/riesgo reducida: Comparado con otras indicaciones, los pacientes con ictus isquémico agudo tratados con ACTILYSE® tienen un riesgo marcadamente aumentado de hemorragia intracraneal, ya que la hemorragia tiene lugar principalmente en el área del infarto. Esto es aplicable en particular a los casos siguientes:
— todas las situaciones enumeradas en la sección 4.3 y en general todas las situaciones que conlleven alto riesgo de hemorragia
— aneurisma pequeño asintomático de los vasos cerebrales
— a medida que aumenta el tiempo desde la aparición de los síntomas del ictus y el inicio del tratamiento, el beneficio clínico neto disminuye. Por tanto, no se debe retrasar la administración de ACTILYSE®
— pacientes pre-tratados con ácido acetilsalicílico (AAS) pueden tener un mayor riesgo de hemorragia intracerebral, sobre todo si se retrasa el tratamiento con ACTILYSE®
— Comparado con pacientes más jóvenes, los pacientes de edad avanzada (más de 80 años) pueden tener un resultado algo peor independientemente del tratamiento. También son más propensos a sufrir ictus más graves que se asocian con un mayor riesgo absoluto de hemorragia intracerebral cuando se los trombolisa en comparación con ictus más leves cuando se los trombolisa o con pacientes no trombolisados. Aunque los datos disponibles indican que el beneficio neto de ACTILYSE® en pacientes de más de 80 años es menor comparado con pacientes más jóvenes, ACTILYSE® se puede usar en pacientes de más de 80 años en base al beneficio-riesgo individual (ver la sección 5.1). Los pacientes de edad avanzada se deben seleccionar muy cuidadosamente teniendo en cuenta tanto la salud general como el estado neurológico.
— El beneficio terapéutico se reduce en pacientes con un ictus previo (ver también la sección 4.3) o en los cuales se conoce una diabetes no controlada, de este modo la relación beneficio-riesgo se considera menos favorable pero todavía positiva para estos pacientes.
— En pacientes con ictus muy leve, los riesgos superan el beneficio esperado (ver la sección 4.3).
— Los pacientes con ictus muy grave presentan un riesgo mayor de hemorragia intracerebral y muerte y no se deben tratar (ver la sección 4.3).
— Los pacientes con infartos extensos presentan un mayor riesgo de resultados insatisfactorios, incluyendo hemorragia grave y muerte. En estos pacientes, se debe considerar cuidadosamente la relación beneficio / riesgo.
— En los pacientes con ictus la probabilidad de un buen desenlace disminuye al aumentar la edad, al aumentar la severidad del ictus y con los niveles de glucosa en sangre altos en el momento del ingreso, mientras que la probabilidad de discapacidad grave y muerte o hemorragias intracraneales destacables aumenta, independientemente del tratamiento. Los pacientes con ictus grave (evaluado clínicamente y/o mediante técnicas de imagen apropiadas) y pacientes con niveles basales de glucosa en sangre < 50 mg/dl o > 400 mg/dl (< 2.8 mM o > 22.2 mM) no se deben tratar con ACTILYSE® (ver la sección 4.3).
Monitorización de la presión sanguínea: La monitorización de la presión sanguínea durante la administración del tratamiento y hasta 24 horas después parece justificada; también se recomienda un tratamiento antihipertensivo por vía intravenosa si la presión sistólica es > 180 mmHg o la presión diastólica es > 105 mmHg.
Otras advertencias especiales: La reperfusión del área isquémica puede inducir a edema cerebral en la zona del infarto.
Debido a un riesgo aumentado de hemorragia, el tratamiento con inhibidores de la agregación plaquetaria no debe iniciarse dentro de las primeras 24 horas después de la trombolisis con alteplasa.
PRECAUCIONES ESPECIALES DE ELIMINACIÓN Y OTRAS MANIPULACIONES:
Para obtener una concentración final de 1 mg de alteplasa por mL tras la reconstitución, todo el volumen del disolvente proporcionado debe transferirse al vial que contiene el polvo de ACTILYSE®. Con este propósito debe utilizarse la cánula de transferencia que se incluye en la presentación de 50 mg.
Para obtener una concentración final de 2 mg de alteplasa por mL tras la reconstitución, sólo debe utilizarse la mitad del disolvente proporcionado (ver tabla). En estos casos, siempre debe utilizarse una jeringa para transferir la cantidad necesaria de disolvente al vial que contiene el polvo de ACTILYSE®.
El contenido de un vial para inyección de ACTILYSE® (50 mg) debe disolverse bajo condiciones asépticas con agua para preparaciones inyectables, según la tabla siguiente, para obtener una concentración final de alteplasa de 1 mg/mL o de 2 mg/mL:
|
ACTILYSE® sustancia seca |
50 mg |
|
(a) Volumen de agua esterilizada para preparaciones inyectables que se debe añadir a la sustancia seca |
50 mL |
|
Concentración final: |
1 mg alteplasa/mL |
|
(b) Volumen de agua esterilizada para preparaciones inyectables que se debe añadir a la sustancia seca |
25 mL |
|
Concentración final: |
2 mg alteplasa/mL |
La solución reconstituida debe administrarse a continuación por vía intravenosa. La solución reconstituida de 1 mg/mL puede diluirse adicionalmente con una solución inyectable estéril de cloruro de sodio 9 mg/mL (0.9 %) hasta una concentración mínima de 0.2 mg/mL. No se recomienda la dilución adicional de la solución reconstituida de 1 mg/mL con agua esterilizada para preparaciones inyectables o, en general, el uso de soluciones de carbohidratos para perfusión, p. ej. dextrosa. ACTILYSE® no debe mezclarse con otros medicamentos ni en el mismo vial de perfusión (ni siquiera con heparina).
Para incompatibilidades ver sección 6.2.
La solución reconstituida es para administración única. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Instrucciones para reconstituir ACTILYSE®:
1. Reconstituir inmediatamente antes de su administración.
2. Retirar las tapas protectoras de los dos viales que contienen agua estéril y ACTILYSE® sustancia seca, respectivamente, tirándolas hacia arriba con un dedo
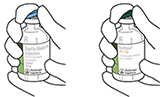
3. Limpiar el tapón de goma de cada uno de los viales con una toallita con alcohol.
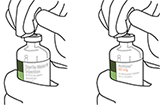
4. Sacar la cánula de transferencia* de su envoltorio.
No desinfectar ni esterilizar la cánula de transferencia; es estéril. Quitar la tapa.
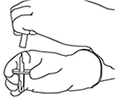
5. Mantener el vial de agua estéril vertical sobre una superficie estable. Directamente desde arriba, perforar el tapón de goma verticalmente en el centro del tapón con la cánula de transferencia, presionando con cuidado pero firmemente, sin girar.
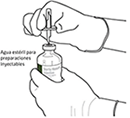
6. Sujetar el vial de agua estéril y la cánula de transferencia firmemente con una mano utilizando las dos solapas laterales.
Retirar la tapa restante de la parte superior de la cánula de transferencia
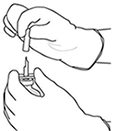
7. Sujetar el vial de agua estéril y la cánula de transferencia firmemente con una mano utilizando las dos solapas laterales.
Sujetar el vial con ACTILYSE® sustancia seca encima de la cánula de transferencia y posicionar la punta de la cánula de transferencia justo en el centro del tapón.
Presionar el vial con la sustancia seca hacia abajo con la cánula de transferencia directamente desde arriba, perforando el tapón de goma verticalmente y con cuidado pero firmemente, sin girar.
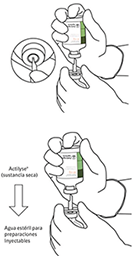
8. Invertir los dos viales y permitir que el agua drene completamente en la sustancia seca.
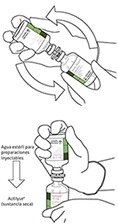
9 Retirar el vial de agua vacío junto con la cánula de transferencia.
Se pueden desechar.
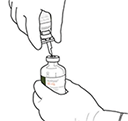
10. Coger el vial con ACTILYSE® reconstituido y girarlo con cuidado para disolver cualquier polvo restante pero no agitar, puesto que esto producirá espuma.
Si hay burbujas, mantener la solución inmóvil durante unos minutos para permitir que desaparezcan.
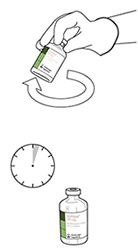
11. La solución contiene 1 mg/ml de ACTILYSE®. Debe ser límpida y de incolora a amarilla clara y no debe contener ninguna partícula.
12. Extraer la cantidad requerida utilizando una aguja y una jeringa.
No utilizar la zona de punción de la cánula de transferencia para evitar pérdidas.
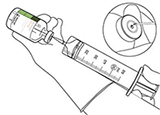
13. Utilizar inmediatamente.
Desechar la solución no utilizada.
* Si se incluye en el kit una cánula de transferencia. La reconstitución también se puede realizar con una jeringa y una aguja.
Nombre y domicilio del laboratorio
Hecho en Alemania por:
Boehringer Ingelheim Pharma GmbH & Co. KG Birkendorfer Straβe 65
88397 Biberach an der Riss, Alemania
Para:
BOEHRINGER INGELHEIM PROMECO S.A. DE C.V.
Maíz No. 49, Col. Barrio Xaltocan,
16090, México, D.F.
® Marca registrada
Logo: Boehringer Ingelheim
Fecha de revisión de la monografía: 22-MAY-2018
FERTILIDAD, EMBARAZO Y LACTANCIA
Embarazo: Los datos relativos al uso de ACTILYSE® en mujeres embarazadas son limitados. Los estudios en animales con dosis superiores a las de los humanos mostraron inmadurez fetal y/o embriotoxicidad, secundario a la actividad farmacológica conocida del medicamento. alteplasa no se considera teratogénica (ver sección 5.3).
En caso de una enfermedad aguda que supone un riesgo para la vida del paciente, debe evaluarse el beneficio frente al riesgo potencial.
Lactancia: Se desconoce si alteplasa se excreta en la leche materna.
Fertilidad: No se dispone de datos clínicos de fertilidad para ACTILYSE®. Estudios en animales realizados con alteplasa no mostraron ningún efecto adverso en fertilidad (ver sección 5.3).
EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR Y UTILIZAR MÁQUINAS: No procede.
REACCIONES ADVERSAS: La reacción adversa más frecuente asociada a ACTILYSE® es la hemorragia con un descenso en los valores de hematocrito y/o hemoglobina.
Las reacciones adversas detalladas a continuación se enumeran según la frecuencia y clasificación por órganos y sistemas. Las frecuencias se definen según las siguientes categorías: muy frecuentes (≥ 1/10), frecuentes (≥ 1/100 a < 1/10), poco frecuentes (≥ 1/1,000 a < 1/100), raras (≥ 1/10,000 a < 1/1,000), muy raras (< 1/10,000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
A excepción de la hemorragia intracraneal como reacción adversa en la indicación ictus y de las arritmias de reperfusión en la indicación infarto de miocardio, no existe ninguna razón médica para suponer que el perfil cualitativo y cuantitativo de reacciones adversas de ACTILYSE® en las indicaciones embolia pulmonar e ictus isquémico agudo sea diferente del perfil en la indicación infarto de miocardio.
|
Tabla 1 Reacciones adversas en infarto agudo de miocardio, embolia pulmonar aguda masiva e ictus isquémico agudo. |
|
|
Clasificación por órganos y sistemas |
Reacción adversa |
|
Hemorragia |
|
|
muy frecuentes |
la hemorragia intracerebral representa la reacción adversa más importante en el tratamiento del ictus isquémico agudo (hasta un 15 % de los pacientes pero sin aumento de la mortalidad y sin ningún aumento relevante en la mortalidad global y en la discapacidad grave combinada, esto es mRS de 5 y 6) hemorragia de vasos sanguíneos lesionados (como hematoma) |
|
frecuentes |
hemorragia intracerebral (como hemorragia cerebral, hematoma cerebral, ictus hemorrágico, transformación hemorrágica del ictus, hematoma intracraneal, hemorragia subaracnoidea) en el tratamiento del infarto agudo de miocardio y embolismo pulmonar agudo hemorragia faríngea hemorragia gastrointestinal (como hemorragia gástrica, úlcera gástrica sangrante, hemorragia rectal, hematemesis, melena, hemorragia bucal, hemorragia gingival) equimosis hemorragia urogenital (como hematuria, hemorragia del tracto urinario) hemorragia en el lugar de inyección (hemorragia en el lugar de punción, hematoma en el lugar de inserción de catéter, hemorragia en el lugar de inserción de catéter) |
|
poco frecuentes |
hemorragia pulmonar (como hemoptisis, hemotorax, hemorragia del tracto respiratorio) epistaxis hemorragia en el oído |
|
raras |
hemorragia en el ojo hemorragia pericardial hemorragia retroperitoneal (como hematoma retroperitoneal) |
|
frecuencia no conocida*** |
hemorragia en los órganos parenquimatosos (como hemorragia hepática) |
|
Trastornos del sistema inmunológico* |
|
|
raras |
Reacciones de hipersensibilidad (p.ej. exantema, urticaria, broncoespasmo, angioedema, hipotensión, shock) |
|
muy raras |
anafilaxia grave |
|
Trastornos del sistema nervioso |
|
|
muy raros |
acontecimientos relacionados con el sistema nervioso (p.ej. ataque epiléptico, convulsiones, afasia, trastorno del habla, delirio, síndrome cerebral agudo, agitación, confusión, depresión, psicosis) a menudo asociados a acontecimientos concurrentes de isquemia o hemorragia cerebrovascular |
|
Trastornos cardíacos** |
|
|
muy frecuentes |
isquemia / angina recurrentes, hipotensión e insuficiencia cardíaca / edema pulmonar |
|
frecuentes |
shock cardiogénico, paro cardíacoy reinfarto |
|
poco frecuentes |
arritmias de reperfusión (como arritmias, extrasístoles, bloqueo auriculoventricular (AV) de primer grado a bloqueo auriculoventricular completo, fibrilación / aleteo (flutter) auricular, bradicardia, taquicardia, arritmia ventricular, taquicardia / fibrilación ventricular, disociación electromecánica [DEM]) regurgitación mitral, embolia pulmonar, otras embolias sistémicas / embolia cerebral, defecto septal ventricular |
|
Trastornos vasculares |
|
|
raras |
embolia, la cual puede conducir a las correspondientes consecuencias en los órganos afectados |
|
Trastornos gastrointestinales |
|
|
raras |
náuseas |
|
frecuencia no conocida*** |
vómitos |
|
Exploraciones complementarias |
|
|
poco frecuentes |
descenso de la presión arterial |
|
frecuencia no conocida*** |
aumento de la temperatura corporal |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
|
|
frecuencia no conocida*** |
embolia grasa (embolización de cristales de colesterol), lo cual puede conducir a las correspondientes consecuencias en los órganos afectados |
|
Procedimientos médicos y quirúrgicos |
|
|
Frecuencia no conocida*** |
transfusión sanguínea (necesaria) |
|
*Ver las secciones 4.4 y 4.5 **Trastornos cardíacos. Como ocurre con otros agentes trombolíticos, se han notificado los siguientes acontecimientos como secuelas de infarto de miocardio y/o administración trombolítica. Estos acontecimientos cardíacos pueden suponer un riesgo para la vida, llegando a producir la muerte. ***Cálculo de la frecuencia. Esta reacción adversa se ha observado a partir de la experiencia post-comercialización. Con un 95 % de seguridad, la categoría de la frecuencia no es mayor que las “raras”, pero puede ser menor. La estimación precisa de la frecuencia no es posible ya que la reacción adversa no ocurrió en la base de datos de ensayo clínicos de 8,299 pacientes. |
|
En pacientes que han padecido un ictus (incluyendo hemorragia intracraneal) y otros episodios hemorrágicos graves se han notificado casos de muerte y discapacidad permanente.
INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN:
No se han realizado estudios formales de interacciones con ACTILYSE® y medicamentos comúnmente administrados en pacientes con infarto agudo de miocardio.
El riesgo de hemorragia aumenta si se administran derivados cumarínicos, anticoagulantes orales, inhibidores de la agregación plaquetaria, heparina no fraccionada o heparina de bajo peso molecular (LMWH) u otras sustancias activas que interfieran con la coagulación (antes, durante o dentro de las primeras 24 horas después del tratamiento con ACTILYSE®) (ver sección 4.3).
El tratamiento concomitante con inhibidores del ECA puede aumentar el riesgo de sufrir una reacción de hipersensibilidad (ver sección 4.4).
El uso concomitante de antagonistas GPIIb/IIIa aumenta el riesgo de hemorragia.
DATOS PRECLÍNICOS SOBRE SEGURIDAD: En estudios de toxicidad subcrónica en ratas y monos titís, no se han observado reacciones adversas inesperadas. En estudios de mutagenicidad, no se observaron indicios de potencial mutagénico.
En animales gestantes no se observaron efectos teratogénicos tras la perfusión intravenosa de dosis farmacológicamente efectivas. En conejos, dosis superiores a 3 mg/kg/día dieron lugar a efectos embriotóxicos (embrioletalidad, retraso en el crecimiento). En ratas, no se observaron efectos en el desarrollo peri-postnatal ni en los parámetros de fertilidad con dosis de hasta 10 mg/kg/día.
POSOLOGÍA Y FORMA DE ADMINISTRACIÓN:
ACTILYSE® debe administrarse lo antes posible después de la presentación de los síntomas. Se aplican las siguientes instrucciones de dosificación.
Infarto agudo de miocardio:
Posología:
a) Régimen de dosificación de 90 minutos (acelerado) para pacientes con infarto agudo de miocardio, en los cuales pueda iniciarse el tratamiento dentro de las 6 horas después de la presentación de los síntomas:
|
Concentración de alteplasa |
||
|
1 mg/mL |
2 mg/mL |
|
|
mL |
mL |
|
|
15 mg en forma de bolo intravenoso |
15 |
7.5 |
|
50 mg en forma de perfusión durante 30 minutos |
50 |
25 |
|
seguidos de una perfusión de 35 mg durante 60 minutos hasta una dosis máxima de 100 mg |
35 |
17.5 |
En pacientes con un peso corporal por debajo de 65 kg, la dosis debe ajustarse al peso de la siguiente forma:
|
Concentración de alteplasa |
||
|
1 mg/mL |
2 mg/mL |
|
|
mL |
mL |
|
|
15 mg en forma de bolo intravenoso |
15 |
7.5 |
|
mL/kgp.c. |
mL/kgp.c. |
|
|
y 0.75 mg/kg de peso corporal (p.c.) durante 30 minutos (máximo 50 mg) |
0.75 |
0.375 |
|
seguidos de una perfusión de 0.5 mg/kg peso corporal (p.c.) durante 60 minutos (máximo 35 mg) |
0.5 |
0.25 |
b) Régimen de dosificación de 3 horas para pacientes en los cuales pueda iniciarse el tratamiento entre las 6 y 12 horas después de la presentación de los síntomas:
|
Concentración de alteplasa |
||
|
1 mg/mL |
2 mg/mL |
|
|
mL |
mL |
|
|
10 mg en forma de bolo intravenoso |
10 |
5 |
|
50 mg en forma de perfusión durante la primera hora |
50 |
25 |
|
mL/30 min |
mL/30 min |
|
|
seguidos por perfusiones de 10 mg durante 30 minutos, hasta una dosis máxima de 100 mg durante 3 horas |
10 |
5 |
En pacientes con un peso corporal por debajo de 65 kg, la dosis total no debería ser superior a 1.5 mg/kg. La dosis máxima de alteplasa es de 100 mg.
Tratamiento coadyuvante: Se recomienda tratamiento antitrombótico coadyuvante en cumplimiento con las guías internacionales actuales para el tratamiento de pacientes con infarto de miocardio con elevación del ST.
Forma de administración:
La solución reconstituida debe administrarse por vía intravenosa.
Los viales de 2 mg de alteplasa no están indicados para ser usados en esta indicación. Para instrucciones previas a la reconstitución/administración, ver sección 6.6.
Embolia pulmonar aguda masiva:
Posología: Debe administrarse una dosis total de 100 mg de alteplasa en 2 horas. El siguiente régimen de dosificación es con el que se tiene mayor experiencia:
|
Concentración de alteplasa |
||
|
1 mg/mL |
2 mg/mL |
|
|
mL |
mL |
|
|
10 mg en forma de bolo intravenoso durante 1-2 minutos |
10 |
5 |
|
seguido de 90 mg como perfusión intravenosa durante 2 horas |
90 |
45 |
En pacientes con un peso corporal por debajo de 65 kg, la dosis total no debería ser superior a 1.5 mg/kg.
Tratamiento coadyuvante: Después del tratamiento con ACTILYSE® debe iniciarse (o reanudarse) un tratamiento con heparina si los valores aPTT son inferiores al doble del límite superior normal. La perfusión debe ajustarse para mantener los valores de aPTT en el rango de 50 – 70 segundos (de 1.5 a 2.5 veces el valor de referencia).
Forma de administración: La solución reconstituida debe administrarse por vía intravenosa.
Los viales de 2 mg de alteplasa no están indicados para ser usados en esta indicación. Para instrucciones previas a la reconstitución/administración, ver sección 6.6.
Ictus isquémico agudo: El tratamiento sólo debe ser realizado bajo la responsabilidad y supervisión de un médico entrenado y con experiencia en cuidados neurovasculares (ver secciones 4.3 y 4.4).
Posología: La dosis recomendada es de 0.9 mg de alteplasa/kg de peso (hasta un máximo de 90 mg) perfundidos por vía intravenosa durante 60 minutos con un 10 % de la dosis total administrada como bolo intravenoso inicial.
|
El tratamiento con ACTILYSE® debe iniciarse tan pronto como sea posible dentro de las 4.5 horas desde la presentación de los síntomas. Más allá de las 4.5 horas después de la presentación de los síntomas de ictus hay una relación beneficio/riesgo negativa asociada al tratamiento con ACTILYSE® y no se debe administrar (ver sección 5.1). |
Tratamiento coadyuvante: La seguridad y eficacia de este régimen con la administración concomitante de heparina y ácido acetilsalicílico durante las primeras 24 horas después de la presentación de los síntomas no han sido suficientemente evaluadas. La administración de ácido acetilsalicílico o heparina intravenosa debe evitarse en las primeras 24 horas después del tratamiento con ACTILYSE®. Si se requiere heparina para otra indicación (p.ej. prevención de la trombosis venosa profunda) la dosis no debe exceder las 10,000 UI por día, administrada por vía subcutánea.
Forma de administración: La solución reconstituida debe administrarse por vía intravenosa.
Los viales de 2 mg de alteplasa no están indicados para ser usados en esta indicación. Para instrucciones previas a la reconstitución/administración, ver sección 6.6.
Población pediátrica: La experiencia con el uso de ACTILYSE® en niños y adolescentes es limitada. ACTILYSE® está contraindicado en el tratamiento del ictus isquémico agudo en niños y adolescentes menores de 16 años (ver sección 4.3). La dosis en adolescentes entre 16 y 17 años es la misma que para los adultos (ver sección 4.4 para ver las recomendaciones de las técnicas de imagen previas que se deben utilizar).
SOBREDOSIS: A pesar de la especificidad relativa por la fibrina, puede producirse una reducción clínica significativa del fibrinógeno y otros componentes de la coagulación sanguínea después de una sobredosificación. En la mayoría de los casos, es suficiente esperar la regeneración fisiológica de estos factores después de haber finalizado el tratamiento con ACTILYSE®. Sin embargo, si se presentan hemorragias graves, se recomienda la perfusión de plasma congelado reciente, y si fuese necesario, pueden administrarse antifibrinolíticos sintéticos.
DESCRIPCIÓN: ACTILYSE®, Polvo Liofilizado para Solución Inyectable.
PRESENTACIÓN:
Naturaleza y contenido del envase:
Caja contiene:
2 frascos ámpula con 50 mg de polvo liofilizado
2 frascos ámpula con 50 mL de diluyente
2 cánulas de conducción de plástico
1 Instructivo