
ZOSTAVAX®
VIRUS VIVO ATENUADO DE LA VARICELA
Suspensión inyectable
1 Caja, 1 Frasco(s) ámpula con liofilizado, 0.65 ml,
1 Caja, 10 Frasco(s) ámpula con liofilizado, 0.65 ml,
III. FORMA FARMACÉUTICA Y FORMULACIÓN
Forma Farmacéutica: Suspensión.
Consideración de uso: Inyectable.
ZOSTAVAX es un preparado liofilizado de la cepa Oka/Merck del virus vivo atenuado de la varicela/zóster.
Fórmula:
Ingredientes activos
Cuando se reconstituye la vacuna como se indica, ZOSTAVAX es un preparado estéril para administración subcutánea. Una vez reconstituido y mantenido a temperatura ambiente hasta por 30 minutos, cada dosis de 0.65 mL contiene un mínimo de 19,400 unidades formadoras de placas de virus vivos de varicela Zóster atenuados de la cepa Oka/Merck.
El frasco ámpula o jeringa prellenada con diluyente contiene 0.7 mL agua estéril para uso inyectable.
Ingredientes inactivos
Cada dosis de 0.65 mL contiene 41.05 mg de sacarosa, 20.53 mg de gelatina porcina hidrolizada, 8.55 mg de urea, 5.25 mg de cloruro de sodio, 0.82 mg de L-glutamato monosódico, 0.75 mg de fosfato dibásico de sodio, 0.13 mg de fosfato monobásico de potasio, 0.13 mg de cloruro de potasio, componentes residuales de células MRC-5 (incluyendo ADN y proteína), y trazas de neomicina y de suero de ternera. El producto no contiene conservadores.
XIX. NÚMERO DE REGISTRO DEL MEDICAMENTO ANTE LA SECRETARÍA
Reg. No. 123M2009 SSA IV
Versión: WPC-V211-R-I-012018 & S-WPC-V211-R-I-052018
RCN: 000017079-MX
IV. INDICACIONES TERAPÉUTICAS
ZOSTAVAX está indicada para:
• prevenir el herpes zóster
• prevenir la neuralgia post-herpética
• disminuir el dolor asociado con el herpes zóster agudo o crónico.
ZOSTAVAX está indicada para inmunizar a personas mayores de 50 años.
ZOSTAVAX puede administrarse concomitantemente con la vacuna inactivada contra influenza (véase XIII. DOSIS Y VÍA DE ADMINISTRACIÓN y V. FARMACOCINÉTICA Y FARMACODINAMIA)
V. FARMACOCINÉTICA Y FARMACODINAMIA
Grupo Farmacoterapéutico: Vacuna viral. ATC J07BK02
Herpes zóster
El herpes zóster (HZ, llamado también simplemente zóster) es una manifestación de la reactivación del virus varicela-zóster (VVZ), que como infección primaria produce varicela. Tras la infección inicial el virus permanece latente en los ganglios de las raíces dorsales o de los nervios craneales sensitivos, hasta que se reactiva el HZ y causa las lesiones características. Usualmente éste se caracteriza por una erupción cutánea vesicular, unilateral, dolorosa, que se distribuye en el dermatoma correspondiente.
Aunque la erupción vesicular es la característica más distintiva del zóster, el síntoma debilitante que con más frecuencia afecta al paciente es el dolor, que puede ocurrir durante la fase prodrómica, la fase de erupción aguda y la fase post-herpética de la infección. Se ha reportado que durante la fase eruptiva aguda, hasta 90% de los pacientes inmunocompetentes presentan dolor local.
Cualquier persona que se haya infectado con el VVZ, incluso las que no tienen historia clínica (antecedente) de varicela, está en riesgo de padecer HZ, que se considera debido a la disminución progresiva de la inmunidad al VVZ. En Estados Unidos casi todos los adultos (~98%) son susceptibles al zóster, en donde se calcula que ocurren un millón de casos al año, y se prevé que ese número aumentará a medida que aumenta el promedio de edad de la población. La incidencia y la severidad del HZ y de sus complicaciones aumentan considerablemente con la edad; dos tercios de los casos ocurren en personas mayores de 50 años. En estudios recientes se ha estimado que el riesgo de padecerlo es de hasta 30% en la población general, y se calcula que 50% de las personas de 85 años habrán experimentado un episodio de HZ.
Del 70 al 80% de las hospitalizaciones por zóster ocurren en personas inmunocompetentes. En Estados Unidos, cada año hay aproximadamente 50,000 a 60,000 hospitalizaciones relacionadas con el HZ, y éste es el diagnóstico primario en 12,000 a 19,000 de ellas.
El HZ puede tener complicaciones importantes, como neuralgia post-herpética (NPH), cicatrices, sobreinfección bacteriana, parálisis de neuronas motoras, neumonía, encefalitis, síndrome de Ramsay Hunt, deterioro visual, hipoacusia, y muerte.
El dolor y el malestar asociados con el HZ pueden ser prolongados y discapacitantes y disminuir la calidad de vida y la capacidad funcional en grado similar al ocasionado por enfermedades debilitantes como insuficiencia cardiaca congestiva, infarto del miocardio, diabetes mellitus tipo II y depresión mayor.
Neuralgia post-herpética
La neuralgia post-herpética (NPH) es la complicación más importante y la causa más frecuente de morbilidad asociada con el HZ en los pacientes inmunocompetentes. En la literatura publicada se calcula que en la población de Estados Unidos hay una prevalencia de NPH de 500,000 a 1,000,000 de casos. Su frecuencia y severidad aumentan con la edad, y puede complicar 25 a 50% de los casos de zóster en pacientes mayores de 50 años. La NPH se ha descrito como hiperestesia o dolor agudo ardoroso, pulsátil, lancinante y/o penetrante, que puede persistir durante meses o hasta años y puede ocasionar estrés emocional. Por lo menos 90% de los pacientes con NPH presentan alodinia (dolor producido por un estímulo inocuo), que es descrita típicamente como uno de los tipos de dolor más estresantes y debilitantes. En la comunidad médica se usan ampliamente varias definiciones de la NPH, incluyendo la de un dolor que persiste por más de 90 días después del inicio de la erupción cutánea.
Mecanismo de acción
El riesgo de padecer HZ tiene una relación causal con una disminución de la inmunidad específica contra el VVZ. Se demostró que ZOSTAVAX refuerza esa inmunidad específica y se considera que ese es el mecanismo por el que protege contra el zóster y sus complicaciones. (Véase más adelante Inmunogenicidad.)
ESTUDIOS CLÍNICOS
Evaluación de la eficacia clínica de ZOSTAVAX
Estudio de Eficacia y Seguridad de ZOSTAVAX (ZEST, por sus siglas en inglés) en sujetos de 50 a 59 años de edad
El estudio de eficacia y seguridad de ZOSTAVAX (ZEST, por sus siglas en inglés) fue un estudio clínico doble ciego y controlado con placebo, que incluyó a 22,439 sujetos de 50 a 59 años de edad, distribuidos al azar para recibir una dosis única de ZOSTAVAX (n = 11,211) o placebo (n = 11,228) y fueron seguidos para vigilar el desarrollo de HZ durante una mediana de 1.3 años (rango de 0 a 2 años). Todos los casos sospechosos de HZ fueron calificados por un comité de evaluación clínica. La determinación final de los casos de zóster se hizo mediante la Reacción en Cadena de Polimerasa (PCR, por sus siglas en inglés) [86%], o en la ausencia de detección del virus, fue determinado por el comité de evaluación clínica [14%].
ZOSTAVAX redujo significativamente la incidencia de HZ comparada con placebo (30 casos [2.0/1,000 personas-año] frente a 99 casos [6.6/1,000 personas-año], respectivamente, p <0.001). La eficacia protectora de ZOSTAVAX contra el HZ fue del 69.8% (IC de 95%: [54.1 a 80.6%]).
Estudio sobre Prevención de Herpes Zóster (SPS por sus siglas en inglés) en sujetos de 60 años de edad y mayores.
En el estudio sobre prevención del herpes zóster (SPS), un estudio clínico de ZOSTAVAX doble ciego comparado con placebo, se distribuyó al azar a 38,546 sujetos de 60 años o más para recibir una sola dosis de ZOSTAVAX (n=19,270) o de placebo (n=19,276) y se vigiló la aparición de HZ durante un promedio de 3.1 años (rango, desde un día hasta 4.9 años). La distribución al azar se estratificó según la edad (grupo de 60 a 69 años y grupo de igual o mayores de 70 años). Un comité de evaluación clínica calificó todos los casos sospechosos de zóster. El diagnóstico final de los casos de zóster se hizo por PCR, cultivo local, o por decisión del comité de evaluación clínica, en ese orden. En ambos grupos (el que recibió ZOSTAVAX y el que recibió placebo), a las personas que presentaron HZ se les administró famciclovir y, si era necesario, analgésicos. La severidad del dolor se evaluó de acuerdo con una escala del "peor dolor", en una escala de puntuación de 0 a 10 usando el Zoster Brief Pain Inventory (ZBPI), que es un cuestionario validado. Se consideró clínicamente significativa una puntuación de 3 o más, porque se correlaciona con una interferencia importante en las actividades cotidianas.
En comparación con el placebo, ZOSTAVAX disminuyó significativamente el riesgo de presentar HZ o NPH. Además, disminuyó significativamente el dolor agudo o crónico asociado con el zóster, medido a través de la puntuación de "carga de enfermedad" (BOI, por sus siglas en inglés: burden of illness) (Tabla 1).
Tabla 1
Eficacia de ZOSTAVAX en comparación con placebo en el Estudio sobre Prevención del Herpes Zóster
|
Punto final |
Eficacia de la vacuna |
IC 95% |
|
Incidencia de zóster |
51% |
44 a 58% |
|
Incidencia de neuralgia post-herpética* |
67% |
48 a 79% |
|
"Carga de enfermedad" en HZ** |
61% |
51 a 69% |
|
IC 95% = Intervalo de confianza de 95%. * Dolor clínicamente significativo asociado con el zóster, persistente o que empezó por lo menos 90 días después de aparecer la erupción. ** La puntuación de la "carga de enfermedad" en HZ es una puntuación compuesta que incluye la incidencia, la severidad y la duración del dolor agudo y crónico asociado con el zóster en un periodo de seguimiento de seis meses. |
||
ZOSTAVAX disminuyó significativamente la incidencia de zóster (315 casos [5.4/1,000 personas-años]) en comparación con el placebo (642 casos [11.1/1,000 personas-años]) (p<0.001). La eficacia protectora de ZOSTAVAX contra el HZ fue de 51% (IC de 95%, 44 a 58%), y disminuyó su incidencia 64% (IC de 95%, 56 a 71%) en las personas de 60 a 69 años y 38% (IC de 95%, 25 a 48%) en los individuos ≥de 70 años. También disminuyó significativamente la incidencia acumulativa del zóster al paso del tiempo en las personas vacunadas (p<0.001) (Figura 1).
Figura 1
Gráfica de Kaplan-Meier de la incidencia acumulativa de HZ con el paso del tiempo* en el Estudio sobre Prevención del Herpes Zóster
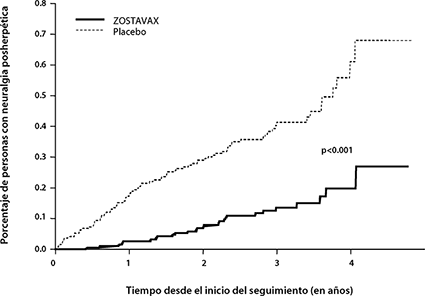
* En un número limitado de personas el seguimiento fue mayor de cuatro años.
ZOSTAVAX disminuyó la incidencia de la NPH (27 casos [0.5/1,000 personas-años]) en comparación con el placebo (80 casos [1.4/1,000 personas-años]) (p<0.001). En este estudio la NPH se definió como dolor clínicamente significativo asociado con el zóster, persistente o que empezó por lo menos 90 días después de aparecer la erupción. La eficacia protectora de ZOSTAVAX contra la NPH fue de 67% (IC de 95%, 48 a 79%), y la disminución fue similar en los dos grupos de edad (60-69 años y ≥ de 70 años). Además, la eficacia de ZOSTAVAX no cambió considerablemente cuando la NPH se definió con otros límites de tiempo de duración del dolor (30, 60, 120 ó 182 días). En comparación con placebo, ZOSTAVAX disminuyó significativamente la incidencia acumulativa de NPH al paso del tiempo (p<0.001) (Figura 2).
Figura 2
Gráfica de Kaplan-Meier de incidencia acumulada de NPH con el paso del tiempo* en el Estudio sobre Prevención de Herpes Zóster
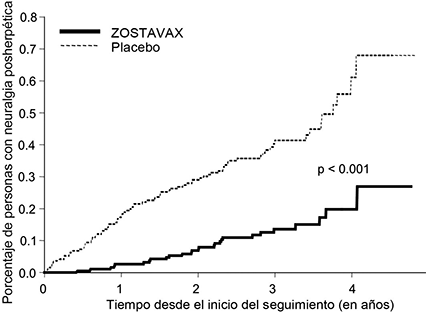
* En un número limitado de personas el seguimiento fue mayor de cuatro años.
ZOSTAVAX disminuyó la calificación de "carga de enfermedad" en HZ en 61% aproximadamente (IC de 95%, 51 a 69%) en comparación con el placebo, y en grado similar en los dos grupos de edad (60-69 años y ≥ de 70 años). La puntuación de la "carga de enfermedad" en HZ es una puntuación compuesta que incluye la incidencia, la severidad y la duración del dolor agudo y crónico asociado con el zóster en un periodo de seguimiento de seis meses.
En comparación con el placebo, ZOSTAVAX disminuyó 73% (IC de 95%, 46 a 87%) la incidencia del dolor intenso y persistente asociado con zóster (puntuación de intensidad-por-duración, > 600). Tuvieron esa puntuación mayor de 600 once de las personas vacunadas con ZOSTAVAX y 40 de las que recibieron placebo (Figura 3).
Entre las personas vacunadas que desarrollaron zóster, ZOSTAVAX disminuyó significativamente el dolor en comparación con el placebo. Durante el periodo de seguimiento de seis meses, la puntuación intensidad-por-duración disminuyó 22% con ZOSTAVAX (promedio de la puntuación, 141 con ZOSTAVAX y 181 con placebo; p=0.008).
Figura 3
Puntuación Intensidad-por-duración del dolor asociado con zóster al paso del tiempo en el Estudio sobre la Prevención de Herpes Zóster*
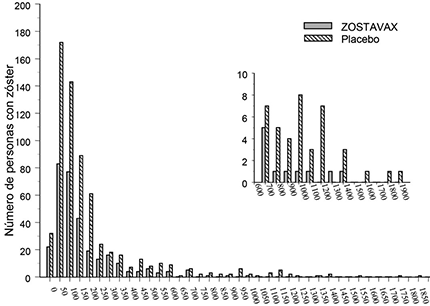
Puntuación intensidad x duración del dolor asociado con el zóster
* La gráfica pequeña presenta el número de personas con puntuación intensidad-por-duración >600. Por ejemplo, un "peor dolor" diario con una puntuación máxima de 10 durante más de 60 días resultaría en una puntuación Intensidad-por-duración mayor de 600.
Entre las personas vacunadas que desarrollaron NPH, ZOSTAVAX disminuyó significativamente el dolor asociado en comparación con placebo. En el periodo transcurrido desde los 90 días después de la aparición de la erupción hasta el final del seguimiento, ZOSTAVAX disminuyó 57% la puntuación intensidad-por-duración (promedio de la puntuación, 347 con ZOSTAVAX y 805 con placebo; p=0.016).
Para evaluar el impacto de ZOSTAVAX sobre la interferencia en las actividades cotidianas por el zóster, se calculó para cada persona una puntuación combinada basada en la interferencia con la actividad general, humor, capacidad para caminar, trabajo normal, relaciones con otras personas, sueño y el disfrute de la vida. Cada uno de esos elementos se midió en una escala de 0 a 10, donde 0 indicaba ninguna interferencia y 10 interferencia máxima. En comparación con el placebo, ZOSTAVAX causó una disminución favorable, pero no estadísticamente significativa (8%) en el riesgo de sufrir una interferencia considerable en las actividades cotidianas (puntuación de la interferencia combinada ≥2 durante siete días o más), más allá de la eficacia de la vacuna contra el zóster. Entre las personas vacunadas que desarrollaron zóster, ZOSTAVAX disminuyó significativamente la interferencia en las actividades cotidianas en comparación con el placebo. Durante el periodo de seguimiento de seis meses, la puntuación combinada intensidad-por-duración de interferencia en las actividades cotidianas disminuyó 31% con ZOSTAVAX (promedio de la puntuación, 57 con ZOSTAVAX y 83 con placebo; p=0.002).
El uso de medicamentos antivirales en las 72 horas siguientes a la aparición de la erupción del zóster no tuvo un efecto significativo sobre la eficacia de ZOSTAVAX contra el dolor del HZ o la incidencia de NPH. La proporción de pacientes que utilizaron analgésicos fue similar en los dos grupos. Por lo tanto, no fue probable que los analgésicos hayan contribuido a disminuir el dolor herpético o la incidencia de NPH.
Las personas que recibieron ZOSTAVAX reportaron menos complicaciones que las que recibieron placebo. La Tabla 2 muestra el número de personas que tuvieron complicaciones específicas reportadas en el Estudio sobre la Prevención de Herpes Zóster con una frecuencia de ≥1%.
Tabla 2
Número de personas con complicaciones específicas de zóster* reportadas en el Estudio sobre Prevención de Herpes Zóster
|
Complicación |
ZOSTAVAX (N=19,270) (n = 321) |
Placebo (N=19,276) (n = 659) |
|
Alodinia |
135 |
310 |
|
Sobreinfección bacteriana |
3 |
7 |
|
Diseminación |
5 |
11 |
|
Deterioro de la visión** |
2 |
9 |
|
Parálisis de nervios motores periféricos |
5 |
12 |
|
Ptosis palpebral** |
2 |
9 |
|
Cicatrices |
24 |
57 |
|
Disminución de la Sensibilidad |
7 |
12 |
|
N=Número de pacientes distribuidos al azar. n=Número de casos de zóster, incluyendo los que ocurrieron en los 30 días siguientes a la vacunación, con esta información disponible. * Complicaciones reportadas con una frecuencia ≥1% en al menos un grupo de vacunación entre los sujetos con zóster. ** Se presentó zóster oftálmico en 35 personas vacunadas con ZOSTAVAX y en 69 de las que recibieron placebo. |
||
Se reportaron complicaciones viscerales como neumonía, hepatitis y meningoencefalitis en menos de 1% de los pacientes con zóster (tres casos de neumonía y uno de hepatitis en el grupo de placebo, y un caso de meningoencefalitis en el grupo de ZOSTAVAX).
Estudio de la efectividad a largo plazo en sujetos de 50 años de edad o mayores
Los resultados de un análisis intermedio de un estudio observacional, de cohorte, prospectivo a gran escala, actualmente en marcha en Estados Unidos, sobre la efectividad de ZOSTAVAX a largo plazo en sujetos de 50 años de edad o mayores en el momento de la vacunación, han mostrado que ZOSTAVAX es efectiva en la reducción de la incidencia de HZ y NPH en sujetos vacunados en comparación con un grupo de referencia de sujetos no vacunados.
Durante este periodo del estudio de 2007 a 2014, de un total de 1,355,720 sujetos del estudio, 392,677 recibieron ZOSTAVAX. Se observaron un total de 48,889 casos confirmados de HZ y 3,316 casos confirmados de NPH (>90 días de dolor asociado al zoster).
Se evaluó la Efectividad de la Vacuna (EV) frente al HZ hasta ocho años posvacunación. La EV estimada por edad en el momento de la vacunación y la Efectividad media de la Vacuna estimada durante los primeros 3 y 5 años posvacunación se muestran a continuación (ver Tabla 3).
Tabla 3: EV* de ZOSTAVAX frente al HZ a lo largo del periodo de estudio y una media durante 3 y 5 años posvacunación, según la edad al momento de la vacunación. De 2007 a 2014
|
Edad al momento de la vacunación† |
|||||
|
50-59 años |
60-69 años |
70-79 años |
80+ años |
Entre todos los grupos de edad |
|
|
EV % (IC 95%) |
EV % (IC 95%) |
EV % (IC 95%) |
EV % (IC 95%) |
EV % (IC 95%) |
|
|
EV a lo largo del periodo de estudio‡ |
|||||
|
2007-2014 |
60% (53, 65) |
51% (48, 53) |
46% (43, 49) |
47% (43, 52) |
49% (48, 51) |
|
EV media§ |
|||||
|
3 años posvacunación |
60% (52, 66) |
55% (52, 57) |
50% (47, 53) |
48% (43, 53) |
52% (51, 54) |
|
5 años posvacunación |
¶ |
49% (47, 52) |
46% (43, 48) |
44% (38, 49) |
47% (46, 49) |
* EV se estimó para el primer episodio de herpes zoster durante el seguimiento y se calculó como (1-cociente de riesgos instantáneos)*100
† Modelos de Cox ajustados por tiempo de calendario, edad, sexo, raza/grupo étnico, utilización de recursos médicos (vacunación frente a la gripe, números de semanas con consulta ambulatoria al año), comorbilidades (índice de DxCG, índice de riesgo HCUP), estado de inmunosupresión durante el seguimiento
‡ EV a lo largo del periodo de estudio es la EV calculada durante toda la duración del estudio (2007-2014) en el momento de este análisis intermedio
§ EV media se calculó como la media ponderada de la EV anual estimada durante 3 y 5 años, respectivamente, donde las ponderaciones son la proporción del período total de tiempo cubierto
¶ Datos no disponibles al momento del análisis intermedio
Abreviaturas: EV denota efectividad de la vacuna; IC intervalo de confianza; DxCG grupo de costos de diagnóstico; HCUP proyecto de coste y utilización
De igual manera, se evaluó la Efectividad de la Vacuna (EV) frente a la Neuralgia Post-Herpética (NPH) hasta ocho años posvacunación. La EV estimada por edad en el momento de la vacunación y la Efectividad media de la Vacuna estimada durante los primeros 3 y 5 años posvacunación se muestran a continuación (ver Tabla 4).
Tabla 4: EV* de ZOSTAVAX frente a la Neuralgia Post-Herpética (NPH) a lo largo del periodo de estudio y una media durante 3 y 5 años posvacunación, según la edad al momento de la vacunación. De 2007 a 2014
|
Edad al momento de la vacunación† |
|||||
|
50-59 años |
60-69 años |
70-79 años |
80+ años |
Entre todos los grupos de edad |
|
|
EV % (IC 95%) |
EV % (IC 95%) |
EV % (IC 95%) |
EV % (IC 95%) |
EV % (IC 95%) |
|
|
EV a lo largo del periodo de estudio‡ |
|||||
|
2007-2014 |
63% (11, 85) |
71% (65, 76) |
70% (63, 75) |
62% (50, 71) |
69% (65, 72) |
|
EV Media§ |
|||||
|
3 años posvacunación |
¶ |
74% (66, 80) |
73% (65, 79) |
63% (49, 73) |
71% (66, 75) |
|
5 años posvacunación |
¶ |
72% (65, 77) |
69% (62, 75) |
61% (47, 71) |
68% (64, 72) |
* EV se estimó para el primer episodio de herpes zoster durante el seguimiento y se calculó como (1-hazard ratio)*100
† Modelos de Cox ajustados por tiempo de calendario, edad, sexo, raza/grupo étnico, utilización de recursos médicos (vacunación frente a la gripe, números de semanas con consulta ambulatoria al año), comorbilidades (índice de DxCG, índice de riesgo HCUP), estado de inmunosupresión durante el seguimiento
‡ EV a lo largo del periodo de estudio es la EV calculada durante toda la duración del estudio (2007-2014) en el momento de este análisis intermedio
§ EV media se calculó como la media ponderada de la EV anual estimada durante 3 y 5 años, respectivamente, donde las ponderaciones son la proporción del período total de tiempo cubierto
¶ Datos no disponibles al momento del análisis intermedio
Abreviaturas: EV denota efectividad de la vacuna; IC intervalo de confianza; DxCG grupo de costos de diagnóstico; HCUP proyecto de coste y utilización
Inmunogenicidad de ZOSTAVAX
En el estudio clínico de eficacia y seguridad de ZOSTAVAX (ZEST, por sus siglas en inglés), las respuestas inmunes a la vacunación fueron evaluadas en una sub-cohorte con distribución al azar del 10% (n=1,136 para ZOSTAVAX y n= 1,133 para placebo) de los sujetos incluidos en ZEST. ZOSTAVAX provocó mayores respuestas inmunes específicas al VVZ, 6 semanas después de la vacunación en comparación con placebo. El aumento en el nivel de anticuerpos anti VVZ, se demostró por el ensayo inmunosorbente ligado a enzima para glucoproteína-(gpELISA) (2.3 veces la diferencia (IC de 95% [2.2, 2.4]), en los títulos geométricos promedio [GMT, por sus siglas en inglés] de 664 frente a 288 unidades gpELISA / mL, p <0.001).
En el Estudio sobre la Prevención del Herpes Zóster (SPS) se evaluó la respuesta inmune a la vacunación en un sub-grupo de personas que ingresaron al estudio (N=1,395). A las seis semanas después de la administración, ZOSTAVAX indujo mayores respuestas inmunes específicas contra el VVZ que el placebo. Se demostraron aumentos tanto en la concentración de anticuerpos contra el VVZ, medido por gpELISA (diferencia de 1.7 veces más, GMT de 479 contra 288 unidades gpELISA/mL, p<0.001) y por la actividad de células T, medida por la prueba ImmunoSpot ligada a enzima de interferón-gamma del virus VZ (IFN-? ELISPOT) (diferencia de 2.2 veces más en las cuentas geométricas promedio, GMC por sus siglas en inglés), de 70 contra 32 células formadoras de manchas por millón de células mononucleares de sangre periférica [SFC/106 PBMCs], p<0.001).
En un análisis integrado de dos estudios clínicos que evaluaron la respuesta inmune a ZOSTAVAX cuatro semanas después de la vacunación, las respuestas generalmente fueron similares en sujetos de 50 a 59 años de edad (n=389) en comparación con los sujetos de 60 años de edad o mayores (n=731) (GMT de 668 vs. 614 unidades gpELISA/mL, respectivamente). El aumento en los GMT de la respuesta inmune tras la vacunación, medido por gpELISA, fue de 2.6 veces (IC 95%: [2.4 a 2.9] en los sujetos de 50-59 años de edad y de 2.3 veces (IC 95%: [2.1 a 2.4] en los sujetos de 60 años de edad o mayores.
Sub-estudio de persistencia a corto plazo de SPS (STPS, por sus siglas en inglés)
El STPS se inició para acumular información adicional sobre la persistencia de la eficacia de la vacuna y preservar un sub-conjunto de sujetos para el sub-estudio de persistencia a largo plazo (LTPS). El STPS incluyó 7,320 sujetos previamente vacunados con ZOSTAVAX y 6,950 sujetos previamente vacunados con placebo en el SPS. La edad promedio en el momento de la inclusión en STPS era de 73.3 años. Durante el curso del STPS, a los que recibieron placebo se les ofreció ZOSTAVAX, momento en el que se consideraba que habían completado el STPS.
El análisis de eficacia de la vacuna en el STPS se basa en la información recolectada principalmente 4 a 7 años después de la vacunación en el SPS. La mediana de seguimiento en el STPS fue de ~1.2 años (el rango es de un día a 2.2 años). En el STPS, hubo 84 casos evaluables de HZ en el grupo de ZOSTAVAX y 95 casos evaluables en el grupo de placebo. La eficacia estimada de la vacuna para la incidencia de HZ durante el periodo de seguimiento de STPS fue de 39.6% (18.2%, 55.5%). La eficacia estimada de la vacuna para la incidencia de NPH fue de 60.1% (-9.8%, 86.7%). La eficacia estimada de la vacuna para la BOI en el HZ fue de 50.1% (14.1%, 71.0%).
No hubo notificación de eventos adversos graves relacionados con la vacuna en el STPS.
Sub-estudio de persistencia a largo plazo de SPS (LTPS, por siglas en inglés)
Tras la finalización del STPS, el estudio abierto LTPS evaluó la duración de la protección de ZOSTAVAX contra HZ, NPH y BOI del HZ en sujetos vacunados en el SPS. Un total de 6,867 sujetos previamente vacunados con ZOSTAVAX en el SPS participaron en el LTPS. La edad promedio en el momento de la inclusión a LTPS fue de 74.5 años.
Debido a que a los sujetos con placebo se les ofreció previamente la vacuna durante el STPS, no estaba disponible un grupo control con placebo concurrente para el cálculo de la eficacia de la vacuna para el LTPS. Por lo tanto, los anteriormente receptores de placebo se utilizaron como grupo de referencia para el cálculo de eficacia de la vacuna en el LTPS.
El análisis del LTPS para la eficacia de la vacuna se basa en la información recolectada principalmente del Año 7 hasta el Año 10 después de la vacunación en el SPS. La mediana de seguimiento durante el LTPS fue de ~3.9 años (el rango es de una semana a 4.75 años). Hubo 263 casos evaluables de HZ durante el LTPS. La eficacia estimada de la vacuna para la incidencia de HZ durante el periodo de seguimiento en LTPS fue de 21.1% (10.9%, 30.4%). La eficacia estimada de la vacuna para la incidencia de NPH fue de 35.4% (8.8%, 55.8%). La eficacia estimada de la vacuna para la BOI del HZ fue de 37.3% (26.7%, 46.4%). La eficacia de la vacuna observada en el LTPS es generalmente consistente con la eficacia de la vacuna para HZ observada en el grupo de 70 años de edad en el SPS y es consistente con la edad actual de la cohorte del estudio.
No hubo notificación de eventos adversos graves relacionados con la vacuna en el LTPS.
Inmunogenicidad Después de la Administración Concomitante
En un estudio doble ciego, controlado, 762 adultos de 50 años de edad o mayores fueron distribuidos al azar para recibir una sola dosis de ZOSTAVAX administrada ya fuese concomitantemente (n= 382) o no concomitantemente (n= 380) con la vacuna inactivada contra influenza. Los sujetos incluidos dentro del grupo concomitante recibieron ZOSTAVAX y la vacuna inactivada contra influenza en el Día 1 y placebo en la Semana 4. Los sujetos del grupo no concomitante recibieron la vacuna inactivada contra influenza y placebo en el Día 1 y ZOSTAVAX en la Semana 4. Cuatro semanas después de la vacunación, las respuestas de anticuerpos para ambas vacunas fueron similares, independientemente de que se administraran concomitantemente o no.
En otro estudio doble ciego y controlado, 882 adultos de Estados Unidos de 50 años de edad y mayores (mediana de edad = 60 años), fueron aleatorizados en dos grupos para recibir la vacuna tetravalente inactivada de influenza y ZOSTAVAX de manera concomitante (N=440), o solamente la vacuna tetravalente inactivada de influenza y posteriormente, a las 4 semanas, recibir ZOSTAVAX (N=442). Las respuestas de anticuerpos para ambas vacunas a las 4 semanas de la vacunación fueron similares en ambos grupos.
En un estudio clínico controlado, doble ciego, 473 adultos de 60 años de edad o más, fueron asignados al azar para recibir ZOSTAVAX y PULMOVAX concomitantemente (N = 237), o sólo PULMOVAX, seguido 4 semanas más tarde por la administración de ZOSTAVAX (N = 236). A las cuatro semanas posteriores a la vacunación, los niveles de anticuerpos contra el VVZ (virus de varicela zóster) con el uso concomitante fueron significativamente más bajos que los niveles de anticuerpos VVZ después de la administración no concomitante (GMTs de 338 contra 484 unidades gpELISA/mL, respectivamente; relación GMT = 0.70 (IC del 95%: [0.61, 0.80 ])). Los niveles de anticuerpos anti-VVZ 4 semanas después de la vacunación se incrementaron 1.9 veces (95% IC: [1.7, 2.1]; cumpliendo el criterio de aceptación previamente especificado) en el grupo concomitante vs. 3.1 veces (95% IC: [2.8, 3.5]) en el grupo no concomitante. Los GMTs para los antígenos de PULMOVAX fueron comparables entre los dos grupos. El uso concomitante de ZOSTAVAX y PULMOVAX demostró un perfil de seguridad que fue generalmente similar al de las dos vacunas administradas de forma no concomitante.
Inmunogenicidad en sujetos con antecedentes de herpes zóster (HZ) antes de la vacunación
En un estudio doble ciego, con distribución al azar, controlado con placebo, se administró ZOSTAVAX a 100 sujetos de 50 años de edad o mayores con antecedentes de HZ antes de la vacunación, para evaluar la inmunogenicidad de ZOSTAVAX. A las 4 semanas después de la vacunación, ZOSTAVAX indujo respuestas inmunes específicas contra el virus de varicela-zóster significativamente mayores, según mediciones con gpELISA en comparación con placebo (diferencia de 2.1 veces (IC de 95%: [1.5 a 2.9], p<0.001, GMT de 812 vs. 393 unidades gpELISA/mL). Las respuestas de anticuerpos anti-VVZ generalmente fueron similares en los sujetos de 50 a 59 años, comparado con los sujetos de 60 años de edad o mayores.
Inmunogenicidad en sujetos que toman corticosteroides sistémicos crónicos / mantenimiento
En un estudio clínico con distribución al azar, doble ciego, controlado con placebo, ZOSTAVAX fue administrado a 206 sujetos de 60 años de edad o más que estaban recibiendo terapia crónica/mantenimiento con corticosteroides sistémicos a dosis diarias equivalentes de 5 a 20 mg de prednisona durante al menos 2 semanas antes de la inclusión, y 6 semanas o más después de la vacunación, para evaluar la inmunogenicidad y perfil de seguridad de ZOSTAVAX. En comparación con placebo, ZOSTAVAX indujo un mayor GMT de anticuerpos VVZ específicos por gpELISA, 6 semanas después de la vacunación (GMT 531.1 vs 224.3 unidades gpELISA/mL, respectivamente). El incremento de los títulos geométricos promedio de la respuesta de anticuerpos anti-VVZ, medida por gpELISA, antes y después de la vacunación, fue de 2.3 (IC de 95%: [2.0 a 2.7]) en el grupo de ZOSTAVAX, en comparación con 1.1 (IC de 95%: [1.0 a 1.2 ]) en el grupo placebo (véase VI. CONTRAINDICACIONES referentes a corticoesteroides).
Inmunogenicidad en sujetos con infección por VIH
En un estudio clínico doble ciego, controlado con placebo, con distribución al azar, ZOSTAVAX se administró como un esquema de dos dosis, a adultos infectados con el virus de la inmunodeficiencia humana (VIH) (18 años de edad o más) en tratamiento con una combinación potente de antirretrovirales, con la función inmune conservada (cuenta de células T CD4 + ≥200 células/μL). Aunque en este estudio se utilizó un esquema de dos dosis, ZOSTAVAX se administra como un esquema de dosis única (véase XIII. DOSIS Y VÍA DE ADMINISTRACIÓN). En este estudio, un total de 295 sujetos recibieron una primera dosis y 286 sujetos recibieron la segunda dosis. En comparación con el placebo, ZOSTAVAX indujo un mayor GMT de anticuerpos específicos contra VVZ por gpELISA a la Semana 6 (6 semanas después de la dosis 1) y a la Semana 12 (6 semanas después de la dosis 2) (GMT de 534.4 y 530.3 contra 263.7 y 250.3 unidades gpELISA/mL, respectivamente). Los incrementos en la media geométrica de la respuesta de anticuerpos anti-VVZ, medidos por gpELISA, desde el nivel inicial hasta la Semana 6 y la Semana 12 fueron de 1.78 (IC de 95% : [1.64 a 1.92]) y 1.80 (IC de 95%: [1.66 a 1.95]), respectivamente, en receptores de la vacuna y de 1.05 (IC de 95%: [0.98 a 1.12]) y 1.04 (IC de 95%: [0.96 a 1.13]), respectivamente, en los receptores de placebo. (Véase VI. CONTRAINDICACIONES respecto a inmunosupresión debida al VIH/SIDA.)
VI. CONTRAINDICACIONES
Antecedentes de hipersensibilidad a cualquiera de los componentes de la vacuna, incluyendo la gelatina.
Antecedentes de reacción anafiláctica o anafilactoide a la neomicina (cada dosis de la vacuna reconstituida contiene trazas de neomicina). Generalmente, la alergia a la neomicina se manifiesta como una dermatitis de contacto. Sin embargo, un antecedente de dermatitis de contacto debida a la neomicina no es una contraindicación para recibir vacunas de virus vivos.
ZOSTAVAX es una vacuna antivaricela-zóster atenuada y su administración a personas que están inmunosuprimidas o inmunodeficientes puede resultar en enfermedad por el virus de la varicela-zóster diseminada, incluyendo casos con desenlace fatal.
Estados de inmunodeficiencia primaria o adquirida debidos a trastornos como: leucemias agudas y crónicas, linfoma, otras condiciones que afectan la médula ósea o el sistema linfático; inmunosupresión por VIH/SIDA (véase V. FARMACOCINÉTICA Y FARMACODINAMIA, Y IX. REACCIONES SECUNDARIAS Y ADVERSAS), o deficiencias inmunitarias celulares.
Tratamiento inmunosupresor (incluyendo las dosis altas de corticosteroides) (ver IX. REACCIONES SECUNDARIAS Y ADVERSAS); sin embargo, ZOSTAVAX no está contraindicado en las personas que están recibiendo corticosteroides tópicos o inhalados, corticosteroides sistémicos a dosis bajas, o en pacientes que están recibiendo corticosteroides como tratamiento de reemplazo por ejemplo, en la insuficiencia suprarrenal.
Tuberculosis activa no tratada.
Embarazo (véase Embarazo en VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO O LA LACTANCIA).
VII. PRECAUCIONES GENERALES
El profesional de la salud debe preguntar al paciente si ha tenido alguna reacción a una dosis anterior de cualquier vacuna que contenga virus de varicela-zóster (véase VI. CONTRAINDICACIONES).
Como con cualquier vacuna, se deben tener los medios terapéuticos adecuados, incluyendo adrenalina inyectable (al 1:1,000), para usarlos inmediatamente si ocurre una reacción anafiláctica o anafilactoide.
Se debe considerar posponer la vacunación si el paciente tiene fiebre de más de 38.5°C.
No se han determinado la seguridad y la eficacia de ZOSTAVAX en adultos infectados con el virus de la inmunodeficiencia humana (VIH) con o sin evidencia de inmunodeficiencia. Se ha completado un estudio fase II de seguridad e inmunogenicidad en pacientes adultos infectados con VIH con función inmune conservada (véase V. FARMACOCINÉTICA Y FARMACODINAMIA y IX. REACCIONES SECUNDARIAS Y ADVERSAS)
Como ocurre con cualquier vacuna, es posible que la vacunación con ZOSTAVAX no proteja a todos los que la reciban.
Transmisión
En los estudios clínicos con ZOSTAVAX no se ha reportado la transmisión del virus de la vacuna. Sin embargo, la experiencia obtenida post-comercialización sugiere que en raros casos los vacunados que presentan una erupción semejante a la varicela pueden transmitir el virus de la vacuna a los contactos susceptibles. También se ha reportado la transmisión del virus de la vacuna por personas que recibieron la vacuna contra la varicela y no presentaron dicha erupción; este es un riego teórico de la vacunación con ZOSTAVAX. Se debe sopesar el riesgo de transmitir el virus atenuado de la vacuna a las personas susceptibles contra el riesgo de desarrollar herpes zóster (HZ) natural y transmitirlo a un individuo susceptible.
Empleo en niños
No se recomienda administrar ZOSTAVAX a niños.
Empleo en personas de edad avanzada
El promedio de edad de las personas incluidas en el estudio clínico más extenso de ZOSTAVAX (n=38,546) fue de 69 años (rango de 59 a 99 años). De las 19,270 personas que recibieron ZOSTAVAX, 10,378 tenían 60 a 69 años, 7,629 tenían 70 a 79 años, y 1,263 eran de 80 años de edad o mayores. Se demostró que ZOSTAVAX fue generalmente segura y eficaz en esta población.
Efectos sobre la habilidad para conducir o manejar maquinaria
No hay información que sugiera que ZOSTAVAX afecte la habilidad de conducir u operar maquinaria.
VIII. RESTRICCIONES DE USO DURANTE EL EMBARAZO O LA LACTANCIA
Embarazo
Categoría C
No se han hecho estudios de reproducción en animales con ZOSTAVAX. Tampoco se sabe si ZOSTAVAX puede causar daños al feto si se administra a una mujer embarazada, o afectar la capacidad reproductora. Sin embargo, se sabe que la infección natural con el VVZ algunas veces puede causar daño fetal. Por lo tanto, no se debe administrar ZOSTAVAX a una mujer embarazada, y se debe evitar el embarazo durante los tres meses siguientes a la vacunación (véase VI. CONTRAINDICACIONES).
Lactancia
No se sabe si el VVZ es excretado en la leche humana. Por lo tanto, debido a que algunos virus sí son excretados con la leche, se debe tener precaución si se administra ZOSTAVAX a una mujer que está amamantando.
IX. REACCIONES SECUNDARIAS Y ADVERSAS
En los estudios clínicos se ha evaluado la seguridad de ZOSTAVAX en más de 32,000 personas mayores de 50 años, y fue generalmente bien tolerada.
Estudio clínico de eficacia y seguridad de ZOSTAVAX (ZEST) en sujetos de 50 a 59 años de edad
En el estudio ZEST, los sujetos recibieron una dosis única, ya fuera de ZOSTAVAX (n=11,184) o placebo (n=11,212) y se vigiló la seguridad general a través del estudio. Durante el estudio, un sujeto vacunado con ZOSTAVAX reportó una reacción adversa seria relacionada con la vacuna (reacción anafiláctica).
Todos los sujetos recibieron una tarjeta de registro de vacunación (VRC, por sus siglas en inglés) para registrar los eventos adversos que ocurrieran los Días 1 al 42 posteriores a la vacunación, además de someterse a una vigilancia de seguridad de rutina durante todo el estudio.
Se reportaron los siguientes eventos adversos muy comunes (≥1/10) y comunes (≥1/100, <1/10) relacionados con el sitio de inyección de la vacuna y eventos adversos sistémicos, en el estudio ZEST. Varios eventos adversos fueron preguntados (Días 1 a 5 posteriores a la vacunación) y se designan con el símbolo*.
Trastornos del sistema nervioso
Común: cefalea
Trastornos generales y condiciones en el lugar de administración
Muy comunes: eritema,* dolor* hinchazón*, prurito
Comunes: hematoma, incremento de temperatura, induración
Trastornos músculo-esqueléticos y del tejido conectivo
Comunes: dolor en las extremidades
La incidencia global de eventos adversos relacionados con el lugar de inyección de la vacuna fue significativamente mayor en sujetos vacunados con ZOSTAVAX vs. quienes recibieron placebo (63.9% para ZOSTAVAX y 14.4% para placebo).
En el periodo de reporte de 42 días posterior a la vacunación en el estudio ZEST, 34 sujetos reportaron erupciones parecidas a zóster en lugares diferentes al sitio de inyección (19 para ZOSTAVAX y 15 para placebo). De las 24 muestras que fueron adecuadas para la prueba de reacción en cadena de polimerasa (PCR, por sus siglas en inglés), se detectó VVZ de tipo salvaje en 10 (3 para ZOSTAVAX y 7 para placebo) de estos especímenes. La cepa Oka/Merck del VVZ no se detectó en ninguna de estas muestras.
Dentro de esos mismos 42 días de periodo de reporte post-vacunación del estudio ZEST, 124 sujetos reportaron erupciones parecidas a la varicela (69 para ZOSTAVAX y 55 para placebo). De 23 muestras que estuvieron disponibles y adecuados para la prueba de PCR, se detectó VVZ en uno de estos especímenes del grupo de sujetos que recibieron ZOSTAVAX; sin embargo, la cepa del virus (cepa Oka/Merck o tipo salvaje) no se pudo determinar.
Shingles Prevention Study (SPS), (Estudio de Prevención de herpes zóster) en sujetos de 60 años y mayores
En el más extenso de esos estudios, el Estudio de Prevención de Herpes Zóster (SPS, por sus siglas en inglés), 38,546 personas recibieron una sola dosis de ZOSTAVAX (n=19,270) o de un placebo (n=19,276) y se evaluó la seguridad durante todo el estudio. Durante el estudio, se reportaron eventos adversos importantes relacionados con la vacuna en dos de los sujetos que recibieron ZOSTAVAX (exacerbación del asma y polimialgia reumática) y en tres de los que recibieron placebo (síndrome de Goodpasture, reacción anafiláctica y polimialgia reumática).
En el Sub-estudio de Vigilancia de Eventos Adversos, se entregaron tarjetas de reporte de vacunación para registrar eventos adversos a un sub-grupo subgrupo de personas del estudio SPS (3,345 recibieron ZOSTAVAX y 3,271 recibieron placebo), que ocurrieran de los Días 0 al 42 después de la vacunación, además de la vigilancia usual de seguridad durante todo el estudio.
Los siguientes eventos adversos muy comunes (≥1/10) y comunes (≥1/100, <1/10) en el sitio de inyección y eventos adversos sistémicos relacionados con la vacuna, fueron reportados en el Adverse Event Monitoring Substudy (sub-estudio de vigilancia de eventos adversos). La mayoría de estos eventos adversos fueron reportados como de intensidad leve. Varios eventos adversos fueron preguntados (Días 0-4 posteriores a la vacunación) y se designan con el símbolo*.
Trastornos del sistema nervioso
Común: cefalea
Trastornos generales y condiciones del sitio de administración
Muy comunes: eritema,* dolor/sensibilidad,* hinchazón*
Comunes: hematoma, prurito, incremento de temperatura
La incidencia general de los eventos adversos en el sitio de la inyección relacionados con la vacuna fue significativamente mayor con ZOSTAVAX (48%) que con placebo (17%).
En los demás pacientes del estudio SPS se hizo la vigilancia usual de la seguridad, pero no se les dieron tarjetas de reporte. Los tipos de eventos reportados en ellos fueron generalmente similares a los observados en el sub-grupo del Sub-estudio de Vigilancia de Eventos Adversos.
Dentro del periodo de reporte de 42 días post-vacunación del estudio SPS, el número de erupciones parecidas a zóster reportadas entre todos los sujetos fue pequeño (17 con ZOSTAVAX, 36 con placebo; p=0.009). De estas 53 erupciones parecidas a zóster se obtuvieron 41 muestras adecuadas para la prueba de PCR. Se detectó VVZ de tipo salvaje en 25 de ellas (5 en ZOSTAVAX y 20 para placebo). En ninguna de las muestras se detectó la cepa Oka/Merck del virus.
Dentro de ese mismo periodo de reporte de 42 días post-vacunación en el estudio SPS, el número de pacientes con erupciones similares a la varicela también fue pequeño (n=59). Se obtuvieron diez muestras adecuadas para la prueba de PCR, y en ninguna de ellas se detectó el VVZ.
Otros estudios
En otros estudios clínicos que apoyaron el registro inicial de la formulación congelada de ZOSTAVAX, las incidencias reportadas de erupciones parecidas a zóster y similares a la varicela fuera del sitio de la inyección dentro de los 42 días siguientes a la vacunación también fueron bajas, tanto en las personas que recibieron la vacuna como en las que recibieron placebo. De 17 casos reportados de erupciones similares a varicela y de erupciones similares a zóster en sitios diferentes al de inyección, se obtuvieron diez muestras adecuadas para prueba de PCR y 2 sujetos tuvieron varicela (inicio en los Días 8 y 17), confirmada como cepa Oka/Merck.
En los estudios clínicos de ZOSTAVAX en sujetos de 50 años de edad o mayores, incluyendo un estudio de administración concomitante de vacuna inactivada contra la influenza, el perfil de seguridad fue generalmente similar al observado en el Sub-estudio de Vigilancia de Eventos Adversos del SPS. Sin embargo, en esos estudios, se reportó una tasa más alta de eventos adversos en el sitio de la inyección, de intensidad leve a moderada, entre los sujetos de 50 a 59 años, comparados con los sujetos ≥60 años.
En un estudio doble ciego, controlado con placebo, con distribución al azar, ZOSTAVAX fue administrado a 100 sujetos de 50 años de edad o mayores con antecedentes de HZ antes de la vacunación, para evaluar la inmunogenicidad de ZOSTAVAX y el perfil de seguridad. En este estudio clínico, el perfil de seguridad fue generalmente similar al observado en el Sub-estudio de Vigilancia de Eventos Adversos del estudio SPS.
Para abordar las dudas sobre las personas de las que no se sabía si ya habían sido vacunadas antes con ZOSTAVAX, se evaluaron la seguridad y la tolerabilidad de una segunda dosis de ZOSTAVAX. En un estudio doble ciego comparado con placebo, 98 adultos de 60 años o más recibieron una segunda dosis de ZOSTAVAX 42 días después de la primera dosis; la vacuna fue generalmente bien tolerada. La frecuencia de eventos adversos relacionados con la vacuna después de la segunda dosis de ZOSTAVAX fue generalmente similar a la observada después de la primera dosis.
Experiencia post- comercialización
Los siguientes eventos adversos adicionales han sido identificados durante la post-comercialización de ZOSTAVAX. Debido a que estos eventos son reportados voluntariamente por una población de tamaño incierto, en general no es posible estimar de manera confiable su frecuencia, o establecer alguna relación causal con la vacuna.
Trastornos gastrointestinales: náusea
Infecciones e infestaciones: herpes zóster (cepa de la vacuna)
Trastornos de la piel y tejido subcutáneo: erupción
Trastornos músculo-esqueléticos y del tejido conectivo: artralgia; mialgia
Trastornos generales y condiciones en el sitio de administración: erupción en el sitio de la inyección; urticaria en el sitio de inyección; pirexia; linfadenopatía transitoria en el sitio de la inyección
Trastornos del sistema inmune: reacciones de hipersensibilidad, incluyendo reacciones anafilácticas
Trastornos oculares: retinitis necrotizante (pacientes con tratamiento inmunosupresor)
Trastornos del sistema nervioso: síndrome de Guillain-Barré; parálisis facial
Inmunogenicidad en sujetos con tratamiento crónico/de mantenimiento con corticosteroides sistémicos
En un estudio clínico doble ciego, controlado por placebo y aleatorizado, ZOSTAVAX fue administrada a 206 sujetos de 60 años de edad o mayores que estaban recibiendo tratamiento crónico o de mantenimiento con corticosteroides sistémicos a una dosis diaria equivalente de 5 a 20 mg de prednisona por al menos 2 semanas previo al reclutamiento y por 6 semanas o más posterior a la vacunación. Se evaluó la inmunogenicidad y el perfil de seguridad de ZOSTAVAX. Todos los pacientes vacunados del estudio tuvieron un seguimiento para evaluar experiencias adversas. La relación entre la vacuna y el evento adverso fue determinada por un investigador basado en información proporcionada de manera ciega. Para evaluar las experiencias adversas temporalmente asociadas con la vacunación en el estudio, se les proporcionó a los pacientes una tarjeta de reporte de vacunación (VCR, por las siglas en inglés para Vaccination Report Card) para el registro de cualquier experiencia adversa sistémica o en el sitio de inyección, temperaturas elevadas, independientemente de la relación con la vacuna del estudio, durante el curso del estudio (hasta el Día 182 posvacunación). En este estudio clínico, el perfil de seguridad fue generalmente similar al observado en el Sub-estudio de Vigilancia de Eventos Adversos del Estudio de Prevención de Herpes Zóster. (Véase VI. CONTRAINDICACIONES sobre corticosteroides).
Inmunogenicidad en sujetos infectados por el VIH
En un estudio doble ciego, controlado por placebo y aleatorizado, ZOSTAVAX fue administrada en un régimen de 2 dosis en adultos (18 años o mayores) infectados por el VIH en tratamiento antirretroviral potente combinado con función inmune conservada (cuenta de células T CD4+ ≥ 200 células/μL).
Aunque en este estudio se utilizó un régimen de 2 dosis, ZOSTAVAX es administrada en un régimen de una dosis única (véase XIII. DOSIS Y VÍA DE ADMINISTRACIÓN). En este estudio clínico, un total de 295 sujetos recibieron la primera dosis y 286 sujetos recibieron la segunda dosis. Todos los pacientes vacunados del estudio tuvieron un seguimiento para evaluar experiencias adversas. La relación entre la vacuna y el evento adverso fue determinada por un investigador basado en información proporcionada de manera ciega. Para evaluar las experiencias adversas temporalmente asociadas con la vacunación en el estudio, se les proporcionó a los pacientes una VCR para el registro de cualquier experiencia adversa sistémica o en el sitio de inyección, temperaturas elevadas y erupciones, hasta la Semana 6 posterior a cada vacunación. Los pacientes tuvieron un seguimiento para evaluar experiencias adversas graves, independientemente de la relación con la vacuna del estudio, durante el curso del estudio (hasta la Semana 24 posterior a la primera dosis). En este estudio clínico, el perfil de seguridad fue generalmente similar al observado en el Sub-estudio de Vigilancia de Eventos Adversos del Estudio de Prevención de Herpes Zóster. (Véase VI. CONTRAINDICACIONES sobre inmunosupresión por VIH/SIDA).
X. INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO
No se debe mezclar ZOSTAVAX con ningún otro medicamento en la misma jeringa. Otros medicamentos inyectables se deben administrar por separado en otros lugares del cuerpo.
No se ha evaluado la administración concomitante de ZOSTAVAX y medicamentos antivirales eficaces contra el virus de varicela-zóster.
ZOSTAVAX y PULMOVAX no deben administrarse concomitantemente, ya que su uso concomitante resultó en una reducción en la inmunogenicidad de ZOSTAVAX. (Véase V. FARMACOCINÉTICA Y FARMACODINAMIA). Considere administrar las dos vacunas con una separación de al menos 4 semanas.
XI. ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO
Durante los estudios clínicos no se realizaron evaluaciones de rutina de laboratorio, por lo tanto, no hay reportes de cambios en las pruebas de laboratorio.
XIII. DOSIS Y VÍA DE ADMINISTRACIÓN
PARA ADMINISTRACIÓN SUBCUTÁNEA.
No se inyecte por vía intravenosa.
Se debe administrar una sola dosis. En este momento, no se sabe cuánto dura la protección después de la vacunación con ZOSTAVAX. En el Estudio sobre Prevención del Herpes Zóster (SPS, por sus siglas en inglés) se demostró protección durante cuatro años de seguimiento. Aún no se ha determinado si es necesaria la revacunación.
ZOSTAVAX no es un tratamiento del zóster ni de la neuralgia post-herpética.
ZOSTAVAX se puede administrar concomitantemente con la vacuna inactivada contra influenza utilizando jeringas diferentes.
Reconstitúyase inmediatamente después de sacarla de refrigeración.
Para reconstituir la vacuna use únicamente el diluyente que se proporciona con ella, que no contiene conservadores u otras sustancias antivirales que podrían inactivar el virus de la vacuna.
Frasco de diluyente:
Para reconstituir la vacuna, aspire primero con una jeringa todo el contenido del frasco de diluyente. Inyecte todo el diluyente en el frasco de vacuna liofilizada, y agite suavemente para mezclar completamente. Aspire todo el contenido con una jeringa e inyecte por vía subcutánea el volumen total de la vacuna reconstituida, de preferencia en la cara externa del brazo (región deltoidea).
Jeringas prellenadas con diluyente:
Para reconstituir la vacuna, inyecte todo el diluyente de la jeringa prellenada en el frasco de la vacuna liofilizada, y agite suavemente para mezclar completamente. Aspire todo el contenido en la jeringa e inyecte por vía subcutánea el volumen total de la vacuna reconstituida, de preferencia en la cara externa del brazo (región deltoidea).
SE RECOMIENDA ADMINISTRAR LA VACUNA INMEDIATAMENTE DESPUÉS DE RECONSTITUIRLA, PARA MINIMIZAR LA PÉRDIDA DE POTENCIA. DESECHE LA VACUNA RECONSTITUIDA QUE NO SE HAYA ADMINISTRADO EN LOS 30 MINUTOS SIGUIENTES A SU RECONSTITUCIÓN.
No congele la vacuna reconstituida.
PRECAUCIÓN: Para cada inyección y/o reconstitución de ZOSTAVAX se debe usar una jeringa estéril y libre de conservadores, antisépticos y detergentes, porque estas sustancias pueden inactivar el virus de la vacuna.
Es importante usar una jeringa y una aguja estériles distintas para cada paciente, para evitar la transmisión de agentes infecciosos de una persona a otra.
Las agujas se deben desechar apropiadamente sin volver a ponerles su funda.
Si las características de la solución y del envase lo permiten, los medicamentos parenterales se deben examinar visualmente antes de administrarlos, en busca de partículas o cambios de coloración. Una vez reconstituida, ZOSTAVAX es un líquido semi-opaco a translúcido, de blanquecino a amarillo claro.
XIV. MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL
No hay información acerca de la sobredosificación.
XII. PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD
No se ha evaluado el potencial carcinogénico, mutagénico o de alteración de la fertilidad de ZOSTAVAX.
XVIII. NOMBRE Y DOMICILIO DEL LABORATORIO
Merck Sharp & Dohme Comercializadora,
S. de R.L. de C.V.
Av. San Jerónimo 369, Piso 8, Col. La Otra Banda, Álvaro Obregón, C.P. 01090, Ciudad de México, México.
XV. PRESENTACIÓN
Caja de cartón con 1 o 10 frascos ámpula con liofilizado, con una dosis de vacuna contra el Herpes Zóster (0.65 mL ya reconstituida). Por separado se proporciona una caja con 1 o 10 frasco(s) ámpula o jeringa(s) prellenada(s) con 0.7 mL de diluyente.
Caja de cartón con 1 o 10 frascos ámpula con liofilizado, con una dosis de vacuna contra el Herpes Zóster (0.65 mL ya reconstituida) y 1 o 10 frasco(s) ámpula o jeringa(s) prellenada(s) con 0.7 mL de diluyente.
Todas las presentaciones con instructivo anexo.
XVI. RECOMENDACIONES SOBRE ALMACENAMIENTO
Para asegurar que no ocurra ninguna pérdida de potencia, durante su transporte la vacuna se debe mantener a una temperatura de 8°C o menor sin exceder temperaturas menores a -50 °C. El uso de hielo seco puede someter a ZOSTAVAX a temperaturas menores a -50 °C.
ZOSTAVAX SE DEBE MANTENER REFRIGERADA a una temperatura de 2 a 8 °C o menor, hasta que sea reconstituida para inyección (véase XIII. DOSIS Y VÍA DE ADMINISTRACIÓN). El diluyente se debe conservar por separado a temperatura ambiente (20 a 25°C) o en el refrigerador (2 a 8°C).
Antes de la reconstitución, protéjase la vacuna de la luz.
DESECHE LA VACUNA RECONSTITUIDA QUE NO SE HAYA INYECTADO EN LOS 30 MINUTOS SIGUIENTES A LA RECONSTITUCIÓN.
NO CONGELE LA VACUNA RECONSTITUIDA.
XVII. LEYENDAS DE PROTECCIÓN
Su venta requiere receta médica.
No se deje al alcance de los niños.
No se use en el embarazo ni lactancia.
Literatura exclusiva para médicos.
Reporte las sospechas de reacción adversa a los correos: farmacovigilancia@cofepris.gob.mx y
dpocmx@merck.com