
XELJANZ
TOFACITINIB
Tabletas recubiertas
1 Caja, 28 Tabletas,
1 Caja, 56 Tabletas,
1 Frasco, 28 Tabletas,
1 Frasco, 60 Tabletas,
1 Frasco, 180 Tabletas,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA RECUBIERTA contiene:
Citrato de tofacitinib equivalente a 5 mg
de tofacitinib
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS:
Artritis reumatoide: XELJANZ® (tofacitinib) está indicado en el tratamiento de pacientes adultos con artritis reumatoide (AR) activa de moderada a grave que han presentado una respuesta inadecuada a uno o más fármacos antirreumáticos modificadores de la enfermedad (FARME).
Artritis psoriásica: XELJANZ® en combinación con metotrexato (MTX) está indicado para el tratamiento de la artritis psoriásica (AP) activa en pacientes adultos que han tenido una respuesta inadecuada o que han sido intolerantes a un tratamiento previo con un fármaco antirreumático modificador de la enfermedad (FARME) (ver sección Propiedades farmacodinámicas).
Colitis ulcerosa: XELJANZ® está indicado para el tratamiento de pacientes adultos con colitis ulcerosa (CU) activa de moderada a grave que han tenido una respuesta insuficiente, una pérdida de respuesta o han sido intolerantes al tratamiento convencional o a un medicamento biológico (ver sección Propiedades farmacodinámicas).
Artritis idiopática juvenil de curso poliarticular: XELJANZ® está indicado para el tratamiento de la artritis idiopática juvenil de curso poliarticular (AIJcp), activa en pacientes de 2 años y mayores, que no han respondido de forma adecuada a la terapia previa con fármacos antirreumáticos modificadores de la enfermedad (FARME).
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacocinéticas: El perfil farmacocinético (PK, por sus siglas en inglés) de tofacitinib se caracteriza por una rápida absorción (las concentraciones pico en plasma se alcanzan en 0.5-1 h), rápida eliminación (vida media ~ 3 horas) e incrementos proporcionales a la dosis en la exposición sistémica. Las concentraciones en el estado estacionario se alcanzan en 24 a 48 horas con una acumulación insignificante después de la administración dos veces al día.
Absorción y distribución: Tofacitinib se absorbe adecuadamente, con una biodisponibilidad oral del 74% después de su administración. La coadministración de XELJANZ® con alimentos con alto contenido graso no cambia el área bajo la curva mientras que la Cmáx se redujo en un 32%. En ensayos clínicos, tofacitinib se administró sin considerar la dieta.
Después de la administración intravenosa el volumen de distribución es de 87 L. Aproximadamente el 40% de tofacitinib en circulación está unido a proteínas. Tofacitinib se une predominantemente a la albúmina y no parece ligarse a la glucoproteína ácido-α1. Tofacitinib se distribuye por igual entre los eritrocitos y el plasma.
Metabolismo y eliminación: Los mecanismos de depuración para tofacitinib son aproximadamente 70% por metabolismo hepático y 30% por excreción renal del fármaco original. El metabolismo de tofacitinib es mediado principalmente por CYP3A4, con contribución menor de CYP2C19. En un estudio en humanos con un radiomarcador, más de 65% de la radioactividad circulante estuvo constituida por fármaco sin cambios y el 35% remanente fue atribuida a 8 metabolitos, cada uno respondiendo por menos de 8% de la radioactividad total. Todos los metabolitos fueron observados en especies animales y se prevé que tengan ≤ 10% de la potencia de tofacitinib para la inhibición de JAK1/3. No se detectó evidencia de estereoconversión en las muestras humanas. La actividad farmacológica de tofacitinib se atribuye a la molécula original. In vitro, tofacitinib es un sustrato para la resistencia a múltiples medicamentos (MDR, por sus siglas en inglés) 1, pero no para la proteína de resistencia al cáncer de mama (BCRP, por sus siglas en inglés), el polipéptido transportador de aniones orgánicos (OATP, por sus siglas en inglés) 1B1/1B3 ni el transportador de cationes orgánicos (OCT, por sus siglas en inglés) 1/2, y no es un inhibidor de MDR1, OAT P1B1/1B3, OCT2, transportador de aniones orgánicos (OAT, por sus siglas en inglés) 1/3 o a la proteína asociada con la resistencia a múltiples medicamentos (MRP, por sus siglas en inglés) en concentraciones significativas desde el punto de vista clínico.
Los datos farmacocinéticos y las recomendaciones de dosificación para poblaciones especiales y las interacciones farmacológicas se proporcionan en la Figura 1.
Las modificaciones requeridas para poblaciones especiales se describen en la sección Dosis y vía de administración.
Farmacocinética en pacientes con artritis reumatoide: El análisis PK de la población en pacientes con artritis reumatoide indicó que la exposición sistémica (ABC, Área Bajo la Curva) a tofacitinib en los extremos de peso corporal (40 kg, 140 kg) fue similar a la de un paciente de 70 kg. Se estimó que los pacientes de edad avanzada de 80 años tienen un incremento < 5% en el ABC en relación con lo observado en el promedio de edad 55 años. En las mujeres se estimó que tienen un ABC 7% más bajo en comparación con los hombres. Los datos disponibles también han demostrado que no hay diferencias importantes en el ABC de tofacitinib entre pacientes caucásicos, afroamericanos y asiáticos. Se observó una relación lineal aproximada entre el peso corporal y el volumen de distribución, resultando en una mayor concentración máxima (Cmáx) y una menor concentración mínima (Cmín) en pacientes más delgados. Sin embargo, no se considera que esta diferencia sea clínicamente relevante. La variabilidad interindividual (porcentaje de coeficiente de variación) en el ABC de XELJANZ® se estima en aproximadamente 27%.
Farmacocinética en pacientes con artritis psoriásica activa: El análisis de farmacocinética de la población en pacientes con artritis psoriásica activa indicó que la exposición sistémica (ABC) de tofacitinib en los extremos del peso corporal (61 kg, 109 kg [décimo y noventavo percentiles en el conjunto de datos poblacionales]) fue similar a la de un paciente de 83.3 kg. Se calculó que los pacientes de edad avanzada de 80 años tuvieron valores de ABC de un 10% más alto con relación con la edad media de 50 años. Se calculó que las mujeres tuvieron valores de ABC de un 5% más bajos en comparación con los hombres. Los datos disponibles también han demostrado que no existen mayores diferencias en el ABC de tofacitinib entre pacientes de raza blanca, negra y asiática. Se calculó que la variabilidad entre sujetos (coeficiente porcentual de variación) en ABC de XELJANZ® es de aproximadamente un 32%.
Farmacocinética en pacientes con colitis ulcerosa activa: El análisis de farmacocinética poblacional en los pacientes con colitis ulcerosa indicó que no hubo diferencias clínicamente relevantes en la exposición a tofacitinib (ABC), con base en la edad, el peso, el sexo ni la raza. La exposición en las mujeres fue un 15% más alta que en los hombres, y los pacientes asiáticos mostraron una exposición un 7.3% más alta que los pacientes no asiáticos. El volumen de distribución aumentó con el peso corporal, y ello llevó a una mayor concentración máxima (Cmáx) y una menor concentración mínima (Cmín) en los pacientes con menor peso corporal. No obstante, esta diferencia no se considera clínicamente relevante. La variabilidad entre sujetos (% del coeficiente de variación) en el ABC de tofacitinib se calcula en aproximadamente un 23% y un 25% con la dosis de 5 mg dos veces al día y la de 10 mg dos veces al día, respectivamente, en los pacientes con colitis ulcerosa.
Farmacocinética en pacientes con AIJcp: El análisis de farmacocinética poblacional basado en los resultados de tofacitinib 5 mg tabletas recubiertas dos veces al día y tofacitinib solución oral con dosis equivalente basada en el peso dos veces al día indicó que la depuración y el volumen de distribución del tofacitinib disminuyeron con la disminución del peso corporal en los pacientes con AIJcp. Los datos disponibles indicaron que no hubo diferencias clínicamente relevantes en la exposición al tofacitinib (ABC) con base en la edad, la raza, el sexo, el tipo de paciente o la severidad inicial de la enfermedad. Se estimó que la variabilidad entre sujetos (% de coeficiente de variación) en (ABC) era de aproximadamente un 24%.
Insuficiencia renal: Los pacientes con insuficiencia renal leve, moderada y grave tuvieron un ABC incrementada en 37%, 43% y 123%, respectivamente, comparada con los pacientes sanos (ver la sección Dosis y vía de administración). En pacientes con insuficiencia renal en etapa terminal, la contribución de la diálisis a la depuración total de tofacitinib fue relativamente pequeña.
Insuficiencia hepática: Los pacientes con insuficiencia hepática leve y moderada tuvieron un ABC incrementada en 3% y 65%, respectivamente, comparada con los pacientes sanos. Los pacientes con insuficiencia hepática grave no fueron estudiados (ver la sección Dosis y vía de administración).
Población pediátrica: La farmacocinética, seguridad y eficacia de XELJANZ® en pacientes pediátricos no ha sido establecida, con la excepción en la AIJcp. Se ha evaluado la farmacocinética, la seguridad y la eficacia de XELJANZ® en pacientes con AIJcp de 2 a < 18 años.
Figura 1. Recomendación de dosificación de XELJANZ® con base en los datos farmacocinéticos
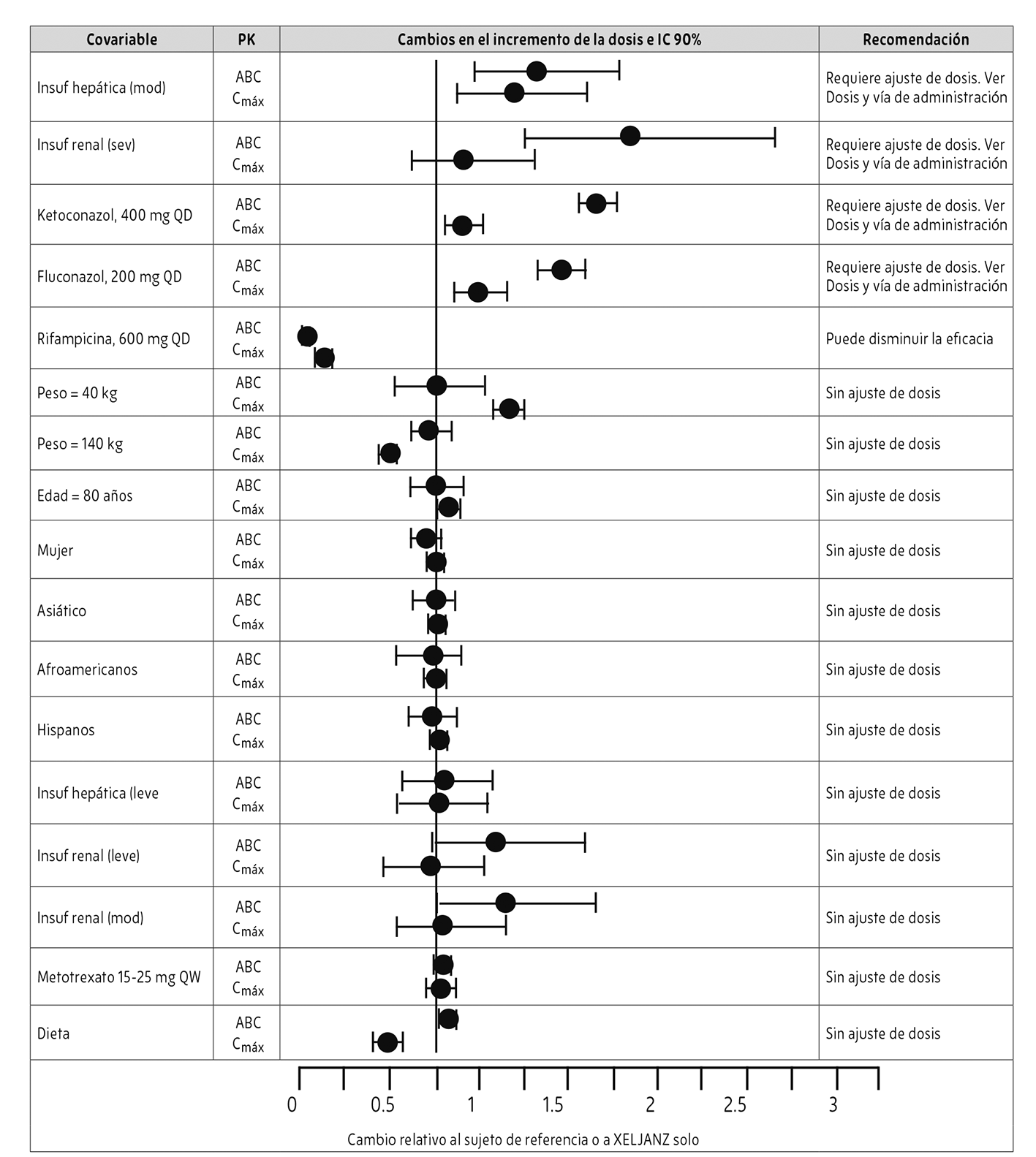
Las comparaciones de raza, peso, edad y género se basan en los datos de pacientes con AR con valores de referencia de 70 kg, 55 años, hombre y caucásico, respectivamente.
NOTA: Los grupos de referencia para insuficiencia renal y hepática son sujetos con función renal o hepática normal, respectivamente; el grupo de referencia para los estudios de interacciones farmacológicas y el efecto de la dieta fue la administración de XELJANZ® solo; Mod. = Moderado; Sev. = grave; Insuf. = Insuficiencia
* El ajuste de dosis requerido para poblaciones especiales se describe en la sección Dosis y vía de administración.
Propiedades farmacodinámicas:
Mecanismo de acción: Tofacitinib es un inhibidor potente y selectivo de la familia de la Cinasa Janus (JAK), con alto grado de selectividad contra otras cinasas en el genoma humano. En los ensayos de cinasas, tofacitinib inhibe a JAK1, JAK2, JAK3 y en un menor grado a la tirosina cinasa 2 (Tyk2, por sus siglas en inglés). En grupos celulares donde las cinasas JAK señalizan en par, tofacitinib inhibe preferencialmente la señalización por receptores heterodiméricos asociados con JAK3 y/o JAK1 con selectividad funcional sobre los receptores que señalizan vía pares de JAK2. La inhibición de JAK1 y JAK3 por tofacitinib bloquea la señalización a través de los receptores de citocinas que contienen la cadena gamma común incluyendo IL-2, 4, 7, 9, 15 y 21. Estas citocinas son integrales para la activación, proliferación y función de los linfocitos y la inhibición de su señalización puede causar la modulación de múltiples aspectos de la respuesta inmune. Además, la inhibición de JAK1, causará la atenuación de la señalización mediante citocinas proinflamatorias adicionales, tales como IL-6 e interferones Tipo I. A exposiciones mayores, la inhibición de la señalización de la eritropoyetina puede ocurrir mediante la inhibición de la señalización de JAK2.
Efecto farmacodinámico:
En pacientes con artritis reumatoide, el tratamiento con XELJANZ® por hasta 6 meses estuvo asociado con reducciones dosis-dependientes de células asesinas naturales (NK) CD16/56+, con reducciones máximas estimadas ocurriendo aproximadamente 8 a 10 semanas después de haber iniciado la terapia. Estos cambios generalmente se resolvieron después de 2 a 6 semanas de haber suspendido el tratamiento. El tratamiento con tofacitinib se asoció con incrementos dosisdependientes en el conteo de células B. Los cambios en el conteo de linfocitos T circulantes y subgrupos de linfocitos T (CD3+, CD4+ y CD8+) fueron pequeños e inconsistentes.
Posterior al tratamiento de largo plazo (duración mediana del tratamiento con XELJANZ® de aproximadamente 5 años) se observaron reducciones medianas del 28% y del 27% respectivamente en los recuentos de CD4+ y CD8+, a partir del valor inicial. En contraste con la disminución observada luego de la dosificación a corto plazo, los recuentos de las células asesinas naturales (NK) CD16/56+ mostró una mediana de incremento de un 73% a partir del valor inicial. El recuento de las células B CD19+ no evidenció incrementos mayores luego del tratamiento a largo plazo con XELJANZ®. Estos cambios regresaron hacia el valor inicial luego de la interrupción temporal del tratamiento. No existió evidencia de un incremento en el riesgo de infecciones graves u oportunistas o de herpes zóster con valores bajos de los recuentos de las células CD4+, CD8+ o NK o recuentos altos de células B.
Los cambios en los niveles séricos de IgG, IgM e IgA después de 6 meses de dosificación con XELJANZ® en pacientes con artritis reumatoide fueron pequeños, no dosis-dependientes y similares a los vistos con placebo.
Posterior al tratamiento con XELJANZ® en pacientes con artritis reumatoide, se observaron disminuciones rápidas de la proteína C reactiva (PCR) sérica, las cuales se mantuvieron durante el tratamiento. Los cambios en la PCR observados en el tratamiento con XELJANZ® persisten después de 2 semanas de suspendido el tratamiento, lo que indica mayor duración de la actividad farmacodinámica comparada con la vida media.
Se han observado cambios similares en las células T, células B y PCR sérica en pacientes con artritis psoriásica activa, aunque no se evaluó la reversibilidad. No se evaluaron las inmunoglobulinas séricas totales en pacientes con artritis psoriásica activa.
Seguridad clínica: En un estudio de vigilancia de seguridad posterior a la autorización (PASS, por sus siglas en inglés), abierto, aleatorizado, de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional, y bajo una dosis estable de metotrexato, los pacientes fueron tratados con tofacitinib 5 mg dos veces al día, tofacitinib 10 mg dos veces al día o un inhibidor del TNF. En particular, en febrero de 2019, la dosis de tofacitinib en el grupo de estudio de 10 mg dos veces al día se redujo a 5 mg dos veces al día después de que se determinó que la frecuencia de embolismo pulmonar aumentó en el grupo de tratamiento de tofacitinib 10 mg dos veces al día en comparación con el inhibidor del TNF. Además, la mortalidad por todas las causas aumentó en el grupo de tratamiento de tofacitinib 10 mg dos veces al día en comparación a los grupos de tratamiento con inhibidor del TNF y tofacitinib 5 mg dos veces al día. En los datos finales del estudio, los pacientes del grupo de tratamiento con tofacitinib 10 mg dos veces al día se analizaron en su grupo de tratamiento originalmente aleatorizado. A continuación, se muestran los resultados de los datos de seguridad finales del estudio para eventos seleccionados.
Mortalidad: Las tasas de incidencia (IR, por sus siglas en inglés) (IC del 95%) para la mortalidad por todas las causas para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.50 (0.33, 0.74), 0.80 (0.57, 1.09), 0.65 (0.50, 0.82) y 0.34 (0.20, 0.54) eventos por cada 100 pacientes-año (PY, por sus siglas en inglés), respectivamente. En comparación con el inhibidor de TNF, la razón de riesgo (HR, por sus siglas en inglés) (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fue 1.49 (0.81, 2.74), 2.37 (1.34, 4.18) y 1.91 (1.12, 3.27), respectivamente.
Las IR (IC del 95%) para las muertes asociadas con infección para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 0.08 (0.02, 0.20), 0.18 (0.08, 0.35), 0.13 (0.07, 0.22) y 0.06 (0.01, 0.17) eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la razón de riesgo (HR) (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fue 1.30 (0.29, 5.79), 3.10 (0.84, 11.45) y 2.17 (0.62, 7.62), respectivamente.
Las IR (IC del 95%) para las muertes asociadas con eventos cardiovasculares para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.25 (0.13, 0.43), 0.41 (0.25, 0.63), 0.33 (0.23, 0.46) y 0.20 (0.10, 0.36) eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la razón de riesgo (HR) (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fue 1.26 (0.55, 2.88), 2.05 (0.96, 4.39), y 1.65 (0.81, 3.34), respectivamente.
Las IR (IC del 95%) para muertes asociadas con neoplasias malignas para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.10 (0.03, 0.23), 0.00 (0.00, 0.08), 0.05 (0.02, 0.12) y 0.02 (0.00, 0.11) eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la razón de riesgo (HR) (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos XELJANZ® fue 4.88 (0.57, 41.74), 0 (0.00, Inf) y 2.53 (0.30, 21.64), respectivamente.
Las IR (IC del 95%) para muertes asociadas con otras causas (excluyendo infecciones, eventos cardiovasculares, neoplasias malignas) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 0.08 (0.02, 0.20), 0.21 (0.10, 0.38), 0.14 (0.08, 0.23) y 0.06 (0.01, 0.17) eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la razón de riesgo (HR) (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fue 1.30 (0.29, 5.81), 3.45 (0.95, 12.54) y 2.34 (0.67, 8.16), respectivamente.
En otros estudios clínicos con XELJANZ® que incluyeron 10 mg dos veces al día, las tasas de incidencia para la mortalidad por todas las causas en pacientes tratados con XELJANZ® 10 mg dos veces al día no fueron mayores que las tasas en pacientes tratados con XELJANZ® 5 mg dos veces al día. Las tasas de mortalidad de pacientes tratados con XELJANZ® son similares a las informadas por pacientes con AR, AP, AIJcp y CU tratados con terapias biológicas.
Infecciones: Las IR (IC del 95%) para todas las infecciones para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 41.74 (39.21, 44.39), 48.73 (45.82, 51.77), 45.02 (43.10, 47.01) y 34.24 (32.07, 36.53) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la razón de riesgo (HR) (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fue 1.20 (1.10, 1.31), 1.36 (1.24, 1.49) y 1.28 (1.18, 1.38), respectivamente.
Las IR (IC del 95%) para infecciones graves para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 2.86 (2.41, 3.37), 3.64 (3.11, 4.23), 3.24 (2.89, 3.62) y 2.44 (2.02, 2.92) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la razón de riesgo (HR) (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.17 (0.92, 1.50), 1.48 (1.17, 1.87) y 1.32 (1.07, 1.63), respectivamente.
Las IR (IC del 95%) para infecciones oportunistas para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 0.76 (0.54, 1.04), 0.91 (0.66, 1.22), 0.84 (0.67, 1.04) y 0.42 (0.26, 0.64) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.82 (1.07, 3.09), 2.17 (1.29, 3.66) y 1.99 (1.23, 3.22), respectivamente. La mayoría de las infecciones oportunistas en los grupos de tratamiento de XELJANZ® fueron infecciones oportunistas por herpes zóster; también se informó un número limitado de eventos con tuberculosis. Excluyendo las infecciones oportunistas por herpes zóster y la tuberculosis, las IR (IC del 95%) para todas las demás infecciones oportunistas para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 0.08 (0.02, 0.20), 0.14 (0.06, 0.30), 0.11 (0.05, 0.20) y 0.06 (0.01, 0.17) pacientes con eventos por cada 100 PY, respectivamente. En comparación con el inhibidor del TNF, la razón de riesgo (HR) (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.30 (0.29, 5.82), 2.40 (0.62, 9.29) y 1.84 (0.51, 6.59), respectivamente.
Las IR (IC del 95%) para el herpes zóster (incluye todos los eventos de herpes zóster) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y los inhibidores del TNF fueron de 3.75 (3.22, 4.34), 3.94 (3.38, 4.57), 3.84 (3.45, 4.26) y 1.18 (0.90, 1.52) pacientes con eventos por cada 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para el herpes zóster con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 3.17 (2.36, 4.27), 3.33 (2.48, 4.48) y 3.25 (2.46, 4.29), respectivamente.
Infecciones graves del estudio de seguridad observacional postautorización: Los datos de un estudio de seguridad observacional postautorización que evaluó tofacitinib en pacientes con AR procedentes de un registro (US Corrona) mostraron una tasa de incidencia numéricamente más alta de infecciones graves con la tableta de liberación prolongada de 11 mg administrada una vez al día que con tabletas recubiertas de 5 mg administradas dos veces al día. Las tasas brutas de incidencia (IC del 95%) (es decir, sin ajustar por edad o sexo) de la disponibilidad de cada formulación a los 12 meses después del inicio del tratamiento fueron 3.45 (1.93, 5.69) y 2.78 (1.74, 4.21) y a los 36 meses fueron 4.71 (3.08, 6.91) y 2.79 (2.01, 3.77) pacientes con eventos por 100 PY en los grupos de tabletas de liberación prolongada de 11 mg una vez al día y tabletas recubiertas de 5 mg dos veces al día, respectivamente. La razón de riesgo (HR) no ajustado fue 1.30 (IC del 95%: 0.67, 2.50) a los 12 meses y 1.93 (IC del 95%: 1.15, 3.24) a los 36 meses para la dosis de 11 mg de liberación prolongada una vez al día en comparación con la dosis de una tableta recubierta de 5 mg dos veces al día. Los datos se basan en un pequeño número de pacientes con eventos observados con intervalos de confianza relativamente grandes y un tiempo de seguimiento limitado disponible en el grupo de dosis de 11 mg de liberación prolongada una vez al día después de 24 meses.
Tromboembolismo:
Tromboembolismo venoso (VTE, por sus siglas en inglés) Las IR (IC del 95%) para VTE para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 0.33 (0.19, 0.53), 0.70 (0.49, 0.99), 0.51 (0.38, 0.67) y 0.20 (0.10, 0.37) pacientes con eventos por cada 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para VTE con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron de 1.66 (0.76, 3.63), 3.52 (1.74, 7.12) y 2.56 (1.30, 5.05), respectivamente.
Las IR (IC del 95%) para la EP para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.17 (0.08, 0.33), 0.50 (0.32, 0.74), 0.33 (0.23, 0.46) y 0.06 (0.01, 0.17) pacientes con eventos por cada 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para EP con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 2.93 (0.79, 10.83), 8.26 (2.49, 27.43) y 5.53 (1.70, 18.02), respectivamente. En los pacientes tratados con tofacitinib en los que se observó EP, la mayoría (97%) tenían factores de riesgo de VTE.
Las IR (IC del 95%) de trombosis venosa profunda (TVP) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.21 (0.11, 0.38), 0.31 (0.17, 0.51), 0.26 (0.17, 0.38) y 0.14 (0.06, 0.29) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para TVP con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.54 (0.60, 3.97), 2.21 (0.90, 5.43) y 1.87 (0.81, 4.30), respectivamente.
En un análisis exploratorio post hoc de biomarcadores dentro de un PASS aleatorizado de gran tamaño en pacientes con AR de 50 años y mayores con al menos un factor de riesgo cardiovascular adicional, se observaron con mayor frecuencia casos de VTE subsecuentes en pacientes tratados con tofacitinib con un nivel de dímero D ≥ 2 x ULN (Límite superior normal, por sus siglas en inglés) a los 12 meses de tratamiento en comparación con aquellos con nivel de dímero D < 2 x ULN. Esta observación no se identificó en pacientes tratados con TNFi. La interpretación está limitada por el bajo número de eventos de VTE y la disponibilidad restringida de la prueba del dímero D (solo se evaluó al inicio, mes 12 y al final del estudio). En pacientes que no tuvieron VTE durante el estudio, los niveles medios de dímero D se redujeron significativamente en el mes 12 en relación con el valor inicial en todos los grupos de tratamiento. Sin embargo, se observaron niveles de dímero D ≥ 2 x ULN en el mes 12 en aproximadamente el 30% de pacientes sin eventos VTE subsecuentes, lo que indica una especificidad limitada de la prueba del dímero D en este estudio. Teniendo en cuenta los datos y las limitaciones generales de este análisis exploratorio post hoc de biomarcadores, la utilidad de la monitorización del dímero D en el contexto de la mitigación de riesgos para eventos VTE es limitada.
Tromboembolismo arterial: Las IR (IC del 95%) para tromboembolismo arterial (ATE, por sus siglas en inglés) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.92 (0.68, 1.22), 0.94 (0.68, 1.25), 0.93 (0.75, 1.14) y 0.82 (0.59, 1.12) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para ATE con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.12 (0.74, 1.70), 1.14 (0.75, 1.74) y 1.13 (0.78, 1.63), respectivamente.
Eventos adversos cardiovasculares mayores (MACE, por sus siglas en inglés), incluido infarto de miocardio: MACE incluye infarto al miocardio no fatal, accidente cerebrovascular no fatal y muertes cardiovasculares, excluida la embolia pulmonar fatal. Las IR (IC del 95%) para MACE para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.91 (0.67, 1.21), 1.05 (0.78, 1.38), 0.98 (0.79, 1.19) y 0.73 (0.52, 1.01) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.24 (0.81, 1.91), 1.43 (0.94, 2.18) y 1.33 (0.91, 1.94), respectivamente.
En los grupos de tratamiento de XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® y TNFi, hubo un total de 19, 19, 38 y 11 pacientes con eventos de infarto de miocardio (IM), respectivamente. De estos totales, el número de pacientes con episodios de IM fatales fue 0, 3, 3 y 3, respectivamente, mientras que el número de pacientes con episodios de IM no mortales fue de 19, 16, 35 y 8, respectivamente. Por lo tanto, las IR que siguen son para IM no fatal. Las IR (IC del 95%) para IM no fatal para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 0.37 (0.22, 0.57), 0.33 (0.19, 0.53), 0.35 (0.24, 0.48) y 0.16 (0.07, 0.31) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 2.32 (1.02, 5.30), 2.08 (0.89, 4.86) y 2.20 (1.02, 4.75), respectivamente.
Neoplasias malignas que excluyen CPNM: Las IR (IC del 95%) para las neoplasias malignas excluyendo el cáncer de piel no melanoma (CPNM) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 1.13 (0.87, 1.45), 1.13 (0.86, 1.45), 1.13 (0.94, 1.35) y 0.77 (0.55, 1.04) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.47 (1.00, 2.18), 1.48 (1.00, 2.19) y 1.48 (1.04, 2.09), respectivamente.
Las IR (IC del 95%) para el linfoma para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.07 (0.02, 0.18), 0.11 (0.04, 0.24), 0.09 (0.04, 0.17) y 0.02 (0.00, 0.10) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 3.99 (0.45, 35.70), 6.24 (0.75, 51.86) y 5.09 (0.65, 39.78), respectivamente.
Las IR (IC del 95%) para el cáncer de pulmón para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.23 (0.12, 0.40), 0.32 (0.18, 0.51), 0.28 (0.19, 0.39) y 0.13 (0.05, 0.26) pacientes con eventos por cada 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.84 (0.74, 4.62), 2.50 (1.04, 6.02) y 2.17 (0.95, 4.93), respectivamente.
CPNM: Las IR (IC del 95%) para CPNM para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 0.61 (0.41, 0.86), 0.69 (0.47, 0.96), 0.64 (0.50, 0.82) y 0.32 (0.18, 0.52) pacientes con eventos por cada 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.90 (1.04, 3.47), 2.16 (1.19, 3.92) y 2.02 (1.17, 3.50), respectivamente.
Las IR (IC del 95%) para el carcinoma de células basales para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 0.37 (0.22, 0.58), 0.33 (0.19, 0.54), 0.35 (0.24, 0.49) y 0.26 (0.14, 0.44) pacientes con eventos por cada 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.43 (0.71, 2.90), 1.28 (0.61, 2.66) y 1.36 (0.72, 2.56), respectivamente.
Las IR (IC del 95%) para el carcinoma cutáneo de células escamosas para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 0.29 (0.16, 0.48), 0.45 (0.29, 0.69), 0.37 (0.26, 0.51) y 0.16 (0.07, 0.31) pacientes con eventos por 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 1.82 (0.77, 4.30), 2.86 (1.27, 6.43) y 2.32 (1.08, 4.99), respectivamente.
Perforaciones gastrointestinales: Las IR (IC del 95%) para perforaciones gastrointestinales para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron de 0.17 (0.08, 0.33), 0.10 (0.03, 0.24), 0.14 (0.08, 0.23) y 0.08 (0.02, 0.20) pacientes con eventos por cada 100 PY, respectivamente. En comparación con el inhibidor del TNF, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y todos los grupos de XELJANZ® fueron 2.20 (0.68, 7.15), 1.29 (0.35, 4.80) y 1.76 (0.58, 5.34), respectivamente.
Fracturas:
Las IR (IC del 95%) para las fracturas para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, todos los grupos de XELJANZ® (combina los grupos de tratamiento de 5 mg dos veces al día y 10 mg dos veces al día) y el inhibidor del TNF fueron 2.79 (2.34, 3.30), 2.87 (2.40, 3.40), 2.83 (2.50, 3.19) y 2.27 (1.87, 2.74) pacientes con eventos por 100 PY respectivamente. En comparación con TNFi, la HR (IC del 95%) para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, y todos los grupos de XELJANZ® fueron de 1.23 (0.96, 1.58), 1.26 (0.97, 1.62) y 1.24 (0.99, 1.55) respectivamente
Pruebas de laboratorio:
Pruebas de enzimas hepáticas: Los porcentajes de pacientes con al menos una elevación de ALT posterior al inicio > 1x ULN, 3x ULN y 5x ULN para el grupo de tratamiento con XELJANZ® 5 mg dos veces al día fueron de 52.83, 6.01 y 1.68, respectivamente. Los porcentajes para el grupo de tratamiento de XELJANZ® 10 mg dos veces al día fueron 54.46, 6.54 y 1.97, respectivamente. Los porcentajes para todos los grupos de XELJANZ® (combina XELJANZ® 5 mg dos veces al día y XELJANZ® 10 mg dos veces al día) fueron de 53.64, 6.27 y 1.82, respectivamente. Los porcentajes para el grupo de tratamiento con inhibidor del TNF fueron de 43.33, 3.77 y 1.12, respectivamente.
Los porcentajes de pacientes con al menos una elevación de AST posterior al inicio > 1x ULN, 3x ULN y 5x ULN para el grupo de tratamiento con XELJANZ® 5 mg dos veces al día fueron 45.84, 3.21 y 0.98, respectivamente. Los porcentajes para el grupo de tratamiento con XELJANZ® 10 mg dos veces al día fueron 51.58, 4.57 y 1.62, respectivamente. Los porcentajes para todos los grupos de XELJANZ® (combina XELJANZ® 5 mg dos veces al día y XELJANZ® 10 mg dos veces al día) fueron 48.70, 3.89 y 1.30, respectivamente. Los porcentajes para el grupo de tratamiento con inhibidor del TNF fueron 37.18, 2.38 y 0.70, respectivamente.
Lípidos: A los 12 meses, en los grupos de tratamiento con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y el inhibidor del TNF, el porcentaje medio de aumento en el colesterol LDL fue 13.80, 17.04 y 5.50, respectivamente. A los 24 meses, el porcentaje medio de aumento fue de 12.71, 18.14 y 3.64, respectivamente.
A los 12 meses, en los grupos de tratamiento con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y el inhibidor del TNF, el porcentaje medio de aumento del colesterol HDL fue de 11.71, 13.63 y 2.82, respectivamente. A los 24 meses, el porcentaje medio de aumento fue de 11.58, 13.54 y 1.42, respectivamente.
Eficacia clínica:
Artritis reumatoide: La eficacia y seguridad de XELJANZ® fueron medidas en seis estudios multicéntricos, doble ciego, controlados, aleatorizados en pacientes > 18 años con artritis reumatoide activa clasificada de acuerdo con los criterios del Colegio Americano de Reumatología (ACR, por sus siglas en inglés). Los pacientes tenían al menos 6 articulaciones sensibles al tacto y 6 inflamadas en la aleatorización (4 articulaciones inflamadas y sensibles al tacto para el estudio II). XELJANZ® de 5 o 10 mg dos veces al día, se administró como monoterapia (estudio I) y en combinación con FARME (estudio II) en pacientes con una respuesta inadecuada a aquellos fármacos y en combinación con MTX en pacientes con una respuesta inadecuada a MTX (estudios III y IV) o eficacia inadecuada o intolerancia a por lo menos un agente biológico inhibidor del TNF aprobado (estudio V).
El estudio I fue un estudio de 6 meses de monoterapia, en el cual 610 pacientes con artritis reumatoide activa moderada a grave que tuvieron respuesta inadecuada a FARME (no biológicos o biológicos) recibieron XELJANZ® de 5 o 10 mg dos veces al día o placebo.
En la visita de los 3 meses, todos los pacientes del grupo placebo se cambiaron de forma ciega a un segundo tratamiento predeterminado de XELJANZ® 5 o 10 mg dos veces al día. Los criterios de valoración primarios a los 3 meses fueron la proporción de pacientes que alcanzaron una respuesta ACR20, los cambios en el Cuestionario de Evaluación de Salud e Índice de Discapacidad (HAQ-DI, por sus siglas en inglés) y las tasas de índice de actividad de la enfermedad calculado con Velocidad de Sedimentación Globular (DAS28-4 [ESR, por sus siglas en inglés]) < 2.6.
El estudio II fue un estudio de doce meses en el cual 792 pacientes con artritis reumatoide activa moderada a grave que tuvieron respuesta inadecuada a FARME recibieron XELJANZ® 5 o 10 mg dos veces al día o placebo más el tratamiento con FARME previo (excluyendo los tratamientos con inmunosupresores potentes tales como azatioprina o ciclosporina). En la visita de los 3 meses, los pacientes que no respondieron del grupo placebo se cambiaron de forma ciega a un segundo tratamiento predeterminado de XELJANZ® 5 o 10 mg dos veces al día. Al final de los 6 meses todos los pacientes del grupo placebo se cambiaron de forma ciega al segundo tratamiento predeterminado. Los criterios de valoración primarios fueron la proporción de pacientes que alcanzaron una respuesta ACR20 a los 6 meses, los cambios en el HAQ-DI a los 3 meses y las tasas de DAS28-4 (ESR) < 2.6 a los 6 meses.
El estudio III fue un estudio de doce meses en el cual 717 pacientes con artritis reumatoide activa moderada a grave que tuvieron respuesta inadecuada a MTX. Los pacientes recibieron XELJANZ® 5 o 10 mg dos veces al día, 40 mg de adalimumab vía subcutánea cada dos semanas o placebo más el tratamiento con MTX de base. Los pacientes del grupo placebo fueron cambiados a XELJANZ®, como en el estudio II. Los criterios de valoración primarios fueron la proporción de pacientes que alcanzaron una respuesta ACR20 a los 6 meses, los cambios en el HAQ-DI a los 3 meses y las tasas DAS28-4 (ESR) < 2.6 a los 6 meses.
El estudio IV fue un estudio de 2 años con un análisis planeado al primer año en el cual 797 pacientes con artritis reumatoide activa moderada a grave que tuvieron respuesta inadecuada a MTX recibieron XELJANZ® 5 o 10 mg dos veces al día o placebo más el tratamiento previo con MTX. Los pacientes del grupo placebo fueron cambiados a XELJANZ® como en el estudio II. Los criterios de valoración primarios fueron la proporción de pacientes que alcanzaron una respuesta ACR20 a los 6 meses, cambio a partir del inicio en el índice total promedio de Sharp van der Heijde modificado (mTSS, por sus siglas en inglés) a los 6 meses, los cambios en HAQ-DI a los 3 meses y las tasas de DAS28-4 (ESR) < 2.6 a los 6 meses.
El estudio V fue un estudio de 6 meses en el cual 399 pacientes con artritis reumatoide activa moderada a grave que tuvieron respuesta inadecuada a por lo menos un agente biológico inhibidor del TNF aprobado recibieron XELJANZ® 5 o 10 mg dos veces al día o placebo más el tratamiento previo con MTX. En la visita de los 3 meses, todos los pacientes asignados al azar al tratamiento con placebo fueron cambiados de forma ciega al segundo tratamiento predeterminado de XELJANZ® 5 o 10 mg dos veces al día. Los criterios de evaluación primarios a los 3 meses fueron la proporción de pacientes que alcanzaron una respuesta ACR20, los cambios en HAQ-DI y las tasas DAS28-4 (ESR) < 2.6.
El estudio VI fue un estudio de 2 años de monoterapia con un análisis planificado a 1 año en el cual 952 pacientes con artritis reumatoide activa de moderada a grave sin tratamiento previo con MTX recibieron XELJANZ® 5 mg o 10 mg dos veces al día o titulación de la dosis de MTX durante 8 semanas de 10 mg a 20 mg por semana. Los criterios de valoración primarios fueron el cambio medio a partir del valor inicial en el puntaje modificado de van der Heijde (mTSS) a los 6 meses y la proporción de pacientes que alcanzaron una respuesta ACR70 de respuesta a los 6 meses.
Respuesta clínica:
Respuesta ACR: Los porcentajes de pacientes tratados con XELJANZ® que alcanzaron respuestas ACR20, ACR50 y ACR70 en los estudios I, II, IV, V y VI se muestran en la tabla 1. En todos los estudios, los pacientes tratados con 5 o 10 mg dos veces al día presentaron tasas de respuestas ACR20, ACR50 y ACR70 estadísticamente significativas a los 3 y 6 meses en comparación con los pacientes tratados con placebo (o en comparación con MTX en el estudio VI).
En el estudio IV, las tasas de respuesta ACR20/50/70 al Mes 12 se mantuvieron hasta el mes 24.
En el estudio VI (Tabla 1), la diferencia con MTX en ambos grupos de tofacitinib en alcanzar las tasas de respuesta ACR20, ACR50 y ACR70 fue estadísticamente significativa en todos los puntos temporales (p ≤ 0.0001). Tofacitinib, administrado como monoterapia en pacientes sin tratamiento previo con MTX, mejoró de manera significativa los signos y síntomas de AR en comparación con MTX. La eficacia observada con tofacitinib se mantuvo hasta el mes 24.
En los estudios I, II y V, la mejoría en la tasa de respuesta ACR20 contra el placebo se observó dentro del plazo en dos semanas.
Durante los periodos controlados de 3 meses (estudios I y V) y 6 meses (estudios II, III y IV), los pacientes tratados con XELJANZ® a dosis de 10 mg dos veces al día tuvieron generalmente mayores tasas de respuesta en comparación con los pacientes tratados con XELJANZ® 5 mg dos veces al día. En el estudio III, los criterios de valoración primarios fueron la proporción de pacientes que alcanzaron una respuesta ACR20 a los 6 meses; los cambios en HAQ-DI a los 3 meses y las tasas DAS28-4 (ESR) < 2.6 a los 6 meses. Los datos de estos resultados primarios fueron 51.5, 52.6, 47.2 y 28.3%; -0.55, -0.61, -0.49 y -0.24; y 6.2%, 12.5%, 6.7% y 1.1% para los grupos de XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, adalimumab 40 mg vía subcutánea cada dos semanas y placebo, respectivamente. Para un criterio secundario preespecificado, las tasas de respuestas ACR70 a los 6 meses para los grupos de XELJANZ® 5 mg dos veces al día y XELJANZ® 10 mg dos veces al día fueron significativamente mayores que para adalimumab 19.9%, 21.9% y 9.1%, respectivamente.
El efecto del tratamiento fue similar en los pacientes independientemente de la positividad para factor reumatoide, la edad, el género, la raza, o el estatus de la enfermedad. El tiempo de aparición de la eficacia fue rápido (tan pronto como la semana 2 en los estudios I, II y V) y la magnitud de la respuesta continuó mejorando con la duración del tratamiento. Como con la respuesta ACR en general en pacientes tratados con XELJANZ® 5 mg o 10 mg dos veces al día, cada uno de los componentes de la respuesta ACR mejoró constantemente a partir del inicio incluyendo: número de articulaciones inflamadas y sensibles al tacto; la evaluación global por el paciente y por el médico; los valores del índice de Discapacidad; la evaluación del dolor y la PCR en comparación con los pacientes que recibieron placebo más MTX u otros FARME en todos los estudios.
Respuesta DAS28-4 (ESR):
Los pacientes en los estudios fase 3 tuvieron un índice de actividad de la enfermedad medio (DAS28-4[ESR]) de 6.1–6.7 en el inicio. Las reducciones significativas en DAS28-4 (ESR) a partir del inicio (mejoría media) de 1.8-2.0 y 1.9-2.2 se observaron en pacientes tratados con 5 y 10 mg de XELJANZ®, respectivamente, en comparación con los pacientes tratados con placebo (0.7-1.1) < 2.6) en los estudios II, III y IV fue significativamente mayor en los pacientes que recibieron 5 mg o 10 mg de XELJANZ® (6-9% y 13-16%, respectivamente) en comparación al 1-3% de los pacientes con placebo a los 6 meses. En el estudio III, los porcentajes de pacientes que alcanzaron DAS28-4(ESR) < 2.6 que se observaron con XELJANZ® 5 mg dos veces al día, 10 mg dos veces al día y adalimumab a los 6 meses fueron 6.2%, 12.5% y 6.7% respectivamente.
En un análisis conjunto de los estudios fase 3, la dosis de 10 mg dos veces al día proporcionó mayores beneficios que 5 mg dos veces al día en múltiples mediciones de signos y síntomas: mejoría a partir del inicio (tasas de respuesta ACR20, ACR50 y ACR70), y el alcance del estado de actividad de la enfermedad deseado (ya sea DAS28-4 (ESR) < 2.6 o ≤ 3.2). Los mayores beneficios de la dosis de 10 mg sobre la de 5 mg se demostraron en las mediciones más exigentes (es decir, las tasas de respuesta ACR70 y DAS28-4 (ESR) < 2.6).
Tabla 1. Porcentaje de pacientes con una respuesta ACR
|
Estudio I: respuesta inadecuada a FARME |
||||
|
Tasa de respuesta (%) |
Tiempo |
Placebo |
XELJANZ® 5 mg dos veces al día monoterapia |
XELJANZ® 10 mg dos veces al día monoterapia |
|
ACR20 |
Mes 3 |
27 |
60 |
66 |
|
Mes 6 |
NA |
69 |
71 |
|
|
Mes 12 |
NA |
NA |
NA |
|
|
Mes 24 |
NA |
NA |
NA |
|
|
ACR50 |
Mes 3 |
13 |
31 |
37 |
|
Mes 6 |
NA |
42 |
47 |
|
|
Mes 12 |
NA |
NA |
NA |
|
|
Mes 24 |
NA |
NA |
NA |
|
|
ACR70 |
Mes 3 |
6 |
15 |
20 |
|
Mes 6 |
NA |
22 |
29 |
|
|
Mes 12 |
NA |
NA |
NA |
|
|
Mes 24 |
NA |
NA |
NA |
|
|
Estudio II: respuesta inadecuada a FARME, con mayor frecuencia MTX |
||||
|
Tasa de respuesta (%) |
Tiempo |
Placebo |
XELJANZ® 5 mg dos veces al día |
XELJANZ® 10 mg FARME |
|
ACR20 |
Mes 3 |
27 |
56 |
65 |
|
Mes 6 |
31 |
53 |
58 |
|
|
Mes 12 |
NA |
51 |
57 |
|
|
ACR50 |
Mes 3 |
10 |
27 |
34 |
|
Mes 6 |
13 |
34 |
37 |
|
|
Mes 12 |
NA |
33 |
43 |
|
|
ACR70 |
Mes 3 |
2 |
8 |
14 |
|
Mes 6 |
3 |
13 |
16 |
|
|
Mes 12 |
NA |
19 |
26 |
|
|
Estudio IV: respuesta inadecuada a MTX |
||||
|
Tasa de respuesta (%) |
Tiempo |
Placebo + MTX |
XELJANZ® 5 mg dos veces al día + MTX |
XELJANZ® 10 mg dos veces al día + MTX |
|
ACR20 |
Mes 3 |
27 |
56 |
66 |
|
Mes 6 |
25 |
51 |
62 |
|
|
Mes 12 |
NA |
49 |
56 |
|
|
Mes 24 |
NA |
41 |
50 |
|
|
ACR50 |
Mes 3 |
8 |
29 |
36 |
|
Mes 6 |
8 |
32 |
44 |
|
|
Mes 12 |
NA |
32 |
39 |
|
|
Mes 24 |
NA |
29 |
40 |
|
|
ACR70 |
Mes 3 |
3 |
11 |
17 |
|
Mes 6 |
1 |
15 |
22 |
|
|
Mes 12 |
NA |
19 |
27 |
|
|
Mes 24 |
NA |
17 |
26 |
|
|
Estudio V: respuesta inadecuada a inhibidor del TNF |
||||
|
Tasa de respuesta (%) |
Tiempo |
Placebo + MTX |
XELJANZ® 5 mg dos veces al día + MTX |
XELJANZ® 10 mg dos veces al día + MTX |
|
ACR20 |
Mes 3 |
24 |
42 |
48 |
|
Mes 6 |
NA |
52 |
55 |
|
|
Mes 12 |
NA |
NA |
NA |
|
|
Mes 24 |
NA |
NA |
NA |
|
|
ACR50 |
Mes 3 |
8 |
27 |
28 |
|
Mes 6 |
NA |
37 |
30 |
|
|
Mes 12 |
NA |
NA |
NA |
|
|
Mes 24 |
NA |
NA |
NA |
|
|
ACR70 |
Mes 3 |
2 |
14 |
11 |
|
Mes 6 |
NA |
16 |
16 |
|
|
Mes 12 |
NA |
NA |
NA |
|
|
Mes 24 |
NA |
NA |
NA |
|
|
Estudio VI: sin tratamiento previo con MTX |
||||
|
Tasa de respuesta (%) |
Tiempo |
MTX |
XELJANZ® 5 mg dos veces al día monoterapia N = 369 |
XELJANZ® 10 mg dos veces al día monoterapia N = 394 |
|
ACR20 |
Mes 3 |
52 |
70 |
78 |
|
Mes 6 |
51 |
71 |
76 |
|
|
Mes 12 |
51 |
68 |
72 |
|
|
Mes 24 |
42 |
64 |
64 |
|
|
ACR50 |
Mes 3 |
20 |
40 |
50 |
|
Mes 6 |
27 |
47 |
56 |
|
|
Mes 12 |
34 |
50 |
56 |
|
|
Mes 24 |
28 |
49 |
49 |
|
|
ACR70 |
Mes 3 |
5 |
20 |
27 |
|
Mes 6 |
12 |
25 |
38 |
|
|
Mes 12 |
15 |
29 |
38 |
|
|
Mes 24 |
15 |
34 |
38 |
|
Los resultados de la proporción de pacientes con una respuesta ACR para los estudios I, II, IV, V y VI se muestran en la Tabla 1. Se observaron resultados similares en el estudio III.
Los resultados de los componentes de los criterios de la respuesta ACR para los estudios IV y V se muestran en la Tabla 2. Se observaron resultados similares en los estudios I, II y III.
Tabla 2. componentes de la respuesta ACR a 3 meses en Estudios IV y V
|
Estudio IV: respuesta inadecuada a MTX |
||||
|
Componente |
Tiempo |
Placebo |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
Número de articulaciones sensibles (0-68) |
Valor inicial |
23 |
24 |
23 |
|
Mes 3 |
18 |
13 |
10 |
|
|
Número de articulaciones inflamadas (0-66) |
Valor inicial |
14 |
14 |
14 |
|
Mes 3 |
10 |
6 |
6 |
|
|
Dolora |
Valor inicial |
55 |
58 |
58 |
|
Mes 3 |
47 |
35 |
29 |
|
|
Evaluación global por el pacientea |
Valor inicial |
54 |
58 |
57 |
|
Mes 3 |
47 |
35 |
29 |
|
|
Índice de discapacidad (HAQ-DI)b |
Valor inicial |
1.31 |
1.41 |
1.39 |
|
Mes 3 |
1.19 |
1.00 |
0.84 |
|
|
Evaluación global del médicoa |
Valor inicial |
56 |
59 |
58 |
|
Mes 3 |
43 |
30 |
25 |
|
|
PCR (mg/L) |
Valor inicial |
13.7 |
15.5 |
17.0 |
|
Mes 3 |
14.6 |
6.9 |
4.4 |
|
|
Estudio V: respuesta inadecuada a inhibidor del TNF |
||||
|
Componente |
Tiempo |
Placebo + MTX |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
Número de articulaciones sensibles al tacto (0-68) |
Valor inicial |
28 |
28 |
28 |
|
Mes 3 |
21 |
16 |
13 |
|
|
Número de articulaciones Inflamadas (0-66) |
Valor inicial |
17 |
16 |
17 |
|
Mes 3 |
12 |
8 |
7 |
|
|
Dolora |
Valor inicial |
61 |
66 |
60 |
|
Mes 3 |
53 |
39 |
38 |
|
|
Evaluación global por el pacientea |
Valor inicial |
62 |
65 |
59 |
|
Mes 3 |
53 |
41 |
37 |
|
|
Índice de discapacidad (HAQ-DI)b |
Valor inicial |
1.63 |
1.60 |
1.50 |
|
Mes 3 |
1.44 |
1.20 |
1.10 |
|
|
Evaluación global por el médicoa |
Valor inicial |
64 |
65 |
59 |
|
Mes 3 |
44 |
35 |
31 |
|
|
PCR (mg/L) |
Valor inicial |
16.7 |
19.3 |
15.7 |
|
Mes 3 |
18.2 |
6.2 |
4.8 |
|
a Escala visual análoga: 0 = Mejor, 100 = Peor
b Índice de discapacidad del cuestionario de evaluación de salud: 0 = mejor, 3 = peor; 20 preguntas; categorías; vestirse y asearse, levantarse, comer, caminar, higiene, alcanzar, agarrar y realizar actividades
El porcentaje de pacientes con respuesta ACR20 por visita para el estudio IV se muestra en la Figura 2. Se observaron respuestas similares en los estudios I, II, III y V.
Figura 2. Porcentaje de pacientes con respuesta ACR20 por visita para el estudio IV
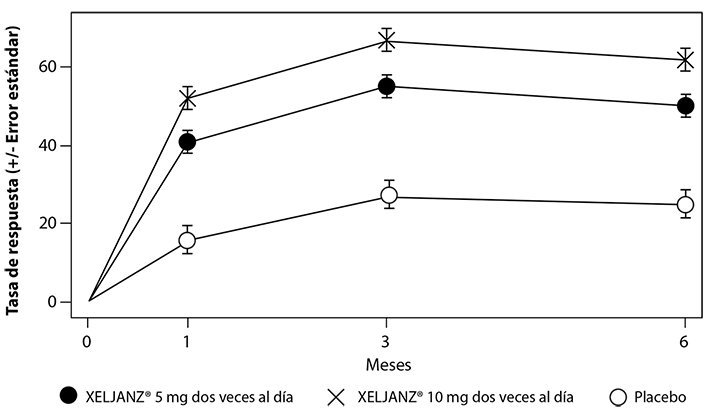
Se usó la imputación de los pacientes que no respondieron. Los pacientes que se retiraron del estudio contaron como fallas, ya que fueron pacientes que no tuvieron al menos una mejora del 20% en su cuenta de articulaciones al mes 3.
Respuesta radiográfica: Se realizaron dos estudios para evaluar el efecto de XELJANZ® en el daño estructural de las articulaciones. En los estudios IV y VI se evaluó la inhibición de la progresión del daño estructural de las articulaciones y expresado como el cambio medio desde el valor inicial en la puntuación del mTSS y sus componentes, el índice de erosión y el índice de disminución del espacio articular (JSN, por sus siglas en inglés) a los 6 y 12 meses. La proporción de pacientes sin progresión radiográfica (cambio en mTSS menor o igual a 0.5) también se midió.
En el estudio IV, la administración de XELJANZ® 10 mg dos veces al día más MTX de base tuvo como resultado una inhibición significativamente mayor de la progresión del daño estructural en comparación con placebo más MTX a los 6 y 12 meses. Cuando se administró una dosis de 5 mg dos veces al día, XELJANZ® más MTX mostraron efectos similares en la progresión media del daño estructural (sin significancia estadística). El análisis de los puntajes de erosión y JSN fue coherente con los resultados generales. Estos resultados se muestran en la Tabla 3 .
En el grupo de placebo más MTX, un 78% de los pacientes no experimentó progresión radiográfica a los seis meses, en comparación con el 89% y el 87% de los pacientes tratados con XELJANZ® 5 mg o 10 mg dos veces al día respectivamente, más MTX, ambos de importancia en comparación con placebo más MTX.
Tabla 3: cambios radiográficos a los 6 y 12 meses
|
Estudio IV |
|||||
|
Placebo + MTX (DE)a |
XELJANZ® 5 mg dos veces al día |
XELJANZ® 5 mg dos veces al día + |
XELJANZ® 10 mg dos veces al día + |
XELJANZ® 10 mg dos veces al día + (IC) |
|
|
mTSSc Valor inicial Mes 6 Mes 12 |
33 (42) 0.5 (2.0) 1.0 (3.9) |
31 (48) 0.1 (1.7) 0.3 (3.0) |
- -0.3 (-0.7, 0.0) -0.6 (-1.3, 0.0) |
37 (54) 0.1 (2.0) 0.1 (2.9) |
- -0.4 (-0.8, 0.0) -0.9 (-1.5, -0.2) |
|
Puntaje de erosiónc Valor inicial Mes 6 Mes 12 |
14 (19) 0.1 (1.0) 0.3 (2.0) |
14 (24) 0.1 (1.0) 0.2 (1.7) |
- -0.1 (-0.3, 0.1) -0.1 (-0.4, 0.2) |
18 (28) 0.0 (0.7) 0.0 (1.1) |
- -0.1 (-0.3, 0.1) -0.3 (-0.6, 0.0) |
|
Puntaje JSNc Valor inicial Mes 6 Mes 12 |
18 (24) 0.3 (1.5) 0.7 (2.9) |
17 (25) 0.1 (1.1) 0.1 (1.9) |
- -0.3 (-0.6, 0.1) -0.5 (-1.0, 0.0) |
20 (28) 0.1 (1.8) 0.1 (2.6) |
- -0.3 (-0.6, 0.0) -0.6 (-1.1, -0.1) |
a DE = Desviación estándar
b Diferencia entre medias de cuadrados mínimos XELJANZ® menos placebo (IC de 95% = intervalo de confianza del 95%)
c Los datos a los 6 y 12 meses son los cambios medios desde el valor inicial
En el estudio VI, la monoterapia con XELJANZ® resultó en una inhibición significativamente mayor en la progresión del daño estructural en comparación con MTX a los 6 meses y 12 meses, tal cual se muestra en la Tabla 4, lo cual también se mantuvo a los 24 meses. El análisis de los puntajes de erosión y JSN fue coherente con los resultados generales.
En el grupo de MTX, el 70% de los pacientes no experimentó progresión radiográfica a los 6 meses en comparación con el 84% y el 90% de los pacientes tratados con XELJANZ® 5 mg o 10 mg dos veces al día respectivamente, ambos estadísticamente significativos en comparación con MTX.
Tabla 4: cambios radiográficos a los 6 y 12 meses
|
Estudio VI |
|||||
|
MTX |
XELJANZ® 5 mg dos veces al día |
XELJANZ® 5 mg dos veces al día |
XELJANZ® 10 mg dos veces al día |
XELJANZ® 10 mg dos veces al día (IC) |
|
|
mTSSc Valor inicial Mes 6 Mes 12 |
17 (29) 0.8 (2.7) 1.3 (3.7) |
20 (40) 0.2 (2.3) 0.4 (3.0) |
- -0.7 (-1.0, -0.3) -0.9 (-1.4, -0.4) |
19 (39) 0.0 (1.2) 0.0 (1.5) |
- -0.8 (-1.2, -0.4) -1.3 (-1.8, -0.8) |
|
Puntaje de erosiónc Valor inicial Mes 6 Mes 12 |
8 (15) 0.5 (1.9) 0.6 (2.2) |
10 (21) 0.1 (1.4) 0.1 (1.6) |
- -0.4 (-0.7, -0.2) -0.6 (-0.8, -0.3) |
9 (20) 0.0 (0.7) 0.0 (1.0) |
- -0.5 (-0.7, -0.3) -0.7 (-0.9, -0.4) |
|
Puntaje JSNc Valor inicial Mes 6 Mes 12 |
8 (16) 0.4 (1.3) 0.6 (2.1) |
11 (21) 0.1 (1.4) 0.3 (2.1) |
- -0.2 (-0.5, 0.0) -0.4 (-0.7, 0.0) |
9 (20) 0.1 (0.9) 0.0 (0.9) |
- -0.3 (-0.5, -0.1) -0.6 (-0.9. -0.3) |
a DE = Desviación Estándar
b Diferencia entre medias de cuadrados mínimos XELJANZ® menos MTX (IC de 95% = intervalo de confianza del 95%)
c Los datos a los 6 y 12 meses son los cambios medios desde el valor inicial
Respuesta en la función física y resultados relacionados con la salud: La mejoría del funcionamiento físico fue medida por el HAQ-DI. Los pacientes que recibieron XELJANZ® 5 o 10 mg dos veces al día demostraron mejoría significativa a partir del valor inicial en el funcionamiento físico comparado con el placebo a los 3 meses (estudios I, II, III y V) y a los 6 meses (estudios II y III). Los pacientes tratados con XELJANZ® 5 o 10 mg dos veces al día demostraron una significativa mejoría en el funcionamiento físico comparado con placebo a partir de la semana 2 en los estudios I y II. En el estudio III, la media de mejoría en HAQ-DI se mantuvo por 12 meses en pacientes tratados con XELJANZ®. Las mejorías promedio de HAQ-DI se mantuvieron por 36 meses en los estudios abiertos de extensión en curso. En comparación con los pacientes tratados con adalimumab, a los 3 meses, los pacientes en el grupo de XELJANZ® de 5 mg dos veces al día tuvieron resultados similares a partir del valor inicial en los valores de HAQ-DI y los pacientes tratados en el grupo con 10 mg dos veces al día tuvieron disminuciones significativamente mayores en HAQ-DI. El cambio medio en HAQ-DI desde el valor inicial a los tres meses en los estudios I a VI se muestra en la Tabla 5.
Tabla 5: cambio medio a partir del valor inicial de HAQ-DI
|
Estudio I: respuesta inadecuada a FARME |
|||
|
Tiempo |
Placebo |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
Cambio medio de LS en HAQ-DI a los 3 mesesa |
-0.19 |
-0.50** |
-0.57** |
|
Estudio II: respuesta inadecuada a FARME |
|||
|
Tiempo |
Placebo + FARME(s) |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
Cambio medio de LS en HAQ-DI a los 3 mesesa |
-0.21 |
-0.46** |
-0.56** |
|
Estudio III: respuesta inadecuada a MTX |
|||
|
Placebo + MTX |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
|
Cambio medio de LS en HAQ-DI a los 3 mesesa |
-0.24 |
-0.55** |
-0.61** -0.49** |
|
Estudio IV: MTX respuesta inadecuada a MTX |
|||
|
Placebo + MTX |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
|
Cambio medio de LS en HAQ-DI a los 3 mesesa |
-0.15 |
-0.40b |
-0.54 |
|
Estudio V: respuesta inadecuada a inhibidor del TNF |
|||
|
Placebo |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
|
Cambio medio de LS en HAQ-DI a los 3 mesesa |
-0.18 |
-0.43** |
-0.46** |
|
Estudio VI: sin tratamiento previo con MTX: monoterapia |
|||
|
Placebo + MTX |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
|
Cambio medio de LS en HAQ-DI a los 3 mesesa |
-0.47 |
-0.75** |
-0.85** |
a Criterio primario de valoración de la eficacia.
b No pudo declararse la importancia estadística en el estudio IV debido a un retroceso en el procedimiento.
** p < 0.0001, XELJANZ® en comparación con el placebo + MTX/FARME
Los resultados se obtienen de un modelo lineal longitudinal con cambio a partir del valor inicial como una variable dependiente y tratamiento, valor inicial, y región como efectos fijos y paciente como efecto aleatorio
IC = intervalo de confianza, FAS = conjunto de análisis completos, LS = cuadrados mínimos, N = número de pacientes, MTX = metotrexato, QOW = cada dos semanas, HAQ-DI = índice de discapacidad de cuestionario de evaluación de salud
La calidad de vida relacionada a la salud fue evaluada con la Encuesta de Salud Breve (SF-36, por sus siglas en inglés) en los 5 estudios. En estos estudios los pacientes que recibieron XELJANZ® 10 mg dos veces al día demostraron una mejoría significativamente mayor desde el valor inicial comparado con el grupo placebo en los 8 dominios de la SF-36 así como en el Resumen de Componentes Físicos (PCS, por sus siglas en inglés) y el Resumen de Componentes Mentales (MCS, por sus siglas en inglés) a los 3 meses. Los dos grupos tratados con XELJANZ® exhibieron mejoría significativamente mayor a partir del valor inicial en comparación con el placebo en los 8 dominios, así como en el PCS y en el MCS a los 3 meses en los estudios I, IV y V. En los estudios III y IV las mejorías en SF-36 se mantuvieron por 12 meses en los pacientes tratados con XELJANZ®.
La mejoría en la fatiga fue evaluada mediante la escala funcional para el tratamiento de enfermedades crónicas (FACIT-F) a los 3 meses en todos los estudios. Los pacientes que recibieron XELJANZ® 5 o 10 mg dos veces al día mostraron una mejoría significativamente mayor desde el valor inicial en la fatiga en comparación con el placebo en los 5 estudios. En los estudios III y IV, las mejorías promedio en FACIT-F se mantuvieron hasta por 12 meses en los pacientes tratados con XELJANZ®.
La mejoría en el sueño fue evaluada mediante los apartados I y II del Índice de Problemas de Sueño de la escala de los desenlaces médicos del estudio del sueño (MOS-Sleep, por sus siglas en inglés) a los 3 meses en todos los estudios. Los pacientes que recibieron XELJANZ® 5 o 10 mg dos veces al día demostraron mejoría significativamente mayor a partir del valor inicial en ambas escalas en comparación con el placebo en los estudios II, III y IV. En los estudios III y IV las mejorías promedio en ambas escalas se mantuvieron hasta por 12 meses en los pacientes tratados con XELJANZ®.
La mejoría en la productividad fue evaluada con el Cuestionario de Limitaciones Laborales (WLQ, por sus siglas en inglés) a los 3 meses en todos los estudios. Los pacientes que recibieron XELJANZ® 10 mg dos veces al día demostraron mejoría significativamente mayor a partir del valor inicial en la escala de los resultados obtenidos en el trabajo global comparado con el placebo en los estudios III, IV y V. En los estudios III y IV, las mejorías globales promedio en los resultados obtenidos se mantuvieron hasta por 12 meses en los pacientes tratados con XELJANZ® 10 mg dos veces al día.
Durabilidad de las respuestas clínicas: La durabilidad del efecto fue evaluada por las tasas de respuesta ACR20, ACR50, ACR70, media de HAQ-DI y media de DAS28-4(ESR) en tres estudios IR de Fase 3 de FARME con una duración de al menos un año. La eficacia se mantuvo en todos los grupos de tratamiento con tofacitinib hasta el final de los estudios. La evidencia de la persistencia de la eficacia con el tratamiento con tofacitinib por hasta 6 años es también proporcionada a partir de los datos de un PASS aleatorizado de gran tamaño en pacientes con AR de 50 años y mayores con al menos un factor de riesgo CV adicional, así como en estudios de seguimiento a largo plazo completos y abiertos hasta 8 años.
Artritis psoriásica: El programa de desarrollo clínico de XELJANZ® para evaluar la eficacia y seguridad en pacientes con artritis psoriásica incluyó 2 ensayos aleatorizados, controlados con placebo, doble ciego y multicéntricos de confirmación en 816 pacientes de 18 años y mayores. Todos los pacientes tuvieron artritis psoriásica activa durante al menos 6 meses según el Criterio de Clasificación de Artritis Psoriásica (CASPAR, por sus siglas en inglés), al menos 3 articulaciones sensibles al tacto/dolorosas y al menos 3 articulaciones inflamadas y psoriasis de placa activa. Los pacientes con diferentes subtipos de artritis psoriásica (no mutuamente excluyentes) se inscribieron en los 2 ensayos clínicos, incluidas < 5 articulaciones o compromiso asimétrico (21%), ≥ 5 articulaciones afectadas (90%), compromiso articular distal interfalángico (IFD, por sus siglas en inglés) (61%), artritis mutilante (8%) y espondilitis (19%). Los pacientes en estos ensayos clínicos tuvieron un diagnóstico de artritis psoriásica durante una mediana de 5.5 años (rango de 3.0 a 6.0 años). En el valor inicial, 80%, 53% y 69% de los pacientes tenía entesitis, dactilitis y área de la superficie corporal (BSA, por sus siglas en inglés) psoriásica total ≥ 3%, respectivamente. A todos los pacientes se les solicitó recibir tratamiento con una dosis estable de FARME sintético convencional (FARMEsc; 79% recibió metotrexato, 13% recibió sulfasalazina, 7% recibió leflunomida, 1% recibió otro FARMEsc) y se les permitió recibir una dosis baja estable de corticosteroides orales (21% recibió el equivalente a ≤ 10 mg/día de prednisona) y/o medicamentos antiinflamatorios no esteroideos (AINE; 57% lo recibió). En ambos ensayos clínicos, los criterios primarios de valoración fueron la respuesta ACR20 y el cambio en HAQ-DI en el Mes 3.
El estudio de PsA-I fue un ensayo clínico de 12 meses que incluyó a 422 pacientes que presentaron una respuesta inadecuada a FARMEsc (67% y 33% fueron pacientes con respuesta inadecuada a 1 FARMEsc y ≥ 2 FARMEsc, respectivamente) y que no se habían tratado previamente con un FARME biológico inhibidor del TNF (TNFi). Los pacientes se aleatorizaron en una proporción de 2:2:2:1:1 para recibir XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, adalimumab 40 mg por vía subcutánea una vez cada 2 semanas, placebo para la secuencia de tratamiento con XELJANZ® 5 mg dos veces al día o placebo para la secuencia de tratamiento con XELJANZ® 10 mg dos veces al día, respectivamente; se agregó el medicamento de estudio al tratamiento con FARMEsc de fondo. En la visita del Mes 3, todos los pacientes aleatorizados al tratamiento con placebo fueron transferidos de manera ciega a una dosis predeterminada de XELJANZ® de 5 mg o 10 mg dos veces al día. El estudio de PsA-I no se diseñó para demostrar la ausencia de inferioridad o superioridad a adalimumab.
El estudio de PsA-II fue un ensayo clínico de 6 meses que incluyó a 394 pacientes que presentaron una respuesta inadecuada a por lo menos a 1 TNFi aprobado (66%, 19% y 15% fueron pacientes con respuesta inadecuada a 1 TNFi, 2 TNFi y ≥ 3 TNFi, respectivamente). Los pacientes se aleatorizaron en una proporción de 2:2:1:1 para recibir XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, placebo para la secuencia de tratamiento de XELJANZ® 5 mg dos veces al día o placebo para la secuencia de tratamiento de XELJANZ® 10 mg dos veces al día, respectivamente; se agregó el medicamento de estudio al tratamiento con un FARMEsc de fondo. En la visita del Mes 3, los pacientes con placebo fueron transferidos de manera ciega a una dosis predeterminada de XELJANZ® de 5 mg o 10 mg dos veces al día como en el estudio de PsA-I.
Respuesta clínica:
Signos y síntomas: En el Mes 3, los pacientes tratados con XELJANZ® 5 mg o 10 mg dos veces al día presentaban tasas de respuesta más altas (p≤0.05) en comparación con el placebo para ACR20, ACR50 y ACR70 en el estudio de PsA-I y para ACR20 y ACR50 en el estudio de PsA-II; las tasas de respuesta ACR70 también fueron más altas para XELJANZ® 5 mg y 10 mg dos veces al día en comparación con placebo en el estudio de PsA-II, aunque las diferencias frente a placebo no fueron estadísticamente significativas (p > 0.05) (Tabla 6). Los exámenes de edad, sexo, raza, actividad de la enfermedad en el periodo inicial y subtipo de artritis psoriásica no identificaron diferencias en la respuesta a XELJANZ®. La cantidad de pacientes con artritis mutilante era demasiado pequeña como para permitir una evaluación significativa.
Tabla 6: Proporción de pacientes con una respuesta ACR en los estudios de PsA-I y PsA-II
|
Porcentaje de pacientes |
|||||||
|
Pacientes con respuesta inadecuada a FARME |
Pacientes con respuesta inadecuada a TNFid |
||||||
|
Estudio de PsA-I |
Estudio de PsA-II |
||||||
|
Grupo de tratamiento |
Placebo |
XELJANZ® 5 mg dos veces al día |
XELJANZ® 10 mg dos veces al día |
Adalimumab 40 mg SC |
Placebo |
XELJANZ® 5 mg dos veces al día |
XELJANZ® 10 mg dos veces al día |
|
Na |
105 |
107 |
104 |
106 |
131 |
131 |
132 |
|
ACR20 Mes 3 Mes 6 Mes 12 |
33% NAb NA |
50%* 59% 68% |
61%* 67% 70% |
52%* 64% 60% |
24% NA -e |
50%* 60% - |
47%* 49% - |
|
ACR50 Mes 3 Mes 6 Mes 12 |
10% NA NA |
28%* 38% 45% |
40%* 46% 48% |
33%* 42% 41% |
15% NA - |
30%* 38% - |
28%* 30% - |
|
ACR70 Mes 3 Mes 6 Mes 12 |
5% NA NA |
17%* 18% 23% |
14%* 32% 31% |
19%* 30% 29% |
10% NA - |
17% 21% - |
14% 14% - |
a N es la cantidad de pacientes aleatorizados y tratados
b NA = No aplicable, ya que los datos para el tratamiento con placebo no se encuentran disponibles más allá del mes 3 debido a la transferencia desde placebo
c Respuesta inadecuada a por lo menos un FARMEsc debido a la falta de eficacia y/o intolerabilidad
d Respuesta inadecuada a por lo menos un inhibidor de TNF (TNFi) debido a falta de eficacia y/o intolerabilidad
e El estudio de PsA-II tuvo una duración de 6 meses
* p ≤ 0.05 para el tratamiento activo frente a placebo
Al igual que con las respuestas ACR, en pacientes tratados con XELJANZ® 5 mg o 10 mg dos veces al día en los estudios de PsA-I y PsA-II, cada uno de los componentes de la respuesta ACR mejoró de manera constante desde el periodo inicial en el mes 3, incluidos recuentos de articulaciones sensibles al tacto/dolorosas e inflamadas, evaluación del paciente de dolor de artritis, evaluación global por parte del paciente y el médico de la artritis, HAQ-DI y CRP en comparación a pacientes que reciben placebo (Tabla 7).
Tabla 7: Componentes de la respuesta ACR en el periodo inicial y el mes 3 en los estudios de PsA-I y PsA-II
|
Pacientes con respuesta inadecuada a FARME sintético convencional (sin tratamiento previo con TNFi) |
Pacientes con Respuesta Inadecuada a TNFi |
||||||
|---|---|---|---|---|---|---|---|
|
Estudio de PsA-I |
Estudio de PsA-II |
||||||
|
Grupo de Tratamiento |
Placebo |
XELJANZ® |
XELJANZ® |
Adalimumab 40 mg SC c/2Sem |
Placebo |
XELJANZ® |
XELJANZ® |
|
N al periodo Inicial |
105 |
107 |
104 |
106 |
131 |
131 |
132 |
|
Componente de ACRa |
|||||||
|
Cantidad de articulaciones sensibles al tacto/dolorosas (0-68) Periodo inicial Mes 3 |
20.6 14.6 |
20.5 12.2 |
20.3 9.9 |
17.1 10.8 |
19.8 15.1 |
20.5 11.5 |
25.5 14.5 |
|
Cantidad de articulaciones inflamadas (0-66) Periodo inicial Mes 3 |
11.5 7.1 |
12.9 6.3 |
11.7 4.3 |
9.8 4.0 |
10.5 7.7 |
12.1 4.8 |
12.8 6.1 |
|
Evaluación del paciente sobre el dolor de artritisb Periodo inicial Mes 3 |
53.2 44.7 |
55.7 34.7 |
54.4 28.5 |
50.7 32.5 |
54.9 48.0 |
56.4 36.1 |
59.5 38.1 |
|
Evaluación global del paciente sobre la artritisb Periodo inicial Mes 3 |
53.9 44.4 |
54.7 35.5 |
53.6 29.8 |
50.6 32.9 |
55.8 49.2 |
57.4 36.9 |
58.5 38.8 |
|
HAQ-DIc Periodo inicial Mes 3 |
1.11 0.95 |
1.16 0.81 |
1.08 0.71 |
1.10 0.75 |
1.25 1.09 |
1.26 0.88 |
1.37 1.03 |
|
Evaluación global del médico sobre la artritisb Periodo inicial Mes 3 |
53.8 35.4 |
54.6 29.5 |
55.2 23.6 |
50.5 26.3 |
53.7 36.4 |
53.5 27.0 |
55.8 25.6 |
|
CRP (mg/L) Periodo Inicial Mes 3 |
10.4 8.60 |
10.5 4.02 |
8.1 2.68 |
14.3 3.10 |
12.1 11.44 |
13.8 7.72 |
15.0 7.25 |
a Los datos mostrados son los valores medios en el periodo inicial y en el mes 3
b Escala analógica visual (VAS por sus siglas en inglés): 0 = mejor, 100 = peor
c HAQ-DI = índice de discapacidad del cuestionario de evaluación de la salud (por sus siglas en inglés): 0 = mejor, 3 = peor; 20 preguntas; categorías: vestirse y asearse, levantarse, comer, caminar, higiene, alcanzar, agarrar y realizar actividades
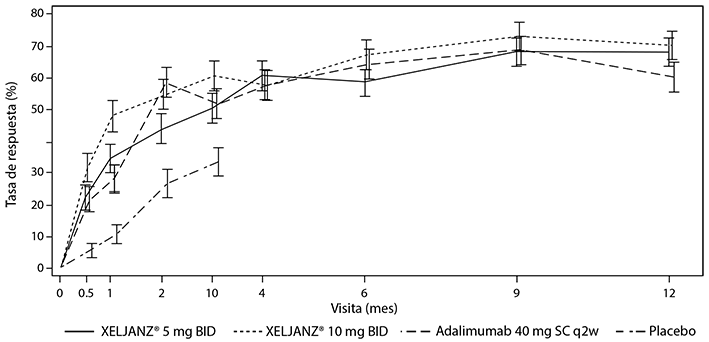
El porcentaje de pacientes con respuesta ACR20 por visita para los estudios de PsA-I y PsA-II se muestra en la Figura 3. En pacientes tratados con XELJANZ® en los estudios de PsA-I y PsA-II, se observaron tasas de respuesta ACR20 significativamente más altas en el plazo de 2 semanas en comparación con el placebo (Figura 3). Después del Mes 3, las tasas de respuesta ACR se mantuvieron o mejoraron hasta el Mes 6 (estudios de PsA-I y PsA-II) y Mes 12 (estudio PsA-I).
Figura 3: porcentaje de pacientes con respuesta ACR20 por visita
a) Hasta el mes 12 en el estudio de PsA-I
b) Hasta el mes 6 en el estudio de PsA-IIa
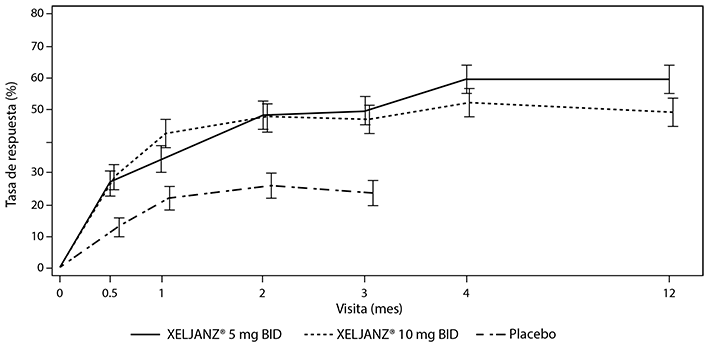
En los estudios de PsA-I y PsA-II, la comparación de XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y adalimumab (estudio de PsA-I solamente) con placebo fue significativa (valor p ≤ 0.05) en los meses 0.5; 1; 2; y 3.
BID = dos veces al día; SC c/2 sem = por vía subcutánea una vez cada 2 semanas.
Los pacientes aleatorizados al tratamiento con placebo fueron transferidos a XELJANZ® 5 mg o 10 mg dos veces al día de manera ciega en el Mes 3; los resultados para la parte XELJANZ® de la secuencia de tratamiento placebo→ XELJANZ® (es decir, posterior al Mes 3) no se incluyen en la figura para facilitar su legibilidad.
a El estudio de PsA-II tuvo una duración de 6 meses.
En pacientes con entesitis en el periodo inicial, se observó evidencia de beneficios en la entesitis con el tratamiento con XELJANZ®. En el estudio de PsA-I, el cambio desde el periodo inicial en el puntaje del índice entesitis Leeds fue de -0.8, -1.5, -1.1, y -0.4 para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, adalimumab 40 mg por vía subcutánea una vez cada 2 semanas y placebo, respectivamente, en el mes 3; y -1.7, -1.6, y -1.6 para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y adalimumab 40 mg por vía subcutánea una vez cada 2 semanas, respectivamente, en el mes 12. En el estudio de PsA-II, el cambio desde el periodo inicial en el puntaje del índice de entesitis de Leeds fue de -1.3, -1.3 y -0.5 para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y placebo, respectivamente, en el Mes 3; y -1.5 y -1.6 para XELJANZ® 5 mg dos veces al día y XELJANZ® 10 mg dos veces al día, respectivamente, en el mes 6.
En el estudio de PsA-I, la resolución de entesitis en el mes 3 se produjo en el 33.3%, 40.6%, 47.4% y 21.5% de los pacientes con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, adalimumab 40 mg por vía subcutánea una vez cada dos semanas y placebo, respectivamente. En el estudio de PsA-II, la resolución de entesitis en el mes 3 se produjo en el 39.8%, 32.3% y 21.5% de los pacientes con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y placebo, respectivamente.
En pacientes con dactilitis en el periodo inicial, se observó evidencia de beneficios en la dactilitis con el tratamiento con XELJANZ®. En el estudio de PsA-I el cambio desde el periodo inicial en el puntaje de severidad de dactilitis fue de -3.5, -5.5, -4.0 y -2.0 para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, adalimumab 40 mg por vía subcutánea una vez cada dos semanas y placebo, respectivamente, en el mes 3; y -7.4, -7.5 y -6.1 para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y adalimumab 40 mg por vía subcutánea una vez cada 2 semanas, respectivamente, en el mes 12. En el estudio de PsA-II, el cambio desde el periodo inicial en el puntaje de severidad de dactilitis fue de -5.2, -5.4 y -1.9 para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y placebo, respectivamente, en el mes 3; y -6.0 y -6.0 para XELJANZ® 5 mg dos veces al día y XELJANZ® 10 mg dos veces al día, respectivamente, en el mes 6.
En el estudio de PsA-I, la resolución de dactilitis en el mes 3 se produjo en el 34.4%, 60.0%, 46.6%, y 32.8% de los pacientes con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, adalimumab 40 mg por vía subcutánea una vez cada 2 semanas y placebo, respectivamente. En el estudio de PsA-II, la resolución de dactilitis en el mes 3 se produjo en el 51.5%, 50.8% y 28.6% de los pacientes con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y placebo, respectivamente.
Se evaluó la evidencia de beneficios en manifestaciones cutáneas de artritis psoriásica según PASI75 (≥ 75% de mejora desde el periodo inicial en el índice de severidad y área de la psoriasis), en pacientes con artritis psoriásica activa que tuvieron un BSA psoriásico total ≥ 3%. En el estudio de PsA-I, las tasas de los pacientes con respuestas de PASI75 en el mes 3 fueron más altas para XELJANZ® 5 mg dos veces al día y XELJANZ® 10 mg dos veces al día en comparación con el placebo. En el estudio de PsA-II, las tasas de los pacientes con respuesta de PASI75 en el mes 3 fueron más altas (sin importancia estadística) para XELJANZ® 5 mg dos veces al día y más altas para XELJANZ® 10 mg dos veces al día en comparación con el placebo. Después del mes 3, el beneficio en este dominio se mantuvo o mejoró hasta el mes 6 (estudios de PsA-I y PsA-II) y el mes 12 (estudio de PsA-I).
La actividad de la artritis psoriásica también se determinó mediante Actividad mínima de la enfermedad (MDA, por sus siglas en inglés) y Puntaje de actividad de artritis psoriásica (PASDAS, por sus siglas en inglés). En el estudio de PsA-I, las tasas de MDA en el Mes 3 fueron de 26%, 26%, 25% y 7% en pacientes con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, adalimumab 40 mg por vía subcutánea una vez cada 2 semanas y placebo, respectivamente. En el estudio de PsA-II, las tasas de MDA en el mes 3 fueron de 23%, 21% y 15% en pacientes con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y placebo, respectivamente. Después del mes 3 en pacientes tratados con XELJANZ®, las tasas de MDA se mantuvieron o mejoraron hasta el mes 6 (estudios de PsA-I y PsA-II) y mes 12 (estudio de PsA-I).
En el estudio de PsA-I, el cambio desde el periodo inicial en el PASDAS en el Mes 3 fue de -2.0, -2.4, -2.2 y -1.2 para XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día, adalimumab 40 mg por vía subcutánea una vez cada 2 semanas y placebo, respectivamente. En el estudio de PsA-II, el cambio desde el periodo inicial en el PASDAS en el mes 3 fue de -1.9, -2.1 y -0.8 para XELJANZ® 5 mg dos veces al dia, XELJANZ® 10 mg dos veces al día y placebo, respectivamente. Después del mes 3 en pacientes tratados con XELJANZ® el cambio desde el periodo inicial en el PASDAS se mantuvo o mejoró hasta el mes 6 (estudios de PsA-I y PsA-II) y mes 12 (estudio de PsA-I).
Función física: La mejora en la función física se determinó mediante el HAQ-DI. Los pacientes que recibían XELJANZ® 5 mg dos veces al día o XELJANZ® 10 mg dos veces al día demostraron mejoras mayores (p ≤ 0.05) desde el periodo inicial en la función física en comparación con el placebo en el mes 3 (Tabla 8). La mejora de HAQ-DI desde el periodo inicial en pacientes tratados con XELJANZ® se mantuvo o mejoró hasta el mes 6 (estudios de PsA-I y PsA-II) y mes 12 (estudio de PsA-I).
Tabla 8: cambio desde el periodo inicial en HAQ-DI en los estudios de PsA-I y PsA-II
|
Cambio de la media de mínimos cuadrados desde el periodo inicial en HAQ-DI: |
|||||
|
Pacientes con respuesta inadecuada de FARME sintético convencionalb (sin tratamiento previo con TNFi) |
Pacientes con respuesta inadecuada a TNFic |
||||
|
Estudio de PsA-I |
Estudio de PsA-II |
||||
|
Grupo de Tratamiento |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
Adalimumab 40 mg |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
Na |
107 |
104 |
106 |
129 |
132 |
|
Mes 3 |
-0.17* |
-0.22* |
-0.20* |
-0.25* |
-0.22* |
a N es la cantidad total de pacientes en el análisis estadístico
b Respuesta inadecuada a por lo menos un FARME sintético convencional (FARMEsc) debido a la falta de eficacia y/o intolerabilidad
c Respuesta inadecuada a por lo menos un inhibidor de TNF (TNFi) debido a falta de eficacia y/o intolerabilidad
* p ≤ 0.05 para tratamiento activo frente a placebo
La tasa de respuesta de HAQ-DI (respuesta definida como una disminución desde el periodo inicial de ≥ 0.35) en el mes 3 en los estudios de PsA-I y PsA-II fue de 53% y 50%, respectivamente en pacientes que recibían XELJANZ® 5 mg dos veces al día, 55% y 41%, respectivamente en pacientes que recibían XELJANZ® 10 mg dos veces al día, 31% y 28%, respectivamente en pacientes que recibían placebo y 53% en pacientes que recibían adalimumab 40 mg por vía subcutánea una vez cada 2 semanas (estudio de PsA-I solamente).
Otros resultados relacionados con la salud: El estado de salud general se evaluó a través de la encuesta de salud del formulario breve (SF-36). En los estudios de PsA-I y PsA-II, los pacientes que recibían XELJANZ® 5 mg dos veces al día o XELJANZ® 10 mg dos veces al día tuvieron mejoras mayores desde el periodo inicial en comparación con placebo en el puntaje del resumen del componente físico (PCS) y en el puntaje de dominio de la función física y ningún empeoramiento en el puntaje del resumen del componente mental (MCS) en el mes 3. Las mejoras en el SF-36 se mantuvieron hasta el mes 6 (estudios de PsA-I y PsA-II) y mes 12 (estudio de PsA-I).
Los resultados de salud relacionados con la fatiga se evaluaron mediante la Evaluación Funcional para el Tratamiento de Enfermedades Crónicas-Fatiga (FACIT-F). En los estudios de PsA-I y PsA-II, los pacientes que recibían XELJANZ® 5 mg dos veces al día o XELJANZ® 10 mg dos veces al día tuvieron una mejora mayor desde el periodo inicial en comparación con el placebo en el puntaje total de FACIT-F, puntaje de dominio de experiencia y puntaje de dominio del efecto en el Mes 3.
Las mejoras en FACIT-F se mantuvieron hasta el Mes 6 (estudios de PsA-I y PsA-II) y mes 12 (estudio de PsA-I).
Respuesta radiográfica: En el estudio de PsA-I, la progresión del daño articular estructural se evaluó radiográficamente utilizando el Puntaje Total de Sharp modificado por Van der Heijde (mTSS) y la proporción de pacientes con progresión radiográfica (aumento de mTSS desde el periodo inicial > 0.5) se evaluó en el mes 12. En el mes 12, el 96%, 95%, y 98% de los pacientes que recibían XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y adalimumab 40 mg por vía SC cada 2 semanas, respectivamente, no tuvieron progresión radiográfica (aumento de mTSS desde el periodo inicial ≤ 0.5).
Colitis ulcerosa: El programa de desarrollo clínico XELJANZ® Fase 3 para la indicación de colitis ulcerosa incluyó 3 estudios confirmatorios (estudio UC-I, estudio UC-II y estudio UC-III), y un estudio abierto de extensión a largo plazo (estudio UC-IV).
Estudios de confirmación: La seguridad y eficacia de XELJANZ® para inducir y mantener la remisión fue evaluada en 3 estudios multicéntricos, doble ciego, aleatorizados, controlados con placebo: 2 estudios de inducción idénticos (8 semanas de duración; estudio UC-I y estudio UC-II) y 1 estudio de mantenimiento (52 semanas de duración; estudio UC-III). Estos estudios pivotales incluyeron pacientes adultos con colitis ulcerosa activa de moderada a grave (puntuación de mayo total de 6 a 12, con una subpuntuación de endoscopía de al menos 2 y puntuación de sangrado rectal de al menos 1) y que habían fallado o eran intolerantes a al menos 1 de los siguientes tratamientos: corticosteroides orales o intravenosos, azatioprina, 6-MP o inhibidor del TNF. La actividad de la enfermedad se evaluó mediante el índice de puntuación de mayo (0 a 12), que consistió en 4 subpuntuaciones (0 a 3 para cada subpuntaje): frecuencia de deposiciones, sangrado rectal, hallazgos en endoscopia y evaluación global del médico. Un subpuntaje de endoscopia de 2 se definió por un eritema marcado, un patrón vascular ausente, cualquier friabilidad y erosiones; un subpuntaje de endoscopia de 3 se definió por sangrado espontáneo y ulceración. Los pacientes que completaron el estudio UC-I o el estudio UC-II y lograron una respuesta clínica fueron elegibles para la re-aleatorización en el estudio UC-III.
Se les permitió a los pacientes la administración de dosis estables de aminosalicilatos y corticosteroides orales (equivalentes a una dosis diaria de prednisona de 25 mg) durante los estudios. Se requería reducir la dosis de corticosteroides en el ingreso al estudio UC-III. XELJANZ® se administró como monoterapia (es decir, sin administración concomitante de medicamentos biológicos ni inmunosupresores) para la colitis ulcerosa durante los estudios.
Además de los estudios anteriores, la seguridad y la eficacia de XELJANZ® también se evaluó en un estudio abierto de extensión a largo plazo (estudio UC-IV). Los pacientes que completaron 1 de los estudios de inducción (estudio UC-I o estudio UC-II), pero no lograron una respuesta clínica o los pacientes que completaron, o se retiraron temprano debido a un fracaso del tratamiento en el estudio de mantenimiento (estudio UC-III), fueron elegibles para el estudio UC-IV. Los pacientes del estudio UC-I o el estudio UC-II que no lograron una respuesta clínica después de 8 semanas en el estudio UC-IV se suspenderían del estudio UC-IV. Se requirió la reducción de corticosteroides al ingresar al estudio UC-IV.
Estudios de inducción (estudio UC-I y estudio UC-II): En el estudio UC-I y el estudio UC-II, se aleatorizó a 1139 pacientes (598 y 541 pacientes, respectivamente) al tratamiento con XELJANZ® 10 mg dos veces al día o placebo, con una proporción 4:1 para la asignación al tratamiento. En el estudio UC-I y el estudio UC-II, 51.7%, 73.2% y 71.9% de los pacientes había fracasado anteriormente en, o resultado intolerante a, el tratamiento con inhibidores del TNF (51.3% en el estudio UC-I y 52.1% en el estudio UC-II), corticosteroides (74.9% en el estudio UC-I y 71.3% en el estudio UC-II) y/o inmunosupresores (74.1% en el estudio UC-I y 69.5% en el estudio UC-II), respectivamente. En el periodo inicial, 46.1% de los pacientes estaban recibiendo corticosteroides orales como tratamiento concomitante para la colitis ulcerosa (45.5% en el estudio UC-I y 46.8% en el estudio UC-II). Las características clínicas iniciales fueron, por lo general, similares entre los pacientes tratados con XELJANZ® y los pacientes que recibieron placebo.
El criterio primario de valoración del estudio UC-I y el estudio UC-II era la proporción de pacientes que estuvieran en remisión en la semana 8, y el criterio secundario clave de valoración era la proporción de pacientes con mejoría en el aspecto endoscópico de la mucosa en la semana 8. La remisión se definió como la remisión clínica (un puntaje Mayo total ≤ 2, sin ningún subpuntaje individual > 1) y un subpuntaje de 0 para el sangrado rectal. La mejoría del aspecto endoscópico de la mucosa se definió como un subpuntaje de 0 o 1 para la endoscopía.
Los resultados de eficacia del estudio UC-I y el estudio UC-II basados en los resultados de la endoscopía leídos de forma centralizada se muestran en la Tabla 9. Una proporción significativamente mayor de pacientes tratados con XELJANZ® 10 mg dos veces al día alcanzó la remisión, la mejoría del aspecto endoscópico de la mucosa y la respuesta clínica en la semana 8, en comparación con los pacientes tratados con placebo, en ambos estudios.
Tabla 9. Proporción de pacientes que cumplieron los criterios de valoración de la eficacia en la semana 8 (estudio de inducción UC-I y estudio de inducción UC-II, lectura centralizada de la endoscopía)
|
Criterio de valoración |
Placebo |
XELJANZ® 10 mg |
Diferencia entre |
Valor p |
|
Estudio UC-I |
||||
|
Remisión en la semana 8a |
8.2% |
18.5% |
10.3% (4.3, 16.3) |
0.0070 |
|
Mejoría del aspecto endoscópico de la mucosa en la semana 8b |
15.6% |
31.3% |
15.7% (8.1, 23.4) |
0.0005 |
|
Normalización del aspecto endoscópico de la mucosa en la semana 8c |
1.6% |
6.7% |
5.1% (1.9, 8.3) |
0.0345 |
|
Respuesta clínica en la semana 8d |
32.8% |
59.9% |
27.1% (17.7, 36.5) |
< 0.0001 |
|
Estudio UC-II |
||||
|
N = 112 |
N = 429 |
|||
|
Remisión en la semana 8a |
3.6% |
16.6% |
13.0% (8.1, 17.9) |
0.0005 |
|
Mejoría del aspecto endoscópico de la mucosa en la semana 8b |
11.6% |
28.4% |
16.8% (9.5, 24.1) |
0.0002 |
|
Normalización del aspecto endoscópico de la mucosa en la semana 8c |
1.8% |
7.0% |
5.2% (1.8, 8.6) |
0.0425 |
|
Respuesta clínica en la semana 8d |
28.6% |
55.0% |
26.4% (16.8, 36.0) |
< 0.0001 |
IC = intervalo de confianza; N = cantidad de pacientes en el conjunto de análisis.
a La remisión se definió como remisión clínica (un puntaje Mayo ≤ 2 sin subpuntajes individuales > 1) y un subpuntaje de 0 en el sangrado rectal.
b La mejoría del aspecto endoscópico de la mucosa se definió como un subpuntaje mayo endoscópico de 0 (normal o enfermedad inactiva) o 1 (eritema, patrón vascular disminuido).
c La normalización del aspecto endoscópico de la mucosa se definió como un subpuntaje mayo endoscópico de 0.
d La respuesta clínica se definió como una disminución respecto del valor inicial en el puntaje mayo, de ≥ 3 puntos y ≥ 30%, junto con una disminución en el subpuntaje del sangrado rectal, de ≥ 1 punto, o un subpuntaje absoluto de 0 o 1 para el sangrado rectal.
Los resultados de eficacia basados en las lecturas endoscópicas en los centros del estudio fueron coherentes con los resultados basados en las lecturas centralizadas de las endoscopías.
Los resultados de los estudios individuales, el estudio UC-I y el estudio UC-II, fueron similares. Los datos combinados proveen un estimado más preciso de la diferencia entre el tratamiento con XELJANZ® 10 mg dos veces al día y el tratamiento con placebo en la semana 8: 11.6% (IC del 95%: 7.7% a 15.5%) en remisión y de 16.3% (IC del 95%: 11.0% a 21.6%) con la mejoría del aspecto endoscópico de la mucosa.
En ambos subgrupos de pacientes con o sin fracaso anterior en el tratamiento con inhibidores del TNF, una mayor proporción de pacientes tratados con XELJANZ® 10 mg dos veces al día alcanzó la remisión y la mejoría del aspecto endoscópico de la mucosa en la Semana 8 en comparación con el placebo. Esta diferencia entre los tratamientos fue coherente entre los 2 subgrupos (Tabla 10).
Tabla 10. Proporción de pacientes que cumplieron los criterios primarios y los criterios secundarios clave de valoración de la eficacia en la semana 8, por subgrupos de tratamiento con inhibidores del TNF (estudio de inducción UC-I y estudio de inducción UC-II, lectura centralizada de la endoscopía)
|
Criterio de valoración |
Placebo |
XELJANZ® 10 mg |
Diferencia entre |
|---|---|---|---|
|
Estudio UC-I |
|||
|
Remisión en la semana 8a |
|||
|
Con fracaso anterior en el tratamiento con inhibidores del TNF |
1.6% (1/64) |
11.1% (27/243) |
9.5% (4.6, 14.5) |
|
Sin fracaso anterior en el tratamiento con inhibidores del TNFb |
15.5% (9/58) |
26.2% (61/233) |
10.7% (-0.2, 21.6) |
|
Mejoría del aspecto endoscópico de la mucosa en la semana 8c |
|||
|
Con fracaso anterior en el tratamiento con inhibidores del TNF |
6.3% (4/64) |
22.6% (55/243) |
16.4% (8.5, 24.3) |
|
Sin fracaso anterior en el tratamiento con inhibidores del TNFb |
25.9% |
40.3% |
14.5% (1.6, 27.4) |
|
Estudio UC-II |
|||
|
Remisión en la semana 8a |
|||
|
Con fracaso anterior en el tratamiento con inhibidores del TNF |
0.0% (0/60) |
11.7% (26/222) |
11.7% (7.5, 15.9) |
|
Sin fracaso anterior en el tratamiento con inhibidores del TNFb |
7.7% (4/52) |
21.7% (45/207) |
14.0% (4.9, 23.2) |
|
Mejoría del aspecto endoscópico de la mucosa en la Semana 8c |
|||
|
Con fracaso anterior en el tratamiento con inhibidores del TNF |
6.7% (4/60) |
21.6% (48/222) |
15.0% (6.6, 23.3) |
|
Sin fracaso anterior en el tratamiento con inhibidores del TNFb |
17.3% (9/52) |
35.7% (74/207) |
18.4% (6.3, 30.6) |
IC = intervalo de confianza; N = cantidad de pacientes en el conjunto de análisis; TNF = factor de necrosis tumoral.
a La remisión se definió como remisión clínica (un puntaje mayo ≤ 2 sin subpuntajes individuales > 1) y un subpuntaje de 0 en el sangrado rectal.
b Incluidos los pacientes que no se trataron con inhibidores del TNF.
c La mejoría del aspecto endoscópico de la mucosa se definió como un subpuntaje de mayo de endoscopía de 0 (normal o enfermedad inactiva) o 1 (eritema, disminución del patrón vascular).
Los cambios respecto del valor inicial en los subpuntajes del sangrado rectal y la frecuencia de las deposiciones se evaluaron en cada visita del estudio UC-I y el estudio UC-II, y se muestran en la Figura 4. Se observaron mejorías significativas respecto del valor inicial tanto en el sangrado rectal como en la frecuencia de defecación en los pacientes tratados con XELJANZ®, en comparación con el placebo. La diferencia en el sangrado rectal y la frecuencia de las deposiciones entre el tratamiento con XELJANZ® 10 mg dos veces al día y el tratamiento con placebo fueron significativas incluso en la semana 2, la visita más temprana programada en el estudio, y en cada vista posterior.
Figura 4. Cambio respecto del valor inicial en los subpuntajes del sangrado rectal y la frecuencia de las deposiciones (estudio UC-I y estudio UC-II)
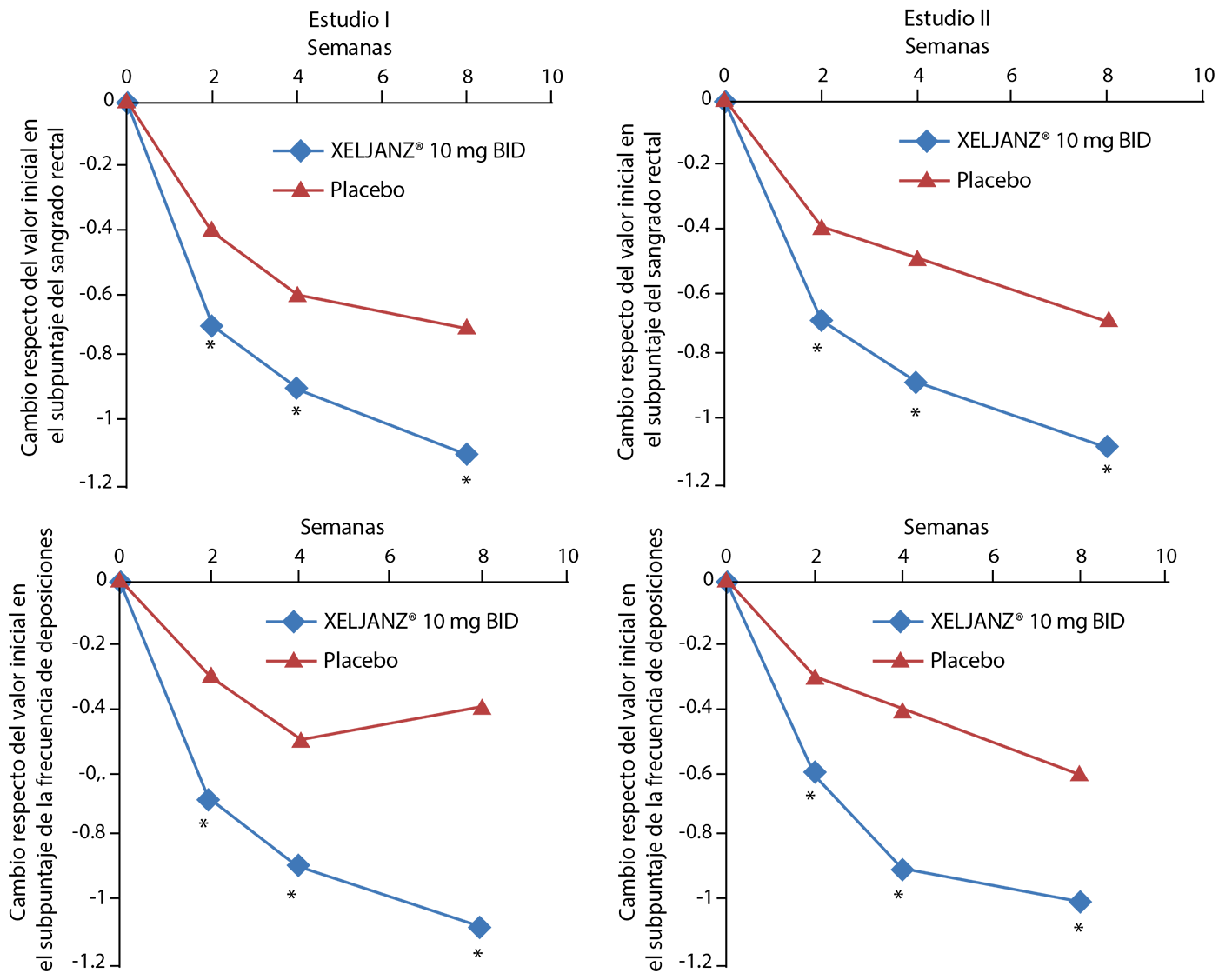
BID = dos veces al día
*p < 0.001 para XELJANZ® 10 mg dos veces al día en comparación con el placebo
Los cambios respecto del valor inicial en el puntaje mayo parcial de los datos combinados del estudio UC-I y el estudio UC-II se muestran en la Figura 5. Se observaron mejorías significativas respecto del valor inicial en el puntaje mayo parcial en los pacientes tratados con XELJANZ® 10 mg dos veces al día en comparación con el placebo en cada visita del estudio. Las diferencias en el puntaje mayo parcial entre el tratamiento con XELJANZ® 10 mg dos veces al día y el tratamiento con placebo fueron significativas incluso en la semana 2, similar al sangrado rectal y la frecuencia de las deposiciones que se observaron en los estudios de inducción individuales.
Figura 5. Cambio respecto del valor inicial en el puntaje mayo parcial (datos combinados del estudio UC-I y el estudio UC-II)
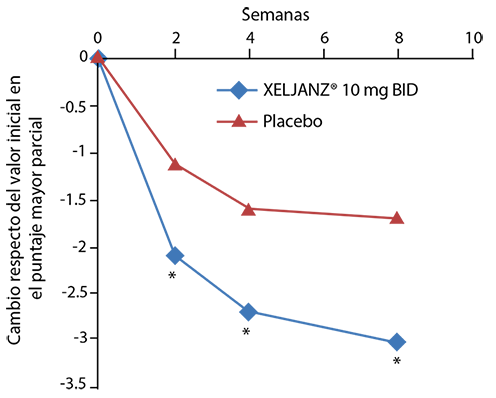
Estudio de mantenimiento (estudio UC-III): Un total de 593 pacientes que completaron 8 semanas en 1 de los estudios de inducción y alcanzaron una respuesta clínica ingresaron en el estudio UC-III; 179 (30.2%) pacientes estaban en remisión en el periodo inicial del estudio UC-III. Se realeatorizó a los pacientes al tratamiento con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día o placebo durante 52 semanas, con una proporción 1:1:1 para la asignación a los tratamientos. La reducción de los corticosteroides era obligatoria para los pacientes que hubieran estado recibiéndolos en el periodo inicial.
En el periodo inicial del estudio UC-III, 289 (48.7%) pacientes estaban en tratamiento con corticosteroides orales; 265 (44.7%), 445 (75.0%) y 413 (69.6%) pacientes habían fracasado anteriormente, o habían sido intolerantes al tratamiento con inhibidores del TNF, corticosteroides e inmunosupresores, respectivamente.
El criterio primario de valoración en el estudio UC-III era la proporción de pacientes que estuvieran en remisión en la semana 52. Había 2 criterios secundarios clave de valoración: la proporción de pacientes con mejoría del aspecto endoscópico en la semana 52 y la proporción de pacientes con remisión sostenida libre de corticosteroides tanto en la semana 24 como en la semana 52 entre los pacientes que hubieran estado en remisión en el periodo inicial del estudio UC-III.
Los resultados de eficacia del estudio UC-III basados en los resultados de la endoscopía leídos de forma centralizada se resumen en la Tabla 11. Una proporción significativamente mayor de pacientes tanto en el grupo de tratamiento con XELJANZ® 5 mg dos veces al día como en el grupo de tratamiento con XELJANZ® 10 mg dos veces al día alcanzó los siguientes criterios de valoración en la semana 52 en comparación con el placebo: remisión, mejoría del aspecto endoscópico de la mucosa, normalización del aspecto endoscópico de la mucosa, mantenimiento de la respuesta clínica, remisión entre los pacientes que hubieran estado en remisión en el periodo inicial y remisión sostenida libre de corticosteroides tanto en la semana 24 como en la semana 52 entre los pacientes que hubieran estado en remisión en el periodo inicial
Tabla 11. Proporción de pacientes que cumplieron los criterios de valoración de la eficacia en el estudio de mantenimiento UC-III (lectura centralizada de la endoscopía)
|
Diferencia entre los tratamientos y placebo (IC del 95%) |
|||||
|
Criterio de valoración |
Placebo |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
XELJANZ® 5 mg al día |
XELJANZ® 10 mg |
|
N = 198 |
N = 198 |
N = 197 |
|||
|
Remisión en la semana 52a |
11.1% |
34.3% |
40.6% |
23.2%* (15.3, 31.2) |
29.5%* (21.4, 37.6) |
|
Mejoría del aspecto endoscópico de la mucosa en la semana 52b |
13.1% |
37.4% |
45.7% |
24.2%* (16.0, 32.5) |
32.6%* (24.2, 41.0) |
|
Normalización del aspecto endoscópico de la mucosa en la semana 52c |
4.0% |
14.6% |
16.8% |
10.6%** (5.0, 16.2) |
12.7%* (6.8, 18.6) |
|
Mantenimiento de la respuesta clínica en la semana 52d |
20.2% |
51.5% |
61.9% |
31.3%* (22.4, 40.2) |
41.7%* (32.9, 50.5) |
|
Remisión en la semana 52 entre los pacientes que estuvieron en remisión en el periodo iniciala,f |
10.2% |
46.2% |
56.4% |
36.0%* (21.6, 50.3) |
46.2%* (31.0, 61.4) |
|
Remisión sostenida libre de corticosteroides tanto en la semana 24 como en la semana 52 entre los pacientes que estuvieron en remisión en el periodo iniciale,f |
5.1% |
35.4% |
47.3% |
30.3%* (17.4, 43.2) |
42.2%* (27.9, 56.5) |
|
N = 101 |
N = 101 |
N = 87 |
|||
|
Remisión libre de corticosteroides en la semana 52 entre los pacientes que se trataron con corticosteroides en el periodo inicial |
10.9% |
27.7% |
27.6% |
16.8% (6.2, 27.5) |
16.7% (5.5, 27.9) |
* p < 0.0001.
** p < 0.001, para XELJANZ® frente al placebo.
IC = Intervalo de confianza; N = cantidad de pacientes en el conjunto de análisis.
a La remisión se definió como la remisión clínica (un puntaje mayo ≤ 2 sin ningún subpuntaje individual > 1) y un subpuntaje de 0 para el sangrado rectal.
b La mejoría del aspecto endoscópico de la mucosa se definió como un subpuntaje mayo endoscópico de 0 (normal o enfermedad inactiva) o 1 (eritema, disminución del patrón vascular).
c La normalización del aspecto endoscópico de la mucosa se definió como un subpuntaje mayo endoscópico de 0.
d El mantenimiento de la respuesta clínica se definió con base en una disminución ≥ 3 puntos y ≥3 0% respecto del puntaje mayo inicial en el estudio de inducción (UC-I, UC-II), junto con una disminución ≥ 1 punto en el subpuntaje del sangrado rectal, o un subpuntaje de sangrado rectal de 0 o 1. Los pacientes debían tener una respuesta clínica en el periodo inicial del estudio de mantenimiento UC-III.
e La remisión sostenida libre de corticosteroides se definió como estar en remisión y no tomar corticosteroides por al menos 4 semanas antes de la visita de la semana 24 y la de la semana 52.
f N = 59 para el placebo, N = 65 para XELJANZ® 5 mg dos veces al día, N = 55 para XELJANZ® 10 mg dos veces al día.
En ambos subgrupos de pacientes con o sin fracaso anterior en el tratamiento con inhibidores del TNF, una mayor proporción de pacientes tratados con XELJANZ® 5 mg dos veces al día o XELJANZ® 10 mg dos veces al día alcanzó los siguientes criterios de valoración en la semana 52 del estudio UC-III, en comparación con los pacientes que recibieron placebo: remisión, mejoría del aspecto endoscópico de la mucosa o remisión sostenida libre de corticosteroides tanto en la semana 24 como en la semana 52 entre los pacientes que hubieran estado en remisión en el periodo inicial (Tabla 12). Esta diferencia entre los tratamientos y el placebo fue similar entre XELJANZ® 5 mg dos veces al día y XELJANZ® 10 mg dos veces al día en el subgrupo de pacientes sin fracaso anterior en el tratamiento con inhibidores del TNF. En el subgrupo de pacientes con fracaso anterior en el tratamiento con inhibidores del TNF, la diferencia observada entre los tratamientos respecto del placebo fue numéricamente superior para XELJANZ® 10 mg dos veces al día que para XELJANZ® 5 mg dos veces al día por 9.7 a 16.7 puntos porcentuales en los criterios primarios y los criterios secundarios clave de valoración.
Tabla 12. Proporción de pacientes que cumplieron los criterios primarios y secundarios clave de valoración de la eficacia en el estudio de mantenimiento UC-III por subgrupo de tratamiento con inhibidores del TNF (lectura centralizada de la endoscopía)
|
Diferencia entre los Tratamientos y el Placebo (IC del 95%) |
|||||
|
Criterio de valoración |
Placebo |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
XELJANZ® 5 mg |
XELJANZ® 10 mg |
|
N = 198 |
N = 198 |
N = 197 |
|||
|
Remisión en la semana 52a |
|||||
|
Con fracaso anterior en el tratamiento con inhibidores del TNF |
10/89 (11.2%) |
20/83 (24.1%) |
34/93 (36.6%) |
12.9% (1.6, 24.2) |
25.3% (13.5, 37.1) |
|
Sin fracaso anterior en el tratamiento con inhibidores del TNFb |
12/109 (11.0%) |
48/115 (41.7%) |
46/104 (44.2%) |
30.7% (20.0, 41.5) |
33.2% (22.0, 44.4) |
|
Mejoría del aspecto endoscópico de la mucosa en la semana 52c |
|||||
|
Con fracaso anterior en el tratamiento con inhibidores del TNF |
11/89 (12.4%) |
25/83 (30.1%) |
37/93 (39.8%) |
17.8% (5.8, 29.8) |
27.4% (15.4, 39.5) |
|
Sin fracaso anterior en el tratamiento con inhibidores del TNFb |
15/109 (13.8%) |
49/115 (42.6%) |
53/104 (51.0%) |
28.8% (17.7, 40.0) |
37.2% (25.6, 48.8) |
|
Remisión sostenida libre de corticosteroides tanto en la semana 24 como en la semana 52 entre los pacientes que estuvieron en remisión en el periodo iniciald |
|||||
|
Con fracaso anterior en el tratamiento con inhibidores del TNF |
1/21 (4.8%) |
4/18 (22.2%) |
7/18 (38.9%) |
17.5% (-3.8, 38.7) |
34.1% (9.8, 58.4) |
|
Sin fracaso anterior en el tratamiento con inhibidores del TNFb |
2/38 (5.3%) |
19/47 (40.4%) |
19/37 (51.4%) |
35.2% (19.4, 50.9) |
46.1% (28.5, 63.7) |
IC = intervalo de confianza; N = cantidad de pacientes en el conjunto de análisis; TNF = factor de necrosis tumoral.
a La remisión se definió como la remisión clínica (un puntaje mayo ≤ 2 sin subpuntajes individuales > 1) y un subpuntaje de 0 para el sangrado rectal.
b Incluidos los pacientes que no se trataron con inhibidores del TNF.
c La mejoría del aspecto endoscópico de la mucosa se definió como un subpuntaje mayo endoscópico de 0 (normal o enfermedad inactiva) o 1 (eritema, disminución del patrón vascular).
d La remisión sostenida libre de corticosteroides se definió como estar en remisión y no tomar corticosteroides durante al menos 4 semanas antes de la visita de la semana 24 y la de la semana 52.
La proporción de pacientes que cumplieron los criterios para el fracaso del tratamiento con el paso del tiempo en el estudio de mantenimiento UC-III se muestra en la Figura 6. El fracaso del tratamiento se definió como un aumento de al menos 3 puntos en el puntaje mayo respecto del valor inicial del estudio de mantenimiento, junto con un aumento de al menos 1 punto en el subpuntaje del sangrado rectal y un aumento de al menos 1 punto en el subpuntaje endoscópico que produzca un subpuntaje endoscópico absoluto de al menos 2 luego de un tratamiento de al menos 8 semanas en el estudio. Se utilizó el subpuntaje endoscópico leído de forma centralizada para determinar el fracaso del tratamiento.
La proporción de pacientes en ambos grupos con XELJANZ® en quienes fracasó el tratamiento fue menor que la del grupo con placebo en cada punto temporal, incluso desde la semana 8, el primer punto temporal en el que se evaluó el fracaso del tratamiento.
Figura 6. Tiempo hasta el fracaso del tratamiento en el estudio de mantenimiento UC-III (curvas de Kaplan-Meier)
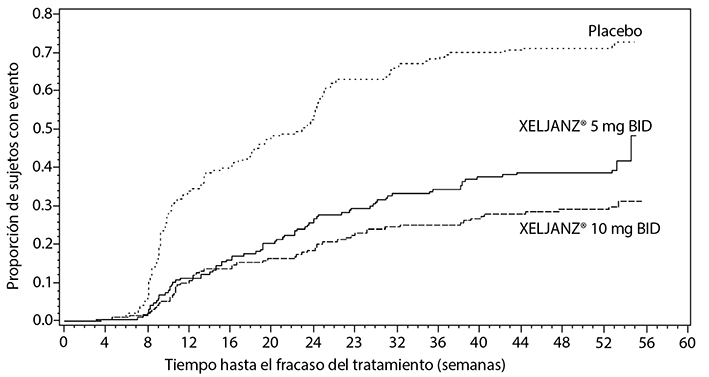
BID=dos veces al día
p<0.0001 para XELJANZ® 5 mg dos veces al día frente al placebo
p<0.0001 para XELJANZ® 10 mg dos veces al día frente al placebo
Otros resultados relacionados con la salud: El estado general de salud se evaluó mediante el Formulario Corto de la encuesta del estado de salud (SF-36). En el estudio de inducción UC-I y el estudio de inducción UC-II, los pacientes que recibieron XELJANZ® 10 mg dos veces al día mostraron una mayor mejoría respecto del valor inicial en comparación con los que recibieron placebo en los puntajes del resumen del componente físico (PCS) y el resumen del componente mental (MCS), y en los 8 dominios del SF-36. En el estudio de mantenimiento UC-III, los pacientes que recibieron XELJANZ® 5 mg dos veces al día o XELJANZ® 10 mg dos veces al día mostraron un mayor mantenimiento de la mejoría en comparación con los pacientes que recibieron placebo en los puntajes del PCS y el MCS, y en los 8 dominios del SF-36, en la semana 24 y la semana 52.
El estado de salud relacionado específicamente con la enfermedad se evaluó mediante el Cuestionario de la Enfermedad Inflamatoria Intestinal (IBDQ, por sus siglas en inglés) en pacientes con colitis ulcerosa. En el estudio de Inducción UC-I y el estudio de inducción UC-II, los pacientes que recibieron XELJANZ® 10 mg dos veces al día mostraron una mayor mejoría respecto del valor inicial en comparación con los que recibieron placebo en el puntaje total y los puntajes de los 4 dominios del IBDQ en la Semana 8. En el estudio de mantenimiento UC-III, los pacientes que recibieron XELJANZ® 5 mg dos veces al día o XELJANZ® 10 mg dos veces al día mostraron un mayor mantenimiento de la mejoría en comparación con los que recibieron placebo en el puntaje total y en los puntajes de los 4 dominios del IBDQ en la semana 24 y la semana 52.
Las utilidades del estado de salud se evaluaron mediante el cuestionario EuroQoL de 5 Dimensiones (EQ-5D) en pacientes con colitis ulcerosa. En el estudio de inducción UC-I, los pacientes que recibieron XELJANZ® 10 mg dos veces al día mostraron una mayor mejoría respecto del valor inicial en comparación con los que recibieron placebo en el puntaje de utilidad en la semana 8; en el estudio de inducción UC-II, los pacientes que recibieron XELJANZ® 10 mg dos veces al día no demostraron una mayor mejoría respecto del valor inicial en comparación con los que recibieron placebo en el puntaje de utilidad en la semana 8. En el estudio de mantenimiento UC-III, los pacientes que recibieron XELJANZ® 5 mg dos veces al día o XELJANZ® 10 mg dos veces al día mostraron un mayor mantenimiento de la mejoría respecto del valor inicial en comparación con el placebo en los puntajes de las utilidades del estado de salud del EQ-5D en la semana 24 y la semana 52.
Se evaluó el Deterioro de la Productividad y la Actividad Laboral (WPAI, por sus siglas en inglés) mediante el cuestionario de WPAI para la colitis ulcerosa (WPAI-CU) en los pacientes con colitis ulcerosa. En el estudio de inducción UC-I, los pacientes que recibieron XELJANZ® 10 mg dos veces al día mostraron una mayor mejoría respecto del valor inicial en comparación con los que recibieron placebo en el presentismo, la pérdida de productividad laboral y los dominios relacionados con el deterioro de las actividades no laborales, pero no en el dominio del absentismo en la Semana 8; en el estudio de inducción UC-II, los pacientes que recibieron XELJANZ® 10 mg dos veces al día mostraron una mayor mejoría respecto del valor inicial en comparación con los que recibieron placebo en el dominio relacionado con el deterioro de la actividad no laboral, pero no en los dominios del absentismo, el presentismo o la pérdida de productividad laboral, en la semana 8. En el estudio de mantenimiento UC-III, los pacientes que recibieron XELJANZ® 5 mg dos veces al día o XELJANZ® 10 mg dos veces al día mostraron un mayor mantenimiento de la mejoría respecto del valor inicial en comparación con los que recibieron placebo en los puntajes del dominio del presentismo y el dominio del deterioro de las actividades no laborales, pero no en los dominios del absentismo y la pérdida de productividad laboral en la semana 52.
Estudio abierto de extensión (estudio UC-IV): En el estudio UC-IV, se inscribió a un total de 944 pacientes y se asignaron al tratamiento con XELJANZ® 5 mg dos veces al día (para los pacientes que hubieran estado en remisión en el periodo inicial del estudio UC-IV) o XELJANZ® 10 mg dos veces al día (para todos los demás pacientes que ingresaron en el estudio UC-IV).
Entre los pacientes que participaron en el estudio UC-IV, 295 recibieron XELJANZ® 10 mg dos veces al día y no alcanzaron una respuesta clínica en 1 de los estudios de inducción (estudio UC-I o estudio UC-II) y luego siguieron recibiendo XELJANZ® 10 mg dos veces al día en el estudio UC-IV. Luego de 8 semanas adicionales de tratamiento con XELJANZ® 10 mg dos veces al día (16 semanas en total), 154/293 (52.6%) pacientes alcanzaron una respuesta clínica y 42/293 (14.3%) pacientes alcanzaron la remisión.
Además, 58 pacientes recibieron XELJANZ® 10 mg dos veces al día en el estudio UC-I o el estudio UC-II y alcanzaron una respuesta clínica, se les redujo la dosis a XELJANZ® 5 mg dos veces al día en el estudio UC-III, sufrieron un fracaso del tratamiento, y luego se les aumentó la dosis a XELJANZ® 10 mg dos veces al día en el estudio UC-IV. Luego de 2 meses de tratamiento con XELJANZ® 10 mg dos veces al día en el estudio UC-IV, se alcanzó la remisión y la cura de las mucosas en 20/58 (34.5%) y 24/58 (41.4%) pacientes, respectivamente. En el mes 12 en el estudio UC-IV, 25/48 (52.1%) y 29/48 (60.4%) de estos pacientes alcanzaron la remisión y la cura de las mucosas, respectivamente. Asimismo, hubo 65 pacientes que se inscribieron por al menos 1 año antes de la fecha de corte de los datos, de 08 de julio de 2016, en el estudio UC-IV, luego de haber alcanzado la remisión en el final del estudio UC-III durante el tratamiento con XELJANZ® 5 mg dos veces al día o XELJANZ® 10 mg dos veces al día. En el mes 12 del estudio UC-IV, 48/65 (73.8%) de estos pacientes permanecieron en remisión mientras recibían XELJANZ® 5 mg dos veces al día.
Artritis idiopática juvenil de curso poliarticular: El programa de desarrollo clínico del tofacitinib para la AIJcp se diseñó para evaluar la seguridad y la eficacia de tofacitinib 5 mg tabletas recubiertas dos veces al día o tofacitinib solución oral con dosis equivalente basada en el peso dos veces al día, para pacientes de 2 años a < 18 años. Se incluyó en el estudio a pacientes con AIJcp (poliartritis con factor reumatoide positivo o negativo, oligoartritis extendida o AIJ sistémica con artritis activa y sin síntomas sistémicos actuales), artritis psoriásica (AP) juvenil y artritis relacionada con entesitis (ARE). Se asignaron al azar 142 pacientes con AIJcp, 15 con AP juvenil y 16 con ARE en la fase doble ciego del estudio. Se permitió que los pacientes recibieran MTX, pero no era necesario. El programa de Fase 3 constó de un ensayo de Fase 3 completado (estudio pcJIA-I [A3921104]) y un ensayo de extensión a largo plazo (LTE, por sus siglas en inglés) (A3921145), en curso.
Todos los pacientes elegibles en el estudio pcJIA-I recibieron tofacitinib 5 mg tabletas recubiertas dos veces al día o tofacitinib solución oral con dosis equivalente basada en el peso dos veces al día, de manera abierta, durante 18 semanas (fase de preinclusión); los pacientes que alcanzaron al menos una respuesta ACR30 de AIJ al final de la fase abierta, se aleatorizaron (1:1) a tofacitinib 5 mg tabletas recubiertas o tofacitinib solución oral o al placebo en la fase doble ciego y controlada con placebo de 26 semanas. Se interrumpió la participación en el estudio a los pacientes que no alcanzaron una respuesta ACR30 de AIJ al final de la fase de preinclusión abierta o que presentaron un único episodio de exacerbación de la enfermedad en cualquier momento. Un total de 225 pacientes se inscribieron en la fase de preinclusión abierta. De éstos, 173 (76.9%) pacientes fueron elegibles para ser aleatorizados en la fase doble ciego, ya sea a tofacitinib 5 mg tabletas recubiertas o tofacitinib solución oral con dosis equivalente basada en el peso dos veces al día (n = 88), o al placebo (n = 85).
Signos y síntomas: Una proporción significativamente menor de pacientes en el estudio pcJIA-I tratados con tofacitinib 5 mg tabletas recubiertas dos veces al día o tofacitinib solución oral con dosis equivalente basada en el peso dos veces al día presentó exacerbación en la semana 44, en comparación con los pacientes tratados con el placebo. Una proporción significativamente mayor de pacientes tratados con tofacitinib 5 mg tabletas recubiertas o tofacitinib solución oral alcanzó respuestas ACR30, 50 y 70 de AIJ, en comparación con los pacientes tratados con el placebo en la semana 44 (Tabla 13).
La incidencia de exacerbación de la enfermedad y las tasas de respuesta ACR30, 50 y 70 de AIJ para los pacientes con AP juvenil y ARE fueron coherentes con aquellas de los resultados generales de AIJcp.
La incidencia de exacerbación de la enfermedad y el porcentaje de pacientes con respuesta ACR50 de AIJ en la fase doble ciego del estudio pcJIA-I se muestran en las Figuras 7 y 8, respectivamente. La incidencia de exacerbación de la enfermedad con el paso del tiempo fue significativamente menor para tofacitinib 5 mg tabletas recubiertas dos veces al día o tofacitinib solución oral con dosis equivalente basada en el peso dos veces al día, en comparación con el placebo a partir de la semana 24 y continuando hasta la semana 44. Las respuestas ACR50 de AIJ con el paso del tiempo fueron significativamente mayores para tofacitinib 5 mg tabletas recubiertas o tofacitinib solución oral, en comparación con el placebo a partir de la semana 24 y hasta la semana 44.
En el estudio pcJIA-I, el cambio medio de los mínimos cuadrados (LS, por sus siglas en inglés) respecto del periodo inicial (semana 18) en el Puntaje de Actividad de la Enfermedad para la Artritis Juvenil en 27 articulaciones con proteína C reactiva (JADAS-27 con PCR) fue significativamente menor a partir de la semana 20 y hasta la semana 44 (Tabla 13) con tofacitinib 5 mg tabletas recubiertas dos veces al día o tofacitinib solución oral con dosis equivalente basada en el peso dos veces al día, en comparación con el placebo (Figura 9).
En el estudio pcJIA-I en la semana 2 de la fase de preinclusión abierta, la respuesta ACR30 de AIJ fue del 45.11% y el cambio medio (error estándar) respecto del periodo inicial de preinclusión abierto en el puntaje JADAS-27 con PCR fue de –6.35 (0.40).
Tabla 13: Criterios primarios y secundarios de valoración de la eficacia en la semana 44* del estudio pcJIA-I
|
Criterio primario de valoración (error de Tipo I controlado) |
Grupo de tratamiento |
Tasa de incidencia |
Diferencia (%) con respecto al placebo (IC del 95%) |
Valor p |
|
Incidencia de exacerbación de la enfermedad |
Tofacitinib 5 mg dos veces al día (N = 72) |
29% |
–23.7 (–39.4, –8.0) |
0.0031 |
|
Placebo (N = 70) |
53% |
|||
|
ACR30 de AIJ |
Tofacitinib 5 mg dos veces al día (N = 72) |
71% |
23.7 (8.0, 39.4) |
0.0031 |
|
Placebo (N = 70) |
47% |
|||
|
ACR50 de AIJ |
Tofacitinib 5 mg dos veces al día (N = 72) |
67% |
19.5 (3.6, 35.5) |
0.0166 |
|
Placebo (N = 70) |
47% |
|||
|
ACR70 de AIJ |
Tofacitinib 5 mg dos veces al día (N = 72) |
54% |
17.0 (0.9, 33.2) |
0.0387 |
|
Placebo (N = 70) |
37% |
|||
|
Criterio secundario de valoración (error de Tipo I controlado) |
Grupo de tratamiento |
Media de LS (SEM) |
Diferencia respecto del placebo (IC del 95%) |
Valor p |
|
Cambio respecto del periodo inicial doble ciego en el Índice de Discapacidad del CHAQ |
Tofacitinib 5 mg dos veces al día (N = 72; n = 49) |
–0.09 (0.04) |
–0.12 (–0.22, –0.01) |
0.0292 |
|
Placebo (N = 70; n = 33) |
0.03 (0.04) |
|||
|
Criterio de valoración secundario |
Grupo de tratamiento |
Media de LS (SEM) |
Diferencia respecto del placebo (IC del 95%) |
Valor p |
|
Cambio respecto del periodo inicial doble ciego en el Puntaje JADAS-27 con PCR |
Tofacitinib 5 mg dos veces al día (N = 72; n = 49) |
0.03 (0.91) |
–4.36 (–7.02, –1.71) |
0.0027 |
|
Placebo (N = 70; n = 32) |
4.39 (1.00) |
ACR = Colegio Americano de Reumatología; CHAQ = cuestionario de evaluación de salud infantil; IC = intervalo de confianza; PCR = proteína C reactiva; JADAS-27 con PCR = puntaje de actividad de la enfermedad para la artritis juvenil en 27 articulaciones con proteína C reactiva; LS = mínimos cuadrados; n = cantidad de pacientes con observaciones en la visita; N = cantidad total de pacientes; AIJcp = artritis idiopática juvenil de curso poliarticular; SEM = error estándar de la media
* La fase doble ciego de 26 semanas va desde la semana 18 hasta la semana 44, en y después del día de la aleatorización.
Los criterios de valoración controlados por error de Tipo I se analizan en este orden: exacerbación de la enfermedad, ACR50 de AIJ, ACR30 de AIJ, ACR70 de AIJ, índice de discapacidad del CHAQ.
En la Figura 7, se muestra la incidencia de exacerbación de la enfermedad por visita en el estudio pcJIA-I.
Figura 7: incidencia de exacerbación de la enfermedad por visita en la fase doble ciego en el estudio pcJIA-I
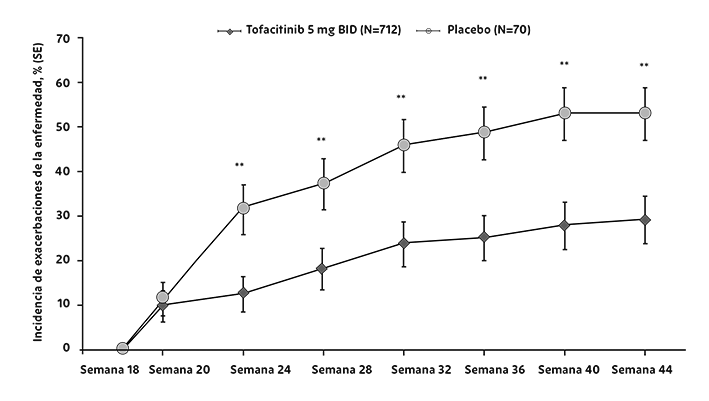
En la Figura 8, se muestran las tasas de respuesta ACR50 por visita para el estudio pcJIA-I.
Figura 8: respuesta ACR50 por visita en la fase doble ciego en el estudio pcJIA-I
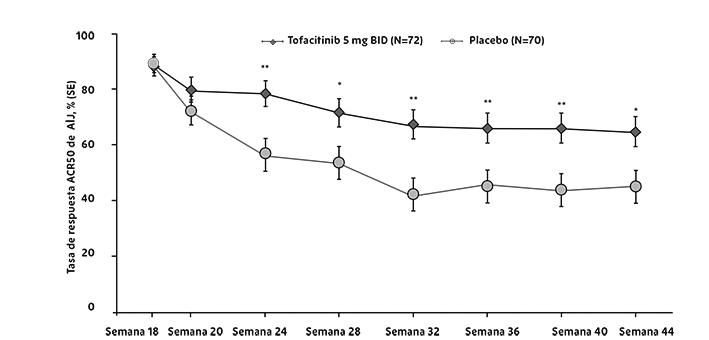
ACR = Colegio Americano de Reumatología; BID = dos veces al día; SE = error estándar; N = cantidad total de pacientes; AIJcp = artritis idiopática juvenil de curso poliarticular
*p < 0.05; **p < 0.01 que compara tofacitinib 5 mg BID con el placebo
La fase doble ciego de 26 semanas va desde la semana 18 hasta la semana 44, en y después del día de la aleatorización. La respuesta se calcula en relación con el periodo inicial abierto.
En la Figura 9, se muestra el cambio medio de los LS respecto del periodo inicial doble ciego en el JADAS-27 con PCR para el estudio pcJIA-I.
Figura 9. cambio medio de los LS respecto del periodo inicial doble ciego en el puntaje JADAS-27 con PCR (MMRM) en la Fase doble ciego en el estudio pcJIA-I
Abreviaturas: BID = dos veces al día; PCR = proteína C reactiva; DB = doble ciego; JADAS-27 con PCR = puntaje de actividad de la artritis juvenil en 27 articulaciones con proteína C reactiva; LS = mínimos cuadrados; MMRM = modelo mixto de mediciones repetidas; pcJIA-I = artritis idiopática juvenil de curso poliarticular.
Cantidad de sujetos = cantidad de sujetos con observaciones en la visita.
La fase doble ciego de 26 semanas va desde la semana 18 hasta la semana 44, en y después del día de la aleatorización. Las barras de error representan el error estándar de la media.
En la fase doble ciego, cada uno de los componentes de la respuesta ACR de AIJ mostró una mejoría mayor desde el periodo inicial abierto (día 1) hasta la semana 44 en los pacientes tratados con tofacitinib solución oral en dosis de 5 mg dos veces al día o la dosis equivalente basada en el peso dos veces al día, en comparación con aquellos que recibieron el placebo en el estudio pcJIA-I (Tabla 14).
Tabla 14: Cambio respecto del periodo inicial de preinclusión abierto en los componentes de la respuesta ACR de AIJ:
semana 24, semana 36 y semana 44* en el estudio pcJIA-I
|
Tofacitinib 5 mg |
Placebo |
Tofacitinib-Placebo |
|||
|---|---|---|---|---|---|
|
Visita del componente ACR de AIJ |
n |
Media de LS (SEM) |
n |
Media de LS (SEM) |
Diferencia (IC del 95%) |
|
Recuento de articulaciones con artritis activa Periodo inicial, media (SE) ∆ Semana 24 ∆ Semana 36 ∆ Semana 44 |
72 66 55 49 |
12.8 (7.25) –9.99 (0.80) –10.08 (0.97) –10.56 (0.62) |
70 60 37 33 |
11.9 (8.12) –8.31 (0.82) –5.79 (1.04) –8.67 (0.64) |
-- –1.67 (–3.79, 0.45) –4.28 (–7.09, –1.49) –1.88 (–3.51, –0.26) |
|
Articulaciones con recuento de rango limitado del movimiento Periodo inicial, media (SE) ∆ Semana 24 ∆ Semana 36 ∆ Semana 44 |
72 66 55 49 |
8.8 (7.98) –5.23 (0.40) –5.27 (0.41) –5.20 (0.42) |
70 60 37 33 |
6.3 (5.14) –4.45 (0.40) –4.16 (0.43) –4.24 (0.45) |
-- –0.78 (–1.74, 0.18) –1.11 (–2.15, –0.07) –0.96 (–2.04, 0.12) |
|
Evaluación global por parte del médicoa Periodo inicial, media (SE) ∆ Semana 24 ∆ Semana 36 ∆ Semana 44 |
72 66 55 49 |
6.2 (1.89) –4.11 (0.26) –4.24 (0.28) –4.49 (0.29) |
70 60 37 33 |
6.3 (1.83) –3.54 (0.27) –3.20 (0.31) –3.47 (0.33) |
-- –0.57 (–1.21, 0.07) –1.04 (–1.77, –0.31) –1.02 (–1.81, –0.23) |
|
Bienestar general del CHAQb Periodo inicial, media (SE) ∆ Semana 24 ∆ Semana 36 ∆ Semana 44 |
72 66 55 49 |
4.6 (2.54) –2.72 (0.27) –2.91 (0.26) –3.20 (0.26) |
70 59 37 33 |
4.9 (2.63) –1.92 (0.28) –2.51 (0.28) –2.61 (0.27) |
-- –0.81 (–1.48, –0.14) –0.40 (–1.04, 0.25) –0.59 (–1.22, 0.04) |
|
Índice de discapacidad del CHAQc Periodo inicial, media (SE) ∆ Semana 24 ∆ Semana 36 ∆ Semana 44 |
72 66 55 49 |
0.9 (0.73) –0.43 (0.06) –0.47 (0.06) –0.53 (0.06) |
70 60 37 33 |
1.0 (0.76) –0.38 (0.06) –0.39 (0.07) –0.43 (0.06) |
-- –0.05 (–0.19, 0.09) –0.09 (–0.24, 0.06) –0.10 (–0.23, 0.04) |
|
ESR (mm/h) Periodo inicial, media (SE) ∆ Semana 24 ∆ Semana 36 ∆ Semana 44 |
72 66 55 49 |
26.1 (23.43) –9.85 (1.61) –7.71 (1.99) –8.81 (1.71) |
70 60 37 33 |
25.3 (25.24) –6.30 (1.66) –6.60 (2.22) –6.95 (1.88) |
-- –3.55 (–7.38, 0.28) –1.11 (–6.49, 4.28) –1.86 (–6.26, 2.54) |
ACR = Colegio americano de reumatología; CHAQ = cuestionario de evaluación de salud infantil; IC = intervalo de confianza; ESR = tasa de sedimentación eritrocítica; AIJ = artritis idiopática juvenil; LS = mínimos cuadrados; n = cantidad de pacientes con observaciones en la visita; pcJIA-I = AIJ de curso poliarticular; SE = error estándar; SEM = error estándar de la media;
∆ = cambio
Evaluación global por parte del médico: escala de 0 a 10 (en incrementos de 0.5), donde los números más altos indican una mayor actividad general de la enfermedad.
Bienestar General del Cuestionario de Evaluación de Salud Infantil (CHAQ): escala de 0 a 10, donde los números más altos indican un peor bienestar general.
Índice de Discapacidad del Cuestionario de Evaluación de la Salud Infantil (CHAQ): escala de 0 a 3, donde los números más altos indican una mayor discapacidad.
* La fase doble ciego de 26 semanas va desde la semana 18 hasta la semana 44, en y después del día de la aleatorización.
Función física y calidad de vida relacionada con la salud: Los cambios en la función física en el estudio pcJIA-I se midieron mediante el Índice de Discapacidad del CHAQ. El cambio medio respecto del periodo inicial doble ciego en el Índice de Discapacidad del CHAQ fue significativamente menor en tofacitinib 5 mg tabletas recubiertas dos veces al día o tofacitinib solución oral con dosis equivalente basada en el peso dos veces al día, en comparación con el placebo, en la semana 44 (Tabla 13).
En la Figura 10, se muestra el cambio medio de los LS respecto del periodo inicial doble ciego en el Índice de Discapacidad del CHAQ para el estudio pcJIA-I.
Figura 10. Cambio medio de los LS (±SE) respecto del periodo inicial doble ciego en el Índice de Discapacidad del CHAQ (MMRM) en la fase doble ciego en el estudio pcJIA-I
Abreviaturas: CHAQ = Cuestionario de Evaluación de Salud Infantil; PCR = proteína C reactiva; DB = doble ciego; LS = mínimos cuadrados; MMRM = modelo mixto de mediciones repetidas; pcJIA-I = artritis idiopática juvenil de curso poliarticular.
Cantidad de sujetos = cantidad de sujetos con observaciones en la visita.
La fase doble ciego de 26 semanas va desde la semana 18 hasta la semana 44, en y después del día de la aleatorización. Las barras de error representan el error estándar de la media.
CONTRAINDICACIONES:
El tratamiento con XELJANZ® no debe ser iniciado en pacientes con:
• Hipersensibilidad conocida al medicamento o a cualquier excipiente de la fórmula.
• Evidencia clínica o de laboratorio de síndromes de inmunodeficiencia.
• Infecciones activas graves.
• Insuficiencia hepática grave.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: No hay estudios adecuados ni bien controlados sobre el uso de XELJANZ® en mujeres embarazadas. Tofacitinib ha mostrado ser teratogénico en ratas y conejos, y tiene efectos en la fertilidad de ratas hembra, el alumbramiento y el desarrollo peri/postnatal (ver la sección Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre fertilidad). XELJANZ® no debe ser usado durante el embarazo a menos que sea claramente necesario.
Se debe aconsejar a las mujeres con potencial reproductivo sobre la utilización de anticoncepción efectiva durante el tratamiento con XELJANZ® y por al menos 4 semanas después de la última dosis.
Lactancia: Tofacitinib fue secretado en la leche materna de ratas lactantes (ver la sección Precauciones en relación con el efecto de carcinogénesis, mutagénesis, teratogénesis y sobre fertilidad). No se sabe si tofacitinib es secretado en la leche humana. Las mujeres no deben amamantar cuando son tratadas con XELJANZ®.
REACCIONES SECUNDARIAS Y ADVERSAS:
Artritis reumatoide: Los siguientes datos incluyen a 6 estudios multicéntricos, controlados, doble ciego de duración variable entre 6 meses y 24 meses (estudios I-IV, ver la sección Farmacocinética y farmacodinamia). En estos estudios, 3200 pacientes fueron aleatorizados y tratados con XELJANZ® 5 mg dos veces al día (616 pacientes) o 10 mg dos veces al día (642 pacientes) en monoterapia y XELJANZ® 5 mg dos veces al día (973 pacientes) o 10 mg dos veces al día (969 pacientes) en combinación con FARME (incluyendo metotrexato).
Todos los pacientes en estos estudios padecían artritis reumatoide moderada a grave. La edad media de la población del estudio de XELJANZ® fue de 52.1 años y 83.2% fueron mujeres.
La vigilancia de la seguridad en la población de pacientes a largo plazo incluye a todos los pacientes que participaron en un estudio doble ciego controlado (incluyendo estudios de desarrollo temprano) y posteriormente se incluyeron en uno de los dos estudios de seguridad a largo plazo.
Un total de 6194 pacientes (Fase 1, 2, 3 y estudios de extensión a largo plazo) fueron tratados con cualquier dosis de XELJANZ® por una duración media de 3.13 años, con 19405.8 pacientes-año acumulados de exposición total al medicamento con base en más de 8 años de exposición continua a XELJANZ®.
Se incluye también la información de un estudio de gran tamaño (N = 4362), aleatorizado, sobre la seguridad posterior a la autorización (PASS) en pacientes con AR de 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (los factores de riesgo CV se definen como tabaquismo actual, diagnóstico de hipertensión, diabetes mellitus, antecedentes familiares de cardiopatía coronaria prematura, antecedentes de arteriopatía coronaria, incluidos antecedentes de procedimientos de revascularización, bypass arterial coronario con injerto, infarto de miocardio, paro cardiaco, angina inestable, síndrome coronario agudo y presencia de enfermedad extraarticular asociada con la AR, p. ej., nódulos, síndrome de Sjögren, anemia de enfermedad crónica, manifestaciones pulmonares) y con una dosis estable de metotrexato de base. La mayoría (más del 90%) de los pacientes con tofacitinib que eran fumadores actuales o exfumadores tenían una duración de tabaquismo de más de 10 años y una mediana de 35.0 y 39.0 años de tabaquismo, respectivamente.
Se aleatorizó a los pacientes para recibir tofacitinib 10 mg abierto dos veces al día, tofacitinib 5 mg dos veces al día o un inhibidor del TNF (el inhibidor del TNF fue etanercept 50 mg una vez a la semana o adalimumab 40 mg cada dos semanas) en una proporción de 1:1:1. Los criterios coprimarios de valoración son neoplasia maligna adjudicada (excluyendo CPNM) y eventos adversos cardiovasculares importantes (MACE) adjudicados, la incidencia acumulativa y la evaluación estadística de los criterios de valoración tienen enmascaramiento. El estudio fue impulsado por eventos que además requirió el seguimiento por 3 años de mínimo 1500 pacientes. Se interrumpió el tratamiento del estudio de tofacitinib 10 mg dos veces al día y se cambió a los pacientes a 5 mg dos veces al día debido a la señal de dependencia a la dosis de la EP.
Artritis psoriásica: Se estudió XELJANZ® 5 mg dos veces al día y 10 mg dos veces al día en 2 ensayos clínicos de Fase 3 doble ciego en pacientes con artritis psoriásica activa (AP).
El estudio de PsA-I tuvo una duración de 12 meses e incluyó a 422 pacientes que tuvieron una respuesta inadecuada a un FARMEsc y que no se habían tratado previamente con un FARME biológico inhibidor de TNF (TNFi). El estudio de PsA-I incluyó un periodo controlado con placebo de 3 meses y también incluyó adalimumab 40 mg por vía subcutánea una vez cada 2 semanas durante 12 meses. El estudio de PsA-II tuvo una duración de 6 meses e incluyó a 394 pacientes que tuvieron una respuesta inadecuada a por lo menos un TNFi aprobado. El estudio de PsA-II incluyó un periodo controlado con placebo de 3 meses. A todos los pacientes en los ensayos clínicos se les solicitó recibir tratamiento con una dosis estable de un FARMEsc (la mayoría recibió metotrexato [78.2%]). En los ensayos clínicos de Fase 3, se aleatorizó a los pacientes y se trataron con XELJANZ® 5 mg dos veces al día (238 pacientes) o XELJANZ® 10 mg dos veces al día (236 pacientes). La población del estudio aleatorizada y tratada con XELJANZ® (474 pacientes) incluyó a 45 (9.5%) pacientes de 65 años o más y 66 (13.9%) pacientes con diabetes en el periodo inicial.
Se realizó un ensayo clínico adicional, abierto, a largo plazo que incluyó a 680 pacientes con artritis psoriásica que originalmente participaron en uno de los 2 ensayos clínicos doble ciego, controlados. Los pacientes que participaron en este ensayo clínico abierto se trataron inicialmente con XELJANZ® 5 mg dos veces al día. Al inicio del mes 1, se permitió un aumento gradual de la dosis a 10 mg de XELJANZ® dos veces al día a discreción del investigador; también se permitió una reducción posterior de la dosis a 5 mg dos veces al día. Esto limita la interpretación de los datos de seguridad a largo plazo con respecto a la dosis.
De los 783 pacientes (a partir del 10 de mayo de 2016) que recibieron dosis de 5 mg dos veces al día o 10 mg dos veces al día de XELJANZ® en ensayos clínicos de artritis psoriásica, 665 recibieron tratamiento durante 6 meses o más, de los cuales 437 recibieron tratamiento durante un año o más, de los cuales 44 recibieron tratamiento durante 24 meses o más.
Colitis ulcerosa: Los siguientes datos de seguridad se basaron en 4 estudios aleatorios, doble ciego, controlados con placebo: 2 estudios de inducción de Fase 3 de diseño idéntico (UC-I y UC-II), un estudio de mantenimiento de Fase 3 (UC-III) y un estudio de inducción Fase 2 de una dosis (UC-V). Los pacientes con colitis ulcerosa de actividad moderada a grave se inscribieron en los estudios de inducción de Fase 2 y Fase 3. En los estudios de inducción, los pacientes aleatorizados recibieron tratamiento con XELJANZ® 10 mg dos veces al día (938 pacientes combinados) o placebo (282 pacientes combinados) hasta por 8 semanas. Los pacientes que completaron el estudio UC-I o el estudio UC-II y lograron una respuesta clínica ingresaron al estudio UC-III. En el estudio UC-III, los pacientes fueron realeatorizados, de modo que 198 pacientes recibieron XELJANZ® 5 mg dos veces al día, 196 pacientes recibieron XELJANZ® 10 mg dos veces al día, y 198 pacientes recibieron placebo hasta por 52 semanas. Se prohibió el uso concomitante de inmunosupresores o productos biológicos durante estos estudios. Se permitieron dosis estables concomitantes de corticosteroides orales en los estudios de inducción, con disminución gradual de corticosteroides hasta la interrupción obligatoria dentro de las 15 semanas de haber ingresado al estudio de mantenimiento. Además de los estudios de inducción y mantenimiento, la seguridad a largo plazo fue evaluada en un estudio abierto de extensión a largo plazo de etiqueta (estudio UC-IV).
Artritis idiopática juvenil de curso poliarticular: Los siguientes datos de seguridad se basaron en el ensayo clínico doble ciego y controlado con placebo de Fase 3 (estudio pcJIA-I) en un total de 225 pacientes con AIJcp (56 de sexo masculino y 169 de sexo femenino) de 2 a < 18 años, tratados con XELJANZ® en dosis de 5 mg dos veces al día o la dosis equivalente basada en el peso dos veces al día, con o sin MTX concomitante.
Experiencia en ensayos clínicos: Las reacciones adversas graves más comunes en artritis reumatoide, artritis psoriásica y artritis idiopática juvenil de curso poliarticular fueron infecciones graves (ver la sección Precauciones generales).
En estudios de inducción y mantenimiento, en todos los grupos de tratamiento, las categorías más comunes de reacciones adversas graves en pacientes con colitis ulcerosa fueron infecciones y desórdenes intestinales.
Artritis reumatoide: Las reacciones adversas más comúnmente reportadas en artritis reumatoide durante los primeros 3 meses en ensayos clínicos controlados (que se presentaron en ≥ 2% de los pacientes tratados con monoterapia de XELJANZ® o en combinación con FARME) fueron dolor de cabeza, infecciones de vías respiratorias altas, nasofaringitis, hipertensión, náuseas y diarrea.
La proporción de pacientes que abandonaron el tratamiento debido a cualquier reacción adversa durante los primeros 3 meses de los estudios doble ciego con metotrexato o con placebo fue 3.8% para pacientes que tomaron XELJANZ® y 3.2% para pacientes tratados con el placebo. Las reacciones adversas más comunes que resultaron en la suspensión de tofacitinib fueron infecciones. Las infecciones más comunes que resultaron en el abandono de la terapia fueron herpes zóster y neumonía.
Artritis psoriásica: En la artritis psoriásica activa, las reacciones adversas informadas con mayor frecuencia durante las primeras 12 semanas en los ensayos clínicos controlados con placebo (ocurrieron en ≥ 2% de los pacientes tratados con XELJANZ® y al menos 1% más que la tasa observada en pacientes con placebo) fueron bronquitis, diarrea, dispepsia, fatiga, dolor de cabeza, nasofaringitis, faringitis.
La proporción de pacientes que interrumpieron el tratamiento debido a alguna reacción adversa durante las primeras 12 semanas de los estudios doble ciego controlados con placebo fue de 3.2% para pacientes tratados con XELJANZ® y de 2.5% para pacientes tratados con placebo. La infección más común como resultado de la interrupción del tratamiento fue sinusitis.
En general, el perfil de seguridad observado en pacientes con artritis psoriásica activa tratados con XELJANZ® fue coherente con el perfil de seguridad en pacientes con artritis reumatoide.
Colitis Ulcerosa: Las reacciones adversas que ocurrieron en por lo menos el 2% de los pacientes que recibían XELJANZ® 10 mg dos veces al día y por lo menos 1% más grande que las observadas en pacientes recibiendo placebo en los estudios de inducción (estudio UC-I, estudio UC-II y estudio UC-V) fueron: incremento de la creatina fosfocinasa sérica, nasofaringitis, pirexia y dolor de cabeza.
En los estudios de inducción y mantenimiento, en todos los grupos de tratamiento, las categorías más comunes de reacciones adversas graves fueron desordenes gastrointestinales e infecciones, y la reacción adversa más común fue el empeoramiento de la colitis ulcerosa.
En los estudios clínicos controlados para la colitis ulcerosa, 1 caso de cáncer de mama fue reportado en un paciente tratado con placebo y no se observaron casos de neoplasias sólidas o linfomas en los pacientes tratados con XELJANZ®. También se observaron neoplasias en el estudio de extensión a largo plazo en pacientes con colitis ulcerosas tratados con XELJANZ®, incluyendo cánceres sólidos y linfomas.
En los estudios de inducción y mantenimiento, la razón más frecuente para la discontinuación del estudio fue el empeoramiento de la colitis ulcerosa. Excluyendo las discontinuaciones debidas al empeoramiento de la colitis ulcerosa, la proporción de pacientes que discontinuaron el tratamiento debido a las reacciones adversas fue menor del 5% en cualquiera de los grupos de tratamiento de XELJANZ® o placebo en estos estudios.
En general, el perfil de seguridad observado en pacientes con colitis ulcerosas tratados con XELJANZ® fue consistente con el perfil de seguridad de XELJANZ® para las demás indicaciones.
Artritis idiopática juvenil de curso poliarticular: En el estudio pivotal Fase 3 (estudio pcJIA-I [A3921104]), en pacientes con artritis idiopática juvenil de 2 a < 18 años, las reacciones adversas informadas con mayor frecuencia en ≥ 5% de los pacientes tratados con tofacitinib en dosis de 5 mg o la dosis equivalente basada en el peso dos veces al día, fueron infecciones de las vías respiratorias superiores, dolor de cabeza, nasofaringitis, pirexia, náuseas y vómitos.
Las reacciones adversas al medicamento (RAMs) se enumeran en la tabla a continuación se presentan por clase de órgano sistema (SOC, por sus siglas en inglés), se presentan los efectos no deseados en orden decreciente de gravedad.
Tabla 15. Reacciones adversas al medicamento por clasificación de órganos del sistema y proporción de incidencia (%) (AR, AP, CU y AIJcp)a
|
Clasificación por órganos y sistemas |
Reacciones adversas |
Proporción de incidencia en AR (%) |
Proporción de incidencia en AP (%) |
Proporción de incidencia en CU (%) |
Proporción de incidencia en AIJcp (%) |
|---|---|---|---|---|---|
|
Infecciones e infestaciones |
Nasofaringitis |
7.1 |
8.0 |
11.7 |
6.7 |
|
Infección del tracto urinario |
4.9 |
2.6 |
2.8 |
2.2 |
|
|
Bronquitis |
4.4 |
3.6 |
2.8 |
1.3 |
|
|
Herpes zóster |
3.3 |
1.0 |
3.1 |
0.9 |
|
|
Influenza |
2.2 |
1.2 |
2.8 |
4.4 |
|
|
Sinusitis |
2.1 |
2.2 |
2.0 |
3.6 |
|
|
Faringitis |
2.0 |
2.6 |
1.8 |
3.1 |
|
|
Neumonía |
1.4 |
0.6 |
0.3 |
0.9 |
|
|
Infección viral |
0.6 |
0.7 |
0.8 |
2.7 |
|
|
Herpes simple |
0.7 |
0.7 |
0.5 |
1.3 |
|
|
Gastroenteritis viral |
0.2 |
0.6 |
0.8 |
1.3 |
|
|
Celulitis |
0.8 |
0.3 |
- |
- |
|
|
Pielonefritis |
0.2 |
0.1 |
0.3 |
- |
|
|
Diverticulitis |
0.2 |
- |
- |
- |
|
|
Tuberculosis |
0.2 |
|
- |
- |
|
|
Sepsis |
0.09 |
- |
- |
- |
|
|
Artritis bacterianab |
0.07 |
- |
- |
- |
|
|
Meningitis criptocócicac |
- |
- |
- |
- |
|
|
Infección micobacteriana atípicac |
- |
- |
- |
- |
|
|
Infección compleja por Mycobacterium aviumc |
- |
- |
- |
- |
|
|
Tuberculosis de sistema nervioso centralc |
- |
- |
- |
- |
|
|
Encefalitisc |
- |
- |
- |
- |
|
|
Fascitis necrotizantec |
- |
- |
- |
- |
|
|
Bacteriemiac |
- |
- |
- |
- |
|
|
Bacteriemia estafilocócicac |
- |
- |
- |
- |
|
|
Neumonía neumocócicac |
- |
- |
- |
- |
|
|
Urosepsis |
0.02 |
- |
- |
- |
|
|
Tuberculosis diseminada |
0.02 |
- |
- |
- |
|
|
Neumonía por Pneumocystis jirovecii |
0.02 |
|
- |
- |
|
|
Neumonía bacteriana |
0.02 |
- |
- |
- |
|
|
Infección por Cytomegalovirus |
- |
- |
- |
- |
|
|
Neoplasia benigna, maligna y no especificada (incluidos quistes y pólipos) |
Cáncer de piel no melanoma |
0.2 |
0.1 |
0.5 |
- |
|
Trastornos hematológicos y del sistema linfático |
Anemia |
2.7 |
0.7 |
3.1 |
2.7 |
|
Leucopenia |
0.8 |
0.6 |
0.3 |
0.9 |
|
|
Neutropenia |
0.6 |
0.6 |
0.3 |
0.9 |
|
|
Linfopenia |
0.4 |
- |
- |
- |
|
|
Trastornos del sistema inmunológico |
Hipersensibilidad al fármacoe |
0.9 |
0.9 |
1.0 |
0.9 |
|
Trastornos del metabolismo y nutrición |
Hiperlipidemia |
0.8 |
0.6 |
0.8 |
0.4 |
|
Dislipidemia |
1.1 |
0.9 |
0.5 |
0.4 |
|
|
Deshidratación |
0.2 |
0.3 |
- |
- |
|
|
Trastornos psiquiátricos |
Insomnio |
1.0 |
0.7 |
1.0 |
- |
|
Trastornos del sistema nervioso |
Dolor de cabeza |
5.3 |
5.8 |
5.8 |
8.0 |
|
Parestesia |
0.6 |
1.2 |
0.5 |
0.4 |
|
|
Trastornos vasculares |
Hipertensión |
4.7 |
2.6 |
2.0 |
- |
|
Tromboembolismo venosof |
0.3 |
0.1 |
- |
- |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
2.6 |
1.2 |
2.8 |
4.0 |
|
Disnea |
0.7 |
1.0 |
0.5 |
0.4 |
|
|
Congestión nasal |
0.5 |
- |
0.3 |
- |
|
|
Trastornos gastrointestinales |
Diarrea |
4.3 |
4.1 |
3.1 |
2.7 |
|
Náusea |
4.1 |
3.2 |
2.3 |
6.2 |
|
|
Dispepsia |
2.7 |
1.7 |
1.3 |
2.2 |
|
|
Vómito |
2.1 |
0.4 |
2.3 |
5.8 |
|
|
Dolor abdominal |
1.7 |
1.9 |
3.1 |
3.6 |
|
|
Gastritis |
1.8 |
1.2 |
0.3 |
0.9 |
|
|
Trastornos hepatobiliares |
Esteatosis hepática |
0.6 |
0.4 |
- |
- |
|
Trastornos de la piel y del tejido subcutáneo |
Erupción |
1.9 |
1.3 |
4.3 |
1.3 |
|
Acné |
0.7 |
1.1 |
1.5 |
1.7 |
|
|
Prurito |
0.5 |
0.3 |
0.5 |
0.4 |
|
|
Eritema |
0.3 |
0.9 |
- |
- |
|
|
Trastornos musculoesqueléticos y del tejido conectivo |
Artralgia |
2.9 |
1.2 |
8.6 |
3.1 |
|
Inflamación articular |
0.5 |
0.4 |
0.3 |
- |
|
|
Tendinitis |
0.4 |
- |
- |
- |
|
|
Dolor musculoesquelético |
0.8 |
0.6 |
0.8 |
0.4 |
|
|
Trastornos generales y reacciones en el sitio de administración |
Edema periférico |
2.4 |
1.2 |
0.5 |
- |
|
Fatiga |
1.1 |
1.7 |
3.1 |
0.9 |
|
|
Pirexia |
1.4 |
0.6 |
2.3 |
6.2 |
|
|
Investigaciones |
Aumento de creatina fosfocinasa sanguínea |
3.5 |
3.9 |
4.8 |
3.1 |
|
Aumento de peso |
2.2 |
1.2 |
1.8 |
- |
|
|
Aumento de la gama-glutamil transferasa |
1.4 |
1.0 |
1.0 |
1.3 |
|
|
Aumento de colesterol en sangre |
0.7 |
0.3 |
1.0 |
|
|
|
Aumento de lipoproteínas de baja densidad |
0.3 |
- |
0.3 |
- |
|
|
Aumento de enzimas hepáticas |
0.9 |
- |
- |
0.4 |
|
|
Aumento de creatinina en sangre |
0.7 |
0.1 |
- |
- |
|
|
Aumento en las transaminasas |
0.6 |
0.1 |
- |
0.4 |
|
|
Prueba de función hepática anormal |
0.2 |
0.1 |
- |
- |
|
|
Lesión, envenenamiento y complicaciones del procedimiento |
Esguince de ligamento |
0.6 |
0.7 |
0.8 |
1.3 |
|
Contractura muscular |
0.4 |
0.3 |
0.3 |
- |
RAM = reacción adversa al medicamento; CPNM = cáncer de piel no melanoma; AIJcp = artritis idiopática juvenil de curso poliarticular; AP = artritis psoriásica; PT = término preferido; AR = artritis reumatoide; CU = colitis ulcerosa.
a Las frecuencias se basan en datos agrupados de ensayos clínicos aleatorizados de Fase 3 (excluyendo el estudio A3921133).
b La frecuencia de la artritis bacteriana se determina mediante las frecuencias combinadas de los PTs de artritis bacteriana y artritis infecciosa.
c Las RAMs solo se informaron en estudios abiertos de extensión a largo plazo; por lo tanto, se estimó la frecuencia de estas RAMs en los ensayos aleatorizados de Fase 3.
d El CPNM identificado como RAM en 2013; CPNM no es un PT: la frecuencia se determina combinando frecuencias para PTs de cáncer de células basales y cáncer de piel de células escamosas.
e Datos de informes espontáneos (se han observado eventos como angioedema y urticaria). También se observaron algunos eventos en los ensayos clínicos.
f Tromboembolia venosa (p. ej., embolia pulmonar, trombosis venosa profunda, trombosis venosa retinal).
* Para AR y AP, tofacitinib 5 mg (10 mg) BID incluye sujetos que fueron aleatorizados a tofacitinib 5 mg (10 mg) BID y placebo cambiado al grupo de tofacitinib 5 mg (10 mg) BID. Para los que cambiaron de placebo, el recuento de eventos comienza desde el día 1 de la dosis de tofacitinib. Los sujetos que fueron aleatorizados para recibir placebo cambiaron al grupo de tofacitinib 5 mg (10 mg) BID, interrumpieron el estudio durante el periodo de tratamiento con placebo y no recibieron tratamiento con tofacitinib, fueron excluidos del análisis. Para AIJ, el análisis incluye todos los eventos excepto los eventos ocurridos durante la exposición al placebo.
- No se observó ningún evento.
Infecciones Generales:
Artritis reumatoide: En los estudios clínicos controlados de Fase 3 de 6 meses y 24 meses, las tasas de infecciones en el grupo con monoterapia de XELJANZ® de 5 mg dos veces al día (616 pacientes en total) y 10 mg dos veces al día (642 pacientes en total) fueron de 16.2% (100 pacientes) y 17.9% (115 pacientes), respectivamente, en comparación con 18.9% (23 pacientes) en el grupo con placebo (122 pacientes en total). En estudios de 6 meses, 12 meses o 24 meses de duración con antecedentes de FARME, las tasas de infecciones en el grupo con XELJANZ® de 5 mg dos veces al día (973 pacientes en total) y 10 mg dos veces al día (969 pacientes en total) más el FARME fue de 21.3% (207 pacientes) y 21.8% (211 pacientes), respectivamente, comparado con el 18.4% (103 pacientes) en el grupo placebo más FARME (559 pacientes en total).
Las infecciones más comúnmente reportadas fueron infecciones de vías respiratorias altas y nasofaringitis (3.7% y 3.2%, respectivamente).
La tasa global de infecciones con XELJANZ® en la población expuesta (4867 pacientes en total), vigilando la seguridad a largo plazo fue de 46.1 pacientes con eventos por 100 pacientes-año (43.8 y 47.2 pacientes con eventos para 5 mg y 10 mg dos veces al día, respectivamente). Para pacientes con monoterapia (1750 pacientes en total), las tasas fueron de 48.9 y 41.9 pacientes con eventos por 100 pacientes-año para 5 mg y 10 mg dos veces al día, respectivamente. Para pacientes con historial de FARME (3117 en total), las tasas fueron de 41.0 y 50.3 pacientes con eventos por 100 pacientes-año para 5 mg y 10 mg dos veces al día, respectivamente.
También se notificaron infecciones en un PASS aleatorizado de gran tamaño en pacientes con AR de 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia).
Artritis psoriásica: En los estudios controlados de Fase 3 de 6 y hasta 12 meses, la frecuencia de infecciones en los grupos con XELJANZ® 5 mg dos veces al día (238 pacientes) y XELJANZ® 10 mg dos veces al día (236 pacientes) fue de 37.8% y 44.5%, respectivamente. La frecuencia de las infecciones en el periodo controlado con placebo de 3 meses fue de 23.5% para el grupo con XELJANZ® 5 mg dos veces al día (238 pacientes), 28.8% para el grupo con XELJANZ® 10 mg dos veces al día (236 pacientes) y 15.7 para el grupo con placebo (236 pacientes).
Las infecciones informadas con mayor frecuencia en el periodo controlado con placebo de 3 meses fueron nasofaringitis (5.9% y 5.5% en los grupos de dosis de 5 mg dos veces al día y 10 mg dos veces al día, respectivamente) e infecciones de las vías respiratorias superiores (5.0% y 4.7% en los grupos de dosis de 5 mg dos veces al día y 10 mg dos veces al día, respectivamente).
A partir de mayo de 2016, la tasa general de infecciones con XELJANZ® en la población de seguridad a largo plazo para dosis combinadas fue de 63.5 pacientes con eventos por cada 100 pacientes-año.
Colitis ulcerosa: En los estudios de inducción aleatorizados Fase 2/3 de 8 semanas, las proporciones de pacientes con infecciones fueron 21.1% para XELJANZ® 10 mg dos veces al día comparado con 15.2% para el placebo. En el estudio de mantenimiento aleatorizado Fase 3 de 52 semanas, la proporción de pacientes con infecciones fue 35.9% para XELJANZ® 5 mg dos veces al día, 39.8% para XELJANZ® 10 mg dos veces al día y 24.2% para placebo. En la experiencia de tratamiento completo con XELJANZ® en el programa de colitis ulcerosa, la incidencia general de infección fue 65.7 eventos por 100 pacientes-año (involucrando 47.9 de los pacientes). La infección más común fue nasofaringitis, ocurriendo en 16.8% de los pacientes.
Artritis idiopática juvenil de curso poliarticular: En la fase doble ciego del estudio pcJIA-I de Fase 3 fundamental, la reacción adversa informada con mayor frecuencia fue infección, con el 44.3% de los pacientes tratados con el tofacitinib, en comparación con el 30.6% de los pacientes tratados con el placebo. En general, las infecciones fueron de severidad leve a moderada.
Infecciones graves:
Artritis reumatoide: En los estudios clínicos controlados de 6 meses y 24 meses, la tasa de infecciones graves en el grupo con monoterapia de XELJANZ® 5 mg dos veces al día fue de 1.7 pacientes con eventos por cada 100 pacientes-año. En el grupo con monoterapia de XELJANZ® de 10 mg dos veces al día fue de 1.6 pacientes con eventos por cada 100 pacientes-año, la tasa fue de 0 eventos por cada 100 pacientes-año para el grupo con placebo y la tasa fue de 1.9 pacientes con eventos por cada 100 pacientes-año para el grupo de metotrexato.
En estudios de duración de 6, 12 o 24 meses, la tasa de infecciones graves en el grupo con monoterapia de XELJANZ® más FARME 5 mg dos veces al día y 10 mg dos veces al día fueron 3.6 y 3.4 pacientes con eventos por cada 100 pacientes-año, respectivamente, comparado con 1.7 eventos por cada 100 pacientes-año para el grupo con placebo más FARME.
En la población expuesta de seguridad a largo plazo compuesto por ensayos clínicos de Fase 2 y Fase 3 y estudios clínicos de extensión a largo plazo, las tasas globales de infecciones graves fueron de 2.4 y 3.0 pacientes con eventos por 100 pacientes-año para 5 mg y 10 mg dos veces al día de grupos de XELJANZ®, respectivamente. Las infecciones graves más comúnmente reportadas con XELJANZ® incluyen neumonía, herpes zóster, infección de vías urinarias, celulitis, gastroenteritis y diverticulitis. Se han reportado casos de infecciones oportunistas (ver la sección Precauciones generales).
De los 4271 pacientes que se reclutaron en los estudios I a VI, un total de 608 pacientes con artritis reumatoide tenían 65 años y mayores, incluyendo 85 pacientes de 75 años y mayores. La frecuencia de infecciones graves entre los pacientes tratados con XELJANZ® de 65 años y mayores fue mayor que en aquéllos de menos de 65 años. Debido a que hay mayor incidencia de infecciones en pacientes de edad avanzada en general, se debe tener precaución cuando se trate a pacientes de edad avanzada.
Las infecciones graves también se reportaron en un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia).
Artritis psoriásica: En los estudios de Fase 3 de 6 y 12 meses, la tasa de infecciones graves en el grupo con XELJANZ® 5 mg dos veces al día fue de 1.30 pacientes con eventos por cada 100 pacientes-año. En el grupo de XELJANZ® 10 mg dos veces al día, la tasa fue de 2.0 pacientes con eventos por cada 100 pacientes-año.
En la población de seguridad a largo plazo, la tasa de infecciones graves fue de 1.4 pacientes con eventos por cada 100 pacientes-año para pacientes tratados con XELJANZ®. La infección sería más común informada con XELJANZ® fue la neumonía.
Colitis ulcerosa: En los estudios de inducción aleatorios de fase 2/3 de 8 semanas, la proporción de pacientes con infecciones graves en pacientes tratados con XELJANZ® 10 mg dos veces al día fue del 0.9% (8 pacientes) en comparación con el 0.0% en pacientes tratados con placebo. En el estudio de mantenimiento, aleatorizado de 52 semanas Fase 3, las tasas de incidencia de infecciones graves en pacientes tratados con XELJANZ® 5 mg dos veces al día (1.35 eventos por 100 pacientes-año) y en pacientes tratados con XELJANZ® 10 mg dos veces al día (0.64 eventos por 100 pacientes-año) no fueron más altas en comparación con el placebo (1.94 eventos por 100 pacientes-año). La tasa de incidencia de infecciones graves en toda la experiencia de tratamiento con XELJANZ® en pacientes con colitis ulcerosa fue de 2.05 eventos por cada 100 pacientes/año. No hubo agrupación aparente en tipos específicos de infecciones graves.
Artritis idiopática juvenil de curso poliarticular: En el estudio pcJIA-I de Fase 3 fundamental, cuatro pacientes presentaron infecciones graves durante el tratamiento con tofacitinib, lo que representa una tasa de incidencia de 3.25 eventos por cada 100 paciente-año: neumonía, empiema epidural (con sinusitis y absceso subperióstico), quiste pilonidal y apendicitis.
Reactivación viral: En los estudios clínicos de XELJANZ®, los pacientes japoneses y coreanos aparentan presentar una mayor tasa de herpes zóster que aquella observada en otras poblaciones. Se informaron eventos de herpes zóster en un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia).
Tromboembolismo venoso:
Artritis Reumatoide: Se informaron eventos de EP y TVP en un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años o más con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia).
Estudios finalizados de artritis reumatoide: En el periodo de 4 a 12 semanas con placebo de los estudios aleatorizados y controlados de 4 semanas a 24 meses de duración, las IR (IC del 95%) de la EP para tofacitinib 5 mg dos veces al día, tofacitinib 10 mg dos veces al día y placebo fueron de 0.00 (0.00, 0.57), 0.00 (0.00, 0.77) y 0.40 (0.01, 2.22) pacientes con eventos por cada 100 PY, respectivamente; las IR (IC del 95%) de la TVP fueron 0.00 (0.00, 0.57), 0.21 (0.01, 1.16) y 0.40 (0.01, 2.22) pacientes con eventos por cada 100 PY, respectivamente.
En el periodo con aleatorización completa de los estudios controlados de 4 semanas a 24 meses, las IR (IC del 95%) de la EP para tofacitinib 5 mg dos veces al día y tofacitinib 10 mg dos veces al día fueron de 0.12 (0.02, 0.34) y 0.15 (0.03, 0.44) pacientes con eventos por cada 100 PY, respectivamente; las IR (IC del 95%) de la TVP fueron de 0.15 (0.04, 0.40) y 0.10 (0.01, 0.36) pacientes con eventos por cada 100 PY, respectivamente.
En la población de seguridad a largo plazo, que incluye la exposición durante los estudios aleatorizados y controlados finalizados y los estudios de extensión abiertos a largo plazo, las IR (IC del 95%) de la EP para tofacitinib 5 mg dos veces al día y tofacitinib 10 mg dos veces al día fueron de 0.12 (0.06, 0.22) y 0.13 (0.08, 0.21) pacientes con eventos por cada 100 PY, respectivamente; las IR (IC del 95%) de la TVP fueron de 0.17 (0.09, 0.27) y 0.15 (0.09, 0.22) pacientes con eventos por cada 100 PY, respectivamente.
Artritis psoriásica: En el periodo de 3 meses con placebo de los estudios aleatorizados y controlados finalizados de 6 a 12 meses de duración, las IR (IC del 95%) de la EP para tofacitinib 5 mg dos veces al día, tofacitinib 10 mg dos veces al día y placebo fueron de 0.00 (0.00, 6.75), 0.00 (0.00, 6.78) y 0.00 (0.00, 6.87) pacientes con eventos por cada 100 PY, respectivamente; las IR (IC del 95%) de la TVP fueron de 0.00 (0.00, 6.75), 0.00 (0.00, 6.78) y 0.00 (0.00, 6.87) pacientes con eventos por cada 100 PY, respectivamente.
En el periodo con aleatorización completa de los estudios controlados de 6 a 12 meses finalizados, las IR (IC del 95%) de la EP para tofacitinib 5 mg dos veces al día y tofacitinib 10 mg dos veces al día fueron de 0.00 (0.00, 1.83) y 0.00 (0.00, 1.87) pacientes con eventos por cada 100 PY, respectivamente; las IR (IC del 95%) de la TVP fueron de 0.00 (0.00, 1.83) y 0.51 (0.01, 2.83) pacientes por cada 100 PY, respectivamente.
En la población de seguridad a largo plazo, que incluye la exposición durante los estudios aleatorizados y controlados finalizados y el estudio de extensión abierto a largo plazo en curso, las IR (IC del 95%) de la EP para tofacitinib 5 mg dos veces al día y tofacitinib 10 mg dos veces al día fueron de 0.11 (0.00, 0.60) y 0.00 (0.00, 0.58) pacientes por cada 100 PY, respectivamente; las IR (IC del 95%) de la TVP fueron de 0.00 (0.00, 0.40) y 0.16 (0.00, 0.87) pacientes por cada 100 PY, respectivamente.
Colitis ulcerosa: En los estudios de inducción aleatorizados y controlados con placebo de 8 semanas de duración finalizados, las IR (IC del 95%) de la EP para tofacitinib 10 mg dos veces al día y placebo fueron de 0.00 (0.00, 2.22) y 1.98 (0.05, 11.04) pacientes por cada 100 PY; las IR (IC del 95%) de la TVP fueron de 0.00 (0.00, 2.22) y 1.99 (0.05, 11.07) pacientes por cada 100 PY, respectivamente.
En el estudio de mantenimiento aleatorizado finalizado de 52 semanas de duración, las IR (IC del 95%) de la EP para tofacitinib 5 mg dos veces al día y tofacitinib 10 mg dos veces al día fueron de 0.00 (0.00, 2.48) y 0.00 (0.00, 2.35) pacientes por cada 100 PY, respectivamente; las IR (IC del 95%) de la TVP fueron de 0.00 (0.00, 2.48) y 0.00 (0.00, 2.35) pacientes por cada 100 PY, respectivamente.
En la población de seguridad a largo plazo, que incluye la exposición durante los estudios aleatorizados y controlados finalizados y el estudio de extensión abierto a largo plazo en curso, las IR (IC del 95%) de la EP para tofacitinib 5 mg dos veces al día y tofacitinib 10 mg dos veces al día fueron de 0.00 (0.00, 0.54) y 0.20 (0.05, 0.52) pacientes por cada 100 PY, respectivamente, las IR (IC del 95%) de la TVP fueron de 0.00 (0.00, 0.54) y 0.05 (0.00, 0.28) pacientes por cada 100 PY, respectivamente.
Experiencia clínica en pacientes con artritis reumatoide no tratados previamente con metotrexato: El estudio VI fue un estudio clínico controlado por principio activo en pacientes con AR no tratados previamente con metotrexato (ver la sección Farmacocinética y farmacodinamia). La experiencia en seguridad en estos pacientes fue consistente con los estudios I-V.
Pruebas de laboratorio: En los ensayos clínicos en artritis psoriásica, colitis ulcerosa y artritis idiopática juvenil de curso poliarticular, los cambios en los linfocitos, neutrófilos y lípidos observados con el tratamiento con XELJANZ® fueron similares a los cambios observados en los ensayos clínicos en artritis reumatoide.
En los ensayos clínicos en artritis psoriásica, colitis ulcerosa y artritis idiopática juvenil de curso poliarticular, los cambios en las pruebas de enzimas hepáticas observados con el tratamiento de XELJANZ® fueron similares a los cambios observados en los ensayos clínicos en artritis reumatoide donde los pacientes recibieron FARME de fondo.
Artritis reumatoide:
Linfocitos: En los estudios clínicos controlados, en artritis reumatoide, la disminución confirmada en conteo de linfocitos < 500 células/mm3 se presentó en 0.23% de los pacientes tratados con 5 mg dos veces al día y 10 mg dos veces al día combinados.
En la población de seguridad a largo plazo, en artritis reumatoide, la disminución confirmada en el conteo de linfocitos < 500 células/mm3 se presentó en 1.3% de los pacientes tratados con 5 mg dos veces al día y 10 mg dos veces al día combinados.
El conteo de linfocitos confirmados < 500 células/mm3 se asociaron con incremento en la incidencia de infecciones tratadas y graves (ver la sección Precauciones generales).
Neutrófilos: En los estudios clínicos controlados, en artritis reumatoide, ocurrieron disminuciones confirmadas en el Recuento Absoluto de Neutrófilos (ANC, por sus siglas en inglés) por debajo de 1000 células/mm3 en 0.08% de los pacientes para las dosis combinadas de 5 mg dos veces al día y 10 mg dos veces al día. No se observaron disminuciones confirmadas en el ANC por debajo de 500 células/mm3 en ningún grupo de tratamiento. No hubo relación clara entre la neutropenia y la presencia de infecciones graves.
En la población vigilada para seguridad a largo plazo, el patrón y la incidencia de las disminuciones confirmadas en el ANC fueron consistentes con lo observado en los estudios clínicos controlados (ver la sección Precauciones generales).
Pruebas de enzimas hepáticas:
Artritis reumatoide: Los incrementos confirmados en las enzimas hepáticas > 3 veces el ULN (3x ULN) no se observaron frecuentemente. En pacientes que experimentaron elevación de enzimas hepáticas, la modificación del régimen de tratamiento, como la reducción de la dosis del FARME concomitante, la interrupción de XELJANZ® o reducción de la dosis de XELJANZ®, demostró reducción o normalización de las enzimas hepáticas.
En la porción controlada del estudio de monoterapia Fase 3 (0-3 meses), (estudio I, ver la sección Farmacocinética y farmacodinamia) se observaron elevaciones de TGP >3x ULN en el 1.65%, 0.41% y 0% de los pacientes que recibieron placebo, XELJANZ® 5 mg y 10 mg dos veces al día, respectivamente. En este estudio, se observaron elevaciones de TGO >3x ULN en el 1.65%, 0.41% y 0% de los pacientes que recibieron placebo, XELJANZ® 5 mg y 10 mg dos veces al día, respectivamente.
En el estudio de monoterapia Fase 3 (0-24 meses) (estudio VI, ver Sección Farmacocinética y farmacodinamia) se observaron elevaciones de TGP >3x ULN en el 7.1%, 3.0% y 3.0% de los pacientes que recibieron metotrexato, XELJANZ® 5 mg, y 10 mg dos veces al día, respectivamente. En este estudio las elevaciones de TGO >3x ULN se observaron en el 3.3%, 1.6% y 1.5% de los pacientes que recibieron metotrexato, XELJANZ® 5 mg y 10 mg dos veces al día, respectivamente.
En la porción controlada de los estudios Fase 3 con historial de FARME (0-3 meses) (estudio II-V, ver sección Farmacocinética y farmacodinamia), se observaron elevaciones de TGP > 3x ULN en el 0.9% 1.24% y 1.14% de los pacientes que recibieron placebo, XELJANZ® 5 mg y 10 mg dos veces al día, respectivamente. En este estudio, se observaron elevaciones de TGO > 3x ULN en el 0.72%, 0.50% y 0.31% de los pacientes que recibieron placebo, XELJANZ® 5 mg y 10 mg dos veces al día, respectivamente.
Se informaron elevaciones de TGP y TGO en un PASS aleatorizado de gran tamaño en pacientes con AR de 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia).
Lípidos: Los incrementos en el perfil lipídico (colesterol total, colesterol LDL, colesterol HDL, triglicéridos) fueron valorados por primera vez un mes después del inicio de XELJANZ® en ensayos clínicos controlados doble ciego de artritis reumatoide. Los incrementos se observaron en este punto de corte y se mantuvieron estables posteriormente.
Artritis reumatoide: Los cambios en los parámetros de lípidos a partir del inicio hasta el final del estudio (6-24 meses) en los estudios clínicos en artritis reumatoide controlados se resumen a continuación:
• La media del colesterol LDL incrementó 15% en el grupo de XELJANZ® 5 mg dos veces al día y 20% en el grupo de XELJANZ® de 10 mg dos veces al día a los 12 meses, e incrementó 16% en el grupo de XELJANZ® de 5 mg dos veces al día y 19% en el grupo de XELJANZ® de 10 mg dos veces al día a los 24 meses.
• La media del colesterol HDL incrementó 17% en el grupo de XELJANZ® 5 mg dos veces al día y 18% en el grupo de XELJANZ® de 10 mg dos veces al día a los 12 meses, e incrementó 19% en el grupo de XELJANZ® de 5 mg dos veces al día y 20% en el grupo de XELJANZ® de 10 mg dos veces al día a los 24 meses.
Se notificaron elevaciones del colesterol LDL y del colesterol HDL en un PASS aleatorizado de gran tamaño en pacientes con AR de 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia).
Al momento del abandono del tratamiento con tofacitinib, los niveles de lípidos volvieron al valor inicial.
En artritis reumatoide, las proporciones medias de colesterol LDL/HDL y las proporciones de apolipoproteína B (ApoB)/ApoA1 se mantuvieron esencialmente sin cambios en los pacientes tratados con XELJANZ®.
En un estudio clínico controlado, los incrementos del colesterol LDL y de la ApoB descendieron a niveles pretratamiento en respuesta a la terapia con estatinas.
En la vigilancia de población de seguridad a largo plazo, los incrementos en el perfil lipídico fueron consistentes con lo que se observó en los estudios clínicos controlados.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
En estudios no clínicos, se observaron efectos en los sistemas inmune y hematopoyético que fueron atribuidos a las propiedades farmacológicas (inhibición de JAK) de tofacitinib. Los efectos secundarios de la inmunosupresión, tales como las infecciones bacterianas, virales y linfoma se observaron con dosis clínicamente relevantes. Otros hallazgos a dosis superiores a la empleada en humanos incluyeron efectos a nivel del hígado, pulmones y sistema gastrointestinal.
Se observaron linfomas en 3 de 8 monos adultos y en 0 de 14 monos jóvenes a los que se les administró tofacitinib a 5 mg/kg dos veces al día. El nivel de efecto adverso no observado (NOAEL, por sus siglas en inglés) para los linfomas fue 1 mg/kg dos veces al día. El ABC no unida con 1 mg/kg dos veces al día fue de 341 ng• h/mL, lo cual es aproximadamente la mitad del ABC no unida con 10 mg 2 veces al día y similar al ABC no unida con 5 mg dos veces al día en humanos.
Tofacitinib no es mutagénico o genotóxico con base en los resultados de una serie de pruebas in vitro e in vivo para mutaciones genéticas y aberraciones cromosómicas.
El potencial carcinogénico de tofacitinib fue medido en estudios de carcinogenicidad de 6 meses con ratones transgénicos rasH2 y de 2 años con ratas. Tofacitinib no fue carcinogénico en los ratones con dosis altas de hasta 200 mg/kg/día (ABC del fármaco libre de ~19 veces el ABC humano con 10 mg dos veces al día). Se observaron tumores benignos en las células de Leydig en ratas: los tumores benignos en las células de Leydig no están asociados con un riesgo de tumores en las células de Leydig en humanos. Se observaron hibernomas (neoplasia maligna del tejido adiposo pardo) en ratas hembra a dosis ≥ 30 mg/kg/día (ABC del fármaco libre de ~41 veces el ABC humana con 10 mg dos veces al día). Se observaron timomas benignos en ratas hembra que recibieron solo la dosis de 100 reducida a 75 mg/kg/día (ABC del fármaco libre de ~94 veces el ABC humana con 10 mg dos veces al día).
Se demostró que tofacitinib es teratogénico en ratas y conejos y tiene efectos sobre la fertilidad, el trabajo de parto, y el desarrollo peri/postnatal de ratas hembra. Tofacitinib no tiene efectos sobre la fertilidad de los machos, la motilidad de los espermatozoides o la concentración del esperma. Tofacitinib fue secretado en la leche de ratas lactantes. En estudios realizados en ratas y monos jóvenes, los efectos relacionaos con tofacitinib en el sistema inmunitario fueron similares a los de los animales adultos. No hubo efectos relacionados con el tofacitinib en el sistema reproductivo o el desarrollo óseo en machos y hembras.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Interacciones que afectan el uso de XELJANZ®: Debido a que tofacitinib es metabolizado por CYP3A4, la interacción con medicamentos que inhiben o inducen el CYP3A4 es probable. La exposición a tofacitinib se incrementa cuando se coadministra con inhibidores potentes del citocromo P450 CYP3A4 (por ejemplo, ketoconazol) o cuando la administración de uno o más medicamentos concomitantes resulta tanto en inhibición moderada de CYP3A4 e inhibición importante de CYP2C19 (por ejemplo, fluconazol) (ver la sección Dosis y vía de administración).
La exposición a tofacitinib se disminuye cuando se coadministra con inductores potentes de CYP (por ejemplo, rifampicina). Los inhibidores de CYP2C19 solos o de la glucoproteína P no parecen alterar la PK de tofacitinib significativamente.
La administración concomitante con metotrexato (15 a 25 mg de MTX una vez a la semana) no tuvo efecto sobre la farmacocinética de tofacitinib. La coadministración de ketoconazol, un inhibidor potente de CYP3A4, con una sola dosis de tofacitinib incrementó el ABC y la Cmáx en 103% y 16%, respectivamente. La coadministración de fluconazol, un inhibidor moderado de CYP3A4 y un inhibidor potente de CYP2C19, incrementó el ABC y la Cmáx en 79% y 27%, respectivamente.
La coadministración de tacrolimus (Tac), un inhibidor leve del CYP3A4, incrementó el ABC de tofacitinib 21% y disminuyó la Cmáx de tofacitinib en 9%. La coadministración de ciclosporina (CsA), un inhibidor moderado de CYP3A4, incrementó el ABC de tofacitinib en 73% y disminuyó la Cmáx de tofacitinib en 17%. El uso combinado de múltiples dosis de tofacitinib con estos inmunosupresores potentes no ha sido estudiado en pacientes con artritis reumatoide, artritis psoriásica, colitis ulcerosa o artritis idiopática juvenil de curso poliarticular. La coadministración de rifampicina, un inductor potente de CYP3A4, disminuyó el ABC y la Cmáx de tofacitinib en 84% y 74%, respectivamente (ver la sección Dosis y vía de administración).
Potencial de XELJANZ® para influenciar la farmacocinética de otros medicamentos: Estudios in vitro indican que tofacitinib no inhibe o induce significativamente la actividad de los principales citocromos humanos metabolizantes de fármacos (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 y CYP3A4) a concentraciones que exceden 80 veces el total de la Cmáx en estado estacionario de una dosis de 5 mg y 10 mg dos veces al día en pacientes con artritis reumatoide, artritis psoriásica, colitis ulcerosa y artritis idiopática juvenil de curso poliarticular. Estos resultados in vitro fueron confirmados por un estudio de interacciones farmacológicas en humanos, sin mostrar cambios en la PK del midazolam, un sustrato muy sensible del CYP3A4, cuando lo coadministraron con tofacitinib.
Los estudios in vitro indican que tofacitinib no inhibe de manera significativa la actividad de la mayoría de los medicamentos metabolizadores de uridina 5’-difosfo-glucuronosiltransferasas (UGT), (UGT1A1, UGT1A4, UGT1A6, UGT1A9, y UGT2B7) en concentraciones que excedieran 250 veces el total de la Cmáx en estado estacionario de una dosis de 5 mg y 10 mg dos veces al día en pacientes con artritis reumatoide, artritis psoriásica, colitis ulcerosa y artritis idiopática juvenil de curso poliarticular.
Los datos in vitro indican que el potencial de tofacitinib para inhibir transportadores como la glucoproteína P, el polipéptido transportador de aniones orgánicos, transportadores orgánicos catiónicos o aniónicos a concentraciones terapéuticas es bajo.
La coadministración de tofacitinib no tuvo efecto en la PK de los anticonceptivos orales levonorgestrel y etinilestradiol en voluntarias sanas.
La coadministración de tofacitinib con metotrexato 15 a 25 mg una vez a la semana disminuyó el ABC y la Cmáx de metotrexato en 10% y 13%, respectivamente. La extensión de la disminución en la exposición a metotrexato no garantiza modificaciones a la dosificación individualizada de metotrexato.
La coadministración de XELJANZ® no tuvo un efecto en la PK de metformina, lo que indica que Tofacitinib no interfiere con los transportadores de cationes orgánicos (OCT2, por sus siglas en inglés) en voluntarios sanos.
En pacientes con artritis reumatoide, artritis psoriásica, colitis ulcerosa y artritis idiopática juvenil de curso poliarticular, la depuración oral de tofacitinib no varía con el tiempo indicando que tofacitinib no normaliza la actividad enzimática de CYP en estos pacientes. Por ello, no se espera que la coadministración con tofacitinib cause incrementos clínicamente relevantes en el metabolismo de los sustratos de CYP en pacientes con artritis reumatoide, artritis psoriásica, colitis ulcerosa y artritis idiopática juvenil de curso poliarticular.
Población pediátrica: Los estudios de interacción fármaco-fármaco solo se han realizado solo en adultos.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Parámetros de laboratorio:
Linfocitos: El conteo de linfocitos < 500 células/mm3 estuvo asociado con incremento en la incidencia de infecciones tratadas y graves. No se recomienda iniciar el tratamiento con XELJANZ® en pacientes con un conteo bajo de linfocitos (por ejemplo, < 500 células/mm3). XELJANZ® no está recomendado en pacientes que desarrollaron una cuenta absoluta confirmada de linfocitos de <500 células/mm3. Los linfocitos deben ser monitoreados antes de iniciar el tratamiento y posteriormente cada 3 meses. Para modificaciones, basarse en el conteo de linfocitos (ver la sección Dosis y vía de administración).
Neutrófilos: El tratamiento con XELJANZ® se asoció a una mayor incidencia de neutropenia (< 2000 células/mm3), en comparación con el placebo. No se recomienda iniciar el tratamiento con XELJANZ® en pacientes con un conteo de neutrófilos bajo (es decir, ANC < 1000 células/mm3). Para pacientes que tomen XELJANZ® 10 mg dos veces al día y que desarrollen un ANC persistente de 500-1000 células/mm3, reducir la dosis de XELJANZ® a 5 mg dos veces al día hasta que ANC sea > 1000 células/mm3. Para pacientes que toman XELJANZ® 5 mg dos veces al día que desarrollen un ANC persistente de 500-1000 células/mm3 se debe interrumpir el tratamiento hasta que el ANC sea > 1000/mm3, En pacientes que desarrollen un conteo confirmado absoluto de neutrófilos de < 500 células/mm3 no se recomienda el tratamiento con XELJANZ®. Los neutrófilos deben monitorearse desde el inicio y después de 4 a 8 semanas de tratamiento; posteriormente se recomienda determinarlos cada 3 meses (ver las secciones Dosis y vía de administración y Reacciones secundarias y adversas).
Hemoglobina: No se recomienda iniciar el tratamiento de XELJANZ® en pacientes con valores de hemoglobina bajos (es decir, < 9 g/dL). El tratamiento con XELJANZ® debe interrumpirse en pacientes que desarrollen valores de hemoglobina de < 8 g/dL o cuyo nivel de hemoglobina disminuya a > 2 g/dL en el tratamiento. La hemoglobina debe ser monitoreada a partir del inicio del tratamiento, a las 4 a 8 semanas de tratamiento y posteriormente cada 3 meses (ver las secciones Dosis y vía de administración y Reacciones secundarias y adversas).
Lípidos: El tratamiento con XELJANZ® estuvo asociado con aumento en el perfil de lípidos como; colesterol total, lipoproteínas de baja densidad (LDL) y lipoproteínas de alta densidad (HDL). Los efectos máximos fueron observados a las 6 semanas. También se informaron aumentos de colesterol total, colesterol LDL y colesterol HDL en un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia).
La determinación del perfil de lípidos debe realizarse aproximadamente a las 4 a 8 semanas después de iniciar el tratamiento con XELJANZ®. Los pacientes deben ser manejados de acuerdo con los lineamientos clínicos (por ejemplo, Programa Nacional Educacional del Colesterol) para el manejo de la hiperlipidemia. Los incrementos en el colesterol total y LDL asociados con XELJANZ® se pueden disminuir a niveles pretratamiento con terapia de estatinas.
PRECAUCIONES GENERALES:
Infecciones graves: Infecciones graves y en ocasiones fatales debido a bacterias, micobacterias, hongos invasivos, virus y otros patógenos oportunistas han sido reportadas en pacientes que reciben agentes inmunomoduladores, incluyendo FARME biológicos y XELJANZ®. Las infecciones graves más comúnmente reportadas con XELJANZ® incluyen neumonía, infección de vías urinarias, celulitis, herpes zóster, bronquitis, choque séptico, diverticulitis, gastroenteritis, apendicitis y sepsis. Entre las infecciones oportunistas: tuberculosis y otras infecciones por micobacterias, criptococos, histoplasmosis, candidiasis esofágica, herpes zóster multidermatomal, infecciones por citomegalovirus, infecciones por virus BK y listeriosis fueron reportadas con XELJANZ®. Algunos pacientes se presentaron con enfermedad diseminada más que localizada, y pacientes con artritis reumatoide a menudo recibían tratamiento concomitante con agentes inmunomoduladores como metotrexato o corticosteroides los cuales, además de la artritis reumatoide, pueden predisponerlos a infecciones. Otras infecciones graves que no fueron reportadas en los estudios clínicos pueden ocurrir también (por ejemplo, coccidioidomicosis).
En un estudio PASS aleatorizado y de gran tamaño realizado en pacientes con AR de 50 años y mayores con al menos un factor de riesgo cardiovascular (CV) adicional, se observó un aumento dependiente de la dosis de infecciones graves en pacientes tratados con tofacitinib en comparación con inhibidores del TNF (ver la sección Farmacocinética y farmacodinamia). Algunas de estas infecciones graves provocaron la muerte. También se informó de infecciones oportunistas en el estudio.
XELJANZ® no debe iniciarse en pacientes con infección activa, incluyendo infecciones localizadas. Los riesgos y beneficios del tratamiento deben ser considerados antes de iniciar XELJANZ® en pacientes con infecciones crónicas o recurrentes o en aquellos que han sido expuestos a tuberculosis, o con antecedentes de una infección grave u oportunista, o que han residido o viajado a áreas endémicas de tuberculosis o micosis endémicas; o tienen condiciones subyacentes que puedan predisponerlos a una infección.
Los pacientes deben ser vigilados cercanamente por el desarrollo de signos y síntomas de infección durante y después del tratamiento con XELJANZ®. XELJANZ® debe ser interrumpido si el paciente desarrolla infección grave, infección oportunista o septicemia. El paciente que desarrolle una nueva infección durante el tratamiento con XELJANZ® debe someterse a pruebas diagnósticas rápidas y completas adecuadas a un paciente inmunocomprometido, se debe iniciar una terapia antimicrobiana apropiada y el paciente debe ser cuidadosamente vigilado.
Debido a que hay una alta incidencia de infecciones en pacientes de edad avanzada y en la población de pacientes diabéticos en general, se debe proceder con cuidado cuando se trate a personas de edad avanzada y diabéticos (ver la sección Reacciones secundarias y adversas).
Se recomienda precaución también en pacientes con antecedentes de enfermedad pulmonar crónica, ya que podrían ser más proclives a infecciones. Se informaron eventos de enfermedad pulmonar intersticial (algunos con desenlace mortal) en pacientes tratados con XELJANZ®, un inhibidor de la Janus-cinasa (JAK), en ensayos clínicos y en el entorno postcomercialización, aunque el rol de la inhibición de la JAK en estos eventos es desconocido.
El riesgo de infección puede ser mayor con grados crecientes de linfopenia y se debe considerar el recuento de linfocitos en la evaluación del riesgo individual de infección del paciente. El criterio para interrupción y el monitoreo para linfopenia se desarrollan en la sección Dosis y vía de administración.
Tuberculosis: Los pacientes deben ser evaluados en busca de infecciones latentes o activas antes de y por los lineamientos aplicables durante la administración de XELJANZ®.
Los pacientes con tuberculosis latente deben ser tratados con el terapia antimicobacteriana estándar contra la tuberculosis previo a la administración de XELJANZ®.
La terapia antituberculosis también debe ser considerada previa a la administración de XELJANZ® en pacientes con antecedentes de tuberculosis latente o activa en quienes no se pueda confirmar un curso de tratamiento adecuado y pacientes con una prueba negativa de tuberculosis latente pero que tienen factores de riesgo para infección por tuberculosis. Se recomienda consultar con un especialista con experiencia en el tratamiento de tuberculosis para ayudar en la decisión sobre el inicio apropiado de la terapia antituberculosis en cada caso individual.
Los pacientes deben ser vigilados de cerca sobre el desarrollo de signos y síntomas de tuberculosis incluyendo pacientes con resultados negativos para infección latente de tuberculosis antes de iniciar la terapia.
Reactivación viral: Se ha reportado reactivación viral en el tratamiento con FARME. En estudios clínicos con XELJANZ®, se observaron casos de reactivación de virus del herpes (por ejemplo, herpes zóster). En un estudio PASS aleatorizado y de gran tamaño realizado en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional, se observó un aumento en los eventos de herpes zóster en pacientes tratados con tofacitinib en comparación con inhibidores del TNF (ver la sección Farmacocinética y farmacodinamia). Se han notificado casos posteriores a la comercialización de reactivación de hepatitis B en pacientes tratados con XELJANZ®. El impacto de XELJANZ® en la hepatitis viral crónica es desconocido. Los pacientes con resultados positivos para hepatitis B o C fueron excluidos de los ensayos clínicos. Debe llevarse a cabo control para hepatitis viral según los lineamientos clínicos locales antes de comenzar la terapia con tofacitinib.
El riesgo de herpes zóster aparenta ser mayor en pacientes japoneses y coreanos tratados con XELJANZ®.
Tromboembolismo Venoso: Se observó tromboembolismo venoso (VTE) en pacientes que toman XELJANZ® en ensayos clínicos y en informes postcomercialización. En un estudio grande, aleatorizado, PASS en pacientes con AR de 50 años y mayores con al menos un factor de riesgo cardiovascular adicional, los pacientes recibieron tratamiento con tofacitinib 5 mg dos veces al día, tofacitinib 10 mg dos veces al día o un inhibidor del TNF. Se observó un aumento dependiente de la dosis en los eventos de embolia pulmonar (EP) en los pacientes tratados con tofacitinib en comparación con inhibidor del TNF (ver la Sección Farmacocinética y farmacodinamia). Muchos de estos eventos de EP fueron graves y algunos provocaron la muerte. En este estudio, los eventos de EP se informaron con más frecuencia en pacientes que tomaban tofacitinib en relación con otros estudios en todo el programa de tofacitinib (ver las secciones Reacciones secundarias y adversas y Farmacocinética y farmacodinamia).
Se observaron eventos de trombosis venosa profunda (TVP) en los tres grupos de tratamiento en este estudio (ver la sección Farmacocinética y farmacodinamia).
Evalúe a los pacientes para detectar factores de riesgo de VTE antes de comenzar el tratamiento y periódicamente durante el tratamiento. Administre XELJANZ® con precaución en pacientes de 65 años y mayores y en pacientes en quienes se haya identificado factores de riesgo de VTE, (p. ej., antecedentes de trombosis). Evalúe con urgencia a los pacientes con signos y síntomas de VTE e interrumpa el tratamiento con tofacitinib mientras evalúa la sospecha de VTE, independientemente de la dosis o las indicaciones.
Eventos adversos cardiovasculares mayores (incluido el infarto de miocardio): En un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional, los pacientes fueron tratados con tofacitinib 5 mg dos veces al día, tofacitinib 10 mg dos veces al día o un inhibidor del TNF. Se observaron eventos adversos cardiovasculares mayores (MACE), incluidos eventos de infarto de miocardio, en los tres grupos de tratamiento en este estudio. Se observó un aumento de infartos de miocardio no mortales en pacientes tratados con tofacitinib en comparación con inhibidores del TNF (ver la sección Farmacocinética y farmacodinamia). Los MACE, incluidos los eventos de infarto de miocardio, fueron más frecuentes en pacientes de 65 años y mayores y en pacientes que son o fueron, por largo tiempo fumadores, y en pacientes con antecedentes de enfermedad cardiovascular aterosclerótica (ECVA). Se debe tener precaución en el tratamiento de pacientes de 65 años y mayores, pacientes que son o fueron, por largo tiempo fumadores y pacientes con otros factores de riesgo cardiovascular. (p. ej., antecedentes de ECVA). En pacientes con estos factores de riesgo, se debe completar una evaluación individualizada de riesgo-beneficio antes de tomar una decisión sobre el inicio o la continuación del tratamiento (ver la sección Farmacocinética y farmacodinamia).
Tumores malignos y trastorno linfoproliferativo (excluyendo el cáncer de piel no melanoma [CPNM]): Se deben considerar los riesgos y beneficios del tratamiento con XELJANZ® antes de iniciar la terapia en pacientes con antecedentes o actualmente con neoplasias malignas diferentes al cáncer de piel no melanoma (CPNM) tratado con éxito, o cuando se considere la continuación de XELJANZ® en pacientes que desarrollan neoplasias malignas. Existe la posibilidad de que XELJANZ® afecte las defensas del huésped contra neoplasias malignas.
Se observó un aumento de neoplasias malignas en pacientes tratados con tofacitinib en comparación con un inhibidor del TNF en un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia). Las neoplasias malignas excluyendo el CPNM fueron más comunes en pacientes de 65 años y mayores, y en pacientes que eran fumadores, actuales o pasados, desde hace mucho tiempo. Se debe tener precaución al tratar a pacientes de 65 años y mayores, a pacientes, actuales o pasados, fumadores desde hace mucho tiempo, y pacientes con otros factores de riesgo de malignidad (p. ej., malignidad actual o antecedentes de malignidad). En pacientes con estos factores de riesgo, se debe completar una evaluación individualizada de riesgo-beneficio antes de tomar una decisión sobre el inicio o la continuación del tratamiento (ver la sección Farmacocinética y farmacodinamia).
Se han observado linfomas en pacientes tratados con XELJANZ® y en pacientes tratados con XELJANZ® en un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia). Los pacientes con artritis reumatoide, particularmente aquellos con enfermedad altamente activa, y los pacientes con psoriasis pueden tener un riesgo mayor (hasta varias veces más) que la población general para el desarrollo de linfoma. El papel de XELJANZ® en el desarrollo de linfoma es incierto.
Se han observado cánceres de pulmón en pacientes tratados con XELJANZ®. También se observaron cánceres de pulmón en pacientes tratados con XELJANZ® en un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional; se observó un aumento en los pacientes tratados con XELJANZ® 10 mg dos veces al día en comparación con el inhibidor del TNF (ver la sección Farmacocinética y farmacodinamia). De los 30 cánceres de pulmón informados en el estudio en pacientes que tomaban tofacitinib, todos menos 2 fueron en pacientes que son o fueron fumadores. Los pacientes con artritis reumatoide pueden tener un riesgo mayor que la población general de desarrollar cáncer de pulmón. El papel de XELJANZ® en el desarrollo del cáncer de pulmón es incierto.
Se observaron otras neoplasias malignas en estudios clínicos y en el marco posterior a la comercialización, incluyendo, pero no limitado a: cáncer de mama, melanoma, cáncer de próstata y cáncer pancreático.
Se desconoce el papel del tratamiento con XELJANZ® en el desarrollo y la evolución de las neoplasias malignas.
Las recomendaciones para cáncer de piel no melanoma se presentan abajo.
Artritis reumatoide: En estudios clínicos de Fase 3 controlados en pacientes con artritis reumatoide, 26 neoplasias malignas (excluyendo CPNM) incluyendo 5 casos de linfoma fueron diagnosticadas en 26 pacientes que recibieron XELJANZ®/XELJANZ® más FARME, en comparación con 0 neoplasias malignas (excluyendo los CPNM) en pacientes del grupo que recibió placebo/placebo más FARME y 2 en 2 pacientes del grupo que recibió adalimumab y 1 en 1 paciente en el grupo que recibió metotrexato, en el grupo placebo/placebo más FARME ningún paciente las desarrolló. 3800 pacientes (3942 pacientes-año de observación) fueron tratados con XELJANZ® hasta por 2 años mientras que aproximadamente 681 pacientes (203 pacientes-año de observación) fueron tratados con placebo por un máximo de 6 meses y 204 pacientes (179 pacientes-año de observación) fueron tratados con adalimumab por 12 meses. La tasa de incidencia ajustada a la exposición para neoplasias malignas y linfoma fue de 0.66 y 0.13 eventos por cada 100 pacientes-año, respectivamente, en los grupos con XELJANZ®.
En la vigilancia de seguridad a largo plazo (4867 pacientes) en estudios de artritis reumatoide, la tasa de neoplasias malignas (excluyendo CPNM) y linfoma fue 0.97 y 0.09 eventos por 100 pacientes-año, respectivamente, consistente con la tasa observada en el periodo controlado.
En un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional, se observó un aumento de neoplasias malignas (excluyendo CPNM) en pacientes tratados con XELJANZ® en comparación con el inhibidor del TNF (ver la sección Farmacocinética y farmacodinamia). Las neoplasias malignas (excluyendo CPNM) fueron más comunes en pacientes de 65 años y mayores y en pacientes que son o fueron por largo tiempo fumadores.
Artritis psoriásica: En 2 ensayos clínicos controlados de Fase 3 en pacientes con artritis psoriásica, hubo 3 neoplasias malignas (excluyendo CPNM) en 474 pacientes (298 pacientes-año de observación) que recibieron XELJANZ® más FARMEsc (6 a 12 meses de exposición) en comparación a 0 neoplasias en 236 pacientes (52.3 pacientes-año) en el grupo con placebo más FARMEsc (3 meses de exposición) y 0 neoplasias en 106 pacientes (91 pacientes-año) en el grupo con adalimumab más FARMEsc (12 meses de exposición). No se informaron linfomas. La tasa de incidencia ajustada por exposición para neoplasias malignas (excluyendo CPNM) fue de 1.95 pacientes con eventos y 0 pacientes con eventos por cada 100 pacientes-años en los grupos con XELJANZ® que recibieron 5 mg dos veces al día y 10 mg dos veces al día, respectivamente.
En la población de seguridad compuesta de 2 ensayos clínicos controlados en Fase 3 y el ensayo de extensión a largo plazo (783 pacientes), la tasa de neoplasias malignas (excluyendo CPNM) fue de 0.63 pacientes con eventos por cada 100 pacientes-año.
Colitis ulcerosa: En los estudios de inducción y mantenimiento controlados con placebo para la colitis ulcerosa, no hubo neoplasias malignas (excluyendo CPNM) en ningún grupo de XELJANZ®. En toda la experiencia del tratamiento XELJANZ® para la colitis ulcerosa, se notificaron neoplasias malignas (excluyendo CPNM) con una tasa de incidencia general de 0.5 eventos por cada 100 pacientes-año.
Cáncer de piel no melanoma: Se han informado sobre casos de cáncer de piel no melanoma (CPNM) en pacientes tratados con XELJANZ®. También se notificaron CPNM en un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional. En este estudio, se observó un aumento en los CPNM en general, incluidos los carcinomas cutáneos de células escamosas, en pacientes tratados con tofacitinib en comparación con el inhibidor del TNF (ver la sección Farmacocinética y farmacodinamia). Dado que existe una mayor incidencia de CPNM en los pacientes de edad avanzada y en pacientes con antecedentes de CPNM, se debe tener precaución al tratar este tipo de pacientes. Se recomienda un examen periódico de la piel para pacientes que tienen aumento en el riesgo de contraer cáncer de piel (ver la tabla 15 en la sección Reacciones secundarias y adversas).
Perforaciones gastrointestinales: Se han reportado eventos de perforación gastrointestinal en ensayos clínicos incluyendo un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional (ver la sección Farmacocinética y farmacodinamia). A pesar de que el papel de la inhibición de JAK en estos eventos es desconocido. Los eventos fueron reportados principalmente como perforación diverticular, peritonitis, absceso abdominal y apendicitis. En los ensayos clínicos sobre artritis reumatoide la tasa de incidencia de perforación gastrointestinal a lo largo de todos los estudios (Fase 1, Fase 2, Fase 3 y de extensión a largo plazo) para todos los grupos de tratamiento en todas las dosis fue de 0.11 eventos por cada 100 pacientes-año con la terapia con XELJANZ®. Los pacientes con artritis reumatoide que desarrollaron perforaciones gastrointestinales estaban recibiendo antiinflamatorios no esteroideos (AINE) concomitantes y/o corticosteroides. La contribución relativa de estos medicamentos concomitantes en comparación con XELJANZ® sobre el desarrollo de perforaciones gastrointestinales es desconocida. La tasa de incidencia en ensayos clínicos de artritis psoriásica (fase 3 y extensión a largo plazo) fue de 0.13 pacientes con eventos por cada 100 pacientes-año con el tratamiento con XELJANZ®.
En los estudios de inducción controlados con placebo para la colitis ulcerosa, la perforación gastrointestinal (todos los casos) ocurrió en 2 (0.2%) pacientes tratados con XELJANZ® 10 mg dos veces al día y en 2 (0.9%) pacientes que recibieron placebo. En el estudio de mantenimiento de Fase 3 para la colitis ulcerosa, la perforación gastrointestinal (todos los casos) no se informó en pacientes tratados con XELJANZ® y se informó en 1 paciente tratado con placebo.
XELJANZ® debe ser usado con precaución en pacientes que pueden estar en mayor riesgo de perforación gastrointestinal (por ejemplo, pacientes con antecedentes de diverticulitis). Los pacientes que presenten un nuevo inicio de síntomas abdominales deben ser evaluados rápidamente para la identificación temprana de perforación gastrointestinal.
Fracturas: Se han observado fracturas en pacientes tratados con XELJANZ® en estudios clínicos y en el entorno postcomercialización.
En estudios clínicos controlados de fase 3 en pacientes con AR durante la exposición de 0 a 3 meses, las tasas de incidencia de fracturas con XELJANZ® 5 mg dos veces al día, XELJANZ® 10 mg dos veces al día y placebo fueron de 2.11, 2.56 y 4.43 pacientes con eventos por 100 PY, respectivamente.
En un PASS aleatorizado de gran tamaño en pacientes con AR que tenían 50 años y mayores con al menos un factor de riesgo cardiovascular adicional, se observaron fracturas en los grupos de tratamiento con XELJANZ® e inhibidores del TNF (ver la sección Farmacocinética y farmacodinamia).
Se debe tener precaución en pacientes con factores de riesgo conocidos de fracturas, como pacientes de edad avanzada, mujeres y pacientes con uso de corticosteroides.
Hipersensibilidad: Se han observado reacciones como angioedema y urticaria que pueden reflejar hipersensibilidad a medicamentos en pacientes que reciben XELJANZ®. Algunos eventos fueron graves. Muchos de estos eventos ocurrieron en pacientes que tienen antecedentes de alergias múltiples. Si se produce una reacción de hipersensibilidad grave, interrumpa inmediatamente el tofacitinib mientras evalúa la posible causa o las causas de la reacción.
Vacunas: No hay datos disponibles sobre la transmisión secundaria de infección por vacunas con virus vivos a pacientes que reciben XELJANZ®. Se recomienda que las vacunas con virus vivos atenuados no se suministren de forma concurrente con XELJANZ®. Se recomienda que todos los pacientes sean regularizados con todas las inmunizaciones de acuerdo con su protocolo de inmunización antes de iniciar la terapia de XELJANZ®. El intervalo entre la vacunación y el inicio del tratamiento con tofacitinib debe estar en concordancia con los lineamientos actuales de vacunación en relación con los agentes inmunomoduladores. De manera coherente con estos lineamientos, si se administra una vacuna viva de herpes zóster, debe administrarse solamente a pacientes con antecedentes conocidos de varicela o aquellos que resulten seropositivos para el virus de varicela zóster. La vacunación debe ocurrir al menos 2 semanas, pero de preferencia 4 semanas antes del comienzo de la administración de agentes inmunomoduladores como el tofacitinib.
En un ensayo clínico controlado, se evaluó la respuesta humoral a la vacunación concurrente con la vacuna contra la influenza y la vacuna neumocócica polisacárida en pacientes con artritis reumatoide que estaban iniciando la toma de tofacitinib 10 mg o de placebo dos veces al día. Un porcentaje similar de pacientes alcanzó una respuesta humoral satisfactoria a la vacuna contra la influenza (incremento de ≥ 4 veces en ≥ 2 de 3 antígenos) en el grupo de tratamiento con tofacitinib (57%) y en el grupo de placebo (62%). Se observó una reducción modesta en el porcentaje de pacientes que alcanzó una respuesta humoral satisfactoria a la vacuna neumocócica polisacárida (aumento de ≥ 2 veces en ≥ 6 de 12 serotipos) en los pacientes tratados con una monoterapia de tofacitinib (62%) y con una monoterapia de metotrexato (62%) en comparación con los que recibieron placebo (77%). La reducción en la tasa de respuesta fue mayor en los pacientes que recibieron ambos tofacitinib y metotrexato (32%). Se desconoce la importancia clínica de este hallazgo.
En otro estudio de vacunas evaluó la respuesta humoral a la vacunación concurrente con la vacuna contra la influenza y la vacuna neumocócica polisacárida en pacientes que recibieron tofacitinib 10 mg dos veces al día durante una mediana de aproximadamente 22 meses. Más del 60% de los pacientes tratados con tofacitinib (con o sin metotrexato) tuvieron respuestas satisfactorias a la vacuna contra la influenza y a la vacuna neumocócica. De manera coherente con el ensayo controlado, los pacientes que recibieron ambos tofacitinib y MTX tuvieron una tasa de respuesta menor a la vacuna neumocócica polisacárida en comparación con los tratados con una monoterapia de tofacitinib (66% frente a 89%).
Un estudio controlado en pacientes con artritis reumatoide con metotrexato de base evaluó las respuestas humoral y mediada por células a la inmunización con una vacuna de virus vivo atenuado (Zostavax) indicada para la prevención del herpes zóster. La inmunización ocurrió de 2 a 3 semanas antes del comienzo de un tratamiento de 12 semanas con tofacitinib 5 mg dos veces al día o placebo. Seis semanas luego de la inmunización con la vacuna de zóster, los que recibieron tofacitinib y placebo mostraron respuestas humoral y mediada por células similares (cambio de incremento medio de anticuerpos IgG VZV de 2.11 para los que recibieron tofacitinib 5 mg dos veces al día y 1.74 con placebo dos veces al día; incremento de ≥ 1.5 veces en el 57% de los que recibieron tofacitinib y en el 43% de los que recibieron placebo; cambio de incremento medio de células T VZV formadoras de puntos en el ensayo de puntos por inmunoabsorción unida a enzimas (ELISPOT) 1.5 con tofacitinib 5 mg dos veces al día y 1.29 en placebo dos veces al día). Estas respuestas fueron similares a aquellas observadas en voluntarios sanos de 50 años y mayores.
En este estudio un paciente experimentó diseminación de la cepa del virus varicela zóster de la vacuna, 16 días luego de la vacunación. El paciente no había estado expuesto al virus de la varicela anteriormente, como se evidenció por la ausencia de antecedentes de infección por varicela y la ausencia de anticuerpos de varicela en el periodo inicial. Se interrumpió el tratamiento con tofacitinib y el paciente se recuperó luego del tratamiento con dosis estándar de la medicación antiviral. Análisis posteriores mostraron que este paciente produjo células T antivaricela y respuestas de anticuerpos robustas a la vacuna aproximadamente 6 semanas después de la vacunación, pero no a las 2 semanas posteriores a la vacunación, como se esperaba para una infección principal.
Pacientes con insuficiencia renal: No se requiere ajuste de la dosis en pacientes con insuficiencia renal leve o moderada. La dosificación de XELJANZ® no debe exceder 5 mg dos veces al día en pacientes con insuficiencia renal grave. Para recomendaciones sobre ajuste de dosis específicas para cada indicación ver la sección Dosis y vía de administración.
En ensayos clínicos, XELJANZ® no fue evaluado en pacientes con valores basales de depuración de creatinina (estimada por la ecuación de Cockroft-Gault) < 40 mL/min (ver las secciones Dosis y vía de administración y Farmacocinética y farmacodinamia).
Pacientes con insuficiencia hepática: No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve. La dosificación de XELJANZ® no debe exceder 5 mg dos veces al día en pacientes con insuficiencia hepática moderada. Para recomendaciones sobre ajuste de dosis específicas para cada indicación ver la sección Dosis y Vía de administración.
XELJANZ® no se debe utilizar en pacientes con insuficiencia hepática grave (ver la sección Dosis y vía de administración).
En ensayos clínicos, XELJANZ® no fue evaluado en pacientes con insuficiencia hepática grave o en pacientes con serología positiva a VHB o VHC.
Combinación con otras terapias:
Artritis reumatoide: XELJANZ® no ha sido estudiado y debe evitarse su uso en pacientes con AR en combinación con FARME biológicos tales como los antagonistas del TNF, antagonistas de IL-1R, antagonistas de IL-6R, anticuerpos monoclonales anti-CD20 y moduladores selectivos de la coestimulación e inmunosupresores potentes tales como azatioprina y ciclosporina, debido a la posibilidad de mayor inmunosupresión y mayor riesgo de infecciones.
Artritis psoriásica: XELJANZ® no se ha estudiado y su administración se debe evitar en pacientes con artritis psoriásica activa en combinación con FARME biológicos como antagonistas del TNF, antagonistas de IL-17 y antagonistas de IL-12/IL-23 e inmunosupresores potentes como azatioprina y ciclosporina debido a la posibilidad de un aumento de la inmunosupresión y aumento de riesgo de infección.
No se ha estudiado la administración de XELJANZ® en combinación con inhibidores de fosfodiesterasa 4 en ensayos clínicos con XELJANZ®.
Colitis ulcerosa: XELJANZ® no se ha estudiado y debe evitarse su uso en pacientes con colitis ulcerosa en combinación con agentes biológicos como los antagonistas del TNF y vedolizumab, y/o inmunosupresores potentes como la azatioprina, 6 mercaptopurina, tacrolimus y ciclosporina debido a la posibilidad de un aumento de la inmunosupresión y aumento del riesgo de infección.
Artritis idiopática juvenil de curso poliarticular: XELJANZ® no se ha estudiado y su administración se debe evitar en pacientes con AIJcp en combinación con FARME biológicos (por ejemplo, antagonistas del receptor de interleucina 6 [IL-6R] y moduladores de coestimulación selectiva) e inmunosupresores potentes tales como la azatioprina y la ciclosporina, debido a la posibilidad de aumento de la inmunosupresión y aumento del riesgo de infección.
Efectos en la capacidad de conducir y usar máquinas: No se han efectuado estudios formales sobre los efectos en la capacidad de conducir y usar máquinas.
DOSIS Y VÍA DE ADMINISTRACIÓN:
XELJANZ® no ha sido estudiado y debe evitarse su uso en combinación con los antagonistas del TNF, antagonistas del IL-1R, antagonistas del IL-6R, anticuerpos monoclonales anti-CD20, antagonistas IL-17, antagonistas IL-12/IL23, antiintegrinas, moduladores selectivos de la coestimulación e inmunosupresores potentes como azatioprina, ciclosporina y tacrolimus, debido a la posibilidad de una mayor inmunosupresión y al mayor riesgo de infecciones.
El tratamiento con XELJANZ® debe interrumpirse si el paciente desarrolla alguna infección grave hasta que ésta se haya controlado.
Vía de administración: XELJANZ® es administrado por vía oral con o sin alimentos.
Posología para artritis reumatoide: XELJANZ® puede ser usado como monoterapia o en combinación con metotrexato (MTX) u otros FARME no biológicos. La dosis recomendada es de 5 mg administrados dos veces al día. Algunos pacientes pueden beneficiarse con el incremento a 10 mg dos veces al día, con base en la respuesta clínica.
Dos tabletas de XELJANZ® 5 mg son bioequivalentes a una tableta de XELJANZ® 10 mg y se pueden utilizar como una alternativa a la administración de una tableta de XELJANZ® 10 mg.
En general administre la dosis más baja efectiva para mantener el beneficio terapéutico.
Posología para artritis psoriásica: La dosis recomendada de XELJANZ® es de 5 mg administrados dos veces al día en combinación con FARME sintéticos convencionales (FARMEsc).
Posología en colitis ulcerosa: La dosis recomendada de XELJANZ® para pacientes adultos con colitis ulcerosa de actividad moderada a grave es de 10 mg por vía oral dos veces al día para la inducción durante al menos 8 semanas y seguido de 5 mg o 10 mg dos veces al día para el mantenimiento, de acuerdo con la respuesta terapéutica.
Dos tabletas de XELJANZ® 5 mg son bioequivalentes a una tableta de XELJANZ® 10 mg y se pueden utilizar como una alternativa a la administración de una tableta de XELJANZ® 10 mg.
Descontinuar la terapia de inducción en pacientes que no muestran evidencia de beneficio terapéutico en la semana 16.
Para los pacientes refractarios, como los que fallaron en la terapia previa con antagonistas del TNF, se debe considerar la continuación de la dosis de mantenimiento de XELJANZ® 10 mg dos veces al día.
Los pacientes que no logran mantener el beneficio terapéutico con XELJANZ® 5 mg dos veces al día pueden beneficiarse de un aumento de XELJANZ® 10 mg administrado dos veces al día.
En general administre la dosis más baja efectiva para mantener el beneficio terapéutico.
Posología para la artritis idiopática juvenil de curso poliarticular:
XELJANZ®/XELJANZ® solución oral se puede administrar como monoterapia o en combinación con metotrexato (MTX).
La dosis recomendada de tofacitinib para los pacientes con AIJcp de 2 años y mayores es tofacitinib tabletas 5 mg dos veces al día o tofacitinib solución oral con dosis equivalente basada en el peso dos veces al día, la cual no se debe exceder (Tabla 16).
Tabla 16. Dosificación recomendada de tofacitinib para los pacientes con AIJcp de 2 años y mayores
|
Peso Corporal (kg) |
Régimen de dosificación |
|
10 -< 20 |
3.2 mg (3.2 mL de solución oral) dos veces al día |
|
20 -< 40 |
4 mg (4 mL de solución oral) dos veces al día |
|
≥ 40 |
5 mg (una tableta de 5 mg o 5 mL de solución oral) dos veces al día* |
* Los pacientes ≥ 40 kg tratados con tofacitinib 5 mL solución oral dos veces al día se pueden cambiar a tofacitinib 5 mg tabletas dos veces al día. Los pacientes < 40 kg no se pueden cambiar de la solución oral de tofacitinib.
Ajuste de la dosis debido a anormalidades de laboratorio (ver la sección Precauciones generales): El ajuste de la dosis o la interrupción de la dosificación pueden ser necesarios para el manejo de alteraciones en pruebas de laboratorio relacionadas con la dosis incluyendo linfopenia, neutropenia y anemia, como se describe en las tablas 17, 18 y 19.
No se recomienda iniciar XELJANZ® en pacientes con conteo de linfocitos < 500 células/mm3.
Tabla 17. Ajuste de la dosis para linfopenia
|
Conteo bajo de linfocitos (ver la sección Precauciones generales) |
|
|
Valor de laboratorio (células/mm3) |
Recomendación |
|
Conteo de linfocitos ≥ 500 |
Mantener la dosis |
|
Conteo de linfocitos < 500 (Confirmado por repetición de la prueba) |
Descontinuar el tratamiento con XELJANZ® |
Se recomienda no iniciar XELJANZ® en pacientes con conteo absoluto de neutrófilos (ANC, por sus siglas en inglés) < 1000 células/mm3.
Tabla 18. Ajuste de la dosis para neutropenia
|
Recuento absoluto de neutrófilos (ANC) bajo (ver la sección Precauciones generales) |
|
|
Valor de laboratorio (células/mm3) |
Recomendación |
|
ANC > 1000 |
Mantener la dosis |
|
ANC 500-1000 |
Para disminuciones persistentes en este rango, reducir la dosis de XELJANZ® o interrumpir la administración hasta que el ANC sea > 1000. Para pacientes que reciben XELJANZ® 5 mg dos veces al día, interrumpir la dosis de XELJANZ®. Cuando el ANC sea > 1000, reanude el tratamiento con XELJANZ® 5 mg dos veces al día. Para pacientes que reciben XELJANZ® 10 mg dos veces al día, reducir la dosis a XELJANZ® 5 mg dos veces al día. Cuando el ANC sea > 1000, aumente la dosis a XELJANZ® 10 mg dos veces al día con base en la respuesta clínica. |
|
ANC < 500 (confirmado por repetición de la prueba) |
Descontinuar el tratamiento con XELJANZ® |
No se recomienda iniciar XELJANZ® en pacientes con hemoglobina < 9 g/dL.
Tabla 19. Ajuste de la dosis para anemia
|
Valor de hemoglobina bajo |
|
|
Valor de laboratorio (g/dL) |
Recomendación |
|
Disminución ≤ 2 g/dL y ≥ 9.0 g/dL |
Mantener la dosis |
|
Disminución > 2 g/dL o menos de 8.0 g/dL (confirmado por repetición de la prueba) |
Interrumpir la administración de XELJANZ® hasta que los valores de hemoglobina se hayan normalizado. |
Poblaciones especiales:
Insuficiencia renal: Para las indicaciones con una dosis máxima recomendada de XELJANZ® 5 mg dos veces al día, en pacientes con insuficiencia renal grave, la dosis recomendada es XELJANZ® 5 mg una vez al día (ver la sección Precauciones generales y Farmacocinética y farmacodinamia).
Recomendaciones específicas de cada indicación se enlistan abajo:
Artritis reumatoide: No se requiere ajuste de la dosis en pacientes con insuficiencia renal leve o moderada. La dosificación de XELJANZ® no debe exceder de 5 mg dos veces al día en pacientes con insuficiencia renal grave (incluidos, pero no limitados a los sometidos a hemodiálisis) (ver las secciones Precauciones generales y Farmacocinética y farmacodinamia).
Artritis psoriásica: No se requiere ajuste de dosis en pacientes con insuficiencia renal leve o moderada. La dosis recomendada de XELJANZ® es de 5 mg una vez al día, en pacientes con insuficiencia renal grave (incluidos, pero no limitados a los que se someten a hemodiálisis) (ver la sección Precauciones generales y Farmacocinética y farmacodinamia).
Colitis ulcerosa: No se requiere ajuste de dosis en pacientes con insuficiencia renal leve o moderada. En pacientes con insuficiencia renal grave (incluidos, pero no limitados a los sometidos a hemodiálisis), la dosis recomendada de XELJANZ® es de 5 mg una vez al día si la dosis en presencia de la función renal normal es 5 mg dos veces al día (ver la sección Precauciones generales y Farmacocinética y farmacodinamia).
En pacientes con insuficiencia renal grave (incluidos, pero no limitados a los sometidos a hemodiálisis), la dosis recomendada de XELJANZ® es de 5 mg dos veces al día si la dosis en presencia de la función renal normal es de 10 mg dos veces al día (ver la sección Precauciones generales y Farmacocinética y farmacodinamia).
Artritis idiopática juvenil de curso poliarticular: No se requiere un ajuste de la dosis en pacientes con insuficiencia renal leve o moderada. En pacientes con insuficiencia renal grave (incluidos, pero no limitados a los sometidos a hemodiálisis), la dosis recomendada de XELJANZ® es de 5 mg una vez al día si la dosis en presencia de la función renal normal es de 5 mg dos veces al día. Para XELJANZ® solución oral, la dosis recomendada es de 3.2 mg, 4 mg o 5 mg una vez al día si la dosis en presencia de la función renal normal es de 3.2 mg, 4 mg o 5 mg dos veces al día, respectivamente (ver las secciones Precauciones generales y Farmacocinética y farmacodinamia).
Insuficiencia hepática: En pacientes con insuficiencia hepática leve no se requiere un ajuste de la dosis. Si la dosis de XELJANZ® es de 5 mg dos veces al día, en pacientes con insuficiencia hepática moderada, la dosis recomendada es XELJANZ® 5 mg una vez al día.
Si la dosis de XELJANZ® es de 10 mg dos veces al día, la dosis recomendada en pacientes con insuficiencia hepática moderada es XELJANZ® 5 mg dos veces al día.
Recomendaciones específicas de cada indicación se enlistan abajo:
Artritis reumatoide: No se requiere ajuste de la dosis en pacientes con insuficiencia hepática leve. XELJANZ® no debe usarse en pacientes con insuficiencia hepática grave. La dosificación de XELJANZ® no debe exceder 5 mg dos veces al día en pacientes con insuficiencia hepática moderada (ver las secciones Precauciones generales y Farmacocinética y farmacodinamia).
Artritis psoriásica: No se requiere ajuste de la dosis en pacientes con insuficiencia hepática leve. XELJANZ® no debe usarse en pacientes con insuficiencia hepática grave. La dosis recomendada de XELJANZ® es de 5 mg una vez al día en pacientes con insuficiencia hepática moderada (ver las secciones Precauciones generales y Farmacocinética y farmacodinamia).
Colitis Ulcerosa: No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve. XELJANZ® no debe usarse en pacientes con insuficiencia hepática grave. En pacientes con insuficiencia hepática moderada, la dosis recomendada de XELJANZ® es de 5 mg dos veces al día cuando la dosis indicada en presencia de función hepática normal es de 10 mg dos veces al día, y la dosis recomendada es de 5 mg una vez al día cuando la dosis indicada en presencia de la función hepática normal es de 5 mg dos veces al día.
Artritis idiopática juvenil de curso poliarticular: No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve. XELJANZ® no debe usarse en pacientes con insuficiencia hepática grave. En pacientes con insuficiencia hepática moderada, la dosis recomendada de XELJANZ® es de 5 mg una vez al día si la dosis en presencia de una función renal normal es de 5 mg dos veces al día. Para XELJANZ® solución oral, la dosis recomendada es de 3.2 mg, 4 mg o 5 mg una vez al día si la dosis en presencia de una función renal normal es de 3.2 mg, 4 mg o 5 mg dos veces al día, respectivamente (ver las secciones Precauciones generales y Farmacocinética y farmacodinamia).
Pacientes con artritis reumatoide, artritis psoriásica, colitis ulcerosa y artritis idiopática juvenil de curso poliarticular que reciben inhibidores del citocromo P450 (CYP3A4) y citocromo 2C19 (CYP2C19): Para indicaciones con una dosis máxima recomendada de XELJANZ® 5 mg dos veces al día en pacientes que reciben inhibidores potentes de CYP3A4 (p. ej., Ketoconazol) o uno o más medicamentos concomitantes que resultan en una inhibición moderada de CYP3A4 y una inhibición potente de CYP2C19 (p. ej., Fluconazol) la dosis recomendada es de XELJANZ® 5 mg una vez al día. A continuación, se proporcionan recomendaciones específicas para cada indicación.
Artritis reumatoide:
La dosificación de XELJANZ® no debe exceder 5 mg dos veces al día en pacientes que reciban inhibidores potentes de CYP3A4 (por ejemplo, ketoconazol). La dosificación de XELJANZ® no debe exceder 5 mg dos veces al día en pacientes que recibieron uno o más medicamentos concomitantes que causen tanto una inhibición moderada de CYP3A4 y una inhibición potente de CYP2C19 (por ejemplo, fluconazol).
Artritis psoriásica: La dosis recomendada de XELJANZ® es de 5 mg una vez al día en pacientes que reciben inhibidores potentes del CYP3A4 (por ejemplo, ketoconazol). La dosis recomendada de XELJANZ® es de 5 mg una vez al día en pacientes que reciben uno o más medicamentos concomitantes que dan como resultado tanto una inhibición moderada del CYP3A4 y una inhibición potente del CYP2C19 (por ejemplo, fluconazol).
Colitis ulcerosa: En pacientes que reciben inhibidores potentes de CYP3A4 (por ejemplo, ketoconazol) o uno o más medicamentos concomitantes que producen tanto una inhibición moderada de CYP3A4 y una potente inhibición de CYP2C19 (por ejemplo, fluconazol), la dosis de XELJANZ® debe reducirse a 5 mg dos veces al día si el paciente toma 10 mg dos veces al día, y la dosis de XELJANZ® debe reducirse a 5 mg una vez al día si el paciente toma 5 mg dos veces al día.
Artritis idiopática juvenil de curso poliarticular: En pacientes que reciben inhibidores potentes del CYP3A4 (por ejemplo, ketoconazol) o uno o más medicamentos concomitantes que producen tanto una inhibición moderada del CYP3A4 y una potente inhibición de CYP2C19 (por ejemplo, fluconazol), la dosis recomendada de XELJANZ® es de 5 mg una vez al día si la dosis en presencia de una función renal normal es de 5 mg dos veces al día. Para XELJANZ® solución oral, la dosis recomendada es de 3.2 mg, 4 mg o 5 mg una vez al día, si la dosis en presencia de una función renal normal es de 3.2 mg, 4 mg o 5 mg dos veces al día, respectivamente (ver las secciones Precauciones generales y Farmacocinética y farmacodinamia).
Pacientes con artritis reumatoide, artritis psoriásica, colitis ulcerosa y artritis idiopática juvenil de curso poliarticular que reciben inductores del citocromo P450 (CYP3A4): La coadministración de XELJANZ® con inductores potentes del CYP (por ejemplo, rifampicina) puede causar reducción o pérdida de la respuesta clínica (ver la sección Interacciones medicamentosas y de otro género). No se recomienda la coadministración de inductores potentes de CYP3A4 con XELJANZ®.
Pacientes de edad avanzada (≥ 65 años): No se requiere ajuste de la dosis en pacientes de 65 años o mayores.
Pacientes pediátricos: Se ha evaluado la seguridad y eficacia de XELJANZ®/XELJANZ® solución oral 5 mg dos veces al día o la dosis equivalente basada en el peso dos veces al día en pacientes con AIJcp de 2 años a < 18 años.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
No hay experiencia con sobredosis de XELJANZ®. No hay un antídoto específico para la sobredosis de XELJANZ®. El tratamiento debe ser sintomático y de apoyo. En caso de sobredosis, se recomienda que se vigilen los signos y síntomas de reacciones adversas. Los pacientes que desarrollen reacciones adversas deben recibir tratamiento adecuado.
Los datos farmacocinéticos hasta, e incluyendo una sola dosis de 100 mg en voluntarios sanos indican que más de 95% de la dosis administrada será eliminada en las primeras 24 horas.
PRESENTACIONES:
Caja con 28 o 56 tabletas.
Frasco con 28, 60 o 180 tabletas y desecante no ingerible.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese a no más de 30 °C.
Consérvese el frasco/la caja bien cerrados.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para profesionales de la salud. No se deje al alcance de los niños. Su venta requiere receta médica. No se use en el embarazo o lactancia. Contiene un desecante NO INGERIBLE, consérvese dentro del envase. Prohibida la venta fraccionada del producto.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx y
MEX.AEReporting@pfizer.com y
a la línea Pfizer 800 401 2002.
PFIZER, S.A. de C.V.
Km. 63 Carretera México-Toluca, Zona Industrial,
C.P. 50140, Toluca, México, México.
Reg. Núm. 105M2013 SSA IV