VICTOZA
LIRAGLUTIDA (ADN RECOMBINANTE)
Solución inyectable
1 Caja, 1 Plumas, 3 mL, 0.6 mg
1 Caja, 1 Pluma precargada, 3 ml,
1 Caja, 2 Pluma precargada, 3 ml,
1 Caja, 3 Pluma precargada, 3 ml,
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada mL contiene:
Liraglutida* 6 mg
Vehículo cbp 1 mL
* Análogo del GLP-1 de origen ADN recombinante expresado en Saccharomyces cerevisiae
Solución inyectable en pluma precargada.
Solución transparente e incolora o casi incolora, isotónica, pH = 8.15
Una pluma precargada contiene 18 mg de liraglutida en 3 mL
Excipientes: Fosfato disódico dihidratado, propilenglicol, fenol, hidróxido de sodio, ácido clorhídrico, agua para la fabricación de inyectables
INDICACIONES TERAPÉUTICAS: Para el tratamiento de la diabetes mellitus tipo 2. VICTOZA® está indicado como adyuvante en la dieta y el ejercicio para lograr el control glucémico en adultos, adolescentes y niños de 10 años o más con diabetes mellitus tipo 2. VICTOZA® está indicado para una administración una vez al día como:
– Monoterapia.
– En combinación con terapia con uno o más antidiabéticos orales (metformina, sulfonilurea, inhibidor del cotransportador de sodio-glucosa tipo 2 [iSGLT2] o tiazolodinediona) cuando la terapia previa no alcanzó el control glucémico adecuado.
– En combinación con terapia con insulina en pacientes que no alcanzaron un control glucémico adecuado con VICTOZA® y con metformina.
– Como un complemento al tratamiento de referencia para reducir el riesgo de eventos cardiovasculares graves en adultos con diabetes mellitus tipo 2 con alto riesgo cardiovascular.
FARMACOCINÉTICA Y FARMACODINAMIA:
Código ATC: A10BJ02
Farmacocinética:
Absorción: La absorción de liraglutida tras la administración subcutánea es lenta, alcanzando su máxima concentración a las 8-12 horas después de la administración. La concentración máxima estimada de liraglutida fue de 9.4 nmol/L para una dosis única subcutánea de liraglutida 0.6 mg. Con 1.8 mg de liraglutida, el promedio de la concentración de liraglutida en estado estacionario (ABC τ/24) alcanzó aproximadamente 34 nmol/L. La exposición a liraglutida aumentó proporcionalmente con la dosis. El coeficiente de variación intrasujeto para el área bajo la curva (ABC) de liraglutida fue del 11% después de la administración de una dosis única. Liraglutida puede administrarse por vía subcutánea en el abdomen, muslo o parte superior del brazo.
La biodisponibilidad absoluta de liraglutida después de la administración subcutánea es aproximadamente del 55%.
Distribución: El volumen aparente de distribución después de la administración subcutánea es de 11-17 L. El volumen medio de distribución después de la administración intravenosa de liraglutida es de 0.07 L/kg. Liraglutida se une ampliamente a proteína plasmática (> 98%).
Metabolismo/biotransformación: Durante un periodo de 24 horas posteriores a la administración de una dosis única de [3H]-liraglutida a sujetos sanos, el componente principal en plasma fue liraglutida intacta. Dos metabolitos menores fueron detectados en plasma (≤ 9% y ≤ 5% de la exposición radioactiva total del plasma). Liraglutida es metabolizado endógenamente, en una forma similar a las proteínas de gran tamaño, sin un órgano específico como la vía mayor de eliminación.
Eliminación: Después de una dosis de [3H]-liraglutida, la liraglutida intacta no fue detectada en orina o en heces. Sólo una menor parte de la radiactividad administrada fue excretada como metabolitos relacionados a liraglutida en orina o heces (6 y 5%, respectivamente).
Sobre todo, la radiactividad de la orina y de las heces fue excretada durante los primeros 6-8 días, y correspondieron a los tres metabolitos menores respectivamente.
La depuración media después de la administración s.c. de una dosis única de liraglutida es aproximadamente de 1.2 L/h con una vida media de eliminación de aproximadamente 13 horas.
Poblaciones especiales:
Adultos mayores: No se requiere ajuste de la dosis con base en la edad. La edad no tuvo un efecto clínico relevante en la farmacocinética de liraglutida, basado en los resultados de un estudio farmacocinético en sujetos sanos y análisis poblacional de los datos farmacocinéticos de los pacientes (18 a 80 años).
Género: No se requiere ajuste de la dosis con base en el género. El género no tuvo un efecto clínico significativo en la farmacocinética de liraglutida, basado en los resultados de análisis de datos farmacocinéticos poblacionales de pacientes masculinos y femeninos, y en un estudio farmacocinético en sujetos sanos.
Origen étnico: No se requiere ajuste de la dosis con base en el origen étnico. El origen étnico no tuvo un efecto clínico relevante en la farmacocinética de liraglutida, basado en los resultados del análisis farmacocinético poblacional que incluyeron sujetos de raza blanca, negra, asiática e hispana.
Obesidad: El análisis farmacocinético poblacional sugiere que el índice de masa corporal (IMC) no tiene un efecto significativo en la farmacocinética de liraglutida.
Insuficiencia hepática: La farmacocinética de liraglutida fue evaluada en sujetos con diversos grados de insuficiencia hepática en un estudio de dosis única. En el estudio se incluyó a sujetos con insuficiencia hepática leve (clasificación Child Pugh 5-6) a severa (clasificación Child Pugh > 9). La exposición no fue mayor en sujetos con insuficiencia hepática comparada con sujetos sanos y, por lo tanto, la insuficiencia hepática no tiene un efecto relevante clínico en la farmacocinética de liraglutida.
Insuficiencia renal: La farmacocinética de liraglutida fue evaluada en sujetos con diversos grados de insuficiencia renal en un estudio de dosis única. En el estudio se incluyó a sujetos con insuficiencia renal leve (depuración estimada de creatinina, 50-80 mL/min) a severa (depuración estimada de creatinina < 30 mL/min) y sujetos con enfermedad renal en etapa terminal con necesidad de diálisis. La insuficiencia renal no tuvo ningún efecto clínicamente relevante en la farmacocinética de liraglutida.
Pacientes pediátricos: Las propiedades farmacocinéticas se evaluaron en estudios clínicos realizados en la población pediátrica con diabetes tipo 2 y de 10 años o más. La exposición a liraglutida en adolescentes y niños fue similar a la observada en la población adulta.
Farmacodinamia:
Mecanismo de acción: Liraglutida es un análogo del péptido similar al glucagón tipo 1 humano (GLP-1) con 97% de homología al GLP-1 humano que se une y activa al receptor GLP-1. El receptor de GLP-1 es el blanco del GLP-1 nativo, una hormona incretina endógena que potencializa la secreción de insulina dependiente de glucosa de las células beta pancreáticas. A diferencia del GLP-1 nativo, liraglutida tiene un perfil farmacocinético y farmacodinámico adecuado en humanos para la administración una vez al día. Después de la administración subcutánea, el perfil de acción es prolongado y está basado en tres mecanismos: autoasociación, la cual resulta en absorción lenta, la unión a la albúmina y la estabilidad enzimática hacia las enzimas dipeptidil peptidasa IV (DPP-IV) y endopeptidasa neutra (NEP) que resultan en una vida media plasmática prolongada.
La acción de la liraglutida es mediada por la interacción específica con los receptores GLP-1, lo que lleva a un incremento de adenosín monofosfato cíclico (AMPc). Liraglutida estimula la secreción de insulina de una manera glucosa dependiente y mejora la función de las células beta. Simultáneamente, liraglutida disminuye la secreción inadecuadamente alta de glucagón, también de manera dependiente de glucosa. Así, cuando la glucosa sanguínea está elevada, la secreción de insulina se estimula y se inhibe la secreción de glucagón. Por el contrario, durante un episodio de hipoglucemia, liraglutida disminuye la secreción de insulina y no altera la secreción de glucagón. El mecanismo de disminución de la glucosa en sangre también involucra un retraso menor en el vaciamiento gástrico. Liraglutida reduce el peso corporal y la masa grasa corporal a través de mecanismos que involucran el reducir el apetito y una reducción en la ingesta energética.
GLP-1 es un regulador fisiológico del apetito y de la ingesta de calorías, y el receptor GLP-1 (GLP-R) está presente en varias áreas del cerebro involucradas en la regulación del apetito.
En estudios en animales, la administración periférica de liraglutida condujo a la captación en regiones específicas del cerebro, incluyendo el hipotálamo en donde liraglutida, a través de la activación específica del receptor GLP-1, aumentó la saciedad y disminuyó las señales de hambre, lo que conduce a reducir el peso corporal.
Los receptores GLP-1 se expresan también en lugares específicos en el corazón, sistema vascular, sistema inmune y riñones. Los estudios en humanos y en animales han demostrado que la activación de estos receptores con liraglutida puede mediar efectos cardiovasculares y microvasculares, incluyendo reducción de la inflamación. Los estudios en animales muestran que liraglutida atenúa el desarrollo de aterosclerosis.
Liraglutida ha demostrado un retraso en la progresión de diabetes en modelos de animales con prediabetes. Se ha demostrado que liraglutida in vitro es un potente agente para la estimulación específica de la proliferación de células beta y la prevención tanto de citocinas como de ácidos grasos libres inducidos por muerte de células beta (apoptosis). In vivo, liraglutida incrementa la biosíntesis de insulina y la masa de células beta en modelos animales diabéticos. Cuando la glucosa es completamente normalizada, liraglutida no aumenta la masa de células beta.
Datos farmacodinámicos: VICTOZA® tiene una duración de acción de 24 horas y mejora el control glucémico mediante la reducción de la glucosa en sangre en ayuno y posprandial en pacientes con diabetes mellitus tipo 2.
La diferencia entre las dosis de 1.8 mg/1.2 mg de VICTOZA® y el placebo en la reducción de la glucosa media en ayuno fue de 3.90 mmol/L (70 mg/dL)/3.33 mmol/L (60 mg/dL) (Figura 1).
Después de una comida estándar, la diferencia en la concentración media de glucosa posprandial de 2 horas fue de 6.02 mmol/L (108 mg/dL)/5.63 mmol/L (101 mg/dL).
Además, VICTOZA® disminuyó la fluctuación glucémica posprandial (glucosa posprandial incrementa) en un promedio de 1.1 mmol/L (20 mg/dL)/1.08 mmol/L (19 mg/dL).
Figura 1. Concentraciones media absoluta (arriba) e incremental (abajo) de glucosa plasmática posprandial. Pacientes con diabetes tipo 2 tratados con 1.8 mg de VICTOZA® o placebo en un diseño cruzado (N = 18) (Estudio 1698).

Secreción de insulina dependiente de glucosa:
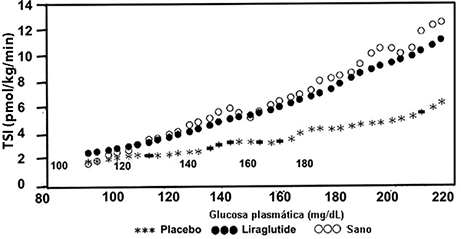
VICTOZA® incrementó la secreción de insulina en relación con el aumento de las concentraciones de glucosa. Utilizando una infusión de glucosa gradual por etapas, la tasa de secreción de insulina se incrementó después de una dosis única de VICTOZA® en pacientes con diabetes tipo 2 a un nivel comparable al observado en sujetos sanos (Figura 2).
Figura 2. Tasa media de Secreción de Insulina (ISR) vs concentración de glucosa después de una dosis única de 7.5 μg/kg (~0.66 mg) o placebo en sujetos con diabetes tipo 2 (N = 10) y sujetos sanos no tratados (N = 10) durante la infusión de glucosa graduada (Estudio 2063).
Función de las células beta: VICTOZA® mejoró la función de las células beta evaluada mediante la respuesta de primera y segunda fase de la insulina, y capacidad secretora máxima de células beta. En un estudio farmacodinámico en pacientes con diabetes tipo 2 se demostró la restauración de la primera fase de secreción de insulina (bolo intravenoso de glucosa), la mejora de la segunda fase de secreción de insulina (clamp hiperglucémico) y una capacidad secretora máxima de insulina (prueba de estimulación con arginina).
Figura 3. Perfiles medios de insulina durante el bolo de glucosa (añadido), clamp hiperglucémico y prueba de estimulación con arginina después de la administración de 6 μg/kg (~0.55 mg) de VICTOZA® o placebo durante 10 días en sujetos con diabetes tipo 2 (Estudio 1332).

En estudios clínicos de hasta 52 semanas con VICTOZA® ha mostrado una mejoría en la función de las células beta, utilizando indicadores como la evaluación del modelo de homeostasis para la función de células beta (HOMA-B) y la proporción proinsulina a insulina.
Secreción de glucagón:
VICTOZA® disminuyó la glucosa en sangre, estimulando la secreción de insulina y disminuyendo la secreción de glucagón. VICTOZA® no alteró la respuesta del glucagón a la concentración baja de glucosa. Además, fue observada una liberación menor de glucosa endógena con VICTOZA®. Vaciamiento gástrico: VICTOZA® causó un retraso menor del vaciamiento gástrico, lo que redujo la tasa en la que la glucosa posprandial aparece en circulación.
Peso corporal, composición corporal e ingesta energética: En estudios clínicos a largo plazo con pacientes con peso corporal elevado, VICTOZA® redujo significativamente el peso corporal. Mediante tomografía computarizada (TC) y absorciometría dual de rayos X (DEXA, por sus siglas en inglés) se comprobó que esta pérdida de peso fue principalmente de tejido adiposo. Estos resultados se consideran explicados por una sensación de hambre reducida y una ingesta calórica reducida, observados durante el tratamiento con VICTOZA®.
Electrofisiología cardiaca (QTc):
El efecto de VICTOZA® en la repolarización cardiaca fue analizado en un estudio de QTc. VICTOZA® en concentraciones en estado estacionario con dosis diarias de hasta 1.8 mg no produjo prolongación de QTc.
Estudios clínicos:
Datos clínicos de eficacia y seguridad: Se aleatorizó a 3,992 pacientes adultos con diabetes tipo 2 en cinco estudios clínicos de seguridad y eficacia, doble ciego y controlados que fueron realizados para evaluar los efectos de VICTOZA® sobre el control glucémico. El tratamiento con VICTOZA® produjo mejoría clínicamente y estadísticamente significativa en la hemoglobina A1c (HbA1c), en la glucosa en plasma en ayuno (GPA) y en la glucosa posprandial (GPP) en comparación con el placebo.
En estos estudios se incluyó a 3,978 pacientes expuestos (2,501 pacientes tratados con VICTOZA®), 53.7% hombres y 46.3% mujeres, 797 pacientes (508 tratados con VICTOZA®) fueron ≥ 65 años de edad y 113 pacientes (66 tratados con VICTOZA®) fueron ≥ 75 años de edad.
Control glucémico:
Tabla 1. Estudios clínicos de fase 3 de VICTOZA® en monoterapia (52 semanas) y en combinación
con antidiabéticos orales (26 semanas)
|
N |
Cifra basal de HbA1c media (%) |
Cambio de HbA1c media con respecto al valor inicial (%) |
Pacientes |
Cifra basal de la media del peso (kg) |
Cambio de la media del peso con respecto al valor inicial (kg) |
|
|
Monoterapia |
||||||
|
Liraglutida 1.2 mg |
251 |
8.18 |
-0.84* |
42.81, 58.33 |
92.1 |
-2.05** |
|
Liraglutida 1.8 mg |
246 |
8.19 |
-1.14** |
50.91, 62.03 |
92.6 |
-2.45** |
|
Glimepirida 8 mg/día |
248 |
8.23 |
-0.51 |
27.81, 30.83 |
93.3 |
1.12 |
|
Complementario a la metformina (2.000 mg/día) |
||||||
|
Liraglutida 1.2 mg |
240 |
8.3 |
-0.97† |
35.31, 52.82 |
88.5 |
-2.58** |
|
Liraglutida 1.8 mg |
242 |
8.4 |
-1.00† |
42.41, 66.32 |
88.0 |
-2.79** |
|
Placebo |
121 |
8.4 |
0.09 |
10.81, 22.52 |
91.0 |
-1.51 |
|
Glimepirida 4 mg/día |
242 |
8.4 |
-0.98 |
36.31, 56.02 |
89.0 |
0.95 |
|
Complementario a glimepirida (4 mg/día) |
||||||
|
Liraglutida 1.2 mg |
228 |
8.5 |
-1.08** |
34.51, 57.42 |
80.0 |
0.32** |
|
Liraglutida 1.8 mg |
234 |
8.5 |
-1.13** |
41.61, 55.92 |
83.0 |
-0.23** |
|
Placebo |
114 |
8.4 |
0.23 |
7.51, 11.82 |
81.9 |
-0.10 |
|
Rosiglitazona 4 mg/día |
231 |
8.4 |
-0.44 |
21.91, 36.12 |
80.6 |
2.11 |
|
Complementario a la metformina2 (2.000 mg/día) + rosiglitazona (4 mg dos veces al día) |
||||||
|
Liraglutida 1.2 mg |
177 |
8.48 |
-1.48 |
57.51 |
95.3 |
-1.02 |
|
Liraglutida 1.8 mg |
178 |
8.56 |
-1.48 |
53.71 |
94.9 |
-2.02 |
|
Placebo |
175 |
8.42 |
-0.54 |
28.11 |
98.5 |
0.60 |
|
Complementario a la metformina2 (2.000 mg/día) + glimepirida (4 mg/día) |
||||||
|
Liraglutida 1.8 mg |
230 |
8.3 |
-1.33* |
53.11 |
85.8 |
-1.81** |
|
Placebo |
114 |
8.3 |
-0.24 |
15.31 |
85.4 |
-0.42 |
|
Insulina glargina4 |
232 |
8.1 |
-1.09 |
45.81 |
85.2 |
1.62 |
|
Complementario a iSGLT25 ± metformina (≥ 1500 mg/día) |
||||||
|
Liraglutida 1.8 mg |
203 |
8.00 |
-1.02 |
54.8 |
91.0 |
-2.92 |
|
Placebo |
100 |
7.96 |
-0.28 |
13.9 |
91.4 |
-2.06 |
* Superioridad (p < 0.01) vs. comparador activo.
** Superioridad (p < 0.0001) vs. comparador activo.
† No inferioridad (p < 0.0001) vs. comparador activo.
1 Todos los pacientes.
2 Monoterapia ADO previa.
3 Pacientes previamente tratados con dieta.
4 La administración de insulina glargina fue abierta y se aplicó de acuerdo con las directrices de ajuste de insulina glargina. El paciente manejó el ajuste de la dosis de insulina glargina después de la capacitación por parte del investigador:
5 Se investigó la adición de VICTOZA® a un iSGLT2 se con todas las dosis aprobadas de iSGLT2.
Guía para el ajuste de dosis de insulina glargina:
|
GPA medida por el paciente |
Aumento de la dosis de insulina glargina (unidad) |
|
≤ 5.5 mmol/L (≤ 100 mg/dL) objetivo |
Sin ajuste |
|
> 5.5 y < 6.7 mmol/L (> 100 y < 120 mg/dL) |
0-2a |
|
≥ 6.7 mmol/L (≥ 120 mg/dL) |
2 |
a De acuerdo con la recomendación individualizada del investigador en la consulta previa, por ejemplo, dependiendo de si el paciente presentó hipoglucemia.
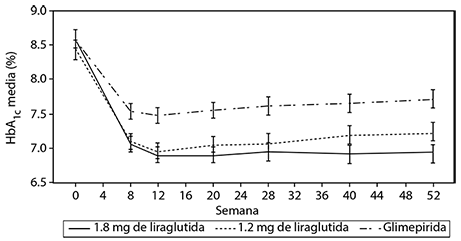
La monoterapia con VICTOZA® durante 52 semanas resultó en reducciones estadísticamente significativas (p < 0.0014) y sostenidas de la HbA1c en comparación con pacientes que recibieron glimepirida (figura 4).
Figura 4. El nivel de HbA1c se redujo por debajo del 7% y se mantuvo durante 12 meses cuando se administró VICTOZA® a pacientes previamente tratados con dieta y ejercicio (Estudio 1573).
Los pacientes con una HbA1c basal superior a 9.5% experimentaron una reducción media en HbA1c del 2.1% después del tratamiento con VICTOZA® en monoterapia, mientras que los pacientes tratados con VICTOZA® en estudios de combinación presentaron reducciones medias en HbA1c de 1.1-2.5%.
Tabla 2. Resultados de un estudio de 12 + 26 semanas en el que se agregó insulina detemir a liraglutida y metformina en pacientes que no consiguieron un control glucémico adecuado (HbA1c < 7.0%) después de un periodo de preinclusión de 12 semanas con liraglutida
|
Tratamiento complementario con insulina detemir |
|||
|
Pacientes que consiguieron la HbA1c objetivo después de 12 semanas de terapia con liraglutida + metformina |
Pacientes que no consiguieron la HbA1c objetivo después de 12 semanas de terapia con liraglutida + metformina |
||
|
Continuación de la terapia |
Adición de insulina detemir después de 12 semanas |
Continuación de la terapia |
|
|
N (expuestos) |
498 |
162 |
161 |
|
Dosis de insulina (promedio en la semana 38) |
39U |
||
|
HbA1c basal (%) (media) |
7.72 |
||
|
Cambio con respecto al inicio |
|||
|
Semanas 12 |
-1.3 |
-0.6 |
-0.7 |
|
Semanas 38 |
-1.1 |
-1.1 |
-0.8 |
|
Pacientes (%) que alcanzaron una HbA1c < 7% |
|||
|
Semanas 12 |
100% |
0.0% |
0.6% |
|
Semanas 38 |
76% |
43% |
17% |
|
Peso corporal (kg) |
|||
|
Basal media |
99.0 kg |
99.5 kg |
98.8 kg |
|
Cambio con respecto al inicio |
|||
|
Semanas 12 |
-4.35 kg |
- 3.53 kg |
-3.46 kg |
|
Semanas 38 |
-4.8 kg |
-4.0 kg |
-4.7 kg |
Nota: En el estudio se incluyó inicialmente a 988 pacientes en preinclusión. Se pidió a los pacientes tratados previamente con metformina + sulfonilurea que interrumpieran la sulfonilurea, pero todos los pacientes continuaron su régimen con metformina anterior al estudio. Después del periodo de preinclusión, 498 pacientes (61% de aquellos que completaron el periodo de preinclusión) alcanzaron HbA1c, < 7% objetivo con liraglutida + metformina, por lo tanto, continuaron el tratamiento en un brazo "no aleatorizado", mientras que los 323 pacientes restantes (39%) con una HbA1c ≥ 7% fueron aleatorizados a continuar con el tratamiento sin cambios con 1.8 mg de VICTOZA® + metformina como control (N = 161) o para recibir una intensificación adicional con insulina detemir como terapia de adición (N = 162).
En pacientes que no lograron el control glucémico con VICTOZA® y metformina, la adición de insulina detemir proporcionó una eficacia superior en comparación con VICTOZA® y metformina sola después de 26 semanas de tratamiento (diferencia de tratamiento estimada de -0.52% en la HbA1c).
En el estudio LEADER (véase sección Farmacocinética y farmacodinamia-Evaluación cardiovascular), 873 pacientes recibieron insulina premezclada (con o sin ADO [s]) al inicio y al menos durante las siguientes 26 semanas. La media de HbA1c basal fue de 8.7% para liraglutida y placebo. A la semana 26, cambió medio estimado en la HbA1c fue de 1.4% y -0.5% para liraglutida y placebo respectivamente con una diferencia de tratamiento estimada de, 0.9 [-1.00; -0.70] en el IC del 95%. El perfil de seguridad de liraglutida en combinación con insulina premezclada fue en general similar al observado con el placebo en combinación con insulina premezclada.
VICTOZA® en terapia combinada, durante 26 semanas, con metformina, una sulfonilurea o metformina y una tiazolidinediona resultó en reducciones estadísticamente significativas (p < 0.0001) y sostenidas de la HbA1c en comparación con pacientes que recibieron placebo.
También se analizó la eficacia de 0.6 mg de VICTOZA® en combinación con una sulfonilurea o con metformina y se encontró que es superior al placebo, pero inferior a las otras dosis de 1.2 y 1.8 mg de VICTOZA®.
Proporción de pacientes que alcanzaron reducciones en HbA1c: La monoterapia de VICTOZA® resultó estadísticamente significativa (p ≤ 0.0007), una proporción mayor de pacientes alcanzaron una HbA1c < 7% a las 52 semanas, comparadas con pacientes recibiendo glimepirida. VICTOZA® en combinación con metformina, sulfonilurea, metformina y tiazolidinediona o iSGLT2 ± metformina resultaron estadísticamente significativos (p ≤ 0.0001), una proporción mayor de pacientes que alcanzaron una HbA1c ≤ 6.5% a las 26 semanas comparado con otros pacientes que recibieron estos agentes solos.
En pacientes que no consiguieron el control glucémico con VICTOZA® y metformina, la proporción de pacientes que consiguieron la HbA1c objetivo de < 7% y ≤ 6.5% fue estadísticamente mayor de manera significativa con el tratamiento con insulina detemir + 1.8 mg de VICTOZA® + metformina en comparación con 1.8 mg de VICTOZA® +
metformina (p ≤ 0.0001/ p = 0.0016).
En todos los estudios combinados a 26 semanas, más pacientes alcanzaron una HbA1c < 7% cuando VICTOZA® fue utilizado como adición que como reemplazo de terapia.
Uso en pacientes con insuficiencia renal: En un estudio doble ciego que comparó la eficacia y seguridad de 1.8 mg de VICTOZA® vs placebo como complemento a la insulina y/o medicamentos antidiabéticos orales en pacientes con diabetes tipo 2 e insuficiencia renal moderada, VICTOZA® fue superior al tratamiento con placebo en la reducción de la HbA1c después de 26 semanas (-1.05 vs. -0.38%, p < 0.0001). Significativamente más pacientes consiguieron una HbA1c por debajo de 7% con VICTOZA® en comparación con el placebo (52.8% vs. 19.5% p < 0.0001). Los pacientes tratados con VICTOZA® presentaron una disminución estadísticamente significativa del peso corporal en comparación con aquellos pacientes tratados con placebo (-2.41 kg vs. -1.09 kg, p = 0.0052). Hubo un riesgo comparable de episodios hipoglucémicos entre los dos grupos de tratamiento. El perfil de seguridad de VICTOZA® fue en general similar al observado en otros estudios con VICTOZA®.
Glucosa en plasma en ayuno: El tratamiento con VICTOZA® solo o en combinación con uno o dos medicamentos antidiabéticos orales resultó en una reducción de la glucosa en plasma en ayuno del 13-43.5 mg/dL (0.72-2.42 mmol/L). Esta reducción fue observada dentro de las primeras dos semanas de tratamiento.
Glucosa posprandial: VICTOZA® redujo la glucosa posprandial a través de las tres comidas diarias en 31-49 mg/dL (1.68-2.71 mmol/L).
Peso corporal: La administración de VICTOZA® en monoterapia durante 52 semanas se asoció con una reducción de peso sostenida.
VICTOZA® en combinación con metformina, metformina y sulfonilurea o metformina y tiazolidinediona o iSGLT2 ± metformina se asoció con una reducción sostenida del peso a lo largo de los estudios.
La pérdida de peso observada en pacientes tratados con VICTOZA® en combinación con metformina fue sostenida después de la adición de insulina detemir.
Se observó una mayor reducción de peso con un mayor índice de masa corporal (IMC) en el periodo basal.
El tratamiento con VICTOZA® como monoterapia durante 52 semanas redujo la circunferencia de cintura media de 3.0-3.6 cm.
Se observó una reducción del peso corporal en pacientes tratados con VICTOZA®, independientemente de la incidencia de náuseas.
En combinación con metformina, VICTOZA® redujo el tejido adiposo visceral en un rango de 13 al 17%.
Enfermedad de hígado graso no alcohólico: VICTOZA® redujo la esteatosis hepática en pacientes con diabetes tipo 2.
Inmunogenicidad: En consistencia con las propiedades potencialmente inmunogénicas de las proteínas y péptidos farmacéuticos, los pacientes pueden desarrollar anticuerpos antiliraglutida después del tratamiento con VICTOZA®. En promedio, el 8.6% de los pacientes desarrollaron anticuerpos. La formación de anticuerpos no se ha asociado con una menor eficacia de VICTOZA®.
Evaluación cardiovascular: El análisis post-hoc de los eventos adversos cardiovasculares graves mayores (muerte cardiovascular, infarto de miocardio, evento cerebrovascular) en todos los estudios Fase 2 y 3 intermedios y de largo plazo (con una duración de entre 26 y hasta 100 semanas) en las cuales se incluyó a 5,607 pacientes (3,651 expuestos a VICTOZA®), no mostró un aumento del riesgo cardiovascular (proporción de incidencia de 0.75 (IC 95% 0.35; 1.63) para VICTOZA® vs todos los comparadores.
El estudio de Efecto de liraglutida y Acción en la Evaluación de los Resultados del Resultado Cardiovascular de la Diabetes (LEADER®) fue un estudio clínico doble ciego, multicéntrico, controlado con placebo. 9,340 pacientes fueron asignados al azar a liraglutida (4,668) o placebo (4,672), ambos en adición a los cuidados de referencia para HbA1c y factores de riesgo cardiovascular (CV).
El resultado primario o estado vital al final del estudio estuvo disponible para el 99.7% y el 99.6% de los participantes aleatorizados a VICTOZA® y placebo, respectivamente. La duración de la observación fue de un mínimo de 3.5 años y hasta un máximo de 5 años. La población del estudio incluyó a pacientes de ≥ 65 años (n = 4,329) y ≥ 75 años (n = 836) y pacientes con insuficiencia renal leve (n = 3,907), moderada (n = 1,934) o severa (n = 224). La edad media fue de 64 años y el IMC medio fue de 32.5 kg/m2. La duración media de la diabetes fue de 12.8 años.
El criterio de valoración primario fue el tiempo desde la aleatorización hasta la primera aparición de eventos adversos cardiovasculares mayores (MACE): muerte CV, infarto de miocardio no fatal o accidente cerebrovascular no fatal. VICTOZA® redujo significativamente el riesgo de MACE vs. placebo (Figura 5). La razón de riesgo estimada fue consistentemente inferior a 1 para los 3 componentes de MACE.
VICTOZA® también redujo significativamente el riesgo de MACE expandido (MACE primario, angina de pecho inestable que condujo a la hospitalización, revascularización coronaria u hospitalización por insuficiencia cardiaca) frente a placebo, y demostró reducciones de riesgo en otros criterios de valoración secundaria (Figura 6).
Figura 5. Gráfico de tiempo de Kaplan Meier del tiempo hasta la primera población MACE-FAS
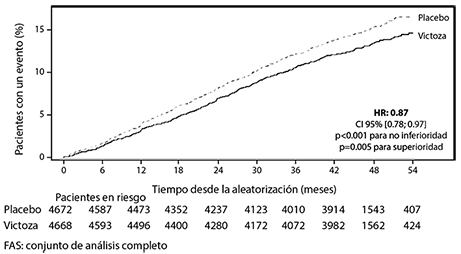
Figura 6. Diagrama de bosque del análisis de los tipos de eventos cardiovasculares individuales-población FAS.

Se observó una reducción significativa y sostenida en la HbA1c desde el inicio hasta el mes 36 con VICTOZA® vs. placebo, además del tratamiento de referencia (-1.16% vs. -0.77%; diferencia estimada de tratamiento [ETD] -0.40% [-0.45; -0.34]). La necesidad de intensificación del tratamiento con insulina se redujo en un 48% con VICTOZA® vs. placebo en pacientes sin tratamiento previo con insulina al inicio (HR 0.52 [0.48; 0.57]). También se observó una reducción significativa y sostenida en el peso corporal desde el inicio hasta el mes 36 con VICTOZA® vs placebo (-2.74 kg vs -0.47 kg, respectivamente; ETD-2.26 [-2.54; -1.99]). El perfil de eventos adversos reportados fue comparable en general a los observados en estudios clínicos completados de VICTOZA® en diabetes mellitus tipo 2 (Véase la sección Reacciones secundarias y adversas).
Presión arterial y frecuencia cardiaca: VICTOZA® redujo la presión arterial sistólica en un intervalo medio de 2.3-6.7 mmHg en las dos primeras semanas de tratamiento en estudios clínicos a largo plazo. VICTOZA® redujo la aparición del síndrome metabólico según la definición del Panel de Tratamiento en Adultos III (ATPIII, por sus siglas en inglés). La reducción en la presión arterial sistólica ocurrió antes de la pérdida de peso.
En el estudio LEADER®, la presión arterial sistólica se redujo con VICTOZA® vs. placebo (-1.4 mm Hg vs -0.2 mm Hg; ETD: -1.20 mm Hg [-1.92; -0.48]), mientras que la presión arterial diastólica disminuyó menos con liraglutida vs. placebo (-0.8 mm Hg vs -1.4 mm Hg, respectivamente, ETD: 0.59 [0.19; 0.99]) después de 36 meses. Fue observado un aumento medio en la frecuencia cardiaca de 2 a 3 latidos por minuto desde el inicio con VICTOZA® en estudios clínicos a largo plazo, incluyendo el LEADER®. En el estudio LEADER®, no se observó un impacto clínico a largo plazo del aumento en la frecuencia cardiaca sobre el riesgo de eventos cardiovasculares.
Evaluación microvascular: En el estudio LEADER®, los eventos microvasculares consistieron en resultados de nefropatía y retinopatía. El análisis del tiempo hasta el primer evento microvascular para liraglutida vs. placebo tuvo una HR de 0.84 [0.73, 0.97]. La HR de liraglutida vs. placebo fue de 0.78 [0.67, 0.92] para el tiempo hasta el primer evento de nefropatía, y 1.15 [0.87, 1.52] para el tiempo hasta el primer evento de retinopatía.
La razón estimada de tratamiento para el cambio en la excreción urinaria de albúmina/creatinina desde el inicio hasta los 36 meses fue de 0.81 [0.76, 0.86].
Población pediátrica:
En un estudio doble ciego que comparó la eficacia y seguridad de VICTOZA® 1.8 mg vs. placebo como tratamiento añadido a metformina ± insulina en adolescentes y niños de 10 años o más con diabetes tipo 2, VICTOZA® fue superior al tratamiento con placebo en la reducción de la HbA1c después de 26 semanas (-1.06, [-1.65, 0.46]). La diferencia de tratamiento en la HbA1c fue del 1.3% después de 26 semanas adicionales de extensión en estudio de etiqueta abierta confirmando el control glucémico sostenido con VICTOZA®.
El perfil de eficacia y seguridad de VICTOZA® fue comparable al observado en la población adulta tratada con VICTOZA®.
Basados en el control glucémico adecuado o la tolerabilidad, el 30% de los sujetos del estudio se mantuvieron recibiendo una dosis de 0.6 mg y el 70% de los sujetos del estudio permanecieron en 1.2 mg o 1.8 mg.
Información clínica adicional: En un estudio abierto que comparó la eficacia y seguridad de VICTOZA® 1.8 mg con lixisenatida 20 mcg en 404 pacientes inadecuadamente controlados con metformina (HbA1c media de 8.4%), VICTOZA® fue superior a lixisenatida en la reducción de HbA1c después de 26 semanas de tratamiento (-1.83% vs. -1.21%, p < 0.0001). Significativamente más pacientes alcanzaron HbA1c por debajo del 7% con VICTOZA® en comparación con lixisenatida (74.2% vs. 45.5%, p < 0.0001), así como la HbA1c objetivo por debajo de o igual a 6.5% (54.6% vs. 26.2%, p < 0.0001). Se alcanzó una reducción significativamente mayor en glucosa plasmática en ayuno con VICTOZA® que con lixisenatida (-2.85 vs -1.70 mmol/L, p < 0.0001). Se observó pérdida de peso corporal en ambos brazos de tratamiento (-4.3 kg con VICTOZA® y -3.7 kg con lixisenatida). El perfil de seguridad de VICTOZA® y lixisenatida fue comparable en general. No se identificó nueva información de seguridad con VICTOZA®.
En un estudio comparando la eficacia y seguridad de VICTOZA® (1.2 mg y 1.8 mg) y sitagliptina (un inhibidor de DPP-4, 100 mg) en pacientes con un control inadecuado con terapia de metformina, VICTOZA® en ambas dosis fue superior al tratamiento con sitagliptina en la reducción de HbA1c después de 26 semanas (-1.24%, -1.50% vs. -0.90% p < 0.0001). Un número significativamente mayor de pacientes alcanzaron una HbA1c por debajo del 7% con VICTOZA® comparado con sitagliptina (43.7% y 56.0% vs. 22.0%, p < 0.0001). Los pacientes tratados con VICTOZA® presentaron una disminución significativa del peso corporal en comparación con aquellos tratados con la sitagliptina (-2.9 kg y -3.4 kg vs. -1.0 kg, p < 0.0001). Una mayor proporción de pacientes tratados con VICTOZA® presentaron náuseas contra los pacientes tratados con sitagliptina. Sin embargo, las náuseas eran transitorias. El rango de hipoglucemias menores no fue significativamente diferente entre el tratamiento con VICTOZA® y sitagliptina (0.178 y 0.161 vs. 0.106 episodios por sujeto al año). Las reducciones de HbA1c y la superioridad vs. sitagliptina se observa después de 26 semanas de tratamiento con VICTOZA® (1.2 mg y 1.8 mg) y se mantiene después de 52 semanas de tratamiento (-1.29% y -1.51% vs -0.88%, p < 0.0001). El cambio de los pacientes de sitagliptina a VICTOZA® después de 52 semanas de tratamiento resultó en una reducción adicional y estadísticamente significativa de la HbA1c (0.24% y 0.45%, IC 95%: 0.41 a 0.07 y -0.67 a 0.23) en la semana 78, pero no se disponía de un grupo control formal.
En un estudio que comparó la eficacia y seguridad de 1.8 mg de VICTOZA® y 10 μg de exenatida dos veces al día en pacientes controlados inadecuadamente con terapia con metformina y/o terapia con sulfonilurea, VICTOZA® fue superior al tratamiento con exenatida en la reducción de la HbA1c después de 26 semanas (-1.12% vs -0.79%, p < 0.0001). Un número significativamente mayor de pacientes consiguió una HbA1c por debajo de 7% con VICTOZA® en comparación con exenatida (54.2% vs 43.4%, p = 0.0015). Ambos tratamientos resultaron en una media de pérdida de peso corporal de aproximadamente 3 kg. En proporción, los pacientes reportaron menos náuseas con VICTOZA® que con exenatida. La tasa de hipoglucemias menores en el grupo de VICTOZA® fue significativamente menor que en el grupo de exenatida (1,932 vs. 2,600 eventos por sujeto al año, p = 0.01). El cambio de pacientes de exenatida a VICTOZA® después de 26 semanas de tratamiento, resultó en una reducción adicional en el HbA1c (-0.32%, p < 0.0001) en la semana 40 mientras que otro 13% de pacientes consiguió una reducción de la HbA1c por debajo de 7%.
VICTOZA® mejoró la sensibilidad a la insulina en comparación con la sulfonilurea por 52 semanas, determinada mediante evaluación de HOMA-IR (evaluación del modelo de homeostasis-índice de resistencia a la insulina.
La eficacia y seguridad de liraglutida (1.8 mg) se comparó con sulfonilurea (SU), ambas como adición a metformina durante el ayuno del ramadán en un estudio de etiqueta abierta de 33 semanas de duración. Los pacientes que cambiaron de SU a liraglutida tuvieron una reducción mayor en la HbA1c desde el inicio del estudio hasta el final del ramadán vs. aquellos que continuaron recibiendo SU (-1.24% vs -0.65% ETD (-0.59% [-0.79; -0.38] IC del 95%, p < 0.0001). El estudio incluyó un periodo de mantenimiento del tratamiento de 6 a 19 semanas antes de que los sujetos comenzaran el ayuno del ramadán. Los niveles de fructosamina fueron numéricamente menores al inicio del ramadán en el grupo de liraglutida (291.8 vs. 301.6 μmol/L) y se redujeron de manera similar con SU durante el ramadán (-12.8 vs. -16.4 μmol/L, p = 0.4311). No se informaron episodios hipoglucémicos severos durante el estudio. Durante el ramadán, se informaron episodios sintomáticos de hipoglucemia documentados en el 2% de los sujetos tratados con liraglutida (4 episodios) vs al 11% de los sujetos tratados con SU (30 episodios), p = 0.0009. El perfil de seguridad de liraglutida generalmente fue similar al observado en otros estudios realizados con liraglutida.
Resultados reportados por los pacientes: En un estudio clínico que comparó VICTOZA® con glimepirida en pacientes con diabetes tipo 2, la monoterapia diaria con 1.8 mg de VICTOZA® durante 52 semanas mejoró significativamente la calidad de vida relacionada con la salud general (p ≤ 0.02), definida por la salud mental y emocional combinadas, y la salud general percibida. La salud mental y emocional (p = 0.01) y el componente de subescalas de trastorno psicológico (p = 0.03) y bienestar psicológico (p = 0.01) mejoraron significativamente con una monoterapia diaria con 1.8 mg de VICTOZA® en comparación con glimepirida, así como la salud general percibida (p = 0.03).
El tratamiento con 1.2 mg o 1.8 mg diarios de VICTOZA® mejoró significativamente la preocupación por el peso, en comparación con glimepirida (p < 0.01), mientras que 1.8 mg diarios de VICTOZA® también mejoró de manera significativa la imagen relacionada con el peso (p < 0.01).
Los resultados de otro estudio clínico que comparó VICTOZA® 1.8 mg y 1.2 mg con glimepirida, ambos en combinación con metformina, mostraron que los pacientes tratados con VICTOZA® 1.8 mg en combinación tuvieron una frecuencia significativamente menor y dependiente de la dosis en la hiperglucemia percibida. VICTOZA® 1.2 mg y 1.8 mg, ambos en combinación con metformina, tuvieron una frecuencia significativamente menor de hiperglucemia que la metformina sola.
Todos los pacientes tratados con 0.6 mg, 1.2 mg y 1.8 mg de VICTOZA® en combinación con metformina experimentaron una frecuencia de hipoglucemia percibida significativamente menor en comparación con glimepirida en combinación con metformina.
En el estudio LEADER®, VICTOZA® redujo significativamente el deterioro en la calidad de vida reportada por los pacientes en comparación con placebo (medida por el índice EQ5D, al mes 36 el cambio desde ETD basal fue 0.018 [0.001; 0.035] y la puntuación VAS, ETD 1.302 [0.101; 2,504]) (véase la sección Farmacocinética y Farmacodinamia- Eficacia Clínica y datos de seguridad-Evaluación cardiovascular).
CONTRAINDICACIONES: Hipersensibilidad a liraglutida o alguno de los excipientes.
No se use en el embarazo ni la lactancia.
No se use en menores de 10 años.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: No existen datos adecuados sobre el uso de VICTOZA® en mujeres embarazadas. Estudios en animales han mostrado toxicidad reproductiva (ver sección Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).
El riesgo potencial para humanos es desconocido. VICTOZA® no debe de ser utilizado durante el embarazo y el uso de insulina es recomendado. Si una paciente desea quedar embarazada, o queda embarazada, el tratamiento con VICTOZA® debe descontinuarse.
Madres lactando/lactancia: No se sabe si liraglutida es secretada en la leche materna. Estudios en animales han mostrado que la transferencia de liraglutida y de metabolitos de relación estructural cercana a la leche es baja. Debido a la falta de experiencia, VICTOZA® no debe utilizarse durante la lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS:
Resumen del perfil de seguridad:
Las reacciones adversas reportadas con mayor frecuencia durante los estudios clínicos fueron los trastornos gastrointestinales: náuseas y diarrea fueron muy comunes, mientras que los eventos de vómito, estreñimiento, dolores abdominales y dispepsia fueron comunes.
Al inicio de la terapia con VICTOZA® estos eventos adversos gastrointestinales pueden ocurrir más frecuentemente; estas reacciones generalmente disminuyen dentro de pocos días o semanas de continuado el tratamiento. También fueron reportados de forma común dolor de cabeza e infección en el tracto respiratorio superior. Además, la hipoglucemia fue común, y muy común cuando VICTOZA® se utilizó en combinación con sulfonilurea, la hipoglucemia severa ha sido observada primordialmente cuando se combinó con sulfonilurea.
Tabla de reacciones adversas: La Tabla 3 incluye las reacciones adversas reportadas en los estudios controlados a largo plazo de fase 3a, el estudio LEADER® y reportes espontáneos (poscomercialización). La frecuencia para todos los eventos se ha calculado con base en su incidencia en los estudios clínicos de fase 3a.
Las reacciones se enlistan a continuación según los términos preferentes MedDRA por clasificación por órganos y sistemas y la frecuencia absoluta. Las frecuencias se define como: muy común (≥ 1/10), común (≥ 1/100 < 1/10), poco común (≥ 1/1,000 a < 1/100), raro (≥ 1/10,000 a < 1/1,000) y muy raro (< 1/10,000).
Tabla 3. Reacciones adversas reportadas en estudios controlados a largo plazo de fase 3a, en el estudio de resultados cardiovasculares a largo plazo (LEADER®) y en los reportes espontáneos (poscomercialización)
|
MedDRA Clasificación |
Muy común |
Común |
Poco común |
Raro |
Muy raro |
Frecuencia desconocida |
|---|---|---|---|---|---|---|
|
Infecciones e infestaciones |
Infección del tracto respiratorio superior |
|||||
|
Trastornos del sistema inmune |
Reacciones anafilácticas |
|||||
|
Trastornos del metabolismo y nutricionales |
Hipoglucemia Anorexia Apetito disminuido |
Deshidratación# |
||||
|
Trastornos del sistema nervioso |
Cefalea Mareo |
Disgeusia |
||||
|
Trastornos cardiacos |
Frecuencia cardiaca elevada |
|||||
|
Trastornos gastrointestinales |
Náusea Diarrea |
Vómitos Dispepsia Dolor abdominal superior Estreñimiento Gastritis Flatulencia Distensión abdominal Enfermedad de reflujo gastroesofágico Eructos |
Retraso en el vaciamiento gástrico |
Pancreatitis (incluyendo pancreatitis necrotizante) |
||
|
Trastornos hepatobiliares |
Colelitiasis Colecistitis |
|||||
|
Trastornos cutáneos y del tejido subcutáneo |
Sarpullido |
Urticaria Prurito |
Amiloidosis cutánea† |
|||
|
Trastornos renales y urinarios |
Insuficiencia renal# Insuficiencia renal aguda# |
|||||
|
Trastornos generales y condiciones en el sitio de administración |
Fatiga Reacciones en el sitio de inyección |
Malestar |
||||
|
Investigaciones |
Aumento de la lipasa** Aumento de la amilasa** |
N = 2,501 pacientes tratados con VICTOZA®.
* La frecuencia es muy común cuando se usa en combinación con insulina.
** De los estudios clínicos controlados de fase 3b y 4 sólo cuando éstos fueron medidos.
# Ver la sección Precauciones generales.
† RAM de fuentes posteriores a la comercialización.
Descripción de reacciones adversas seleccionadas:
Hipoglucemia: La mayor parte de episodios de hipoglucemia confirmados en estudios clínicos fueron menores.
No se observaron episodios de hipoglucemia grave en el estudio con VICTOZA® utilizado como monoterapia. Una hipoglucemia grave puede presentarse de manera poco común y ha sido observado principalmente cuando VICTOZA® se combina con sulfonilurea (0.02 eventos/sujeto-año). Muy pocos episodios (0.001 eventos/sujetos-año) fueron observados con la administración de VICTOZA® en combinación con una no sulfonilurea. En el estudio LEADER®, los episodios hipoglucémicos severos se reportaron a una tasa menor con liraglutida vs. placebo (1.0 vs 1.5 eventos por 100 años de exposición paciente, índice de la tasa estimada 0.69 [0.51 a 0.93]) (véase la sección: Farmacocinética y Farmacodinamia-Eficacia Clínica y datos de seguridad-evaluación cardiovascular).
En los pacientes tratados con premezcla de insulina al inicio del estudio y al menos durante las 26 semanas siguientes, la tasa de hipoglucemia grave tanto para liraglutida como para placebo fue de 2.2 eventos por 100 años de exposición-paciente.
Cuando la insulina detemir se adicionó a VICTOZA® 1.8 mg y metformina no se observaron episodios de hipoglucemia mayor. La tasa de episodios hipoglucemicos menores fueron de 0.228 eventos por sujeto-año. En los grupos de comparación tratados con VICTOZA® 1.8 mg y metformina, las tasas de eventos hipoglucémicos menores fueron de 0.034 y 0.115 eventos por año-sujeto, respectivamente.
La siguiente tabla presenta la incidencia como la proporción de pacientes que experimentaron al menos un episodio confirmado de hipoglucemia.
Tabla 4. Hipoglucemia en estudios clínicos controlados de largo plazo de VICTOZA® como monoterapia o combinaciones con medicamentos antidiabéticos orales
|
Número de episodios divididos por sujetos-año de exposición |
||
|
Monoterapia |
Liraglutida |
Placebo + sulfonilurea |
|
(52 semanas de estudio) |
0.27 |
1.70 |
|
Combinación con metformina |
Liraglutida + metformina |
Metformina + sulfonilurea |
|
(26 semanas de estudio) |
0.05 |
0.87 |
|
Combinación con sulfonilurea |
Liraglutida + sulfonilurea |
Sulfonilurea + tiazolidinediona |
|
(26 semanas de estudio) |
0.43 |
0.14 |
|
Combinación con metformina + tiazolidinediona |
Liraglutida + metformina + tiazolidinediona |
Placebo + metformina + tiazolidinediona |
|
(26 semanas de estudio) |
0.50 |
0.18 |
|
Combinación con metformina + sulfonilurea |
Liraglutida + metformina + sulfonilurea |
Insulina glargina + metformina + sulfonilurea |
|
(26 semanas de estudio) |
1.21 |
1.33 |
|
Combinación con iSGLT2 ± metformina |
Liraglutida + iSGLT2 ± metformina |
Placebo + iSGLT2 ± metformina |
|
0.05 |
0.06 |
|
|
Niños y adolescentes |
Liraglutida + metformina ± insulina |
Placebo + metformina ± insulina |
|
0.58 |
0.29 |
|
Eventos adversos gastrointestinales: La mayor parte de episodios de náuseas fueron de leves a moderados, transitorios y rara vez condujeron a la interrupción del tratamiento (Figura 7).
Figura 7. Porcentaje de pacientes con eventos adversos de náuseas por semana–Estudio a largo plazo.
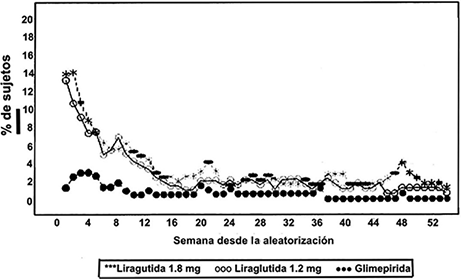
En pacientes tratados con VICTOZA® combinado con metformina, el 20.7% reportó por lo menos un episodio de náusea y en el 9.1% en combinación con sulfonilurea. En el 12.6% de los pacientes tratados con VICTOZA® se reportó al menos un episodio de diarrea en combinación con metformina y en el 7.9% en combinación con sulfonilurea.
La incidencia de retiros debido a eventos adversos fue de 7.8% para los pacientes tratados con VICTOZA® y 3.4% para los pacientes tratados con comparador en los estudios controlados a largo plazo (26 semanas o más). Los eventos adversos más comunes que resultaron en el retiro de pacientes tratados con VICTOZA® fueron náusea (2.8% de los pacientes) y vómito (1.5%).
Los pacientes de > 70 años pueden experimentar un mayor efecto gastrointestinal al tratamiento con VICTOZA®. Los pacientes con insuficiencia renal leve y moderada (depuración de creatinina 60-90 mL/min y 30-59 mL/min respectivamente) pueden experimentar mayores efectos gastrointestinales al tratamiento con VICTOZA®.
Colelitiasis y colecistitis: Se han reportado pocos casos de colelitiasis (0.4%) y colecistitis (0.1%) durante los estudios clínicos controlados de fase 3a a largo plazo con VICTOZA®. En el estudio LEADER®, la frecuencia de colelitiasis y colecistitis fue del 1.5% y 1.1% para liraglutida, y 1.1% y 0.7% para placebo, respectivamente (véase la sección: Farmacocinética y Farmacodinamia-Eficacia Clínica y datos de seguridad-Evaluación cardiovascular).
Trastornos de la piel y del tejido subcutáneo:
Se debe instruir a los pacientes para que realicen una rotación continua del lugar de inyección para reducir el riesgo de desarrollar amiloidosis cutánea. Puede haber un riesgo potencial de cambio en la absorción o el efecto de la liraglutida después de las inyecciones de liraglutida en sitios con amiloidosis cutánea.
Reacciones en el sitio de inyección:
La reacción en el sitio de inyección ha sido reportada en aproximadamente el 2% de los pacientes que recibieron VICTOZA® en estudios clínicos controlados a largo plazo (26 semanas o más). La mayoría de estas reacciones fueron leves.
Pancreatitis: Se han reportado pocos casos de pancreatitis aguda (< 0.2%) durante los estudios clínicos controlados de la fase 3 a largo plazo con VICTOZA®. También se reportó pancreatitis en el uso durante la comercialización. En el estudio LEADER®, la frecuencia de pancreatitis aguda confirmada por adjudicación fue del 0.4% para liraglutida y 0.5% para placebo, respectivamente (ver sección Farmacocinética y Farmacodinamia-Eficacia Clínica y datos de seguridad-Evaluación cardiovascular).
Reacciones alérgicas: Se han reportado reacciones alérgicas como urticaria, sarpullido y prurito en el uso durante la comercialización de VICTOZA®.
Se han reportado pocos casos de reacción anafiláctica con síntomas adicionales como hipotensión, palpitaciones, disnea y edema en el uso durante la comercialización de VICTOZA®.
Población pediátrica:
En general, la frecuencia, el tipo y la gravedad de las reacciones adversas en adolescentes y niños de 10 años o más fueron comparables a las observadas en la población adulta.
La tasa de episodios de hipoglucemia confirmada fue mayor con liraglutida (0.58 eventos/año paciente) en comparación con placebo (0.29 eventos/año paciente). No se produjeron episodios hipoglucémicos graves en el grupo de tratamiento con liraglutida.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los datos preclínicos no muestran riesgos especiales para los humanos con base en estudios convencionales de seguridad farmacológica, toxicidad a dosis repetidas o genotoxicidad.
Se observaron tumores de células C tiroideas no letales en estudios de carcinogenicidad de 2 años en ratas y ratones. En ratas, no se observó un nivel sin efecto adverso observable (NOAEL). Estos tumores no se observaron en monos tratados durante 20 meses. Estos hallazgos en roedores son causados por un mecanismo no genotóxico, mediado por un receptor de GLP-1 específico, al cual los roedores son particularmente sensibles. Es probable que la relevancia para los humanos sea baja pero no puede excluirse por completo. No se han encontrado otros tumores relacionados con el tratamiento.
Los estudios en animales no indicaron efectos dañinos directos con respecto a la fertilidad, pero aumentaron ligeramente las muertes embrionarias tempranas a la dosis más elevada. La dosificación con liraglutida a la mitad de la gestación causó una reducción en el peso materno y crecimiento fetal con efectos equívocos en las costillas de ratas y variación esquelética en el conejo. Se redujo el crecimiento neonatal en las ratas durante la exposición a liraglutida y persistió en el periodo posterior al destete en el grupo de dosis elevada. Se desconoce si estos efectos están relacionados con una ingesta calórica disminuida como un efecto directo de GLP-1.
Fertilidad: Además de una ligera disminución en el número de implantes vivos, los estudios en animales no indicaron efectos nocivos en relación con la fertilidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Evaluación in vitro de interacciones medicamento-medicamento: VICTOZA® ha mostrado muy bajo potencial para ser involucrado en interacción farmacocinética con otros principios activos relacionados con la unión al citocromo P450 (CYP) y a la unión a proteínas plasmáticas.
Evaluación in vivo de interacciones medicamento-medicamento: El pequeño retraso del vaciado gástrico con VICTOZA® puede influir en la absorción de los medicamentos orales administrados concomitantemente. Los estudios de interacción no mostraron ningún retraso clínicamente relevante en la absorción y, por lo tanto, no es necesario un ajuste de la dosis. Algunos pacientes tratados con VICTOZA® reportaron por lo menos un episodio de diarrea severa. La diarrea puede afectar la absorción de los medicamentos orales concomitantes.
Warfarina y otros derivados de la cumarina: No se han realizado estudios de interacción. No es posible excluir una interacción clínicamente relevante con principios activos con una solubilidad pobre o con un índice terapéutico estrecho, como la warfarina. Una vez que se inicie el tratamiento con VICTOZA® en pacientes tratados con warfarina u otros derivados de la cumarina, se recomienda un monitoreo más frecuente de la relación normalizada internacional (INR).
Paracetamol (acetaminofén): VICTOZA® no cambió la exposición general de paracetamol después de una dosis única de 1000 mg. La Cmáx del paracetamol fue disminuida en un 31% y la mediana del Tmáx fue retrasada por 15 min. No se requiere ajuste de dosis para usar concomitantemente con paracetamol.
Atorvastatina: VICTOZA® no cambió la exposición general de atorvastatina en un grado clínico relevante después de la administración de una dosis única de 40 mg de atorvastatina. Por lo tanto, no se requiere ajuste de dosis de atorvastatina cuando se administra con VICTOZA®. La Cmáx de atorvastatina fue disminuida en un 38% y la mediana del Tmáx fue retrasada de 1 a 3 h con VICTOZA®.
Griseofulvina: VICTOZA® no cambió la exposición general de griseofulvina después de la administración de una dosis única de 500 mg de griseofulvina. La Cmáx de griseofulvina aumentó en un 37% mientras que la mediana del Tmáx no cambió. No se requiere ajuste de dosis de griseofulvina y de otros componentes con solubilidad baja y permeabilidad alta.
Digoxina: La administración de una dosis única de 1 mg de digoxina con VICTOZA® mostró una reducción del ABC de digoxina del 16%, el Cmáx disminuyó en un 31%. La mediana del tiempo hasta la concentración máxima (Tmáx) de la digoxina se retrasó de 1 a 1.5 h. No se requiere ajuste de la dosis de digoxina con base en estos resultados.
Lisinopril: La administración de una dosis única de 20 mg de lisinopril con VICTOZA® mostró una reducción del ABC de lisinopril del 15%, la Cmáx disminuyó en un 27%. La mediana del Tmáx de Lisinopril fue retrasada de 6 a 8 h con VICTOZA®. No se requiere ningún ajuste de dosis de lisinopril con base en estos resultados.
Anticonceptivos orales: VICTOZA® disminuyó la Cmáx del etinilestradiol y levonorgestrel en un 12 y 13% respectivamente, después de la administración de una dosis única de un producto anticonceptivo oral. La Tmáx fue retrasada por 1.5 h con VICTOZA® para ambos componentes. No hubo efectos clínicos relevantes en la exposición total del etinilestradiol o del levonorgestrel. Por lo tanto, el efecto anticonceptivo se prevé no sea afectado cuando se coadministra con VICTOZA®.
Insulina: No se observaron interacciones farmacocinéticas ni farmacodinámicas entre VICTOZA® e insulina detemir al momento de administrar una dosis única de 0.5 U/kg de insulina detemir con VICTOZA® 1.8 mg en estado estacionario en pacientes con diabetes tipo 2.
Población pediátrica:
Solamente se realizaron estudios de interacción en adultos.
Incompatibilidades: Las sustancias adicionadas a VICTOZA® pueden provocar la degradación de Liraglutida. VICTOZA® no debe mezclarse con otros medicamentos, p. ej., soluciones para infusión.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: VICTOZA® está asociada con aumentos promedio en enzimas pancreáticas, lipasa y amilasa de hasta un 38 y 21% respectivamente (ver sección Precauciones generales). En ausencia de otros signos y síntomas de pancreatitis aguda, las elevaciones de las enzimas pancreáticas por sí solas no son predictivas de pancreatitis aguda.
PRECAUCIONES GENERALES: VICTOZA® no debe utilizarse en pacientes con diabetes mellitus tipo 1 o para el tratamiento de la cetoacidosis diabética.
VICTOZA® no es un sustituto de la insulina.
No hay experiencia terapéutica en pacientes con insuficiencia cardiaca congestiva clase IV según la Asociación de Cardiología de Nueva York (NYHA) y, por lo tanto, VICTOZA® no se recomienda para el uso en estos pacientes.
Hay experiencia limitada en pacientes con enfermedad inflamatoria intestinal y gastroparesia diabética. No se recomienda el uso de VICTOZA® en estos pacientes, ya que se asocia con reacciones adversas gastrointestinales transitorias, incluyendo náuseas, vómito y diarrea.
Pancreatitis aguda: Se ha observado pancreatitis aguda con el uso de agonistas del receptor GLP-1. Se debe informar a los pacientes sobre los síntomas característicos de pancreatitis aguda. Si se sospecha de pancreatitis, liraglutida debe suspenderse, si se confirma pancreatitis aguda, liraglutida no debe reiniciarse. En ausencia de otros signos y síntomas de la pancreatitis aguda, las elevaciones de las enzimas pancreaticas por sí solas no son predictivas de pancreatitis aguda.
Enfermedad tiroidea: Se han reportado en estudios clínicos eventos adversos tiroideos, tales como bocio, en particular en pacientes con enfermedad tiroidea preexistente. Por lo tanto, VICTOZA®debe utilizarse con precaución en estos pacientes.
Hipoglucemia: Los pacientes que reciben VICTOZA® en combinación con una sulfonilurea o una insulina pueden tener un aumento de riesgo de hipoglucemia. Puede disminuirse el riesgo de hipoglucemia mediante la reducción de la dosis de sulfonilurea o de la dosis de insulina.
Deshidratación: Se han reportado signos y síntomas de deshidratación, incluyendo insuficiencia renal e insuficiencia renal aguda en pacientes tratados con VICTOZA®. Se debe orientar a los pacientes tratados con VICTOZA® del riesgo potencial de deshidratación relacionada con efectos secundarios gastrointestinales y a que tomen precauciones para evitar la pérdida de líquidos.
Efectos sobre la capacidad para conducir y operar máquinas: No se han realizados estudios sobre los efectos sobre la capacidad para conducir y operar máquinas. Es poco probable que la capacidad para conducir o utilizar máquinas sea alterada por VICTOZA®. Se debe advertir a los pacientes que tomen precauciones para evitar la hipoglucemia mientras conducen y utilizan máquinas, en particular cuando se utiliza VICTOZA® en combinación con una sulfonilurea o una insulina.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Inyección subcutánea.
Dosis: Para mejorar la tolerabilidad gastrointestinal, la dosis inicial de VICTOZA® es de 0.6 mg diariamente. Después de al menos una semana, la dosis debe aumentarse a 1.2 mg. Se espera que algunos pacientes se beneficien de un aumento en la dosis de 1.2 mg a 1.8 mg y con base en la respuesta clínica, después de al menos una semana puede aumentarse la dosis a 1.8 mg para un mejor control glucémico. La dosis diaria mayor a 1.8 mg no es recomendable.
VICTOZA® puede administrarse en combinación con otros agentes hipoglucemiantes y no es necesario ajustar la dosis para metformina, tiazolidinediona o iSGLT2.
Cuando se agrega VICTOZA® a una terapia con sulfonilurea o insulina se debe considerar una reducción de la dosis de sulfonilurea o insulina para reducir el riesgo de hipoglucemia (véase Precauciones generales).
El automonitoreo de glucosa en sangre no es necesario para ajustar la dosis de VICTOZA®. Sin embargo, cuando se inicia el tratamiento con VICTOZA® en combinación con sulfonilurea o insulina, el automonitoreo de la glucosa en sangre puede ser necesario para ajustar la dosis de sulfonilurea o insulina.
No se requiere ajuste de dosis durante el ramadán cuando liraglutida es adicionado a metformina para el tratamiento de diabetes mellitus tipo 2 (ver sección Farmacocinética y Farmacodinamia-Información clínica adicional). Se recomienda finalizar la escalación de dosis de liraglutida antes que los pacientes comiencen con el ayuno del ramadán.
Poblaciones especiales:
Adultos mayores (> 65 años de edad): No se requiere el ajuste de dosis con base a la edad (véase Farmacocinética).
Pacientes con insuficiencia renal: No se requiere el ajuste de dosis para pacientes con insuficiencia renal leve, moderada o severa. No se cuenta con experiencia terapéutica en pacientes con insuficiencia renal en fase terminal y por lo tanto no se recomienda el uso de VICTOZA® en estos pacientes (véase Farmacocinética).
Pacientes con insuficiencia hepática: No se requiere de ajuste de dosis en pacientes con insuficiencia hepática (véase Farmacocinética).
Niños y adolescentes: No se requiere ajuste de dosis en adolescentes y niños de 10 años o más. No existen datos disponibles para niños menores de 10 años de edad.
Método de administración: VICTOZA® se administra una vez al día a cualquier hora, independientemente de las comidas y puede inyectarse por vía subcutánea en el abdomen, en el muslo o en la parte superior del brazo. Siempre se deben rotar los lugares de la inyección dentro de la misma zona para reducir el riesgo de amiloidosis cutánea (véase la sección Reacciones secundarias y adversas). El sitio de inyección y hora pueden cambiarse sin ajuste de la dosis. Sin embargo, es preferible inyectar VICTOZA® aproximadamente a la misma hora del día, cuando se haya elegido la hora más conveniente del día. Para mayores instrucciones sobre la administración, (véase Recomendaciones sobre almacenamiento).
VICTOZA® no debe administrarse por vía intravenosa o intramuscular.
Dosis omitida: En caso de omitir una dosis, VICTOZA® debe administrarse tan pronto como sea posible dentro de un plazo de 12 horas desde el momento de la dosis prevista.
Si se omite la dosis durante más de 12 horas, VICTOZA® debe administrarse al día siguiente, según lo previsto.
No debe administrarse una dosis extra o incrementar la dosis de VICTOZA® el día siguiente para compensar la dosis omitida.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Durante los estudios clínicos y su uso durante la comercialización se han reportado sobredosis de hasta 40 veces la dosis de mantenimiento recomendada (72 mg). Se ha reportado un caso de una sobredosis de 10 veces (18 mg diarios) administrada por 7 meses. Generalmente, los pacientes reportaron náusea, vómito y diarrea severos, pero se recuperaron sin complicaciones. Se han observado casos de hipoglucemia severa.
En caso de sobredosis,se debe iniciar un tratamiento complementario apropiado deberá iniciarse de acuerdo a los signos clínicos y síntomas del paciente. Se debe observar al paciente para detectar signos clínicos de deshidratación y se deben controlar los niveles de glucosa en sangre.
PRESENTACIONES:
Caja con 1, 2, 3 o 10 pluma(s) precargada(s), cada una con un cartucho con 3 mL. Cada pluma de VICTOZA® contiene 3 mL de solución, liberando 30 dosis de 0.6 mg de liraglutida, 15 dosis de 1.2 mg de liraglutida o 10 dosis de 1.8 mg de liraglutida.
Pluma precargada con cartucho vidrio tipo I.
Puede que no todas las presentaciones se comercialicen.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Almacenar en refrigeración (2 a 8 °C). No almacenar en el congelador o directamente en el enfriador del refrigerador. No congele VICTOZA® y no utilice VICTOZA® si ha sido congelado.
Después del primer uso de la pluma de VICTOZA®, el producto puede almacenarse por 1 mes a una temperatura no mayor de 30 °C o en refrigeración (2 a 8 °C). No congelar.
Si después de un mes de uso todavía queda producto en la pluma, deberá desecharlo.
Mantener la tapa de la pluma puesta cuando la pluma de VICTOZA® no se utilice con el fin de proteger de la luz.
VICTOZA® debe protegerse del calor excesivo y de la luz solar.
La pluma de VICTOZA® es para uso individual.
VICTOZA® no debe utilizarse si no tiene una apariencia clara e incolora o casi incolora.
VICTOZA® no debe utilizarse si se ha congelado.
VICTOZA® se puede administrar con agujas de una longitud hasta de 8 mm y un grosor de 32 G. La pluma está diseñada para utilizarse con agujas desechables NovoFine®.
Siempre retirar la aguja de inyección después de cada inyección y almacenar la pluma de VICTOZA® sin aguja. Esto previene contaminación, infección y fugas. Esto también asegura que la dosificación sea exacta.
El paciente debe ser instruido para desechar la aguja de inyección después de cada inyección de acuerdo con los requerimientos locales después de cada inyección y almacenar la pluma VICTOZA® sin una aguja de inyección puesta. Esto previene la contaminación, infección y fuga. También garantiza que la dosificación sea exacta.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. No se use en menores de 10 años. No use VICTOZA® durante el embarazo y la lactancia. Literatura exclusiva para médicos. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. No se administre si el cierre ha sido violado.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
Titular del registro sanitario:
Novo Nordisk A/S
Novo Allé, Bagsvaerd, 2880, Dinamarca
Representante legal:
NOVO NORDISK MÉXICO, S.A. de C.V.
Homero Núm. 1500, piso 3,
Col. Polanco Chapultepec
C.P. 11560, Miguel Hidalgo
Ciudad de México, México
Reg. Núm. 225M2009, SSA IV