
VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
INTERPRETACIÓN DE LAS TINCIONES Y RESULTADOS PREVISTOS:
El patrón de tinción celular del ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL es nuclear.
Un anatomopatólogo cualificado con experiencia en la interpretación con microscopio de muestras anatomopatológicas, en procedimientos de ISH y en el reconocimiento de copias sencillas y amplificadas de HER2 y Cromosoma 17 (Chr17) (para el que es necesario un examen mediante microscopio con objetivos de 20x, 40x o 60x) debe evaluar los controles antes de interpretar los resultados.
Nota: No se recomienda el uso de objetivos 100x. Todas las lecturas de los portaobjetos de tejido que se llevaron a cabo durante la verificación del diseño y las pruebas de validación se realizaron con objetivos 20x, 40x y/o 60x.
El ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL debe usarse junto con la Guía de interpretación de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL [N/P 1018386] para la evaluación de los portaobjetos.
En las secciones siguientes, se describe cómo interpretar y asignar una puntuación a los portaobjetos. En la Tabla 4, se ilustra la forma de contar las señales discretas.
Definiciones:
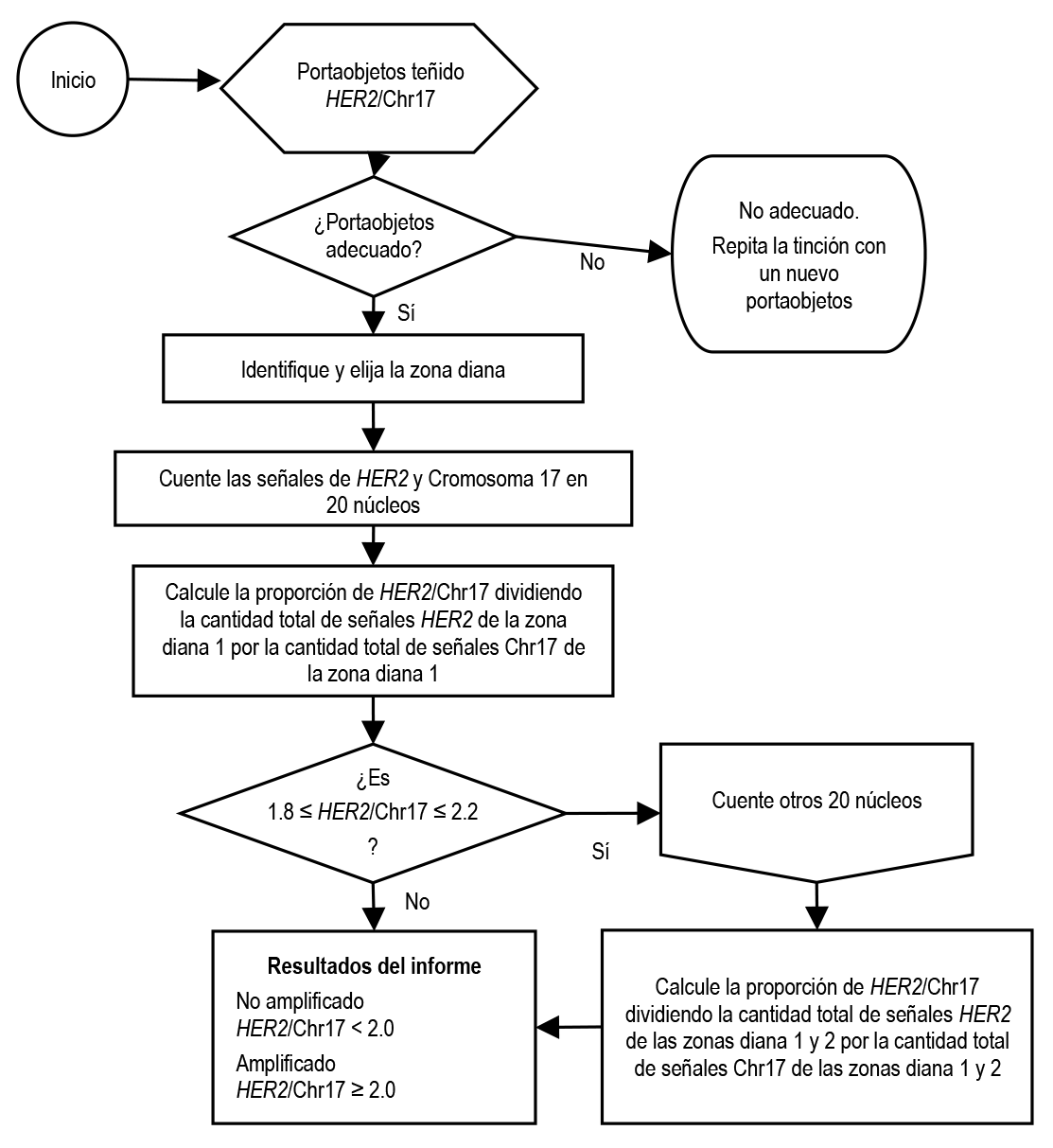
1. Estado del gen HER2. El estado del gen HER2 es una función de la proporción del número de copias del gen HER2 con respecto al número de copias de Chr17 por célula en un caso de carcinoma de mama invasivo o GEA. El estado del gen HER2 se clasifica mediante las siguientes pautas:
a. Proporción HER2/Chr17 ≥ 2.0, existe amplificación.
b. Proporción HER2/Chr17 < 2.0, no existe amplificación.
2. Idoneidad de los portaobjetos. Los portaobjetos de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL deben cumplir tres criterios para considerarse idóneos para la enumeración; si el portaobjetos no cumple estos criterios, no se podrá enumerar y los resultados serán deficientes.
a. Control positivo interno. Las señales normales de HER2 y de Chr17 (de 1 a 2 copias por célula) actúan como controles positivos internos y deben ser visibles en las muestras. Puede localizarse tinción nuclear en varias células no neoplásicas, entre otras: fibroblastos estromales, células endoteliales, linfocitos y células epiteliales no neoplásicas.
b. Células neoplásicas. Con los objetivos 20x, 40x y 60x, el aspecto invasivo del tumor debe presentar un campo enumerable de señales de plata y de Red ISH.
c. Fondo. La tinción de fondo que resulta de cualquiera de los sistemas de detección de señales, de plata o de Red ISH, debe evaluarse para determinar si interfiere en la enumeración de las señales de plata y de Red ISH. El fondo SISH normalmente se presenta como «polvo» SISH que puede distinguirse de la señal específica. El fondo Red puede aparecer en forma de bruma roja o, en contadas ocasiones, como señales no específicas cuya intensidad es más tenue que la de la señal específica.
3. Zonas diana para la enumeración de señal. Una zona diana aceptable en el carcinoma invasivo presenta un campo enumerable de señales SISH y de Red ISH. La enumeración de las señales no debería llevarse a cabo en zonas que contengan señales SISH o de Red ISH débiles, comprimidas o que se solapen con el núcleo o en necrosis. Si una de las zonas diana se considera inadecuada para la enumeración, suele ser posible encontrar otras zonas diana dentro del mismo portaobjetos que sí sean adecuadas. Esto se puede determinar mediante la presencia de células normales que presenten una tinción adecuada de SISH o Red ISH en la zona diana o la región adyacente.
Observaciones adicionales sobre HER2 y Cromosoma 17:
Es posible anotar otras observaciones en forma de comentarios en el informe del anatomopatólogo.
1. Heterogeneidad: En algunos casos, el tejido puede contener zonas del carcinoma que sean genéticamente heterogéneas en el número de copias de HER2 (es decir, puede existir una combinación de núcleos no amplificados y amplificados o una mezcla de núcleos que contengan varias copias de HER2). Esto se puede observar entre las células del carcinoma dentro de la zona diana en sí o entre dos zonas diana diferentes.
2. La aneusomía es una condición en la que un organismo contiene más o menos cromosomas específicos de lo normal, p. ej., cuando el número de un cromosoma en concreto (en este caso, Chromosome 17) no es diploide. En la polisomía, puede haber tres o más copias del cromosoma en lugar de las dos copias esperadas. En cuanto a la monosomía, las células tumorales pueden presentar una sola copia de Chromosome 17. Se han detectado casos de «amplificación» aparente, presencia de grupos o polisomía del Cromosoma 17 (con o sin grupos SISH de HER2).27 En los casos en los que se presentan grupos de HER2 y Cromosoma 17, es preciso cerciorarse de que no se los considere con una proporción ~ 1.0. El lector debe consultar los resultados de inmunohistoquímica (IHC) de los análisis de sobreexpresión de proteína HER2 en estos casos, ya que la mayoría tiende a ser 3+.
3. Deleción monoalélica: La eliminación del gen HER2 del Cromosoma 17 en las células tumorales da lugar a una proporción HER2/Chr17 < 1.0.
Visualización de la señal:
Las señales SISH y de Red ISH se visualizan de la siguiente forma:
1. Copia sencilla. Un punto negro discreto (SISH) se cuenta como una copia sencilla de HER2. Los puntos únicos discretos que se visualizan en los núcleos internos de control (no neoplásicos) reflejan el tamaño de una copia sencilla en las células de carcinoma invasivo de la señal (negra) de plata. En cuanto a las señales de Red ISH, cada señal discreta se cuenta como una copia. Hay que tener en cuenta que la señal de Red ISH de Chr17 puede presentar un tamaño superior al de las señales de plata y, en ocasiones, con una forma más alargada. Es posible que se produzca una bruma rosa que no debe confundirse con una señal. Las señales Red con un color muy poco intenso en comparación con la señal de los núcleos del control positivo interno y el patrón general de la tinción no se deberían enumerar, ya que podrían no ser específicas. Las señales rojas específicas tienen bordes discretos, tal y como se muestra en la Tabla 4.
2. Varias copias. Las señales de plata únicas discretas que se observan en los núcleos del control positivo interno reflejan el tamaño de una copia sencilla de HER2 en células de carcinoma invasivo. El tamaño de las señales de plata únicas se utiliza como referencia para determinar el número relativo de copias amplificadas en el núcleo de células tumorales. En cuanto a las señales de Red ISH, cada señal discreta se cuenta como una copia.
3. Grupos. Presencia de varias señales que se solapan en el núcleo y que no se pueden enumerar. El clúster se define como una gran cantidad de señales de plata que se solapan en el núcleo y que no se pueden diferenciar de forma independiente. Únicamente el lector puede calcular los grupos de HER2. Por ejemplo, se puede estimar que un clúster de gran tamaño de varias señales de plata contiene 12 copias, mientras que los grupos más pequeños se estima que contienen 6 copias. Esta estimación se puede realizar mediante las copias sencillas de SISH presentes en las células de control positivo interno como referencia. La presencia de grupos de HER2 se indica en la hoja de puntuación.
4 Los núcleos solapados, los núcleos con presencia de un solo color y las muestras con tinción no específica no se deberían enumerar. Cualquier núcleo en el que se solapen las señales de plata y las señales Red ISH y en el que sea imposible diferenciarlas debe visualizarse con más aumentos para tratar de distinguir las dos señales o, de lo contrario, no deberían contarse. Los núcleos que presentan burbujeo no deberían contarse.
Enumeración de las señales de SISH y Red ISH para determinar el estado del gen HER2:
Examine el portaobjetos con tinción de H y E para localizar las zonas que contienen carcinoma de mama o gastroesofágico invasivos. Examine el portaobjetos con tinción HER2 Dual ISH que corresponde a H y E e identifique la zona diana del carcinoma de mama invasivo o gastroesofágico. Antes de enumerar las señales de HER2 y Cromosoma 17 para determinar el estado del gen HER2, es fundamental establecer si la zona diana invasiva (el tejido lesional) se ha teñido adecuadamente y cumple con los criterios que se describen en la idoneidad de los portaobjetos (consulte la sección Definiciones más arriba, Idoneidad de los portaobjetos).
El algoritmo de puntuación que se ha desarrollado para el ensayo aumenta al máximo la precisión y la eficacia del recuento. Se deberían enumerar 20 núcleos que contengan señales rojas (Red ISH) y negras (SISH).
Criterios de selección celular:
Únicamente se deben contar los núcleos cuyo diámetro sea representativo de la población media de los núcleos de carcinoma invasivo en la zona diana. No tenga en cuenta las señales en los núcleos cuyo diámetro sea:
1. Mucho mayor que el tamaño medio de los núcleos del carcinoma
2. Mucho menor que el tamaño medio de los núcleos del carcinoma
Cuente únicamente los núcleos que sean representativos de la población de núcleos del carcinoma invasivo con la cantidad promedio más alta de señales (tanto SISH como Red ISH).
En zonas diana genéticamente heterogéneas respecto al número de copias de HER2, cuente únicamente los núcleos que sean representativos de la población de núcleos del carcinoma invasivo con la cantidad promedio más alta de señales (tanto SISH como Red ISH). Tenga en cuenta que la heterogeneidad está presente en la hoja de puntuación.
Tabla 4. Visualización de la señal
|
|
No cuente el solapamiento de núcleos. |
|
|
No tenga en cuenta los núcleos que no presentan señal. |
|
|
No tenga en cuenta los núcleos que presentan señal de un solo color. |
|
|
No cuente los núcleos si la señal se encuentra en el exterior de éstos. |
|
|
Cuente 1 señal negra (HER2) y 1 señal roja (Chr17). |
|
|
Cuente 2 señales negras (HER2) y 2 señales rojas (Chr17). |
|
|
Cuente 1 señal negra (HER2) y 2 señales rojas (Chr17). La señal negra es «doble». Cuente dos señales adyacentes del mismo color únicamente si la distancia entre ellas es igual o mayor que la del diámetro de una sola señal. |
|
|
Los grupos pequeños de SISH únicamente se deben calcular mediante el tamaño de una sola señal como referencia. Con las células estromales puede estimar el tamaño de la señal (célula más pequeña). De hecho, en este grupo se podría estimar la presencia de 6 señales SISH; si se añaden las otras 2 señales sencillas, el recuento total es de 8. Cuente 2 señales rojas. Anote en la hoja de puntuación que hay presencia de grupos de HER2. |
|
|
Calcule el grupo grande. En este grupo se podría estimar la presencia de 12 señales negras; si se añaden las otras 4 señales sencillas, el recuento total es de 16. Cuente las señales rojas como 2 copias de Chr17. Anote en la hoja de puntuación que hay presencia de grupos de HER2. |
|
|
Una señal roja cerca de otra negra se debería contar como una señal roja y otra negra. Es posible que sea necesario recurrir a un objetivo de 60x para diferenciarlas. Por lo tanto, cuente 4 señales negras (HER2) y 2 señales rojas (Chr17). Si las señales se solapan y no se pueden diferenciar, no cuente los núcleos. |
|
|
Grupo de puntos negros que oscurecen las señales rojas. Es posible utilizar un mayor aumento (60x) si se quiere confirmar la presencia o la ausencia de señales rojas; de lo contrario, no se deberían contar: Cuente siempre los núcleos que contienen señales rojas claras. Anote la presencia de grupos SISH en la hoja de la puntuación. Los núcleos que contienen señal roja visible y en mayores cantidades deberían puntuarse en los núcleos que contengan grupos SISH. |
|
|
Si se produce «polvo» SISH en los núcleos, cuente estos únicamente si las señales SISH específicas se pueden distinguir con claridad del fondo. |
|
|
Es posible que se observe una bruma rosa que no debe confundirse con una señal. Es posible que se observen señales Red ISH pequeñas y con un color más claro que podrían representar uniones no específicas de la sonda Chr17 a otros cromosomas. En la imagen se muestran 2 señales rojas discretas (Chr17) y 2 señales negras (HER2). |
Estado del gen HER2: Algoritmo de puntuación para VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL:
Se deben enumerar veinte núcleos (cada uno con señales rojas (Chr17) y negras (HER2)). Los resultados finales del estado de HER2 se emiten en función de la proporción calculada al dividir la suma de señales de HER2 de los 20 núcleos por la suma de las señales Cromosoma 17 de los 20 núcleos. El estado de amplificación se establece como Amplificado si la proporción HER2/Chr17 es ≥ 2.0 y como No amplificado si la proporción HER2/Chr17 es < 2.0. Si la proporción HER2/Chr17 se encuentra entre 1.8 y 2.2, deberán enumerarse otros 20 núcleos. Se debería formular una nueva proporción en función de los 40 núcleos y emitir el estado de amplificación de acuerdo con el procedimiento descrito anteriormente.
Controles:
Las células normales que se encuentran en la zona diana o adyacentes a ella sirven como controles internos de la tinción. Para considerar la zona diana adecuada para el recuento, al menos un 50% de los núcleos de células normales deberían contener, como mínimo, una señal de plata y por lo menos un 50% deberían contener, como mínimo, una señal Red ISH (las señales de plata y de Red ISH no tienen que estar necesariamente en las mismas células). El hecho de que no se detecte una señal adecuada en las células normales de ningún portaobjetos de la sesión indica que el portaobjetos en concreto no es adecuado para la enumeración. El uso de muestras de control positivo o de portaobjetos con xenoinjertos contribuye a la resolución de los posibles problemas del instrumento o de los reactivos.
RESOLUCIÓN DE PROBLEMAS:
Tabla 29. Soluciones para la resolución de problemas
|
Problema |
Solución |
|---|---|
|
Tinción SISH débil o ausente |
1. Compruebe que los dispensadores del reactivo funcionan correctamente (p. ej., que no se encuentran obstruidos o vacíos) y que se han llenado los fluidos. Revise la cámara de cebado del dispensador de reactivo para ver si hay meniscos, partículas o cuerpos extraños, tales como fibras o precipitados. Si se ha bloqueado el dispensador, no lo utilice y póngase en contacto con el representante local de asistencia técnica de Roche. En caso contrario, vuelva a cebar el dispensador colocándolo sobre el recipiente de residuos, retirando el tapón de la boquilla y presionando hacia abajo la parte superior del dispensador. Si la tinción continúa siendo débil o sigue sin presentarse, lleve a cabo el paso 2 que aparece a continuación. 2. Compruebe que el tipo de fijación, el tiempo y el grosor de la sección son los adecuados para los ensayos de ISH. 3. Asegúrese de utilizar medios de montaje compatibles con SISH (consulte la Tabla 30) para preservar las señales de plata. Si la tinción continúa siendo débil o sigue sin presentarse, lleve a cabo el paso 4 que aparece a continuación. 4. Aumente el tiempo de CC1 a > 16 minutos. 5. Aumente el tiempo de CC2 a > 16 minutos para el carcinoma gástrico/GEA o a > 24 minutos para el carcinoma de mama. 6. Aumente el tiempo de ISH Protease 3 a > 16 minutos para el carcinoma gástrico o a > 20 minutos para el carcinoma de mama si la morfología del núcleo está intacta. |
|
Ausencia de tinción Red ISH o tinción débil |
1. Compruebe que los dispensadores del reactivo funcionan correctamente (p. ej., que no se encuentran obstruidos o vacíos) y que se han llenado los fluidos. Si la tinción continúa siendo débil o sigue sin presentarse, lleve a cabo el paso 2 que aparece a continuación. 2. Compruebe que no se han empleado los baños de alcohol o los lavados de xileno prolongados para deshidratar los portaobjetos teñidos, ya que hacerlo degrada las señales Red ISH. Si la tinción continúa siendo débil o sigue sin presentarse, lleve a cabo el paso 3 que aparece a continuación. 3. Compruebe que el tipo de fijación, el tiempo y el grosor de la sección son los adecuados para los ensayos de ISH. 4. Aumente el tiempo de CC1 a > 16 minutos. 5. Aumente el tiempo de CC2 a > 16 minutos para el carcinoma gástrico o a > 24 minutos para el carcinoma de mama. 6. Aumente el tiempo de ISH Protease 3 a > 16 minutos para el carcinoma gástrico o a > 20 minutos para el carcinoma de mama si la morfología del núcleo está intacta. |
|
Fondo Red ISH inespecífico |
1. Compruebe que se han utilizado portaobjetos con carga positiva y que las muestras se han fijado y cortado de la forma adecuada para los ensayos de ISH. 2. Si es posible distinguir el fondo Red ISH de la señal Red ISH específica, enumere el portaobjetos pero no tenga en cuenta las señales Red ISH no específicas. 3. Si el fondo Red ISH del núcleo interfiere con la enumeración, repita la tinción con una temperatura de lavado de restricción de 76 o 78 °C. La reducción del tiempo de tratamiento con acondicionamiento celular o con proteasa también atenúa el fondo rojo. |
|
Fondo SISH inespecífico |
1. Compruebe que se han utilizado portaobjetos con carga positiva y que las muestras se han fijado y cortado de la forma adecuada para los ensayos de ISH. 2. Si es posible distinguir el fondo SISH de las señales SISH específicas, enumere el portaobjetos pero no tenga en cuenta las señales no específicas. 3. Si el fondo SISH del núcleo interfiere con la enumeración, repita la tinción con una reducción del tratamiento con proteasa o un tiempo menor de acondicionamiento celular. |
|
Precipitación |
1. Si un artefacto procedente de la precipitación interfiere con la enumeración, repita la tinción. Si es posible distinguir el fondo SISH de las señales SISH específicas, enumere el portaobjetos, pero no tenga en cuenta las señales no específicas. 2. Compruebe que las etiquetas de código de barras del portaobjetos están centradas y se han aplicado al portaobjetos de vidrio sin dejar salientes. No ponga dos etiquetas ni vuelva a poner etiquetas de código de barras utilizadas. |
|
Burbujeo |
1. Si las burbujas interfieren con la enumeración, asegúrese de que tanto los procedimientos previos al análisis como el grosor de corte de la muestra se han llevado a cabo según las recomendaciones. |
|
El tejido se pierde en el portaobjetos. |
1. Asegúrese de que se utilizan portaobjetos con carga positiva. |
Tabla 30. Compatibilidad de los medios de montaje con los ensayos de SISH
|
Medios de montaje |
Fabricante |
Tipo (xileno, alcohol, acuoso) |
Compatibilidad con SISH |
|---|---|---|---|
|
Entellan |
Merck |
Xileno |
No |
|
Entellan New |
Merck |
Xileno |
No |
|
Eukitt |
EMS |
Xileno |
No |
|
HSR |
Sysmex |
Xileno |
No |
|
Malinol |
Muto Chemical |
Xileno |
No |
|
Acrytol |
SurgiPath |
Xileno |
Sí |
|
Alcolmount |
Diapath |
Alcohol |
Sí |
|
BioMount 2 |
BBInternational |
Xileno |
Sí |
|
Cytoseal 60 |
Richard Allan Scientific |
Xileno |
Sí |
|
Cytoseal XYL |
Richard Allan Scientific |
Xileno |
Sí |
|
Diamount |
Diapath |
Xileno |
Sí |
|
DPX |
BDH: Raymond Lamb |
Xileno |
Sí |
|
FloTexx |
Lerner Labs |
Xileno |
Sí |
|
Gel Mount |
Biomeda |
Acuoso |
Sí |
|
Histomount |
Raymond Lamb |
Xileno |
Sí |
|
MicroMount |
SurgiPath |
Xileno |
Sí |
|
MM24 |
SurgiPath |
Xileno |
Sí |
|
Mountex |
Histolab |
Xileno |
Sí |
|
MountQuick |
Daido Sangyo Co. |
Acuoso |
Sí |
|
Paramount |
Protaqs Quartett: Dako |
Xileno |
Sí |
|
Permount |
Fisher |
Xileno |
Sí |
|
Pertex |
Cell Path |
Xileno |
Sí |
|
Shandon Consul mount |
Thermo Scientific |
Xileno |
Sí |
|
Softmount |
WAKO |
Lemasol A |
Sí |
|
SureMount |
Triangle Biomedical Sciences |
Xileno |
Sí |
|
Thermo EZ Mount |
Thermo Scientific |
Xileno |
Sí |
|
Ultramount |
Dako |
Xileno |
Sí |
ALMACENAMIENTO Y ESTABILIDAD:
Tras la recepción y cuando no se utilice, consérvese de 2-8 °C. No lo congele.
Para garantizar una dispensación adecuada del reactivo y la estabilidad de la sonda, vuelva a poner el tapón del dispensador después de cada uso y almacene inmediatamente el dispensador en el refrigerador, en posición vertical.
Todos los dispensadores de sondas tienen una fecha de caducidad. Si se almacena correctamente, el reactivo se mantendrá estable hasta la fecha indicada en la etiqueta. No usar el reactivo después de la fecha de caducidad.
ADVERTENCIAS Y PRECAUCIONES:
1. Para uso diagnóstico in vitro (IVD).
2. Sólo para uso profesional.
3. No utilizar por encima del número especificado de ensayos.
4. Advertencia: el producto contiene formamida. La formamida es una sustancia química tóxica cuando se inhala y moderadamente tóxica cuando se ingiere. Tiene la capacidad de irritar la piel, los ojos y las membranas mucosas y se absorbe a través de la piel. Puede ocasionar daños en el feto. Adopte las precauciones oportunas cuando manipule los reactivos. Utilice guantes y póngase el equipo de protección personal cuando vaya a manipular material tóxico y sustancias posiblemente carcinógenas.
5. Los materiales de origen animal o humano deben manipularse como materiales potencialmente biopeligrosos y eliminarse con las precauciones adecuadas. En caso de exposición, deberán seguirse las directivas sanitarias de las autoridades responsables.23,24
6. Evite el contacto de los reactivos con los ojos y las membranas mucosas. Si los reactivos entran en contacto con zonas sensibles, lávelas con agua abundante. Evite la inhalación de los reactivos.
7. Asegúrese de que el recipiente de residuos está vacío antes de comenzar una sesión con el instrumento. Si no toma estas precauciones, el recipiente de residuos puede llegar a rebosar y el usuario corre el riesgo de resbalar y caerse.
8. Evite la contaminación microbiana de los reactivos, dado que podría producir a resultados incorrectos.
9. Para obtener más información sobre el uso de este producto, consulte el Manual del usuario del instrumento BenchMark IHC/ISH y las instrucciones de uso de todos los componentes necesarios que puede encontrar en navifyportal.roche.com.
10. Consulte a las autoridades locales o nacionales para conocer el método de eliminación recomendado.
11. El etiquetado de seguridad de los productos sigue principalmente las directrices del SGA de la UE. Está disponible bajo petición la hoja de datos de seguridad para los usuarios profesionales.
12. Para comunicar la sospecha de incidentes graves relacionados con este dispositivo, póngase en contacto con su representante local de servicio Roche y con las autoridades competentes del Estado o País Miembro de residencia del usuario.
Este producto contiene componentes clasificados como sigue de conformidad con el Reglamento (CE) nº 1272/2008:
Tabla 1. Información de riesgos
|
Riesgo |
Código |
Declaración |
|
PELIGRO
|
H351 |
Se sospecha que puede causar cáncer. |
|
H360D |
Puede dañar al feto. |
|
|
H373 |
Puede provocar daños en determinados órganos debido a la exposición prolongada o recurrente. |
|
|
P201 |
Antes de utilizarlo, obtenga cualquier tipo de instrucción especial. |
|
|
P202 |
No lo manipule hasta haber leído atentamente las precauciones de seguridad y haberlas entendido por completo. |
|
|
P260 |
No inhale la niebla o los vapores. |
|
|
P280 |
Lleve guantes y prendas de protección, así como protección auditiva y para el rostro. |
|
|
P308 + P313 |
Si se sufre una exposición importante: Consultar a un médico. |
|
|
P501 |
Eliminar el contenido/el recipiente en una planta de eliminación de residuos aprobada. |
Este producto contiene CAS nº 75-12-7: formamida
MATERIAL SUMINISTRADO:
El dispensador de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL contiene reactivo suficiente para 30 pruebas.
Un dispensador de 6 mL de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIl contiene aproximadamente 14 μg/mL de sondas HER2 marcadas con dinitrofenilo (DNP) y 0.24 μg/mL de sondas Chromosome 17 marcadas con digoxigenina (DIG) formuladas en un tampón de hibridación con base de formamida. Ambas sondas se utilizan para determinar el estado del gen HER2 (es decir, la proporción de HER2/Cromosoma 17).
Consulte las hojas de datos del kit de detección VENTANA correspondiente para obtener descripciones detalladas de los siguientes aspectos: Principios del procedimiento, Material y métodos, Recogida y preparación de muestras para análisis, Procedimientos de control de calidad, Resolución de problemas, Interpretación de los resultados y Limitaciones.
MATERIALES NECESARIOS PERO NO SUMINISTRADOS:
No se suministran reactivos de tinción como los kits de detección de VENTANA ni los componentes auxiliares.
Puede que no todos los productos que aparecen en la hoja de datos estén disponibles en todos los lugares. Consulte al representante local de asistencia técnica de Roche.
No se suministran los reactivos y materiales siguientes, a pesar de ser necesarios para la tinción:
1. VENTANA Silver ISH DNP Detection Kit (nº cat. 760-516 / 08318883001)
2. VENTANA Red ISH DIG Detection Kit (nº cat. 760-512 / 08318832001)
3. HybReady Solution (nº cat. 780-4409 / 05917557001)
4. ISH Protease 3 (nº cat. 780-4149 / 05273331001)
5. Hematoxylin II (nº cat. 790-2208 / 05277965001)
6. Bluing Reagent (nº de cat. 760-2037 / 05266769001)
7. Reaction Buffer Concentrate (10X) (nº cat. 950-300 / 05353955001)
8. SSC (10X) (nº cat. 950-110 / 05353947001)
9. EZ Prep Concentrate (10X) (nº cat. 950-102 / 05279771001)
10. ultraView Silver Wash II (Pre-dilute) (nº cat. 780-003 / 05446724001)
11. Cell Conditioning Solution (CC1) (nº cat. 950-124 / 05279801001)
12. Cell Conditioning Solution (CC2) (nº cat. 950-123 / 05279798001)
13. LCS (Predilute) (nº cat. 650-010 / 05264839001)
14. ULTRA LCS (Pre-dilute) (nº cat. 650-210 / 05424534001)
15. ULTRA Cell Conditioning Solution (ULTRA CC1) (nº cat. 950-224 / 05424569001)
16. ULTRA Cell Conditioning Solution (ULTRA CC2) (nº cat. 950-223 / 05424542001)
17. Instrumento BenchMark IHC/ISH
18. Portaobjetos para microscopio con carga positiva (Superfrost Plus o equivalente)
19. Medio de montaje permanente*
20. Cubreobjetos en cantidad suficiente para cubrir los tejidos
21. Montador automático
22. HER2 Dual ISH 3-in-1 Xenograft Slides (nº cat. 783-4422 / 05640300001) puede servir para la resolución de problemas cuando sea necesario
* Consulte la Tabla 30 para conocer los medios de montaje compatibles con este ensayo.
PROCEDIMIENTOS DE CONTROL DE CALIDAD:
Muestra de control positivo: Las señales normales de HER2 y Cromosoma 17 (de 1 a 2 copias por célula) actúan como controles positivos internos y deben ser visibles en las muestras mediante objetivos de 20x, 40x o 60x. Sin embargo, no en todas las células se presenta una única copia del gen debido a la heterogeneidad biológica. Puede localizarse tinción nuclear específica en varias células, entre otras fibroblastos estromales, células endoteliales, linfocitos y células epiteliales no neoplásicas. Si los controles positivos no presentan una tinción positiva, puede ser indicación de que existe un problema con el instrumento o el reactivo. Como cada muestra contiene un control positivo interno (p. ej., tinción ISH apropiada en células normales), este actúa como un «control positivo real».
Puede usarse un control positivo de muestra específica del laboratorio en cada procedimiento de tinción que se lleve a cabo. Las muestras de control pueden ser muestras que se hayan preparado de la misma forma que las de los pacientes. Estos controles son útiles a la hora de hacer un seguimiento de todos los pasos que conlleva el proceso, desde la preparación de muestras hasta la tinción. El uso de una muestra que se haya preparado de forma diferente a las muestras de la prueba que se van a analizar proporcionará un control de los reactivos, del instrumento y de los procedimientos, pero no de la fijación ni del procesamiento de las muestras. Los resultados con las muestras de la prueba se deben analizar en la misma sesión. Estos controles no deberían sustituir a la evaluación oportuna de los controles internos en las muestras de cada paciente.
Muestra de xenoinjerto: Los portaobjetos de xenoinjertos pueden ser útiles para la validación preliminar del método que se ha utilizado en la tinción de los portaobjetos con el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL. También se recomiendan como referencia en la resolución de problemas cuando se utilizan en sesiones que contienen muestras clínicas. Para obtener más información al respecto, consulte la hoja de datos del portaobjetos del xenoinjerto correspondiente.
Discrepancias no explicadas: Las discrepancias no explicadas en los controles deberían comunicarse al representante local de asistencia técnica de Roche de forma inmediata. Si los resultados de los controles de calidad no cumplen las especificaciones, los resultados del paciente no serán válidos. Consulte la sección Resolución de problemas de esta hoja de datos.
Identifique el problema y corríjalo; a continuación, repita las muestras del paciente.
Verificación del ensayo: Antes de comenzar a utilizar una sonda o un sistema de tinción en un procedimiento diagnóstico, se debe comprobar la especificidad de la sonda mediante pruebas en una serie de tejidos que contengan características de rendimiento en ISH conocidas (consulte la hoja de datos de la sonda y las recomendaciones sobre control de calidad de College of American Pathologists Laboratory Accreditation Program, Anatomic Pathology Checklist,25 o CLSI Approved Guideline26 o ambos documentos). Estos procedimientos de control de calidad deben repetirse para cada nuevo lote de reactivos o cuando se produzca un cambio en los parámetros del ensayo.
CARACTERÍSTICAS DE RENDIMIENTO:
Se evaluó el rendimiento de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL mediante estudios clínicos y analíticos. Todas las tinciones se llevaron a cabo mediante el protocolo de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL, tal y como se muestra en la Tabla 3 en los instrumentos BenchMark IHC/ISH, a menos que se especifique lo contrario.
En la Tabla 5 y la Tabla 6, se resumen los datos de rendimiento de estos estudios: estudios de concordancia, repetibilidad y precisión, precisión del lector y entre lectores, precisión entre lotes, precisión del instrumento entre laboratorios, sensibilidad y especificidad analíticas, caracterización del ensayo y estabilidad. Un subconjunto de estos estudios se describen con mayor detalle en las siguientes secciones.
Tabla 5. Resumen de resultados de rendimiento en carcinoma de mama en los estudios clínicos y analíticos
|
Apto |
No apto |
Total |
Modos de fallo |
|||
|
Debilidad/ausencia de HER2/Chr17 (control interno o células diana) |
Fallos de fondo |
Sin tejido |
Otros |
|||
|
2893 |
127 |
3020 |
113 (3.74%) |
5 (0.17%) |
6 (0.20%) |
3 (0.10%) |
Tabla 6. Resumen de resultados de rendimiento en gástricos en los estudios clínicos y analíticos
|
Apto |
No apto |
Total |
Modos de fallo |
|||
|
Debilidad/ausencia de HER2/Chr17 (control interno o células diana) |
Fallos de fondo |
Sin tejido |
Otros |
|||
|
1340 |
17 |
1357 |
17 (1.25%) |
0 (0%) |
0 (0%) |
0 (0%) |
RENDIMIENTO CLÍNICO:
Estudio de concordancia con ensayo PathVysion: VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en el instrumento BenchMark ULTRA frente a Abbott/Vysis PathVysion HER-2 DNA Probe Kit:
Se llevó a cabo un estudio de concordancia en múltiples centros para evaluar la concordancia del ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL con la de un dispositivo de comparación, Abbott/Vysis PathVysion HER-2 FISH Kit, en la determinación del estado del gen HER2 en el carcinoma de mama invasivo. Participaron tres laboratorios centrales para el análisis con el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL. Se suministraron seiscientos treinta y seis casos de carcinoma de mama invasivo humano de tres sitios de inscripción clínica para la posible inclusión en el estudio en función de la expresión de la proteína HER2, que se obtuvo previamente mediante IHC. El patrocinador del estudio complementó 133 casos. Los laboratorios centrales que llevaron a cabo el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIl y el ensayo PathVysion HER-2 FISH desconocían el estado de IHC y el identificador original del caso para evitar cualquier sesgo en la evaluación de las muestras. Un laboratorio central llevó a cabo la tinción IHC de todas las muestras con PATHWAY anti-HER-2/neu (4B5) Rabbit Monoclonal Primary Antibody (anticuerpo PATHWAY anti-HER2 (4B5)) para los análisis adicionales. Los resultados de la tinción mediante FISH y el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL se enumeraron al contar al menos 20 núcleos en cada muestra. Los resultados se clasificaron de la siguiente forma: Proporción HER2/Chr 17 ≥ 2.0: amplificado; HER2/Chr 17 < 2.0: no amplificado. De los 678 casos que se tiñeron con ambos ensayos, FISH y VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL, 605 muestras se pudieron enumerar con ambos ensayos y, por tanto, se incluyeron en el análisis de los índices de concordancia.
Resultados principales:
En el análisis principal se llevó a cabo una comparación de los índices de concordancia positiva y negativa para evaluar la concordancia entre los ensayos VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y PathVysion HER-2 FISH en el carcinoma de mama. Los datos de las evaluaciones clínicas de casos amplificados y no amplificados de cada ensayo, combinando los datos de todos los sitios, se presentan en una tabla 2 × 2 a continuación, con los índices de concordancia positiva y negativa en los que PathVysion HER-2 FISH es el ensayo de referencia. Los criterios de aceptación para demostrar la equivalencia en el rendimiento de estos dos métodos de ensayo cuando se utiliza el instrumento BenchMark ULTRA requerían límites inferiores de puntuación del intervalo de confianza del 95% bilateral del 85% o superior al combinar los datos de los tres sitios. Se cumplieron estos criterios de aceptación (Tabla 7). Además, los índices de concordancia positiva y negativa por sitio fueron todossuperiores al 85% (Tabla 8).
Tabla 7. Concordancia entre VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y Abbott/Vysis PathVysion HER-2 DNA Probe Kit en una cohorte de muestras de carcinoma de mama humano
|
Resultado de PathVysion HER-2 FISH |
|||
|---|---|---|---|
|
Resultado de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL |
Amplificado |
No amplificado |
Total |
|
Amplificado |
270 |
12 |
282 |
|
No amplificado |
32 |
291 |
323 |
|
Total |
302 |
303 |
605 |
|
n/N |
% (puntuación CI del 95%) |
||
|
Porcentaje de concordancia positiva |
270/302 |
89.4 (85.4, 92.4) |
|
|
Porcentaje de concordancia negativa |
291/303 |
96.0 (93.2, 97.7) |
|
Tabla 8. Resumen de los índices de concordancia negativa, positiva y global de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y Abbott/Vysis PathVysion HER-2 DNA Probe Kit en las muestras de carcinoma de mama humano mostrados por sitio
|
VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL frente a PathVysion HER-2 FISH |
Porcentaje de concordancia positiva |
Porcentaje de concordancia negativa |
Porcentaje de concordancia global |
|
Sitio A: n/N (%) (CI del 95%) |
92/100 (92.0%) (85.0, 95.9) |
92/93 (98.9%) (94.2, 99.8) |
184/193 (95.3%) (91.4, 97.5) |
|
Sitio B: n/N (%) (CI del 95%) |
93/103 (90.3%) (83.0, 94.6) |
108/119 (90.8%) (84.2, 94.8) |
201/222 (90.5%) (86.0, 93.7) |
|
Sitio C: n/N (%) (CI del 95%) |
85/99 (85.9%) (77.7, 91.4) |
91/91 (100.0%) (95.9, 100.0) |
176/190 (92.6%) (88.0, 95.6) |
Estos datos indican una excelente concordancia entre el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y PathVysion HER-2 FISH Kit a la hora de determinar el estado del gen HER2 en muestras de carcinoma de mama humano.
Resultados secundarios: El porcentaje de concordancia global entre VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y PathVysion HER-2 FISH Kit y su puntuación CI del 95% bilateral, combinando los datos de todos los sitios clínicos, fue del 92.7% (90.4, 94.5).
Resultados secundarios: IHC frente a ISH para el estado de HER2: El estudio de concordancia en el que se comparaban VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y PathVysion FISH se había diseñado para evaluar también los casos en función de sus puntuaciones de IHC de los niveles de proteína HER2 (consulte la hoja de datos del anticuerpo PATHWAY anti-HER2 (4B5) [N/P 14427EN] para obtener información sobre la puntuación de IHC). Esto permitió realizar un análisis secundario para comparar los índices de concordancia entre el anticuerpo PATHWAY anti-HER2 (4B5) y el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y entre el anticuerpo PATHWAY anti-HER2 (4B5) y el ensayo PathVysion FISH. En este estudio, las puntuaciones de IHC de 2+/3+ se consideraron positivas para la sobreexpresión de HER2. Los datos de concordancia del ensayo PathVysion HER-2 FISH y el anticuerpo PATHWAY HER2/neu (4B5) se muestran en la Tabla 9. Los datos de concordancia del ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y el anticuerpo PATHWAY HER2/neu (4B5) se muestran en la Tabla 10.
Tabla 9. Comparación de IHC en el instrumento BenchMark ULTRA frente a FISH: Datos combinados de todos los centros
|
Resultado de PathVysion HER-2 FISH |
|||||
|
Amplificado |
No amplificado |
Total |
|||
|
Resultados del anticuerpo PATHWAY HER2 (4B5) |
Positiva (casos 2+/3+) |
277 |
63 |
340 |
|
|
Negativo (0/1+) |
27 |
238 |
265 |
||
|
Total |
304 |
301 |
605 |
||
|
n/N |
% (puntuación CI del 95%) |
||||
|
Porcentaje de concordancia positiva |
277/304 |
91.1 (87.4, 93.8) |
|||
Tabla 10. Comparación de IHC en el instrumento BenchMark ULTRA frente al ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL: Datos combinados de todos los centros
|
Resultado de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL |
|||||
|
Amplificado |
No amplificado |
Total |
|||
|
Resultados del anticuerpo PATHWAY HER2 (4B5) |
Positiva (casos 2+/3+) |
248 |
78 |
326 |
|
|
Negativo (0/1+) |
18 |
253 |
271 |
||
|
Total |
266 |
331 |
597 |
||
|
n/N |
% (puntuación CI del 95%) |
||||
|
Porcentaje de concordancia positiva |
248/266 |
93.2 (89.6, 95.7) |
|||
Estudio de concordancia:
Ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en el instrumento BenchMark ULTRA frente al ensayo Dako HER2 IQFISH pharmDx™ Kit:
Se llevó a cabo un estudio de concordancia para evaluar el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en comparación con Dako HER2 IQFISH pharmDx™ Kit en cuanto a la determinación del estado del gen HER2 en casos de GEA mediante hibridación in situ con fluorescencia (FISH). La comparabilidad del ensayo en muestras de GEA se determinó comparando los resultados de la tinción de ambos ensayos (Tabla 11). Se tiñeron ciento treinta y cuatro (134) muestras de GEA humano (una combinación de casos amplificados y no amplificados) con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL. En la misma cohorte se realizó una tinción con el ensayo Dako HER2 IQFISH pharmDx™. Los resultados desglosados de los índices de concordancia negativos, positivos y globales de las 146 muestras de esta cohorte que se pudieron enumerar con ambos ensayos, Dako HER2 IQFISH pharmDx™ y VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL, se muestran en la Tabla 11 y la Tabla 12.
Tabla 11. Concordancia entre VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y el ensayo Dako HER2 IQFISH pharmDx™ en una cohorte de muestras de GEA humano
|
Estado de amplificación de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL |
Estado de amplificación del ensayo Dako HER2 IQFISH pharmDx™ |
|
|
Ampl. |
No ampl. |
|
|
Ampl. |
49 |
8 |
|
No ampl. |
5 |
84 |
Tabla 12. Resumen de los índices de concordancia negativa, positiva y global de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y Dako HER2 IQFISH pharmDx™ en las muestras de GEA humano
|
Negativa Tipo de concordancia |
Positiva Tipo de concordancia |
Global Tipo de concordancia |
||||
|
Datos sin procesar/ nº de casos |
Porcentaje (puntuación CI del 95%) |
Datos sin procesar/ nº de casos |
Porcentaje (puntuación CI del 95%) |
Datos sin procesar/ nº de casos |
Porcentaje (puntuación CI del 95%) |
|
|
VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL |
84/92 |
91.3 (83.8-95.5) |
49/54 |
90.7 (80.1 – 96.0) |
133/146 |
91.1 (85.4 – 94.7) |
RENDIMIENTO DE ANÁLISIS:
Repetibilidad y precisión del instrumento BenchMark IHC/ISH con el carcinoma de mama:
Se evaluó la repetibilidad y la precisión de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en los instrumentos BenchMark IHC/ISH junto con los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit.
Se evaluó la repetibilidad dentro del análisis utilizando 28 muestras de carcinoma de mama. Se realizó una tinción con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en dos portaobjetos replicados de cada una de las muestras en un solo instrumento BenchMark ULTRA, BenchMark XT o BenchMark GX. Para el análisis de los datos de los instrumentos BenchMark XT y GX, se ponderaron los casos con porcentajes entre 1.5 y 2.5 en función de su prevalencia.
La precisión intermedia entre días se evaluó también con muestras de carcinoma de mama. Se realizó una tinción con VENTANA HER2 Dual ISH DNA Probe Cocktail en portaobjetos replicados de cada una de las 28 muestras en instrumentos BenchMark IHC/ISH durante 5 días no consecutivos. Para el análisis de los datos de los instrumentos BenchMark XT y BenchMark GX, se ponderaron los casos con porcentajes entre 1.5 y 2.5 en función de su prevalencia.
La repetibilidad dentro del análisis se determinó mediante el promedio de concordancia positiva (APA), el promedio de concordancia negativa (ANA) y el porcentaje de concordancia global (OPA). La precisión intermedia entre días se determinó mediante el porcentaje de concordancia positiva (PPA), el porcentaje de concordancia negativa (NPA) y el porcentaje de concordancia global (OPA) de todas las observaciones que se realizaron con la población que se podía evaluar. En la Tabla 13, se muestra un resumen de los resultados de ambos estudios.
Tabla 13. Repetibilidad dentro del análisis y precisión intermedia entre días del instrumento BenchMark IHC/ISH
|
Plataforma |
Repetibilidad/precisión |
Estado clínico |
Concordancia |
|||
|---|---|---|---|---|---|---|
|
Tipo |
n/N |
% |
CI del 95% |
|||
|
ULTRA |
Repetibilidad dentro del análisis |
Amplificado |
APA |
194/194 |
100 |
(98.1, 100) |
|
No amplificado |
ANA |
186/186 |
100 |
(98.0, 100) |
||
|
Total |
OPA |
190/190 |
100 |
(98.0, 100) |
||
|
ULTRA |
Precisión intermedia entre días |
Amplificado |
PPA |
139/139 |
100 |
(97.3, 100) |
|
No amplificado |
NPA |
135/135 |
100 |
(97.2, 100) |
||
|
Total |
OPA |
274/274 |
100 |
(98.6, 100) |
||
|
XT |
Repetibilidad dentro del análisis |
Amplificado |
APA |
128.8/128.8 |
100 |
(97.1, 100) |
|
No amplificado |
ANA |
151.2/151.2 |
100 |
(97.5, 100) |
||
|
Total |
OPA |
140.0/140.0 |
100 |
(97.3, 100) |
||
|
XT |
Precisión intermedia entre días |
Amplificado |
PPA |
128.8/128.8 |
100 |
(97.1, 100) |
|
No amplificado |
NPA |
151.2/151.2 |
100 |
(97.5, 100) |
||
|
Total |
OPA |
280.0/280.0 |
100 |
(98.6, 100) |
||
|
GX |
Repetibilidad dentro del análisis |
Amplificado |
APA |
128.8/128.8 |
100 |
(97.1, 100) |
|
No amplificado |
ANA |
151.2/151.2 |
100 |
(97.5, 100) |
||
|
Total |
OPA |
140.0/140.0 |
100 |
(97.3, 100) |
||
|
GX |
Precisión intermedia entre días |
Amplificado |
PPA |
128.8/128.8 |
100 |
(97.1, 100) |
|
No amplificado |
NPA |
151.2/151.2 |
100 |
(97.5, 100) |
||
|
Total |
OPA |
280.0/280.0 |
100 |
(98.6, 100) |
||
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil; en los casos en los que la estimación de punto fue del 100%, se utilizó el método de puntuación de Wilson. En el estudio se incorporaron 4 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Precisión intermedia entre instrumentos con el carcinoma de mama:
Se determinó la precisión intermedia entre instrumentos BenchMark IHC/ISH de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL mediante la tinción de portaobjetos replicados de 28 muestras de carcinoma de mama en 3 instrumentos BenchMark IHC/ISH con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit. La precisión intermedia entre instrumentos se determinó mediante el PPA, el NPA y el OPA de todas las observaciones que se realizaron con la población que se podía evaluar. Los casos con porcentajes entre 1.5 y 2.5 se ponderaron en función de su prevalencia (instrumentos BenchMark XT/BenchMark GX). En la Tabla 14, se muestra un resumen de los resultados de este estudio.
Tabla 14. Precisión intermedia entre instrumentos BenchMark IHC/ISH
|
Plataforma |
Precisión |
Estado clínico |
Concordancia |
|||
|---|---|---|---|---|---|---|
|
Tipo |
n/N |
% |
CI del 95% |
|||
|
ULTRA |
Precisión intermedia entre instrumentos |
Amplificado |
PPA |
84/84 |
100 |
(95.6, 100) |
|
No amplificado |
NPA |
84/84 |
100 |
(95.6, 100) |
||
|
Total |
OPA |
168/168 |
100 |
(97.8, 100) |
||
|
XT |
Precisión intermedia entre instrumentos |
Amplificado |
PPA |
77.3/77.3 |
100 |
(95.3, 100) |
|
No amplificado |
NPA |
90.7/90.7 |
100 |
(95.9, 100) |
||
|
Total |
OPA |
168.0/168.0 |
100 |
(97.8, 100) |
||
|
GX |
Precisión intermedia entre instrumentos |
Amplificado |
PPA |
76.2/76.2 |
100 |
(95.2, 100) |
|
No amplificado |
NPA |
90.7/90.7 |
100 |
(95.9, 100) |
||
|
Total |
OPA |
166.9/166.9 |
100 |
(97.8, 100) |
||
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil; en aquellos casos en los que la estimación de punto fue del 100%, se utilizó el método de puntuación de Wilson. En el estudio se incorporaron 4 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Precisión intralector y entre lectores con carcinoma de mama:
Se determinó la precisión intralector y entre lectores de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en un instrumento BenchMark IHC/ISH mediante la evaluación por parte de tres lectores de 60 muestras de carcinoma de mama teñidas con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL con los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit en un instrumento BenchMark ULTRA. En el caso de la precisión intralector, se realizó dos veces la lectura del mismo conjunto de portaobjetos tras un periodo mínimo de dos semanas entre las lecturas. La precisión intralector y entre lectores se determinó mediante los APA, ANA y OPA de todas las observaciones que se realizaron con la población que se podía evaluar. En la Tabla 15, se muestra un resumen de los resultados de este estudio.
Tabla 15. Precisión intralector y entre lectores en el instrumento BenchMark ULTRA
|
Precisión |
Estado clínico |
Concordancia |
|||
|
Tipo |
n/N |
% |
CI del 95% |
||
|
Mismo lector |
Amplificado |
APA |
178/181 |
98.3 |
(96.3, 100) |
|
No amplificado |
ANA |
174/177 |
98.3 |
(96.1, 100) |
|
|
Total |
OPA |
176/179 |
98.3 |
(96.1, 100) |
|
|
Entre lectores |
Amplificado |
APA |
350/362 |
96.7 |
(93.2, 99.4) |
|
No amplificado |
ANA |
342/354 |
96.6 |
(92.8, 99.4) |
|
|
Total |
OPA |
346/358 |
96.6 |
(92.8, 99.4) |
|
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil. En el estudio se incorporaron 6 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Precisión entre plataformas con el carcinoma de mama:
Se determinó la precisión entre plataformas de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en un instrumento BenchMark IHC/ISH mediante la evaluación de 28 muestras de carcinoma de mama teñidas con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit en instrumentos BenchMark IHC/ISH. La precisión entre plataformas se determinó mediante el PPA, el NPA y el OPA de todas las observaciones que se realizaron con la población que se podía evaluar. Los casos cuyo porcentaje se encontraba entre el 1.5 y el 2.5 se ponderaron en función de su prevalencia. En la Tabla 16, se muestra un resumen de los resultados de este estudio.
Tabla 16. Precisión entre plataformas de los instrumentos BenchMark IHC/ISH
|
Precisión |
Estado clínico |
Concordancia |
|||
|
Tipo |
n/N |
% |
CI del 95% |
||
|
Precisión entre plataformas |
Amplificado |
PPA |
230.8/230.8 |
100 |
(98.4, 100) |
|
No amplificado |
NPA |
271.0/272.2 |
99.6 |
(98.3, 100) |
|
|
Total |
OPA |
501.8/502.9 |
99.8 |
(99.2, 100) |
|
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil; en aquellos casos en los que la estimación de punto fue del 100%, se utilizó el método de puntuación de Wilson. En el estudio se incorporaron 4 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Instrumento BenchMark IHC/ISH: Repetibilidad y precisión con adenocarcinoma gástrico:
Se evaluó la repetibilidad y la precisión de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en los instrumentos BenchMark IHC/ISH junto con los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit.
Se evaluó la repetibilidad dentro del análisis utilizando catorce muestras de adenocarcinoma gástrico. Se realizó una tinción con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en dos portaobjetos replicados de cada una de las muestras de adenocarcinoma gástrico en un solo instrumento BenchMark IHC/ISH. Los casos cuyo porcentaje se encontraba entre el 1.5 y el 2.5 se ponderaron en función de su prevalencia.
La precisión intermedia entre días se evaluó también con muestras de adenocarcinoma gástrico. Se realizó una tinción con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en los portaobjetos replicados de cada una de las 14 muestras en un instrumento BenchMark IHC/ISH durante 5 días no consecutivos. Los casos cuyo porcentaje se encontraba entre el 1.5 y el 2.5 se ponderaron en función de su prevalencia.
La repetibilidad dentro del análisis se determinó mediante el promedio de concordancia positiva (APA), el promedio de concordancia negativa (ANA) y el porcentaje de concordancia global (OPA). La precisión intermedia entre días se determinó mediante el porcentaje de concordancia positiva (PPA), el porcentaje de concordancia negativa (NPA) y el porcentaje de concordancia global (OPA) de todas las observaciones que se realizaron con la población que se podía evaluar. En la Tabla 17, se muestra un resumen de los resultados de ambos estudios.
Tabla 17. Instrumento BenchMark IHC/ISH: Repetibilidad dentro del análisis y precisión intermedia entre días
|
Plataforma |
Repetibilidad /precisión |
Estado clínico |
Concordancia |
|||
|
Tipo |
n/N |
% |
CI del 95% |
|||
|
ULTRA |
Repetibilidad dentro del análisis |
Amplificado |
APA |
70.0/70.0 |
100 |
(94.8, 100) |
|
No amplificado |
ANA |
70.0/70.0 |
100 |
(94.8, 100) |
||
|
Total |
OPA |
70.0/70.0 |
100 |
(94.8, 100) |
||
|
ULTRA |
Precisión intermedia entre días |
Amplificado |
PPA |
70.0/70.0 |
100 |
(94.8, 100) |
|
No amplificado |
NPA |
70.0/70.0 |
100 |
(94.8, 100) |
||
|
Total |
OPA |
140.0/140.0 |
100 |
(97.3, 100) |
||
|
XT |
Repetibilidad dentro del análisis |
Amplificado |
APA |
70.0/70.0 |
100 |
(94.8, 100) |
|
No amplificado |
ANA |
70.0/70.0 |
100 |
(94.8, 100) |
||
|
Total |
OPA |
70.0/70.0 |
100 |
(94.8, 100) |
||
|
XT |
Precisión intermedia entre días |
Amplificado |
PPA |
70.0/70.0 |
100 |
(94.8, 100) |
|
No amplificado |
NPA |
70.0/70.0 |
100 |
(94.8, 100) |
||
|
Total |
OPA |
140.0/140.0 |
100 |
(94.8, 100) |
||
|
GX |
Repetibilidad dentro del análisis |
Amplificado |
APA |
64.6/65.1 |
99.1 |
(95.9, 100) |
|
No amplificado |
ANA |
70.0/70.6 |
99.2 |
(95.2, 100) |
||
|
Total |
OPA |
67.3/67.9 |
99.2 |
(96.9, 100) |
||
|
GX |
Precisión intermedia entre días |
Amplificado |
PPA |
67.3/67.9 |
99.2 |
(96.5, 100) |
|
No amplificado |
NPA |
70.0/70.0 |
100 |
(94.8, 100) |
||
|
Total |
OPA |
137.3/137.9 |
99.6 |
(98.5, 100) |
||
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil; en aquellos casos en los que la estimación de punto fue del 100%, se utilizó el método de puntuación de Wilson. En el estudio se incorporaron 2 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Precisión intermedia entre instrumentos con el adenocarcinoma gástrico:
Se determinó la precisión intermedia entre instrumentos BenchMark IHC/ISH de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL mediante la tinción de portaobjetos replicados de 14 muestras de adenocarcinoma gástrico en 3 instrumentos BenchMark IHC/ISH con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit. La precisión intermedia entre instrumentos se determinó mediante el PPA, el NPA y el OPA de todas las observaciones que se realizaron con la población que se podía evaluar. Los casos cuyo porcentaje se encontraba entre el 1.5 y el 2.5 se ponderaron en función de su prevalencia. En la Tabla 18, se muestra un resumen de los resultados de este estudio.
Tabla 18. Precisión intermedia entre instrumentos BenchMark IHC/ISH
|
Plataforma |
Precisión |
Estado clínico |
Concordancia |
|||
|
Tipo |
n/N |
% |
CI del 95% |
|||
|
ULTRA |
Precisión intermedia entre instrumentos |
Amplificado |
PPA |
42.0/42.0 |
100 |
(91.6, 100) |
|
No amplificado |
NPA |
42.0/42.0 |
100 |
(91.6, 100) |
||
|
Total |
OPA |
84.0/84.0 |
100 |
(95.6, 100) |
||
|
XT |
Precisión intermedia entre instrumentos |
Amplificado |
PPA |
40.4/40.9 |
98.6 |
(94.1, 100) |
|
No amplificado |
NPA |
40.9/40.9 |
100 |
(91.4, 100) |
||
|
Total |
OPA |
81.3/81.9 |
99.3 |
(97.5, 100) |
||
|
GX |
Precisión intermedia entre instrumentos |
Amplificado |
PPA |
40.9/40.9 |
100 |
(91.4, 100) |
|
No amplificado |
NPA |
42.0/42.0 |
100 |
(91.6, 100) |
||
|
Total |
OPA |
82.9/82.9 |
100 |
(95.6, 100) |
||
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil; en aquellos casos en los que la estimación de punto fue del 100%, se utilizó el método de puntuación de Wilson. En el estudio se incorporaron 2 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Precisión intralector y entre lectores con adenocarcinoma gástrico:
Se determinó la precisión intralector y entre lectores de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en un instrumento BenchMark IHC/ISH mediante la evaluación por parte de tres lectores de 28 muestras de adenocarcinoma gástrico teñidas con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL con los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit en un instrumento BenchMark ULTRA. Se aleatorizaron todos los portaobjetos y se enmascaró el diagnóstico de los casos. En el caso de la precisión intralector, se realizó dos veces la lectura del mismo conjunto de portaobjetos tras un periodo mínimo de dos semanas entre las lecturas. La precisión intralector y la precisión entre lectores se determinó mediante los APA, ANA y OPA de todas las observaciones que se realizaron con la población que se podía evaluar. En la Tabla 19, se muestra un resumen de los resultados de este estudio.
Tabla 19. Precisión intralector y entre lectores en el instrumento BenchMark ULTRA
|
Precisión |
Estado clínico |
Concordancia |
|||
|
Tipo |
n/N |
% |
CI del 95% |
||
|
Entre lectores |
Amplificado |
APA |
80/84 |
95.2 |
(90.5, 100) |
|
No amplificado |
ANA |
80/84 |
95.2 |
(90.5, 100) |
|
|
Total |
OPA |
80/84 |
95.2 |
(90.5, 100) |
|
|
Mismo lector |
Amplificado |
APA |
82/84 |
97.6 |
(95.2, 100) |
|
No amplificado |
ANA |
82/84 |
97.6 |
(95.2, 100) |
|
|
Total |
OPA |
82/84 |
97.6 |
(95.2, 100) |
|
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil. En el estudio se incorporaron 2 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Precisión entre plataformas con el adenocarcinoma gástrico:
Se determinó la precisión entre plataformas de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en un instrumento BenchMark IHC/ISH mediante la evaluación de la tinción de 14 muestras de adenocarcinoma gástrico con VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL y los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit en instrumentos BenchMark IHC/ISH. La precisión entre plataformas se determinó mediante el PPA, el NPA y el OPA de todas las observaciones que se realizaron con la población que se podía evaluar. Los casos cuyo porcentaje se encontraba entre el 1.5 y el 2.5 se ponderaron en función de su prevalencia. En la Tabla 20, se muestra un resumen de los resultados de este estudio.
Tabla 20. Instrumento BenchMark IHC/ISH: Precisión entre plataformas
|
Precisión |
Estado clínico |
Concordancia |
|||
|
Tipo |
n/N |
% |
CI del 95% |
||
|
Precisión entre plataformas |
Amplificado |
PPA |
123.3/123.9 |
99.5 |
(98.1, 100) |
|
No amplificado |
NPA |
124.9/124.9 |
100 |
(97.0, 100) |
|
|
Total |
OPA |
248.2/248.8 |
99.8 |
(99.2, 100) |
|
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil; en aquellos casos en los que la estimación de punto fue del 100%, se utilizó el método de puntuación de Wilson. En el estudio se incorporaron 2 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Precisión entre lotes con el carcinoma de mama: Se determinó la precisión entre lotes mediante el análisis de 3 lotes de producción de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL, VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit en instrumentos BenchMark ULTRA. Se tiñeron veintiocho casos de carcinoma de mama con cada sonda y kit de detección. En la Tabla 21, se muestra un resumen de los resultados de la precisión entre lotes del ensayo.
Tabla 21. Precisión entre lotes
|
Precisión |
Estado clínico |
Concordancia |
|||
|
Tipo |
n/N |
% |
CI del 95% |
||
|
Entre lotes |
Amplificado |
PPA |
121/121 |
100 |
(96.9, 100) |
|
No amplificado |
NPA |
123/123 |
100 |
(97.0, 100) |
|
|
Total |
OPA |
244/244 |
100 |
(98.5, 100) |
|
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil; en aquellos casos en los que la estimación de punto fue del 100%, se utilizó el método de puntuación de Wilson. En el estudio se incorporaron 4 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Estudio de reproducibilidad entre laboratorios del instrumento BenchMark ULTRA con carcinoma de mama y adenocarcinoma gástrico:
Se llevó a cabo un estudio de reproducibilidad entre laboratorios (ILR) para evaluar la reproducibilidad de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en la determinación del estado del gen HER2 en tejidos de carcinoma de mama y adenocarcinoma gástrico teñidos con el instrumento BenchMark ULTRA junto con los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit.
Se utilizaron veintiocho 2.5 muestras de tejido de carcinoma de mama y adenocarcinoma gástrico FFPE y aproximadamente la mitad de estos casos presentaron un estado amplificado de la expresión de HER2 y la otra mitad un estado no amplificado del estado de HER2.
Se cortaron varias secciones de cada muestra y se facilitaron a tres sitios de estudio externos. Cada sitio tiñó 28 casos de mama y 28 casos gástricos cada uno de los 5 días no consecutivos durante un periodo mínimo de 20 días. Tras la tinción en el instrumento BenchMark ULTRA, un lector evaluó cada portaobjetos para asignar el estado del gen HER2.
Los resultados se resumen en la Tabla 22 y la Tabla 23, a continuación. Se llevó a cabo un análisis de los datos para obtener el PPA y el NPA de todas las observaciones. En cada caso, todas las observaciones evaluables (amplificado frente a no amplificado) se compararon con el resultado modal de cada caso. Los casos cuyo porcentaje se encontraba entre el 1.5 y el 2.5 se ponderaron en función de su prevalencia. Las comparaciones se combinaron en todos los sitios y días y se agregaron los resultados de todos los casos.
Tabla 22. Reproducibilidad entre laboratorios: índices de concordancia en el instrumento BenchMark ULTRA con el carcinoma de mama
|
Reproducibilidad entre laboratorios |
Concordancia |
||||
|---|---|---|---|---|---|
|
Tipo |
n/N |
% |
CI del 95% |
||
|
Entre sitios (tres sitios) |
PPA |
208.9/208.9 |
100 |
(98.2, 100.0) |
|
|
NPA |
198.1/200.3 |
98.9 |
(96.8, 100.0) |
||
|
OPA |
407.0/409.3 |
99.5 |
(98.4, 100.0) |
||
|
Entre días (5 días no consecutivos) |
Sitio A |
PPA |
72/74 |
97.3 |
(92.3, 100.0) |
|
NPA |
63/63 |
100 |
(94.3, 100.0) |
||
|
OPA |
135/137 |
98.5 |
(95.6, 100.0) |
||
|
Sitio B |
PPA |
70/70 |
100 |
(94.8, 100.0) |
|
|
NPA |
63/64 |
98.4 |
(95.8, 100.0) |
||
|
OPA |
133/134 |
99.3 |
(97.8, 100.0) |
||
|
Sitio C |
PPA |
70/70 |
100 |
(94.8, 100.0) |
|
|
NPA |
69/69 |
100 |
(94.7, 100.0) |
||
|
OPA |
139/139 |
100 |
(97.3, 100.0) |
||
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil; en aquellos casos en los que la estimación de punto fue del 100%, se utilizó el método de puntuación de Wilson. En el estudio se incorporaron 4 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Tabla 23. Reproducibilidad entre laboratorios:
Índices de concordancia en el instrumento BenchMark ULTRA con el adenocarcinoma gástrico
|
Reproducibilidad entre laboratorios |
Concordancia |
||||
|
Tipo |
n/N |
% |
CI del 95% |
||
|
Entre sitios (tres sitios) |
PPA |
206.8/206.8 |
100 |
(98.2, 100.0) |
|
|
NPA |
208.4/208.9 |
99.7 |
(99.2, 100.0) |
||
|
OPA |
415.1/415.7 |
99.9 |
(99.6, 100.0) |
||
|
Entre días (5 días no consecutivos) |
Sitio A |
PPA |
70/70 |
100 |
(94.8, 100.0) |
|
NPA |
69/70 |
98.6 |
(96.0, 100.0) |
||
|
OPA |
139/140 |
99.3 |
(97.9, 100.0) |
||
|
Sitio B |
PPA |
67/67 |
100 |
(94.6, 100.0) |
|
|
NPA |
69/69 |
100 |
(94.7, 100.0) |
||
|
OPA |
136/136 |
100 |
(97.3, 100.0) |
||
|
Sitio C |
PPA |
70/70 |
100 |
(94.8, 100.0) |
|
|
NPA |
70/70 |
100 |
(94.8, 100.0) |
||
|
OPA |
140/140 |
100 |
(97.3, 100.0) |
||
Nota: Los datos de CI del 95% se calcularon mediante el método bootstrap percentil; en aquellos casos en los que la estimación de punto fue del 100%, se utilizó el método de puntuación de Wilson. En el estudio se incorporaron 4 casos cuyos resultados de ISH mostraban porcentajes de 1.5 a 2.5, ambos incluidos.
Rendimiento de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en el instrumento BenchMark ULTRA PLUS:
Concordancia entre los instrumentos BenchMark ULTRA PLUS y BenchMark ULTRA en el carcinoma de mama: Tres laboratorios de diferentes instituciones de Estados Unidos participaron en un estudio de concordancia entre el instrumento BenchMark ULTRA PLUS y el instrumento BenchMark ULTRA. Se evaluaron 193 casos únicos de carcinoma de mama invasivo FFPE que representaban el intervalo de tinción del ensayo VENTANA HER2 DUAL ISH COCKTAIL, con una distribución equitativa aproximada entre los casos con amplificación de HER2 y sin amplificación de HER2. Roche realizó la tinción de los portaobjetos con tejido de todos los casos con H y E junto con VENTANA HER2 DUAL ISH COCKTAIL en un instrumento BenchMark ULTRA y el protocolo de tinción recomendado. Los portaobjetos con tejido sin tinción de todos los casos se aleatorizaron y se distribuyeron de forma equitativa (64-65 casos/por sitio) en los sitios del estudio para su tinción en un instrumento BenchMark ULTRA PLUS con el protocolo de tinción recomendado de VENTANA HER2 DUAL ISH COCKTAIl. Los anatomopatólogos, con los estados de casos enmascarados, evaluaron los portaobjetos teñidos en un instrumento BenchMark IHC/ISH y determinaron el estado del gen HER2. Tras un periodo de dos semanas, los anatomopatólogos evaluaron los portaobjetos teñidos en el segundo instrumento BenchMark IHC/ISH. El estado del gen HER2 se determinó mediante la proporción entre las señales del gen HER2 y las señales del cromosoma 17 (Chr17) (es decir, la proporción HER2:Chr17) en el núcleo de las células tumorales. Si la proporción era 2.0 o superior, el caso se consideraba HER2 amplificado; si era inferior a 2.0, se consideraba HER2 no amplificado. Los resultados se analizaron en Roche. Los porcentajes de OPA, PPA y NPA fueron de 97.1% (535/551), 97.3% (248/255) y 97.0% (287/296), respectivamente. Los resultados se resumen en la Tabla 24.
Tabla 24. Concordancia combinada del estado del gen HER2 de casos de carcinoma de mama teñidos con VENTANA HER2 DUAL ISH COCKTAIL en el instrumento BenchMark ULTRA PLUS frente al BenchsMark ULTRA
|
Estado del gen HER2 en BenchMark ULTRA PLUS |
Estado del gen HER2 en BenchMark ULTRA |
Total |
|
|
Amplificado |
No amplificado |
||
|
Amplificado |
248 |
9 |
257 |
|
No amplificado |
7 |
287 |
294 |
|
Total |
255 |
296 |
551 |
|
n/N |
% (CI del 95%) |
||
|
PPA |
248/255 |
97.3 (95.0, 99.2) |
|
|
NPA |
287/296 |
97.0 (94.8, 99.0) |
|
|
OPA |
535/551 |
97.1 (95.5, 98.6) |
|
Nota: Los CI del 95% bilaterales se calcularon mediante el método bootstrap percentil con 2000 replicados seleccionados con estratificación en las cuatro franjas de puntuación diagnóstica que se habían empleado durante la selección de casos [con amplificación (no límite), sin amplificación (no límite), con amplificación límite, sin amplificación límite].
Estudio de reproducibilidad entre laboratorios con el instrumento BenchMark ULTRA PLUS con el carcinoma de mama:
Se llevó a cabo un estudio de reproducibilidad entre laboratorios (ILR) para evaluar la reproducibilidad de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en la determinación del estado del gen HER2 en tejidos de carcinoma de mama teñidos en el instrumento BenchMark ULTRA PLUS junto con los kits VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit.
Se utilizaron veintiocho casos únicos de carcinoma de mama invasivo FFPE que representaban el intervalo de tinción del ensayo VENTANA HER2 DUAL ISH COCKTAIL, con una distribución equitativa aproximada entre los casos con amplificación de HER2 y sin amplificación de HER2.
Se cortaron varias secciones de cada muestra y se facilitaron a tres sitios de estudio externos. Los 28 casos se tiñeron con el instrumento BenchMark ULTRA PLUS en cada uno de los cinco días no consecutivos en un periodo mínimo de 20 días en cada sitio. Los lectores evaluaron los portaobjetos y determinaron el estado del gen HER2.
Los resultados se resumen en la Tabla 25 y la Tabla 26. En la Tabla 25, se muestran los datos de análisis para determinar los PPA, NPA y OPA y, en la Tabla 26 figuran los APA, ANA y OPA de todas las observaciones. En cada caso, todas las observaciones evaluables (amplificado frente a no amplificado) se compararon con el resultado modal de cada caso. Las comparaciones se combinaron en todos los sitios y días y se agregaron los resultados de todos los casos.
Tabla 25. Reproducibilidad entre laboratorios: índices de concordancia con el estado modal en el instrumento BenchMark ULTRA PLUS del carcinoma de mama
|
Reproducibilidad entre laboratorios |
Concordancia |
|||
|
Tipo |
n/N |
% |
CI del 95% |
|
|
Global |
PPA |
372/381 |
97.6 |
(95.3, 100.0) |
|
NPA |
421/440 |
95.7 |
(91.1, 99.3) |
|
|
OPA |
793/821 |
96.6 |
(94.3, 98.5) |
|
|
Entre sitios (tres sitios) |
PPA |
380/389 |
97.7 |
(95.3, 100.0) |
|
NPA |
421/432 |
97.5 |
(95.3, 99.3) |
|
|
OPA |
801/821 |
97.6 |
(96.3, 98.7) |
|
|
Entre lectores |
PPA |
383/389 |
98.5 |
(97.1, 99.5) |
|
NPA |
424/432 |
98.1 |
(97.1, 99.0) |
|
|
OPA |
807/821 |
98.3 |
(97.5, 99.0) |
|
Nota: Los intervalos de confianza (CI) bilaterales del 95% se calcularon mediante el método bootstrap percentil.
Tabla 26. Reproducibilidad entre laboratorios: Índices de concordancia entre pares en el instrumento BenchMark ULTRA PLUS en carcinoma de mama
|
Reproducibilidad entre laboratorios |
Concordancia |
|||
|
Tipo |
n/N |
% |
CI del 95% |
|
|
Entre sitios (tres sitios) |
APA |
7204/7652 |
94.1 |
(91.1, 96.9) |
|
ANA |
7968/8416 |
94.7 |
(91.5, 97.4) |
|
|
OPA |
7586/8034 |
94.4 |
(91.5, 97.1) |
|
|
Entre lectores |
APA |
370/390 |
94.9 |
(92.5, 97.1) |
|
ANA |
408/428 |
95.3 |
(92.7, 97.5) |
|
|
OPA |
389/409 |
95.1 |
(92.7, 97.3) |
|
|
Entre días (5 días no consecutivos) |
APA |
1472/1519 |
96.9 |
(95.5, 98.2) |
|
ANA |
1642/1689 |
97.2 |
(95.8, 98.5) |
|
|
OPA |
1557/1604 |
97.1 |
(95.7, 98.3) |
|
Nota: Los intervalos de confianza (CI) bilaterales del 95% se calcularon mediante el método bootstrap percentil.
Concordancia entre los instrumentos BenchMark ULTRA PLUS y BenchMark ULTRA en el carcinoma gástrico:
Se evaluaron 109 casos únicos de carcinoma gástrico invasivo FFPE que representaban el intervalo de tinción del ensayo VENTANA HER2 DUAL ISH COCKTAIL, con una distribución equitativa aproximada entre los casos con amplificación de HER2 y sin amplificación de HER2. Los portaobjetos con tejido se tiñeron en un instrumento BenchMark ULTRA PLUS y en un instrumento BenchMark ULTRA utilizando el protocolo de tinción recomendado. Un anatomopatólogo asignó la puntuación a los portaobjetos con tinción. El porcentaje de concordancia global de la tinción con VENTANA HER2 DUAL ISH COCKTAIL en función del estado del gen HER2 (HER2 amplificado, HER2 no amplificado) fue de 92.4%. Los intervalos de confianza del 95% bilaterales, que son del 84.4% al 96.5%, se calcularon mediante el método de puntuación de Wilson. Los índices de aceptabilidad de tinción de fondo y morfología de todos los casos fueron del 100% en el instrumento BenchMark ULTRA PLUS.
Estudios de precisión del instrumento BenchMark ULTRA PLUS en carcinoma gástrico:
Se analizaron doce casos de tejido de carcinoma gástrico que representaban el intervalo de tinción del ensayo VENTANA HER2 DUAL ISH COCKTAIL en el instrumento BenchMark ULTRA PLUS. La distribución de los casos fue equitativa de forma aproximada entre los estados del gen HER2 con amplificación de HER2 y sin amplificación de HER2. Un anatomopatólogo evaluó los portaobjetos con tinción. Todos los índices de concordancia se calcularon con intervalos de confianza del 95% bilaterales mediante el método bootstrap percentil.
Para evaluar la repetibilidad dentro del análisis se tiñeron cinco portaobjetos por caso en el instrumento BenchMark ULTRA PLUS. El porcentaje de concordancia global de la tinción con VENTANA HER2 DUAL ISH COCKTAIL, en función del estado del gen HER2 (HER2 amplificado, HER2 no amplificado), fue de 91.7% (CI del 95%: 81.7, 100.0).
Para evaluar la precisión intermedia entre días se tiñeron dos portaobjetos por caso en el instrumento BenchMark ULTRA PLUS en cinco sesiones de tinción que se llevaron a cabo en un periodo de cinco días no consecutivos. El porcentaje de concordancia global de la tinción con VENTANA HER2 DUAL ISH COCKTAIL, en función del estado del gen HER2 (HER2 amplificado, HER2 no amplificado), fue de 90.8 % (CI del 95 %: 80.8, 100.0)
Para evaluar la precisión intermedia entre instrumentos se tiñeron dos portaobjetos por caso en cada uno de los tres instrumentos BenchMark ULTRA PLUS. El porcentaje de concordancia global de la tinción con VENTANA HER2 DUAL ISH COCKTAIL, en función del estado del gen HER2 (HER2 amplificado, HER2 no amplificado), fue de 92.6% (CI del 95%: 84.5, 100.0).
Sensibilidad y especificidad:
Se determinó la especificidad analítica (eficacia de la hibridación) del ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL mediante la tinción de las extensiones en metafase normales humanas en un instrumento BenchMark ULTRA. De 100 extensiones en metafase analizadas, en el 100% se observó la localización conjunta específica de ambas sondas HER2 y Cromosoma 17.
La sensibilidad analítica mide la capacidad de la sonda de detectar su diana específica y la especificidad, la capacidad de diferenciarla del resto de las secuencias de la muestra. El ensayo contiene un control de sensibilidad y especificidad analítica integrado en cada tejido humano. Las células humanas normales (entre otras, los fibroblastos estromales, las células endoteliales, los linfocitos y las células epiteliales de mama no neoplásicas) deberían contener 1-2 copias de HER2 y Chr17. Por lo tanto, esas 1-2 copias de HER2 y Chr17 de las células humanas normales indican que las sondas están detectando su diana específica, midiendo, en consecuencia, la sensibilidad. La presencia de una a dos copias de HER2 y Chr17 en las células normales indica también que la sonda están detectando únicamente su diana específica, midiendo, en consecuencia, la especificidad. El primer porcentaje de aptos del ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIl en 40 muestras de tejido de mama fijado de conformidad con las directrices ASCO CAP (NBF al 10% durante un plazo de 6 a 72 horas) fue de 97.5% (87.1-99.6) en instrumentos BenchMark ULTRA; de 100% (91.2-100) en instrumentos BenchMark XT y de 97.5% (87.1-99.6) en instrumentos BenchMark GX. En las mismas 40 muestras de tejido de mama, la especificidad sin control de la sonda fue de 100% (91.2-100) en instrumentos BenchMark ULTRA.
El primer porcentaje de aptos del ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en 39 muestras de tejido gástrico fijado de conformidad con las directrices ASCO CAP (NBF al 10% durante un plazo de 6 a 72 horas) fue de 97.4% (86.8-99.5) en instrumentos BenchMark ULTRA; de 97.4% (86.8-99.5) en instrumentos BenchMark XT y de 100% (91-100) en instrumentos BenchMark GX.
También se evaluó la sensibilidad analítica y la especificidad mediante la tinción de varios casos de tejidos humanos normales y neoplásicos con el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL, VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit. Los resultados se muestran en la Tabla 27 y la Tabla 28. No se observó ninguna tinción no prevista en los tejidos normales y neoplásicos con el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL.
Tabla 27. La sensibilidad/especificidad del ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL se determinó analizando tejidos normales FFPE
|
Tejido |
Nº de casos aceptables/ total |
Tejido |
Nº de casos aceptables/ total |
|---|---|---|---|
|
Glándula suprarrenal |
3/3 |
Pulmón |
3/3 |
|
Vejiga |
3/3 |
Ganglio linfático |
3/3 |
|
Médula ósea |
3/3 |
Mesotelio |
3/3 |
|
Ovario |
3/3 |
Páncreas |
3/3 |
|
Mama |
3/3 |
Glándula paratiroidea |
3/3 |
|
Cerebelo |
3/3 |
Nervio periférico |
3/3 |
|
Cerebro |
3/3 |
Próstata |
3/3 |
|
Cuello del útero |
3/3 |
Músculo esquelético |
3/3 |
|
Colon |
3/3 |
Piel |
3/3 |
|
Endometrio |
3/3 |
Bazo |
3/3 |
|
Esófago |
3/3 |
Estómago |
3/3 |
|
Corazón |
3/3 |
Testículos |
3/3 |
|
Hipófisis (pituitaria) |
3/3 |
Timo |
3/3 |
|
Intestino |
3/3 |
Tiroides |
3/3 |
|
Riñón |
3/3 |
Glándula salival/lingual |
3/3 |
|
Hígado |
3/3 |
Amígdala |
3/3 |
Tabla 28. La sensibilidad/especificidad del ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL se determinó analizando una variedad de tejidos neoplásicos FFPE
|
Patología |
Nº de casos aceptables/ total |
|---|---|
|
Glioblastoma (cerebro) |
3/3 |
|
Meningioma (cerebro) |
1/1 |
|
Oligodendroglioma (cerebro) |
1/1 |
|
Carcinoma endometrioide (ovario) |
1/1 |
|
Adenocarcinoma (ovario) |
1/1 |
|
Neoplasia neuroendocrina pancreática (páncreas) |
1/1 |
|
Adenocarcinoma (páncreas) |
1/1 |
|
Seminoma (testículos) |
1/1 |
|
Carcinoma embrionario (testículos) |
1/1 |
|
Carcinoma medular (tiroides) |
1/1 |
|
Carcinoma papilar (tiroides) |
1/1 |
|
Carcinoma ductal in situ (mama) |
1/1 |
|
Carcinoma ductal invasivo (mama) |
2/2 |
|
Linfoma de linfocitos B; sin especificar (bazo) |
1/1 |
|
Carcinoma de células pequeñas (pulmón) |
1/1 |
|
Carcinoma de células escamosas (pulmón) |
1/1 |
|
Adenocarcinoma (esófago) |
1/1 |
|
Carcinoma de células escamosas (esófago) |
1/1 |
|
Adenocarcinoma (estómago) |
1/1 |
|
Adenocarcinoma (unión gastroesofágica) |
1/1 |
|
Adenocarcinoma (intestino delgado) |
1/1 |
|
Tumor estromal gastrointestinal (GIST) (intestino delgado) |
1/1 |
|
Tumor estromal gastrointestinal (GIST) (colon) |
1/1 |
|
Adenocarcinoma (colon) |
1/1 |
|
Adenocarcinoma (recto) |
1/1 |
|
Tumor estromal gastrointestinal (GIST) (recto) |
1/1 |
|
Hepatoblastoma (hígado) |
1/1 |
|
Carcinoma hepatocelular (hígado) |
1/1 |
|
Carcinoma de células claras (riñón) |
1/1 |
|
Adenocarcinoma (próstata) |
2/2 |
|
Leiomioma (útero) |
1/1 |
|
Adenocarcinoma endometrioide (útero) |
1/1 |
|
Carcinoma de células claras (útero) |
1/1 |
|
Carcinoma de células escamosas (cuello uterino) |
2/2 |
|
Rabdomiosarcoma embrionario (músculo estriado) |
1/1 |
|
Carcinoma de células escamosas (piel) |
1/1 |
|
Carcinoma de células basales (piel) |
1/1 |
|
Neurofibroma (lumbar) |
1/1 |
|
Neuroblastoma (retroperitoneo) |
1/1 |
|
Mesotelioma (peritoneo) |
1/1 |
|
Linfoma de linfocitos B, sin especificar (ganglio linfático) |
2/2 |
|
Linfoma de Hodgkin (ganglio linfático) |
3/3 |
|
Linfoma anaplásico de células grandes (ganglio linfático) |
1/1 |
|
Leiomiosarcoma (vejiga) |
1/1 |
|
Carcinoma urotelial (vejiga) |
1/1 |
|
Osteosarcoma (hueso) |
1/1 |
|
Mesotelioma (peritoneo) |
1/1 |
|
Leiomiosarcoma (músculo liso) |
1/1 |
USO PREVISTO:
VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL está destinado a la determinación del estado del gen HER2 a través de la enumeración de la proporción del gen HER2 respecto al Cromosoma 17 mediante microscopía óptica. Las sondas HER2 y Cromosoma 17 se detectan mediante hibridación in situ (ISH) cromogénica de dos colores en muestras de tejido de carcinoma gástrico y de mama humano fijado con formol y embebido en parafina, incluida la unión gastroesofágica, con una tinción posterior en instrumentos BenchMark IHC/ISH.

Figura 1.Estado de amplificación de HER2 con el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en carcinoma de mama.
VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL está indicado como ayuda en la evaluación de pacientes para quienes se considera la posibilidad de administrar un tratamiento con Herceptin (trastuzumab). La interpretación de este producto debe correr a cargo de un anatomopatólogo cualificado junto con un examen histológico, la información clínica pertinente y los controles adecuados.
Este producto está destinado para uso diagnóstico in vitro (IVD).
LIMITACIONES:
Limitaciones generales:
1. La ISH es una metodología que comprende varios pasos y requiere una formación especializada en cuanto a la correcta elección de los reactivos, el procesamiento y la preparación de muestras, la preparación de los portaobjetos de ISH y la interpretación de los resultados.
2. La tinción del tejido depende de la manipulación y el procesamiento del tejido antes de la tinción. Una fijación, congelación, descongelación, lavado, secado, calentamiento y seccionado incorrectos o la contaminación con otros tejidos o líquidos puede provocar la aparición de artefactos, que los reactivos queden atrapados en el tejido o la obtención de resultados falsos negativos y falsos positivos. La existencia de resultados incoherentes puede ser consecuencia de la introducción de variaciones en los métodos de fijación e inclusión o puede derivarse de las irregularidades características del tejido.
3. Una contratinción incompleta o excesiva puede comprometer la correcta interpretación de los resultados.
4. La interpretación clínica de cualquier tinción se debe evaluar en función del contexto de la historia clínica, la morfología y otros criterios histopatológicos. Es responsabilidad del anatomopatólogo cualificado estar familiarizado con los reactivos y los métodos que se utilizan para preparar la tinción. La tinción se debe llevar a cabo en un laboratorio certificado y con licencia y bajo la supervisión de un anatomopatólogo, que será el responsable de revisar los portaobjetos teñidos y de garantizar la idoneidad de los controles.
5. VENTANA proporciona reactivos con una dilución óptima para su uso siempre que se respeten las instrucciones que se suministran. Cualquier diferencia en la forma de llevar a cabo los procedimientos de prueba recomendados pueden invalidar los resultados previstos. Los usuarios que no sigan los procedimientos de prueba recomendados deberán hacerse responsables de la interpretación de los resultados de la paciente.
6. Debido a variaciones en el procesamiento de la muestra, puede que sea necesario aumentar o disminuir el tiempo de tratamiento previo con proteasa de la ISH. Además, el aumento o la reducción del acondicionamiento celular puede afectar a los resultados de la tinción. El usuario debe validar tales cambios. Los usuarios que no sigan los procedimientos de prueba recomendados deberán hacerse responsables de la interpretación de los resultados del paciente teniendo en cuenta las circunstancias.
7. Los reactivos pueden mostrar reacciones imprevistas en tejidos que no se hayan probado previamente. No es posible descartar totalmente la posibilidad de observar reacciones no previstas incluso en los grupos de tejidos probados, dada la variabilidad biológica de los tejidos. Póngase en contacto con el representante local de asistencia técnica de Roche y documente las reacciones imprevistas.
LIMITACIONES ESPECÍFICAS:
1. No todos los fijadores son compatibles con el ensayo. El fijador recomendado es NBF al 10% durante un periodo de 6 a 72 horas.
2. El ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL se ha desarrollado para la tinción de secciones de tejido cortadas con un grosor ~ 4 μm.20 Es posible que se produzca una pérdida de tejido en aquellas secciones con un grosor superior a los 4 μ m.
3. Es posible que no todos los ensayos estén registrado en todos los instrumentos. Póngase en contacto con el representante local de asistencia técnica de Roche para obtener más información.
4. Puede producirse una oxidación, un desvanecimiento o la desaparición de las señales de plata debido al uso de determinadas marcas de los medios de montaje. Consulte la Tabla 30 para conocer la compatibilidad de los medios de montaje.
5. Para evitar que se disuelva la señal de Red ISH, los portaobjetos teñidos no deben sumergirse en soluciones de acetona o alcohol para llevar a cabo la deshidratación. Se recomienda que se sequen al aire o que se sequen en un horno. Los portaobjetos teñidos deben estar completamente secos antes de aplicar el cubreobjetos.
6. Como ocurre en cualquier otra prueba, un resultado negativo significa que no se ha detectado una diana concreta, no necesariamente que esta no esté presente en las células o en el tejido que se ha usado para el ensayo.
7. La sonda se ha optimizado para su uso con los reactivos VENTANA en los instrumentos BenchMark IHC/ISH. Los usuarios que no sigan los procedimientos de prueba recomendados deberán hacerse responsables de la interpretación de los resultados del paciente teniendo en cuenta las circunstancias.
PREPARACIÓN DE MUESTRAS:
Los tejidos fijados con formol y embebidos en parafina (FFPE) que se procesan de forma habitual resultan adecuados para su uso con esta sonda cuando se utilizan con un instrumento BenchMark IHC/ISH. El fijador de tejido recomendado es formol tamponado neutro (NBF) al 10% durante un periodo de entre 6 y 72 horas.20 Aparte de los ensayos VENTANA, los estudios han concluido que la mayoría de los resultados del gen HER2 no concluyentes mediante FISH están relacionados con factores previos al análisis, como una fijación deficiente o demasiado prolongada,21 así como con los retrasos en la fijación.22 Una aplicación estricta de los procesos de fijación (p. ej., un procesador especializado que garantiza un tiempo mínimo de 6 horas de fijación) dio lugar a una reducción del 68.5% de los casos no concluyentes, del 10.8% de fallos al 3.4%. Las muestras fijadas en formol durante < 6 horas pueden dar lugar a una pérdida de señal y un exceso de digestión en el núcleo, según se observa por la tinción de hematoxilina pálida/débil. Únicamente se recomienda la fijación en NBF al 10%, dado que algunos fijadores producen una tinción variable con los ensayos basados en ISH (como el de Bouin’s y el de Alcohol Formalin-Acetic Acid [AFA]).21
Los portaobjetos deben teñirse inmediatamente, ya que la calidad de las dianas de ácido nucleico de los cortes de tejido puede disminuir con el tiempo. Estudios internos han concluido que los portaobjetos con secciones de mama y estómago que se conservan a una temperatura de entre 2 y 8 °C pueden permanecer estables durante 12 meses. Los portaobjetos con carga positiva pueden ser sensibles a tensiones ambientales que ocasionen una tinción inapropiada de cualquier ensayo de ISH (por ejemplo, falta de tinción o contratinción en el tejido). Solicite a su representante de servicio de Roche una copia de «Impact of environmental stress on various histology slide types» para comprender mejor cómo utilizar estos tipos de portaobjetos.
Las secciones deben cortarse con el grosor adecuado (4 μ m) en función del ensayo que se vaya a utilizar y se deben colocar en portaobjetos con carga positiva (Superfrost Plus o equivalentes). Es necesario drenar o secar los portaobjetos para eliminar cualquier resto de agua que se encuentre entre el portaobjetos y el tejido.
En las secciones cuyo grosor supere los 4 μ m puede ser necesario un tratamiento de proteasa más fuerte que el que se recomienda en las condiciones; además, puede presentar un burbujeo mayor en el núcleo que las secciones con menos grosor debido al exceso de parafina en el tejido. El burbujeo se observa en forma de burbujas pequeñas o grandes o vacuolas en el núcleo. Cuando se produce el burbujeo en el núcleo a menudo se observa un espectro de repercusiones en las señales de plata y de Red ISH que se caracteriza por 1) núcleos que presentan burbujas en los que las señales de plata y Red ISH se quedan generalmente en la ubicación central del núcleo y 2) núcleos que presentan burbujas que empujan las señales de plata y de Red ISH a la periferia. Con frecuencia en ambos casos, si las señales de plata y de Red ISH se perciben con claridad, no están distorsionadas de otro modo y todavía se pueden enumerar, el caso se puede puntuar. En ocasiones, sin embargo, un burbujeo importante en el núcleo puede distorsionar las señales de plata y de Red ISH o provocar que no se puedan diferenciar, de forma que no se pueda llevar a cabo una enumeración precisa. Este efecto se produce más a menudo cuando se empujan las señales de plata y de Red ISH a la periferia del núcleo. Cuando esto sucede, es posible encontrar núcleos en otras ubicaciones en la muestra que se pueden enumerar y que hacen posible puntuar el caso. Si el burbujeo es grave, hasta el punto de que no es posible encontrar los núcleos suficientes en los que se puedan enumerar de forma fiable las señales de plata y Red ISH, no será posible asignar una puntuación al caso. El burbujeo en el núcleo puede producirse también cuando la fijación es insuficiente (1-3 horas con formol), aunque en este caso es menos discreto. Es posible solucionarlo en una fijación de 3 horas con un cambio en el tratamiento de acondicionamiento celular o de proteasa pero casi imposible en los casos de una fijación de 1 hora.
El ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL se ha desarrollado con opciones adicionales de tratamiento previo que pueden servir de ayuda para optimizar el ensayo en diferentes laboratorios y para la consecuente resolución de problemas en casos concretos de tejidos o portaobjetos que presenten una tinción que no sea óptima. Se recomienda que cada laboratorio lleve a cabo sesiones iniciales en muestras de control representativas que se hayan preparado en las mismas condiciones que las muestras clínicas que se van a analizar. Esto ayudará a optimizar las condiciones de tinción específicas de los laboratorios individuales, que pueden variar en los procedimientos exactos de preparación de muestras respectivos. Es posible que se obtengan resultados variables como consecuencia de la existencia de factores previos al análisis diferentes de los que se han recomendado. Es posible que la tinción de las muestras cuya preparación previa al análisis se lleva a cabo en condiciones que no son las recomendadas no llegue a ser nunca la apropiada con el ensayo.
PRINCIPIO DEL PROCEDIMIENTO:
VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL contiene sondas HER2 (marcadas con dinitrofenilo hapteno o DNP) y sondas Chromosome 17, marcadas con digoxigenina hapteno o DIG, que se han formulado a partir de un tampón con base de formamida. Las sondas están diseñadas para detectar la amplificación del gen HER2 en carcinoma de mama invasivo y GEA. La sonda HER2 DNA Probe es una mezcla de oligosondas cuya diana específica es el gen HER2 (también conocido como ERBB2 y NEU) ubicado en el Cromosoma 17 (17q12) humano. La sonda Cromosoma 17 es una mezcla de oligosondas cuya diana son las secuencias de la región centromérica y que sirve de referencia para detectar la aneusomía. Los números de copia de ambas sondas se enumeran en los núcleos tumorales y los resultados se presentan como una proporción de HER2/Cromosoma 17 para determinar el estado de amplificación de HER2 (si la proporción de HER2/Cromosoma 17 es ≥ 2.0, hay amplificación; si la proporción es < 2.0, no hay amplificación). VENTANA HER2 DUAL ISH DNA PROBE COCKTAIl se ha formulado de forma óptima para su uso con VENTANA Silver ISH DNP Detection Kit, VENTANA Red ISH DIG Detection Kit y los reactivos auxiliares en un instrumento BenchMark IHC/ISH.
El kit de detección contiene un anticuerpo primario y un anticuerpo secundario marcado con enzimas conjugado con peroxidasa de rábano (HRP) o fosfatasa alcalina (AP), que se utiliza como enzima cromogénica. Durante el procedimiento de tinción de la hibridación in situ doble Dual (Dual ISH), las sondas marcadas con DNP y DIG se cohibridan con sus respectivas secuencias de ADN diana específicas dentro del núcleo celular. La detección de la sonda HER2 marcada con DNP se produce en primer lugar mediante el VENTANA Silver ISH (SISH) DNP Detection Kit, que contiene los siguientes dispensadores: anticuerpo primario anti-DNP de ratón marcado con hidroxiquinoxalina (HQ), anticuerpo secundario anti-HQ de ratón conjugado con peroxidasa de rábano (HRP), Chromogen A (Silver A), Chromogen B (Silver B) y Chromogen C (Silver C). Tras la incubación con el anticuerpo primario anti-DNP de ratón marcado con HQ y después con el conjugado de anticuerpo secundario anti-HQ de ratón conjugado con HRP, se produce la reacción SISH. En resumen, la incorporación secuencial de los cromógenos A (acetato de plata), B (hidroquinona) y C (H2O2) es la que origina esta reacción. Aquí, la hidroquinona reduce a los iones de plata (Ag+) a átomos de plata metálica (Ag0). El sustrato de HRP y el peróxido de hidrógeno (Chromogen C) favorecen la reacción. El precipitado de plata se deposita en los núcleos y se puede observar una copia sencilla del gen HER2 en forma de punto negro. La reacción SISH se ilustra en la Figura 2.
Tras la detección mediante SISH de HER2, se identifica la sonda Cromosoma 17 marcada con DIG mediante el VENTANA Red ISH DIG Detection Kit. Este kit contiene los siguientes dispensadores: anticuerpo primario anti-DIG de ratón marcado con nitropirazol (NP), anticuerpo secundario anti-NP de ratón conjugado con fosfatasa alcalina (AP), pH Enhancer, Naphthol y Fast Red. Tras el desarrollo de las señales de plata, el portaobjetos se incuba con el anticuerpo primario anti-DIG de ratón marcado con NP, que se une al hapteno DIG en la sonda Cromosoma 17. El anticuerpo primario anti-hapteno se detecta mediante el conjugado del anti-NP de ratón con una enzima AP. Se incuba el portaobjetos con la solución pH Enhancer, que aporta los componentes salinos, así como las concentraciones y el pH tamponado necesarios para que el rendimiento de la enzima AP sea óptimo. A continuación se aplica el naftol fosfato, que sirve como sustrato para la enzima AP (naftol defosforilado por AP). Fast Red se incorpora al portaobjetos a continuación y, combinado con el naftol defosforilado, forma un precipitado rojo que se puede visualizar mediante microscopía óptica. La reacción Red ISH se ilustra en la Figura 3. A continuación es necesaria la contratinción de la muestra con Hematoxylin II para poder llevar a cabo la interpretación mediante microscopía óptica.
El protocolo de tinción está formado por diversos pasos en los que los reactivos se incuban durante periodos predeterminados y a temperaturas específicas. Al final de cada paso de incubación, el instrumento BenchMark IHC/ISH lava las secciones para eliminar el material que no se ha ligado y aplica un cubreobjetos líquido que minimiza la evaporación de los reactivos acuosos del portaobjetos. Los resultados se interpretan mediante microscopía óptica con objetivos de 20x, 40x o 60x.
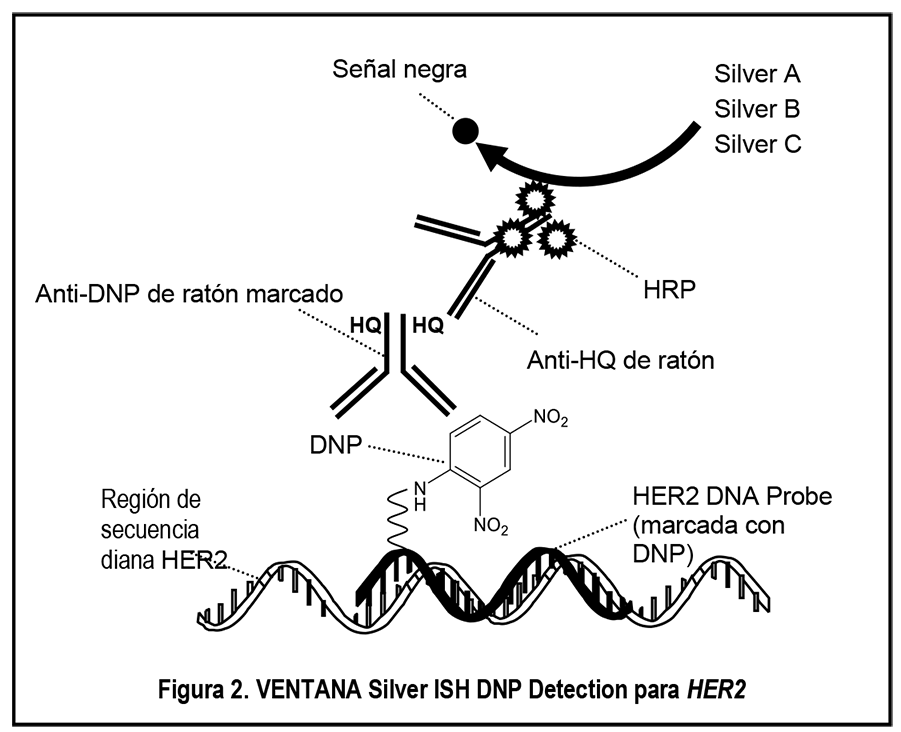
Figura 2. VENTANA Silver ISH DNP Detection para HER2.
 Figura 3. Detección VENTANA Red ISH DIG
Figura 3. Detección VENTANA Red ISH DIG
para Cromosoma 17.
PROCEDIMIENTO DE TINCIÓN:
Las sondas VENTANA se han desarrollado para su uso en un instrumento BenchMark IHC/ISH junto con los kits de detección VENTANA y sus accesorios. Los procedimientos de tinción para el instrumento BenchMark IHC/ISH con VENTANA Silver ISH DNP Detection Kit y VENTANA Red ISH DIG Detection Kit se indican en la Tabla 2. Los protocolos de tinción recomendados se enumeran en la Tabla 3.
Los parámetros de los procedimientos automatizados se pueden visualizar, imprimir y editar según el procedimiento descrito en el Manual del usuario del instrumento. Consulte la hoja de datos correspondiente del kit de detección de VENTANA para obtener más información.
Para obtener más información sobre el uso adecuado de este dispositivo, consulte la hoja de datos del dispensador en línea asociada al N/P 800-6043.
Tabla 2. Para llevar a cabo el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en los instrumentos BenchMark IHC/ISH, utilice los siguientes procedimientos de tinción
|
Plataforma del instrumento |
Procedimiento de tinción |
|
BenchMark GX |
GX VENTANA HER2 DISH DNA PRB CKT |
|
BenchMark XT |
XT VENTANA HER2 DISH DNA PRB CKT |
|
BenchMark ULTRA o BenchMark ULTRA PLUS |
U VENTANA HER2 DISH DNA PRB CKT |
Tabla 3. Condiciones recomendadas para la tinción del ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL en los instrumentos BenchMark IHC/ISH
|
Condición de tinción |
Mama |
Gástrico |
|
Horneado |
No seleccionado |
No seleccionado |
|
Cell Conditioning 1 |
16 minutos |
16 minutos |
|
Cell Conditioning 2 |
24 minutos |
16 minutos |
|
ISH Protease 3 |
20 minutos |
16 minutos |
|
Temperatura de lavado de restricción |
76 °C en instrumentos BenchMark GX/XT |
76 °C en instrumentos BenchMark GX/XT |
|
74 °C en instrumentos BenchMark ULTRA o ULTRA PLUS |
74 °C en instrumentos BenchMark ULTRA o ULTRA PLUS |
Debido a variaciones en la fijación y el procesamiento del tejido, así como a las condiciones generales de los instrumentos y del entorno del laboratorio, puede que sea necesario aumentar o disminuir el tiempo de tratamiento previo con acondicionamiento celular o de la proteasa en función de las muestras particulares.
Inicio de una sesión en instrumentos BenchMark IHC/ISH:
1. Coloque la etiqueta de código de barras de portaobjetos que se corresponda con el protocolo de la sonda que se va a llevar a cabo.
2. Cargue el ensayo VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL, los reactivos de los kits de detección VENTANA Red ISH DIG y VENTANA Silver ISH DNP Detection Kit y los reactivos auxiliares necesarios en las bandejas de reactivos o el carrusel. Coloque las bandejas de reactivos o el carrusel en el instrumento.
3. Compruebe los fluidos y los residuos.
4. Las botellas del tampón de reacción deben estar llenas.
5. El recipiente de residuos se debe vaciar antes de comenzar la sesión.
6. Cargue los portaobjetos en el instrumento.
7. Inicie la sesión de tinción.
8. Cuando haya finalizado la sesión, retire los portaobjetos del instrumento. Los portaobjetos teñidos contendrán restos del tampón y de la solución líquida cubreobjetos. Lleve a cabo el lavado y la deshidratación (consulte las instrucciones más abajo).
Procedimiento de deshidratación:
Nota: El cromógeno Fast Red es soluble en alcohol y acetona. La exposición de los portaobjetos teñidos a alcohol y/o acetona puede dar lugar a una pérdida de señal específica.
1. Para eliminar la solución líquida de cubreobjetos, lave de forma secuencial los portaobjetos en dos soluciones de detergente lavavajillas suave (no debe utilizarse detergente desarrollado para lavavajillas automáticos).
2. Enjuague bien los portaobjetos con agua destilada durante aproximadamente un minuto. Retire el exceso de agua.
3. Coloque los portaobjetos en el horno (a una temperatura de entre 45 y 60 °C) para secarlos o déjelos secar al aire a temperatura ambiente. Si utiliza el horno, el rango de tiempo para el secado varía entre 10 minutos y una hora (el secado de los portaobjetos teñidos durante un periodo más prolongado no parece tener consecuencias en los resultados de la tinción). Compruebe que los portaobjetos están completamente secos antes de aplicar el cubreobjetos, dado que los restos de agua en los portaobjetos pueden interferir con el proceso de aplicación de cubreobjetos y provocar que se formen burbujas.
4. Transfiera los portaobjetos a una solución de xileno durante unos 30 segundos.
5. Aplique los medios de montaje en el portaobjetos.
6. Coloque el cubreobjetos en el portaobjetos. Tenga en cuenta que ciertos medios de montaje no son compatibles con el ensayo y no deberían usarse (consulte las secciones Limitaciones y Resolución de problemas).
RESUMEN Y EXPLICACIÓN:
El receptor 2 del factor de crecimiento epidérmico humano (HER2) es un miembro de la subfamilia de factores de crecimiento epidérmicos de receptores transmembrana de tirosina quinasa que inducen el crecimiento, la diferenciación y la supervivencia de las células.1,2 En aproximadamente un 15 al 30 por ciento de los carcinomas de mama se observa una sobreexpresión de la proteína HER2, la amplificación del gen HER2 (ERBB2) o ambas.3,4 La detección del estado del gen HER2 y/o de la proteína en los carcinomas de mama invasivos permite a los médicos tomar decisiones más informadas a fin de mejorar la gestión general del cuidado de estas pacientes.5 El estado de HER2 es un factor predictivo establecido de la respuesta al tratamiento dirigido a HER2 en pacientes con cáncer de mama.5,6,7
Trastuzumab (Herceptin) es un anticuerpo monoclonal humanizado dirigido contra el dominio extracelular de HER2 y se ha demostrado que aporta beneficios a pacientes con cáncer de mama con HER2 positivo.8-13 La demostración de la amplificación del gen HER2 y/o la sobreexpresión de proteína es fundamental para seleccionar pacientes para el tratamiento con trastuzumab.5,14
De manera similar, la amplificación del gen HER2 o la sobreexpresión de proteína ocurre en el adenocarcinoma de la unión gastroesofágica y gástrico (denominado en conjunto como adenocarcinoma gastroesofágico o GEA).15,16,17 Se ha notificado un amplio intervalo de frecuencia de sobreexpresión de HER2 en los diversos estudios publicados. Sin embargo, uno de los conjuntos de datos de cribado más grandes que incluía a 3803 pacientes con GEA notificó que el 22 por ciento de los pacientes tuvieron un resultado positivo para la amplificación del gen o la expresión de la proteína HER2.18 En la mayoría de los estudios, se sugiere que en ausencia de tratamiento dirigido a HER2, la sobreexpresión de HER2 es un factor de pronóstico negativo.19
El tratamiento dirigido a HER2 con trastuzumab es un elemento fundamental en el tratamiento del carcinoma de mama invasivo y tiene valor terapéutico en el tratamiento de pacientes con cáncer gástrico/GEA que presentan una sobreexpresión del receptor.15,17 La demostración de la amplificación del gen HER2 y/o la sobreexpresión de proteína es fundamental para seleccionar pacientes para el tratamiento con trastuzumab.15,19 Se ha demostrado en estudios clínicos que los pacientes con cáncer de mama o cáncer gástrico/GEA con una alta sobreexpresión de proteína HER2 y/o amplificación del gen se benefician en mayor medida de trastuzumab.3,15
REFERENCIAS:
1. Moasser MM. The Oncogene Her2: Its Signaling and Transforming Functions and Its Role in Human Cancer Pathogenesis. Oncogene. 2007;26(45):6469-6487.
2. Hsu JL, Hung MC. The Role of Her2, Egfr, and Other Receptor Tyrosine Kinases in Breast Cancer. Cancer Metastasis Rev. 2016;35(4):575-588.
3. Hudis CA. Trastuzumab--Mechanism of Action and Use in Clinical Practice. N Engl J Med. 2007;357(1):39-51.
4. Cornejo KM, Kandil D, Khan A, et al. Theranostic and Molecular Classification of Breast Cancer. Arch Pathol Lab Med. 2014;138(1):44-56.
5. Cardoso F, Kyriakides S, Ohno S, et al. Early Breast Cancer: ESMO Clinical Practice Guidelines for Diagnosis, Treatment and Follow-Up. Ann Oncol. 2019.
6. Ferretti G, Felici A, Papaldo P, et al. Her2/Neu Role in Breast Cancer: From a Prognostic Foe to a Predictive Friend. Curr Opin Obstet Gynecol. 2007;19(1):56-62.
7. Moasser MM, Krop IE. The Evolving Landscape of Her2 Targeting in Breast Cancer. JAMA Oncol. 2015;1(8):1154-1161.
8. Vogel CL, Cobleigh MA, Tripathy D, et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol. 2002;20:719-726.
9. Baselga J, Carbonell X, Castaneda-Soto NJ, et al. Phase II study of efficacy, safety, and pharmacokinetics of trastuzumab monotherapy administered on a 3-weekly schedule. J Clin Oncol. 2005;23:2162-2171.
10. Slamon DJ, Leyland-Jones B, Shak S, et al. Concurrent administration of anti-HER2 monoclonal antibody and first-line chemotherapy for HER2-overexpressing metastatic breast cancer. A phase III, multinational, randomized controlled trial. N Engl J Med. 2001;344:783-792.
11. Marty M, Cognetti F, Maraninichi D, et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatments: The M77001 Study Group. J Clin Oncol. 2005;23:4265-4274.
12. Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med. 2005;353:1659-1672.
13. Romond EH, Perez EA, Bryant J, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med. 2005;353:1673-1684.
14. Wolff AC, Hammond MEH, Allison KH, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Arch Pathol Lab Med. 2018;142(11):1364-1382
15. Bang YJ, Van Cutsem E, Feyereislova A, et al: ToGA Trial Investigators: Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): A phase 3, open-label, randomised controlled trial. Lancet 2010;376:687-697.
16. Subasinghe D, Acott N, Kumarasinghe MP. A Survival Guide to Her2 Testing in Gastric/Gastroesophageal Junction Carcinoma. Gastrointest Endosc. 2019;90(1):44-54.
17. Smyth EC, Verheij M, Allum W, et al. Gastric Cancer: Esmo Clinical Practice Guidelines for Diagnosis, Treatment and Follow-Up. Ann Oncol. 2016;27(suppl 5):v38-v49
18. Van Cutsem E, Bang YJ, Feng-Yi F, et al. Her2 Screening Data from Toga: Targeting Her2 in Gastric and Gastroesophageal Junction Cancer. Gastric Cancer. 2015;18(3):476-484.
19. Abrahao-Machado LF, Scapulatempo-Neto C. Her2 Testing in Gastric Cancer: An Update. World J Gastroenterol. 2016;22(19):4619-4625.
20. Carson FL, Cappellano C. Histotechnology; A Self-Instructional Text, 5th edition. American Society for Clinical Pathology Press; 2020, 2022.
21. Middleton LP, et al. Implementation of American Society of Clinical Oncology/College of American Pathologists HER2 Guideline Recommendations in a tertiary care facility increases HER2 immunohistochemistry and fluorescence in situ hybridization concordance and decreases the number of inconclusive cases. Arch Pathol Lab Med. 2009;133:775-780.
22. Khoury T, Sait S, Hwang H, Chandrasekhar R, Wilding G, Tan D, Kulkami S. Delay to formalin fixation effect on breast biomarkers. Mod Pathol. 2009;22:1457-1467.
23. Occupational Safety and Health Standards: Occupational exposure to hazardous chemicals in laboratories. (29 CFR Part 1910.1450). Fed. Register.
24. Directive 2000/54/EC of the European Parliament and Council of 24 June 2020 on the protection of workers from risks related to exposure to biological agents at work.
25. College of American Pathologists Laboratory Accreditation Program, Anatomic Pathology Checklist, 2007.CLSI (formerly NCCLS). Quality Assurance for Design Control and Implementation of Immunocytochemistry Assays: Approved Guideline-Second Edition. CLSI document I/LA28-A2 (ISBN 1-56238-745-6). CLSI, 950 West Valley Road, Suite 2500, Wayne, PA 19087-1898 USA, 2011.
26. Reinholz MM, et al. Breast cancer and aneusomy 17: Implications for carcinogenesis and therapeutic response. Lancet Oncol. 2009 Mar;10:267-277.
27. Reinholz MM, et al. Breast cancer and aneusomy 17: Implications for carcinogenesis and therapeutic response. Lancet Oncol. 2009 Mar;10:267-277.
Nota: En este documento siempre se ha usado el punto como separador decimal para marcar el borde entre la parte entera y la parte fraccionaria de los numerales con decimales. No se han usado separadores para las unidades de millar.
El resumen de los aspectos de seguridad y rendimiento se puede ver a continuación: https://ec.europa.eu/tools/eudamed
Símbolos:
VENTANA usa los siguientes símbolos y signos además de los indicados en la norma ISO 15223-1 (para USA: consulte elabdoc.roche.com/symbols para obtener más información).
|
GTIN |
Número mundial de artículo comercial |
|
Rx only |
Para USA: Precaución: Las normas nacionales restringen la venta de este dispositivo a médicos autorizados o por orden de estos. |
Propiedad intelectual:
VENTANA, BENCHMARK, HYBREADY, PATHWAY y ULTRAVIEW son marcas comerciales de Roche. Todos los demás nombres de productos y marcas comerciales pertenecen a sus respectivos propietarios.
© 2025 Ventana Medical Systems, Inc.
For USA: Rx only
Información de contacto:
ROCHE DIAGNOSTICS GMBH
Sandhofer Strasse 116
D-68305 Mannheim Germany
+800 5505 6606
|
Apéndice A: Formulario de puntuación de VENTANA HER2 DUAL ISH DNA PROBE COCKTAIL |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1. ID de caso/ID de paciente: |
2. ¿Es posible enumerar el caso? 2a.Sí: continúe con el nº 3 2b. No: omita el nº 3. Continúe con el nº 4 |
3. ¿El tumor presenta heterogeneidad? 3a. Sí: omita el n.º 4. Continúe con el n.º 5. 3b. No: omita el n.º 4. Continúe con el n.º 5. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4. El caso no se puede enumerar porque (marque TODAS las respuestas que correspondan): |
4a. No quedaba tejido en el portaobjetos con tinción ISH |
4b. No había carcinoma invasivo en el tejido del portaobjetos con tinción ISH |
4c. La morfología del núcleo no es aceptable; no es posible diferenciar los elementos estructurales del tejido de células normales de los de las células diana de carcinoma. |
4d. El fondo no es aceptable, interfiere con la puntuación del portaobjetos con tinción ISH HER2 Chr 17 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4e. No es posible detectar la señal del control positivo interno HER2 Chr 17 |
4f. Tinción ISH débil o ausente en las células diana; no es posible asignar una puntuación HER2 Chr 17 |
4g. Otros (especificar): |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
5. Enumere la Zona diana 1: Cuente la señal HER2 y la señal Chr17 en cada uno de los 20 núcleos. Añada el recuento de la señal HER2. Añada el recuento de Chr 17. Calcule la proporción del estado del gen dividiendo el recuento TOTAL de la señal HER2 por el recuento TOTAL de la señal Chr 17. Redondee a la primera posición decimal. Anote el recuento, si corresponde, de grupos de señales.
6. Resultados de los 20 núcleos: 6a. No amplificados: HER2/Chr17 < 2.0 o 6b. Amplificados: HER2/Chr17 ≥ 2.0 Si la proporción HER2/Chr17 se encuentra entre 1.8 y 2.2, será necesario enumerar otros 20 núcleos. 7. Enumere la Zona diana 2: Cuente la señal HER2 y la señal Chr17 en cada uno de los 20 núcleos. Añada el recuento de la señal HER2. Añada el recuento de Chr 17. Anote el recuento, si corresponde, de grupos de señales.
8. Resultados de todos los 40 núcleos: 8a. Total HER2 Zona diana 1 + Total HER2 Zona diana 2 = Recuento total HER2 8c. Proporción: Total HER2 / Total Chr17 (proviene de la casilla 5u) (proviene de la casilla 7u) 8b. Total Chr17 Zona diana 1 + Total Chr17 Zona diana 2 = Recuento total Chr17 (proviene de la casilla 5u) (proviene de la casilla 7u) 8d. Resultado final de los 40 núcleos: No amplificados: HER2/Chr17 < 2.0 o Amplificados: HER2/Chr ≥ 2.0 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Puntuación asignada por: |
Fecha: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||