
TRELEGY
FLUTICASONA, UMECLIDINIO, VILANTEROL
Polvo para inhalación
1 Caja, 1 Dispositivo inhalador, 30 Dosis,
Para visualizar el contenido completo de la IPPA (información para prescribir amplia), deberá iniciar sesión.
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada dosis contiene:
Furoato de fluticasona 100 mcg
Bromuro de umeclidinio equivalente a 62.5 mcg de Umeclidinio
Trifenatato de vilanterol equivalente a 25 mcg de Vilanterol
Excipiente cbp
INDICACIONES TERAPÉUTICAS: TRELEGY está indicado para el tratamiento de mantenimiento para prevenir y aliviar síntomas asociados con la enfermedad pulmonar obstructiva crónica (EPOC).
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacodinamia:
Código ATC:
Grupo farmacoterapéutico: Fármacos para enfermedades obstructivas de las vías respiratorias, Adrenérgicos en combinación con anticolinérgicos que incluyen combinaciones triples con corticosteroides.
Código ATC: R03AL08.
Mecanismo de acción: El Furoato de fluticasona, umeclidinio y vilanterol representan tres clases de fármacos: un corticosteroide sintético, un antagonista de los receptores muscarínicos de larga acción (también denominado LAMA o anticolinérgico) y un agonista de los receptores beta2 de larga acción (LABA), respectivamente.
Furoato de fluticasona: El Furoato de fluticasona es un corticosteroide con una potente actividad antiinflamatoria. Se desconoce el mecanismo preciso a través del cual el Furoato de fluticasona afecta los síntomas de EPOC. Los corticosteroides han demostrado tener un amplio rango de acciones en múltiples tipos de células (ej. eosinófilos, macrófagos, linfocitos) y mediadores (ej. citosinas y quimiocinas) que participan en la inflamación.
Umeclidinio: El umeclidinio es un antagonista de los receptores pan-muscarínicos de larga acción (también denominados anticolinérgicos). El umeclidinio ejerce su actividad broncodilatadora al inhibir competitivamente la unión de la acetilcolina con los receptores colinérgicos muscarínicos en el músculo liso de las vías aéreas. Demuestra una lenta reversibilidad en el subtipo de receptor muscarínico M3 humano in vitro y una larga duración de acción in vivo cuando se administra directamente a los pulmones en los modelos preclínicos.
Vilanterol: Vilanterol es un LABA selectivo. Los efectos farmacológicos de los fármacos agonistas de los adrenoceptores beta 2, incluyendo vilanterol, son al menos en parte atribuibles a la estimulación de la adenilato ciclasa intracelular, la enzima que cataliza la conversión de adenosina trifosfato (ATP) a adenosina monofosfato 3’,5’ cíclico (AMP cíclico). Los niveles elevados de AMP cíclico provocan la relajación del músculo liso bronquial y la inhibición de la liberación de los mediadores de hipersensibilidad inmediata de las células, especialmente de las células mastoides.
Efectos farmacodinámicos:
Efectos cardiovasculares: El efecto de TRELEGY sobre el intervalo QT no se ha evaluado en un estudio detallado QT (TQT).
Los estudios TQT para furoato de fluticasona/vilanterol y umeclidinio/vilanterol no mostraron efectos clínicamente relevantes sobre el intervalo QT con dosis clínicas de furoato de fluticasona, umeclidinio y vilanterol (véase a continuación).
El efecto de umeclidinio/vilanterol sobre el intervalo QT se evaluó en un estudio de QT controlado con placebo y moxifloxacino que incluyó una administración una vez al día de 125/25 microgramos o 500/100 microgramos de umeclidinio/vilanterol por 10 días en 103 voluntarios sanos. La media de la diferencia máxima en las prolongaciones del intervalo QT (corregido usando el método de Fridericia, QTcF) del placebo después de la corrección inicial fue 4.3 (CI de 90%: 2.2, 6.4) milisegundos observada 10 minutos después de la administración con 125/25 microgramos de umeclidinio/vilanterol y 8.2 (CI de 90%: 6.2, 10.2) milisegundos 30 minutos después de la administración con 500/100 microgramos de umeclidinio/vilanterol.
No se observó ningún efecto clínicamente relevante sobre la prolongación del intervalo QT (corregido usando el método de Fridericia) con la dosis de 125/25 microgramos de umeclidinio/vilanterol. Además, no se observaron efectos clínicamente significativos de umeclidinio/vilanterol sobre el ritmo cardiaco en un monitoreo Holter de 24 horas en 281 pacientes que recibieron 125/25 microgramos de umeclidinio/vilanterol una vez al día por hasta 12 meses.
El efecto de Furoato de fluticasona/vilanterol sobre el intervalo QT se evaluó en un estudio cruzado, doble ciego, de múltiples dosis, controlado con placebo y fármaco positivo en 85 voluntarios sanos. La media de la diferencia máxima (límite de confianza superior de 95%) en el QTcF a partir del placebo después de la corrección inicial fue 4.9 (7.5) milisegundos y 9.6 (12.2) milisegundos observada 30 minutos después de la dosificación con 200/25 microgramos de Furoato de fluticasona/vilanterol y 800/100 microgramos de Furoato de fluticasona/vilanterol, respectivamente. También se observó un incremento dependiente de la dosis en la frecuencia cardiaca. La media de la diferencia máxima (límite superior de confianza de 95%) en la frecuencia cardiaca a partir del placebo después de la corrección inicial fue 7.8 (9.4) latidos/min y 17.1 (18.7) latidos/min observada 10 minutos después de la dosificación con 200/25 microgramos de Furoato de fluticasona/vilanterol y 800/100 microgramos de Furoato de fluticasona/vilanterol, respectivamente.
No se observaron efectos clínicamente relevantes sobre el intervalo QTc en la revisión de los ECG que tuvieron una lectura central de 911 sujetos con EPOC expuestos a TRELEGY por hasta 24 semanas o en el subconjunto de 210 sujetos expuestos por hasta 52 semanas.
Farmacocinética: Cuando se administraron Furoato de fluticasona, umeclidinio y vilanterol en combinación por vía inhalada a partir de un inhalador único en sujetos sanos, la farmacocinética de cada componente fue similar a la observada cuando se administró cada sustancia activa ya sea como combinación de Furoato de fluticasona/vilanterol, como combinación de umeclidinio/vilanterol, o cada componente como monoterapia.
Se realizaron análisis PK de la población para furoato de fluticasona/umeclidinio/vilanterol utilizando un conjunto de datos de PK combinados de tres estudios fase III en 821 sujetos con EPOC. Los niveles sistémicos de fármaco (Cmax y AUC en estado estable) de furoato de fluticasona, umeclidinio y vilanterol después de la administración de furoato de fluticasona/umeclidinio/vilanterol en un inhalador (combinación triple) se encontraron dentro del rango de los observados después de la administración de furoato de fluticasona/vilanterol más umeclidinio a través de dos inhaladores, combinaciones dobles furoato de fluticasona/vilanterol y umeclidinio/vilanterol), o con inhaladores individuales (furoato de fluticasona, umeclidinio vilanterol).
Absorción:
Furoato de fluticasona: Después de la administración inhalada de TRELEGY en sujetos sanos, la Cmax de Furoato de fluticasona ocurrió a los 15 minutos. La biodisponibilidad absoluta de Furoato de fluticasona al administrarse como Furoato de fluticasona/vilanterol por inhalación fue en promedio 15.2%, principalmente debido a la absorción de la porción inhalada de la dosis administrada al pulmón, con una contribución insignificante a partir de la absorción oral. Después de la dosificación repetida de Furoato de fluticasona/vilanterol inhalados, el estado estable se alcanzó en 6 días con una acumulación de hasta 1.6 veces.
Umeclidinio: Después de la administración inhalada de TRELEGY en sujetos sanos, la Cmax de umeclidinio ocurrió a los 5 minutos. La biodisponibilidad absoluta de umeclidinio inhalado fue en promedio 13%, con una contribución insignificante a partir de la absorción oral. Después de la dosificación repetida de umeclidinio inhalado, el estado estable se alcanzó en 7 a 10 días con una acumulación de 1.5 a 2 veces.
Vilanterol: Después de la administración inhalada de TRELEGY en sujetos sanos, la Cmax de vilanterol ocurrió a los 7 minutos. La biodisponibilidad absoluta de vilanterol inhalado fue en promedio 27%, con una contribución insignificante a partir de la absorción oral. Después de la dosificación repetida de Furoato de fluticasona/vilanterol inhalados, el estado estable se alcanzó en 6 días con una acumulación de hasta 1.5 veces.
Distribución:
Furoato de fluticasona: Después de la administración intravenosa de Furoato de fluticasona a sujetos sanos, el volumen de distribución medio fue de 661 litros. La unión a proteínas plasmáticas in vitro en el plasma humano fue > 99.6%.
Umeclidinio: Después de la administración intravenosa de umeclidinio a sujetos sanos, el volumen de distribución medio fue 86 litros. La unión a proteínas plasmáticas in vitro en el plasma humano fue en promedio 89%.
Vilanterol: Después de la administración intravenosa de vilanterol a voluntarios sanos, el volumen de distribución medio en estado estable fue 165 litros. La unión a proteínas plasmáticas in vitro en el plasma humano fue en promedio 94%.
Metabolismo:
Furoato de fluticasona: Los estudios in vitro mostraron que el Furoato de fluticasona se metaboliza principalmente por CYP3A4 y es un sustrato para el transportador de P-glicoproteína (P-gp). El Furoato de fluticasona se metaboliza principalmente a través de hidrólisis del grupo S-fluorometil carbotioato a los metabolitos con una actividad de corticosteroides significativamente reducida. La exposición sistémica a los metabolitos es baja.
Umeclidinio: Los estudios in vitro mostraron que umeclidinio se metaboliza principalmente por CYP2D6 y es un sustrato para el transportador de P-gp. Las vías metabólicas primarias para umeclidinio son oxidación (hidroxilación, O-desalquilación) seguida de conjugación (glucuronidación, etc.), lo que resulta en un rango de metabolitos ya sea con una actividad farmacológica reducida o para la cual la actividad farmacológica no se ha establecido. La exposición sistémica a los metabolitos es baja.
Vilanterol: Los estudios in vitro mostraron que el vilanterol se metaboliza principalmente por medio de CYP3A4 y es un sustrato para el transportador de P-gp. Las vías metabólicas primarias son O-desalquilación a un rango de metabolitos con una actividad significativamente reducida beta1 y beta2 agonista. Los perfiles metabólicos plasmáticos después de la administración oral de vilanterol en un estudio radiomarcado humano fueron consistentes con un alto metabolismo de primer paso. La exposición sistémica a los metabolitos es baja.
Interacciones medicamentosas: Se realizó un estudio de dosis repetidas en sujetos sanos con la combinación de Furoato de fluticasona/vilanterol (200/25 microgramos) y ketoconazol (400 miligramos, un fuerte inhibidor de CYP3A4 e inhibidor de Pgp). La coadministración incrementó el valor medio de la AUC (0-24) y Cmax del Furoato de fluticasona en 36% y 33%, respectivamente. El incremento en la exposición a Furoato de fluticasona se asoció con una reducción del 27% en la media ponderada de cortisol sérico de 0-24 horas. La coadministración incrementó las medias de AUC(0-t) y Cmax de vilanterol en 65% y 22%, respectivamente. El incremento en la exposición al vilanterol no se asoció con un incremento en los efectos sistémicos relacionados a los agonistas beta en la frecuencia cardiaca o el potasio sanguíneo.
El Furoato de fluticasona, umeclidinio y vilanterol son sustratos de la P-gp. Un estudio de interacción medicamentosa de dosis repetidas realizado en sujetos sanos que recibieron umeclidinio/vilanterol o umeclidinio, y el inhibidor de P-gp y el inhibidor moderado de CYP3A4 verapamilo (240 miligramos), no mostró ningún efecto clínicamente significativo sobre la farmacocinética de vilanterol o umeclidinio.
El efecto de un genotipo metabolizador deficiente de CYP2D6 sobre la farmacocinética en estado estable de umeclidinio se evaluó en voluntarios sanos (metabolizadores normales de CYP2D6 y metabolizadores deficientes de CYP2D6). No se observó ninguna diferencia clínicamente importante en la exposición sistémica a umeclidinio (500 microgramos lo cual es ocho veces mayor que la dosis terapéutica) después de una dosificación inhalada diaria repetida en sujetos metabolizadores normales y deficientes de la CYP2D6.
Eliminación:
Furoato de fluticasona: La vida media de la eliminación plasmática aparente de Furoato de fluticasona después de la administración inhalada de Furoato de fluticasona/vilanterol fue, en promedio, 24 horas. Después de la administración intravenosa, la vida media de la fase de eliminación promedió 15.1 horas. La depuración plasmática después de la administración intravenosa fue 65.4 litros/hora. La excreción urinaria representó aproximadamente 2 % de la dosis administrada por vía intravenosa. Después de la administración oral, el Furoato de fluticasona se eliminó en humanos principalmente por metabolismo con los metabolitos excretándose casi exclusivamente en las heces, con < 1% de la dosis radioactiva recuperada eliminada en la orina.
Umeclidinio: La vida media de eliminación plasmática de umeclidinio después de una dosificación inhalada por 10 días promedió 19 horas, con 3% a 4% del fármaco excretado sin cambios en la orina en estado estable. La depuración plasmática después de la administración intravenosa fue 151 litros/hora. Después de la administración intravenosa, alrededor de 58% de la dosis radiomarcada administrada se excretó en las heces y aproximadamente 22% de la dosis radiomarcada administrada se excretó en la orina. La excreción del material relacionado al fármaco en las heces después de la dosificación intravenosa indicó una secreción en la bilis. Posterior a la administración oral, 92% de la dosis radiomarcada administrada se excretó principalmente en las heces. Menos de 1% de la dosis administrada por vía oral (1% de la radioactividad recuperada) se excretó en la orina, lo que indica una absorción insignificante después de la administración oral.
Vilanterol: La vida media de eliminación plasmática de vilanterol después de la administración inhalada por 10 días promedió 11 horas. La depuración plasmática de vilanterol después de la administración intravenosa fue 108 litros/hora. Después de la administración oral de vilanterol radiomarcado, 70% de la radiomarca se excretó en la orina y 30% en las heces. La eliminación primaria de vilanterol fue por metabolismo seguido de la excreción de los metabolitos en la orina y las heces.
Poblaciones especiales de pacientes:
En un análisis farmacocinético de la población (n = 821), se evaluó el efecto de las covariables demográficas (raza/etnicidad, edad, género, peso) sobre la farmacocinética de furoato de fluticasona, umeclidinio y vilanterol. La insuficiencia renal y la insuficiencia hepática se evaluaron en estudios separados.
Raza:
En sujetos del este de Asia con EPOC, (descendientes de japoneses y de personas nacidas en el este de Asia) (n = 113) que recibieron furoato de fluticasona/umeclidinio/vilanterol, los estimados de AUC ss fueron en promedio 30% mayores en comparación con los sujetos caucásicos. No obstante, no se espera que estas exposiciones sistémicas más altas tengan un efecto clínicamente relevante sobre la excreción de cortisol sérico o urinario de 24 horas. No hubo ningún efecto de la raza sobre la farmacocinética de umeclidinio o vilanterol en los sujetos con EPOC.
No se observaron diferencias clínicamente relevantes que hayan requerido ajustar la dosis con base en la raza en la exposición sistémica de furoato de fluticasona, umeclidinio o vilanterol.
Pacientes de edad avanzada:
No se observaron efectos clínicamente relevantes que hayan requerido ajustes de la dosis con base en la edad.
Insuficiencia renal: TRELEGY no se ha evaluado en sujetos con insuficiencia renal. No obstante, se han realizado estudios con Furoato de fluticasona/vilanterol y umeclidinio/vilanterol.
Un estudio de farmacología clínica de Furoato de fluticasona/vilanterol mostró que la insuficiencia renal severa (depuración de creatinina < 30 ml/min) no resultó en una exposición significativamente mayor a Furoato de fluticasona o vilanterol o en unos efectos sistémicos más notorios de los corticosteroides o los agonistas beta2 en comparación con los sujetos sanos.
Un estudio en sujetos con insuficiencia renal severa que fueron administrados con umeclidinio/vilanterol no mostró ninguna evidencia de un incremento en la exposición sistémica ya sea a umeclidinio o vilanterol (Cmax y AUC). Se realizaron estudios de unión a proteínas in vitro entre los sujetos con insuficiencia renal severa y voluntarios sanos y no se observó ninguna evidencia clínicamente significativa de una unión proteica alterada.
No se han estudiado los efectos de la hemodiálisis.
Insuficiencia hepática: TRELEGY no se ha evaluado en sujetos con insuficiencia hepática. No obstante, se han realizado estudios con Furoato de fluticasona/vilanterol y umeclidinio/vilanterol.
Después de la dosificación repetida de Furoato de fluticasona/vilanterol por 7 días, hubo un incremento en la exposición sistémica de Furoato de fluticasona (hasta de tres veces conforme a la medición del AUC (0-24)) en sujetos con insuficiencia hepática (Child-Pugh A, B o C) en comparación con sujetos sanos. El incremento en la exposición sistémica de Furoato de fluticasona (200/25 microgramos de Furoato de fluticasona/vilanterol) en sujetos con insuficiencia hepática moderada (Child-Pugh B) se asoció con una reducción promedio de 34% en el cortisol sérico en comparación con los sujetos sanos. En sujetos con insuficiencia hepática severa (Child-Pugh C) que recibieron 100/12.5 microgramos de Furoato de fluticasona/vilanterol no hubo ninguna reducción en el cortisol sérico (incremento de 10% en el cortisol sérico).
Después de la dosificación repetida de Furoato de fluticasona/vilanterol por 7 días, no hubo un incremento significativo en la exposición sistémica al vilanterol (Cmax y AUC) en los sujetos con insuficiencia hepática leve, moderada o severa (Child-Pugh A, B o C).
No hubo efectos clínicamente relevantes de la combinación de Furoato de fluticasona/vilanterol sobre los efectos sistémicos beta adrenérgicos (frecuencia cardiaca o potasio sérico) en los sujetos con insuficiencia hepática leve o moderada (vilanterol, 25 microgramos) o con insuficiencia hepática severa (vilanterol, 12.5 microgramos) en comparación con los sujetos sanos.
Los sujetos con insuficiencia hepática moderada no mostraron evidencia de un incremento en la exposición sistémica ya sea a umeclidinio o vilanterol (Cmax y AUC). Se realizaron estudios de unión proteica in vitro entre sujetos con insuficiencia hepática moderada y voluntarios sanos, y no se observó ninguna evidencia clínicamente significativa de unión proteica alterada. Umeclidinio no se ha evaluado en sujetos con insuficiencia hepática severa.
Otras características de los pacientes: No se observaron diferencias clínicamente relevantes que hayan requerido ajuste de la dosis con base en el efecto del género, el peso o el índice de masa corporal.
Sujetos con metabolismo deficiente de CYP2D6 no mostraron ninguna evidencia de un efecto clínicamente significativo de polimorfismo genético de CYP2D6 sobre la exposición sistémica a umeclidinio.
Estudios clínicos:
Estudio 1: La eficacia de TRELEGY (100/62.5/25 microgramos de FF/UMEC/VI) administrado como un tratamiento una vez al día en pacientes con un diagnóstico clínico de EPOC se ha evaluado en un estudio de 24 semanas controlado con fármaco activo con una extensión de hasta 52 semanas en un subconjunto de pacientes (estudio CTT116853, FULFIL).
TRELEGY de 100/62.5/25 microgramos administrado una vez al día demostró una mejoría estadísticamente significativa en la función pulmonar (como lo define el cambio a partir del valor mínimo inicial de VEF1 en la Semana 24; criterio de valoración co-primario) en comparación con 400/12 microgramos de budesonida/formoterol (BUD/FOR) administrados dos veces al día (véase la Tabla 2). Los efectos broncodilatadores con TRELEGY fueron evidentes en el primer día del tratamiento y se mantuvieron durante el periodo de tratamiento de 24 semanas.
TRELEGY demostró una mejoría estadísticamente significativa en comparación con BUD/FOR en la Semana 24 para la Calidad de Vida relacionada a la salud (HRQoL) medida por la puntuación total (criterio de valoración co-primario) del Cuestionario Respiratorio St. George (SGRQ), el análisis de sujetos con respuesta de SGRQ, la puntuación de la Prueba de evaluación de EPOC (CAT) y el análisis de los sujetos con respuesta de CAT y también para síntomas respiratorios medidos utilizando la puntuación de Evaluación de Síntomas Respiratorios en EPOC (E-RSTM: EPOC) y las puntuaciones de las subescalas durante las Semanas 21-24, la dificultad respiratoria medida usando la puntuación focal del Índice de Disnea Transicional (TDI) en la Semana 24, y el uso de medicamento de rescate medido por el número medio de ocasiones por día durante las Semanas 1-24 (véase la Tabla 2).
TRELEGY demostró una reducción estadísticamente significativa en la tasa anual de exacerbaciones moderadas/severas (es decir, que requieren tratamiento con antibióticos o corticosteroides u hospitalización; extrapolado a partir de los datos hasta la Semana 24) en comparación con BUD/FOR. Se observó una reducción en el riesgo de una exacerbación moderada/severa con TRELEGY en comparación con BUD/FOR (con base en el análisis del tiempo para la primera exacerbación) (véase la Tabla 2).
Tabla 2. Criterios de valoración de eficacia claves hasta la Semana 24 (Estudio CTT116853)
|
TRELEGY FF/UMEC/ VI 100/62.5/25 mcg OD (n = 911) |
BUD/FOR 400/12 mcg BID (n = 899) |
Comparación con BUD/FOR |
||
|
Diferencia de los tratamientos (CI de 95%) valor p |
Relación del tratamiento (CI de 95%) valor p |
|||
|
VEF1 valle (L) en la Semana 24, cambio promedio por LS desde el valor basal (SE)a, e |
0.142 (0.0083) |
-0.029 (0.0085) |
0.171 (0.148, 0.194) p < 0.001 |
- |
|
Puntuación total del SGRQ en la Semana 24, cambio promedio por LS desde el valor basal (SE)a, f |
-6.6 (0.45) |
-4.3 (0.46) |
-2.2 (-3.5, -1.0) p < 0.001 |
- |
|
Sujetos con respuesta de acuerdo a la Puntuación total del SGRQ en la Semana 24, %f, h |
50% |
41% |
- |
1.41b (1.16, 1.70) p < 0.001 |
|
Tasa anual de exacerbación moderada/severa de EPOC en tratamiento (con base en los datos hasta la Semana 24) |
0.22 |
0.34 |
- |
0.65c (0.49, 0.86) p = 0.002 |
|
Incidencia de exacerbación moderada/severa de EPOC hasta la Semana 24, % |
10% |
14% |
- |
0.67d (0.52, 0.88) p = 0.004 |
|
Puntuación total de E-RS: EPOC durante las Semanas 21-24, cambio promedio por LS desde el valor basal (SE)g |
-2.31 (0.157) |
-0.96 (0.160) |
-1.35 (-1.79, -0.91) p < 0.001 |
- |
|
Sujetos con respuesta de acuerdo a la Puntuación total de E-RS: EPOC durante las Semanas 21-24, % g, h |
47% |
37% |
- |
1.59b (1.30, 1.94) p < 0.001 |
|
Puntuación focal de TDI en la Semana 24, media de LS (SE)f |
2.29 (0.096) |
1.72 (0.099) |
0.57 (0.30, 0.84) p < 0.001 |
- |
|
Sujetos con respuesta de acuerdo a la puntuación focal del TDI en la Semana 24, % f, h |
61% |
51% |
- |
1.61b (1.33, 1.95) p < 0.001 |
|
Porcentaje de actividad diaria de días con una puntuación de 2 (capaz de realizar más actividades de lo usual) durante las Semanas 1-24, cambio promedio por LS desde el valor basal (SE) |
0.0 (0.38) |
-0.1 (0.39) |
0.1 (-0.9, 1.1) p = 0.817 |
- |
|
Número promedio de ocasiones de uso de medicamento de rescate por día durante las Semanas 1-24, cambio promedio por LS desde el valor basal (SE) |
-0.1 (0.04) |
0.1 (0.04) |
-0.2 (-0.3, -0.1) p < 0.001 |
- |
|
Puntuación CAT en la Semana 24, cambio promedio por LS desde el valor basal (SE) |
-2.5 (0.18) |
-1.6 (0.19) |
-0.9 (-1.4, -0.4) p < 0.001 |
- |
|
Sujetos con respuesta de acuerdo a la Puntuación CAT en la Semana 24, %h |
53% |
45% |
- |
1.44b (1.19, 1.75) p < 0.001 |
BID = dos veces al día; BUD = budesonida; FOR = formoterol; CI = intervalo de confianza; FEV1= volumen espiratorio forzado en 1 segundo; L = litros; LS = mínimos cuadrados; mcg = microgramos; n = número en la población con intención de tratar; OD = una vez al día; SE = error estándar; SGRQ =Cuestionario Respiratorio de St. George; CAT = Prueba de evaluación de EPOC; E-RS = Evaluación de Síntomas Respiratorios; TDI = Índice de Disnea Transicional.
a Criterios de valoración co-primarios.
b Cociente de probabilidades.
c Relación de incidencia.
d Índice de riesgo con base en el análisis del tiempo para el primer evento.
e Diferencia entre los tratamientos estadísticamente significativa para FF/UMEC/VI vs. BUD/FOR también observada en las Semanas 2, 4 y 12.
f Diferencia entre los tratamientos estadísticamente significativa para FF/UMEC/VI vs. BUD/FOR también observada en la Semana 4.
g Diferencia entre los tratamientos estadísticamente significativa para FF/UMEC/VI vs. BUD/FOR también observada durante cada periodo de 4 semanas a lo largo de la duración del estudio.
h La respuesta se definió como una reducción de ≥ 4 unidades desde el valor inicial para SGRQ, una reducción de ≥ 2 unidades desde la situación inicial para la puntuación total de E-RS y para CAT y una puntuación ≥ 1 unidad para TDI.
La función pulmonar, el HRQoL, los síntomas y los resultados de las exacerbaciones hasta 52 semanas de tratamiento en un subconjunto de pacientes (n = 430) fueron consistentes con los resultados hasta 24 semanas.
Estudio 2: La eficacia a largo plazo de TRELEGY (100/62.5/25 microgramos de FF/UMEC/VI) administrado una vez al día en pacientes con EPOC y antecedentes de exacerbaciones moderadas o severas dentro de los 12 meses anteriores se ha evaluado en un estudio controlado con activo de 52 semanas en comparación con la combinación de dosis fija de furoato de fluticasona/vilanterol (100/25 microgramos de FF/VI) y umeclidinio/vilanterol (62.5/25 microgramos de UMEC/VI) (aleatorización 2:2:1) (estudio CTT116855, IMPACT).
Los pacientes tratados con TRELEGY demostraron una reducción estadísticamente significativa en la tasa anual de exacerbaciones moderadas/severas durante el tratamiento (criterio de valoración primario) en comparación con FF/VI y en comparación con UMEC/VI. Véase los resultados del criterio de valoración de eficacia en la Tabla 3.
Tabla 3. Criterios de valoración clave de eficacia (Estudio CTT116855)
|
TRELEGY FF/UMEC/VI (n = 4,151) |
FF/VI (n = 4,134) |
UMEC/VI (n = 2,070) |
TRELEGY FF/UMEC/VI vs. FF/VI |
TRELEGY FF/UMEC/VI vs. UMEC/VI |
|
|
Tasa de exacerbaciones moderadas/severasa |
|||||
|
Exacerbaciones al año |
0.91 |
1.07 |
1.21 |
||
|
Reducción en la tasa (%) CI del 95% valor p |
15% 10, 20 p < 0.001 |
25% 19,30 p < 0.001 |
|||
|
Tiempo hasta la primera exacerbación moderada/severa |
|||||
|
Pacientes con un evento (%) |
47% |
49% |
50% |
||
|
Reducción en el riesgo (%) CI del 95% valor p |
14.8% 9.3, 19.9 p < 0.001 |
16.0% 9.4, 22.1 p < 0.001 |
|||
|
Tasa de exacerbaciones severas |
|||||
|
Exacerbaciones al año |
0.13 |
0.15 |
0.19 |
||
|
Reducción en la tasa (%) CI del 95% valor p |
13% -1,24 p = 0.064 |
34% 22,44 p < 0.001 |
|||
|
FEV1 valle (L) en la semana 52 |
|||||
|
Media de LS del cambio a partir del valor inicial (SE) |
0.094 (0.004) |
-0.003 (0.004) |
0.040 (0.006) |
||
|
Diferencia entre tratamientos CI del 95% valor p |
0.097 0.085, 0.109 p < 0.001 |
0.054 0.039, 0.069 p < 0.001 |
|||
|
Puntuación total del SGRQ en la Semana 52 |
|||||
|
Media de LS del cambio a partir del valor inicial (SE) |
-5.5 (0.23) |
-3.7 (0.24) |
-3.7 (0.35) |
||
|
Diferencia entre tratamientos CI del 95% valor p |
-1.8 -2.4, -1.1 p < 0.001 |
-1.8 -2.6, -1.0 p < 0.001 |
|||
|
Sujetos con respuesta de acuerdo con la Puntuación total del SGRQ en la Semana 52 |
|||||
|
Sujetos con respuestab (%) |
42% |
34% |
34% |
||
|
Índice de probabilidad CI del 95% valor p |
1.41 1.29, 1.55 p < 0.001 |
1.41 1.26, 1.57 p < 0.001 |
|||
CI = intervalo de confianza; FEV1 = volumen espiratorio forzado en 1 segundo; L = litros; LS = mínimos cuadrados; n = número en la población con intención de tratar; SE = error estándar; SGRQ = Cuestionario Respiratorio de St. George.
a Criterio de valoración primario.
b Definido como una puntuación total del SGRQ de 4 unidades debajo del valor inicial o inferior.
Los efectos de la función pulmonar (cambio desde la línea base de FEV1) de TRELEGY en comparación con FF/VI y UMEC/VI para FEV1 valle se observaron en todos los momentos de valoración a lo largo del estudio de 52 semanas (véase la Figura 1).
Figura 1. Media de mínimos cuadrados (LS) del cambio a partir de la línea base en el punto más bajo FEV1 (L)
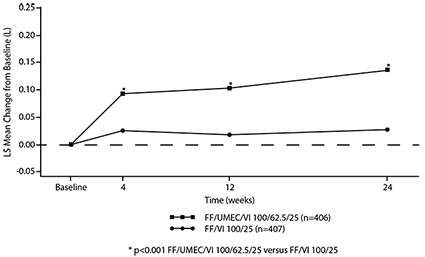
La reducción del número medio de ocasiones/día del uso del medicamento de rescate de agonista beta2 y el porcentaje de periodos de 24 horas sin necesidad de medicamento de rescate fue estadísticamente significativo en pacientes que recibieron TRELEGY en comparación con FF/VI o UMEC/VI en las semanas 49 a 52 (véase la Tabla 4) y estas diferencias se observaron en el trascurso del estudio de 52 semanas.
Los pacientes que recibieron TRELEGY tuvieron estadísticamente una reducción significativamente mayor en el número de veces que despertaron durante la noche debido a síntomas de EPOC en comparación con FF/VI o UMEC/VI en las semanas 49 a 52 (véase la Tabla 4) y estas diferencias se observaron durante el transcurso del estudio de 52 semanas para UMEC/VI y para la mayoría de los momentos de valoración para FF/VI.
Tabla 4. Otros criterios de valoración (Estudio CTT116855)
|
TRELEGY FF/UMEC/VI (n = 4,151) |
FF/VI (n = 4,134) |
UMEC/VI (n = 2,070) |
TRELEGY FF/UMEC/VI vs. FF/VI |
TRELEGY FF/UMEC/VI vs. UMEC/VI |
|
|
Media del número de ocasiones/día de uso de medicamento de rescate en las semanas 49 a 52 |
|||||
|
Media de LS del cambio a partir el valor inicial (SE) |
0.16 (0.031) |
0.44 (0.032) |
0.46 (0.045) |
||
|
Diferencia entre tratamientos CI del 95% valor p |
-0.28 -0.37, -0.19 p < 0.001 |
-0.30 -0.41, -0.19 p < 0.001 |
|||
|
Porcentaje de periodos de 24 horas sin necesidad de medicamento de rescate en las semanas 49 a 52 |
|||||
|
Media de LS del cambio a partir el valor inicial (SE) |
-1.9 (0.61) |
-7.1 (0.62) |
-6.3 (0.89) |
||
|
Diferencia entre tratamientos CI del 95% valor p |
5.2 3.5, 6.9 p < 0.001 |
4.4 2.3, 6.5 p < 0.001 |
|||
|
Despertares nocturnos debidos a síntomas de EPOC en las semanas 49 a 52 |
|||||
|
Media de LS del cambio a partir el valor inicial (SE) |
-0.21 (0.012) |
-0.16 (0.013) |
-0.12 (0.018) |
||
|
Diferencia entre tratamientos CI del 95% valor p |
-0.05 -0.08, -0.01 p = 0.005 |
-0.10 -0.14, -0.05 p < 0.001 |
|||
CI = intervalo de confianza; LS =mínimos cuadrados; n = número en la población con intención de tratar; SE = error estándar.
El tratamiento con TRELEGY demostró una mejoría clínicamente significativa de -2.0 puntos en la Prueba de evaluación de EPOC (CAT) a partir del valor inicial en la semana 52. Las diferencias fueron estadísticamente significativas en comparación con FF/VI (-0.5; CI del 95%: -0.8, -0.2; p < 0.001) y con UMEC/VI (-0.4; CI del 95%: -0.8, -0.1; p = 0.021). La tasa de sujetos con respuesta en CAT (definida como 2 unidades por debajo del valor inicial o inferior) en la semana 52 fue estadística y significativamente mayor en los pacientes tratados con TRELEGY (42%) en comparación con FF/VI (37%; índice de probabilidad 1.24; CI del 95%: 1.14, 1.36; p < 0.001) y con UMEC/VI (36%; índice de probabilidad 1.28; CI del 95%: 1.15, 1.43; p < 0.001).
La dificultad respiratoria, medida usando la puntuación focal del Índice de Disnea Transicional (TDI) en la semana 52, se midió en un subconjunto de pacientes (N = 5,058 de 10 países: Bélgica, Canadá, República Checa, Dinamarca, Alemania, Países Bajos, Polonia, España, Reino Unido, Estados Unidos). El tratamiento con TRELEGY (n = 2,029) demostró una mejoría estadísticamente significativa en comparación con FF/VI (n = 2,014), media de LS de la puntuación focal del TDI de 0.98 y 0.71, respectivamente, una diferencia de 0.27 (CI del 95%: 0.04, 0.49; p = 0.020). No se observó un efecto estadísticamente significativo entre TRELEGY y UMEC/VI (n = 1,015), media de LS de la puntuación focal del TDI de 0.98 y 0.89, respectivamente, una diferencia de 0.09 (CI del 95%: -0.19, 0.37; p = 0.522). La proporción de sujetos con respuesta mediante TDI (definida como al menos 1 unidad) fue estadística y significativamente mayor para TRELEGY (36%) en comparación con FF/VI (29%; índice de probabilidad 1.36; CI del 95%: 1.19, 1.55; p < 0.001) y UMEC/VI (30%; índice de probabilidad 1.33; CI del 95%: 1.13, 1.57; p<0.001) en la semana 52.
Otros estudios que respaldan la eficacia:
El 200812 fue un estudio de 24 semanas de no inferioridad (N = 1,055) que comparó TRELEGY (FF/UMEC/VI 100/62.5/25 microgramos), administrado como inhalador único, con furoato de fluticasona/vilanterol (100/25 microgramos) + umeclidinio (62.5 microgramos), co- administrados como terapia con inhaladores múltiples, una vez al día a pacientes con antecedentes de exacerbaciones moderadas o severas en los 12 meses previos. En este estudio, FF/UMEC/VI fue no inferior en comparación con FF/VI + UMEC en cuanto a la mejoría a partir de la línea basal en el FEV1 en la semana 24. El margen de no inferioridad previamente especificado fue de 50 mL.
Umeclidinio con Furoato de fluticasona/vilanterol: En dos estudios de 12 semanas, controlados con placebo (200109 y 200110), la suma de umeclidinio (62.5 microgramos) a Furoato de fluticasona/vilanterol (FF/VI) (100/25 microgramos) una vez al día en pacientes adultos con un diagnóstico clínico de EPOC, resultó en mejorías estadísticamente significativas y clínicamente importantes en el criterio de valoración primario de VEF1 mínimo en el Día 85 en comparación con el placebo más FF/VI (124 ml [CI de 95%: 93, 154, p < 0.001] en el estudio 200109 y 122 mL [CI de 95%: 91, 152, p < 0.001] en el estudio 200110).
Estudios de 12 meses con Furoato de fluticasona/vilanterol: Dos estudios de 52 semanas, aleatorizados, doble ciego, de grupos paralelos (HZC102970 y HZC102871) compararon la tasa anual de exacerbaciones moderadas/severas en pacientes adultos con un diagnóstico clínico de EPOC, tratados con FF/VI o con vilanterol una vez al día.
Los resultados de un análisis integrado de ambos estudios mostraron que el tratamiento con 100/25 microgramos de FF/VI una vez al día resultó en una reducción de 27% en la tasa anual de exacerbaciones de EPOC moderada/severa en comparación con vilanterol (CI de 95%: 16, 37, p < 0.001). Las reducciones en el riesgo de exacerbación moderada/severa (con base en el análisis del tiempo para la primera exacerbación) y la tasa de exacerbaciones que requirieron uso de corticosteroides también se observaron con 100/25 microgramos de FF/VI una vez al día en comparación con vilanterol.
CONTRAINDICACIONES: TRELEGY está contraindicado en pacientes con alergia severa a las proteínas de la leche o que han demostrado hipersensibilidad al Furoato de fluticasona, umeclidinio, vilanterol o cualquiera de los componentes de la fórmula.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Fertilidad: No existen datos sobre los efectos de TRELEGY sobre la fertilidad humana. Los estudios en animales no indican ningún efecto sobre la fertilidad masculina o femenina (véase Precauciones generales y Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).
Embarazo: Existen datos insuficientes derivados del uso de TRELEGY en mujeres embarazadas. Los estudios en animales han demostrado toxicidad reproductiva después de la administración de agonistas beta2 o corticosteroides (véase Precauciones generales y Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).
TRELEGY debe utilizarse durante el embarazo únicamente si el beneficio esperado para la madre justifica el riesgo potencial para el feto.
Lactancia: Se desconoce si el Furoato de fluticasona, umeclidinio, vilanterol o sus metabolitos se excretan en la leche humana. Sin embargo, otros corticosteroides, antagonistas muscarínicos y agonistas beta2 se detectan en la leche humana. No puede excluirse un riesgo para los recién nacidos en lactancia/lactantes.
Se debe tomar una decisión respecto a descontinuar la lactancia o descontinuar la terapia con TRELEGY considerando el beneficio de la lactancia para el niño y el beneficio de la terapia para la mujer.
REACCIONES SECUNDARIAS Y ADVERSAS:
Datos de estudios clínicos: El perfil de seguridad de TRELEGY se basa en tres estudios clínicos de fase III.
El primer estudio incluyó datos de la seguridad de 911 pacientes con EPOC que recibieron dosis de TRELEGY de 100/62.5/25 microgramos una vez al día hasta por 24 semanas, de los cuales, 210 pacientes recibieron TRELEGY de 100/62.5/25 microgramos una vez al día hasta por 52 semanas, con un comparador activo (estudio CTT116853, FULFIL).
El segundo estudio incluyó los datos de la seguridad de 527 pacientes con EPOC que recibieron TRELEGY de 100/62.5/25 microgramos y 528 pacientes con EPOC que recibieron furoato de fluticasona/vilanterol de 100/25 microgramos + umeclidinio de 62.5 microgramos una vez al día hasta por 24 semanas (estudio 200812).
El tercer estudio incluyó datos de la seguridad de 4,151 pacientes con EPOC que recibieron TRELEGY de 100/62.5/25 microgramos una vez al día hasta por 52 semanas, con dos comparadores activos (estudio CTT116855, IMPACT). A continuación, se informa la frecuencia más alta, cuando las frecuencias de reacción adversa difirieron entre estudios.
Las reacciones adversas se enlistan a continuación por clase de sistema orgánico MedDRA y frecuencia (Tabla 1). Se ha utilizado la siguiente convención para la clasificación de reacciones adversas:
Muy común: ≥ 1/10.
Común: ≥ 1/100 a < 1/10.
Poco común: ≥ 1/1000 a < 1/100.
Rara: ≥ 1/10000 a < 1/1000.
Muy rara: < 1/10000.
Tabla 1. Reacciones adversas.
|
Clase de sistema y órganos |
Reacción(es) adversa(s) |
Frecuencia |
|
Infecciones e infestaciones |
Neumonía Infección de vías respiratorias superiores Bronquitis Faringitis Rinitis Sinusitis Influenza Nasofaringitis Candidiasis de boca y garganta Infección de las vías urinarias |
Común |
|
Infección viral de las vías respiratorias |
Poco común |
|
|
Trastorno del sistema nervioso |
Cefalea |
Común |
|
Trastornos cardiacos |
Taquiarritmia supraventricular Taquicardia Fibrilación auricular |
Poco común |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos Dolor bucofaríngeo |
Común |
|
Disfonía |
Poco común |
|
|
Trastornos gastrointestinales |
Estreñimiento |
Común |
|
Boca seca |
Poco común |
|
|
Trastornos musculoesqueléticos y del tejido conectivo |
Artralgia |
Común |
|
Dolor de espalda |
||
|
Fracturas |
Poco común |
Descripción de las reacciones adversas seleccionadas:
Neumonía (véase Precauciones generales): En un total de 1,810 pacientes con EPOC avanzada (media de la selección de VEF1 posterior a broncodilatador de 45% de lo pronosticado en la visita de evaluación, desviación estándar [SD] 13%), 65% de los cuales tuvieron una experiencia de exacerbación moderada/severa de EPOC en el año previo al ingreso al estudio (estudio CTT116853), se notificó una mayor incidencia de eventos de neumonía en pacientes que recibieron TRELEGY (20 pacientes, 2%) que en los pacientes que recibieron budesonida/formoterol (7 pacientes, < 1%). La neumonía que requirió hospitalización se presentó en 1% de los pacientes que recibieron TRELEGY y < 1% de los pacientes que recibieron budesonida/formoterol hasta 24 semanas. Se notificó un caso letal de neumonía en un paciente que recibió TRELEGY. En el subconjunto de 430 pacientes tratados por hasta 52 semanas, la incidencia de eventos de neumonía reportados tanto en el grupo de TRELEGY y budesonida/formoterol fue igual a 2%.
En un estudio de 52 semanas, un total de 10,355 pacientes con EPOC y antecedentes de 1 o más exacerbaciones moderadas o severas dentro de los 12 meses anteriores (media del FEV1 post-broncodilatador del 46% predictivo, SD 15%) (estudio CTT116855), la incidencia de neumonía fue de 8% para TRELEGY (n = 4,151), 7% para furoato de fluticasona/vilanterol (n = 4,134), y 5% para umeclidinio/vilanterol (n = 2,070). Se presentó neumonía fatal en 12 de 4,151 pacientes (3.5 por 1,000 años-paciente) que recibieron TRELEGY, 5 de 4,134 pacientes (1.7 por 1,000 años-paciente) que recibieron furoato de fluticasona/vilanterol y 5 de 2,070 pacientes (2.9 por 1,000 años-paciente) que recibieron umeclidinio/vilanterol.
La incidencia de eventos de neumonía con TRELEGY es comparable con aquella observada con fluticasona furoato/vilanterol 100/25 en estudios clínicos en EPOC.
Datos posteriores a la comercialización: No disponibles.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Los efectos farmacológicos y toxicológicos observados con Furoato de fluticasona, umeclidinio o vilanterol en los estudios no clínicos fueron aquellos típicamente asociados con los glucocorticoides, los antagonistas de los receptores muscarínicos o los agonistas de los receptores beta2 adrenérgicos. La administración de la combinación de Furoato de fluticasona, umeclidinio y vilanterol a perros no resultó en ninguna toxicidad significativa nueva o ninguna exacerbación mayor de los hallazgos esperados asociados con el Furoato de fluticasona, umeclidinio o vilanterol solos.
Carcinogénesis/mutagénesis: El Furoato de fluticasona no fue genotóxico en un conjunto de estudios estándar y no fue carcinogénico en los estudios de inhalación de por vida en ratas o ratones con exposiciones AUC 1.4 o 2.9 veces, respectivamente, mayores a aquellas en los humanos que recibieron 100 microgramos de Furoato de fluticasona.
El umeclidinio no fue genotóxico en un conjunto de estudios estándar y no fue carcinogénico en estudios de inhalación de por vida en ratones o ratas a exposiciones ≥ 20 o ≥ 17 veces la exposición clínica humana a 62.5 microgramos de umeclidinio, con base en el AUC, respectivamente.
Los estudios de toxicidad genética indican que el vilanterol no representa un riesgo genotóxico para los humanos. Consistente con los hallazgos para otros beta2 agonistas, en los estudios de inhalación de por vida, el vilanterol causó efectos proliferativos en las ratas hembra y el tracto reproductivo de los ratones y de la glándula pituitaria en ratas. No hubo ningún incremento en la incidencia tumoral en ratas o ratones con exposiciones 0.9 o 22 veces, respectivamente, la exposición clínica humana de vilanterol a 25 microgramos con base en el AUC.
Toxicología reproductiva: Ni el Furoato de fluticasona ni el umeclidinio ni el vilanterol tuvieron un efecto adverso sobre la fertilidad masculina o femenina en ratas.
El Furoato de fluticasona no fue teratogénico en ratas o conejos, pero retrasó el desarrollo en las ratas y causó aborto en conejos con dosis inhaladas tóxicas maternas. No hubo ningún efecto sobre el desarrollo en ratas a exposiciones aproximadamente 6.6 veces la exposición clínica humana a 100 microgramos, con base en el AUC. El Furoato de fluticasona no tuvo ningún efecto adverso sobre el desarrollo pre o postnatal en ratas.
El umeclidinio no fue teratogénico en ratas o conejos. En un estudio pre y postnatal, la administración subcutánea de umeclidinio a ratas resultó en una menor ganancia de peso corporal materno y consumo de alimentos y redujo ligeramente los pesos corporales de los cachorros antes del destete en las madres que recibieron la dosis de 180 microgramos/kg/día (alrededor de 61 veces la exposición clínica humana a 62.5 microgramos de umeclidinio, con base en el AUC).
El vilanterol no fue teratogénico en ratas. En estudios de inhalación en conejos, el vilanterol causó efectos similares a los observados con otros beta2 agonistas (paladar hendido, párpados abiertos, fusión esternebral y mal rotación/flexión de extremidades). Cuando se administró subcutáneamente no hubo efectos con exposiciones de 62 veces la exposición clínica humana a 25 microgramos, con base en el AUC. El vilanterol no tuvo ningún efecto adverso sobre el desarrollo pre o postnatal en ratas.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Las interacciones medicamentosas clínicamente significativas mediadas por Furoato de fluticasona, umeclidinio o vilanterol en dosis clínicas se consideran poco probables debido a las bajas concentraciones plasmáticas alcanzadas después de una administración inhalada.
Interacción con betabloqueadores: Los bloqueadores beta adrenérgicos pueden debilitar o antagonizar el efecto de los agonistas beta2-adrenérgicos como el vilanterol. En caso de que se requieran betabloqueadores, se deben considerar los betabloqueadores cardioselectivos; no obstante, se debe tener precaución durante el uso simultáneo de betabloqueadores no selectivos y selectivos.
Interacción con inhibidores de CYP3A4: El Furoato de fluticasona y vilanterol, ambos componentes de TRELEGY, se eliminan rápidamente por metabolismo de primer paso extensivo mediado por la enzima CYP3A4.
Se recomienda tener precaución al coadministrarse con fuertes inhibidores de CYP3A4 (ej. ketoconazol, ritonavir) ya que existe el potencial de una exposición sistémica elevada tanto a Furoato de fluticasona como a vilanterol, lo que podría conducir a un incremento en el potencial de reacciones adversas (véase Farmacocinética y farmacodinamia).
Otros antimuscarínicos de larga acción y agonistas beta2-adrenérgicos de larga acción: La coadministración de TRELEGY con otros antagonistas muscarínicos de larga acción o agonistas beta2 adrenérgicos de larga acción no se ha estudiado y no se recomienda ya que puede potenciar las reacciones adversas (véase Reacciones secundarias y adversas, Manifestaciones y manejo de la sobredosificación o ingesta accidental).
Inhibidores de la monoaminooxidasa y antidepresivos tricíclicos: El vilanterol, al igual que otros agonistas beta2, debe administrarse con extrema precaución a los pacientes tratados con inhibidores de la monoaminooxidasa, antidepresivos tricíclicos o fármacos que se sabe que prolongan el intervalo QTc o dentro de las 2 semanas de la discontinuación de dichos agentes, debido a que el efecto de los agonistas adrenérgicos en el sistema cardiovascular puede ser potenciado por estos agentes. Los fármacos que prolongan el intervalo QTc tienen un mayor riesgo de arritmias ventriculares.
Diuréticos no ahorradores de potasio: Los cambios electrocardiográficos y/o la hipocalemia que pueden resultar de la administración de diuréticos no ahorradores de potasio (como diuréticos de asa o tiazida) pueden empeorar de forma aguda por los agonistas beta, especialmente cuando se excede la dosis recomendada del agonista beta. Aunque se desconoce la importancia clínica de estos efectos, se recomienda precaución en la administración concomitante de agonistas beta con diuréticos no ahorradores de potasio.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No se cuenta con información.
PRECAUCIONES GENERALES:
Eventos relacionados - Asma severa - Hospitalizaciones, Intubaciones, Muerte:
La seguridad y eficacia de TRELEGY en pacientes con asma no ha sido establecida. TRELEGY no está indicado para el tratamiento de asma.
El uso de agonistas de los receptores beta-2 de larga acción (LABA) como monoterapia [sin corticoesteroides inhalados (ICS)] para asma está asociado con un incremento en el riesgo de muerte relacionada al asma. Los datos disponibles de estudios clínicos controlados también sugieren que el uso de LABA como monoterapia incrementa el riesgo de hospitalización relacionada con asma en pacientes pediátricos y adolescentes. Estos efectos son considerados un efecto de clase de la monoterapia de LABA. Cuando LABA es usado en una combinación de dosis fija con ICS, datos de estudios clínicos prolongados no muestran un incremento significativo en el riesgo de eventos serios relacionados con asma (hospitalizaciones, intubaciones, muerte) en comparación con ICS solo.
Los datos disponibles de estudios clínicos en sujetos con EPOC no sugieren un incremento en el riesgo de muerte con el uso de LABA en pacientes con EPOC.
Deterioro de la enfermedad y episodios agudos: TRELEGY no debe iniciarse en pacientes durante episodios de EPOC con rápido deterioro o potencialmente mortales. TRELEGY no se ha estudiado en sujetos con EPOC con deterioro agudo. El inicio de TRELEGY en este caso no es apropiado.
TRELEGY no debe utilizarse para el alivio de síntomas agudos, es decir, como terapia de rescate para el tratamiento de episodios agudos de broncoespasmo. TRELEGY no se ha estudiado para el alivio de los síntomas agudos y no se deben usar dosis adicionales para ese propósito. Los síntomas agudos se deben tratar con un agonista beta2 inhalado de acción corta.
Al comenzar el tratamiento con TRELEGY, los pacientes que hayan estado recibiendo agonistas beta2 de acción corta orales o inhalados de forma regular (p. ej., 4 veces al día) deben recibir instrucciones de interrumpir el uso regular de estos fármacos y usarlos únicamente para el alivio sintomático de los síntomas respiratorios agudos.
La EPOC puede deteriorarse de forma aguda durante un periodo de horas o de manera crónica durante varios días o un periodo más largo. Si TRELEGY ya no controla los síntomas de la broncoconstricción o si el agonista beta2 inhalado de acción corta del paciente se vuelve menos efectivo o si el paciente necesita más agonista beta2 de acción corta de lo normal, éstos pueden ser marcadores de deterioro de la enfermedad. En este contexto, se debe realizar una reevaluación del paciente y debe iniciarse el régimen de tratamiento de la EPOC inmediatamente. En esta situación no es apropiado aumentar la dosis diaria de TRELEGY más allá de la dosis recomendada.
Uso excesivo de TRELEGY y su uso con otros agonistas beta2 de acción prolongada: TRELEGY no debe usarse con más frecuencia de la recomendada, ni en dosis superiores a las recomendadas, o en combinación con otros medicamentos que contengan LABA, ya que puede producirse una sobredosis. Se han informado efectos cardiovasculares clínicamente significativos y muertes en asociación con el uso excesivo de fármacos simpaticomiméticos inhalados. Los pacientes que usan TRELEGY no deben usar otro medicamento que contenga un LABA (p. e., salmeterol, fumarato de formoterol, tartrato de arformoterol, indacaterol) por ningún motivo.
Efectos locales de los corticosteroides inhalados: TRELEGY contiene furoato de fluticasona, un corticosteroide inhalado (ICS). Se han producido infecciones localizadas de la boca y la faringe con Candida albicans en sujetos tratados con medicamentos inhalados oralmente que contienen furoato de fluticasona. Cuando se desarrolla una infección de este tipo, debe tratarse con terapia antifúngica local o sistémica (es decir, oral) apropiada mientras continúa el tratamiento con TRELEGY, pero a veces puede ser necesario interrumpir el tratamiento con TRELEGY. Aconseje al paciente que se enjuague la boca con agua sin tragar después de la inhalación para ayudar a reducir el riesgo de candidiasis orofaríngea.
Neumonía: Los médicos deben permanecer atentos al posible desarrollo de neumonía en pacientes con EPOC ya que las características clínicas de la neumonía y las exacerbaciones se superponen con frecuencia. Se han reportado infecciones del tracto respiratorio inferior, incluida neumonía, después de la administración inhalada de corticosteroides.
En dos ensayos de 12 semanas de pacientes con EPOC (N = 824), la incidencia de neumonía fue inferior al 1% para ambos grupos de tratamiento: umeclidinio 62.5 mcg + furoato de fluticasona/vilanterol 100 mcg/25 mcg o placebo + furoato de fluticasona/vilanterol 100 mcg/25 mcg. Se produjo neumonía fatal en 1 sujeto que recibió placebo + furoato de fluticasona/vilanterol 100 mcg/25 mcg.
En un estudio de 52 semanas en sujetos con EPOC (N= 10,355), la incidencia de neumonía fue 8% para TRELEGY (n=4,151), 7% para furoato de fluticasona/vilanterol 100 mcg/25 mcg (n=4,134), y 5% para umeclidinio/vilanterol 62.5 mcg/25 mcg (n=2,070). Neumonía fatal ocurrió en 12 de 4,151 pacientes (0.35 por cada 100 pacientes/año) recibiendo TRELEGY, 5 de 4,134 pacientes (0.17 por cada 100 pacientes/año) recibiendo fluticasona furoato/ vilanterol, y 5 de 2,070 pacientes (0.29 por cada 100 pacientes/año) recibiendo umeclidinio/vilanterol.
En un ensayo de mortalidad con furoato de fluticasona/vilanterol con una duración mediana del tratamiento de 1.5 años en 16,568 sujetos con EPOC moderada y enfermedad cardiovascular, la tasa de incidencia anualizada de neumonía fue de 3.4 por cada 100 años-pacientes para el furoato de fluticasona/vilanterol 100 mcg/25 mcg, 3.2 para placebo, 3.3 para furoato de fluticasona 100 mcg y 2.3 para vilanterol 25 mcg. Las muertes adjudicadas durante el tratamiento debido a neumonía se produjeron en 13 sujetos que recibieron furoato de fluticasona/vilanterol 100 mcg/25 mcg, 9 sujetos que recibieron placebo, 10 sujetos que recibieron furoato de fluticasona 100 mcg y 6 sujetos que recibieron vilanterol 25 mcg (menos de 0.2 por cada 100 años-pacientes para cada grupo de tratamiento).
Inmunosupresión: Los ICS deben usarse con precaución, en su caso, en pacientes con infecciones del tracto respiratorio por tuberculosis, activas o quiescentes; infecciones sistémicas por hongos, bacterias, virus o parásitos; o herpes simple ocular.
Transferencia de pacientes de la terapia con corticosteroides sistémicos: Se necesita un cuidado especial para los pacientes que han sido transferidos de corticosteroides sistémicamente activos a ICS debido a que se han producido muertes por insuficiencia suprarrenal en pacientes con asma durante y después de la transferencia de corticosteroides sistémicos a ICS menos disponibles sistémicamente. Después de la retirada de los corticosteroides sistémicos, se requieren varios meses para la recuperación de la función hipotalámica-hipofisaria-suprarrenal (HPA).
Los pacientes que se han mantenido previamente con la dosis de 20 mg o más de prednisona (o su equivalente) pueden ser los más susceptibles, especialmente cuando sus corticosteroides sistémicos se han retirado casi por completo. Durante este periodo de supresión de HPA, los pacientes pueden exhibir signos y síntomas de insuficiencia suprarrenal cuando se exponen a traumatismos, cirugía o infección (en particular, gastroenteritis) u otras afecciones asociadas con la pérdida severa de electrólitos. Aunque TRELEGY puede controlar los síntomas de la EPOC durante estos episodios, en las dosis recomendadas suministra menos de las cantidades fisiológicas normales de glucocorticoides sistémicamente y NO proporciona la actividad mineralocorticoide que es necesaria para hacer frente a estas emergencias.
Durante los periodos de estrés o una exacerbación grave de la EPOC, los pacientes a quienes se les han retirado corticosteroides sistémicos deben recibir instrucciones de reanudar los corticosteroides orales (en dosis grandes) inmediatamente y ponerse en contacto con sus médicos para recibir más instrucciones. A estos pacientes también se les debe indicar que lleven una tarjeta de advertencia que indique que pueden necesitar corticosteroides sistémicos suplementarios durante periodos de estrés o una exacerbación grave de la EPOC.
Los pacientes que requieren corticosteroides orales deben interrumpir paulatinamente el uso de corticosteroides sistémicos después de cambiarlos al tratamiento con TRELEGY. La reducción de la prednisona se puede lograr reduciendo la dosis diaria de prednisona en 2.5 mg semanalmente durante el tratamiento con TRELEGY. La función pulmonar (volumen espiratorio forzado en 1 segundo [FEV1]), el uso de agonistas beta y los síntomas de la EPOC deben controlarse cuidadosamente durante la retirada de los corticosteroides orales. Además, los pacientes deben ser observados para detectar signos y síntomas de insuficiencia suprarrenal, como fatiga, cansancio, debilidad, náuseas y vómitos e hipotensión.
La transferencia de pacientes de la terapia sistémica con corticosteroides a TRELEGY puede desenmascarar afecciones alérgicas previamente suprimidas por la terapia con corticosteroides sistémicos (p. ej., rinitis, conjuntivitis, eccema, artritis, afecciones eosinofílicas).
Durante la retirada de los corticosteroides orales, algunos pacientes pueden experimentar síntomas de abstinencia de corticosteroides sistémicamente activos (p. ej., dolor articular y/o muscular, lasitud, depresión) a pesar del mantenimiento o incluso de la mejora de la función respiratoria.
Hipercortisolismo y supresión suprarrenal: El furoato de fluticasona inhalado se absorbe en la circulación y puede ser sistémicamente activo. Los efectos del furoato de fluticasona en el eje HPA no se observan con las dosis terapéuticas de furoato de fluticasona en TRELEGY. Sin embargo, exceder la dosis recomendada o la administración concomitante con un inhibidor fuerte del citocromo P450 3A4 (CYP3A4) puede resultar en disfunción HPA (consulte Precauciones generales e Interacciones medicamentosas y de otro género).
Debido a la posibilidad de absorción sistémica significativa de ICS en pacientes sensibles, los pacientes tratados con TRELEGY deben observarse cuidadosamente para detectar cualquier evidencia de efectos sistémicos de corticosteroides. Se debe tener especial cuidado al observar a los pacientes en el contexto postoperatorio o durante los periodos de estrés para detectar una respuesta suprarrenal inadecuada.
Es posible que los efectos sistémicos de los corticosteroides, como el hipercortisolismo y la supresión suprarrenal (incluida la crisis suprarrenal), puedan aparecer en un pequeño número de pacientes que son sensibles a estos efectos. Si se producen tales efectos, se debe considerar la terapia apropiada.
Interacciones farmacológicas con inhibidores potentes del citocromo P450 3A4: Se debe tener precaución al considerar la administración concomitante de TRELEGY con ketoconazol y otros inhibidores potentes conocidos del CYP3A4 (por ejemplo, ritonavir, claritromicina, conivaptán, indinavir, itraconazol, lopinavir, nefazodona, nelfinavir, saquinavir, telitromicina, troleandomicina, voriconazol) porque puede haber un aumento de efectos adversos de corticosteroides sistémicos y efectos adversos cardiovasculares (ver Interacciones medicamentosas y de otro género).
Broncoespasmo paradójico: Al igual que con otros medicamentos inhalados, TRELEGY puede producir broncoespasmo paradójico, que puede ser potencialmente mortal. Si se produce broncoespasmo paradójico después de la administración de TRELEGY, debe tratarse inmediatamente con un broncodilatador inhalado de acción corta; TRELEGY debe discontinuarse inmediatamente; y se debe instituir una terapia alternativa.
Reacciones de hipersensibilidad incluyendo anafilaxia: Las reacciones de hipersensibilidad como anafilaxia, angioedema, exantema y urticaria pueden ocurrir después de la administración de TRELEGY. Suspenda TRELEGY si ocurren tales reacciones. Ha habido informes de reacciones anafilácticas en pacientes con alergia severa a la proteína láctea después de la inhalación de otros medicamentos en polvo que contienen lactosa; por lo tanto, los pacientes con alergia severa a la proteína de la leche no deben usar TRELEGY (ver Contraindicaciones).
Efectos cardiovasculares: El vilanterol, como otros agonistas beta2, puede producir un efecto cardiovascular clínicamente significativo en algunos pacientes, medido por aumentos en la frecuencia cardiaca, presión arterial sistólica o diastólica, y también arritmias cardiacas, como taquicardia supraventricular y extrasístoles. Si se producen tales efectos, puede ser necesario interrumpir TRELEGY. Además, se ha informado que los agonistas beta producen cambios electrocardiográficos, como aplanamiento de la onda T, prolongación del intervalo QTc y depresión del segmento ST, aunque se desconoce el significado clínico de estos hallazgos (ver Farmacocinética y farmacodinamia).
Se han reportado muertes en asociación con el uso excesivo de fármacos simpaticomiméticos inhalados.
TRELEGY, como otras aminas simpaticomiméticas, debe usarse con precaución en pacientes con trastornos cardiovasculares, especialmente insuficiencia coronaria, arritmias cardiacas e hipertensión.
En un estudio de 52 semanas en sujetos con EPOC, las tasas ajustadas a la exposición para cualquier evento cardiaco adverso mayor durante el tratamiento, incluidas hemorragias del sistema nervioso central y afecciones cerebrovasculares no mortales, infarto de miocardio (IM) no mortal, IM agudo no mortal, y la muerte en tratamiento debida a eventos cardiovasculares fue de 2.2 por cada 100 pacientes/año para TRELEGY (n = 4,151), 1.9 por cada 100 pacientes/año para furoato de fluticasona / vilanterol 100 mcg / 25 mcg (n = 4,134 ), y 2.2 por cada 100 pacientes/año para umeclidinium / vilanterol 62.5 mcg/ 25 mcg (n = 2,070). La muerte en tratamiento debida a eventos cardiovasculares ocurrió en 20 de 4,151 pacientes (0.54 por cada 100 pacientes/año) que recibieron TRELEGY, 27 de 4,134 pacientes (0.78 por cada 100 pacientes/año) que recibieron furoato de fluticasona/vilanterol, y 16 de 2,070 pacientes (0.94 por cada 100 pacientes/año) que recibieron umeclidinium / vilanterol.
En un ensayo de mortalidad con furoato de fluticasona/ vilanterol con una duración mediana del tratamiento de 1.5 años en 16,568 sujetos con EPOC moderada y enfermedad cardiovascular, la tasa de incidencia anualizada de eventos cardiovasculares adjudicados (compuesto de infarto de miocardio, accidente cerebrovascular, angina inestable, ataque isquémico transitorio, o muerte durante el tratamiento debido a eventos cardiovasculares) fue de 2.5 por cada 100 años-pacientes para furoato de fluticasona/ vilanterol 100 mcg/25 mcg, 2.7 para placebo, 2.4 para furoato de fluticasona 100 mcg y 2.6 para vilanterol 25 mcg. Las muertes adjudicadas durante el tratamiento debido a eventos cardiovasculares ocurrieron en 82 sujetos que recibieron furoato de fluticasona/ vilanterol 100 mcg/25 mcg, 86 sujetos que recibieron placebo, 80 sujetos que recibieron furoato de fluticasona 100 mcg y 90 sujetos que recibieron vilanterol 25 mcg (la tasa de incidencia anualizada varió de 1.2 a 1.3 por cada 100 años-pacientes para los grupos de tratamiento).
Reducción de la densidad mineral ósea: Se han observado disminuciones en la densidad mineral ósea (DMO) con la administración a largo plazo de productos que contienen ICS. Se desconoce la importancia clínica de los pequeños cambios en la (DMO) con respecto a las consecuencias a largo plazo, como la fractura. Los pacientes con factores de riesgo importantes de disminución del contenido mineral óseo, como inmovilización prolongada, antecedentes familiares de osteoporosis, estado posmenopáusico, consumo de tabaco, edad avanzada, mala nutrición o uso crónico de fármacos que pueden reducir la masa ósea (p. ej., anticonvulsivos, corticosteroides orales) deben ser monitoreados y tratados con estándares de cuidado establecidos. Dado que los pacientes con EPOC a menudo tienen múltiples factores de riesgo para una (DMO) reducida, se recomienda evaluar la (DMO) antes de iniciar TRELEGY y periódicamente a partir de entonces. Si se observan reducciones significativas en la (DMO) y TRELEGY aún se considera médicamente importante para el tratamiento de la EPOC de ese paciente, se debe considerar seriamente el uso de medicamentos para tratar o prevenir la osteoporosis.
Glaucoma y cataratas, empeoramiento del glaucoma de ángulo estrecho y corioretinopatía serosa central: Se ha reportado glaucoma, aumento de la presión intraocular y cataratas en pacientes con EPOC después de la administración a largo plazo de ICS o con el uso de anticolinérgicos inhalados. Otro efecto sistémico posible es la coriorretinopatía serosa central. TRELEGY debe usarse con precaución en pacientes con glaucoma de ángulo estrecho. Los médicos y los pacientes también deben estar alerta para detectar los signos y síntomas del glaucoma agudo de ángulo estrecho (p. ej., dolor o malestar ocular, visión borrosa, halos visuales o imágenes coloreadas en asociación con ojos rojos por congestión conjuntival y edema corneal). Indique a los pacientes que consulten a su médico de inmediato si se desarrolla alguno de estos signos o síntomas. Considere referir con un oftalmólogo a los pacientes que desarrollan síntomas oculares o que usan TRELEGY a largo plazo.
Empeoramiento de la retención urinaria: TRELEGY, como todos los medicamentos que contienen un anticolinérgico, debe usarse con precaución en pacientes con retención urinaria. Los médicos y los pacientes deben estar alertas para detectar signos y síntomas de retención urinaria (p. ej., dificultad para orinar, dolor al orinar), especialmente en pacientes con hiperplasia prostática u obstrucción del cuello de la vejiga. Indique a los pacientes que consulten a un proveedor de atención médica de inmediato si se desarrolla alguno de estos signos o síntomas.
Condiciones coexistentes: TRELEGY, como todos los medicamentos que contienen aminas simpaticomiméticas, debe usarse con precaución en pacientes con trastornos convulsivos o tirotoxicosis y en aquellos que son excepcionalmente sensibles a las aminas simpaticomiméticas. Se ha informado que las dosis del agonista albuterol del adrenoceptor beta2 relacionado, cuando se administran por vía intravenosa, agravan la diabetes mellitus y la cetoacidosis, preexistentes.
Hipocalemia e hiperglucemia: Los agonistas adrenérgicos beta pueden producir hipocalemia significativa en algunos pacientes, posiblemente a través de la derivación intracelular, que tiene el potencial de producir efectos cardiovasculares adversos. La disminución del potasio sérico suele ser transitoria y no requiere suplementos. Los medicamentos beta-agonistas pueden producir hiperglucemia transitoria en algunos pacientes.
Efectos sobre la capacidad de conducir y utilizar maquinaria: No existen estudios para investigar el efecto de TRELEGY sobre la capacidad de realizar tareas que requieran juicio, o capacidades motrices o cognitivas.
No se anticiparía un efecto perjudicial sobre dichas actividades a partir de la farmacología de Furoato de fluticasona, umeclidinio o vilanterol en dosis clínicas.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Bucal.
Considrración de uso: Para inhalación.
Después de la inhalación, el paciente debe enjuagar su boca con agua sin tragarla.
Poblaciones:
Adultos: La dosis recomendada y máxima es una inhalación de TRELEGY de 100/62.5/25 microgramos una vez al día, a la misma hora todos los días.
Niños y adolescentes: El uso en pacientes menores de 18 años de edad no es relevante, debido a la indicación para este producto.
Pacientes de edad avanzada: No se requiere ningún ajuste de la dosis en los pacientes mayores de 65 años (véase Farmacocinética-Poblaciones especiales de pacientes).
Insuficiencia renal: No se requiere ningún ajuste de la dosis para los pacientes con insuficiencia renal (véase Farmacocinética-Poblaciones especiales de pacientes
Insuficiencia hepática: No se requiere ningún ajuste de la dosis en pacientes con insuficiencia hepática. Umeclidinio no se ha estudiado en pacientes con insuficiencia hepática severa (véase Precauciones generales, farmacocinética-Poblaciones especiales de pacientes).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: No se cuenta con datos disponibles derivados de los estudios clínicos relativos a sobredosis de TRELEGY.
Síntomas y signos: Una sobredosis de TRELEGY puede producir signos, síntomas o efectos adversos asociados con las acciones farmacológicas de los componentes individuales (véase Precauciones generales y Farmacocinética y farmacodinamia).
Tratamiento: No existe un tratamiento específico para una sobredosis con TRELEGY. En caso de que se presente sobredosis, el paciente debe recibir tratamiento de soporte con el monitoreo apropiado según sea necesario.
El bloqueo beta cardioselectivo debe considerarse únicamente para los efectos de sobredosis profunda con vilanterol que sean clínicamente preocupantes y no respondan a medidas de soporte. Los fármacos beta bloqueadores cardioselectivos deben utilizarse con precaución en pacientes con una historia de broncoespasmo.
Se debe dar tratamiento adicional cuando esté clínicamente indicado, o conforme a lo recomendado por el centro nacional de intoxicaciones cuando esté disponible.
PRESENTACIÓN: Caja con dispositivo inhalador con 30 dosis.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30°C.
Después de retirar el dispositivo de la bandeja, el producto se conserva por un periodo máximo de 6 semanas cuando se almacena a no más de 30°C. Consérvese el dispositivo bien cerrado.
Contiene un desecante NO INGERIBLE, consérvese dentro del envase.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. Literatura exclusiva para médicos. No se use en menores de 18 años. El uso de este medicamento durante el embarazo y la lactancia queda bajo la responsabilidad del médico. Este medicamento contiene lactosa monohidratada, que puede producir reacciones de hipersensibilidad.
Reporte las sospechas de reacción adversa a los correos:
farmacovigilancia@cofepris.gob.mx y
farmacovigilancia.mx@gsk.com
GLAXOSMITHKLINE MÉXICO, S.A. de C.V.
Calz. México-Xochimilco No. 4900,
Col. San Lorenzo Huipulco,
C.P. 14370, Tlalpan, Ciudad de México, México.
Reg. Núm. 374M2017, SSA IV
Clave IPP: GDS06/IPI06 12-Nov-2018
Fecha de autorización: 06 de diciembre de 2019, 193300415J0054