
TRADOL-DUO
DICLOFENACO, TRAMADOL
Tabletas
1 Caja, 10 Tabletas, 25/25 mg/mg
1 Caja, 20 Tabletas, 25/25 mg/mg
1 Caja, 30 Tabletas, 25/25 mg/mg
1 Caja, 10 Tabletas, 50/50 mg/mg
1 Caja, 20 Tabletas, 50/50 mg/mg
1 Caja, 30 Tabletas, 50/50 mg/mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
TRADOL®-DUO 25 mg/25 mg
Cada TABLETA contiene:
Clorhidrato de tramadol 25 mg
Diclofenaco sódico 25 mg
Excipiente cbp 1 tableta
TRADOL®-DUO 50 mg/50 mg
Cada TABLETA contiene:
Clorhidrato de tramadol 50 mg
Diclofenaco sódico 50 mg
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS: Está indicado para el alivio del dolor agudo de intensidad moderado a severo.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas:
Grupo farmacoterapéutico: Otros opioides en combinación con analgésicos no opioides.
Código ATC: N02A J 15.
Tramadol: Tramadol es un analgésico racémico que actúa en el sistema nervioso central. Sus actividades múltiples complementarias residen en los enantiómeros (+) y (-). A concentraciones submicromolares, tramadol (-) inhibe la recaptación sináptica de la norepinefrina (NE) y tramadol (+) inhibe la recaptación sináptica de la serotonina (5-HT). Además, tramadol cuenta con actividad agonista en los receptores opioides μ a través de los enantiómeros (+) que aumenta en gran medida hacia las afinidades nanomolares en el enantiómero (+) del metabolito O-desmetil-tramadol (M1). A pesar de que los transportadores de monoamina son más bajos que aquellos del receptor opioide μ, la inhibición de la recaptación de NE y 5-HT contribuye a la actividad antinociceptiva de tramadol.
Diclofenaco: Diclofenaco sódico es un fármaco antiinflamatorio no esteroide (AINE) que exhibe actividades antiinflamatorias, analgésicas y antipiréticas en modelos animales. El mecanismo de acción de diclofenaco sódico, al igual que el de otros AINE, no se comprende del todo, pero puede relacionarse con la inhibición de la ciclooxigenasa con la reducción de la síntesis de prostaglandina.
Tramadol/diclofenaco:
Efecto analgésico: Tramadol y diclofenaco muestran interacciones aditivas y sinérgicas en modelos de roedores de antinocicepción aguda, hiperalgesia térmica o dolor inflamatorio.
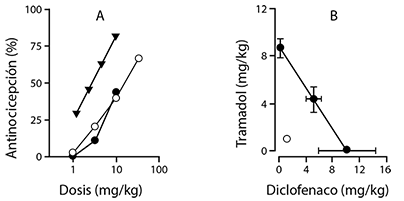
Figura 1. Las curvas dosis-respuesta en la hiperalgesia térmica en ratas después de la administración de diclofenaco (círculos negros), tramadol (círculos abiertos) o la combinación de ambos fármacos (triángulos negros) (A) y el análisis isobolográfico de tal combinación. La combinación de tramadol y diclofenaco a proporciones de dosis equivalentes (círculo abierto) desciende hacia la izquierda y por debajo de la línea de aditividad indicando una interacción supra-aditiva (sinérgica) (B). Los datos se expresan como media ± s.e.m. (n=6).
Efecto antiinflamatorio: En la prueba de edema inducido por carragenina en ratas, la combinación de tramadol y diclofenaco suprimió la formación del edema con un rango de dosis efectiva similar a aquella obtenida con diclofenaco por sí solo. En la misma prueba, el efecto ulcerogénico gástrico de la combinación fue menor que aquel de diclofenaco. Esto fue indicado por una dosis de umbral dos veces mayor para el efecto ulcerogénico gástrico y un puntaje de ulcerogénico menor que fue 3.45 para la combinación a 21.5 mg/kg p.o. y 6.0 para diclofenaco a la misma dosis.
Experiencia clínica: De conformidad con los resultados preclínicos, la combinación de tramadol y diclofenaco ofreció un mejor alivio del dolor en seres humanos con dolor postoperatorio que la monoterapia con tramadol o diclofenaco.
TRADOL®-DUO está posicionado como un analgésico de la etapa II de la escala de dolor de la OMS y debe utilizarse de acuerdo con las instrucciones del médico.
Propiedades farmacocinéticas:
Absorción y biodisponibilidad: Más del 90% de tramadol es absorbido después de la administración oral. La biodisponibilidad media absoluta después de una dosis oral única es de alrededor de 70% independientemente de la ingestión concomitante de alimentos. La diferencia entre la absorción y la biodisponibilidad absoluta de tramadol se debe probablemente al efecto de primer paso. Después de la administración oral, el efecto de primer paso es un máximo de 30%. Las concentraciones máximas en suero se alcanzan a 1.5 a 2 horas después de la administración. Después de la administración oral repetida, el estado estacionario se alcanza en 36 horas. Las concentraciones de estado estacionario son 30% a 40% mayores que aquellas extrapoladas de una administración de dosis única. Estas concentraciones mayores son probablemente causadas por la saturación del metabolismo de primer paso.
La absorción de diclofenaco es completa, pero su inicio es retardado hasta el paso a través del estómago que puede ser afectado por alimentos, lo cual retrasa el vaciado del estómago. La concentración plasmática media máxima de diclofenaco se alcanza después de aproximadamente 2 horas.
Alrededor de la mitad de diclofenaco administrado es metabolizada durante su primer paso a través del hígado (efecto de "primer paso"), el área por debajo de la curva de concentración (ABC) después de la administración oral es aproximadamente la mitad de aquella después de una dosis parenteral equivalente.
El comportamiento farmacocinético no se altera con la administración repetida. No ocurre la acumulación, siempre que se observen los intervalos de dosificación recomendados.
Distribución: Tramadol se distribuye de forma amplia y rápida. El volumen total de distribución según fue determinado en 12 estudios I.V. variaba entre 203±40 L y 290±37 L. Solamente alrededor del 20% del tramadol administrado se liga a proteínas. Tramadol atraviesa la barrera placentaria y una cantidad muy pequeña de tramadol inalterado y M1 (aprox. 0.1% de la dosis materna administrada) entra en la leche materna en mujeres que están lactando.
El 99.7% del diclofenaco se une a las proteínas séricas, principalmente a la albúmina (99.4%). El diclofenaco entra en el líquido sinovial, donde se determinan concentraciones máximas de 2 a 4 horas después de que se hayan alcanzado las concentraciones plasmáticas máximas. La semivida de eliminación aparente del líquido sinovial es de 3-6 horas. Dos horas después de alcanzar las concentraciones plasmáticas máximas, las concentraciones del principio activo ya son mayores en el líquido sinovial que en el plasma, y se mantienen más elevadas durante un periodo de hasta 12 horas.
Metabolismo: Se han encontrado más de 11 metabolitos de tramadol en la orina humana. Las rutas metabólicas principales son la N- y O-desmetilación y la conjugación de los derivados de O-desmetilo con el ácido glucurónico y sulfúrico.
Solamente un metabolito, O-desmetiltramadol (+), es farmacológicamente activo. Este metabolito tiene propiedades antinociceptivas originadas por la unión al receptor opioide μ.
Varias isoenzimas hepáticas están involucradas en el metabolismo de tramadol; CYP2D6 está principalmente involucrada en la O-desmetilación mientras que CYP3A4 y CYP2B6 son responsables de la N-desmetilación. La inhibición de una de estas isoenzimas involucradas en la biotransformación de tramadol puede afectar la concentración plasmática de tramadol o su metabolito activo. Hasta ahora, no se han reportado interacciones clínicamente relevantes.
Un estudio de inhibición in vitro mostró que tramadol no tiene un efecto inhibidor clínicamente relevante en las isoformas del citocromo P450 principales a concentraciones terapéuticas.
La biotransformación de diclofenaco implica en parte la glucuronidación de la molécula intacta, pero principalmente la hidroxilación y metoxilación única y múltiple que resulta en varios metabolitos fenólicos, la mayoría de los cuales son convertidos a conjugados de glucurónido. Dos de los metabolitos fenólicos son biológicamente activos, pero a un grado mucho menor que el diclofenaco.
Eliminación: Tramadol y sus metabolitos se eliminan casi exclusivamente por los riñones. Ocurre cierta excreción biliar, pero es de importancia menor.
El aclaramiento total según fue determinado en 12 estudios I.V. variaba entre 432±53 mL/min y 607±130 mL/min.
La vida media promedio de la eliminación plasmática terminal del tramadol es de 5 a 7 horas independientemente de la vía de administración. La vida media terminal de M1 es comparable a la de tramadol.
El aclaramiento sistémico total de diclofenaco del plasma es de 263±56 mL/min (media±desviación estándar). La vida media plasmática terminal es de 1-2 horas. Cuatro de los metabolitos, incluyendo los dos activos, también tienen vidas medias cortas en el plasma de 1-3 horas.
Aproximadamente 60% de la dosis administrada es excretada en la orina en forma del conjugado glucorónido de la molécula intacta y en forma de metabolitos, la mayoría de los cuales también son convertidos en conjugados glucorónidos. Menos del 1% es excretado como sustancia inalterada. El resto de la dosis es eliminado como metabolitos a través de la bilis en las heces.
Tramadol/diclofenaco: Se realizó un estudio clínico farmacocinético en 34 sujetos seleccionados de 36 mexicanos saludables evaluados de ambos sexos; la biodisponibilidad farmacocinética de tramadol y diclofenaco observada después una dosis única de la combinación de dosis fija (25 mg/25 mg) se comparó con la obtenida con una dosis única de tramadol (25 mg) o diclofenaco (25 mg).
Los parámetros farmacocinéticos y los análisis de bioequivalencia se muestran en la Tabla 1.
Tabla 1. Parámetros farmacocinéticos e intervalos de confianza para el índice de los parámetros farmacocinéticos del tramadol y diclofenaco con la administración de una dosis única de una combinación en dosis fija o de los fármacos por separado
|
Parámetro (media±DE) |
Tramadol |
||
|
CDF |
R |
Índice CDF/R |
|
|
% (90% IC) |
|||
|
Cmáx (ng/mL) |
64.76±18.37 |
62.25±19.59 |
105.17 (96.49-114.64) |
|
ABC0-t (ng• h/mL) |
362.71±155.62 |
345.59±136.65 |
104.70 (99.95-110.23) |
|
ABC0-? (ng• h/mL) |
380.15±157.18 |
363.99±134.66 |
103.74 (99.30-108.38) |
|
Parámetro (media±DE) |
Diclofenaco |
||
|
CDF |
R |
Índice CDF/R |
|
|
% (90% IC) |
|||
|
Cmáx (ng/mL) |
365.61±200.02 |
516.85±272.91 |
69.85 (61.04-79.94) |
|
ABC0-t (ng• h/mL) |
501.00±133.37 |
507.59±151.62 |
99.75 (95.05-104.68) |
|
ABC0-∝ (ng• h/mL) |
511.27±138.15 |
527.43±156.57 |
100.10 (95.47-104.95) |
DE: desviación estándar, CDF: combinación de dosis fija, R: referencia, IC: intervalo de confianza.
La magnitud de la absorción (ABC) de tramadol y diclofenaco con la combinación en dosis fija fue bioequivalente a cualquiera de los productos solos, el ritmo de absorción (Cmáx) de tramadol con la combinación en dosis fija fue bioequivalente al tramadol solo. El ritmo de absorción (Cmáx) del diclofenaco no fue bioequivalente al del diclofenaco solo. No se considera que la Cmáx más baja del diclofenaco obtenida con la combinación en dosis fija en este estudio afecte el inicio y la duración del efecto terapéutico aportado por el diclofenaco en la combinación en dosis fija; no se considera que refleje un efecto sistemático del tramadol en la farmacocinética del diclofenaco, sino las características de absorción muy variable del diclofenaco en la fase inicial después de la administración oral.
La ausencia de un efecto del tramadol en la velocidad de absorción de diclofenaco se sustenta además con un estudio farmacocinético poblacional en pacientes sometidas a cesárea que no mostró también indicación de algún efecto del diclofenaco en la farmacocinética de disposición del tramadol o su metabolito activo O-desmetiltramadol.
No hay indicios de un potencial de interacción entre tramadol y diclofenaco después de la administración intravenosa y oral en perros.
CONTRAINDICACIONES:
• En casos de hipersensibilidad al tramadol, diclofenaco o a cualquiera de los excipientes.
• En casos de intoxicación aguda con alcohol, medicamentos hipnóticos, analgésicos, opioides u otros medicamentos psicotrópicos.
• En pacientes que estén recibiendo inhibidores de la MAO o que los hayan tomado dentro del periodo de los últimos 14 días (véase Interacciones medicamentosas y de otro género).
• En pacientes con epilepsia no controlada adecuadamente con tratamiento.
• En pacientes con antecedentes de broncoespasmo, asma, rinitis o urticaria después de la administración de ácido acetilsalicílico u otros AINE.
• En pacientes con recurrencia existente o previa de úlceras pépticas o hemorragia (por lo menos dos episodios distintos de ulceración comprobada o hemorragia).
• En pacientes con antecedentes de hemorragia gastrointestinal o perforación relacionado con el tratamiento previo con AINE.
• En pacientes con hemorragia cerebrovascular u otras hemorragias activas.
• En pacientes con insuficiencia hepática o renal grave.
• En pacientes con insuficiencia cardiaca grave (véase Precauciones generales).
• En pacientes con dolor de tipo visceral con riesgo de hemorragia gastrointestinal.
• Por todo lo anterior, TRADOL®-DUO está contraindicado en el embarazo y en la lactancia (véase Restricciones de uso durante el embarazo y la lactancia).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: Debido a que TRADOL®-DUO es una combinación fija de ingredientes activos incluyendo diclofenaco, está contraindicado en los últimos tres meses de embarazo. Debido a que TRADOL®-DUO contiene adicionalmente clorhidrato de tramadol, no debe utilizarse durante el embarazo.
Datos respecto al clorhidrato de tramadol: El clorhidrato de tramadol no debe utilizarse durante el embarazo debido a que no hay disponible evidencia apropiada para evaluar la seguridad del clorhidrato de tramadol en mujeres embarazadas. El clorhidrato de tramadol administrado antes o durante el nacimiento no afecta la contractilidad uterina. En neonatos puede inducir cambios en la frecuencia respiratoria que generalmente no son clínicamente relevantes. El tratamiento de largo plazo durante el embarazo puede conducir a síntomas de abstinencia en el recién nacido después del parto, como consecuencia de la habituación.
Datos respecto al diclofenaco: Se han reportado anormalidades congénitas en asociación con la administración de AINE en el hombre; sin embargo, éstos ocurren en una baja frecuencia y no parecen seguir ningún patrón discernible. En vista de los efectos conocidos de AINE en el sistema cardiovascular fetal (riesgo de cierre del conducto arterioso), está contraindicado el uso en el último trimestre de embarazo. El inicio del parto puede retrasarse y la duración incrementarse con un aumento en la tendencia de sangrado tanto en la madre como en el niño. En los primeros seis meses de embarazo el diclofenaco deberá administrarse sólo si es absolutamente necesario. Si se administra diclofenaco a una mujer que está tratando de embarazarse o durante los primeros seis meses de embarazo, se deberá mantener la dosis lo más baja posible y una duración de tratamiento lo más corta posible.
Durante los últimos tres meses de embarazo todos los inhibidores de síntesis de prostaglandinas pueden exponer al feto a los siguientes riesgos:
• Toxicidad cardiopulmonar (con oclusión prematura del conducto arterioso e hipertensión pulmonar).
• Trastornos en la función renal que conducen a insuficiencia renal y oligohidramnios; exponer a la madre y al niño a los siguientes riesgos al final del embarazo:
• Posible prolongación del tiempo de sangrado, inhibición de agregación trombocitaria, que pueden ocurrir incluso con dosis muy bajas;
• Inhibición de las contracciones uterinas resultando en un retraso o prolongación del parto.
Por todo lo anterior, TRADOL®-DUO está contraindicado en el Embarazo.
Lactancia: Debido a que TRADOL®-DUO es una combinación fija de sustancias activas incluyendo clorhidrato de tramadol, no se debe tomar durante la lactancia.
Datos respecto al clorhidrato de tramadol: El clorhidrato de tramadol y sus metabolitos se encuentran en pequeñas cantidades en la leche materna humana. Un lactante podría ingerir aproximadamente 0.1% de la dosis administrada a la madre. Clorhidrato de tramadol no debe ingerirse durante la lactancia.
Datos respecto al diclofenaco: Pequeñas cantidades de la sustancia activa diclofenaco y sus metabolitos pasan a la leche materna. Hasta ahora, no se han reportado efectos negativos en el infante, y por lo tanto en los casos de administración de corto plazo, generalmente no es necesario interrumpir la lactancia. Si se prescribe la administración de largo plazo o de dosis elevadas para enfermedades reumáticas, se deberá considerar la descontinuación temprana de la lactancia.
Fertilidad:
Datos respecto al diclofenaco: Como con otros AINE, el uso de diclofenaco puede alterar la fertilidad femenina y no se recomienda en mujeres que estén intentando concebir. En mujeres con dificultades para concebir o que estén siendo sometidas a un estudio de fertilidad, se debería considerar la suspensión de este medicamento.
Por todo lo anterior, TRADOL®-DUO está contraindicado en la lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS: Los efectos no deseados reportados más comúnmente reportados para la combinación clorhidrato de tramadol/diclofenaco fueron náusea, mareos y somnolencia, observados en más de 10% de los pacientes.
Dentro de cada grupo de frecuencia, se presentan los efectos no deseados en orden decreciente de seriedad.
Las frecuencias se definen como se indica a continuación:
Muy común: >1/10
Común: >1/100, <1/10
Poco común: >1/1000, <1/100
Raro: >1/10 000, <1/1000
Muy raro: <1/10 000
Desconocido: no se puede estimar a partir de los datos disponibles.
Dentro de cada grupo de frecuencia, los efectos no deseados se presentan en orden decreciente de gravedad.
Trastornos sanguíneos y del sistema linfático:
Muy raros: dishematopoyesis (anemia aplásica, leucopenia, trombocitopenia, pancitopenia, agranulocitosis), anemia hemolítica. Los primeros signos pueden ser fiebre, dolor de garganta, heridas superficiales en la boca, síntomas gripales, agotamiento severo, hemorragias nasales y hemorragia de la piel.
Trastornos cardiacos:
Poco comunes: palpitaciones, taquicardia, dolor torácico. Estas reacciones adversas pueden ocurrir especialmente en pacientes que se encuentran físicamente estresados.
Raros: bradicardia.
Muy raros: disfunción cardiaca congestiva, infarto del miocardio.
Los estudios clínicos y los datos epidemiológicos sugieren que el uso de diclofenaco, en particular en dosis elevadas (150 mg diarios) y el tratamiento de largo plazo pueden estar asociados con un riesgo ligeramente elevado de eventos trombóticos arteriales (por ejemplo, infarto al miocardio o accidente cerebrovascular).
Desconocido: Síndrome de Kounis.
Trastornos de la visión:
Raros: visión borrosa, miosis, midriasis.
Muy raros: trastornos visuales (visión doble).
Trastornos del oído y del laberinto:
Muy raros: tinnitus, trastornos auditivos transitorios.
Trastornos gastrointestinales:
Muy comunes: molestias gastrointestinales como náusea, vómito, diarrea y pérdida menor de sangre gastrointestinal, que en casos excepcionales puede causar anemia.
Comunes: estreñimiento, boca seca, dolor abdominal, dispepsia, flatulencias, calambres abdominales, úlceras gastrointestinales (posiblemente con hemorragia y perforación).
Poco comunes: arcadas, irritación gastrointestinal (una sensación de presión en el estómago, distención abdominal), hematemesis, melena o diarrea con sangrado.
Muy raros: estomatitis, glositis, lesiones esofágicas, molestias en el abdomen inferior (por ejemplo, colitis hemorrágica o colitis ulcerosa exacerbada/enfermedad de Crohn), colitis isquémica, pancreatitis, estenosis intestinal diafragmática.
Se le pide al paciente que suspenda el medicamento en caso de que se presente dolor abdominal superior grave, melena o hematemesis y consultar a un médico inmediatamente.
Trastornos generales y condiciones del sitio de administración:
Comunes: fatiga.
Poco comunes: edema particularmente en pacientes con hipertensión arterial o insuficiencia renal.
Trastornos hepato-biliares:
Comunes: transaminasas séricas elevadas.
Poco comunes: daño hepático en particular con tratamiento de largo plazo, hepatitis aguda con o sin ictericia.
Muy raros: hepatitis fulminante.
Infecciones e infestaciones:
Muy raros: Ha habido reportes de un deterioro en la inflamación relacionada con la infección (por ejemplo, desarrollo de fascitis necrotizante) en relación temporal con la administración sistémica de AINE (como diclofenaco sódico presente en TRADOL®-DUO). Esto posiblemente está relacionado con el mecanismo de acción de los AINE. Reportes de meningitis aséptica (especialmente en pacientes con trastornos autoinmunes existentes, como lupus sistémico eritematoso, enfermedad mixta del tejido conectivo) con síntomas como rigidez del cuello, dolor de cabeza, náusea, vómito, fiebre o desorientación.
Investigaciones:
Muy raros: bajos niveles de hemoglobina.
Trastornos del sistema inmunológico:
Raros: reacciones alérgicas. Pueden presentarse en la forma de edema facial, inflamación de la lengua y laringe interna con constricción del tracto respiratorio (edema angioneurótico), disnea, broncoespasmo, jadeo, taquicardia, hipotensión que culmina en shock inminente, anafilaxia.
En el caso de uno de estos síntomas, que puede presentarse incluso cuando la preparación se usa por pirmera vez, TRADOL®-DUO se deberá descontinuar y será necesario el tratamiento médico inmediato.
Metabolismo y trastornos nutricionales:
Comunes: pérdida del apetito.
Raros: Cambios en el apetito.
Trastornos musculoesqueléticos y del tejido conectivo:
Raros: debilidad motora.
Trastornos del sistema nervioso:
Muy comunes: mareos.
Comunes: cefalea, somnolencia, agitación, irritabilidad.
Raros: parestesia, temblores, convulsiones epileptiformes, contracciones musculares involuntarias, coordinación anormal, síncope.
Las convulsiones epileptiformes ocurrieron principalmente después de la administración de dosis elevadas de tramadol o después del tratamiento concomitante con medicamentos que pueden disminuir el umbral convulsivo. (Véase secciones Precauciones generales e Interacciones medicamentosas y de otro género).
Muy raros: desorientación, espasmos, temblores.
Trastornos psiquiátricos:
Raros: alucinaciones, confusión, trastornos del sueño, ansiedad y pesadillas.
Las reacciones psíquicas adversas pueden ocurrir después de la administración de tramadol las cuales varían individualmente en intensidad y naturaleza (dependiendo de la personalidad y duración del tratamiento). Éstas incluyen cambios en el estado de ánimo (usualmente elación, ocasionalmente disforia), cambios en las actividades (usualmente supresión, ocasionalmente incremento) y cambios en la capacidad cognitiva y sensorial (por ejemplo, comportamiento en la toma de decisiones, trastornos de la percepción). Puede presentarse dependencia. Pueden ocurrir síntomas de reacciones de abstinencia, similares a las que se presentan durante la abstinencia de opioides, como por ejemplo: agitación, ansiedad, nerviosismo, insomnio, hiperquinesia, temblores y síntomas gastrointestinales. Otros síntomas que han sido muy raramente observados con la descontinuación de tramadol incluyen: ataques de pánico, ansiedad severa, alucinaciones, parestesias, tinnitus y síntomas inusuales del SNC (por ejemplo, confusión, delirios, despersonalización, desrealización, paranoia).
Muy raros: depresión.
Trastornos respiratorios, torácicos y mediastinales:
Raros: depresión respiratoria, disnea.
Si las dosis recomendadas son excedidas considerablemente y se administran de forma concomitante otras sustancias depresoras del sistema nervioso central (véase Interacciones medicamentosas y de otro género), puede ocurrir depresión respiratoria.
Se ha reportado empeoramiento del asma con tramadol.
Muy raros: neumonitis.
Trastornos del sistema renal y urinario:
Poco comunes: retención de fluidos.
Raros: trastornos de la micción (dificultad en el paso de la orina, disuria y retención urinaria).
Muy raros: daño del tejido renal (nefritis intersticial, necrosis papilar) que puede estar acompañado por insuficiencia renal aguda, proteinuria y/o hematuria; síndrome nefrótico.
Trastornos de la piel y del tejido subcutáneo:
Comunes: sudoración, prurito, sarpullido.
Poco comunes: alopecia, urticaria.
Muy raros: eczema, eritema, fotosensibilización, púrpura (también llamada púrpura alérgica) y reacciones cutáneas bullosas como síndrome de Stevens-Johnson y necrólisis epidérmica tóxica (síndrome de Lyell).
Trastornos vasculares:
Poco comunes: regulación cardiovascular (hipotensión postural o colapso cardiovascular).
Muy raros: hipertensión.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Tramadol: Tras la administración repetida oral y parenteral de tramadol durante 6-26 semanas a ratas y perros, así como durante 12 meses por vía oral a perros, no se detectó ninguna alteración relacionada con la sustancia en los análisis hematológicos, clínico-químicos ni en el examen histológico. Únicamente tras la administración de dosis muy elevadas, considerablemente superiores a la dosis terapéutica, se presentaron síntomas nerviosos centrales: agitación, salivación, convulsiones y reducción del aumento de peso. Ratas y perros toleraron, sin reacción alguna, dosis orales de 20 mg/kg y 10 mg/kg de peso corporal respectivamente; los perros toleraron dosis administradas por vía rectal de 20 mg/kg de peso corporal.
Los resultados de las pruebas estándar de mutagenicidad no revelaron un riesgo genotóxico potencial asociado al uso de clorhidrato de tramadol en el hombre. Los resultados de las pruebas de carcinogenicidad no indican que el clorhidrato de tramadol suponga un riesgo potencial para el hombre. Los estudios de toxicidad reproductiva con clorhidrato de tramadol revelaron, a dosis tóxicas maternas, desarrollo y osificaciones retardadas y mortalidad neonatal. No se afectaron el rendimiento reproductivo, fertilidad y desarrollo de las crías. Tramadol atraviesa la placenta. No se ha observado ningún efecto sobre la fertilidad después de la administración oral de clorhidrato de tramadol en dosis de hasta 50 mg/kg en la rata macho y 75 mg/kg en la rata hembra.
Diclofenaco: Con la administración repetida a animales, la toxicidad crónica de diclofenaco fue particularmente evidente en forma de lesiones y ulceraciones en el tracto gastrointestinal. Durante un estudio de toxicidad de 2 años en ratas, se observó un aumento dependiente de la dosis de oclusiones trombóticas de los vasos cardiacos en ratas tratadas con diclofenaco.
En estudios experimentales en animales sobre toxicidad reproductiva, diclofenaco causó una inhibición de la ovulación en conejos así como el deterioro de la implantación y el desarrollo embrionario temprano en ratas. El periodo de gestación y parto se prolongaron con diclofenaco. Efectos embriotóxicos como aborto y retraso de crecimiento en ratas, ratones y conejos se observaron a dosis maternotóxicas. Basándose en los datos disponibles, diclofenaco se clasifica como no teratogénico. Dosis menores al umbral maternotóxico no tienen influencia en el desarrollo postnatal de la progenie.
Tramadol/diclofenaco: La administración intravenosa en bolo de tramadol HCI y diclofenaco (3 mg/kg + 1.5 mg/kg) causó ligeros efectos cardiovasculares y respiratorios (por ejemplo, disminuciones de la presión arterial, el ritmo cardiaco y ritmo respiratorio) en conejos anestesiados.
En un estudio de toxicidad de dosis orales repetidas en ratas, la administración combinada de tramadol HCI de 8 mg/kg y diclofenaco sódico de 4 mg/kg por 13 semanas indujo intranquilidad y peritonitis que se asoció con la muerte en 1 de 20 ratas hembra.
En estudios de toxicidad embrio-fetal en ratas y conejos, la administración oral de tramadol HCI de 8 mg/kg y diclofenaco sódico de 4 mg/kg no fue teratogénica y no causó retardos de crecimiento fetal ni siquiera con toxicidad materna. Solamente en los conejos aumentó el número de resorciones y se encontró una congestión del hígado en los fetos.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
• TRADOL®-DUO no deberá combinarse con inhibidores de la MAO (véase Contraindicaciones). En pacientes tratados con inhibidores de la MAO en los 14 días previos al uso del opioide petidina, han sido observadas interacciones que ponen en riesgo la vida en el sistema nervioso central, en la función respiratoria y cardiovascular. No se pueden descartar las mismas interacciones con los inhibidores de la MAO durante el tratamiento con TRADOL®-DUO.
• La administración concomitante de TRADOL®-DUO con otros medicamentos depresores centrales incluyendo al alcohol puede potenciar los efectos en el SNC (véase Reacciones secundarias y adversas).
• Tramadol puede inducir convulsiones e incrementar el potencial para que los inhibidores selectivos de la recaptación de serotonina (ISRS), antidepresores tricíclicos, antipsicóticos y otros medicamentos que disminuyen el umbral convulsivo causen convulsiones.
• El uso terapéutico concomitante de tramadol y fármacos serotoninérgicos, como los inhibidores selectivos de la recaptación de serotonina (ISRS), los inhibidores de la recaptación de serotonina-norepinefrina (IRSN), los inhibidores de la MAO (véase Contraindicaciones), los antidepresivos tricíclicos y la mirtazapina pueden causar toxicidad por serotonina. El síndrome de serotonina es probable cuando se observa uno de los siguientes síntomas:
• Clonus espontáneo.
• Clonus inducible u ocular con agitación o diaforesis.
• Temblor e hiperreflexia.
• Hipertonía y temperatura corporal >38ºC y clonus inducible u ocular.
El retiro de los medicamentos serotoninérgicos generalmente provoca una rápida mejoría. El tratamiento depende de la naturaleza y gravedad de los síntomas.
• Los resultados de los estudios farmacocinéticos han demostrado hasta ahora que con la administración previa o concomitante de cimetidina (inhibidor enzimático) no es probable que ocurran interacciones clínicamente relevantes con tramadol. La administración previa o simultánea de carbamazepina (inductor enzimático) puede reducir el efecto analgésico y acortar la duración de acción.
• Otras sustancias activas que se sabe que inhiben el CYP3A4, como ketoconazol y eritromicina, podrían inhibir el metabolismo de tramadol (N-desmetilación), probablemente también el metabolismo del metabolito O-desmetilado activo. La importancia clínica de dicha interacción no ha sido estudiada (véase Reacciones secundarias y adversas).
• Se recomienda precaución cuando se prescribe conjuntamente diclofenaco con inhibidores potentes de CYP2C9 (como voriconazol), lo que podría provocar un aumento significativo en las concentraciones plasmáticas máximas y la exposición al diclofenaco debido a la inhibición del metabolismo de diclofenaco.
• En un número limitado de estudios, la aplicación preoperatoria o postoperatoria del antagonista antiemético 5-HT3 ondansetrón aumentó el requerimiento de tramadol en pacientes con dolor postoperatorio.
• Se debe tener precaución durante el tratamiento concomitante con TRADOL®-DUO y los derivados de cumarina (por ejemplo, warfarina) debido a informes de aumento de INR (International Normalized Ratio) con hemorragia grave y equimosis en algunos pacientes tratados con tramadol. También los AINE, incluido el diclofenaco, pueden intensificar los efectos de los anticoagulantes, como la warfarina (véase Precauciones generales).
• La administración concomitante de diferentes AINE puede incrementar el riesgo de úlceras y hemorragia gastrointestinal debido al efecto sinérgico. Por lo tanto, no se recomienda la administración concomitante de TRADOL®-DUO y otros AINE (véase Precauciones generales).
• La administración concomitante de TRADOL®-DUO y digoxina o litio puede incrementar la concentración de estos medicamentos en la sangre. El uso concomitante de glucósidos cardiacos y AINE en pacientes puede exacerbar la insuficiencia cardiaca, reducir la tasa de filtración glomerular (TFG) y aumentar los niveles de glucósido en plasma. Se deberá verificar los niveles de litio sérico. Se recomiendan las revisiones de digoxina sérica.
• Fármacos antiinflamatorios no esteroideos como el diclofenaco pueden atenuar el efecto de diuréticos y medicamentos antihipertensivos. En pacientes con disfunción renal (por ejemplo, pacientes deshidratados o pacientes en edad avanzada con disfunción renal) la administración concomitante de un inhibidor de la enzima convertidora de angiotensina (ACE) o un antagonista de la angiotensina-II con un medicamento que inhibe la ciclooxigenasa puede deteriorar posteriormente la función renal con la posibilidad de provocar una insuficiencia renal aguda, que generalmente es reversible. Por lo tanto, una combinación como ésta sólo debe utilizarse con precaución, particularmente en pacientes en edad avanzada. Se debe solicitar a los pacientes tomar cantidades adecuadas de fluidos y se debe considerar hacer verificaciones regulares de los valores renales después del inicio de la terapia de combinación. La administración concomitante de TRADOL®-DUO y diuréticos ahorradores de potasio, ciclosporina, tacrolimus o trimetoprima puede estar asociado con un aumento en los niveles séricos de potasio, que por lo tanto deben ser vigilados con frecuencia.
• Posible aumento del riesgo de nefrotoxicidad cuando se administran AINE con tacrolimus.
• Colestipol y colestiramina: estos agentes pueden inducir un retraso o una disminución en la absorción de diclofenaco. Por lo tanto, se recomienda administrar diclofenaco al menos una hora antes o de 4 a 6 horas después de la administración de colestipol/colestiramina.
• Glucocorticoides: Incremento en el riesgo de úlceras o hemorragia gastrointestinal (véase sección Precauciones generales).
• Inhibidores de agregación plaquetaria como el ácido acetilsalicílico y ISRS: Incremento en el riesgo de hemorragia gastrointestinal (véase Precauciones generales).
• La administración de TRADOL®-DUO dentro del lapso de 24 horas antes o después de metotrexato puede incrementar la concentración de metotrexato en la sangre y aumentar sus efectos tóxicos.
• AINE (como diclofenaco sódico en Tradol®-DUO) pueden incrementar la nefrotoxicidad por ciclosporina.
• Los medicamentos que contienen probenecid o sulfinpirazona pueden retrasar la excreción de diclofenaco.
• Cuando se administran AINE con zidovudina hay un incremento en el riesgo de toxicidad hematológica. Existe evidencia de un aumento en el riesgo de hemartrosis y hematoma en hemofílicos VIH (+) que reciben tratamiento concurrente con zidovudina e ibuprofeno.
• Antagonistas del calcio (Isradipino, verapamilo): Hay estudios en los que se ha registrado una disminución en su eficacia terapéutica por acción de diclofenaco.
• Antidiabéticos: Los ensayos clínicos han demostrado que diclofenaco puede administrarse junto con antidiabéticos orales sin que influya sobre su efecto clínico. Sin embargo, se han notificado casos aislados de efectos tanto hipoglucémicos como hiperglucémicos con diclofenaco que precisaron modificar la dosis de los antidiabéticos. Por esta razón, se recomienda controlar los niveles de glucosa en sangre como medida de precaución durante el tratamiento concomitante.
• Antibacterianos:
Quinolónicos: Existen informes aislados de convulsiones que pueden haber sido debidas al uso concomitante de quinolonas y AINE.
Ceftriaxona: Hay estudios en los que se ha registrado un incremento de su eliminación por el diclofenaco.
• Fenitoína: Cuando se utiliza concomitantemente fenitoína con diclofenaco, se recomienda una monitorización de los niveles plasmáticos de la fenitoína, ya que se espera un aumento a la exposición de fenitoína.
• Alcohol: Se puede ver potenciada la toxicidad de los antiinflamatorios no esteroideos.
• Misoprostol: Se puede ver potenciada la toxicidad con antiinflamatorios no esteroideos.
• Pentazocina: Hay estudios en los que se ha registrado la aparición de ataques convulsivos de tipo tónico-clónico con antiinflamatorios no esteroideos.
• Inductores de CYP2C9: Se recomienda precaución cuando se prescribe diclofenaco con inductores de CYP2C9 (como rifampicina), que pueden dar lugar a un descenso significativo de la concentración plasmática y exposición a diclofenaco.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
• Trastornos del sistema linfático y venoso: Dishematopoyesis (anemia aplásica, leucopenia, trombocitopenia, pancitopenia, agranulocitosis) (muy raro).
• Anemia hemolítica (muy raro).
• Trastornos hepatobiliares: Elevación de las transaminasas séricas (común).
• Niveles bajos de hemoglobina (muy bajo).
PRECAUCIONES GENERALES:
Advertencias:
• Se han reportado convulsiones en pacientes a quienes recibieron tramadol a dosis recomendadas. El riesgo puede incrementarse cuando las dosis de clorhidrato de tramadol exceden al límite superior de la dosis diaria recomendada. Además, tramadol puede incrementar el riesgo de presentar convulsiones en pacientes que toman otros medicamentos que disminuyen el umbral convulsivo (véase Interacciones medicamentosas y de otro género).
Los pacientes epilépticos o aquellos que son susceptibles a las convulsiones deben ser tratados con TRADOL®-DUO sólo si existen circunstancias que lo ameriten.
• Tramadol tiene un bajo potencial de dependencia. En uso a largo plazo, puede desarrollar dependencia psíquica y física. En pacientes con una tendencia al abuso o dependencia de fármacos, el tratamiento con TRADOL®-DUO sólo deberá realizarse durante periodos cortos de tiempo bajo estricta supervisión médica.
• TRADOL®-DUO no se recomienda como un sustituto en pacientes dependientes de opioides. Aunque es un agonista opioide, tramadol no puede suprimir los síntomas de privación de la morfina.
• Debe evitarse el uso de TRADOL®-DUO con AINE concomitantes incluyendo inhibidores selectivos de la ciclooxigenasa-2.
• Se han reportado hemorragia, úlceras o perforación gastrointestinal, en algunos casos con resultados fatales, con el uso de todos los AINE incluyendo diclofenaco. Ocurrieron en cualquier momento durante la terapia con o sin signos de advertencia o un historial de eventos gastrointestinales graves.
• El riesgo de hemorragia, úlceras o perforación gastrointestinal es mayor con dosis más elevadas de TRADOL®-DUO, en pacientes con antecedentes de úlceras, en particular con complicaciones de hemorragia o perforación (véase Contraindicaciones), y en pacientes de edad avanzada. Estos pacientes deberán comenzar con la dosis más baja disponible. En estos pacientes y en aquellos que requieran tratamiento concomitante con ácido acetilsalicílico (ASA) en dosis bajas u otros medicamentos que puedan incrementar el riesgo gastrointestinal (véase Interacciones medicamentosas y de otro género), deberá considerarse la terapia de combinación con agentes protectores (por ejemplo, misoprostol o inhibidores de la bomba de protones) (véase abajo Interacciones medicamentosas y de otro género).
• Los pacientes con antecedentes de toxicidad gastrointestinal, en particular en edades avanzadas, deberán reportar cualquier síntoma abdominal inusual (en particular, hemorragia gastrointestinal), especialmente al inicio del tratamiento. Se deberán tomar cuidados en pacientes que estén tomando de manera concomitante medicamentos que puedan incrementar el riesgo de úlceras o hemorragia, por ejemplo, corticosteroides orales, anticoagulantes como warfarina, inhibidores selectivos de la recaptación de serotonina o inhibidores de la agregación trombocitaria como ASA (véase Interacciones medicamentosas y de otro género).
• Si se producen hemorragia o úlceras gastrointestinales durante el tratamiento con TRADOL®-DUO, deberá suspenderse el tratamiento.
• Los AINE, incluido el diclofenaco, pueden aumentar el riesgo de fuga anastomótica gastrointestinal. Se recomienda una vigilancia médica estrecha y precaución cuando se utilice diclofenaco después de una intervención quirúrgica gastrointestinal.
• Durante el tratamiento con AINE ha habido reportes muy raros de reacciones cutáneas graves, en algunos casos con un resultado fatal, incluyendo dermatitis exfoliativa, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica (síndrome de Lyell) (véase Reacciones secundarias y adversas). El riesgo de dichas reacciones parece ser mayor al inicio del tratamiento, debido a que en la mayoría de los casos estas reacciones ocurrieron en el primer mes de tratamiento. A los primeros signos de sarpullido, lesiones en las mucosas u otros signos de una reacción de hipersensibilidad TRADOL®-DUO deberá descontinuarse.
• Como con otros fármacos antiinflamatorios no esteroideos, pueden ocurrir reacciones alérgicas, incluyendo reacciones anafilácticas/anafilactoides sin exposición previa al fármaco. A los primeros signos de una reacción de hipersensibilidad, después de la administración de TRADOL®-DUO, debe suspenderse el tratamiento. Sólo expertos deben iniciar los procedimientos médicos requeridos. Las reacciones de hipersensibilidad también pueden evolucionar a un síndrome de Kounis, una reacción alérgica grave que puede cursar con un infarto de miocardio. Los síntomas iniciales de estas reacciones pueden consistir en dolor torácico asociado a una reacción alérgica al diclofenaco.
• Diclofenaco puede inhibir transitoriamente la agregación trombocitaria. Por lo tanto, los pacientes con trastornos de coagulación deberán ser monitoreados cuidadosamente.
• Como otros AINE, diclofenaco puede ocultar los síntomas de una infección debido a sus propiedades farmacodinámicas. Si durante la administración de TRADOL®-DUO recurren o se deterioran los signos de una infección, se debe pedir al paciente que consulte inmediatamente a un médico quien deberá verificar si está indicado el tratamiento antiinfeccioso/antibiótico.
• La administración de analgésicos a largo plazo puede provocar dolor de cabeza que no debe ser tratado incrementando la dosis del medicamento.
• En general, la toma habitual de analgésicos, en particular combinados con diferentes sustancias analgésicas, puede llevar a un daño renal permanente con el riesgo de insuficiencia renal (nefropatía analgésica).
• El uso concomitante de TRADOL®-DUO y alcohol puede intensificar los efectos secundarios relacionados con la sustancia, particularmente los que afecten al tracto gastrointestinal o al sistema nervioso central.
Trastornos respiratorios relacionados con el sueño: Los opioides pueden causar trastornos respiratorios relacionados con el sueño, como la apnea central del sueño (ACS) y la hipoxemia relacionada con el sueño. El uso de opioides aumenta el riesgo de ACS en función de la dosis. En pacientes que presenten ACS, se debe considerar disminuir la dosis total de opioides.
Precauciones: Para prevenir una sobredosis, no coadministrar otros medicamentos que contengan diclofenaco o tramadol. En adultos y gente joven mayor de 18 años, la dosis total de diclofenaco no debe exceder 150 mg/día, lo que con la combinación de dosis fija resulta en una dosis diaria máxima de tramadol de 150 mg/día.
• TRADOL®-DUO sólo podrá usarse con precauciones especiales en pacientes dependientes de opioides, pacientes con traumatismo craneoencefálico, shock, un nivel reducido de consciencia de origen desconocido, trastornos del centro o función respiratoria, aumento de la presión intracraneal.
• En pacientes sensibles a los opiáceos, TRADOL®-DUO sólo deberá usarse con precaución.
• Los efectos secundarios pueden disminuir administrando la dosis efectiva más baja durante el periodo más corto necesario para el manejo de los síntomas (véase Dosis y vía de administración y riesgos gastrointestinales y cardiovasculares abajo).
Uso en pacientes de edad avanzada:
• En pacientes de edad avanzada, la incidencia de eventos adversos durante el tratamiento con AINE (como diclofenaco sódico presente en TRADOL®-DUO es mayor, en particular hemorragia y perforación gastrointestinal, en algunos casos con resultados fatales (véase Dosis y vía de administración).
En pacientes con enfermedad gastrointestinal:
• En pacientes con antecedentes de enfermedad gastrointestinal (colitis ulcerosa, enfermedad de Crohn), los AINE sólo deberán ser utilizados con precaución, ya que la condición del paciente puede deteriorarse (véase Reacciones secundarias y adversas).
Riesgos cardiovasculares o cerebrovasculares:
• Se requiere el monitoreo y asesoramiento apropiados para pacientes con un historial de hipertensión y/o insuficiencia cardiaca congestiva leve a moderada, ya que se ha reportado retención de fluidos y edema en asociación con la terapia con AINE incluyendo diclofenaco.
• Estudios clínicos y datos epidemiológicos sugieren que el uso de diclofenaco, en particular en dosis elevadas (150 mg diarios) y en tratamiento de largo plazo puede estar asociado con un riesgo ligeramente elevado de eventos trombóticos arteriales (por ejemplo, infarto al miocardio o accidente cerebrovascular).
• En consecuencia, pacientes con insuficiencia cardiaca congestiva (clasificación I de NYHA), con factores de riesgo cardiovascular (p. ej. hipertensión, hiperlipidemia, diabetes mellitus, hábito tabáquico), cardiopatía isquémica establecida, enfermedad arterial periférica y/o cerebrovascular sólo deberán ser tratados con diclofenaco después de una cuidadosa consideración. Dado que los riesgos cardiovasculares de diclofenaco pueden incrementarse con la dosis y la duración del tratamiento, se debe utilizar la dosis diaria eficaz más baja y la duración del tratamiento más corta posible. En estos pacientes se recomienda una vigilancia estrecha.
• Los pacientes deben estar atentos ante signos y síntomas de acontecimientos trombóticos arteriales graves (p. ej. dolor de pecho, respiración entrecortada, debilidad, dificultad para hablar), que puede suceder sin previo aviso. En tales casos, los pacientes deben saber que tienen que acudir inmediatamente al médico.
Riesgos en pacientes con insuficiencia hepática:
• La vigilancia médica detallada es imperativa en pacientes que sufran de insuficiencia grave de la función hepática (véase Contraindicaciones). Los AINE, incluido el diclofenaco, pueden producir una elevación de los enzimas hepáticos. Durante el tratamiento prolongado con diclofenaco debería controlarse la función hepática como medida de precaución. Si las pruebas de función hepática muestran anormalidades que persisten o empeoran, si aparecen signos o síntomas clínicos son consistentes con la enfermedad hepática, se desarrollan o si ocurren otras manifestaciones (eosinofilia, sarpullido), TRADOL®-DUO deberá ser descontinuado. Puede ocurrir hepatitis sin síntomas prodrómicos. Se recomienda una vigilancia estrecha a estos pacientes. En pacientes con porfiria, diclofenaco puede desencadenar un episodio agudo.
Efectos renales:
• Debido a que se han comunicado casos de retención de líquidos y edema asociado al tratamiento con AINE, incluido el diclofenaco, se deberá tener especial precaución en los pacientes con función cardiaca o renal alteradas, antecedentes de hipertensión, en personas de edad avanzada, en los pacientes que están siendo tratados concomitantemente con diuréticos o con otros medicamentos que puedan afectar la función renal de forma significativa y en aquellos con depleción sustancial del volumen extracelular por cualquier causa, p. ej. en la fase pre- o postoperatoria de intervenciones quirúrgicas mayores (ver Contraindicaciones). Por lo tanto, como medida cautelar, se recomienda controlar la función renal cuando se administre diclofenaco en tales casos. El cese del tratamiento, suele ir seguido de la recuperación hasta el estado previo al mismo.
TRADOL®-DUO sólo deberá usarse después de una cuidadosa consideración de la relación beneficio/riesgo en pacientes con:
• Trastornos congénitos del metabolismo de las porfirinas (por ejemplo, porfiria aguda intermitente);
• Lupus eritematoso sistémico (LES) y enfermedad mixta del tejido conectivo (véase Reacciones secundarias y adversas);
• Particularmente la supervisión médica cuidadosa es necesaria en disfunción renal; trastornos de la función hepática; con riesgo cardiovascular; inmediatamente después de una cirugía mayor;
• Pacientes que sufren de fiebre del heno, pólipos nasales o enfermedad pulmonar obstructiva crónica, debido a que tienen un alto riesgo de reacciones alérgicas. Éstas pueden ser en la forma de ataques de asma ("asma analgésica"), edema angioneurótico o urticaria;
• También es necesario el cuidado especial en pacientes que son alérgicos a otras sustancias, porque también hay un riesgo elevado de reacciones alérgicas con la administración de TRADOL®-DUO;
• Con la administración a largo plazo de TRADOL®-DUO la función renal y los niveles hematológicos deberán revisarse a intervalos regulares.
Efectos sobre la capacidad para conducir y operar maquinaria: Aun cuando se toma de acuerdo con las instrucciones, TRADOL®-DUO puede ocasionar efectos secundarios en el sistema nervioso central como fatiga, somnolencia y mareos y por lo tanto puede afectar las reacciones de los conductores de vehículos y de operarios de maquinaria. Esto aplica particularmente con dosificaciones elevadas o en conjunto con otras sustancias psicotrópicas, particularmente alcohol.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Oral.
Las tabletas no deberán partirse o masticarse. Se deben ingerir completas con una cantidad suficiente de líquido y sin estar en ayunas. En caso de estómagos sensibles, se recomienda tomar la tableta junto con los alimentos.
La dosis se debe ajustar acorde a la intensidad del dolor y a la sensibilidad de cada paciente. Generalmente, debe seleccionarse la dosis efectiva más baja.
La dosis total de diclofenaco no debe exceder 150 mg/día, resultando en la combinación de dosis fija, en un máximo de tramadol, una dosis diaria de 150 mg/día.
A menos que se prescriba otra cosa, TRADOL®-DUO debe administrarse como:
Adultos y adolescentes mayores de 18 años de edad:
TRADOL®-DUO 25 mg/25 mg, tabletas: Una tableta (25 mg clorhidrato de tramadol, 25 mg diclofenaco sódico) cada ocho horas (corresponde a 75 mg clorhidrato de tramadol, 75 mg diclofenaco sódico diariamente).
TRADOL®-DUO 50 mg/50 mg, tabletas: Una tableta (50 mg clorhidrato de tramadol, 50 mg diclofenaco sódico) cada ocho horas (corresponde a 150 mg clorhidrato de tramadol, 150 mg diclofenaco sódico diariamente).
La combinación de dosis fija de clorhidrato de tramadol y diclofenaco sódico no deberá ser administrada más tiempo del absolutamente necesario bajo ninguna circunstancia.
Niños: No se ha establecido el uso de la combinación de dosis fija de clorhidrato de tramadol y diclofenaco sódico en niños menores de 18 años. Por lo tanto, no se recomienda el tratamiento en esta población.
Pacientes de edad avanzada: Por lo general, no es necesario un ajuste de la dosis en pacientes de hasta 75 años sin insuficiencia hepática o renal clínicamente manifiesta. En pacientes mayores de 75 años, la eliminación de tramadol puede prolongarse. Por lo tanto, si es necesario, el intervalo de dosificación se extenderá de acuerdo con los requisitos del paciente. TRADOL®-DUO debe usarse con especial precaución en pacientes que generalmente son más propensos a reacciones adversas de medicamentos antiinflamatorios no esteroideos.
En particular, se recomienda que se use la dosis efectiva más baja en pacientes ancianos frágiles o en aquellos con un peso corporal bajo y se debe monitorear al paciente por hemorragia GI durante el tratamiento.
Insuficiencia renal e insuficiencia hepática: Para pacientes con disfunción renal y/o hepática leve a moderada, la eliminación del clorhidrato de tramadol puede ser más lenta. En estos pacientes, la prolongación de los intervalos de dosis debe ser considerada con cuidado de acuerdo con los requerimientos del paciente.
Para pacientes con disfunción renal y/o hepática severa, no se recomienda el uso de la combinación de dosis fija de clorhidrato de tramadol y diclofenaco sódico (véase Contraindicaciones).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: TRADOL®-DUO es una combinación fija de principios activos. En caso de sobredosis, los síntomas pueden incluir los signos y síntomas de toxicidad de clorhidrato de tramadol o paracetamol o de los dos principios activos.
Síntomas de sobredosis con clorhidrato de tramadol: En principio, en caso de intoxicación con clorhidrato de tramadol, se esperan síntomas similares a los de otros analgésicos de acción central (opioides). Éstos incluyen en particular, miosis, vómito, colapso cardiovascular, trastornos de la consciencia hasta el coma, convulsiones y depresión respiratoria hasta el paro respiratorio.
Síntomas de sobredosis con diclofenaco: Trastornos del sistema central nervioso, tales como cefalea, mareos, aturdimiento y pérdida de conocimiento (en niños también convulsiones mioclónicas) pueden ocurrir como síntomas de una sobredosis, así como dolor abdominal, náusea y vómito. Asimismo es posible que se presenten hemorragia gastrointestinal y trastornos de la función hepática y renal. Hipotensión, depresión respiratoria y cianosis pueden ocurrir también.
Tratamiento: Se deben observar las normas generales para casos de emergencia consistentes en mantener despejadas las vías respiratorias, mantener la respiración y circulación según el cuadro sintomatológico. En caso de depresión respiratoria se debe utilizar como antídoto la naloxona. En el caso de convulsiones deben administrarse las benzodiacepinas de acción prolongada (por ejemplo, diazepam). No existe ningún antídoto específico para diclofenaco.
En caso de intoxicación, la descontaminación gastrointestinal con carbón activado o mediante lavados gástricos se recomienda sólo dentro de las 2 primeras horas después de la toma. La descontaminación gastrointestinal en un tiempo posterior puede ser útil en caso de intoxicación con cantidades excepcionalmente grandes.
Mediante hemodiálisis o hemofiltración se eliminan cantidades mínimas de tramadol sérico. Por tanto, el tratamiento de la intoxicación aguda causada por TRADOL®-DUO exclusivamente mediante hemodiálisis o hemofiltración no es adecuado para la desintoxicación.
PRESENTACIONES:
Caja con 10, 20 y 30 tabletas de 25 mg de tramadol y 25 mg de diclofenaco.
Caja con 10, 20 y 30 tabletas de 50 mg de tramadol y 50 mg de diclofenaco.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30°C.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance ni a la vista de los niños. No se use durante el embarazo y la lactancia. El empleo de este medicamento puede alterar la capacidad de reacción, por lo que si presenta somnolencia y mareo no maneje vehículos ni opere maquinaria. No se administre a pacientes con antecedentes de crisis convulsivas. No se administre a menores de 18 años.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx y
drugsafety.mx@grunenthal.com
GRÜNENTHAL DE MÉXICO, S.A. de C.V.
Periférico Sur No. 5991, Col. Arenal Tepepan,
C.P. 14610, Tlalpan, Ciudad de México, México.
Reg. Núm. 191M2020 SSA IV