
TERBAC I.M.
CEFTRIAXONA
Solución inyectable
1 Caja, 1 Frasco(s) ámpula, 2 mL, 500 mg
1 Caja, 1 Frasco(s) ámpula, 2 mL, 1 g
1 Caja, 1 Frasco(s) ámpula, 3.5 mL, 500 mg
1 Caja, 1 Frasco(s) ámpula, 3.5 mL, 1 g
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada frasco ámpula contiene:
Ceftriaxona disódica equivalente a 500 mg ó 1 g de Ceftriaxona
La ampolleta con diluyente contiene:
Clorhidrato de lidocaína al 1% 2 mL ó 3.5 mL
TERBAC® I.M. contiene aproximadamente 83 mg (3.6 mEq) de sodio por gramo de ceftriaxona
INDICACIONES TERAPÉUTICAS: Infecciones causadas por patógenos sensibles a TERBAC® IM, p. ej.:
• Sepsis.
• Meningitis.
• Borreliosis de Lyme diseminada (fase precoz y tardía de la enfermedad).
• Infecciones abdominales (peritonitis, infecciones gastrointestinales o de las vías biliares).
• Infecciones de los huesos, las articulaciones, los tejidos blandos, de la piel o de heridas.
• Infecciones en pacientes con disminución de los mecanismos de defensa.
• Infecciones del tracto urinario y renal.
• Infecciones del tracto respiratorio, especialmente neumonía e infecciones de oído, nariz y garganta.
• Infecciones genitales, incluida la gonorrea.
• Cuidado perioperatorio profiláctico de las infecciones.
FARMACOCINÉTICA Y FARMACODINAMIA:
Propiedades farmacodinámicas: La actividad bactericida de ceftriaxona resulta de la inhibición de la síntesis de la pared celular bacterial. La ceftriaxona ejerce actividad in vitro contra una amplia gama de microorganismos gramnegativos y grampositivos. La ceftriaxona es altamente estable a la mayoría de las β-lactamasas, ambas penicilinas y cefalosporinas, de bacterias grampositivas y gramnegativas. La ceftriaxona es usualmente activa contra los siguientes microorganismos in vitro y en infecciones clínicas.
Aerobios Grampositivos: Staphylococcus aureus (sensible a meticilina), estafilococos coagulasa negativos, Streptococcus pyogenes (β-hemolítico, grupo A), Streptococcus agalactiae (β-hemolítico, grupo B), estreptococos β-hemolíticos (ningún grupo A o B), Streptococcus viridans, Streptococcus pneumoniae.
Nota: Los estafilococos resistentes a meticilina son resistentes a las cefalosporinas, incluida la ceftriaxona. Por lo general, Enterococcus faecalis, Enterococcus faecium y Listeria monocytogenes son resistentes.
Aerobio Gramnegativos: Acinetobacter Iwoffi, Acinetobacter anitratus (sobre todo A. baumannii)*, Aeromonas hydrophila, Alcaligenes faecalis, Alcaligenes odorans, Bacterias de tipo Alcaligenes, Borrelia burgdorferi; especies del género Capnocytophaga, Citrobacter diversus (incluido C. amalonaticus), Citrobacter freundii*, Escherichia coli, Enterobacter aerogenes*, Enterobacter cloacae*; otras especies del género Enterobacter*, Haemophilus ducreyi, Haemophilus influenzae, Haemophilus parainfluenzae, Hafnia alvei, Klebsiella oxytoca, Klebsiella pneumoniae**, Moraxella catarrhalis (antiguamente Branhamella catarrhalis), Moraxella osloensis; otras especies del género Moraxella, Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Pasteurella multocida, Plesiomonas shigelloides, Proteus mirabilis, Proteus penneri*, Proteus vulgaris, Pseudomonas fluorescens*; otras especies del género Pseudomonas*, Providencia rettgeri; otras especies del género Providencia, Salmonella typhi; especies no tifoideas del género Salmonella, Serratia marcescens; otras especies del género Serratia; género Shigella; género Vibrio; Yersinia enterocolítica; otras especies del género Yersinia.
Nota: Muchas cepas de los microorganismos mencionados, que son multirresistentes a otros antibióticos p. ej.: aminopenicilinas, ureidopenicilina, cefalosporinas clásicas y aminoglucósidos, son sensibles a ceftriaxona. Treponema pallidum es sensible in vitro y en los experimentos con animales. Las investigaciones clínicas indican que la sífilis primaria y secundaria responde bien al tratamiento con ceftriaxona.
Con unas pocas excepciones, los aislamientos clínicos de P. aeruginosa son resistentes a la ceftriaxona.
Organismos anaeróbicos: Género Bacteroides (especies sensibles a la bilis)*; género Clostridium (excepto C. difficile), Fusobacterium nucleatum; otras especies del género Fusobacterium, Gaffkia anaeróbica (antiguamente Peptococcus), género Peptostreptococcus.
Nota: Muchas cepas de Bacteroides productos de β-Iactamasas (sobre todo B. fragilis) son resistentes. Clostridium difficile es resistente.
La sensibilidad a la ceftriaxona puede determinarse mediante la prueba de difusión en disco o pruebas de dilución en agar o en caldo, con técnicas estandarizadas de determinación de la sensibilidad, como las recomendadas por el National Committee for Clinical Laboratory Standards (NCCLS). El NCCLS ha publicado los siguientes valores límite para la ceftriaxona.
|
Prueba de dilución |
Sensible |
Moderadamente sensible |
Resistente |
|
Concentraciones inhibitorias en mg/L |
= 8 |
16-32 |
= 64 |
|
Prueba de difusión (disco de 30 ug de ceftriaxona) diámetro de la zona de inhibición en mm |
= 21 |
20-14 |
= 13 |
En todos los microorganismos debe ensayarse el disco con ceftriaxona, ya que las pruebas in vitro han demostrado que puede ser activo frente a algunas cepas resistentes a discos con otras cefalosporinas.
En los laboratorios que no utilicen habitualmente las recomendaciones del NCCLS, pueden seguirse otras normas alternativas de valoración de la sensibilidad bien estandarizadas como las publicadas por DIN, ICS y otras pueden sustituirse.
Propiedades Farmacocinéticas: La farmacocinética de ceftriaxona no es lineal y todos los parámetros farmacocinéticos básicos, excepto la vida-media de eliminación, son dosis dependientes si se basan en las concentraciones totales del fármaco.
Absorción: La concentración plasmática máxima tras una única dosis i.m. de 1.0 g es de unos 81 mg/L y se alcanza al cabo de 2-3 horas de administración. Tras la administración i.m., el área bajo la curva de concentración plasmática - tiempo es equivalente al obtenido tras la administración i.v. de una dosis equivalente, lo cual indica una biodisponibilidad del 100% para la ceftriaxona por vía intramuscular.
Distribución: El volumen de distribución de la ceftriaxona es de 7-12 L.
La ceftriaxona ha demostrado una excelente penetración en los tejidos y en los líquidos corporales con dosis de 1-2 g. En más de 60 tejidos o líquidos corporales incluyendo pulmón, corazón, hígado y vías biliares, amígdalas, oído medio y mucosa nasal, huesos, líquido cefalorraquídeo, líquido pleural, secreción prostática y líquido sinovial, se detectan durante más de 24 horas concentraciones muy superiores a las concentraciones mínimas inhibitorias para la mayoría de los gérmenes patógenos responsables de la infección.
Fijación a proteínas: La ceftriaxona se une a la albúmina de forma reversible y disminuye la fijación con el incremento de la concentración, p. ej. pasa de una fijación del 95% con concentraciones plasmáticas < de 100 mg/L a una fijación del 85% con concentraciones de 300 mg/L. Debido a su menor contenido en albúmina, la proporción de ceftriaxona libre es mayor en el líquido intersticial que en el plasma.
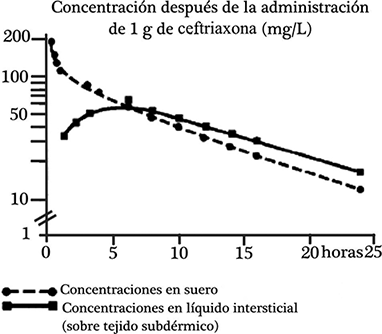
Penetración en tejidos especiales: En los pacientes adultos con meningitis, la administración de 50 mg/kg da lugar, al cabo de 2 a 24 horas, a concentraciones en el LCR varias veces superiores a la concentración mínima inhibitoria para las bacterias que con mayor frecuencia producen meningitis.
La ceftriaxona atraviesa la barrera placentaria y se excreta en la leche materna en pequeñas cantidades.
Metabolismo: La ceftriaxona no se metaboliza sistémicamente; únicamente la flora intestinal transforma este fármaco en metabolitos inactivos.
Eliminación: La depuración plasmática total es de 10-22 mL/min. La depuración renal es de 5-12 mL/min. La ceftriaxona se excreta de forma inalterada, en un 50-60% por la orina, mientras que el 40-50% se excreta sin cambio por la bilis. La vida-media de eliminación es en los adultos de unas 8 horas.
Farmacocinética en poblaciones especiales:
Pacientes con insuficiencia hepática o renal: En los pacientes con insuficiencia hepática o renal, la farmacocinética de la ceftriaxona apenas se altera, y la vida-media de eliminación aumenta muy poco. Si solamente está afectada la función renal, la eliminación biliar de la ceftriaxona aumenta; si solamente está afectada la función hepática, la eliminación renal aumenta.
Ancianos: En ancianos de más de 75 años de vida-media promedio de eliminación suele ser unas dos veces mayor que en los adultos jóvenes.
Niños: En los recién nacidos se recoge en la orina aproximadamente un 70% de la dosis. En los lactantes menores de 8 días el promedio de vida-media de eliminación suele ser de 2 a 3 veces mayor que en los adultos jóvenes.
* Algunas cepas de estas especies son resistentes a ceftriaxona, debido fundamentalmente a la producción de una β-Iactamasa codificada cromosómicamente.
** Algunas cepas de estas especies son resistentes a la ceftriaxona, debido a la producción de una β-Iactamasa de amplio espectro mediada por plásmidos.
* Algunas cepas de estas especies son resistentes a la ceftriaxona, debido a la producción de β-lactamasa.
CONTRAINDICACIONES: TERBAC® IM está contraindicado en pacientes con antecedentes de hipersensibilidad a los antibióticos cefalosporínicos. Conviene tener presente la posibilidad de reacciones alérgicas cruzadas en pacientes alérgicos a la penicilina.
Recién nacidos hiperbilirrubianémicos y prematuros no deben tratarse con ceftriaxona. Estudios in vitro han demostrado que la ceftriaxona puede desplazar la bilirrubina de su sitio de unión a la albúmina sérica y posiblemente puede desarrollar encefalopatía por bilirrubina en estos pacientes.
TERBAC® IM no debe ser administrado en recién nacidos con soluciones que contienen calcio por el riesgo de precipitación de la sal ceftriaxona-calcio. En recién nacidos se han descrito casos de reacciones fatales con precipitaciones de calcio-ceftriaxona en pulmón y riñón. En algunos casos por diferentes líneas de infusión y tiempos de administración de la ceftriaxona y soluciones que contienen calcio. Por lo tanto, en recién nacidos TERBAC® IM y soluciones I.V. que contienen calcio no deben ser administradas dentro de las 48 horas entre una y otra.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA: Durante el embarazo, se recomienda administrar TERBAC® IM sólo en casos en que sea absolutamente necesario (particularmente durante el 1er. Trimestre).
La ceftriaxona atraviesa la barrera placentaria. Todavía no se ha determinado la inocuidad de la ceftriaxona en las mujeres embarazadas. En los estudios reproductivos realizados en animales no se han apreciado datos de embriotoxicidad, fetotoxicidad, teratogenicidad o reacciones adversas sobre la fertilidad (masculina o femenina) o el desarrollo peri- y postnatal. En los primates tampoco se ha observado embriotoxicidad o teratogenicidad.
La ceftriaxona se elimina en la leche materna en pequeñas concentraciones. Se aconseja extremar las precauciones, cuando TERBAC® IM se administre a las madres lactantes.
REACCIONES SECUNDARIAS Y ADVERSAS: Con TERBAC® IM se han observado los siguientes efectos secundarios, que fueron reversibles de forma espontánea o tras retirar el fármaco:
Efectos secundarios generales: Molestias digestivas (aprox. 2% de los casos): heces sueltas o diarrea, náuseas, vómitos, estomatitis y glositis.
Alteraciones hematológicas (aprox. 2%): Eosinofilia, leucopenia, granulocitopenia, anemia hemolítica, trombocitopenia. Se han descrito casos aislados de agranulocitosis (< 500/mm3), la mayoría de ellos tras 10 días de tratamiento y la administración de dosis totales de 20 g o superiores.
Reacciones cutáneas (aprox. 1%): Exantema, dermatitis alérgica, prurito, urticaria, edema. Han sido reportados casos aislados de reacciones adversas cutáneas severas (eritema multiforme, Síndrome Stevens-Johnson o síndrome Lyell´s/necrólisis tóxica epidermal).
Otros efectos secundarios raros: Cefalea y vértigo, precipitación sintomática de ceftriaxona en la vesícula biliar, aumento de las enzimas hepáticas, oliguria, aumento de la creatinina sérica, micosis genitales, fiebre, escalofríos y reacciones anafilácticas o anafilactoides.
La ceftriaxona no debe mezclarse o administrarse simultáneamente con soluciones o productos que contengan calcio, aun por diferentes líneas de infusión.
Se han descrito casos de reacciones fatales con precipitaciones de calcio y ceftriaxona en pulmón y riñón en recién nacidos. En algunos casos las líneas de infusión y tiempos de administración de ceftriaxona y soluciones con calcio fueron diferentes.
La enterocolitis pseudomembranosa y trastornos de la coagulación han sido reportados como efectos secundarios y muy raros.
Se han reportado algunos casos aislados de precipitación renal, la mayoría en niños de más de 3 años que habían recibido tratamiento con dosis elevadas (p. ej.: dosis diaria > 80 mg/kg) o dosis total > 10 g y presentan otros factores de riesgo (p. ej.: restricción de líquidos, encamamiento, etc.). Este efecto secundario, sintomático o no, puede provocar insuficiencia renal, reversible tras la suspensión del tratamiento con TERBAC® IM.
Efectos secundarios locales: La inyección intramuscular sin solución de lidocaína es dolorosa.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: Estudios reproductivos en animales no han demostrado evidencia de embriotoxicidad, fototoxicidad, teratogenicidad o efectos adversos en fertilidad en machos o hembras, nacimiento o desarrollo perinatal y postnatal. En primates, no se ha observado embriotoxicidad o teratogenicidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Hasta la fecha no se ha descrito empeoramiento de la función renal tras la administración simultánea de dosis elevadas de TERBAC® IM y diuréticos potentes (p. ej.: furosemida) Tampoco hay datos de que TERBAC® IM potencie la toxicidad renal de los aminoglucósidos. No se ha descrito ningún efecto parecido al del disulfiram con la ingestión de alcohol tras la administración de TERBAC® IM. La ceftriaxona carece de un grupo N-metiltiotetrazólico, que se ha asociado con una posible intolerancia al etanol y los problemas de sangrado de algunas cefalosporinas. La probenecida no altera la eliminación de TERBAC® IM.
En un estudio in vitro se han observado efectos antagónicos con la asociación de cloranfenicol y ceftriaxona.
TERBAC® IM no debe agregarse a soluciones que contienen calcio con la solución de Hartmann y Ringer.
Basado en los reportes de la literatura, la ceftriaxona es incompatible con amsacrina, vancomicina, fluconazol y aminoglucósidos.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: En algunos casos aislados de pacientes tratados con ceftriaxona, se han obtenido falsos positivos en la prueba de Coombs.
TERBAC® IM, como cualquier antibiótico, puede dar lugar a falsos positivos en las pruebas de galactosemia.
De forma parecida, los métodos no enzimáticos para la determinación de glucosa en orina pueden proporcionar falsos positivos. Por este motivo, la determinación de la glucosuria debe realizarse por métodos enzimáticos durante el tratamiento con TERBAC® IM.
PRECAUCIONES GENERALES: Al igual que sucede con otras cefalosporinas, nunca puede descartarse la posibilidad de un choque anafiláctico, incluso si se tienen cuidados con el paciente.
Se han descrito casos de colitis pseudomembranosa con casi todos los fármacos antibacterianos, incluida la ceftriaxona. Por lo tanto, es importante plantearse la posibilidad de este diagnóstico en pacientes con diarrea tras la administración de un antibiótico.
Pueden producirse sobreinfecciones por microorganismos resistentes, como en cualquier otro antibiótico.
En ecografías de la vesícula biliar se han detectado sombras malinterpretadas como cálculos biliares, por lo general tras la administración de dosis superiores a la recomendada habitualmente. Estas sombras son, sin embargo, precipitados de ceftriaxona cálcica, que desaparecen una vez concluida la terapia con TERBAC® IM. Rara vez se han asociado estos hallazgos con síntomas. No obstante, si los síntomas persisten, se recomienda un tratamiento conservador no quirúrgico. El médico deberá considerar individualmente la conveniencia de suspender el tratamiento con TERBAC® IM en los casos sintomáticos.
Además de algunos recién nacidos, en la información científica disponible, no hay reportes de precipitación intravascular en otros pacientes tratados con ceftriaxona y soluciones que contienen calcio o cualquier otro producto que contenga calcio. Sin embargo, la ceftriaxona no debe mezclarse o administrarse simultáneamente con soluciones que contienen calcio a ningún paciente, aunque sea por diferente línea de infusión.
En raras ocasiones se han descrito casos de pancreatitis, en pacientes tratados con TERBAC® IM debido a obstrucción biliar. La mayoría de ellos presentaban factores de riesgo de estasis biliar y "Iodo" biliar, por ejemplo, antecedente de tratamiento mayor, enfermedad grave y nutrición parenteral total. No cabe excluir la posibilidad de que TERBAC® IM haya actuado de factor desencadenante o al menos de cofactor para precipitar enfermedad biliar.
En los recién nacidos, los lactantes y los niños se han comprobado la inocuidad y la eficacia de TERBAC® IM para las dosis descritas en el apartado de Dosis y vía de administración. Se ha demostrado en diversos estudios que la ceftriaxona, como el resto de las cefalosporinas, puede desplazar la bilirrubina de su unión a la albúmina sérica.
TERBAC® IM no debe administrarse a recién nacidos (especialmente prematuros) con riesgo de encefalopatía bilirrubínica.
En tratamientos prolongados es conveniente controlar el perfil sanguíneo de forma periódica.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Intramuscular.
Dosis estándar:
Adultos y niños mayores de 12 años: La dosis usual es de 1-2 g de TERBAC® IM una vez al día (cada 24 horas). En casos severos o en infecciones causadas por organismos moderadamente sensibles, la dosis puede aumentar a 4 g una vez al día.
Duración de la terapia: La duración de la terapia varía de acuerdo con el curso de la enfermedad. Como en general es con la terapia es con antibióticos, la administración de TERBAC® IM se debe continuar mínimo por 48-72 horas después de que el paciente esté sin fiebre o que se haya obtenido evidencia de la erradicación bacterial.
Terapia combinada: Se ha demostrado sinergia entre TERBAC® IM y los aminoglicósidos con muchas Bacterias gramnegativas bajo condiciones experimentales. Aunque la actividad importante de este tipo de combinaciones no es siempre fiable, se deben considerar infecciones peligrosas para la vida debido a microorganismos como las Pseudomonas aeruginosa. Debido a la incompatibilidad física, ambos fármacos deben ser administrados separadamente a las dosis recomendadas.
Método de administración: Como regla general, las soluciones deben ser usadas inmediatamente después de la preparación. El rango de color de las soluciones de amarillo claro a ámbar depende de la concentración y longitud de almacenamiento. La coloración de las soluciones no es significativa para la eficacia o tolerancia del fármaco.
Inyección intramuscular: Para la inyección IM TERBAC® IM 500 mg se disuelve en 2 mL y TERBAC® IM 1 g en 3.5 mL de solución de clorhidrato de lidocaína al 1% e inyectar con profundidad en un músculo relativamente grande. Se recomienda no inyectar más de 1 g en un solo sitio.
La solución de lidocaína nunca debe administrarse intravenosamente.
Instrucciones para dosis especiales:
Pacientes con daño hepático: En pacientes con hígado dañado, no es necesario reducir la dosis, dando por hecho que la función renal está intacta.
Pacientes con daño renal: En pacientes con función renal dañada, no es necesario reducir la dosis de TERBAC® IM, dando por hecho que la función hepática está intacta. Solamente en casos de daño renal preterminal (depuración de creatinina < 10 mL/min) la dosis de TERBAC® IM no debe exceder de 2 g por día.
En pacientes con ambas disfunciones severas, renal y hepática, la concentración plasmática de ceftriaxona debe ser determinada en intervalos regulares y ajustar la dosis, si es necesario.
En pacientes que estén bajo diálisis no requieren dosis suplementaria adicional después de ésta. Las concentraciones plasmáticas deben, sin embargo, ser monitoreadas, para determinar si los ajustes de dosis son necesarios, desde la tasa de eliminación en pacientes posiblemente alterados.
Ancianos: La dosis recomendada en adultos no requiere ser modificada en pacientes ancianos.
Niños:
Recién nacidos, lactantes y niños mayores de 12 años: Los siguientes esquemas de dosificación son recomendables para una administración de una vez al día:
Recién nacidos más de (14 días): 20-50 mg/kg una vez al día. La dosis diaria no debe exceder de 50 mg/kg. No es necesario diferenciar entre lactantes prematuros y de término.
Lactantes y niños: 20-80 mg/kg una vez al día.
Para niños de 50 kg o más, se debe administrar la dosis usual para adulto.
Dosis intravenosa de ≥ 50 mg/kg deben administrarse por infusión durante al menos 30 minutos.
Meningitis: En lactantes y niños con meningitis, el tratamiento comienza con dosis de 100 mg/kg (máximo 4 g) una vez al día. Tan pronto como el organismo causante ha sido identificado y determinado su sensibilidad, por consiguiente, la dosis puede reducirse.
La siguiente duración de tratamiento ha demostrado ser efectiva:
Neisseria meningitidis: 4 días.
Haemophilus influenzae: 6 días.
Streptococcus pneumoniae: 7 días.
Borreliosis de Lyme: En niños y adultos de 50 mg/kg, máximo 2 g una vez al día durante 14 días.
Gonorrea: (cepas productoras de penicilinasa y no penicilinasa). Una dosis i.m.: simple de 250 mg.
Profilaxis perioperativa: Una dosis simple de 1-2 g dependiendo del riesgo de la infección, de 30-90 minutos antes de la cirugía.
En cirugía colorrectal, ha sido probada la efectividad de la administración de TERBAC® IM con o sin 5-nitromidazol, p. ej. omidazol (administración separada).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: En caso de intoxicación, la concentración del fármaco no puede reducirse por hemodiálisis ni diálisis peritoneal. No se dispone de antídoto específico. El tratamiento de la sobredosificación debe ser sintomático.
PRESENTACIONES:
Caja de cartón con frasco ámpula etiquetado con 500 mg de polvo, ampolleta con 2 mL o 3.5 mL de diluyente respectivamente (Reg. No. 067M88 SSA, Fabricado por Laboratorios Pisa, S.A. de C.V.) e instructivo impreso en caja, con y sin jeringa de plástico (Reg. No.: 72043 SSA), aguja hipodérmica (Reg. No.: 02036C99 SSA) y antiséptico en almohadilla (Reg. No.: 74982 SSA).
Caja de cartón con frasco ámpula etiquetado con 1 g de polvo, ampolleta con 2 mL o 3.5 mL de diluyente respectivamente (Reg. No. 067M88 SSA, Fabricado por Laboratorios Pisa, S.A. de C.V.) e instructivo impreso en caja, con y sin jeringa de plástico (Reg. No.: 72043 SSA), aguja hipodérmica (Reg. No.: 02036C99 SSA) y antiséptico en almohadilla (Reg. No.: 74982 SSA).
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a no más de 30ºC.
Consérves la caja bien cerrada.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. No se deje al alcance de los niños. Su venta requiere receta médica. Su uso durante el embarazo y lactancia queda bajo responsabilidad del médico. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos, o si el cierre ha sido violado. Hecha la mezcla adminístrese de inmediato y deséchese el sobrante. Antibiótico. El uso incorrecto de este producto puede causar resistencia bacteriana.
Reporte las sospechas de reacción adversas al correo: farmacovigilancia@cofepris.gob.mx
En caso de una reacción adversa o dudas comunicarse al 5340.19.56/01800.706.2738 o al correo
farmacovigilancia@gruposomar.com
Hecho en México por:
Laboratorios PiSA, S.A. de C.V.
Calle 6 No. 2676, Zona Industrial
C.P. 44940, Guadalajara, Jalisco, México.
Distribuido por:
LAKESIDE SALUD HUMANA, S.A. de C.V.
Calle Olivo No. 27, Nave 6B-11,
Parque Prologis Álamos
Col. Recursos Hidráulicos,
C.P. 54913, Tultitlán, México, México.
Para:
Serral, S. A. de C.V.
Camino Real a Cocotitlan sin Esq. con
Constitución 5 Feb., Zona Industrial Chalco,
C.P. 56600, Chalco, México, México.
Reg. Núm. 344M95, SSA IV
®Marca Registrada