SOLIQUA
INSULINA GLARGINA, LIXISENATIDA
Solución inyectable
1 Caja, 1 Pluma precargada, 3 mL, 50 µg/ml
1 Caja, 3 Pluma precargada, 3 mL, 50 µg/ml
1 Caja, 5 Pluma precargada, 3 mL, 50 µg/ml
1 Caja, 1 Pluma precargada, 3 mL, 33 µg/ml
1 Caja, 3 Pluma precargada, 3 mL, 33 µg/ml
1 Caja, 5 Pluma precargada, 3 mL, 33 µg/ml
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada mL contiene:
Insulina glarginaª 100 U equivalente a 3.64 mg
Lixisenatida 50 μg
Vehículo cs 1 mL
ªAnálogo de insulina humana de origen ADN recombinante expresado en Escherichia coli.
Una unidad de SOLIQUA® contiene 1 U de insulina glargina y 0.5 μg de lixisenatida
Cada mL contiene:
Insulina glarginaa 100 U equivalente a 3.64 mg
Lixisenatida 33 μg
Vehículo cs 1 mL
ªAnálogo de insulina humana de origen ADN recombinante expresado en Escherichia coli.
Una unidad de SOLIQUA® contiene 1 U de insulina glargina y 0.33 μg de lixisenatida.
INDICACIONES TERAPÉUTICAS: SOLIQUA® está indicado para el tratamiento de adultos con diabetes mellitus tipo 2 para mejorar el control glucémico cuando éste no ha sido proporcionado por los siguientes tratamientos:
• Medicamento(s) hipoglucemiante(s) oral(es), ya sea(n) solo(s) (LixiLan O) o combinados con insulina basal (LixiLan L).
• O combinado(s) con un agonista del receptor del péptido-1 similar al glucagón (GLP-1) (Lixilan G).
• O con insulina basal sola (subgrupo de LixiLan L).
FARMACOCINÉTICA Y FARMACODINAMIA:
Farmacodinamia:
Mecanismo de acción: SOLIQUA® combina dos sustancias activas con mecanismos de acción complementarios para mejorar el control glucémico: la insulina glargina, un análogo basal de insulina (dirigido principalmente a la glucosa en ayunas) y lixisenatida, un agonista del receptor GLP-1 (dirigido principalmente a la glucosa postprandial).
Insulina glargina: La actividad primaria de la insulina, incluida la insulina glargina, es la regulación del metabolismo de la glucosa. La insulina y sus análogos reducen los niveles de glucosa en sangre estimulando la captación de glucosa periférica, especialmente por el sistema musculoesquelético y la grasa, e inhibiendo la producción de glucosa hepática. La insulina inhibe la lipólisis y la proteólisis, y aumenta la síntesis de proteínas.
Lixisenatida: Lixisenatida es un agonista del receptor del péptido similar al glucagón (GLP-1). El receptor de GLP-1 es el blanco para el GLP-1 nativo, una hormona incretina endógena que potencia la secreción de insulina dependiente de glucosa de las células beta y suprime el glucagón de las células alfa en el páncreas.
Similar al GLP-1 endógeno, la acción del lixisenatida es mediada por una interacción específica con los receptores GLP-1, incluidos los de las células alfa y beta pancreáticas. Después de una comida, la lixisenatida activa las siguientes respuestas fisiológicas individuales:
• Mejora la secreción de insulina por las células β.
• Ralentiza el vaciado gástrico.
• Suprime la secreción de glucagón por las células α.
La lixisenatida estimula la secreción de insulina cuando aumenta la glucosa en la sangre, pero no en la normoglucemia, lo que limita el riesgo de hipoglucemia. En paralelo, se suprime la secreción de glucagón. En caso de hipoglucemia, el mecanismo de rescate de la secreción de glucagón se conserva. Una inyección posprandial de lixisenatida también retrasa el vaciado gástrico, reduciendo así la velocidad a la que se absorbe la glucosa derivada de la comida y aparece en la circulación. Se ha demostrado que la lixisenatida preserva la función de las células beta y previene la muerte celular (apoptosis) en células aisladas de islotes pancreáticos humanos.
Propiedades farmacodinámicas: SOLIQUA® La combinación de insulina glargina y lixisenatida no tiene impacto en la farmacodinamia de insulina glargina. El impacto de la combinación de insulina glargina y lixisenatida en la farmacodinamia de la lixisenatida no se ha estudiado en los estudios de fase 1.
Consistente con una concentración relativamente constante y con el perfil de tiempo de la insulina glargina durante 24 horas sin pico pronunciado cuando se administra sola, la tasa de utilización de glucosa y el perfil de tiempo fueron similares, cuando se administra en la combinación insulina glargina/lixisenatida.
El curso de tiempo de la acción de insulinas, incluido SOLIQUA®, puede variar entre individuos y dentro del mismo individuo.
Insulina glargina: En los estudios clínicos con insulina glargina (100 U/mL) el efecto hipoglucemiante en una base molar (es decir, cuando se administra a las mismas dosis) de insulina glargina intravenosa es aproximadamente el mismo que para la insulina humana.
Lixisenatida: En un estudio controlado con placebo de 28 días en pacientes con diabetes tipo 2 con lixisenatida 5 a 10 μg dieron lugar a una disminución estadísticamente significativa de la glucosa posprandial después del desayuno, el almuerzo y la cena.
Retraso en el vaciado gástrico: Después de una prueba de comida estandarizada y marcada, en el estudio mencionado anteriormente, se confirmó que la lixisenatida retrasa el vaciado gástrico, reduciendo de este modo la velocidad de absorción posprandial de glucosa. El efecto del retraso en el vaciado gástrico se mantuvo al final del estudio.
Farmacocinética: La relación insulina glargina/lixisenatida no tiene ningún impacto relevante sobre la farmacocinética de la insulina glargina y de la lixisenatida en SOLIQUA®.
Absorción: Después de la administración subcutánea de las combinaciones de insulina glargina/lixisenatida a pacientes con diabetes tipo 1, la insulina glargina no mostró un pico pronunciado. La exposición a insulina glargina después de la administración de la combinación de insulina glargina/lixisenatida fue de 86%-88% en comparación con la administración de inyecciones simultáneas separadas de insulina glargina y lixisenatida. Esta diferencia no se considera clínicamente relevante.
Después de la administración subcutánea de las combinaciones de insulina glargina/lixisenatida a pacientes con diabetes tipo 1, la mediana de la tmáx de la lixisenatida fue en el rango de 2.5 a 3.0 horas. ABC fue comparable mientras hubo una pequeña disminución en la Cmáx de lixisenatida del 22% a 34% en comparación con la administración simultánea por separado de insulina glargina y lixisenatida, que probablemente no sea clínicamente significativa.
No hay diferencias clínicas relevantes en la tasa de absorción cuando lixisenatida como monoterapia se administra por vía subcutánea en el abdomen, deltoide o muslo.
Distribución: La lixisenatida tiene un nivel bajo (55%) de unión a proteínas humanas. El volumen aparente de distribución de la lixisenatida después de la administración subcutánea de las combinaciones de insulina glargina/lixisenatida (Vz/F) es de aproximadamente 100 L. El volumen aparente de distribución de la insulina glargina después de la administración subcutánea de las combinaciones de insulina glargina/lixisenatida (Vss/F) es aproximadamente 1 700 L.
Metabolismo: Un estudio del metabolismo en pacientes diabéticos que recibieron insulina glargina sola indica que la insulina glargina se metaboliza rápidamente en la parte del carboxilo-terminal de la cadena B a dos formas activas de metabolitos M1 (21A-Gli-insulina) y M2 (21A-Gli-des-30B-Thr-insulina). En el plasma, el principal compuesto circulante es el metabolito M1. Los hallazgos farmacocinéticos y farmacodinámicos indican que el efecto de la inyección subcutánea con insulina glargina se basa principalmente en la exposición a M1.
Eliminación: Como un péptido, la lixisenatida se elimina a través de la filtración glomerular, seguida por la reabsorción tubular y posterior degradación metabólica, que resulta en péptidos más pequeños y aminoácidos, que se vuelven a introducir en el metabolismo de las proteínas. Después de la administración de dosis múltiples en pacientes con diabetes tipo 2, la media vida terminal fue de aproximadamente 3 horas y el aclaramiento aparente medio (CL/F) de aproximadamente 35 L/h.
Poblaciones especiales:
Insuficiencia renal: En los sujetos con leve (aclaramiento de creatinina 60-90 mL/min calculado por la fórmula Cockcroft-Gault), moderada (aclaramiento de creatinina 30-60 mL/min) e insuficiencia renal severa (aclaramiento de creatinina 15-30 mL/min) el ABC de lixisenatida se incrementó en un 46%, 51% y 87% respectivamente.
La insulina glargina no se ha estudiado en pacientes con insuficiencia renal. Sin embargo, en pacientes con insuficiencia renal, los requerimientos de insulina pueden disminuir debido a la reducción del metabolismo de la insulina.
Daño hepático: Como la lixisenatida se depura principalmente mediante el riñón, no se han realizado estudios de farmacocinética en pacientes con daño hepático agudo o crónico. No se espera que la disfunción hepática afecte la farmacocinética de lixisenatida.
La insulina glargina no se ha estudiado en pacientes diabéticos con insuficiencia hepática. En pacientes con insuficiencia hepática, los requerimientos de insulina pueden disminuir debido a la reducción de la capacidad de gluconeogénesis y la reducción del metabolismo de la insulina.
Edad, etnia, género o peso corporal:
Insulina glargina: El efecto de la edad, etnia y género en la farmacocinética de insulina glargina no se ha evaluado. En los ensayos clínicos controlados en adultos con insulina glargina (100 U/mL), los análisis de subgrupo con base en la edad, etnia, y género no afectaron las diferencias en la seguridad y eficacia.
Lixisenatida: La edad no tiene ningún efecto clínicamente relevante en la farmacocinética de la lixisenatida. En un estudio farmacocinético en sujetos no diabéticos de edad avanzada, la administración de lixisenatida 20 μg resultó en un aumento medio del ABC de la lixisenatida en un 29% en la población de edad avanzada (11 sujetos de 65 a 74 años y 7 sujetos ≥75 años) en comparación con 18 sujetos de 18 a 45 años, probablemente relacionados con la reducción de la función renal en el grupo de mayor edad.
El origen étnico no tuvo ningún efecto clínicamente relevante en la farmacocinética de la lixisenatida basándose en los resultados de estudios farmacocinéticos en sujetos caucásicos, japoneses y chinos.
El género no tiene ningún efecto clínicamente relevante en la farmacocinética de la lixisenatida.
El peso corporal no tiene efecto clínicamente relevante sobre el ABC de lixisenatida.
lnmunogenicidad: En presencia de anticuerpos anti-lixisenatida, la exposición a lixisenatida y la variabilidad en la exposición aumentan notablemente independientemente del nivel de dosis.
Población pediátrica: No se han realizado estudios con SOLIQUA® en niños y adolescentes menores de 18 años.
Estudios clínicos:
Eficacia clínica y seguridad: La seguridad y la eficacia de SOLIQUA® en el control glucémico se evaluaron en tres estudios clínicos aleatorizados en pacientes con diabetes mellitus tipo 2:
• Adición a medicamentos hipoglucemiantes orales (sin tratamiento previo con insulina).
• Cambio de insulina basal.
• Cambio de agonista del receptor GLP-1.
En cada uno de los ensayos controlados-activos, el tratamiento con SOLIQUA® produjo mejoras clínicas y estadísticamente significativas en la hemoglobina A1c (HbA1c).
La obtención de niveles más bajos de HbA1c y el logro de una reducción mayor en la HbA1c no aumentó las tasas de hipoglucemia con el tratamiento de combinación contra la insulina glargina sola (ver sección Reacciones secundarias y adversas).
En el estudio clínico de adición a metformina el tratamiento se inició en 10 unidades (10 unidades de insulina glargina y 5 μg de lixisenatida). En el cambio del estudio clínico de insulina basal, la dosis inicial fue de 20 unidades (20 unidades de insulina glargina y 10 μg de lixisenatida) o 30 unidades (30 unidades de insulina glargina y 10 μg de lixisenatida; ver sección Dosis y vía de administración), dependiendo de la dosis de insulina anterior. En ambos estudios, la dosis fue titulada una vez a la semana con base en la mediana de los valores de glucosa en plasma.
Adición a metformina [sin tratamiento previo con insulina]:
Estudio clínico en pacientes con diabetes tipo 2 no controlada con tratamiento ADO (Lixilan-0): Un total de 1 170 pacientes con diabetes tipo 2 fueron aleatorizados en un estudio abierto, de 30 semanas, controlado-activo para evaluar la eficacia y seguridad de SOLIQUA® en comparación con los componentes individuales, insulina glargina (100 U/mL) y lixisenatida (20 μg).
Los pacientes con diabetes tipo 2, tratados con metformina sola o metformina y un segundo agente antidiabético oral (ADO) que podía ser una sulfonilurea o una glinida, o un inhibidor del cotransportador de sodio-glucosa tipo 2 (SGLT-2) o un inhibidor de dipeptidil peptidasa 4 (DPP-4), y que no estaban adecuadamente controlados con este tratamiento (rango de HbA1c del 7.5% al 10% para los pacientes previamente tratados con metformina sola y entre el 7% y el 9% para los pacientes previamente tratados con metformina y un segundo tratamiento hipoglucemiante oral) ingresaron a un periodo de adaptación durante 4 semanas. Durante esta fase de adaptación, se optimizó el tratamiento de metformina y se suspendió cualquier otro ADO. Al final del periodo de adaptación, los pacientes que continuaron inadecuadamente controlados (HbA1c entre el 7% y el 10%) fueron aleatorizados a SOLIQUA®, insulina glargina o lixisenatida. De los 1 479 pacientes que iniciaron el periodo de adaptación, 1 170 fueron asignados al azar. Las razones principales para no entrar en la fase aleatoria fueron GPA valor >250.4 mg/dL (13.9 mmol/L) y HbA1c valor <7% o >10% al final del periodo de adaptación (preinclusión).
La población aleatorizada con diabetes tipo 2 tuvo las siguientes características: la edad promedio fue de 58.4 años siendo la mayoría (57.1%) entre 50 a 64 años, y el 50.6% eran hombres. El índice de masa corporal promedio al inicio fue de 31.7 kg/m2 con 63.4% de los pacientes con un IMC ≥30 kg/m2 La duración promedio de la diabetes fue de aproximadamente 9 años. La metformina fue una terapia de base obligatoria y el 58% de los pacientes recibió un segundo ADO, siendo una sulfonilurea en el 54% de los pacientes seleccionados.
En la semana 30, SOLIQUA® proporcionó mejoría estadísticamente significativa en la HbA1c (valor de p<0.0001) en comparación con los componentes individuales. En un análisis previamente especificado de este parámetro de valoración primario, las diferencias observadas fueron consistentes respecto a la HbA1c inicial (<8% o ≥8%) o el uso inicial ADO (metformina sola o metformina más un segundo ADO).
Vea la Tabla 1 y la Figura 1 para los demás parámetros de valoración en el estudio.
Tabla 1 - Resultados a las 30 semanas - estudio clínico de adición a metformina (población de intención de tratamiento modificada [mlTT])
|
SOLIQUA® |
Insulina glargina |
Lixisenatida |
|
|
Número de pacientes (mlTT) |
468 |
466 |
233 |
|
HbA1c (%) |
|||
|
Línea basal (promedio; posterior a la fase de adaptación) |
8.1 |
8.1 |
8.1 |
|
Fin del estudio (promedio) |
6.5 |
6.8 |
7.3 |
|
Cambio LS desde la línea basal (promedio) |
-1.6 |
-1.3 |
-0.9 |
|
Diferencia contra insulina glargina [IC 95%] (valor de p) |
-0.3 [-0.4, 0.2] (<0.0001) |
||
|
Diferencia contra lixisenatida [IC 95%] (valor de p) |
-0.8 [-0.9, -0.7] (<0.0001) |
||
|
Cantidad de pacientes (%) que alcanzó HbA1c <7% en la semana 30 |
345 (74%) |
277 (59%) |
77 (33%) |
|
Glucosa en plasma en ayunas (mg/dL) [mmol/L] |
|||
|
Línea basal (promedio) |
178.0 {9.88} |
175.7 {9.75} |
176.4 {9.79} |
|
Fin del estudio (promedio) |
113.9 {6.32} |
117.6 {6.53} |
148.9 {8.27} |
|
Cambio LS desde la línea basal (promedio) |
-62.4 {-3.46} |
-59.0 {3.27} |
-27.0 {-1.50} |
|
Diferencia LS contra glargina (promedio) [IC 95%] (valor de p) |
-3.5 [-7.6 a 0.7] {-0.19 [-0.420 a 0.038]} (0.1017) |
||
|
Diferencia LS contra lixisenatida (promedio) [IC 95%] (valor de p) |
-35.4 [-40.5 a -30.3] {-1.96 [-2.246 a -1.682]} (<0.0001) |
||
|
GPP de 2 horas (mg/dL) {mmol/L} [Excursión de glucosa de 2 h* (mg/dL) {mmol/L}] |
|||
|
Línea basal (promedio) |
273.7 {15.19} |
263.2 {14.61} |
265.2 {14.72} |
|
Fin del estudio (promedio) |
164.9 {9.15} |
204.5 {11.35} |
180.0 {9.99} |
|
Cambio de LS desde la línea basal |
-102.4 {-5.68} [41.7 {-2.31}] |
-59.6 {-3.31} [3.2 {-0.2}] |
-82.5 {-4.58} [-58.1 {-3.23}] |
|
Diferencia de LS contra glargina (promedio) [IC 95%] |
-42.9 [-50.3 a -35.3] {-2.38 (-2.79 a -1.96)} |
||
|
Diferencia de LS contra lixisenatida (promedio) [IC 95%] |
-19.82 [-29.4 a -10.3] {-1.10 (-1.63 a -0.57)} |
||
|
Peso corporal promedio (kg) |
|||
|
Línea basal (promedio) |
89.4 |
89.8 |
90.8 |
|
Cambio LS desde la línea basal (promedio) |
-0.3 |
1.1 |
-2.3 |
|
Comparación contra insulina glargina [IC 95%] (valor de p) |
-1.4 [-1.9 a -0.9] (<0.0001) |
||
|
Comparación contra lixisenatida [IC 95%] |
2.01 [1.4 a 2.6] |
||
|
Número de pacientes (%) que alcanzaron HbA1c <7.0% sin aumento del peso corporal en la semana 30 |
202 (43.2%) |
117 (25.1%) |
65 (27.9%) |
|
Diferencia en la proporción contra insulina glargina [IC 95%] (valor de p) |
18.1 [12.2 a 24.0] (< 0.0001) |
||
|
Diferencia en la proporción contra lixisenatida [IC 95%] |
15.2 [8.1 a 22.4] |
||
|
Dosis diaria de insulina glargina (U) |
|||
|
Dosis de insulina LS en la semana 30 (promedio) |
39.8 |
40.5 |
NA |
* Glucosa posprandial (GPP) de 2 h menos el valor de la glucosa antes de la comida.
Figura 1 - HbA1c (%) promedio al inicio de la selección, punto de aleatorización en cada punto de tiempo (pacientes que completaron) y en la semana 30 -población de intención de tratamiento modificada (mlTT)
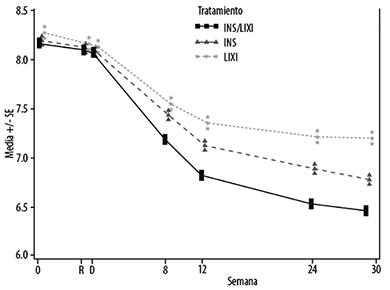
Los pacientes en el grupo de SOLIQUA® reportaron una disminución estadística y significativamente mayor en el promedio del perfil de auto-medición de glucosa plasmática de 7 puntos (SMPG, por sus siglas en inglés) desde el inicio hasta la semana 30 (-60.36 mg/dL {3.35 mmol/L}) en comparación con los pacientes en el grupo de insulina glargina (-47.87 mg/dL {-2.66 mmol/L}); diferencia 12.49 mg/dL {-0.69 mmol/L}) y pacientes en el grupo de lixisenatida (-35.11 mg/dL; diferencia 25.24 mg/dL) {(-1.95 mmol/L; diferencia -1.40 mmol/L)} (p<0.0001 para ambas comparaciones). En todos los puntos de tiempo, los valores promedio de la glucosa en plasma de 30 semanas fueron más bajos en el grupo de SOLIQUA® que en el grupo de insulina glargina como en el grupo de lixisenatida, con la única excepción del valor previo al desayuno que fue similar entre el grupo de SOLIQUA® y el grupo de insulina glargina.
Cambio de insulina basal:
Estudios clínicos en pacientes con diabetes tipo 2 no controlados con insulina basal (Lixilan L): Un total de 736 pacientes con diabetes tipo 2 participaron en un estudio multicéntrico, aleatorizado, de 30 semanas, controlado-activo, abierto, de 2 brazos de tratamiento, de grupo paralelo, para evaluar la eficacia y seguridad de SOLIQUA® en comparación con insulina glargina (100 U/mL).
Los pacientes seleccionados que tenían diabetes tipo 2 estaban tratados con insulina basal durante al menos 6 meses, y recibían una dosis diaria fija entre 15 y 40 unidades sola o combinada con 1 o 2 ADOs (metformina o alguna sulfonilurea o una glinida, o con un inhibidor de SGLT-2 o un inhibidor de DPP-4), tenían una HbA1c entre 7.5% y 10% (promedio de HbA1c de 8.5% en la selección) y una glucosa plasmática de ayuno (GPA) ≤180 mg/dL [10.0 mmol/L] o 200 mg/dL [11.1 mmol/L] dependiendo de su tratamiento hipoglucemiante previo.
Después de la selección, los pacientes seleccionados (n=1 018) ingresaron a la fase de adaptación de 6 semanas en la que los pacientes continuaron con, o fueron cambiados a insulina glargina, en caso de que tomaran otra insulina basal, y se les tituló o estabilizó su dosis de insulina mientras continuaban con metformina (si la tomaban anteriormente). Se suspendió cualquier otro ADOs.
Al final del periodo de adaptación, los pacientes con HbA1c entre el 7% y el 10%, GPA ≤140 mg/dL [7.77 mmol/L] y dosis diaria de insulina glargina de 20 a 50 unidades, fueron aleatorizados a SOLIQUA® (n=367) o a insulina glargina (n=369).
La población aleatorizada con diabetes tipo 2 tuvo las siguientes características: La edad promedio fue de 60 años siendo la mayoría (56.3%) entre 50 a 64 años de edad, y el 53.3% eran mujeres. El índice de masa corporal promedio al inicio fue de 31.1 kg/m2 con 57.3% de los pacientes con un IMC ≥30 kg/m2. La duración promedio de la diabetes fue de aproximadamente 12 años y la duración media del tratamiento basal con insulina previa fue de aproximadamente 3 años. En la selección el 64.4% de los pacientes recibían insulina glargina como insulina basal y 95.0% recibieron al menos 1 ADO concomitante.
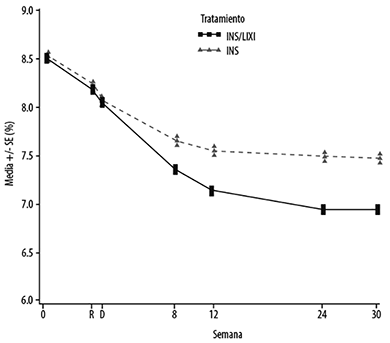
En la semana 30, SOLIQUA® brindó mejoría estadísticamente significativa en la HbA1c (valor de p<0.0001) en comparación con insulina glargina.
Vea la Tabla 2 y la Figura 2 para los demás parámetros de valoración en el estudio.
Tabla 2 - Resultados a las 30 semanas. Estudio de diabetes tipo 2 no controlada con insulina basal en población de mlTT
|
SOLIQUA® |
Insulina glargina |
|
|
Número de pacientes (mlTT) |
366 |
365 |
|
HbA1c (%) |
||
|
Línea basal (promedio; posterior a la fase de adaptación) |
8.1 |
8.1 |
|
Fin del tratamiento (promedio) |
6.9 |
7.5 |
|
Cambio LS desde la línea basal (promedio) |
-1.1 |
-0.6 |
|
Diferencia contra insulina glargina [IC 95%] (valor de p) |
-0.5 [-0.6, -0.4] (<0.0001) |
|
|
Pacientes [n (%)] que alcanzaron HbA1c <7% en la semana 30 |
201 (54.9%) |
108 (29.6%) |
|
Glucosa en plasma en ayunas (mg/dL) {mmol/L} |
||
|
Línea basal (promedio) |
132.0 [7.33] |
132.0 [7.32] |
|
Fin del estudio (promedio) |
122.1 [6.78] |
120.5 [6.69] |
|
Cambio LS desde la línea basal (promedio) |
-6.3 [-0.35] |
-8.3 [-0.46] |
|
Diferencia contra insulina glargina [IC 95%] |
0.11 (-0.21 a 0.43) |
|
|
GPP de 2 horas (mg/dL) {mmol/L} [Excursión de glucosa de 2 h* (mg/dL) {mmol/L}] |
||
|
Línea basal (promedio) |
267.5 [14.85] |
269.7 [14.97] |
|
Fin del estudio (promedio) |
178.5 [9.91] |
241.6 [13.41] |
|
Cambio de LS desde la línea basal (promedio) |
-85.1 {-4.72} |
-25.1 {-1.39} |
|
Diferencia de LS contra glargina (promedio) [IC 95%] |
-60.0 (-70.1 a -49.9) [-3.33 (-3.89 a -2.77)] |
|
|
Peso corporal promedio (kg) |
||
|
Línea basal (promedio)| |
87.8 |
87.1 |
|
Cambio LS desde la línea basal (promedio) |
-0.7 |
0.7 |
|
Comparación contra insulina glargina [IC 95%] (valor de p) |
-1.4 [-1.8 a -0.9] (<0.0001) |
|
|
Número de pacientes (%) que alcanzaron HbA1c <7.0% sin aumento del peso corporal en la semana 30 |
125 (34.2%) |
49 (13.4%) |
|
Diferencia en la proporción contra insulina glargina [IC 95%] (valor de p) |
20.8 [15.0 a 26.7] (< 0.0001) |
|
|
Dosis diaria de insulina glargina |
||
|
Línea basal (promedio) |
35.0 |
35.2 |
|
Punto final (promedio) |
46.7 |
46.7 |
|
Dosis de insulina LS en la semana 30 (promedio) |
10.6 |
10.9 |
* Glucosa posprandial (GPP) de 2 h menos el valor de la glucosa antes de la comida.
Figura 2 - HbA1c (%) promedio al inicio de la selección, en la aleatorización, en cada punto de tiempo (pacientes que completaron) y en la semana 30 - población de mlTT
Estudio clínico en pacientes con diabetes tipo 2 no controlados con agonista del receptor GLP-1: (Lixilan G).
La eficacia y seguridad de SOLIQUA® en comparación con un tratamiento previo con agonistas del receptor GLP-1 se estudiaron en un ensayo aleatorizado, abierto, durante 26 semanas. El estudio incluyó a 514 pacientes con diabetes mellitus tipo 2 controlados inadecuadamente (niveles de HbA1c del 7% al 9%), que fueron tratados al menos durante 4 meses con liraglutida o exenatida o durante 6 meses con dulaglutida, albiglutida o exenatida de liberación prolongada, todas a la dosis máxima tolerada, y metformina sola o en combinación con pioglitazona, un inhibidor de SGLT-2 o ambos. Los pacientes elegibles fueron asignados al azar para recibir SOLIQUA® o continuar con su terapia previa con agonista del receptor GLP-1, además de su tratamiento antidiabético oral anterior.
En la selección, el 59.7% de los sujetos recibió un agonista del receptor GLP-1 una o dos veces al día y el 40.3% recibió un agonista del receptor GLP-1 una vez por semana. Los agonistas del receptor de GLP-1 recibidos más frecuentemente fueron liraglutida (54.5%) y dulaglutida (20.4%). En la selección, 6.6% de los sujetos recibieron pioglitazona y 10.1% de un inhibidor de SGLT-2, ambos en combinación con metformina. La población del estudio tenía las siguientes características: la edad media era de 59.6 años, el 52.5% de los sujetos eran hombres, el 94.4% eran caucásicos, el 3.7% eran negros o afroamericanos, el 1.4% eran asiáticos y el 10.3% eran hispanos. La duración media de la diabetes fue de 11.1 años, la duración media del tratamiento previo con agonista del receptor de GLP-1 fue de 1.9 años, el IMC medio fue de aproximadamente 32.9 kg/m2, la TFGe media fue de 87. 3 mL/min/1.73 m2 y el 90.7% de los pacientes tenían una TFGe ≥ 60 mL/min.
La dosis inicial de SOLIQUA® fue de 10 unidades (10 unidades de insulina glargina/5 μg de lixisenatida). La dosis media al inicio del estudio fue de 1. 7 mg para liraglutida, 18.2 μg para exenatida, 1.4 mg para dulaglutida, 2 mg para exenatida de liberación prolongada y 47.8 mg para albiglutida.
SOLIQUA® se tituló dos veces por semana durante las primeras 8 semanas de tratamiento para alcanzar un objetivo de glucosa en plasma auto medida en ayunas (SMPG) de 80 a 100 mg/dL. Posteriormente, la dosis se ajustó según fuera necesario para mantener este objetivo SMPG en ayunas, con la recomendación de evaluar la dosis al menos una vez por semana. La dosis diaria promedio de SOLIQUA® en la semana 26 fue de 43.5 unidades.
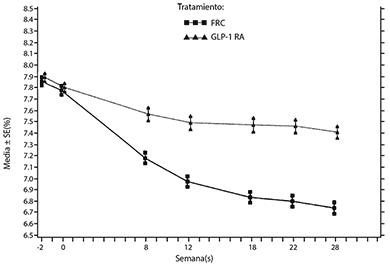
El valor primario de cambio en HbA1c en la semana 26, fue evaluado para determinar la superioridad de SOLIQUA® sobre las terapias con agonista del receptor GLP-1. A la semana 26, hubo una reducción en los valores basales de HbA1c del -1.0% para SOLIQUA® y -0.4% para el agonista del receptor GLP-1. La diferencia media (IC 95%) en la reducción de HbA1c entre SOLIQUA® y los agonistas del receptor GLP-1 fue de -0.6 [-0.80, -0.5] y estadísticamente fue significativa. Un análisis preespecificado por el subtipo de agonistas del receptor GLP-1 (formulación una vez/dos veces al día o semanalmente) utilizado en el cribado mostró que el cambio de HbA1c en la semana 26 fue similar para cada subgrupo y muy consistente con el análisis primario para la población general.
Tabla 3: Resultados a 26 semanas. Estudio de diabetes tipo 2 no controlados en una población mlTT con agonista del receptor GLP-1.
|
SOLIQUA® |
Agonista del receptor GLP-1 |
|
|
Número de sujetos (mlTT) |
252 |
253 |
|
HbA1c (%) |
||
|
Valores basales (media) |
7.8 |
7.8 |
|
Valores finales (media) |
6.7 |
7.4 |
|
Cambio medio (LS) a partir de los valores basales |
-1.0 |
-0.4 |
|
Diferencia contra agonista del receptor GLP-1 [IC 95%] (valor de p) |
-0.6 [-0.8, -0.5] (<0.0001) |
|
|
Pacientes [n (%)] alcanzando HbA1c <7% en la semana 26 |
156 (61.9%) |
65 (25.7%) |
|
Diferencia (IC 95%) contra agonistas del receptor GLP-1 |
36.1 (28.1% a 44.0%) |
|
|
Valor P |
< 0.0001 |
|
|
Glucosa plasmática en ayunas (mg/dL) {mmol/L} |
||
|
Valores basales (media) |
163.2 {9.06} |
170.2 {9.45} |
|
Valores finales (media) |
123.6 {6.86} |
156.1 {8.66} |
|
Cambio medio LS a partir de los valores iniciales |
-41.0 {-2.28} |
-10.9 {-0.60} |
|
Diferencia contra agonista del receptor GLP-1 [IC 95%] (Valor p) |
-1.67 {-2.00 a -1.34} (< 0.0001) |
|
|
Glucosa en plasma auto medida en ayunas (SMPG) promedio de 7 puntos (mmol/L) |
||
|
Valores basales (media) |
9.41 |
9.53 |
|
Valores finales (media) |
7.70 |
8.79 |
|
Cambio medio LS a partir de los valores basales |
-1.69 |
-0.67 |
|
Diferencia contra agonista del receptor GLP-1 [IC 95%] (Valor p) |
-1.02 (-1.325 a -0.708) (< 0.0001) |
|
|
Glucosa posprandial a 2 horas (mg/dL) [Excursión glucosa a 2 h* (mg/dL) {mmol/L}] |
||
|
Cambio medio LS a partir de los valores iniciales a la semana 26 |
-71.3 {-4.0} [-27.2 {-1.5}] |
-20.0 {-1.1} [-9.4 {-0.5}] |
|
Diferencia contra agonista del receptor GLP-1 |
-51.3 {-2.9} [-17.8 {-1.0}] |
|
|
Peso corporal promedio (kg) |
||
|
Valores iniciales (media) |
93.01 |
95.49 |
|
Cambio medio (LS) a partir de los valores basales |
1.9 |
-1.1 |
|
Diferencia contra agonista del receptor GLP-1 [IC 95%] |
3.0 [2.04 a 3.6] |
|
|
Dosis diaria de insulina glargina (U)** |
||
|
Valores basales (media) |
10.1 |
NA |
|
Valores finales (media) |
43.5 |
NA |
* Glucosa posprandial (GPP) de 2 h menos el valor de la glucosa antes de la comida.
** No incluido en el procedimiento de prueba de reducción gradual especificado previamente.
Figura 3: HbA1c media (%) por visita durante el periodo de 26 semanas de tratamiento aleatorizado en la población mITT.
Estudios de desenlaces cardiovasculares: La seguridad cardiovascular de insulina glargina y lixisenatida se ha establecido en los ensayos clínicos ORIGIN y ELIXA, respectivamente. No se ha conducido un ensayo clínico cardiovascular específico con SOLIQUA®.
Insulina glargina: El ensayo de reducción de desenlaces con intervención inicial con glargina (es decir, ORIGIN) fue un estudio abierto, aleatorizado, de 12,537 pacientes que comparó LANTUS® con la atención estándar o tratamiento de referencia al momento de la primera incidencia de algún evento adverso cardiovascular mayor (MACE). MACE se define como el compuesto de muerte CV, infarto del miocardio no fatal y accidente cerebrovascular no fatal. La duración media del seguimiento del estudio fue de 6.2 años. La incidencia de MACE fue similar entre LANTUS® y la atención de referencia en ORIGIN [proporción de riesgo (IC del 95%) para MACE; 1.02 (0.94, 1.11)].
Lixisenatida: El estudio ELIXA fue un estudio aleatorizado, doble ciego, controlado con placebo, multinacional que evaluó los resultados cardiovasculares (CV) durante el tratamiento con lixisenatida en pacientes (n=6068) con diabetes mellitus tipo 2 después de un evento reciente de síndrome coronario agudo. El parámetro de valoración primario combinado de eficacia fue el tiempo hasta la primera incidencia de alguno de los siguientes eventos adjudicados positivamente por el Comité de Adjudicación de Eventos Cardiovasculares: muerte cardiovascular, infarto al miocardio no fatal, accidente cerebrovascular no fatal u hospitalización por angina inestable. La duración media del seguimiento del estudio fue de 25.8 y 25.7 meses en el grupo con lixisenatida y en el grupo placebo, respectivamente.
La incidencia del criterio de valoración primario fue similar en los grupos de lixisenatida (13.4%) y placebo (13.2%): la proporción de riesgo (HR) para lixisenatida contra placebo fue 1.017, con un intervalo de confianza (IC) 95% 0.886 a 1.168.
CONTRAINDICACIONES:
• SOLIQUA® está contraindicado en pacientes con hipersensibilidad conocida a lixisenatida, insulina glargina o a cualquiera de los componentes de la fórmula.
• SOLIQUA® no se deberá utilizar en pacientes con diabetes mellitus tipo 1 o para el tratamiento de cetoacidosis diabética.
• No administrar SOLIQUA® durante el embarazo y la lactancia.
• No administrar SOLIQUA® en menores de 18 años ni en pacientes con pancreatitis aguda.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo: No hay datos clínicos sobre embarazos expuestos de los estudios clínicos controlados con el uso de SOLIQUA®, insulina glargina o lixisenatida.
Una gran cantidad de datos en mujeres embarazadas (más de 1 000 desenlaces de embarazos) con insulina glargina no indican efectos adversos específicos de insulina glargina en el embarazo ni malformaciones específicas, o toxicidad del feto o neonatal con insulina glargina. Los datos en animales no indican toxicidad reproductiva con insulina glargina.
No existen datos adecuados sobre el uso de lixisenatida en mujeres embarazadas. Estudios con lixisenatida en animales han mostrado toxicidad reproductiva (ver sección Precauciones en relación con efectos de carcinogénesis, mutagénesis, teratogénesis y sobre la fertilidad).
SOLIQUA® no debe utilizarse durante el embarazo. Si una paciente desea quedar embarazada, u ocurre un embarazo, el tratamiento con SOLIQUA® debe interrumpirse.
Lactancia: Se desconoce si la insulina glargina o lixisenatida se excretan en la leche humana. Debido a la falta de experiencia, SOLIQUA® no se deberá utilizar durante la lactancia.
Deben administrarse medidas anticonceptivas en pacientes en edad fértil.
REACCIONES SECUNDARIAS Y ADVERSAS:
Resumen del perfil de seguridad: Los 2 estudios clínicos de SOLIQUA® de fase 3 (LixiLan L y O) incluyeron 834 pacientes tratados con SOLIQUA®. Un estudio clínico adicional de fase 3 (LixiLan G) incluyó 255 pacientes tratados con SOLIQUA®.
Las reacciones adversas no deseables reportadas con mayor frecuencia durante el tratamiento con SOLIQUA® fueron hipoglucemia y reacciones adversas gastrointestinales.
Lista tabular de reacciones adversas:
El siguiente índice de frecuencia CIOMS (Consejo de Organizaciones Internacionales de las Ciencias Médicas, siglas en inglés) se utiliza, según corresponda: Muy común ≥ 10%; común ≥ 1 y < 10%; poco común ≥ 0.1 y < 1%; raro ≥ 0.01 y < 0.1%; muy raro < 0.01%; desconocido (su frecuencia no se puede estimar a partir de los datos disponibles).
Tabla 4 - Lista tabulada de reacciones adversas
|
Clasificación por sistemas y órganos |
Frecuencia |
|||
|
Muy común |
Común |
Poco común |
Desconocida |
|
|
Infecciones e infestaciones |
Nasofaringitis Infección de vías respiratorias superiores |
|||
|
Trastornos del sistema inmunológico |
Urticaria |
|||
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia |
|||
|
Trastornos del sistema nervioso |
Mareo |
Cefalea |
||
|
Trastornos gastrointestinales |
Náusea Diarrea Vómito |
Dispepsia Dolor abdominal |
||
|
Trastornos generales y alteraciones en el lugar de administración |
Fatiga Reacciones en el sitio de inyección |
|||
|
Trastornos de la piel y del tejido subcutáneo |
Lipodistrofia* Amiloidosis cutánea* |
|||
* Reacción adversa observada para insulina glargina.
Descripción de las reacciones adversas seleccionadas:
Hipoglucemia: Los ataques graves de hipoglucemia, especialmente si son recurrentes, pueden provocar daño neurológico. Los episodios prolongados o severos de hipoglucemia pueden ser potencialmente mortales.
La siguiente tabla describe la tasa de hipoglucemia sintomática documentada (≤ 70 mg/dL [3.9 mmol/L]) e hipoglucemia severa para ambos SOLIQUA® y el comparador.
Tabla 5 - Reacciones adversas sintomáticas o graves documentadas de hipoglucemia
|
Pacientes sin tratamiento previo con insulina |
Cambio de insulina basal |
Cambio del agonista del receptor GLP-1 |
|||||
|
SOLIQUA® |
Insulina glargina |
Lixisenatida |
SOLIQUA® |
Insulina glargina |
SOLIQUA® |
Agonista del receptor GLP-1 |
|
|
N |
469 |
467 |
233 |
365 |
365 |
255 |
256 |
|
Hipoglucemia sintomática documentada* |
|||||||
|
Pacientes con evento, n (%) |
120 (25.6%) |
110 (23.6%) |
15 (6.4%) |
146 (40.0) |
155 (42.5) |
71 (27.8%) |
6 (2.3%) |
|
Eventos por paciente-año, n |
1.44 |
1.22 |
0.34 |
3.03 |
4.22 |
1.54 |
0.08 |
|
Hipoglucemia grave** |
|||||||
|
Eventos por paciente-año, n |
0 |
< 0.01 |
0 |
0.02 |
< 0.01 |
< 0.01 |
0 |
* La hipoglucemia sintomática documentada fue un evento en el que los síntomas típicos de hipoglucemia estuvieron acompañados de una concentración medida de glucosa en plasmas ≤70 mg/dL (3.9 mmol/L).
** La hipoglucemia sintomática grave fue un evento que requirió de la ayuda de otra persona para administrar de forma activa carbohidratos, glucagón u otras acciones de resucitación.
Trastornos gastrointestinales: Las reacciones gastrointestinales adversas (náusea, vómito y diarrea) fueron reacciones adversas reportadas con frecuencia durante el periodo de tratamiento. Después de 30 semanas de tratamiento con SOLIQUA® en 2 estudios clínicos fase 3 agrupados (LixiLan L y LixiLan O) en pacientes tratados con SOLIQUA®, la incidencia de náusea, diarrea y vómito relacionados fue del 8.4%, 2.2% y 2.2%, respectivamente. Las reacciones gastrointestinales adversas fueron en su mayoría de naturaleza leve y transitoria. Las reacciones adversas gastrointestinales fueron en su mayoría leves y transitorias. En los pacientes tratados con lixisenatida, la incidencia de náuseas, diarrea y vómitos relacionados fue del 22.3, 3 y 3.9%, respectivamente. En un tercer estudio de fase 3 (LixiLan G), después de 26 semanas de tratamiento, en pacientes tratados con SOLIQUA®, la incidencia de náusea, diarrea y vómito fue del 5.5, 0.8 y 1.2% respectivamente.
Trastornos de la piel y del tejido subcutáneo:
Lipodistrofia:* La administración subcutánea de insulinas, incluyendo SOLIQUA®, puede producir lipoatrofia (depresión de la piel) o lipohipertrofia (agrandamiento o engrosamiento del tejido) en el sitio de inyección.
Amiloidosis cutánea:* Se ha producido amiloidosis cutánea localizada en el sitio de inyección con insulinas. Se ha reportado hiperglucemia después de la administración subcutánea repetida de insulina en áreas de amiloidosis cutánea. Se ha reportado hipoglucemia después de un cambio repentino en un sitio de inyección no afectado.
La rotación continua del sitio de inyección dentro de la misma región (abdomen, deltoides o muslo) puede ayudar a reducir el riesgo o prevenir estas reacciones (ver sección Dosis y vía de administración).
Trastornos del sistema inmunológico: Se han reportado reacciones alérgicas (urticaria) posiblemente relacionadas con SOLIQUA® en el 0.3% de los pacientes. Se han reportado casos de reacción alérgica generaliza, incluida reacción anafiláctica y angioedema durante el uso de insulina glargina y lixisenatida comercializadas.
Inmunogenicidad: Al igual que con todas las proteínas terapéuticas, existe el potencial de inmunogenicidad.
La administración de SOLIQUA® puede causar la formación de anticuerpos contra insulina glargina y/o lixisenatida.
Después de 30 semanas de tratamiento con SOLIQUA® en 2 ensayos fase 3, la incidencia de formación de anticuerpos antiinsulina glargina fue de 21.0% y 26.2%. En aproximadamente el 93% de los pacientes, los anticuerpos anti-insulina glargina mostraron reactividad cruzada a la insulina humana. La incidencia de formación de anticuerpos anti-lixisenatida fue de aproximadamente de 43%. Ni el estado de los anticuerpos antiinsulina glargina ni los anticuerpos anti-lixisenatida tuvieron un impacto clínico relevante sobre la seguridad o la eficacia.
En un tercer estudio de fase 3, la incidencia de formación de anticuerpos anti-insulina glargina fue de 17.4% y del 44.5% para anticuerpos anti-lixisenatida.
Reacciones en el sitio de inyección: Algunos pacientes (1.7%) con terapia de insulina, incluyendo SOLIQUA®, han experimentado eritema, edema local y prurito en el lugar de aplicación de la inyección. Estas condiciones normalmente fueron autolimitadas.
Ritmo cardiaco: Se ha reportado aumento de la frecuencia cardiaca con el uso de GLP1RA y también se observó un aumento transitorio en algunos estudios con lixisenatida. No se observó ningún aumento en la frecuencia cardiaca media en todos los estudios de Fase 3 con SOLIQUA®.
* Aunque la amiloidosis cutánea localizada y la lipodistrofia no se consideraron relacionadas con la insulina glargina + lixisenatida, estas son reacciones adversas conocidas para todas las insulinas, incluida la insulina glargina.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: No se han conducido estudios en animales con la combinación de insulina glargina y lixisenatida para evaluar la toxicidad de dosis repetidas, la carcinogénesis, genotoxicidad o toxicidad de la reproducción.
Insulina glargina: Los datos preclínicos de insulina glargina no revelan peligro especial para humanos con base en los estudios convencionales de farmacología de seguridad, toxicidad de dosis repetida, genotoxicidad, potencial carcinogénico y toxicidad para la reproducción.
Lixisenatida: En los estudios de carcinogenicidad subcutánea de 2 años, se observaron tumores de células T de tiroides no letales en ratas y ratones y se considera que pueden ser provocados por un mecanismo mediado por el receptor no genotóxico de GLP-1 al que los roedores son particularmente sensibles. Se observó hiperplasia de las células C y adenoma en todas las dosis en ratas y no se pudo definir un nivel sin efecto adverso observado (NOAEL). En ratones, estos efectos ocurrieron en una proporción de exposición por arriba de 9.3 veces cuando se compara con la exposición humana a la dosis terapéutica. No se observó carcinoma de células C en ratones y no ocurrió carcinoma de células C en ratas con una proporción de exposición relativa a la exposición a una dosis terapéutica humana de aproximadamente 900 veces.
En un estudio de 2 años de carcinogenicidad subcutánea en ratones, se observaron 3 casos de adenocarcinoma en el endometrio en el grupo de dosis media con un aumento estadísticamente significativo, correspondiente a una razón de exposición de 97 veces. No se demostró ningún efecto relacionado con el tratamiento.
Los estudios en animales no indicaron efectos nocivos directos respecto a la fertilidad de machos y hembras en ratas. Se observaron lesiones reversibles testiculares y del epidídimo en perros tratados con lixisenatida. No se observó efecto relacionado a espermatogénesis en machos sanos.
En los estudios de desarrollo embriofetal, se observaron malformaciones, retardo en el crecimiento, retardo en la osificación y efectos esqueléticos en ratas a todas las dosis (proporción de 5 veces la exposición en comparación con la exposición humana) y en conejos con dosis elevadas (proporción de 32 veces la exposición en comparación con la exposición humana) de lixisenatida. En ambas especies, hubo una toxicidad materna ligera que consistió en el consumo bajo de alimentos y que redujo el peso corporal. El crecimiento neonatal se redujo en ratas macho expuestas a dosis de lixisenatida durante la gestación y la lactancia, observándose un ligero aumento en la mortalidad de las crías.
Fertilidad: Los estudios en animales con lixisenatida o insulina glargina no indican efectos negativos directos respecto a la fertilidad.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: No se han realizado estudios de interacción con SOLIQUA®. La información presentada a continuación se basa en estudios con los componentes individuales.
Insulina glargina: Varias sustancias afectan el metabolismo de glucosa y pueden requerir del ajuste de dosis de SOLIQUA®.
Las sustancias que pueden aumentar el efecto hipoglucemiante en sangre e incrementar la susceptibilidad a la hipoglucemia incluyen medicamentos anti-hiperglucémicos, inhibidores de la enzima convertidora de angiotensina ECA, disopiramida, fibratos, fluoxetina, inhibidores de la monoaminooxidasa (MAO), pentoxifilina, propoxifeno, salicilatos y antibióticos sulfonamidas.
Las sustancias que pueden reducir el efecto hipoglucemiante en sangre incluyen corticosteroides, danazol, diazóxido, diuréticos, glucagón, isoniazida, estrógenos, progestágenos, derivados de fenotiazina, somatropina, agentes simpaticomiméticos (tales como epinefrina [adrenalina], salbutamol, y terbutalina), hormonas tiroideas, medicamentos antipsicóticos atípicos (p. ej., olanzapina y clozapina) e inhibidores de la proteasa.
Los beta-bloqueadores, clonidina, sales de litio y alcohol pueden potenciar o debilitar el efecto hipoglucemiante de la insulina. Pentamidina puede provocar hipoglucemia, que en ocasiones puede ser seguida por hiperglucemia.
Además, bajo la influencia de medicamentos simpaticolíticos tales como bloqueadores beta, clonidina, guanetidina y reserpina, los signos de la contrarregulación adrenérgica se pueden reducir o estar ausentes.
Lixisenatida: La lixisenatida es un péptido y no lo metaboliza el citocromo P450. En los estudios in vitro, la lixisenatida no afectó la capacidad de las isoenzimas del citocromo P450 ni de los transportadores analizados.
Efecto del vaciado gástrico en los medicamentos orales: El vaciado gástrico puede reducir la tasa de absorción de los medicamentos administrados por vía oral. Los pacientes que reciben medicamentos de margen terapéutico estrecho o medicamentos que requieren un seguimiento clínico cuidadoso deben ser seguidos de cerca, especialmente en el momento del inicio del tratamiento con lixisenatida.
Estos medicamentos deben tomarse de forma estandarizada en relación con lixisenatida. Si estos medicamentos se administran con alimentos, se debe recomendar a los pacientes que, si es posible, los tomen con una comida cuando no se administre lixisenatida.
Para los medicamentos orales que son particularmente dependientes a concentraciones umbrales para ser eficaces, tales como antibióticos, se debe aconsejar a los pacientes que tomen esos medicamentos al menos 1 hora antes u 11 horas después de la inyección de SOLIQUA®.
Las formulaciones gastro-resistentes que contienen sustancias sensibles a la degradación del estómago, deben administrarse 1 hora antes o 4 horas después de la inyección de SOLIQUA®.
Paracetamol: El paracetamol se utilizó como modelo para evaluar el efecto de la lixisenatida en el vaciado gástrico. Tras la administración de una dosis única de paracetamol 1000 mg, el ABC y el t½ del paracetamol permanecieron sin cambios cualquiera que fuera el momento de su administración (antes o después de la inyección de lixisenatida).
Cuando se administró 1 o 4 horas después de 10 μg de lixisenatida, la Cmáx de paracetamol disminuyó en un 29% y un 31% respectivamente y la tmáx media se retrasó en 2.0 y 1.75 horas, respectivamente. Se ha predicho una demora adicional en el tmáx y una Cmáx reducida del paracetamol con la dosis de mantenimiento de 20 μg.
No se observaron efectos sobre la Cmáx y el tmáx del paracetamol cuando se administró paracetamol 1 hora antes de la lixisenatida.
Basándose en estos resultados, no se requiere ajuste de dosis para paracetamol, pero el tmáx retrasado observado cuando se administra paracetamol 1-4 horas después de lixisenatida debe tenerse en cuenta cuando se requiere un inicio rápido de acción para la eficacia.
Anticonceptivos orales: Después de la administración de una dosis única de algún producto anticonceptivo oral (etinilestradiol 0.03 mg/levonorgestrel 0.15 mg) 1 hora antes u 11 horas después de 10 μg de lixisenatida, la Cmáx, ABC, t½ y tmáx de etinilestradiol y levonorgestrel no cambiaron.
La administración del anticonceptivo oral 1 o 4 horas después de lixisenatida no afectó el ABC ni la t½ de etinilestradiol y levonorgestrel, mientras que la Cmáx de etinilestradiol disminuyó un 52% y 39%, respectivamente, y la Cmáx de levonorgestrel disminuyó un 46% y 20%, respectivamente, y la mediana de la tmáx se retrasó en 1 a 3 horas.
La reducción de la Cmáx es de relevancia clínica limitada y no se requiere un ajuste de dosis para los anticonceptivos orales. Se recomienda que los anticonceptivos orales sean administrados al menos 1 hora antes u 11 horas después de la administración de SOLIQUA®.
Atorvastatina: Cuando lixisenatida 20 μg y atorvastatina 40 mg se administraron de forma concomitante en la mañana por 6 días, no se afectó la exposición de atorvastatina, aunque la Cmáx se disminuyó un 31% y la tmáx se retrasó por 3.25 horas.
No se observó tal incremento para la tmáx cuando se administró atorvastatina en la noche y lixisenatida en la mañana, pero el ABC y la Cmáx de atorvastatina aumentaron en 27% y 66%, respectivamente.
Estos cambios no son clínicamente relevantes y, por lo tanto, no se requiere del ajuste de la dosis para atorvastatina cuando se administra de forma concomitante con lixisenatida. Sin embargo, debido al retraso en la tmáx, los pacientes que toman atorvastatina deben ser advertidos de tomarla al menos 1 hora antes u 11 horas después de la administración de SOLIQUA®.
Warfarina y otros derivados de cumarina: Después de la administración concomitante de warfarina 25 mg con la administración repetida de lixisenatida 20 μg, no hubo efectos en el ABC ni en la proporción normalizado internacional (INR), aunque la Cmáx se redujo un 19% y la tmáx se retrasó 7 horas.
Con base en estos resultados, no se requiere del ajuste de dosis para warfarina cuando se coadministra con lixisenatida; sin embargo, se recomienda la monitorización frecuente del INR en pacientes con warfarina y/o derivados cumarínicos en el momento del inicio o fin del tratamiento con lixisenatida.
Digoxina: Después de la administración concomitante de lixisenatida 20 μg y de digoxina 0.25 mg en estado de equilibrio, el ABC de digoxina no fue afectada. La tmáx de digoxina se retrasó 1.5 horas y la Cmáx se redujo un 26%. Con base en estos resultados, no se requiere de ajuste de dosis para digoxina cuando se administra de forma concomitante con SOLIQUA®.
Ramipril: Después de la administración concomitante de lixisenatida 20 μg y ramipril 5 mg durante 6 días, el ABC de ramipril incrementó un 21%, mientras que la Cmáx se redujo un 63%. El ABC y la Cmáx del metabolito activo (ramiprilat) no fueron afectados. La tmáx de ramipril y de ramiprilat se retrasó en aproximadamente 2.5 horas.
Con base en estos resultados, no se requiere del ajuste de dosis de ramipril cuando se administre de forma concomitante con SOLIQUA®.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: No existe información disponible.
PRECAUCIONES GENERALES:
Hipoglucemia: La hipoglucemia fue la reacción adversa no deseable observable que se reportó con mayor frecuencia durante el tratamiento con SOLIQUA® (ver sección Reacciones secundarias y adversas). Puede ocurrir hipoglucemia si la dosis de SOLIQUA® es más alta que la requerida.
Los factores que aumenten la susceptibilidad a hipoglucemia requieren de monitorización estrecha en particular y puede ser necesario el ajuste de dosis. Los factores incluyen:
• Cambio en el área de inyección.
• Mejora la sensibilidad a la insulina (p. ej., eliminación de factores de estrés).
• Actividad física no acostumbrada, en exceso o prolongada.
• Enfermedad subyacente (p. ej., vómito y diarrea).
• lngesta alimentaria inadecuada.
• Omisión de comidas.
• Consumo de alcohol.
• Ciertos trastornos endocrinos descompensados (p. ej., en el hipotiroidismo y en la insuficiencia de la pituitaria anterior o adrenocortical).
• Tratamiento concomitante con otros medicamentos (ver sección Interacciones medicamentosas y de otro género).
• La lixisenatida y/o la insulina en combinación con una sulfonilurea pueden aumentar el riesgo de hipoglucemia. Por lo tanto, SOLIQUA® no debe administrarse en combinación con una sulfonilurea.
La dosis de SOLIQUA® se debe personalizar con base en la respuesta clínica y titular con base en la necesidad de insulina del paciente (ver sección Dosis y vía de administración).
El efecto prolongado de la insulina glargina subcutánea puede retrasar la recuperación de la hipoglucemia.
Enfermedad aguda de la vesícula biliar: El uso de agonistas del receptor de GLP-1 se ha asociado con enfermedad aguda de la vesícula biliar. Se han reportado eventos agudos de vesícula biliar como, colelitiasis o colecistitis en pacientes tratados con lixisenatida, aunque no se ha establecido una relación causal. Se debería informar a los pacientes de los síntomas característicos de la enfermedad aguda de la vesícula biliar: dolor abdominal superior, fiebre, náusea, vómito e ictericia. Si se sospecha de colelitiasis, se indican exámenes de vesícula biliar y seguimiento.
Pancreatitis aguda: El uso de agonistas del receptor del péptido similar al glucagón (GLP-1) se ha asociado con un riesgo de desarrollar pancreatitis aguda. Se han reportado pocos eventos de pancreatitis aguda con lixisenatida, aunque no se ha establecido una relación causal. Se deberá informar a los pacientes de los síntomas característicos de pancreatitis aguda: dolor abdominal persistente e intenso. Si se sospecha de pancreatitis, se deberá suspender SOLIQUA®; si se confirma pancreatitis aguda, no se deberá reiniciar lixisenatida. Utilice con precaución en pacientes con antecedentes de pancreatitis.
Lipodistrofia y amiloidosis cutánea: Se deberá indicar a los pacientes tratados con SOLIQUA® que deben realizar una rotación continua del sitio de inyección para reducir el riesgo de desarrollar lipodistrofia y amiloidosis cutánea localizada. Existe riesgo potencial de retraso en la absorción de insulina y empeoramiento del control glucémico después de inyecciones de insulina en sitios con lipodistrofia y/o amiloidosis cutánea. Se deberá informar al paciente que un cambio repentino en el lugar de la inyección a un área no afectada provoca hipoglucemia; por lo que se recomienda el control de los niveles de glucosa en sangre después del cambio en el sitio de inyección y se puede necesitar el ajuste de la dosis de SOLIQUA®.
Enfermedad gastrointestinal grave: El uso de agonistas del receptor de GLP-1 se puede asociar con reacciones adversas gastrointestinales. SOLIQUA® no se ha estudiado en pacientes con enfermedad gastrointestinal grave, incluida la gastroparesia grave y, por lo tanto, no se recomienda el uso de SOLIQUA® en estos pacientes.
Daño renal grave: No hay experiencia terapéutica en pacientes con daño renal grave (depuración de creatinina <30 mL/min) o enfermedad en etapa terminal. No se recomienda el uso en pacientes con daño renal grave o enfermedad renal terminal (ver sección Dosis y vía de administración, Farmacocinética y farmacodinamia).
Medicamentos concomitantes: El retraso en el vaciamiento gástrico con lixisenatida puede reducir la tasa de absorción de los medicamentos administrados por vía oral. SOLIQUA® se deberá utilizar con precaución en pacientes que reciban medicamentos orales que requieran de absorción gastrointestinal rápida, que requieran de la monitorización clínica cuidadosa o que tengan una proporción terapéutica estrecha (ver sección Interacciones medicamentosas y de otro género).
Deshidratación: Se deberá advertir a los pacientes tratados con SOLIQUA® del riesgo potencial de deshidratación en relación con las reacciones gastrointestinales adversas y de que tomen precauciones para evitar la depleción de líquidos.
Formación de anticuerpos: La administración de SOLIQUA® puede provocar la formación de anticuerpos contra insulina glargina y/o lixisenatida. En casos raros, la presencia de tales anticuerpos puede necesitar del ajuste de la dosis de SOLIQUA® a fin de corregir la tendencia de hiperglucemia o hipoglucemia.
Evitar errores de medicación: Los pacientes deben ser instruidos para comprobar siempre la etiqueta de la pluma antes de cada inyección para evitar mezclas accidentales entre las dos diferentes concentraciones de SOLIQUA® y mezclas con otros medicamentos inyectables para la diabetes.
Para evitar errores de dosificación y sobredosis potencial ni los pacientes ni los profesionales de la salud deben utilizar nunca una jeringa para extraer el medicamento del cartucho de la pluma precargada en una jeringa.
Poblaciones no estudiadas: No se ha estudiado la transferencia o cambio del tratamiento con un agonista del receptor de GLP-1 a SOLIQUA®.
SOLIQUA® no se ha estudiado en combinación con inhibidores de dipeptidil peptidasa-4 (DPP-4), sulfonilureas, glinidas, pioglitazona.
Efectos en la habilidad para manejar un vehículo o el uso de maquinaria: SOLIQUA® no tiene influencia o es mínima sobre la capacidad de conducir o utilizar maquinaria. Sin embargo, la capacidad del paciente para concentrarse y reaccionar se puede deteriorar como resultado de, por ejemplo, la hipoglucemia o hiperglucemia o, por ejemplo, como resultado del deterioro visual. Esto puede constituir un riesgo en situaciones en las que estas capacidades sean de importancia especial (p. ej., conducir un auto u operar maquinaria).
Se deberá advertir a los pacientes que tomen precauciones para evitar la hipoglucemia mientras conducen/manejan o utilizan máquinas. Esto es particularmente importante en aquellos pacientes con reducida o nula capacidad para percibir los síntomas de aviso de hipoglucemia, o que padecen episodios frecuentes de hipoglucemia. Debe considerarse si es aconsejable conducir o utilizar maquinaria en estas circunstancias.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Subcutánea.
SOLIQUA® se encuentra disponible en dos plumas precargadas, que brindan diferentes opciones de dosificación. La diferenciación entre las concentraciones de las plumas precargadas se basa en el rango de dosis de la pluma precargada:
• SOLIQUA® 100 unidades/mL y 50 μg/mL: pluma precargada 10-40.
- 1 unidad de SOLIQUA® contiene 1 unidad de insulina glargina y 0.5 μg de lixisenatida.
- Permite dosis diarias entre 10 y 40 unidades de SOLIQUA® (10 a 40 unidades de insulina glargina en combinación con 5 a 20 μg de lixisenatida).
• SOLIQUA® 100 unidades/mL y 33 μg/mL: pluma precargada 30-60.
- 1 unidad de SOLIQUA® contiene 1 unidad de insulina glargina y 0.33 μg de lixisenatida.
- Permite dosis diarias entre 30 y 60 unidades de SOLIQUA® (30 a 60 unidades de insulina glargina en combinación con 10 a 20 μg de lixisenatida).
Para evitar errores en la medicación, debe asegúrarse de que la concentración sea correcta y que el número de unidades se indique en la receta (ver Precauciones generales).
Posología: La dosis de SOLIQUA® se debe individualizar con base en la respuesta clínica y se titula con base en la necesidad de insulina del paciente. La dosis de lixisenatida se incrementa o se reduce junto con la dosis de insulina glargina y también depende de qué pluma precargada se utilice.
Dosis inicial: El tratamiento con insulina basal o agonista del receptor GLP-1 debe interrumpirse antes del inicio de SOLIQUA®.
La dosis de inicio de SOLIQUA® se selecciona con base en el tratamiento previo contra la diabetes y a fin de no exceder la dosis de inicio recomendada de lixisenatida de 10 μg:
Tabla 6 - Dosis de inicio de SOLIQUA®
|
Tratamiento previo |
|||||
|
Medicamentos orales antidiabéticos (pacientes sin tratamiento previo con insulina o agonista del receptor GLP-1) |
Insulina glargina (100 U)** < 20 unidades |
Insulina glargina (100 U)** ≥ 20 a < 30 unidades |
Insulina glargina (100 U)** ≥ 30 a ≤ 60 unidades |
||
|
Dosis de inicio y pluma precargada |
SOLIQUA® Pluma precargada (10-40) |
10 unidades (10 U/5 μg)* |
20 unidades (20 U/10 μg)* |
||
|
SOLIQUA® Pluma precargada (30-60) |
30 unidades (30 U/10 μg)* |
||||
* Unidades de insulina glargina (100 unidades/mL)/μg de lixisenatida.
** Si se usó una insulina basal diferente:
• Para la insulina basal dos veces al día o insulina glargina (300 U/mL), la dosis total diaria que previamente se usó se deberá reducir en 20% para elegir la dosis de inicio de SOLIQUA®.
• Para cualquier otra insulina basal, se deberá aplicar la misma regla que para la insulina glargina (100 U/mL).
La dosis diaria máxima es de 60 unidades de insulina glargina y 20 μg de lixisenatida correspondiente a 60 dosis.
SOLIQUA® se deberá inyectar por vía subcutánea una vez al día durante la hora previa a cualquier comida. Es preferible que la inyección prandial de SOLIQUA® se realice antes de la misma comida diario, cuando se haya elegido la comida más conveniente.
Titulación de la dosis: SOLIQUA® se administrará en conformidad con las necesidades particulares del paciente para insulina. Se recomienda optimizar el control glucémico mediante el ajuste de dosis basado en la monitorización de la glucosa en plasma en ayunas (ver sección Farmacocinética y farmacodinamia).
Se recomienda la monitorización estrecha de glucosa durante la transferencia y en las siguientes semanas.
• Si el paciente comienza con la pluma precargada de SOLIQUA® (10-40), la dosis se puede titular hasta a 40 unidades con esta pluma precargada.
• Para dosis totales diarias >40 unidades/día la titulación debe continuar con plumas (30-60) de SOLIQUA®.
• Si el paciente comienza con la pluma SOLIQUA® (30-60), la dosis se puede titular hasta 60 unidades con esta pluma.
• Para las dosis totales diarias >60 unidades/día, no utilice SOLIQUA®.
Los pacientes que ajusten la cantidad o el horario de la administración de la dosis de SOLIQUA® solo lo deberán hacer bajo orientación médica con la monitorización adecuada de la glucosa (ver sección Precauciones generales).
Poblaciones especiales:
Uso geriátrico (≥ 65 años): SOLIQUA® se puede utilizar en pacientes de edad avanzada. La dosis se deberá ajustar de forma individual, con base en la monitorización de glucosa. En los ancianos, el deterioro progresivo de la función renal puede conducir a una disminución constante de los requerimientos de insulina. Para lixisenatida no se requiere ajuste de la dosis basándose en la edad. La experiencia terapéutica de SOLIQUA® en pacientes ≥ 75 años es limitada.
Daño renal: SOLIQUA® no se recomienda en pacientes con insuficiencia renal grave y enfermedad renal terminal, ya que no hay suficiente experiencia terapéutica con el uso de lixisenatida.
No se requiere ajuste de dosis para lixisenatida en pacientes con insuficiencia renal leve o moderada.
En pacientes con insuficiencia renal, los requerimientos de insulina pueden disminuir debido a la reducción del metabolismo de la insulina.
En pacientes con insuficiencia renal de leve a moderada utilizando SOLIQUA®, puede ser necesario un control frecuente de la glucosa y un ajuste de dosis puede ser necesario.
Daño hepático: No es necesario ajustar la dosis de lixisenatida en pacientes con insuficiencia hepática (ver sección Farmacocinética y farmacodinamia). En pacientes con daño hepático, los requerimientos de insulina pueden disminuir debido a la capacidad reducida de gluconeogénesis y la disminución en el metabolismo de insulina. Puede ser necesaria la monitorización frecuente de glucosa y el ajuste de dosis para SOLIQUA® en pacientes con daño hepático.
Uso pediátrico: No se ha establecido el uso de SOLIQUA® en población pediátrica.
Modo de administración: SOLIQUA® se inyecta subcutáneamente en el abdomen, deltoides o muslo.
Los sitios de inyección deben ser rotados dentro de la misma región (abdomen, deltoides o muslo) de una inyección a la siguiente para reducir el riesgo de lipodistrofia y amiloidosis cutánea localizada. No inyectar en las áreas con lipodistrofia o amiloidosis cutánea localizada. (ver sección Reacciones secundarias y adversas).
Los pacientes deben ser instruidos para usar siempre una aguja nueva. La reutilización de las agujas de la pluma de insulina aumenta el riesgo de agujas bloqueadas, que pueden causar baja dosificación o dosificación excesiva. En caso de agujas bloqueadas, los pacientes deben seguir las instrucciones descritas en las "Instrucciones de uso" que se expresan en el instructivo.
SOLIQUA® no debe extraerse del cartucho de la pluma precargada en una jeringa para evitar errores de dosificación y sobredosis potencial (ver la sección Precauciones generales).
Preparación y manejo: Antes del primer uso, la pluma se debe sacar del refrigerador y almacenarla por debajo de 25 °C durante 1 a 2 horas.
SOLIQUA® debe ser revisada antes de cada uso. SOLIQUA® solo debe ser usada si la solución es clara, incolora, sin partículas visibles, y si tiene consistencia acuosa.
SOLIQUA® no se debe mezclar ni diluir con ninguna otra insulina. La mezcla o dilución puede cambiar su perfil de tiempo y acción, y la mezcla puede provocar la precipitación.
Se debe colocar una aguja nueva antes de cada uso. Las agujas no se deben reutilizar. El paciente deberá desechar la aguja después de cada inyección.
En el caso de agujas bloqueadas, los pacientes deben seguir las indicaciones descritas en las "Instrucciones de uso", instructivo que se encuentra dentro de la caja.
Nunca se deben reutilizar las plumas precargadas vacías y se deben desechar de forma adecuada.
Para evitar la posible transmisión de enfermedades, cada pluma precargada debe ser utilizada únicamente por un paciente.
La etiqueta siempre se debe verificar antes de cada inyección para evitar errores en la medicación entre SOLIQUA® y otros medicamentos hipoglucemiantes inyectables, incluidas las 2 diferentes plumas precargadas de SOLIQUA® (ver sección Precauciones generales).
Una vez transcurrido el periodo de vida útil, SOLIQUA® deberá desecharse.
SOLIQUA® en pluma precargada SoloStar® debe usarse con las siguientes agujas:
Agujas para pluma, marca BD:
• BD Micro-FineMR+, BD Micro-FineMR Plus, BD Ultra-FineMR, BD Micro-FineMR Ultra and BDMR. Tamaños: 0.23 mm (32G) x 4 mm, 0.25 mm (31G) x 5 mm, 0.25 (31G) x 8 mm, 0.30 (30G) x 8 mm, 0.33 mm (29G) x 12.7 mm.
• BD AUTOSHIELDMR DUO Safety pen needle with Dual Automatic Protective Shields. Tamaños: 0.30 mm (30G) x 5 mm, 0.30 mm (30G) x 8 mm.
• BD AUTOSHIELDMR Pen needles with Automatic Protective Shield. Tamaños: 0.33 mm (29G) x 5 mm, 0.33 mm (29G) x 8 mm.
Agujas para pluma, marca Owen Mumford:
• Unifine® Pentips®. Tamaños: 0.23 mm (32G) x 4 mm, 0.25 mm (31G) x 5 mm, 0.25 mm (31G) x 6 mm, 0.25 mm (31G) x 8 mm y 0.33 mm (29G) x 12 mm.
• Unifine® Pentips® Plus. Tamaños: 0.25 mm (31G) x 5 mm, 0.25 mm (31G) x 6 mm, 0.25 mm (31G)x 8 mm y 0.33 mm (29G) x 12 mm.
Agujas para pluma, marca YPSOMED:
• Penfine®. Tamaños: 0.25 mm (31G) x 6 mm, 0.25 mm (31G) x 8 mm, 0.33 mm (29G) x 10 mm, 0.33 mm (29G) x 12 mm.
• Optifine®. Tamaños: 0.25 mm (31G) x 6 mm, 0.25 mm (31G) x 8 mm, 0.33 mm (29G) x 10 mm, 0.33 mm (29G) x 12 mm.
• Clickfine® AutoProtectTM. Tamaños: 0.33 mm (29G) x 8 mm.
• Penfine® Classic. Tamaños: 0.23 mm (32G) x 4 mm, 0.23 mm (32G) x 6 mm y 0.25 mm (31G) x 8 mm.
• Clickfine®. Tamaños: 0.23 mm (32G) x 4 mm, 0.25 mm (31G) x 4.5 mm, 0.25 mm (31G) x 6 mm, 0.25 mm (31G) x 8 mm, 0.33 mm (29G) x 10 mm, 0.33 mm (29G) x 12 mm.
Utilice siempre una aguja nueva para cada inyección. La reutilización de agujas aumenta el riesgo de que las agujas se bloqueen, lo que puede resultar en dosis inferiores o una sobredosis. Deseche la aguja de forma segura después de cada uso.
Antes de usar SOLIQUA®, se deben leer cuidadosamente las instrucciones para su uso incluidas en el instructivo dentro de la caja.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Se pueden desarrollar hipoglucemia y reacciones adversas gastrointestinales si un paciente recibe más SOLIQUA® del requerido.
Los episodios leves de hipoglucemia usualmente pueden ser tratados con carbohidratos orales. Los ajustes en la dosis del medicamento, régimen de comidas, o ejercicio pudieran ser necesarios.
Los episodios más graves de hipoglucemia con coma, convulsiones, o deterioro neurológico pueden ser tratados con glucagón intramuscular o subcutáneo, o con glucosa intravenosa concentrada. Puede ser necesaria la ingesta sostenida de carbohidratos y la observación ya que la hipoglucemia pudiera recurrir después de la recuperación clínica aparente.
En caso de reacciones adversas gastrointestinales, el tratamiento de apoyo adecuado se deberá iniciar según los signos y síntomas clínicos del paciente, y la dosis de SOLIQUA® se deberá reducir a la dosis prescrita.
PRESENTACIONES:
Caja con 1, 3 o 5 pluma(s) precargada(s) SoloStar® con 3 mL de SOLIQUA® 100 U, 50 μg/mL e instructivo anexo.
Caja con 1, 3 o 5 pluma(s) precargada(s) SoloStar® con 3 mL de SOLIQUA® 100 U, 33 μg/mL e instructivo anexo.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Plumas no en uso (cerradas): Consérvese en refrigeración entre 2 a 8 °C.
No congele ni coloque cerca del compartimento del congelador ni de un paquete del congelador.
Mantenga la pluma precargada en la caja de cartón a fin de protegerla de la luz.
Plumas en uso (abiertas):
Vida útil después del primer uso de la pluma precargada: 28 días, una vez transcurrido este periodo debe desecharse.
Almacene a no más de 25 °C. No se refrigere.
No se congele.
No guarde con la aguja puesta. Deséchese cada aguja después de su uso en los contenedores apropiados.
Almacene la pluma precargada lejos del calor o luz directa. La tapa de la pluma precargada se debe colocar nuevamente después de cada inyección a fin de protegerla de la luz.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta requiere receta médica. No se deje al alcance de los niños. No administrar durante el embarazo y la lactancia. No administrar en menores de 18 años. Este medicamento no se administra por vía intravenosa. No se administre si el cierre ha sido violado. No debe ser diluido ni mezclado con ningún otro medicamento. No se administre si la solución no es transparente, si contiene partículas en suspensión o sedimentos. Este medicamento contiene metacresol, que puede producir reacciones de hipersensibilidad.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
SANOFI-AVENTIS DE MÉXICO, S.A. de C.V.
Acueducto del Alto Lerma No. 2,
Zona Industrial Ocoyoacac,
C.P. 52740, Ocoyoacac, México, México
Reg. Núm. 103M2018, SSA IV