SIPTATINMET
METFORMINA, SITAGLIPTINA
Tabletas
1 Caja, 14 Tabletas, 50/500 mg/mg
1 Caja, 28 Tabletas, 50/500 mg/mg
1 Caja, 56 Tabletas, 50/500 mg/mg
1 Caja, 14 Tabletas, 50/850 mg/mg
1 Caja, 28 Tabletas, 50/850 mg/mg
1 Caja, 56 Tabletas, 50/850 mg/mg
1 Caja, 14 Tabletas, 50/1,000 mg/mg
1 Caja, 28 Tabletas, 50/1,000 mg/mg
1 Caja, 56 Tabletas, 50/1,000 mg/mg
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Clorhidrato de sitagliptina monohidratada equivalente a 50 mg de sitagliptina
Clorhidrato de metformina 500 mg, 850 mg, 1,000 mg
Excipiente cbp 1 tableta
INDICACIONES TERAPÉUTICAS:
Para pacientes adultos con diabetes mellitus tipo 2:
Sitagliptina/Metformina está indicado como complemento de la dieta y el ejercicio para mejorar el control glucémico en pacientes inadecuadamente controlados con su dosis máxima tolerada de metformina sola o aquellos que ya están siendo tratados con la combinación de Sitagliptina/Metformina.
Sitagliptina/Metformina está indicado en combinación con una sulfonilurea (es decir, terapia de combinación triple) como complemento de la dieta y el ejercicio en pacientes inadecuadamente controlados con su dosis máxima tolerada de metformina y una sulfonilurea.
Sitagliptina/Metformina está indicado como terapia de combinación triple con un agonista del receptor gamma activado por proliferador de peroxisomas (PPAR?) (es decir, una tiazolidindiona) como complemento de la dieta y el ejercicio en pacientes inadecuadamente controlados con su dosis máxima tolerada de metformina y un agonista de PPAR?.
Sitagliptina/Metformina también está indicado como complemento de la insulina (es decir, terapia de combinación triple) como complemento de la dieta y el ejercicio para mejorar el control glucémico en pacientes cuando la dosis estable de insulina y metformina solas no proporciona un control glucémico adecuado.
FARMACOCINÉTICA Y FARMACODINAMIA:
Grupo farmacoterapéutico: Fármacos utilizados en la diabetes, Combinaciones de fármacos hipoglucemiantes orales.
Código ATC: A10BD07.
Mecanismo de acción:
Sitagliptina/Metformina:
Sitagliptina/Metformina combina dos medicamentos antihiperglucémicos con mecanismos de acción complementarios para mejorar el control glucémico en pacientes con diabetes tipo 2: sitagliptina, un inhibidor de la dipeptidil peptidasa 4 (DPP-4), y metformina, un miembro de la clase de la biguanida.
Sitagliptina:
Sitagliptina es un miembro de una clase de agentes hipoglucemiantes llamados inhibidores de la dipeptidil peptidasa 4 (DPP-4), que mejoran el control glucémico en pacientes con diabetes tipo 2, aumentando las concentraciones de las hormonas incretinas activas. Estas hormonas, que incluyen el péptido-1 similar al glucagón (GLP-1) y el péptido insulinotrópico dependiente de la glucosa (GIP), son liberadas por el intestino durante todo el día y sus concentraciones aumentan en respuesta a la ingestión de alimentos. Las incretinas forman parte de un sistema endógeno que participa en la regulación fisiológica de la homeostasis de la glucosa.
Cuando la glucemia está normal o elevada, el GLP-1 y el GIP aumentan la síntesis y la liberación de insulina por las células beta del páncreas a través de vías de señalización intracelulares en las que interviene el monofosfato de adenosina cíclico (AMPc). Se ha demostrado que el tratamiento con inhibidores del GLP-1 o de la DPP-4 en modelos animales de diabetes tipo 2 mejora la capacidad de respuesta de las células beta a la glucosa y estimula la biosíntesis y la liberación de insulina. Con concentraciones mayores de insulina, aumenta la captación tisular de glucosa. Además, el GLP-1 disminuye la secreción de glucagón por las células alfa del páncreas. Las concentraciones disminuidas de glucagón y el aumento de las concentraciones de insulina hacen que disminuya la producción hepática de glucosa, lo cual da por resultado la disminución de la concentración de glucosa en la sangre. Los efectos del GLP-I y del GIP son dependientes de la glucosa, de tal manera que cuando la glucemia está baja no se observa estimulación de la liberación de insulina ni la inhibición de la secreción de glucagón por el GLP-1. La estimulación de liberación de insulina, tanto por GLP-1 como por GIP, se potencializa cuando los niveles de glucosa están por arriba de lo normal. Más aún, GLP-1 no afecta la respuesta normal del glucagón a la hipoglucemia. La actividad de GLP-1 y de GIP está limitada por la enzima DPP-4, que hidroliza rápidamente las incretinas y las transforma en productos inactivos. La sitagliptina impide esa hidrólisis de las incretinas por la DPP-4, por lo que aumentan las concentraciones plasmáticas de las formas activas del GLP-1 y del GIP. Como consecuencia, la sitagliptina aumenta la liberación de insulina y disminuye la concentración de glucagón de manera dependiente de la glucosa. En los pacientes con diabetes tipo 2 con hiperglucemia, esos cambios en las concentraciones de insulina y de glucagón hacen que disminuyan las concentraciones de hemoglobina A1c (HbA1c) y la glucemia en ayunas y posprandial. El mecanismo dependiente de glucosa de sitagliptina es diferente al de sulfonilureas, ya que éstas incrementan la secreción de insulina aun cuando los niveles de glucosa estén bajos, lo que puede causar hipoglucemia en pacientes con diabetes tipo 2 y en sujetos normales. Aunque la sitagliptina es un inhibidor potente y sumamente selectivo de la enzima DPP-4, no inhibe las enzimas estrechamente relacionadas DPP-8 y DPP-9, a concentraciones terapéuticas.
La sitagliptina difiere en estructura química y acción farmacológica de los análogos de GLP-1, insulina, sulfonilureas o meglitinidas, biguanidas, agonistas del receptor gamma activado por proliferadores de peroxisomas (PPAR?), inhibidores de la alfa-glucosidasa y análogos de amilina.
En un estudio de dos días en sujetos sanos, la sitagliptina sola aumentó las concentraciones activas de GLP-1, mientras que la metformina sola aumentó las concentraciones activas y totales de GLP-1 en grados similares.
La administración concomitante de sitagliptina y metformina tuvo un efecto aditivo sobre las concentraciones activas de GLP-1. Sitagliptina pero no la metformina aumentó las concentraciones activas de GIP.
Metformina:
La metformina es un agente hipoglucemiante que mejora la tolerancia a la glucosa en pacientes con diabetes tipo 2, disminuyendo tanto la glucosa plasmática basal como la posprandial. Sus mecanismos de acción farmacológicos son diferentes de los de otras clases de hipoglucemiantes orales. La metformina disminuye la producción hepática y la absorción intestinal de glucosa y mejora la sensibilidad a la insulina aumentando la captación y la utilización periférica de glucosa. A diferencia de las sulfonilureas, la metformina no produce hipoglucemia ni en los pacientes con diabetes tipo 2 ni en los sujetos normales (excepto en circunstancias especiales; véase Precauciones generales), y no causa hiperinsulinemia. El tratamiento con metformina no modifica la secreción de insulina, mientras que puede disminuir los niveles de insulina en ayunas y la respuesta de la insulina plasmática durante todo el día.
La metformina estimula la síntesis de glucógeno intracelular actuando sobre la glucógeno sintasa. La metformina aumenta la capacidad de transporte de tipos específicos de transportadores de glucosa de membrana (GLUT-1 y GLUT-4).
Sitagliptina/Metformina:
Los resultados de un estudio de bioequivalencia definitivo en sujetos sanos demostraron que las tabletas de sitagliptina/metformina (sitagliptina/clorhidrato de metformina) con 50 mg/500 mg y con 50 mg/1,000 mg son bioequivalentes a la coadministración de esas mismas dosis de sitagliptina y metformina en tabletas individuales.
Debido a que se demostró bioequivalencia a las dosis más baja y más alta de tabletas combinadas, se confirió bioequivalencia a la tableta de combinación fija (FDC) de 50 mg/850 mg (Sitagliptina/Metformina).
Farmacodinamia:
General:
En pacientes con diabetes tipo 2, la administración de dosis orales únicas de sitagliptina inhibe la actividad de la enzima DPP-4 durante 24 horas, lo cual aumenta al doble o al triple las concentraciones circulantes de GLP-1 y GIP activos, aumenta las concentraciones plasmáticas de insulina y de péptido C, y disminuye las concentraciones de glucagón, la glucemia en ayunas y el margen de variación de la glucemia después de la ingestión de glucosa o de una comida.
En los estudios clínicos Fase III de 18 y 24 semanas de duración, el tratamiento con 100 mg diarios de sitagliptina en pacientes con diabetes tipo 2 mejoró significativamente el funcionamiento de las células beta evaluado mediante varios marcadores, que incluyeron la Evaluación Modeloβ de la Homeostasis (HOMA-β, por sus siglas en inglés), la relación proinsulina/insulina y las mediciones de la sensibilidad de las células beta según las muestras múltiples de la prueba de tolerancia a la ingestión de alimentos. En estudios de Fase II, la eficacia sobre la glucemia de la dosificación de 50 mg de sitagliptina dos veces al día fue similar a la de 100 mg una vez al día. En un estudio doble ciego de dos días, cruzado, de cuatro periodos, con distribución al azar y controlado, de doble enmascaramiento en adultos sanos, se compararon los efectos de la coadministración de sitagliptina y metformina sobre las concentraciones de GLP-1 plasmático activo y total y la glucemia postprandiales con los de la administración de sitagliptina sola, metformina sola o placebo, cada uno administrado por dos días. El aumento del promedio ponderado de las concentraciones de GLP-1 activo cuatro horas después de la comida fue aproximadamente dos veces mayor con la sitagliptina sola o la metformina sola que con el placebo. La coadministración de sitagliptina y metformina tuvo un efecto aditivo sobre las concentraciones de GLP-1 activo, que aumentaron unas cuatro veces más que con el placebo. La sitagliptina sola también aumentó sólo las concentraciones de GLP-1 activo, debido muy probablemente a la inhibición de la DPP-4, mientras que la metformina sola aumentó en grado similar las concentraciones de GLP-1 activo y total, lo cual refleja un mecanismo diferente para el aumento del GLP-1 activo, debido principalmente a un aumento del GLP-1 total. Estos datos son consistentes con diferentes mecanismos de acción para incrementar las concentraciones de GIP-1 activo. Los resultados de ese estudio también demostraron que la sitagliptina, pero no la metformina, aumenta las concentraciones de GIP activo.
En estudios con sujetos sanos, la sitagliptina no disminuyó la glucemia ni provocó hipoglucemia, lo cual sugiere que sus acciones insulinotrópica y supresora del glucagón son dependientes de la glucosa.
Efectos sobre la presión arterial:
En un estudio cruzado, controlado con placebo y con distribución al azar en pacientes hipertensos tratados con uno o más antihipertensivos (que incluyeron inhibidores de la enzima convertidora de angiotensina, antagonistas de la angiotensina II, bloqueadores de canales de calcio, bloqueadores beta y diuréticos), la coadministración con sitagliptina fue generalmente bien tolerada. En esos pacientes, la sitagliptina tuvo un modesto efecto reductor de la presión arterial; 100 mg diarios disminuyeron unos 2 mmHg el promedio de presión sistólica ambulatoria en comparación con el placebo. No se han observado disminuciones en personas normotensas.
Electrofisiología cardiaca:
En un estudio cruzado, controlado con placebo y con distribución al azar, se administró a 79 sujetos sanos una dosis oral única de 100 mg de sitagliptina, de 800 mg de sitagliptina (ocho veces mayor que la dosis recomendada), y placebo. La dosis recomendada de 100 mg no tuvo ningún efecto sobre el intervalo QTc obtenido durante la concentración plasmática máxima o en cualquier otro momento del estudio. Con la dosis de 800 mg, el aumento máximo del promedio de cambio del QTc inicial corregido respecto al placebo fue de sólo 8.0 mseg tres horas después de la administración. Este pequeño aumento no se consideró clínicamente importante. Con la dosis de 800 mg, las concentraciones plasmáticas máximas de sitagliptina fueron aproximadamente once veces mayores que las producidas por la dosis de 100 mg.
En los pacientes con diabetes tipo 2 que recibieron sitagliptina a dosis de 100 mg diarios (N = 81) o de 200 mg diarios (N = 63) no hubo cambios importantes del intervalo QTc en los electrocardiogramas obtenidos en el momento de la concentración plasmática máxima esperada. Estudios clínicos-eficacia clínica y seguridad:
Los estudios clínicos con la coadministración de sitagliptina y metformina demostraron mejorías significativas en el control glucémico en pacientes con diabetes tipo 2. Se ha demostrado la bioequivalencia de Sitagliptina/Metformina tabletas con la coadministración de sitagliptina y clorhidrato de metformina de liberación inmediata para todas las concentraciones de las tabletas respectivamente.
En un estudio comparativo, la administración una vez al día de metformina de liberación prolongada ha tenido una eficacia similar a la de la formulación de metformina de liberación inmediata dos veces al día, en todas las medidas de control de la glucemia.
Sitagliptina:
En general, la sitagliptina mejoró el control glucémico cuando se utilizó como monoterapia o en tratamiento combinado en pacientes adultos con diabetes tipo 2. En pacientes con diabetes tipo 2, la administración de dosis orales únicas de sitagliptina inhibe la actividad de la enzima DPP-4 durante 24 horas, lo cual aumenta al doble o al triple las concentraciones circulantes de GLP-1 y GIP activos, aumenta las concentraciones plasmáticas de insulina y de péptido C, y disminuye las concentraciones de glucagón, la glucemia en ayunas y el margen de variación de la glucemia después de la ingestión de glucosa o de una comida.
En estudios clínicos, la sitagliptina como monoterapia mejoró el control glucémico con reducciones significativas de la hemoglobina a1c (HbA1c) y la glucosa en ayunas y postprandial. Se observó una reducción de la glucosa plasmática en ayunas (GPA) a las 3 semanas, el primer punto de tiempo en el que se midió la GPA. La incidencia observada de hipoglucemia en pacientes tratados con sitagliptina fue similar a placebo. El peso corporal no aumentó desde el inicio con el tratamiento con sitagliptina.
En los estudios clínicos fase III de 18 y 24 semanas de duración, el tratamiento con 100 mg diarios de sitagliptina en pacientes con diabetes tipo 2 mejoró significativamente el funcionamiento de las células beta evaluado mediante varios marcadores, que incluyeron la Evaluación Modelo β de la Homeostasis (HOMA-β, por sus siglas en inglés), la relación proinsulina/insulina y las mediciones de la sensibilidad de las células beta según las muestras múltiples de la prueba de tolerancia a la ingestión de alimentos. En estudios de Fase II, la eficacia sobre la glucemia de la dosificación de 50 mg de sitagliptina dos veces al día fue similar a la de 100 mg una vez al día. Sitagliptina y metformina como tratamiento inicial en pacientes con diabetes tipo 2:
Un total de 1,091 pacientes con diabetes tipo 2 y control inadecuado de la glucemia con dieta y ejercicio, participaron en un estudio factorial de 24 semanas, con distribución al azar, doble ciego, controlado con placebo, diseñado para evaluar la eficacia y seguridad del tratamiento inicial con la combinación de sitagliptina y metformina. Se distribuyó al azar a un número aproximadamente equivalente de pacientes para recibir tratamiento inicial con placebo; sitagliptina 100 mg una vez al día; metformina 500 o 1,000 mg dos veces al día; o sitagliptina 50 mg dos veces al día combinada con metformina 500 o 1,000 mg dos veces al día.
El tratamiento inicial con la combinación de sitagliptina y metformina produjo mejorías significativas en HbA1c, en glucosa plasmática en ayunas (GPA) y en glucosa plasmática post-pandrial (GPP) a las 2 horas en comparación con placebo, con metformina sola y con sitagliptina sola (p < 0.001; Tabla 1, Figura 1). A las 3 semanas (el primer punto de evaluación después de iniciar el tratamiento), se logró una mejoría en GPA cercana a la máxima reducción de GPA y se mantuvo durante las 24 semanas del estudio. Las mediciones de la función de las células beta, HOMA-β y la relación proinsulina a insulina también mostraron más mejoría con la coadministración de sitagliptina y metformina en comparación con la monoterapia de ambos medicamentos. En general, los efectos en los lípidos fueron neutrales. La disminución en el peso corporal en el grupo de sitagliptina y metformina fue similar al de los grupos de metformina sola o de placebo. Las reducciones promedio respecto al inicio en HbA1c comparado con placebo fueron generalmente mayores en los pacientes que al inicio tenían valores más altos de HbA1c. La mejoría en HbA1c fue generalmente consistente entre los subgrupos definidos por sexo, edad, raza o IMC inicial. Las reducciones promedio respecto al inicio en HbA1c de los pacientes que no estaban bajo tratamiento hipoglucemiante al inicio del estudio fueron: sitagliptina 100 mg una vez al día, -1.06%; metformina 500 mg dos veces al día, -1.09%; metformina 1,000 mg dos veces al día, -1.24%; sitagliptina 50 mg dos veces al día más metformina 500 mg dos veces al día, -1.59%; sitagliptina 50 mg dos veces al día más metformina 1,000 mg dos veces al día, -1.94% y; para quienes recibieron placebo, -0.17%.
Figura 1. Cambios promedio respecto al inicio en HbA1c durante 24 semanas con sitagliptina y metformina, solas y en combinación, como tratamiento inicial en pacientes con diabetes tipo 2†
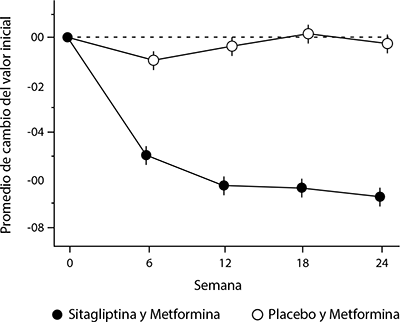 † Todos los mínimos cuadrados de la Población de Pacientes Tratados ajustados para tratamiento hipoglucemiante y valor basal previos.
† Todos los mínimos cuadrados de la Población de Pacientes Tratados ajustados para tratamiento hipoglucemiante y valor basal previos.
Tabla 1. Parámetros de glucemia y peso corporal en la visita final (estudio de 24 semanas) para sitagliptina y metformina, solos o en combinación como tratamiento inicial†
|
Placebo |
Sitagliptina 100 mg una vez al día |
Metformina 500 mg dos veces al día |
Sitagliptina 50 mg una vez al día + metformina 500 mg dos veces al día |
Metformina 1,000 mg dos veces al día |
Sitagliptina 50 mg dos veces al día + metformina 1,000 mg dos veces al día |
|
|---|---|---|---|---|---|---|
|
HbA1c (%) |
n = 165 |
n = 175 |
n = 178 |
n = 183 |
n = 177 |
n = 178 |
|
Basal (promedio) |
8.68 |
8.87 |
8.90 |
8.79 |
8.68 |
8.76 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
0.17 |
-0.66 |
-0.82 |
-1.40 |
-1.13 |
-1.90 |
|
Diferencia respecto a placebo promedio ajustado‡) |
- |
-0.83§ |
-0.99§ |
-1.57§ |
-1.30§ |
-2.07§ |
|
Pacientes (%) que alcanzaron HbA1c < 7% |
15 (9.1%) |
35 (20.0%) |
41 (23.0%) |
79 (43.2%) |
68 (38.4%) |
118 (66.3%) |
|
GPA (mg/dL) |
n = 169 |
n = 178 |
n = 179 |
n = 183 |
n = 179 |
n = 180 |
|
Basal (promedio) |
196.3 |
201.4 |
205.2 |
203.9 |
197.0 |
196.7 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
5.8 |
-17.5 |
-27.3 |
-47.1 |
-29.3 |
-63.9 |
|
Diferencia respecto a placebo (promedio ajustado‡) |
- |
-23.3§ |
-33.1§ |
52.9§ |
-35.1§ |
-69.7§ |
|
GPP 2 horas (mg/dL) |
n = 129 |
n = 136 |
n = 141 |
n = 147 |
n = 138 |
n = 152 |
|
Basal (promedio) |
276.8 |
285.4 |
292.7 |
291.8 |
283.4 |
286.9 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
0.3 |
-51.9 |
-53.4 |
-92.5 |
-78.0 |
-116.9 |
|
Diferencia respecto a placebo (promedio ajustado‡) |
-52.2§ |
-53.7§ |
-92.8§ |
-78.3§ |
-116.9§ |
|
|
Peso corporal (kg)% |
n = 167 |
n = 175 |
n = 179 |
n = 184 |
n = 175 |
n = 178 |
|
Basal (promedio) |
90.1 |
85.9 |
88.1 |
90.0 |
89.4 |
88.2 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-0.9 |
0.0 |
-0.9 |
-0.6 |
-1.1 |
-1.3 |
|
Diferencia respecto a placebo (promedio ajustado‡) |
0.9¶ |
0.1# |
0.4# |
-0.1# |
-0.3# |
† Población de todos los pacientes tratados (análisis de intención de tratar).
‡ Promedio de mínimos cuadrados ajustado según el tratamiento hipoglucemiante anterior y el nivel basales.
§ p < 0.001 comparado con placebo.
% Población de todos los pacientes tratados, excluyendo datos posteriores al tratamiento glucémico de rescate.
¶ p = 0.005 comparado con placebo.
# Sin significancia estadística (p ≥ 0.05) comparado con placebo.
Además, este estudio incluyó pacientes (n = 117) con hiperglucemia más severa (HbA1c > 11%) o glucosa sanguínea (> 280 mg/dL) que fueron tratados en forma abierta con sitagliptina 50 mg más metformina 1,000 mg dos veces al día. En este grupo de pacientes, el valor inicial de HbA1c era 11.15%, GPA era 314.4 mg/dL y GPP a las 2 horas era 441 mg/dL. Después de 24 semanas se observaron disminuciones de -2.94% para HbA1c, -126.7 mg/dL para GPA y -207.9 mg/dL para GPP a las dos horas. En esta cohorte abierta se observó un modesto incremento del peso corporal de 1.3 kg a las 24 semanas.
Adición de sitagliptina en pacientes controlados inadecuadamente con metformina sola:
La seguridad y la eficacia de la combinación de sitagliptina y metformina se evaluó en dos estudios clínicos doble ciego, controlados con placebo en pacientes con diabetes mellitus tipo 2. En ambos estudios se distribuyó al azar a pacientes en los que dosis estables de 1,500 mg o más de metformina no controlaban suficientemente la glucemia, para recibir 100 mg diarios de sitagliptina o placebo añadido a su tratamiento con metformina.
En un estudio, 701 pacientes recibieron 100 mg de sitagliptina o placebo una vez al día durante 24 semanas. En comparación con el placebo, la adición de sitagliptina al tratamiento con metformina mejoró significativamente la concentración de HbA1c (-0.65%), la GPA (-25.4 mg/dL) y la GPP a las dos horas (-50.6 mg/dL) (Figura 2 y Tabla 2). En esa mejoría de la HbA1c respecto a placebo, no influyeron su concentración basal, el tratamiento hipoglucemiante previo, el sexo, la edad, el índice de masa corporal basal, el tiempo transcurrido desde que se diagnosticó la diabetes, la presencia de síndrome metabólico, ni los índices estándares de resistencia a la insulina (HOMA-IR) o de secreción de insulina (HOMA-β). Comparado con los pacientes que tomaron placebo, los pacientes que recibieron sitagliptina presentaron ligeras disminuciones en colesterol total, colesterol no HDL y en los triglicéridos. En los dos grupos de tratamiento se observó una disminución similar del peso corporal.
Figura 2. Cambio promedio del valor basal de HbA1c en el transcurso de 24 semanas con dosis totales diarias de 100 mg de sitagliptina más metformina o con placebo más metformina en pacientes con diabetes tipo 2†,‡
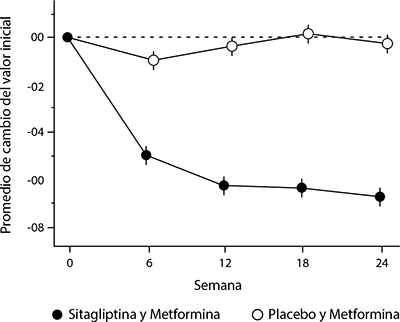 Pacientes con control glucémico inadecuado con la monoterapia con metformina.
Pacientes con control glucémico inadecuado con la monoterapia con metformina.
‡ Los mínimos cuadrados de la población de todos los pacientes tratados ajustados para tratamiento hipoglucemiante y valor basal previos.
Tabla 2. Parámetros glucémicos y peso corporal en la visita final (Estudio de 24 semanas). Sitagliptina añadida a tratamiento actual con metformina en pacientes con control inadecuado de la glucemia†
|
Sitagliptina 100 mg + metformina una vez al día |
Placebo + metformina |
|
|---|---|---|
|
HbA1c (%) |
n = 453 |
n = 224 |
|
Basal (promedio) |
7.96 |
8.03 |
|
Cambio del valor basal (promedio ajustado‡) |
-0.67 |
-0.02 |
|
Diferencia con el placebo + metformina (promedio ajustado‡) |
-0.65§ |
|
|
% de pacientes que llegaron a HbA1c < 7% |
213 (47.0%) |
41 (18.3%) |
|
GPA (mg/dL) |
N = 454 |
N = 226 |
|
Basal (promedio) |
170.0 |
173.5 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-16.9 |
8.5 |
|
Diferencia respecto a placebo + metformina (promedio ajustado‡) |
-25.4§ |
|
|
GPP a las dos horas (mg/dL) |
N = 387 |
N = 182 |
|
Basal (promedio) |
274.5 |
272.4 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-62.0 |
-11.4 |
|
Diferencia respecto a placebo + metformina (promedio ajustado‡) |
-50.6§ |
|
|
Peso corporal (kg)* |
N = 399 |
N = 169 |
|
Basal (promedio) |
86.9 |
87.6 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-0.7 |
-0.6 |
|
Diferencia respecto a placebo + metformina (promedio ajustado‡) |
-0.1 |
† Todos los pacientes tratados (análisis según la intención de tratar).
‡ Promedios de los mínimos cuadrados ajustados según el tratamiento hipoglucemiante y el valor basal previos.
§ p < 0.001 comparado con placebo + metformina.
* Todos los pacientes tratados, excluyendo datos posteriores al tratamiento hipoglucemiante de rescate.
¶ Sin significancia estadística (p ≥ 0.05) comparado con placebo + metformina.
En otro estudio se midió la glucemia durante las 24 horas del día. Veintiocho pacientes recibieron 50 mg de sitagliptina o placebo dos veces al día durante cuatro semanas además de su tratamiento con metformina dos veces al día. Al cabo de esas cuatro semanas se determinó la diferencia en la eficacia reductora de la glucemia según el promedio ponderado de la glucemia en 24 horas, basándose en la toma de múltiples muestras de sangre, incluyendo las obtenidas antes y después de las comidas y por la noche.
En comparación con el placebo más metformina, la coadministración de 50 mg de sitagliptina dos veces al día con la metformina disminuyó significativamente (-32.8 mg/dL) el promedio ponderado de la glucemia en 24 horas, disminuyó considerablemente la glucemia en ayunas, y causó menores variaciones de la glucemia después de las tres comidas del día (Figura 3). En las mediciones de la glucemia hechas por los pacientes, el tratamiento con sitagliptina más metformina también disminuyó significativamente en comparación con el placebo más metformina el promedio de glucemia en ayunas (-20.3 mg/dL), el promedio de siete mediciones de la glucemia (-28.0 mg/dL) y la glucemia postprandial a las dos horas (-36.6 mg/dL).
Figura 3. Perfil de la glucemia plasmática durante 24 horas después de cuatro semanas de tratamiento con 50 mg diarios dos veces al día de sitagliptina y metformina o con placebo y metformina en pacientes con diabetes tipo 2†

† Pacientes con insuficiente control de la glucemia bajo monoterapia con metformina.
Tratamiento de adición de sitagliptina a pacientes controlados inadecuadamente con la combinación de glimepirida y metformina:
Un total de 441 pacientes con diabetes tipo 2 participaron en un estudio de 24 semanas, con distribución al azar, doble ciego, controlado con placebo, que se diseñó para evaluar la eficacia de sitagliptina 100 mg una vez al día en combinación con glimepirida (sola o en combinación con metformina). En este estudio 220 pacientes estuvieron en la combinación de glimepirida (≥ 4 mg diarios) y metformina (≥ 1,500 mg diarios). Los resultados de los puntos finales de glucemia, incluyendo HbA1c y glucosa en ayunas, se describen a continuación.
La combinación de sitagliptina, glimepirida y metformina, produjo, respecto al nivel basal, reducciones significativas en HbA1c (-0.89%) y GPA (-20.7 mg/dL) en comparación con placebo (véase Tabla 3). Las reducciones promedio respecto al nivel basal en HbA1c comparado con placebo en general fueron mayores en quienes tenían valores mayores de HbA1c al inicio. Los pacientes tratados con sitagliptina tuvieron un modesto incremento en el peso corporal (+1.1 kg) respecto a quienes recibieron placebo.
Tabla 3. Parámetros glucémicos y peso corporal en la visita final (Estudio de 24 semanas) para sitagliptina en combinación con glimepirida con metformina†
|
Sitagliptina 100 mg + Glimepirida + metformina |
Placebo + Glimepirida + metformina |
|
|
HbA1c (%) |
N = 115 |
N = 105 |
|
Basal (promedio) |
8.27 |
8.28 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-0.59 |
0.30 |
|
Diferencia con placebo (promedio ajustado‡) |
-0.89§ |
|
|
Pacientes (%) que alcanzó HbA1C < 7% |
26 (22.6) |
1 (1.0) |
|
GPA (mg/dL) |
N = 115 |
N = 109 |
|
Basal (promedio) |
179.3 |
178.9 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-7.8 |
12.9 |
|
Diferencia con placebo (promedio ajustado‡) |
-20.7§ |
|
|
Peso corporal (kg)% |
N = 102 |
N = 74 |
|
Basal (promedio) |
86.5 |
84.6 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
0.4 |
-0.7 |
|
Diferencia con placebo (promedio ajustado‡) |
1.1†† |
† Todos los pacientes tratados (análisis según la intención de tratar).
‡ Promedios de los mínimos cuadrados ajustados según el tratamiento hipoglucemiante y el valor basal previos.
§ p < 0.001 comparado con placebo.
% Todos los pacientes tratados, excluyendo datos posteriores al tratamiento hipoglucemiante de rescate.
†† p = 0.007 comparado con placebo.
Tratamiento combinado de adición en pacientes controlados inadecuadamente con metformina más rosiglitazona (PPAR?):
Un total de 262 pacientes con diabetes tipo 2 participaron en un estudio controlado con placebo, de 54 semanas, doble ciego, con distribución al azar diseñado para evaluar la eficacia de sitagliptina en combinación con metformina y rosiglitazona. Pacientes con control glucémico inadecuado con un esquema estable de metformina (≥ 1,500 mg diarios) y rosglitazona (≥ 4 mg diarios) fueron distribuidos al azar a la adición de 100 mg de sitagliptina o de placebo administrados una vez al día. Los parámetros glucémicos fueron evaluados en el primer punto en el tiempo de la semana 18 y a la semana 54.
En combinación con metformina y rosiglitazona, sitagliptina brindó mejorías significativas en HbA1c, GPA y GPP de 2 horas en comparación a placebo con metformina y rosiglitazona (Tabla 4, Figura 4) a la semana 18, con mejorías sostenidas hasta el final del estudio. Los efectos en los lípidos fueron generalmente neutrales. No hubo diferencias significativas entre sitagliptina y placebo en el cambio en el peso corporal.
Figura 4. Cambio promedio en HbA1c (%) respecto al inicio durante 54 semanas en un estudio de adición de sitagliptina al tratamiento de pacientes controlados inadecuadamente con metformina y rosiglitazona†

† Población de todos los pacientes tratados; Promedio de mínimos cuadrados ajustado según el tratamiento y el valor inicial basales (barras de error = error estándar).
* Adición al tratamiento en curso con metformina y rosiglitazona.
Tabla 4. Parámetros glucémicos y peso corporal en las semanas 18 y 54 (visita final) para sitagliptina en tratamiento combinado de adición a metformina y rosiglitazona†
|
Semana 18 |
Semana 54 |
|||
|---|---|---|---|---|
|
Sitagliptina 100 mg + metformina + rosiglitazona |
Placebo + metformina + rosiglitazona |
Sitagliptina 100 mg + metformina + rosiglitazona |
Placebo + metformina + rosiglitazona |
|
|
HbA1c (%) |
N = 168 |
N = 88 |
N = 168 |
N = 88 |
|
Basal (promedio) |
8.81 |
8.73 |
8.81 |
8.73 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-1.03 |
-0.31 |
-1.05 |
-0.28 |
|
Diferencia con placebo + rosiglitazona + metformina (promedio ajustado‡) |
-0.72§ |
-0.77§ |
||
|
Pacientes (%) que lograron A1C < 7% |
37 (22%) |
8 (9%) |
44 (26%) |
12 (14%) |
|
GPA (mg/dL) |
N = 169 |
N = 89 |
N = 169 |
N = 89 |
|
Basal (promedio) |
182.1 |
183.5 |
182.1 |
183.5 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-30.7 |
-11.7 |
-28.0 |
-10.7 |
|
Diferencia con placebo + rosiglitazona + metformina (promedio ajustado‡) |
-19.0§ |
-17.4§ |
||
|
GPP 2 horas (mg/dL) |
N = 142 |
N = 75 |
N = 147 |
N = 77 |
|
Basal (promedio) |
257.8 |
249.5 |
256.6 |
247.7 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-59.9 |
-22.0 |
-50.7 |
-16.6 |
|
Diferencia con placebo + rosiglitazona + metformina (promedio ajustado‡) |
-37.9§ |
-34.1§ |
||
|
Peso corporal (kg)% |
N = 157 |
N = 79 |
N = 115 |
N = 40 |
|
Basal (promedio) |
82.1 |
87.0 |
82.0 |
85.6 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
0.5 |
0.2 |
1.9 |
1.3 |
|
Diferencia con placebo + rosiglitazona + metformina (promedio ajustado‡) |
0.3¶ |
0.6¶ |
||
† Población de todos los pacientes tratados (análisis de intención de tratar).
‡ Promedio de mínimos cuadrados ajustado según el tratamiento hipoglucemiante y el valor basal previos.
§ p < 0.001 comparado con placebo + metformina + rosiglitazona.
% Todos los pacientes tratados, excluyendo datos posteriores al tratamiento glucémico de rescate.
¶ Sin diferencia estadísticamente significativa (p ≥ 0.05) comparado con placebo + metformina + rosiglitazona.
Estudio de sitagliptina en combinación con metformina y un agonista de PPAR?:
Se diseñó un estudio controlado con placebo de 26 semanas para evaluar la eficacia y seguridad de sitagliptina (100 mg una vez al día) añadida a la combinación de pioglitazona y metformina. La adición de sitagliptina a pioglitazona y metformina proporcionó mejoras significativas en los parámetros glucémicos. El cambio desde el inicio en el peso corporal fue similar para los pacientes tratados con sitagliptina en relación con placebo. La incidencia de hipoglucemia también fue similar en pacientes tratados con sitagliptina o placebo.
Tratamiento combinado de adición de sitagliptina en pacientes controlados inadecuadamente con la combinación de metformina e insulina:
Un total de 641 pacientes con diabetes tipo 2 participaron en un estudio controlado con placebo, doble ciego, con distribución al azar, de 24 semanas diseñado para evaluar la eficacia de sitagliptina 100 mg una vez al día en combinación con una dosis estable de insulina. Aproximadamente 75% de los pacientes estaban también tomando metformina. Pacientes con insulina premezclada, de acción larga o de acción intermedia (con o sin metformina), fueron distribuidos al azar para que se les añadiera sitagliptina 100 mg o placebo. Los puntos finales glucémicos incluyeron HbA1c, glucosa en ayunas y glucosa postprandial de 2 horas.
La combinación de sitagliptina, metformina e insulina proporcionó mejorías significativas en HbA1c, glucosa en ayunas y glucosa postprandial de 2 horas comparado con placebo (Tabla 5). La mejoría en HbA1c comparado con placebo fue generalmente consistente entre los subgrupos definidos por sexo, edad, raza, IMC inicial, tiempo desde el diagnóstico de diabetes, presencia de síndrome metabólico, e índices estándar de resistencia la insulina (HOMA-IR) y de secreción de insulina (HOMA-β). No hubo diferencias importantes en el peso corporal respecto al inicio entre los grupos.
Tabla 5. Parámetros glucémicos y peso corporal en la Visita Final (Estudio de 24 semanas) para sitagliptina en tratamiento combinado de adición con metformina y una dosis estable de insulina†
|
Sitagliptina 100 mg + insulina + metformina |
Placebo + insulina + metformina |
|
|
HbA1c (%) |
N = 223 |
N = 229 |
|
Basal (promedio) |
8.73 |
8.60 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-0.66 |
-0.13 |
|
Diferencia vs. placebo (promedio ajustado‡,§) |
-0.53% |
|
|
Pacientes (%) que lograron la meta HbA1c < 7% |
32 (14.3) |
12 (5.2) |
|
GPA (mg/dL) |
N = 225 |
N = 229 |
|
Basal (promedio) |
173.5 |
175.6 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-22.2 |
-3.9 |
|
Diferencia vs. placebo (promedio ajustado‡) |
-18.3% |
|
|
GPP de 2 horas (mg/dL) |
N = 182 |
N = 189 |
|
Basal (promedio) |
280.7 |
280.6 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-39.0 |
1.5 |
|
Diferencia vs. placebo (promedio ajustado‡) |
-40.4% |
|
|
Peso corporal (kg)¶ |
N = 201 |
N = 200 |
|
Basal (promedio) |
87.9 |
88.0 |
|
Cambio respecto al valor basal (promedio ajustado‡) |
-0.1 |
0.0 |
|
Diferencia vs. placebo (promedio ajustado‡) |
-0.1# |
† Población de todos los pacientes tratados (análisis de intención de tratar).
‡ Promedio de mínimos cuadrados ajustado a uso de insulina en la Visita 1 (premezclada vs. no premezclada [acción intermedia o larga]), y valor inicial.
§ El tratamiento por interacción de estratos con insulina no fue significativo (p > 0.10).
% p < 0.001 comparado con placebo.
¶ Todos los pacientes tratados, excluyendo datos posteriores al tratamiento glucémico de rescate.
# Sin diferencia estadística significativa (p ≥ 0.05) comparado con placebo.
En otro estudio de 24 semanas, aleatorizado, doble-ciego, controlado con placebo, para evaluar la eficacia de la sitagliptina añadida a la insulina como terapia combinada, 660 pacientes con control glicémico inadecuado usando insulina glargina con o sin metformina (≥ 1,500 mg al día) fueron aleatorizados a la adición ya sea de 100 mg de sitagliptina (N = 330) o placebo (N = 330), administrados una vez al día mientras experimentaban intensificación de la terapia con insulina. Entre los pacientes que tomaban metformina, el valor inicial de HbA1c fue de 8.70% y la dosis inicial de insulina era 37 UI/día. Los pacientes recibieron instrucciones para calibrar su dosis de insulina glargina con base en los valores obtenidos de glucosa en ayuno con prueba por punción capilar. Los puntos finales glucémicos medidos incluyeron HbA1c y a FPG.
Entre los pacientes que tomaban metformina, en la semana 24, el aumento en la dosis diaria de insulina fue 21% menor en los pacientes tratados con sitagliptina (19UI/día, N = 285) que en los pacientes tratados con placebo (24 UI/día, N = 283). La diferencia en la dosis de insulina (-5 UI/día) fue estadísticamente significativa (p = 0.007). La reducción de HbA1c para pacientes tratados con sitagliptina, metformina, e insulina fue -1.35% comparado con -0.90% para pacientes tratados con placebo, metformina, e insulina, una diferencia de -0.45% [95% CI: -0.62, -0.29]. La reducción de FPG para pacientes tratados con sitagliptina, metformina, e insulina fue -54.8 mg/dL comparada con -43.0 mg/dL para pacientes tratados con placebo, metformina, e insulina, una diferencia de -11.8 mg/dL [95% CI: -18.7, -4.9]. La incidencia de hipoglucemia fue 24.9% para pacientes tratados con sitagliptina, metformina, e insulina y 37.8% para pacientes tratados con placebo, metformina e insulina. La diferencia en la incidencia de hipoglucemia (-12.9%) fue estadísticamente significativa (p < 0.001). La diferencia se debió principalmente a un mayor porcentaje de pacientes en el grupo placebo que experimentaron 3 o más episodios de hipoglucemia (9.1 vs. 19.8 %). No hubo diferencia en la incidencia de hipoglucemia grave.
Metformina:
El estudio prospectivo con distribución al azar UKPDS (United Kingdom Prospective Diabetes Study) ha demostrado el beneficio a largo plazo del control intensivo de la glucemia en la diabetes tipo 2. El análisis de los resultados obtenidos en pacientes obesos tratados con metformina después de haber fracasado el tratamiento con dieta sola mostró:
• Una disminución significativa del riesgo absoluto de cualquier complicación relacionada con la diabetes en el grupo de metformina (29.8 casos/1,000 pacientes-años) en comparación con la dieta sola (43.3 casos/1,000 pacientes-años), p = 0.0023 y en comparación con los grupos de monoterapia con sulfonilurea y con insulina combinados (40.1 casos/1,000 pacientes-años) (p = 0.0034).
• Una disminución significativa del riesgo absoluto de mortalidad relacionada con la diabetes: metformina, 7.5 muertes/1,000 pacientes-años; dieta sola, 12.7 muertes/1,000 pacientes-años (p = 0.017).
• Una disminución significativa del riesgo absoluto de mortalidad total: metformina, 13.5 muertes/1,000 pacientes-años, en comparación con la dieta sola (20.6 muertes/1,000 pacientes-años) (p = 0.011), y en comparación con los grupos de monoterapia con sulfonilurea y con insulina combinados (18.9 muertes/1,000 pacientes-años) (p = 0.021).
• Una disminución significativa del riesgo absoluto de infarto del miocardio: metformina, 11 casos/1,000 pacientes-años; dieta sola, 18 casos/1,000 pacientes-años (p = 0.01).
Estudio de Seguridad Cardiovascular TECOS:
El Estudio de Evaluación de Desenlaces Cardiovasculares (TECOS, por las siglas en inglés para Trial Evaluating Cardiovascular Outcomes with sitagliptin) fue un estudio aleatorizado en 14,671 pacientes de la población por intención de tratar con una HbA1c de ≥ del 6.5 al 8.0% con enfermedad CV establecida que recibieron sitagliptina (7,332) 100 mg diarios (o 50 mg diarios si la TFGe basal fue ≥ 30 y < 50 ml/min/1.73 m2) o placebo (7,339) añadidos al cuidado usual, apuntando a estándares regionales para HbA1c y factores de riesgo CV. No se incluyeron en el estudio pacientes con una TFG estimada < 30 mL/min/1.73 m2. La población de estudio incluyó a 2,004 pacientes ≥ 75 años de edad y 3,324 pacientes con insuficiencia renal (TFG estimada < 60 mL/min/1.73 m2).
Durante el curso del estudio, la diferencia promedio global estimada (SD) en HbA1c entre los grupos sitagliptina y placebo fue de 0.29% (0.01), 95% IC (-0.32, -0.27); p < 0.001. Los pacientes en el grupo sitagliptina recibieron menos agentes hipoglucemiantes que los del grupo placebo (razón de riesgo 0.72, 95% IC, 0.68 a 0.77; p ≤ 0.001) y, entre los pacientes sin insulina a la entrada al estudio, hubo menor probabilidad de iniciar tratamiento crónico con insulina (razón de riesgo 0.70, 95% IC, 0.63 a 0.79; p < 0.001).
El criterio de valoración cardiovascular primario fue un compuesto de la primera aparición de muerte cardiovascular, infarto de miocardio no mortal, accidente cerebrovascular no mortal u hospitalización por angina inestable. Los criterios de valoración cardiovasculares secundarios incluyeron la primera aparición de muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal; primera aparición de los componentes individuales del compuesto primario; mortalidad por todas las causas; y los ingresos hospitalarios por insuficiencia cardíaca congestiva.
Tras una mediana de seguimiento de 3 años, sitagliptina, añadido al tratamiento habitual, no aumentó el riesgo de acontecimientos cardiovasculares adversos importantes o el riesgo de hospitalización por insuficiencia cardiaca comparado con el tratamiento habitual sin sitagliptina en pacientes con diabetes tipo 2 (Tabla 6).
Tabla 6. Tasas de Desenlaces Cardiovasculares Compuestos y Desenlaces Secundarios Clave
|
Sitagliptina 100 mg |
Placebo |
Razón de riesgo (95% CI) |
Valor de P† |
|||
|
N (%) |
Tasa de incidencia por 100 pacientes-años* |
N (%) |
Tasa de incidencia por 100 pacientes años* |
|||
|
Análisis en la población por protocolo |
||||||
|
Número de pacientes |
7,257 |
7,266 |
0.98 (0.88-1.09) |
< 0.001 |
||
|
Punto final primario compuesto |
||||||
|
(Muerte cardiovascular, infarto al miocardio no fatal, apoplejía no fatal, u hospitalización por angina inestable) |
695 (9.6) |
3.7 |
695 (9.6) |
3.8 |
||
|
Punto final secundario compuesto |
||||||
|
(Muerte cardiovascular, infarto al miocardio no fatal, o apoplejía no fatal) |
609 (8.4) |
3.2 |
602 (8.3) |
3.3 |
0.99 (0.89-1.11) |
< 0.001 |
|
Análisis en la población de intención de tratar |
||||||
|
Número de pacientes |
7,332 |
7,339 |
0.98 (0.89-1.08) |
< 0.001 |
||
|
Punto final primario compuesto |
||||||
|
(Muerte cardiovascular, infarto al miocardio no fatal, apoplejía no fatal, u hospitalización por angina inestable) |
839 (11.4) |
4.1 |
851 (11.6) |
4.2 |
||
|
Punto final secundario compuesto |
0.99 (0.89-1.10) |
< 0.001 |
||||
|
(Muerte cardiovascular, infarto al miocardio no fatal, o apoplejía no fatal) |
745 (10.2) |
3.6 |
746 (10.2) |
3.6 |
||
|
Desenlace secundario |
||||||
|
Muerte cardiovascular |
380 (5.2) |
1.7 |
366 (5.0) |
1.7 |
1.03 (0.89-1.19) |
0.711 |
|
Todos los infartos al miocardio (fatales y no fatales) |
300 (4.1) |
1.4 |
316 (4.3) |
1.5 |
0.95 (0.81-1.11) |
0.487 |
|
Todas las apoplejías (fatales y no fatales) |
178 (2.4) |
0.8 |
183 (2.5) |
0.9 |
0.97 (0.79-1.19) |
0.760 |
|
Hospitalización por angina inestable |
116 (1.6) |
0.5 |
129 (1.8) |
0.6 |
0.90 (0.70-1.16) |
0.419 |
|
Muerte por cualquier causa |
547 (7.5) |
2.5 |
537 (7.3) |
2.5 |
1.01 (0.90-1.14) |
0.875 |
|
Hospitalización por insuficiencia cardiaca‡ |
228 (3.1) |
1.1 |
229 (3.1) |
1.1 |
1.00 (0.83-1.20) |
0.983 |
* Tasa de incidencia por 100 pacientes-años calculada como 100 x (número total de pacientes con ≥ 1 evento durante el periodo de exposición elegible por total de pacientes-años de seguimiento).
† Basado en un modelo estratificado de Cox por región. Para puntos finales compuestos, el valor de p corresponde a una prueba de no inferioridad que buscó mostrar que la razón de riesgo es menor de 1.3. Para los demás puntos finales, los valores de p corresponden a una prueba de diferencias en las razones de riesgo.
‡ El análisis de hospitalización por insuficiencia cardiaca se ajustó por antecedentes de insuficiencia cardiaca a nivel basal.
Población pediátrica:
La seguridad y eficacia de la adición de sitagliptina en pacientes pediátricos de 10 a 17 años de edad con diabetes tipo 2 y control glucémico inadecuado con metformina con o sin insulina se evaluó en dos estudios durante 54 semanas. La adición de sitagliptina (administrada como sitagliptina + metformina o sitagliptina + metformina de liberación prolongada [XR]) se comparó con la adición de placebo a metformina o metformina XR.
Aunque se demostró la superioridad de la reducción de HbA1c para sitagliptina + metformina/sitagliptina + metformina XR sobre metformina en la semana 20 en el análisis agrupado de estos dos estudios, los resultados de los estudios individuales fueron inconsistentes. Además, no se observó una mayor eficacia para sitagliptina + metformina/sitagliptina + metformina XR en comparación con metformina en la semana 54. Por lo tanto, sitagliptina/metformina no debe utilizarse en pacientes pediátricos de 10 a 17 años de edad debido a una eficacia insuficiente.
Propiedades farmacocinéticas:
Las siguientes afirmaciones reflejan las propiedades farmacocinéticas de los principios activos individuales de sitagliptina metformina.
Absorción:
Sitagliptina/Metformina:
Posterior a la ingesta de las tabletas de Sitagliptina/Metformina con un desayuno alto en grasas, el grado total de exposición (ABC) y la tasa de absorción (Cmáx y Tmáx) para sitagliptina no se alteraron en comparación con el estado de ayuno. Posterior a la ingesta de tabletas de Sitagliptina/Metformina con un desayuno alto en grasas, el ABC y Cmáx de metformina disminuyeron en 6% y 28% respectivamente, y el Tmáx ocurrió aproximadamente 1.5 horas más tarde, en relación con el estado de ayuno.
Sitagliptina:
Tras la administración oral de una dosis de 100 mg a sujetos sanos, sitagliptina se absorbió rápidamente, con concentraciones plasmáticas máximas (mediana de Tmáx) de 1 a 4 horas después de la dosis, el AUC plasmático medio de sitagliptina fue de 8.52 μM• h, Cmáx fue de 950 nM. La biodisponibilidad absoluta de sitagliptina es de aproximadamente el 87%. Dado que la administración concomitante de una comida rica en grasas con sitagliptina no tuvo ningún efecto sobre la farmacocinética, la sitagliptina puede administrarse con o sin alimentos.
El AUC plasmático de sitagliptina aumentó de manera proporcional a la dosis. No se estableció la proporcionalidad de la dosis para Cmáx y C24 h (Cmáx aumentó de una manera mayor que la dosis proporcional y C24 h aumentó de una manera menor que la dosis-proporcional). Metformina:
Después de una dosis oral de metformina, el Tmáx es de 2.5 h. La biodisponibilidad absoluta de un comprimido de 500 mg de metformina administrado en ayunas es de 50%-60%, aproximadamente. Después de una dosis oral, la fracción no absorbida recuperada en las heces fue del 20%-30 %. Los estudios con dosis orales únicas de tabletas de metformina de 500 a 1,500 mg y de 850 a 2,550 mg indican que el efecto no es proporcional al incremento de las dosis, lo cual se debe a una disminución de la absorción y no a una alteración en la eliminación. La presencia de alimentos disminuye y retarda ligeramente la absorción de la metformina, como muestran una disminución de 40% aproximadamente en su concentración plasmática máxima (Cmáx), una disminución de 25% del ABC de concentración plasmática y un aumento de 35 minutos del tiempo para alcanzar la concentración máxima plasmática (Tmáx) tras la administración de un solo comprimido de 850 mg de metformina con alimentos, en comparación con la administración de esa misma dosis en ayunas. Se desconoce la importancia clínica de estas disminuciones.
Los alimentos bajos y altos en grasa incrementaron la exposición sistémica (medido por el ABC) de las tabletas de Glumetza alrededor de un 38% y 73%, respectivamente, en relación con el ayuno. Ambos alimentos prolongaron el Tmáx de metformina en aproximadamente 3 horas, pero la Cmáx no fue afectada.
Distribución:
Sitagliptina:
El volumen de distribución promedio en estado de equilibrio tras una dosis única intravenosa de sitagliptina a personas sanas es de 198 litros aproximadamente. La porción de sitagliptina que se une reversiblemente a las proteínas plasmáticas es baja (38%).
Metformina:
El volumen aparente de distribución (V/F) de la metformina tras la administración única de tabletas con 850 mg de metformina fue en promedio de 654 ± 358 litros. A diferencia de las sulfonilureas, que se unen en más de 90% a las proteínas plasmáticas, la metformina se une escasamente a éstas. Parte de la metformina penetra en los eritrocitos, muy probablemente en función del tiempo. A las dosis clínicas y horarios de administración usuales de las tabletas de metformina, las concentraciones plasmáticas máximas de metformina en el estado de equilibrio se alcanzan en 24 a 48 horas y son generalmente menores de 1 μg/mL. Durante los estudios clínicos controlados de metformina, sus concentraciones plasmáticas máximas no fueron mayores de 5 μg/mL, aun con las dosis máximas.
Metabolismo:
Sitagliptina:
La sitagliptina se elimina principalmente sin cambios en la orina, y el metabolismo es una vía menor Aproximadamente el 79% de sitagliptina se excreta sin cambios en la orina.
Después de una dosis oral de sitagliptina [14C], aproximadamente el 16% de la radiactividad se excretó como metabolitos de la sitagliptina. Se detectaron seis metabolitos a niveles traza y no se espera que contribuyan a la actividad plasmática inhibidora de la Sitaglipina. Los estudios in vitro indicaron que la enzima principal responsable del metabolismo limitado de la sitagliptina fue CYP3A4, con contribución de CYP2C8.
Los datos in vitro mostraron que la sitagliptina no es un inhibidor de las isoenzimas CYP CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 o 2B6, y no es un inductor de CYP3A4 y CYP1A2.
Metformina:
Los estudios con dosis únicas por vía intravenosa en sujetos normales demostraron que la metformina es excretada sin cambio en la orina y no es metabolizada en el hígado (no se ha identificado ningún metabolito en los seres humanos) ni excretada con la bilis.
Eliminación:
Sitagliptina:
Tras la administración de una dosis oral de sitagliptina a sujetos sanos, aproximadamente el 100% de la radiactividad administrada se eliminó en las heces (13%) o en la orina (87%) en el plazo de una semana a partir de la administración. La t1/2 terminal aparente después de una dosis oral de 100 mg de sitagliptina fue de aproximadamente 12.4 horas. La sitagliptina se acumula sólo mínimamente con dosis múltiples. El aclaramiento renal fue de aproximadamente 350 mL/min.
La eliminación de sitagliptina se produce principalmente a través de la excreción renal e implica la secreción tubular activa. La sitagliptina es un sustrato para el transportador de aniones orgánicos humanos 3 (hOAT-3), que puede estar implicado en la eliminación renal de la sitagliptina. No se ha establecido la relevancia clínica de hOAT-3 en el transporte de sitagliptina. La sitagliptina es también un sustrato de la glicoproteína p, que también puede estar implicada en la mediación de la eliminación renal de la sitagliptina. Sin embargo, la ciclosporina, un inhibidor de la p-glicoproteína, no redujo el aclaramiento renal de la sitagliptina. La sitagliptina no es un sustrato para transportadores OCT2 u OAT1 o PEPT1/2. In vitro, sitagliptina no inhibió el transporte mediado por OAT3 (IC50=160 μM) o p-glicoproteína (hasta 250 μM) a concentraciones plasmáticas terapéuticamente relevantes. En un estudio clínico, la sitagliptina tuvo un pequeño efecto sobre las concentraciones plasmáticas de digoxina, lo que indica que la sitagliptina puede ser un inhibidor leve de la glicoproteína-p.
Metformina:
La depuración renal de la metformina es aproximadamente 3.5 veces mayor que la de la creatinina, lo cual indica que la secreción tubular es la principal vía de eliminación de la metformina. Tras la administración por vía oral, aproximadamente 90% del medicamento absorbido es eliminado por la vía renal en las primeras 24 horas, con una vida media de eliminación plasmática de 6.2 horas aproximadamente. En la sangre, la vida media de eliminación es de unas 17.6 horas aproximadamente, lo cual sugiere que la masa eritrocitaria puede ser un compartimiento de distribución del fármaco.
Características en pacientes:
Diabetes tipo 2:
Sitagliptina:
La farmacocinética de la sitagliptina es generalmente similar en los pacientes con diabetes tipo 2 y en los sujetos sanos.
Metformina:
Si la función renal es normal, no hay ninguna diferencia en la farmacocinética de la metformina administrada en dosis únicas o múltiples entre los pacientes con diabetes tipo 2 y los sujetos.
Insuficiencia renal:
Sitagliptina:
Se realizó un estudio abierto de dosis única para evaluar la farmacocinética de una dosis reducida de sitagliptina (50 mg) en pacientes con diversos grados de insuficiencia renal crónica en comparación con sujetos control sanos normales. El estudio incluyó pacientes con insuficiencia renal leve, moderada y grave, así como pacientes con ERT en hemodiálisis. Además, los efectos de la insuficiencia renal sobre la farmacocinética de sitagliptina en pacientes con diabetes tipo 2 e insuficiencia renal leve, moderada o grave (incluida la ERT) se evaluaron mediante análisis farmacocinéticos poblacionales.
En comparación con los sujetos control sanos normales, el AUC plasmático de sitagliptina aumentó aproximadamente 1.2 veces y 1.6 veces en pacientes con insuficiencia renal leve (TFG ≥ 60 a < 90 ml/min) y pacientes con insuficiencia renal moderada (TFG ≥ 45 a < 60 ml/min), respectivamente. Debido a que los aumentos de esta magnitud no son clínicamente relevantes, no es necesario ajustar la dosis en estos pacientes.
En comparación con los sujetos con función renal normal, los pacientes con insuficiencia renal moderada (TFG ≥ 30 a < 45 ml/min), el ABC plasmática de la sitagliptina aumentó aproximadamente al doble y aproximadamente 4 veces en los pacientes con en los pacientes con insuficiencia renal grave (TFGe < 30 mL/min/1.73 m2) incluyendo a los pacientes con nefropatía terminal bajo tratamiento con hemodiálisis.
La sitagliptina se eliminó moderadamente mediante hemodiálisis (13.5% durante una sesión de hemodiálisis de 3 a 4 horas a partir de 4 horas después de la dosis).
Metformina:
En los pacientes con disminución de la función renal, aumenta la vida media plasmática y sanguínea de la metformina y disminuye su depuración renal (véase Contraindicaciones y Precauciones generales). Insuficiencia hepática:
Sitagliptina:
No es necesario ajustar la dosis de sitagliptina en pacientes con insuficiencia hepática leve o moderada (puntuación de Child-Pugh ≤ 9), tras la administración de una dosis única de 100 mg de sitagliptina, los promedios de ABC y de Cmáx de sitagliptina fueron aproximadamente 21% y 13% mayores, respectivamente, que en los testigos sanos. Esas diferencias no se consideran clínicamente importantes.
No hay experiencia clínica en pacientes con insuficiencia hepática grave (puntuación de Child-Pugh > 9). Sin embargo, debido a que la sitagliptina se elimina principalmente por vía renal, no se espera que la insuficiencia hepática grave afecte a la farmacocinética de la sitagliptina.
Metformina:
No se han hecho estudios sobre la farmacocinética de la metformina en pacientes con insuficiencia hepática. Sexo:
Sitagliptina:
Basándose en un análisis compuesto de los datos farmacocinéticas de la Fase I y en un análisis farmacocinético de población de los datos de las Fases I y II, el sexo no tuvo ningún efecto de importancia clínica sobre la farmacocinética de la sitagliptina.
Metformina:
Los parámetros farmacocinéticos de la metformina no difirieron significativamente entre las personas normales y los pacientes con diabetes tipo 2 cuando se analizaron según el sexo, y en los estudios clínicos controlados en pacientes con diabetes tipo 2 el efecto hipoglucemiante de la metformina fue similar en los hombres y en las mujeres.
Pacientes de edad avanzada:
Sitagliptina:
Según un análisis farmacocinético de población de los datos de las Fases I y II, la edad no tuvo un efecto de importancia clínica sobre la farmacocinética de la sitagliptina. Las personas de edad avanzada (65 a 80 años) tuvieron concentraciones plasmáticas de sitagliptina aproximadamente 19% mayores que en sujetos de menor edad.
Metformina:
Datos limitados de estudios farmacocinéticos controlados de metformina sanos sugieren que en éstas está disminuida la depuración plasmática total de la metformina y aumentadas su vida media y su Cmáx en comparación con personas jóvenes sanas. Según estos datos, el cambio en la farmacocinética de la metformina al aumentar la edad es debido principalmente al cambio en la función renal.
Población pediátrica:
Sitagliptina/Metformina:
La farmacocinética de sitagliptina (dosis única de 50 mg, 100 mg o 200 mg) se investigó en pacientes pediátricos (10 a 17 años de edad) con diabetes tipo 2. En esta población, el AUC ajustado a la dosis de sitagliptina en plasma fue aproximadamente un 18% menor en comparación con los pacientes adultos con diabetes tipo 2 para una dosis de 100 mg. No se han realizado estudios con sitagliptina en pacientes pediátricos < 10 años de edad.
Raza:
Sitagliptina:
Basándose en un análisis compuesto de los datos farmacocinéticos de la Fase I y en un análisis farmacocinético de población de los datos de las Fases I y II que incluyeron personas de razas blanca y negra, hispanoamericanos, asiáticos y de otros grupos raciales, la raza no tuvo ningún efecto de importancia clínica sobre la farmacocinética de la sitagliptina.
Metformina:
No se han hecho estudios de los parámetros farmacocinéticos de la metformina según la raza. En estudios clínicos controlados de metformina en pacientes con diabetes tipo 2, su efecto hipoglucemiante fue similar en blancos (n = 249), negros (n = 51) e hispanoamericanos (n = 24).
Índice de masa corporal:
Sitagliptina/Metformina:
No se necesita realizar ajuste de la dosis en función del género o el índice de masa corporal (IMC) de los pacientes. Estas características no tuvieron efecto clínicamente importante sobre la farmacocinética de la sitagliptina de acuerdo con un análisis farmacocinético combinado de los datos obtenidos en fase I y con un análisis farmacocinético poblacional de los datos obtenidos en fase I y fase II.
CONTRAINDICACIONES:
Sitagliptina/Metformina está contraindicado en pacientes con:
1. Insuficiencia renal severa (TFGe < 30 mL/min/1.73 m2) (véase Precauciones generales, metformina, insuficiencia renal).
2. Hipersensibilidad conocida a los principios activos o a los componentes de la fórmula (véase precauciones generales, sitagliptina, reacciones de hipersensibilidad y reacciones secundarias y adversas, experiencia después de la comercialización).
3. Problemas agudos con capacidad para alterar la función renal, como:
• Deshidratación.
• Infección grave.
• Shock.
• Administración intravascular de agentes de contraste yodados.
• Enfermedad aguda o crónica que puede producir hipoxia tisular, como:
• Insuficiencia cardiaca o respiratoria.
• Infarto de miocardio reciente.
• Shock.
• Insuficiencia hepática.
• Intoxicación aguda por alcohol, alcoholismo.
• Lactancia.
4. Acidosis metabólica aguda o crónica, incluyendo cetoacidosis diabética, con o sin coma.
5. Se debe suspender temporalmente la administración de Sitagliptina/Metformina en los pacientes que van a ser sometidos a estudios radiológicos con administración intravascular de medios de contraste yodados, porque éstos pueden causar alteraciones agudas de la función renal (véase Precauciones generales).
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Embarazo:
No hay datos adecuados sobre el uso de sitagliptina en mujeres embarazadas. Los estudios en animales han mostrado toxicidad para la reproducción a dosis altas de sitagliptina.
Una cantidad limitada de datos sugiere que el uso de metformina en mujeres embarazadas no se asocia con un mayor riesgo de malformaciones congénitas. Los estudios en animales con metformina no indican efectos perjudiciales con respecto al embarazo, el desarrollo embrionario o fetal, el parto o el desarrollo posnatal.
Sitagliptina/Metformina no debe usarse durante el embarazo. Si una paciente desea quedar embarazada o si se produce un embarazo, el tratamiento debe interrumpirse y la paciente debe cambiar al tratamiento con insulina lo antes posible.
Sitagliptina:
La sitagliptina no fue teratogénica en ratas a dosis orales de hasta 250 mg/kg ni en conejas que recibieron hasta 125 mg/kg durante la organogénesis (dosis hasta 32 y 22 veces mayores, respectivamente, que la exposición en seres humanos, basándose en la dosis diaria recomendada en adultos de 100 mg diarios). En las ratas aumentó ligeramente la incidencia de malformaciones costales en los fetos (costillas ausentes, hipoplásicas u onduladas) con la dosificación de 1,000 mg/kg/día (aproximadamente 100 veces mayor que la exposición en seres humanos, basándose en la dosis diaria recomendada en adultos de 100 mg diarios). En las crías de las ratas que recibieron dosis orales de 1,000 mg/kg/día se observó una pequeña disminución del promedio de peso corporal antes del destete en ambos sexos y del promedio de aumento de peso después del destete en los machos. Sin embargo, los estudios de reproducción en animales no siempre pronostican la respuesta en los seres humanos.
Metformina:
La metformina no fue teratogénica en ratas y conejas a dosificaciones de hasta 600 mg/kg/día, que representan una exposición aproximadamente dos y seis veces mayor, respectivamente, que la producida por la dosis diaria máxima recomendada en los seres humanos de 2,000 mg, basándose en el área de superficie corporal. Las concentraciones en los fetos demostraron una barrera placentaria parcial contra la metformina.
Lactancia:
No se han hecho estudios en hembras lactantes con los componentes combinados de Sitagliptina/Metformina. En estudios realizados con los componentes individuales, tanto la sitagliptina como la metformina fueron secretadas en la leche de las ratas lactantes. No se sabe si la sitagliptina es secretada en la leche humana. Por lo tanto, no se debe administrar Sitagliptina/Metformina a una mujer que está amamantando.
REACCIONES SECUNDARIAS Y ADVERSAS:
Resumen del perfil de seguridad:
En estudios clínicos controlados con placebo en pacientes con diabetes mellitus tipo 2, la combinación de sitagliptina y metformina generalmente fue bien tolerada. La incidencia general de reacciones secundarias reportada por los pacientes que recibieron la combinación de sitagliptina y metformina fue similar a la reportada por los pacientes que recibieron la combinación de placebo y metformina.
Se han notificado reacciones adversas graves incluyendo pancreatitis y reacciones de hipersensibilidad. Se ha notificado hipoglucemia en combinación con sulfonilurea (13.8%) e insulina (10.9%).
Sitagliptina/Metformina:
Las reacciones adversas se enumeran a continuación como término preferido de MedDRA por sistema de clasificación de órganos y frecuencia absoluta (Tabla 7). Las frecuencias se definen como: muy frecuentes (≥ 1/10); frecuentes (≥ 1/100 a < 1/10); poco frecuentes (≥ 1/1,000 a < 1/100); raras (≥ 1/10,000 a < 1/1,000); muy raros (< 1/10,000) y no conocidos (no pueden estimarse a partir de los datos disponibles).
La frecuencia de reacciones adversas identificadas a partir de estudios clínicos controlados con placebo de sitagliptina y metformina solas, y la experiencia posterior a la comercialización.
Trastornos de la sangre y del sistema linfático: Raros: Trombocitopenia
Trastornos del sistema inmunitario:
Frecuencia no conocida: Reacciones de hipersensibilidad incluyendo respuestas anafilácticas*,†
Trastornos del metabolismo y la nutrición:
Frecuentes: Hipoglucemia†
Trastornos del sistema nervioso:
Poco frecuentes: Somnolencia
Trastornos respiratorios, torácicos y mediastínicos: Frecuencia no conocida: Enfermedad pulmonar intersticial*
Trastornos gastrointestinales:
Frecuentes: Náuseas, flatulencia, vómitos
Poco frecuentes: Diarrea, estreñimiento, dolor abdominal superior
Frecuencia no conocida: Pancreatitis aguda*,†,‡, pancreatitis hemorrágica y necrotizante mortal y no mortal*,† Trastornos de la piel y del tejido subcutáneo:
Poco frecuentes: Prurito*
Frecuencia no conocida: Angioedema *,†, erupción cutánea*,†, urticaria*,†, vasculitis cutánea*,†, afecciones exfoliativas de la piel incluyendo el síndrome de Stevens-Johnson*,†, penfigoide ampolloso*
Trastornos musculoesqueléticos y del tejido conectivo:
Frecuencia no conocida: artralgia*, mialgia*, dolor en las extremidades*, dolor de espalda*, artropatía
Trastornos renales y urinarios:
Frecuencia no conocida: deterioro de la función renal*, insuficiencia renal aguda*
Las reacciones adversas se identificaron a través de la vigilancia posterior a la comercialización.
‡ Consulte el Estudio de seguridad cardiovascular de TECOS a continuación.
Descripción de reacciones adversas seleccionadas: Algunas reacciones adversas se observaron con mayor frecuencia en los estudios de uso combinado de sitagliptina y metformina con otros medicamentos antidiabéticos que en los estudios de sitagliptina y metformina en monoterapia. Reacciones adversas como hipoglucemia (muy frecuentes con sulfonilurea o insulina), estreñimiento (frecuentes con sulfonilurea), edema periférico (frecuentes con pioglitazona) y cefalea y sequedad de boca (poco frecuentes con insulina). Pancreatitis:
En un análisis combinado de 19 estudios clínicos doble ciego que incluyó datos de 10,246 pacientes distribuidos al azar a recibir sitagliptina 100 mg/día (N = 5,429) o el correspondiente control (tratamiento activo o placebo), (N = 4,817), la incidencia de eventos no adjudicados de pancreatitis aguda fue 0.1 por 100 años-paciente en cada grupo (4 pacientes con un evento en 4,708 años-paciente para sitagliptina y 4 pacientes con un evento en 3,942 años-paciente para el grupo control).
Sitagliptina/Metformina:
Tratamiento combinado con sitagliptina y metformina (Tratamiento Inicial):
En un estudio factorial de 24 semanas, controlado con placebo, de tratamiento inicial con sitagliptina 50 mg dos veces al día en combinación con metformina 500 o 1,000 mg dos veces al día, los eventos adversos relacionados con el medicamento reportados por ≥ 1% (y mayor a los que recibieron placebo) de los pacientes que recibieron el tratamiento combinado se muestran en la Tabla 7.
Tabla 7. Tratamiento inicial con la combinación de sitagliptina y metformina: reacciones adversas relacionadas con el medicamento reportadas en ≥ 1% de los pacientes (y mayor a los que recibieron placebo), de los pacientes que recibieron el tratamiento combinado†
|
Número de pacientes (%) |
||||
|
Placebo |
Sitagliptina 100 mg una vez al día |
Metformina 500 o 1000 mg b.i.d.†† |
Sitagliptina 50 mg b.i.d. + metformina 500 o 1000 mg b.i.d.†† |
|
|
N = 176 |
N = 179 |
N = 364 |
N = 372 |
|
|
Diarrea |
2 (1.1) |
0 (0.0) |
12 (3.3) |
13 (3.5) |
|
Náusea |
1 (0.6) |
0 (0.0) |
9 (2.5) |
6 (1.6) |
|
Dispepsia |
0 (0.0) |
0 (0.0) |
4 (1.1) |
5 (1.3) |
|
Flatulencia |
0 (0.0) |
0 (0.0) |
2 (0.5) |
5 (1.3) |
|
Vómito |
0 (0.0) |
0 (0.0) |
1 (0.3) |
4 (1.1) |
|
Cefalea |
0 (0.0) |
1 (0.6) |
4 (1.1) |
5 (1.3) |
|
Hipoglucemia |
0 (0.0) |
1 (0.6) |
2 (0.5) |
4 (1.1) |
† Población intención de tratar
†† Datos combinados de los pacientes que recibieron las dosis menores y máximas de metformina.
Tratamiento combinado de adición a metformina:
En un estudio de 24 semanas, controlado con placebo, en el que se añadió sitagliptina a tratamiento en curso con metformina, 464 pacientes recibieron metformina y 100 mg una vez al día de sitagliptina y 237 recibieron placebo y metformina. La única reacción adversa reportada relacionada con el medicamento que ocurrió con una incidencia ≥ 1% y mayor que con placebo en los que recibieron sitagliptina y metformina fue náusea (1.1% con 100 mg de sitagliptina y metformina, 0.4% con placebo y metformina).
Hipoglucemia y reacciones adversas gastrointestinales:
En los estudios controlados con placebo de tratamiento combinado con sitagliptina y metformina, la incidencia de hipoglucemia (independientemente de la causalidad atribuida por el investigador) reportada por los pacientes que recibieron la combinación de sitagliptina y metformina fue similar a la reportada por los pacientes tratados con metformina y placebo. La incidencia de reacciones adversas gastrointestinales preespecificadas en pacientes tratados con la combinación de sitagliptina y metformina fue similar a la reportada por los pacientes tratados con metformina sola; véase la Tabla 8.
Tabla 8. Hipoglucemia y reacciones adversas gastrointestinales pre-especificadas (independientemente de la causalidad atribuida por el investigador) reportadas por los pacientes que recibieron tratamiento combinado†
|
Número de pacientes (%) |
||||||
|
Estudio de sitagliptina y metformina como tratamiento inicial |
Estudio de adición de sitagliptina a tratamiento actual con metformina |
|||||
|
Placebo |
Sitagliptina 100 mg una vez al día |
Metformina 500 o 1,000 mg dos veces al día†† |
Sitagliptina 50 mg dos veces al día + metformina 500 o 1,000 mg dos veces al día†† |
Placebo y metformina ≥ 1,500 mg diarios |
Sitagliptina 100 mg diarios y metformina ≥ 1,500 mg diarios |
|
|
n = 176 |
n = 179 |
n = 364 |
n = 372 |
n = 237 |
n = 464 |
|
|
Hipoglucemia |
1 (0.6) |
1 (0.6) |
3 (0.8) |
6 (1.6) |
5 (2.1) |
6 (1.3) |
|
Diarrea |
7 (4.0) |
5 (2.8) |
28 (7.7) |
28 (7.5) |
6 (2.5) |
11 (2.4) |
|
Náusea |
2 (1.1) |
2 (1.1) |
20 (5.5) |
18 (4.8) |
2 (0.8) |
6 (1.3) |
|
Vómito |
1 (0.6) |
0 (0.0) |
2 (0.5) |
8 (2.1) |
2 (0.8) |
5 (1.1) |
|
Dolor abdominal |
4 (2.3) |
6 (3.4) |
14 (3.8) |
11 (3.0) |
9 (3.8) |
10 (2.2) |
† En el estudio de tratamiento inicial, el malestar abdominal fue incluido en dolor abdominal.
†† Datos combinados de los pacientes que recibieron las dosis menores y máximas de metformina.
En todos los estudios las reacciones adversas de hipoglucemia se basaron en todos los reportes de hipoglucemia sintomática; no se requirió hacer una medición de la glucosa.
Sitagliptina en Combinación con metformina y una sulfonilurea:
En un estudio controlado con placebo de 24 semanas de sitagliptina 100 mg diarios añadidos a la combinación con glimepirida ≥ 4 mg diarios y metformina ≥ 1,500 mg diarios, las reacciones adversas relacionadas con el medicamento reportadas en ≥ 1% de los pacientes tratados con sitagliptina (n = 116) y más común que en los pacientes tratados con placebo (n = 113) fueron hipoglucemia (sitagliptina 13.8%, placebo 0.9%) y estreñimiento (1.7%, 0%).
Sitagliptina en combinación con metformina y un agonista PPAR:
En un estudio controlado con placebo de sitagliptina 100 mg diarios añadidos al tratamiento combinado en curso de metformina y rosiglitazona, las reacciones adversas relacionadas con el medicamento reportadas durante el punto de tiempo primario a la semana 18 en ≥ 1% de los pacientes tratados con sitagliptina (n = 170) y más comúnmente que en los pacientes tratados con placebo (n = 92) fueron: cefalea (sitagliptina, 2.4%; placebo, 0%), diarrea (1.8%, 1.1%), náusea (1.2%, 1.1%), hipoglucemia (1.2%, 0.0%), y vómito (1.2%, 0%). A la semana 54, las reacciones adversas relacionadas con el medicamento reportadas en ≥ 1% de los pacientes tratados con sitagliptina y más comúnmente que en los pacientes tratados con placebo fueron: cefalea (2.4%, 0%), hipoglucemia (2.4%, 0%), infección del tracto respiratorio superior (1.8%, 0%), náusea (1.2%, 1.1%), tos (1.2%, 0%), infecciones fúngicas cutáneas (1.2%, 0%), edema periférico (1.2%, 0%), y vómito (1.2%, 0%).
Sitagliptina en combinación con metformina e insulina:
En un estudio controlado con placebo de 24 semanas con sitagliptina 100 mg añadida en combinación al tratamiento en curso con metfomina ≥ 1,500 mg diarios y una dosis estable de insulina, la única reacción adversa relacionada con el medicamento reportada en ≥ 1% de los pacientes tratados con sitagliptina (n = 229) y más comúnmente que en los pacientes tratados con placebo (n = 233) fue hipoglucemia (sitagliptina, 10.9%; placebo, 5.2%). En otro estudio de 24 semanas los pacientes recibieron sitagliptina como tratamiento adicional mientras se intensificaba la isulina (con o sin metformina), la única reacción adversa relacionada con el fármaco reportada en ≥ 1% de los pacientes tratados con sitagliptina y metformina y con mayor frecuencia que en los pacientes tratados con placebo y metformina fue el vómito (sitagliptina y metformina, 1.1%, placebo y metformina 0.4%).
Población pediátrica:
En ensayos clínicos con sitagliptina/metformina en pacientes pediátricos con diabetes mellitus tipo 2 de 10 a 17 años, el perfil de reacciones adversas fue generalmente comparable al observado en adultos. En pacientes pediátricos con o sin insulina de fondo, la sitagliptina se asoció con un mayor riesgo de hipoglucemia.
Sitagliptina:
Reacciones adversas reportadas con sitagliptina: No hubo reportes de reacciones adversas relacionadas con el medicamento con una incidencia ≥ 1% en los pacientes que recibieron sitagliptina.
En estudios en monoterapia de sitagliptina 100 mg una vez al día sola en comparación con placebo, las reacciones adversas notificadas fueron cefalea, hipoglucemia, estreñimiento y mareos.
Entre estos pacientes, los acontecimientos adversos notificados independientemente de la relación causal con el medicamento que ocurrieron en al menos el 5% incluyeron infección del tracto respiratorio superior y nasofaringitis. Además, la osteoartritis y el dolor en las extremidades se notificaron con una frecuencia poco frecuente (> 0.5% mayor entre los usuarios de sitagliptina que en el grupo control).
Metformina:
Los síntomas gastrointestinales se informaron con mucha frecuencia en estudios clínicos y en el uso posterior a la comercialización de metformina. Los síntomas gastrointestinales como náuseas, vómitos, diarrea, flatulencia, astenia, indigestión, dolor abdominal, cefalea y pérdida de apetito ocurren con mayor frecuencia durante el inicio de la terapia y se resuelven espontáneamente en la mayoría de los casos. Las reacciones adversas adicionales asociadas con metformina incluyen sabor metálico (común); acidosis láctica, trastornos de la función hepática, hepatitis, urticaria, eritema y prurito (muy raro). El tratamiento a largo plazo con metformina se ha asociado con una disminución de la absorción de vitamina B12 que muy raramente puede dar lugar a una deficiencia clínicamente significativa de vitamina B12 (p. ej., anemia megaloblástica).
Estudio de Seguridad Cardiovascular TECOS:
El Estudio para Evaluar los Desenlaces Cardiovasculares con sitagliptina (The Trial Evaluating Cardiovascular Outcomes with Sitagliptin, TECOS) incluyó a 7,332 pacientes tratados con sitagliptina, a 100 mg diarios (o 50 mg diarios si la tasa de filtración glomerular basal estimada (TFGe) era ≥ 30 y < 50 mL/min/1.73 m2), y 7,339 pacientes tratados con placebo en la población de intención de tratar. Ambos tratamientos se añadieron al cuidado usual, apuntando a estándares regionales para HbA1c y factores de riesgo CV. La incidencia general de eventos adversos graves en los pacientes que recibieron sitagliptina fue similar a la de los pacientes que recibieron placebo. La población de estudio incluyó un total de 2,004 pacientes ≥ 75 años de edad (970 tratados con sitagliptina y 1,034 tratados con placebo). La incidencia global de eventos adversos graves en los pacientes que recibieron sitagliptina fue similar a la de los pacientes que recibieron placebo. La evaluación de complicaciones relacionadas con la diabetes preespecificadas reveló incidencias similares entre los grupos, incluyendo infecciones (18.4% de los pacientes tratados con sitagliptina y 17.7% de los pacientes tratados con placebo) e insuficiencia renal (1.4% de los pacientes tratados con sitagliptina y 1.5% de los pacientes tratados con placebo). El perfil de eventos adversos en los pacientes ≥ 75 años de edad fue generalmente similar al de la población general.
En la población de intención de tratar, entre los pacientes que estaban usando insulina y/o una sulfonilurea a nivel basal, la incidencia de hipoglucemia grave fue de 2.7% en los pacientes tratados con sitagliptina y 2.5% en los pacientes tratados con placebo, entre los pacientes que no estaban usando insulina y/o una sulfonilurea a nivel basal, la incidencia de hipoglucemia grave fue de 1% en los pacientes tratados con sitagliptina y de 0.7% en los pacientes tratados con placebo. La incidencia de eventos de pancreatitis con adjudicación confirmada fue de 0.3% en los pacientes tratados con sitagliptina y de 0.2% en los pacientes tratados con placebo. La incidencia de eventos de malignidad con adjudicación confirmada fue de 3.7% en los pacientes tratados con sitagliptina y de 4.0% en los pacientes tratados con placebo.
Experiencia después de la comercialización:
Durante el uso después de la comercialización de Sitagliptina/Metformina o sitagliptina, uno de los componentes de Sitagliptina/Metformina se han identificado reacciones adversas adicionales. Estas reacciones han sido reportadas cuando Sitagliptina/Metformina o sitagliptina se utilizaron como monoterapia o en combinación con otros medicamentos hipoglucemiantes. Como estas reacciones se reportaron voluntariamente de una población de tamaño incierto, generalmente no es posible estimar de manera confiable su frecuencia o establecer una relación causal a la exposición del medicamento.
Reacciones de hipersensibilidad incluyendo anafilaxis, angioedema, erupción, cutánea, urticaria, vasculitis cutánea, y condiciones cutáneas exfoliativas incluyendo el síndrome de Stevens-Johnson (véase Contraindicaciones y Precauciones generales, sitagliptina, reacciones de hipersensibilidad); pancreatitis aguda, incluyendo pancreatitis necrotizante o hemorrágica fatal y no fatal (Precauciones generales, pancreatitis); deterioro de la función renal, incluyendo insuficiencia renal aguda (algunas veces requiriendo diálisis); penfigoide ampolloso (Precauciones generales, penfigoide ampolloso); infección de vías respiratorias superiores; nasofaringitis; estreñimiento, vómito, cefalea; artralgia, mialgia, dolor en las extremidades, dolor de espalda, prurito.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Sitagliptina/Metformina:
La coadministración de dosis múltiples de 50 mg de sitagliptina dos veces al día y 1,000 mg de metformina dos veces al día no alteró significativamente la farmacocinética de ninguno de los dos medicamentos en pacientes con diabetes tipo 2.
No se han hecho estudios de interacción farmacocinética con la combinación de sitagliptina y metformina pero sí con los componentes individuales sitagliptina y metformina.
Sitagliptina:
Los datos in vitro y clínicos descritos a continuación sugieren que el riesgo de interacciones clínicamente significativas después de la administración conjunta de otros medicamentos es bajo.
Los estudios in vitro indicaron que la enzima principal responsable del metabolismo limitado de la sitagliptina es el CYP3A4, con contribución del CYP2C8 y 2C9. En pacientes con función renal normal, el metabolismo, incluido el que se produce a través de CYP3A4, desempeña sólo un pequeño papel en el aclaramiento de la sitagliptina. El metabolismo puede desempeñar un papel más importante en la eliminación de la sitagliptina en el contexto de una insuficiencia renal grave o una enfermedad renal terminal (ERT). Por esta razón, es posible que los inhibidores potentes de CYP3A4 (es decir, ketoconazol, itraconazol, ritonavir, claritromicina) puedan alterar la farmacocinética de la sitagliptina en pacientes con insuficiencia renal grave o ERT. No se han evaluado los efectos de los inhibidores potentes de CYP3A4 en el contexto de la insuficiencia renal en un estudio clínico. En los estudios de interacciones farmacológicas, la sitagliptina no tuvo efectos de importancia clínica sobre la farmacocinética de los siguientes medicamentos: metformina, rosiglitazona, gliburida, simvastatina, warfarina y anticonceptivos orales.
Los estudios de transporte in vitro demostraron que la sitagliptina es un sustrato de la glucoproteína P y del transportador de aniones orgánicos-3 (OAT3). El transporte de la sitagliptina mediado por OAT3 fue inhibido in vitro por el probenecid, aunque el riesgo de interacciones clínicamente significativas se considera que es bajo. No se ha evaluado in vivo la administración concomitante de inhibidores de OAT3.
Se han realizado análisis de farmacocinética de población en pacientes con diabetes tipo 2. Los medicamentos administrados concomitantemente no tuvieron un efecto clínicamente importante en la farmacocinética de sitagliptina. Los medicamentos evaluados fueron aquellos que comúnmente se administran en pacientes con diabetes tipo 2, incluyendo reductores de colesterol (p. ej., estatinas, fibratos, ezetimiba), antiplaquetarios (clopidogrel), antihipertensivos (inhibidores de la ECA, bloqueadores de los receptores de angiotensina, bloqueadores beta, antagonistas de canales de calcio, hidroclorotiazida), analgésicos y antiinflamatorios no esteroideos (p. ej., naproxeno, diclofenaco, celecoxib), antidepresivos (p. ej., bupropión, fluoxetina, sertralina), antihistamínicos (cetrizina), inhibidores de la bomba de protones (p. ej., omeprazol, lansoprazol) y medicamentos para disfunción eréctil (p. ej., sildenafil).
Ciclosporina:
Se realizó un estudio para evaluar el efecto de la ciclosporina, un potente inhibidor de la glucoproteína P, sobre la farmacocinética de la sitagliptina. La administración conjunta de una dosis oral única de 100 mg de sitagliptina y una dosis oral única de 600 mg de ciclosporina aumentó el AUC y la Cmáx de la sitagliptina en aproximadamente un 29% y un 68%, respectivamente. Estos cambios en la farmacocinética de la sitagliptina no se consideraron clínicamente significativos. El aclaramiento renal de la sitagliptina no se alteró significativamente. Por lo tanto, no serían de esperar interacciones significativas con otros inhibidores de la glucoproteína P.
Efectos de la sitagliptina sobre otros medicamentos: Digoxina:
Sitagliptina tuvo un efecto pequeño sobre las concentraciones plasmáticas de digoxina. Después de la administración concomitante de 0.25 mg de digoxina con 100 mg de sitagliptina al día durante 10 días, el AUC plasmático de digoxina aumentó una media de 11% y la Cmáx plasmática una media de 18%. No se recomienda ajustar la dosis de digoxina. Sin embargo, se debe vigilar a los pacientes con riesgo de toxicidad por digoxina cuando se administren de forma concomitante sitagliptina y digoxina.
Los datos in vitro sugieren que la sitagliptina no inhibe ni induce las isoenzimas CYP450. En ensayos clínicos, la sitagliptina no alteró significativamente la farmacocinética de la metformina, la gliburida, la simvastatina, la rosiglitazona, la warfarina o los anticonceptivos orales, aportando pruebas in vivo de una baja propensión para producir interacciones con sustratos de CYP3A4, CYP2C8, CYP2C9 y el transportador de cationes orgánicos (OCT). La sitagliptina podría ser un inhibidor leve de la glucoproteína P in vivo.
Metformina:
Combinaciones que requieren precauciones de empleo:
Algunos medicamentos pueden afectar de forma adversa la función renal, lo que puede incrementar el riesgo de acidosis láctica, p. ej., los AINE, incluidos los inhibidores selectivos de la ciclooxigenasa (COX) II, los inhibidores de la ECA, los antagonistas del receptor de la angiotensina II y los diuréticos, en especial, los diuréticos del asa. Cuando se inicien o se utilicen estos productos en combinación con metformina, es necesario supervisar de manera estrecha la función renal.
Gliburida:
En un estudio sobre interacción de dosis únicas en pacientes con diabetes tipo 2, la coadministración de metformina y gliburida no causó ningún cambio en la farmacocinética o la farmacodinámica de la metformina. Se observaron disminuciones del ABC y de la Cmáx de la gliburida, pero esas disminuciones fueron muy variables. Debido a que fue un estudio con dosis únicas y a la falta de correlación entre las concentraciones sanguíneas de gliburida y los efectos farmacodinámicos, es incierta la importancia clínica de esta interacción.
Furosemida:
Un estudio sobre la interacción de dosis únicas de metformina y furosemida en sujetos sanos demostró que la coadministración afectó los parámetros farmacocinéticos de ambos compuestos. La furosemida aumentó 22% la Cmáx plasmática y sanguínea y 15% el ABC sanguínea de la metformina, sin ningún cambio significativo en su depuración renal. Cuando se coadministró con metformina, la Cmáx y el ABC de la furosemida fueron 31% y 12% menores, respectivamente, que cuando se administró sola, y su vida media terminal disminuyó 32%, sin ningún cambio significativo en su depuración renal. No hay información disponible acerca de la interacción de la metformina y la furosemida cuando se coadministran por tiempo prolongado.
Nifedipino:
Un estudio sobre la interacción de dosis únicas de metformina y nifedipino en sujetos sanos demostró que la coadministración de nifedipino aumentó 20% la Cmáx y 9% el ABC de la metformina, así como la cantidad de metformina excretada en la orina. Su Tmáx y su vida media no se modificaron. El nifedipino aumenta la absorción de metformina, y ésta tuvo efectos mínimos sobre el nifedipino.
El uso concomitante de medicamentos que interfieren con los sistemas comunes de transporte tubular renal, involucrados en la eliminación renal de la metformina (p. ej. Transportador-2 de cationes orgánicos [OCT2]/inhibidores de extrusión de múltiples fármacos y toxinas [MATE] tales como ranolazina, vandetanib, dolutegravir y cimetidina), podría aumentar la exposición sistémica a metformina y puede aumentar el riesgo de acidosis láctica. Considerar los beneficios y los riesgos del uso concomitante. Cuando se coadministran tales medicamentos, se debe considerar realizar una vigilancia estrecha del control glucémico, el ajuste de dosis dentro de la posología recomendada y cambios en el tratamiento diabético.
Otros:
Los glucocorticoides (administrados por vía sistémica y local), los agonistas beta-2 y los diuréticos tienen actividad hiperglucémica intrínseca. Esos medicamentos incluyen las tiacidas y otros diuréticos, corticosteroides, fenotiacinas, productos tiroideos, estrógenos, anticonceptivos orales, fenitoína, ácido nicotínico, simpaticomiméticos, bloqueadores de canales de calcio y la isoniacida. Se debe informar al paciente y realizar una monitorización más frecuente de la glucemia, especialmente al inicio del tratamiento con dichos medicamentos. Si es necesario, se debe ajustar la dosis del medicamento antihiperglucémico durante el tratamiento con el otro medicamento y al interrumpirlo. Los inhibidores de la ECA pueden disminuir los niveles de glucosa en sangre. Si es necesario, se debe ajustar la dosis del medicamento antihiperglucémico durante el tratamiento con el otro medicamento y al interrumpirlo. En estudios de interacción con dosis únicas en voluntarios sanos, la coadministración de metformina y propranolol o de metformina e ibuprofeno no afectó la farmacocinética de esos medicamentos.
A diferencia de las sulfonilureas, que se unen en gran proporción a las proteínas plasmáticas, la metformina se une escasamente a ellas, por lo que es menos probable que interactúe con medicamentos que se unen mucho a las proteínas plasmáticas, como los salicilatos, las sulfonamidas, el cloranfenicol y el probenecid.
No se recomienda el uso concomitante.
Alcohol:
La intoxicación por alcohol se asocia con un mayor riesgo de acidosis láctica, particularmente en casos de ayuno, desnutrición o insuficiencia hepática.
Agentes de contraste yodados:
Se debe interrumpir el tratamiento con Sitagliptina/Metformina antes o en el momento del procedimiento de imagen y no reiniciarlo hasta al menos 48 horas después, siempre que se haya reevaluado la función renal y se haya encontrado estable.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO:
Sitagliptina:
La incidencia de reacciones adversas de laboratorio fue similar en los pacientes tratados con sitagliptina y metformina comparados con los pacientes tratados con placebo y metformina. A lo largo de esos estudios se observó un pequeño aumento del número de leucocitos (una diferencia de aproximadamente 200 leucocitos/μl en comparación con el placebo; cuenta promedio basal de leucocitos de aproximadamente 6,600/μl), debido a un pequeño aumento de los neutrófilos. Esta observación se ha hecho en la mayoría pero no en todos los estudios. Este cambio en los parámetros de laboratorio no se considera clínicamente importante.
Metformina:
En estudios clínicos comparativos de metformina de 29 semanas de duración, se observó una disminución a valores subnormales de las concentraciones séricas previas normales de vitamina B12, sin manifestaciones clínicas, en aproximadamente 7% de los pacientes. Sin embargo, esa disminución (debida posiblemente a la interferencia de la absorción de esa vitamina a partir del complejo B12-factor intrínseco) muy rara vez se acompaña de anemia y parece ser rápidamente reversible al suspender la administración de metformina o al administrar vitamina B12 (véase Precauciones generales).
PRECAUCIONES GENERALES:
Sitagliptina/Metformina:
No se debe usar Sitagliptina/Metformina en pacientes con diabetes tipo 1 ni para tratar la cetoacidosis diabética. Pancreatitis:
En pacientes que toman sitagliptina han habido reportes de pancreatitis aguda, incluyendo pancreatitis necrotizante o hemorrágica fatal y no fatal (véase Reacciones secundarias y adversas, Experiencia después de la comercialización). Se debe advertir a los pacientes sobre los síntomas característicos de la pancreatitis aguda: dolor abdominal persistente y severo. Se ha observado que la pancreatitis se resuelve tras la suspensión de sitagliptina (con o sin tratamiento de apoyo), pero se han notificado casos muy raros de pancreatitis necrosante o hemorrágica y/o muerte. Si se sospecha pancreatitis, se debe descontinuar Sitagliptina/Metformina o cualquier otro medicamento que se sospeche pueda causarla. Si se confirma pancreatitis aguda, no se debe reiniciar el tratamiento con Sitagliptina/Metformina. Se debe tener precaución en pacientes con antecedentes de pancreatitis.
Función renal:
Se sabe que la metformina y la sitagliptina son excretadas en gran parte por vía renal. El riesgo de acumulación de metformina y acidosis láctica aumenta con el grado de insuficiencia renal.
Sitagliptina/Metformina está contraindicado en insuficiencia renal severa, pacientes con una TFGe < 30 mL/min/1.73 m2 (véase Dosis y vía de administración, Contraindicaciones y Precauciones generales, metformina, acidosis láctica).
Antes de iniciar el tratamiento con Sitagliptina/Metformina y después por lo menos cada año, se debe evaluar la función renal. Si se prevé el desarrollo de insuficiencia renal, se debe medir la función renal con mayor frecuencia y suspender la administración de Sitagliptina/Metformina si aparecen signos de insuficiencia renal.
Hipoglucemia en combinación con una sulfonilurea o con insulina:
Como es típico con otros medicamentos hipoglucemiantes, se ha observado hipoglucemia en pacientes que son tratados con sitagliptina y metformina en combinación con insulina o una sulfonilurea (Reacciones secundarias y adversas). Por ello, para reducir el riesgo de hipoglucemia inducida por sulfonilurea o por insulina, se debe considerar una dosis menor de la sulfonilurea o de la insulina (véase Dosis y vía de administración).
Sitagliptina:
Hipoglucemia en combinación con una sulfonilurea o con insulina:
En los estudios clínicos de sitagliptina como monoterapia o como parte del tratamiento combinado con medicamentos que se sabe causan hipoglucemia (p. ej. metformina o un agonista del PPAR [tiazolidinediona]), las tasas de hipoglucemia fueron similares a las observadas en los pacientes que recibieron placebo. Como es típico con otros medicamentos hipoglucemiantes, se ha observado hipoglucemia en pacientes que son tratados con sitagliptina en combinación con insulina o una sulfonilurea (véase Reacciones secundarias y adversas). Por ello, para reducir el riesgo de hipoglucemia inducida por sulfonilurea o por insulina, se debe considerar una dosis menor de la sulfonilurea o de la insulina (véase Dosis y vía de administración).
Reacciones de hipersensibilidad:
Han habido reportes después de la comercialización de reacciones de hipersensibilidad graves en pacientes tratados con sitagliptina, uno de los componentes de Sitagliptina/Metformina. Estas reacciones incluyen anafilaxis, angioedema, y condiciones cutáneas, exfoliativas, incluyendo el síndrome de Stevens-Johnson. Como estas reacciones se reportan voluntariamente de una población de tamaño incierto, en general no es posible estimar de manera confiable su frecuencia o establecer una relación causal a la exposición al fármaco. El inicio de estas reacciones ocurrió dentro de los primeros 3 meses después del inicio del tratamiento con sitagliptina, algunos reportes ocurrieron después de la primera dosis. Si se sospecha una reacción de hipersensibilidad, descontinúe Sitagliptina/Metformina, evalúe otras causas potenciales del evento e inicie un tratamiento alternativo para la diabetes (véase Contraindicaciones y Reacciones secundarias y adversas).
Penfigoide ampolloso:
En contexto de poscomercialización se han reportado casos de penfigoide ampolloso que requirieron hospitalización con el uso de inhibidores de la DPP-4. En estos casos reportados, los pacientes típicamente se recuperaron con tratamiento inmunosupresor tópico o sistémico y suspendiendo el tratamiento con el inhibidor de la DPP-4. Pida a sus pacientes reportar la aparición de ampollas o erosiones cuando estén bajo tratamiento con Sitagliptina/Metformina. En caso de sospecha de penfigoide ampolloso se debe suspender el tratamiento con Sitagliptina/Metformina y se debe considerar referir al paciente con el dermatólogo para diagnóstico y tratamiento apropiado.
Metformina:
Acidosis láctica:
La acidosis láctica es una complicación rara, pero grave, que puede ocurrir debido a la acumulación de metformina durante el tratamiento con Sitagliptina/Metformina. Es mortal en aproximadamente 50% de los casos, ocurre con mayor frecuencia en el empeoramiento agudo de la función renal o enfermedad cardiorrespiratoria o sepsis. La acumulación de metformina ocurre en el empeoramiento agudo de la función renal y aumenta el riesgo de acidosis láctica.
También puede ocurrir en varios estados fisiopatológicos, incluyendo diabetes mellitus, y cuando hay hipoperfusión e hipoxemia tisulares importantes. La acidosis láctica se caracteriza por concentraciones sanguíneas elevadas de lactato (> 5 mmol/L), disminución del pH sanguíneo, trastornos electrolíticos con aumento de la brecha aniónica y aumento de la relación lactato/piruvato. Cuando la metformina está implicada como causa de la acidosis láctica, generalmente sus concentraciones plasmáticas son mayores de 5 μg/mL. La incidencia reportada de acidosis láctica en pacientes que están recibiendo metformina es muy baja (aproximadamente 0.03 casos/1,000 pacientes-años y aproximadamente 0.015 casos mortales por cada 1,000 pacientes/años). En más de 20,000 pacientes-años de exposición a la metformina en los estudios clínicos, no hubo ningún reporte de acidosis láctica. Los casos reportados han ocurrido principalmente en pacientes diabéticos con insuficiencia renal significativa, incluyendo tanto nefropatía intrínseca como hipoperfusión renal, a menudo en un cuadro de múltiples problemas médicos/quirúrgicos concomitantes y numerosos medicamentos (véase la sección Dosis y vía de administración, recomendaciones de uso para pacientes con insuficiencia renal).
En caso de deshidratación (vómitos intensos, diarrea, fiebre o ingesta reducida de líquidos), la metformina debe suspenderse temporalmente y se recomienda el contacto con un profesional de la salud.
Los medicamentos que pueden deteriorar gravemente la función renal (como antihipertensivos, diuréticos y AINE) deben iniciarse con precaución en pacientes tratados con metformina. Otros factores de riesgo para la acidosis láctica son la ingesta excesiva de alcohol, insuficiencia hepática, diabetes inadecuadamente controlada, cetosis, ayuno prolongado y cualquier condición asociada con hipoxia, así como el uso concomitante de medicamentos que puedan causar acidosis láctica.
Los pacientes y/o cuidadores deben ser informados del riesgo de acidosis láctica. La acidosis láctica se caracteriza por disnea acidótica, dolor abdominal, calambres musculares, astenia e hipotermia seguida de coma. En caso de sospecha de síntomas, el paciente debe dejar de tomar metformina y buscar atención médica inmediata. Los hallazgos de laboratorio de diagnóstico son disminución del pH sanguíneo (< 7.35), aumento de los niveles plasmáticos de lactato (> 5 mmol/L) y un aumento de la brecha aniónica y la relación lactato/piruvato.
Los pacientes con insuficiencia cardiaca congestiva que necesitan tratamiento farmacológico, en particular aquéllos con insuficiencia cardiaca congestiva inestable o aguda que están en riesgo de hipoperfusión e hipoxemia, tienen mayor riesgo de presentar acidosis láctica. El riesgo de acidosis láctica aumenta con el grado de insuficiencia renal y con la edad del paciente; por lo tanto, ese riesgo podría disminuir significativamente vigilando regularmente la función renal de los pacientes que reciben metformina y usando la dosis mínima efectiva de ésta, particularmente en los pacientes de edad avanzada (véase más abajo empleo en pacientes de edad avanzada). Además, se debe suspender enseguida la administración de metformina si aparece cualquier trastorno asociado con hipoxemia, deshidratación o sepsis. Debido a que el deterioro de la función hepática puede limitar significativamente la capacidad para depurar lactato, generalmente se debe evitar administrar metformina a pacientes con signos clínicos o de laboratorio de hepatopatía. Los pacientes que están tomando metformina deben evitar el consumo excesivo agudo o crónico de alcohol, porque éste potencia los efectos de la metformina sobre el metabolismo del lactato. Además, se debe suspender temporalmente la administración de metformina antes de cualquier estudio radiológico con un medio de contraste intravascular o de cualquier intervención quirúrgica.
En muchos casos la acidosis láctica inicia sutilmente, acompañada sólo por síntomas inespecíficos como malestar general, mialgias, disnea, incremento de la somnolencia y malestar abdominal inespecífico. Con una acidosis mayor se pueden asociar hipotermia, hipotensión y bradiarritmias resistentes. El paciente y su médico deben tener presente la posible importancia de esos síntomas, se debe indicar al paciente que informe inmediatamente a su médico si aparecen, y se debe suspender la administración de metformina hasta aclarar la situación. Puede ser útil medir los electrólitos, cetonas séricas, glucemia y, si está indicado, el pH sanguíneo, el lactato y la concentración sanguínea de metformina. Una vez que se ha estabilizado a un paciente con determinada dosificación de metformina, es improbable que los síntomas gastrointestinales, que son comunes durante el inicio del tratamiento, estén relacionados con el medicamento. La aparición posterior de síntomas gastrointestinales puede ser debida a acidosis láctica o a otra enfermedad grave.
Las concentraciones de lactato en plasma venoso en ayunas mayores que el límite superior normal pero menores de 5 mmol/L en pacientes que están tomando metformina no indican necesariamente una inminente acidosis láctica, sino que pueden ser debidas a otros mecanismos, como diabetes mal controlada, obesidad, actividad física intensa o problemas técnicos en el manejo de las muestras.
Se debe sospechar acidosis láctica en cualquier paciente diabético con acidosis metabólica, pero sin signos de cetoacidosis (cetonuria y cetonemia).
La acidosis láctica es una urgencia médica que se tiene que tratar en un hospital. En el caso de un paciente con acidosis láctica que está tomando metformina, se debe suspender inmediatamente la administración de ésta e iniciar enseguida medidas de sostén. Dado que la metformina es dializable (con una depuración de hasta 170 mL/min con buenas condiciones hemodinámicas), se recomienda una pronta hemodiálisis para corregir la acidosis y extraer la metformina acumulada. En muchos casos ese tratamiento corrige rápidamente los síntomas y acelera la recuperación (véase Contraindicaciones). Hipoglucemia:
En las circunstancias usuales de uso, los pacientes que reciben metformina sola no presentan hipoglucemia, pero ésta puede ocurrir cuando el ingreso calórico es deficiente, cuando la actividad física intensa no es compensada por complementos calóricos, o durante el uso concomitante de otros agentes que disminuyen la glucemia (como las sulfonilureas y la insulina) o de etanol. Los pacientes ancianos, debilitados, desnutridos, con insuficiencia suprarrenal o hipofisiaria o con intoxicación alcohólica son particularmente propensos a los efectos hipoglucemiantes. La hipoglucemia puede ser difícil de identificar en los ancianos y en las personas que están tomando bloqueadores β-adrenérgicos.
Uso concomitante de medicamentos que pueden afectar la función renal o la disposición de la metformina:
Se deben usar con precaución medicamentos concomitantes que pueden afectar la función renal, causar cambios hemodinámicos significativos o interferir con la disposición de la metformina, como medicamentos catiónicos que son eliminados por secreción tubular (véase Interacciones medicamentosas y de otro género).
Estudios radiológicos con medios de contraste yodados intravasculares, como urografía o colangiografía intravenosas, angiografía, y tomografía computarizada con medio de contraste intravascular:
Los medios de contraste intravasculares yodados pueden causar alteraciones agudas de la función renal, y se han asociado con acidosis láctica en pacientes que recibían metformina (véase Contraindicaciones). Por lo tanto, en pacientes con una TFGe de ≥ 30 a < 60 mL/min/1.73 m2, en pacientes con antecedente de insuficiencia hepática, alcoholismo o insuficiencia cardiaca, o en pacientes que recibirán contraste yodado intra-arterial, se debe suspender temporalmente la administración de Sitagliptina/Metformina antes o al momento y durante 48 horas después de hacer cualquiera de esos estudios, y continuarla sólo después de reevaluar la función renal y comprobar que es aceptable (véase Dosis y vía de administración).
Estados hipóxicos:
El colapso cardiovascular (choque) de cualquier causa, la insuficiencia cardiaca congestiva aguda, el infarto agudo al miocardio y otros trastornos caracterizados por hipoxemia se han asociado con acidosis láctica y también pueden causar hiperazoemia prerrenal. Si ocurren en pacientes bajo tratamiento con Sitagliptina/Metformina, se debe suspender enseguida la administración de este medicamento.
Intervenciones quirúrgicas:
Se debe suspender temporalmente la administración de Sitagliptina/Metformina antes de cualquier intervención quirúrgica (excepto en operaciones menores en las que no se restringe la ingestión de alimentos y líquidos), bajo anestesia general, espinal o epidural.
La terapia puede reiniciarse no antes de 48 horas después de la cirugía o la reanudación de la nutrición oral y siempre que la función renal haya sido reevaluada y se haya encontrado estable.
Ingestión de alcohol:
Se sabe que el alcohol potencia el efecto de la metformina sobre el metabolismo del lactato, por lo que se debe advertir a los pacientes que deben evitar el consumo excesivo agudo o crónico de alcohol mientras están recibiendo Sitagliptina/Metformina.
Deterioro de la función hepática:
Como el deterioro de la función hepática se ha asociado con algunos casos de acidosis láctica, generalmente se debe evitar administrar Sitagliptina/Metformina a pacientes con signos clínicos o de laboratorio de hepatopatía.
Concentraciones de vitamina B12: En estudios clínicos controlados de metformina de 29 semanas de duración se observó en aproximadamente 7% de los pacientes una disminución hasta valores subnormales de las concentraciones séricas previamente normales de vitamina B12, sin manifestaciones clínicas. Sin embargo, esa disminución (debida posiblemente a la interferencia de la absorción de esa vitamina a partir del complejo B12-factor intrínseco) muy rara vez se acompaña de anemia y cesa rápidamente al suspender la administración de metformina o al administrar vitamina B12. Se recomienda medir los parámetros hematológicos cada año en los pacientes tratados con Sitagliptina/Metformina, para investigar y tratar apropiadamente cualquier anormalidad que se encuentre.
Algunas personas (con ingestión o absorción insuficiente de vitamina B12 o de calcio) tienden a presentar concentraciones subnormales de vitamina B12 en el suero. Puede ser útil medir esas concentraciones cada dos a tres años.
Cambio en el estado clínico de pacientes con diabetes tipo 2 previamente controlada:
Un paciente con diabetes tipo 2 previamente bien controlada con Sitagliptina/Metformina que desarrolle anomalías de laboratorio o enfermedad clínica (especialmente enfermedad vaga y mal definida) debe ser evaluado rápidamente para detectar evidencia de cetoacidosis o acidosis láctica. La evaluación debe incluir electrolitos séricos y cetonas, glucosa en sangre y, si está indicado, pH sanguíneo, lactato, piruvato y niveles de metformina. Si se produce acidosis de cualquiera de las formas, el tratamiento debe interrumpirse inmediatamente e iniciarse otras medidas correctivas apropiadas. Pérdida del control de la glucemia:
Cuando un paciente que está controlado con cualquier régimen antidiabético se ve expuesto a estrés (como fiebre, traumatismo, infección o cirugía) se puede perder durante cierto tiempo el control de la glucemia, y puede ser necesario suspender la administración de sitagliptina/metformina y administrar insulina temporalmente. Una vez resuelto ese episodio agudo, se puede reanudar el tratamiento con Sitagliptina/Metformina.
Efectos sobre la capacidad de conducir y utilizar maquinaria:
La influencia de Sitagliptina/Metformina sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. Sin embargo, al conducir o utilizar máquinas, debe tenerse en cuenta que se han notificado mareos y somnolencia con sitagliptina. Además, se debe alertar a los pacientes sobre el riesgo de hipoglucemia. Población pediátrica:
No se han determinado la seguridad y la eficacia de Sitagliptina/Metformina en pacientes pediátricos menores de 18 años de edad.
Pacientes de edad avanzada:
Sitagliptina/Metformina:
Como la sitagliptina y la metformina son excretadas en gran parte por los riñones y el envejecimiento se puede asociar con una disminución de la función renal, Sitagliptina/Metformina se debe usar con precaución conforme se envejece. Se debe escoger con cuidado la dosificación, basándose en una vigilancia cuidadosa y regular de la función renal (véase arriba Función renal).
Sitagliptina:
En los estudios clínicos, la seguridad y la eficacia de la sitagliptina en pacientes de edad avanzada (≥ 65 años) fueron similares a las observadas en los de menor edad (< 65 años).
Metformina:
Los estudios clínicos controlados de metformina no incluyeron suficientes pacientes de edad avanzada para determinar si responden de modo diferente de como lo hacen los de menor edad, aunque en otra experiencia clínica reportada no se han identificado diferencias en las respuestas entre los dos grupos de edad.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTÁGENESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
Carcinogenicidad:
No se han realizado estudios en animales con Sitagliptina/Metformina.
En estudios de 16 semanas en los que los perros fueron tratados con metformina sola o una combinación de metformina y sitagliptina no se observó toxicidad adicional de la combinación. El NOEL en estos estudios se observó en exposiciones a sitagliptina de aproximadamente 6 veces la exposición humana y a metformina de aproximadamente 2.5 veces la exposición humana. Los siguientes datos son hallazgos en estudios realizados con sitagliptina o metformina individualmente.
Sitagliptina:
Se hizo un estudio de dos años sobre la carcinogenicidad en ratas machos y hembras que recibieron dosis orales de sitagliptina de 50, 150 y 500 mg/kg/día. Con la dosificación mayor (exposición aproximadamente 58 veces mayor que en los seres humanos basándose en la dosis diaria recomendada en adultos de 100 mg diarios) hubo un aumento de la incidencia de adenomas y carcinomas hepáticos en los machos y de carcinomas hepáticos en las hembras. Esa dosificación se asoció con hepatotoxicidad en las ratas. La dosificación con la que no se observó ninguna inducción de neoplasias hepáticas fue la de 150 mg/kg/día (aproximadamente 19 veces mayor que la exposición en seres humanos con la dosis recomendada de 100 mg diarios).
Como se ha mostrado que en las ratas la hepatotoxicidad está correlacionada con la inducción de neoplasias hepáticas, ese aumento de la incidencia de tumores hepáticos es probablemente secundario a toxicidad hepática crónica a esa alta dosificación. Se desconoce la importancia clínica de esos resultados para los seres humanos. Se hizo un estudio de dos años sobre la carcinogenicidad en ratones machos y hembras, con dosis orales de sitagliptina de 50, 125, 250 y 500 mg/kg/día. La sitagliptina no aumentó la incidencia de tumores de ningún órgano en los ratones con dosis de hasta 500 mg/kg/día (exposición aproximadamente 68 veces mayor que la usada en seres humanos por la dosis recomendada de 100 mg diarios).
Metformina:
Se han hecho estudios a largo plazo sobre la carcinogenicidad en ratas (durante 104 semanas) y en ratones (durante 91 semanas) con dosificaciones de hasta 900 mg/kg/día y 1,500 mg/kg/día respectivamente, que son aproximadamente cuatro veces mayores que la dosis diaria máxima de 2,000 mg recomendada en seres humanos basándose en la comparación de las áreas de superficie corporal. No se encontró ningún indicio de carcinogenicidad de la metformina en los ratones machos o hembras ni en las ratas machos, pero sí aumentó la incidencia de pólipos benignos del estroma uterino en las ratas hembras tratadas con 900 mg/kg/día.
Mutagénesis:
Sitagliptina:
La sitagliptina no fue mutagénica ni clastogénica en una serie de estudios de toxicología genética que incluyeron la prueba bacteriana de Ames (prueba de mutagénesis microbiana), la prueba de aberraciones cromosómicas en células de ovario de hámster Chino (células CHO) y una prueba citogenética in vitro con células CHO, un ensayo de dilución alcalina en ADN de hepatocitos de rata (que mide la capacidad del medicamento para inducir roturas de una cadena en el ADN), y una prueba de micronúcleos in vivo.
Metformina:
No hubo ningún indicio de potencial mutagénico de la metformina en las siguientes pruebas in vitro: Prueba de Ames (S. typhimurium), prueba de mutación genética (en células de linfoma de ratón) o prueba de aberraciones cromosómicas (en linfocitos humanos). Los resultados de la prueba de micronúcleos in vivo en ratones también fueron negativos.
Teratogénesis:
Se observaron anomalías en los dientes incisivos en ratas a niveles de exposición 67 veces superiores al nivel de exposición clínica. El nivel sin efecto para este hallazgo fue 58 veces mayor basado en el estudio de 14 semanas en ratas. Se desconoce la relevancia de estos hallazgos para los seres humanos. Se observaron signos físicos transitorios relacionados con el tratamiento, algunos de los cuales sugieren toxicidad neural, como respiración con la boca abierta, salivación, emesis espumosa blanca, ataxia, temblores, disminución de la actividad y/o postura encorvada en perros a niveles de exposición aproximadamente 23 veces el nivel de exposición clínica. Además, también se observó histológicamente una degeneración del músculo esquelético muy leve a leve a dosis que resultaron en niveles de exposición sistémica de aproximadamente 23 veces el nivel de exposición humana. Se encontró un nivel sin efecto para estos hallazgos a una exposición 6 veces mayor que el nivel de exposición clínica.
Fertilidad:
Los datos en animales no sugieren un efecto del tratamiento con sitagliptina sobre la fertilidad masculina y femenina. Faltan datos humanos.
Sitagliptina:
No se observó ningún efecto adverso sobre la fertilidad en ratas machos y hembras que recibieron dosis orales de hasta 1,000 mg/kg de sitagliptina (exposición hasta unas 100 veces mayor que la exposición en seres humanos, basándose en la dosis diaria recomendada en adultos de 100 mg diarios) antes y durante el apareamiento. En un estudio de desarrollo pre y postnatal realizado en ratas, la sitagliptina no mostró eventos adversos. Los estudios de toxicidad reproductiva mostraron un ligero aumento de la incidencia de malformaciones costales fetales relacionadas con el tratamiento (costillas ausentes, hipoplásicas y onduladas) en la descendencia de ratas a niveles de exposición sistémica superiores a 29 veces los niveles de exposición humana. La toxicidad materna se observó en conejos a más de 29 veces los niveles de exposición humana. Debido a los altos márgenes de seguridad, estos hallazgos no sugieren un riesgo relevante para la reproducción humana. La sitagliptina se secreta en cantidades considerables en la leche de ratas lactantes (relación leche/plasma: 4:1).
Metformina:
La fertilidad de las ratas machos o hembras no fue afectada por la metformina administrada a dosificaciones tan altas como 600 mg/kg/día, que es aproximadamente tres veces mayor que la dosis diaria máxima recomendada en seres humanos basándose en la comparación de las áreas de superficie corporal.
Desarrollo fetal:
Sitagliptina:
La sitagliptina no fue teratogénica en ratas a dosis orales de hasta 250 mg/kg ni en conejas que recibieron hasta 125 mg/kg durante la organogénesis (exposición hasta 32 y 22 veces mayor, respectivamente, que la causada en seres humanos por la dosis diaria recomendada en adultos de 100 mg diarios). En las ratas aumentó ligeramente la incidencia de malformaciones costales en los fetos (costillas ausentes, hipoplásicas u onduladas) con la dosificación de 1,000 mg/kg/día (exposición aproximadamente 100 veces mayor que la causada en seres humanos por la dosis diaria recomendada en adultos de 100 mg diarios). El nivel de dosificación con el que no se observaron efectos sobre el desarrollo fetal fue de 250 mg/kg/día (exposición 32 veces mayor que la causada en seres humanos por la dosis diaria recomendada en adultos de 100 mg diarios). En las crías de las ratas que recibieron dosis orales de 1,000 mg/kg/día se observaron disminuciones relacionadas con el tratamiento del promedio de peso corporal antes del destete en ambos sexos y del promedio de aumento de peso después del destete en los machos.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Vía de administración: Oral.
Recomendaciones sobre la dosificación:
La dosis de tratamiento antihiperglucémico con Sitagliptina/Metformina debe individualizarse en función del régimen actual, la eficacia y la tolerabilidad del paciente, sin exceder la dosis diaria máxima recomendada de 100 mg de sitagliptina.
Sitagliptina/Metformina se debe administrar dos veces al día con alimentos.
Las tabletas de Sitagliptina/Metformina están disponibles en:
• 50 mg de sitagliptina/500 mg de clorhidrato de metformina
• 50 mg de sitagliptina/850 mg de clorhidrato de metformina
• 50 mg de sitagliptina/1,000 mg de clorhidrato de metformina
Tratamiento inicial:
En pacientes con diabetes tipo 2 con hiperglucemia inadecuadamente controlada con dieta y ejercicio solos, la dosis inicial total diaria recomendada de Sitagliptina/Metformina es de 100 mg de sitagliptina/1,000 mg de metformina. En los pacientes con control glucémico inadecuado a esta dosis, se puede escalar gradualmente para reducir los efectos adversos asociados con metformina, hasta la dosis máxima diaria recomendada de metformina de 2,000 mg.
Adultos con función renal normal (TFG ≥ 90 ml/min): Para pacientes inadecuadamente controlados con la monoterapia con metformina:
En los pacientes en los que metformina sola no controla suficientemente la glucemia, la dosis inicial total recomendada de Sitagliptina/Metformina es de 100 mg de sitagliptina y la dosis previamente prescrita de metformina.
Para pacientes inadecuadamente controlados con la monoterapia con sitagliptina:
En los pacientes en los que sitagliptina sola no controla suficientemente la glucemia, la dosificación inicial recomendada de Sitagliptina/Metformina es de 100 mg de sitagliptina/1,000 mg de metformina. La dosis de metformina puede ser escalada gradualmente conforme sea necesario para lograr el control glucémico. Se debe considerar escalar gradualmente la dosis para reducir los efectos adversos gastrointestinales asociados con metformina. A los pacientes que están tomando sitagliptina sola a una dosificación ajustada por insuficiencia renal no se les debe cambiar a Sitagliptina/Metformina (véase Contraindicaciones).
Para pacientes que están tomando sitagliptina coadministrada con metformina:
En los pacientes que están tomando sitagliptina y metformina por separado, se puede iniciar la administración de Sitagliptina/Metformina a la dosis previamente prescrita de sitagliptina y metformina. Para pacientes inadecuadamente controlados con la combinación de tratamiento dual con cualquiera de dos de los siguientes tres medicamentos:
Sitagliptina, metformina o una sulfonilurea:
La dosificación inicial usual de Sitagliptina/Metformina debe procurar 50 mg de sitagliptina dos veces al día (100 mg dosis total diaria de sitagliptina). Para determinar la dosis inicial del componente metformina se debe considerar el nivel de control glucémico del paciente y la dosis actual (si la hay) de metformina. Para reducir los efectos gastrointestinales asociados a metformina se debe considerar ajustar la dosis gradualmente. Los pacientes que inician o que actualmente toman una sulfonilurea pueden requerir una dosis menor de la sulfonilurea para reducir el riesgo de hipoglucemia inducida por sulfonilureas (véase Precauciones generales).
Para pacientes inadecuadamente controlados con la combinación de tratamiento dual con cualquiera de dos de los siguientes tres medicamentos: Sitagliptina, metformina o un agonista del PPAR? (por ejemplo, tiazolidinedionas):
La dosificación inicial usual de Sitagliptina/Metformina debe procurar 100 mg dosis total diaria de sitagliptina. Para determinar la dosis inicial del componente metformina se debe considerar el nivel de control glucémico del paciente y la dosis actual (si la hay) de metformina. Para reducir los efectos gastrointestinales asociados a metformina se debe considerar ajustar la dosis gradualmente.
Para pacientes inadecuadamente controlados con la combinación de tratamiento dual con cualquiera de dos de los siguientes tres medicamentos: Sitagliptina, metformina o insulina:
La dosificación inicial usual de Sitagliptina/Metformina debe procurar 100 mg dosis total diaria de sitagliptina. Para determinar la dosis inicial del componente metformina se debe considerar el nivel de control glucémico del paciente y la dosis actual (si la hay) de metformina. Para reducir los efectos gastrointestinales asociados a metformina se debe considerar ajustar la dosis gradualmente. Los pacientes con insulina o que la están iniciando pueden requerir dosis menores de ésta para reducir el riesgo de hipoglucemia (véase Precauciones generales).
No se han hecho estudios examinando específicamente la seguridad y la eficacia de Sitagliptina/Metformina en pacientes que estaban siendo tratados con otros agentes hipoglucemiantes y fueron cambiados a Sitagliptina/Metformina. Cualquier cambio en el tratamiento de la diabetes tipo 2 se debe hacer con precaución y vigilancia adecuada, porque pueden ocurrir cambios en el control de la glucemia.
Todos los pacientes deben continuar su dieta recomendada con una distribución adecuada de la ingesta de carbohidratos durante el día.
Poblaciones especiales:
Insuficiencia renal:
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve (tasa de filtración glomerular [TFG] ≥ de 60 ml/min).
Se debe evaluar la función renal antes de iniciar el tratamiento con Sitagliptina/Metformina y periódicamente después de iniciarlo.
Sitagliptina/Metformina está contraindicado en pacientes con una TFGe < 30 mL/min/1.73 m2.
El uso de Sitagliptina/Metformina no se recomienda en pacientes con una TFGe ≥ 30 mL/min/1.73 m2 y < 45 mL/min/1.73 m2 debido a que estos pacientes requieren una dosis inferior de sitagliptina, la cual, no está disponible para la presentación combinada de Sitagliptina/Metformina.
La dosis diaria máxima de metformina debe dividirse preferiblemente en 2-3 dosis diarias. Se deben revisar los factores que pueden aumentar el riesgo de acidosis láctica antes de considerar el inicio del tratamiento con metformina en pacientes con TFG < 60 ml/min.
Si no se dispone de una concentración adecuada de Sitagliptina/Metformina, se deben utilizar monocomponentes individuales en lugar de la combinación de dosis fija.
|
TFG ml/min |
Metformina |
Sitagliptina |
|---|---|---|
|
60-89 |
La dosis máxima diaria es de 3,000 mg. Se puede considerar la reducción de la dosis en relación con el deterioro de la función renal. |
La dosis máxima diaria es de 100 mg. |
|
45-59 |
La dosis máxima diaria es de 2,000 mg. La dosis inicial es como máximo la mitad de la dosis máxima. |
La dosis máxima diaria es de 100 mg. |
|
30-44 |
La dosis diaria máxima es de 1000 mg. La dosis inicial es como máximo la mitad de la dosis máxima. |
La dosis máxima diaria es de 50 mg. |
|
< 30 |
La metformina está contraindicada. |
La dosis máxima diaria es de 25 mg. |
Insuficiencia hepática:
Sitagliptina/Metformina no debe utilizarse en pacientes con insuficiencia hepática.
Anciano:
Como la metformina y la sitagliptina se excretan por el riñón, la Sitagliptina/Metformina debe usarse con precaución a medida que aumenta la edad. La monitorización de la función renal es necesaria para ayudar en la prevención de la acidosis láctica asociada a metformina, especialmente en pacientes de edad avanzada.
Población pediátrica:
Sitagliptina/Metformina no debe usarse en niños y adolescentes de 10 a 17 años de edad debido a la eficacia insuficiente. No se ha estudiado Sitagliptina/Metformina en pacientes pediátricos menores de 10 años de edad. Forma de administración:
Sitagliptina/Metformina debe administrarse dos veces al día con las comidas para reducir las reacciones adversas gastrointestinales asociadas con metformina.
Interrupción del tratamiento con Sitagliptina/Metformina por procedimientos de imagenología con contraste yodado:
Se debe descontinuar Sitagliptina/Metformina al momento, o previo a un procedimiento de imagenología que involucre contraste yodado en pacientes con una TFGe de ≥ 30 a < 60 mL/min/1.73 m2, en pacientes con antecedente de enfermedad hepática, alcoholismo o insuficiencia cardiaca, o en pacientes que recibirán contraste yodado intra-arterial. Se debe reevaluar la TFGe a las 48 horas posterior al procedimiento de imagenología, el tratamiento con Sitagliptina/Metformina se puede restablecer si la función renal es aceptable (véase Precauciones generales).
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Sitagliptina:
Durante los estudios clínicos controlados en sujetos sanos, dosis únicas de hasta 800 mg de sitagliptina fueron generalmente bien toleradas. En un estudio se observaron aumentos mínimos del QTc, que no se consideraron clínicamente importantes, con la dosis de 800 mg (véase Farmacocinética y farmacodinamia, farmacodinamia, electrofisiología cardiaca). No hay ninguna experiencia con dosis mayores de 800 mg en estudios clínicos. En estudios de Fase I de dosis múltiple, no se observaron reacciones adversas clínicas relacionadas con el medicamento con dosis de sitagliptina de hasta 600 mg por día durante periodos de hasta 10 días y 400 mg al día por periodos de hasta 28 días.
Una gran sobredosis de metformina (o riesgos coexistentes de acidosis láctica) puede provocar acidosis láctica, que es una emergencia médica y debe tratarse en el hospital. El método más eficaz para eliminar el lactato y la metformina es la hemodiálisis.
Si ocurre una sobredosis, es razonable emplear las medidas de soporte usuales, como retirar del tracto digestivo el medicamento no absorbido, aplicar monitoreo clínico (incluyendo electrocardiograma) y establecer tratamiento de sostén si es necesario.
La sitagliptina es poco dializable. En los estudios clínicos se extrajo aproximadamente 13.5% de la dosis durante una sesión de hemodiálisis de tres a cuatro horas. Se puede considerar hemodiálisis prolongada si es clínicamente apropiada. No se sabe si la sitagliptina es dializable por diálisis peritoneal.
Metformina:
Se han reportado sobredosis de metformina, incluyendo la ingestión de más de 50 gramos. Hubo hipoglucemia en aproximadamente 10% de los casos, pero no se ha determinado ninguna relación causal con la metformina. Se ha reportado acidosis láctica en aproximadamente 32% de los casos de sobredosificación de metformina (véase Precauciones generales). La metformina es dializable, con una depuración de hasta 170 mL/min en buenas condiciones hemodinámicas, por lo que la hemodiálisis puede ser útil para extraer el medicamento acumulado en los pacientes en los que se sospecha una sobredosificación de metformina.
PRESENTACIONES:
Caja de cartón con 14, 28 o 56 tabletas de 50 mg/500 mg, 50 mg/850 mg o 50 mg/1,000 mg.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese a no más de 25 °C.
Consérvese la caja bien cerrada.
LEYENDAS DE PROTECCIÓN:
Su venta requiere receta médica. No se deje al alcance de los niños. No se use durante el embarazo ni lactancia. Prohibida la venta fraccionada del producto.
Reporte las sospechas de reacción adversa al correo:
farmacovigilancia@cofepris.gob.mx
Propiedad de:
Sandoz GmbH
Biochemiestraße 10, 6250 Kundl
Austria
Representante Legal:
SANDOZ, S.A. de C.V.
La Candelaria No. 186,
Col. Atlántida, C.P. 04370, Coyoacán,
Ciudad de México, México.
Reg. Núm. 234M2022, SSA IV
23330022130058/04Jul2023/IPPA_DRA-Sandoz
®Marca Registrada